Abstract
Assessment of lymphatic metastasis is an essential component of solid tumour staging. Sentinel lymph node (SLN) biopsy is a minimally invasive procedure that allows regional lymph node involvement by tumour to be estimated by selectively examining the sentinel lymph node while minimising the morbidity of systematic lymph node dissection. Within the group of genital cancers, the diagnostic value of SLN biopsy is rated differently. For selected patients with early-stage vulvar cancer (unifocal primary tumour < 4 cm, clinically negative inguinal lymph nodes) the SLN technique is already an established procedure in the guidelines of the German Society for Gynaecology and Obstetrics (DGGG)/German Cancer Society (DKG) and the recommendations of the European Society of Gynaecological Oncology (ESGO). For cervical cancer, SLN biopsy has not yet been sufficiently standardised but can be considered for patients without risk factors with a primary tumour size < 2 cm. The SLN is identified by combined use of radioactive 99m technetium nanocolloid and patent blue. The use of indocyanine green offers an alternative for SLN identification with few side effects. Recent studies aim to increase the diagnostic reliability of intraoperative frozen section analysis as this continues to show limited sensitivity in both vulvar and cervical cancer. The rate of detection of micrometastases can be increased by additional ultrastaging, the prognostic significance of which for both diseases is still unclear. The prognostic value of SLN biopsy compared with systematic lymph node dissection is being investigated in current studies (GROINSS-V-II for vulvar cancer and SENTIX-, SENTICOL-3 for cervical cancer). For this review article, a guideline-based literature search was performed in the National Library of Medicine (PubMed/MEDLINE) database with a particular focus on recent cohort studies and conference contributions.
Key words: vulvar cancer, cervical cancer, sentinel lymph node, ultrastaging, micrometastases
Introduction
Assessment of lymphatic metastasis is an essential component of solid tumour staging. Historically, this assessment has been made by systematic lymph node dissection, which is associated with high patient morbidity because of its invasiveness. Sentinel lymph node (SLN) biopsy is a minimally invasive procedure that allows regional lymph node involvement by tumour to be estimated by selectively examining the sentinel lymph node. This concept is based on the assumption that lymphatic metastasis of tumours follows an anatomically systematic path and thus is predictable 1 .
Mapping consists of identification and histological examination of the SLN; today it is an established and standardised procedure in breast cancer and malignant melanoma 2 , 3 . Among the genital cancers, the diagnostic value of SLN biopsy is rated differently.
For selected patients with early-stage vulvar cancer, defined as a unifocal primary tumour with a diameter < 4 cm and clinically negative inguinal lymph nodes, the SLN technique is already an established procedure in the guidelines of the German Society for Gynaecology and Obstetrics (DGGG)/German Cancer Society (DKG) and the recommendations of the European Society of Gynaecological Oncology (ESGO) 4 , For cervical cancer, SLN biopsy on its own has not yet been finally standardised and should only be performed as part of clinical studies 5 , 6 .
For this review article, a literature search guided by the current guidelines of the DGGG/DKG and ESMO was performed in the National Library of Medicine (PubMed/MEDLINE) database. Retrospective observational studies and randomised interventional studies were included, with emphasis on large cohort studies since 2010. Contributions to the annual conferences of the American Society of Clinical Oncology (ASCO), ESGO and DGGG in 2019 and 2020 were also included.
Overview
Vulvar cancer
With an incidence of 3300 women in Germany in 2016, accounting for ~ 5% of all gynaecological tumours, vulvar cancer is a rare malignancy 7 , 8 . Invasive cancers are almost all diagnosed at an early stage (FIGO I – II). Standard management comprises wide local excision and staging of the inguinofemoral lymph nodes (stage FIGO IB and above) 4 . One woman in five already has lymphatic metastasis at the time of diagnosis 4 . This lymphatic involvement is the most relevant prognostic risk factor for overall survival and requires surgical lymph node dissection 9 . According to the 2015 S2k guideline issued by the DGGG/DKG, it is still unclear at the present time whether systematic inguinofemoral lymph node dissection (ILND) should always be performed or whether removal of all metastatic lymph nodes suffices as part of a multimodal treatment concept 4 , 10 .
Because of its anatomic accessibility and lymphatic drainage, vulvar cancer was the first female genital tumour for which SLN biopsy was studied 11 . The results of the GROningen International Study on Sentinel node in Vulva cancer (GROINSS-V), first published in 2008, showed that a negative SLN biopsy can replace the more invasive ILND in a subgroup of patients with an equivalent prognostic outcome 12 .
Current practice
In the ESGO guidelines from 2017 and the joint DGGG/DKG S2k guidelines from 2015 SLN biopsy is recommended in patients with a unifocal primary tumour < 4 cm and unremarkable inguinal lymph node findings upon clinical examination at the same time 4 , 13 . Diagnostic investigation by means of SLN biopsy may be considered if
No lymph nodes suspicious for malignancy are apparent clinically or on imaging (cN0) and
There has been no previous surgery in the affected lymphatic drainage region.
If the SLN cannot be identified or if SLN metastasis is found, ILND should be recommended to the patient according to the ESGO guidelines. Primary tumours that cross the midline represent a special scenario. Bilateral SLN biopsy is recommended in these cases 13 . If the SLN can be identified only on one side, ILND should be performed on the contralateral side.
Method
According to the current ESGO guidelines, the SLN should be identified by means of a radioactive tracer ( 99m technetium nanocolloid) 13 . Preoperatively, tracer-containing fluid is injected subcutaneously at four locations around the tumour and traced by scintigraphy. Detection by gamma probe is successful in 94% of cases with a sensitivity of 91%. The diagnostic reliability can be further increased by the additional use of patent blue (detection rate 95%, sensitivity 95%) 14 . The correct indication is critical as a much higher rate of false-negative results has been described for SLN biopsy in advanced stages (> FIGO I) 15 . The use of indocyanine green (ICG) enables radiation-free SLN detection with a generally more favorable side effect profile, especially as regards the occurrence of anaphylactic reactions 16 , 17 , 18 . In certain cases, the number and SLN location can be determined more exactly using lymphoscintigraphy or single photon emission computed tomography (SPECT) 4 . A second surgical procedure can be avoided by intraoperative frozen section analysis. Recent studies indicate that these frozen section analyses are inferior in reliability to complete histopathological examination (less sensitive detection of micrometastases) 19 . Pathological processing includes the examination of fully embedded SLN biopsies using haematoxylin-eosin (HE) morphology. If the result is negative with this primary staining, further analysis and preparation of serial sections (maximum distance 200 – 400 µM, Table 1 ) should be carried out 12 , 15 , 20 , 21 , 22 , 23 , 24 . This “ultrastaging” can be supplemented by secondary analysis for pan-cytokeratin antibodies AE1 and/or AE3 by immunohistochemistry (IHC) 25 . In this way the detection rate of micrometastases (< 2 mm) can be increased, though their prognostic significance in vulvar cancer remains unclear at the present time 26 , 27 .
Table 1 SLN mapping and status of ultrastaging in vulvar cancer.
| n | Section thickness | false-negative | LN metastases | Upstaging by ultrastaging | Reference |
|---|---|---|---|---|---|
| 70 | 400 µM | 0% | 33% | – | Vidal-Sicart et al. 2007 15 |
| 125 | 200 µM | 2% | 31% | – | Hampl et al. 2008 16 |
| 403 | ~ 333 µM | – | 32% | 42% | Van der Zee et al. 2008 11 |
| 46 | 200 µM | 0% | 21% | – | Achimus-Cadariu et al. 2009 17 |
| 60 | 400 µM | 0% | 35% | 12% | Devaja et al. 2011 18 |
| 418 | 40 µM | 4% | 32% | 23% | Levenback et al. 2012 19 |
| 133 | 40 µM | 0.1% | 17% | 9% | Euscher et al. 2018 and 2020 20 |
Advantages of sentinel lymph node biopsy
For selected groups of patients, targeted identification and biopsy of the SLN is a diagnostic procedure with high sensitivity as regards the detection of lymphatic metastasis. Compared with ILND, SLN biopsy is a method with fewer complications, which can significantly reduce iatrogenic injuries and the risk of lymphoedema ( Table 2 ) 28 . Patient surveys within the GROINSS-V-I study showed that subjective satisfaction is markedly increased with the SLN technique compared with ILND 29 . Significant morbidity caused by ILND was reported especially because of lymphoedema (p = 0.01), pain in the surgical site (p = 0.03) and wearing compression stockings (p = 0.003). The chosen procedure had no influence on the sexual activity of the surveyed patients. From the socioeconomic aspect, SLN biopsy is markedly more cost-effective and associated with a shorter operation time and shorter hospitalisation ( Table 2 ) 12 , 30 , 31 . Finally, it should be mentioned that the diagnostic success of the SLN technique is greatly influenced by the existing surgical expertise in the treating centre. Based on this knowledge, the GROINSS-V-I study recommends that SLN be performed only in acknowledged centres, defined as a minimum number of ≥ 10 confirmed SLN procedures in patients with vulvar cancer per clinician per year 12 .
Table 2 Clinical comparison of SLN biopsy and ILND in vulvar cancer.
| n | SLN-B | ILND | p-value | Reference |
|---|---|---|---|---|
| Abbreviations: SLN-B = sentinel lymph node biopsy, ILND = inguinal lymph node dissection, NA = not applicable * Meta-analysis | ||||
| Duration of surgical procedure | ||||
| 128 | 76 min | 103 min | < 0.001 | Brammen et al. 2014 26 |
| 75 | 86 min | 121 min | 0.002 | Hefler et al. 2008 27 |
| Length of hospitalisation | ||||
| 128 | 13.3 days | 18.1 days | 0.006 | Brammen et al. 2014 26 |
| 75 | 12.6 days | 22.9 days | < 0.001 | Hefler et al. 2008 27 |
| 403 | 8.4 days | 13.7 days | < 0.0001 | van der Zee et al. 2008 11 |
| Inguinal drainage | ||||
| 128 | 4 days | 7 days | < 0.001 | Brammen et al. 2015 26 |
| 75 | 3 days | 7 days | < 0.001 | Hefler et al. 2008 27 |
| Wound infection | ||||
| 2667* | 4.4% | 30.7% | NA | Reade et al. 2012 24 |
| Lymphocyst | ||||
| 2667* | 3.8% | 15.5% | NA | Reade et al. 2012 24 |
| Lymphoedema | ||||
| 2667* | 1.5% | 22.9% | NA | Reade et al. 2012 24 |
Studies
SLN biopsy is still a relatively young diagnostic procedure at the present time and is the subject of intensive clinical research, especially with regard to
The reliability of frozen section analysis,
The prognostic significance of micrometastases and
The prognostic significance compared with established procedures
Based on current data, the sensitivity of intraoperative frozen section analysis for SLN identification is sometimes limited. In the GROINSS-V-I study (n = 403), for example, markedly reduced sensitivity of only 48% was apparent, though with excellent specificity (100%) 19 . The reliability of SLN biopsy can be increased by additional IHC examination compared with HE staining alone. In the GROINSS-V-I study, micrometastasis was detected in this way in 12% of the SLN biopsies that were previously HE-negative. In the American GOG-173 study (n = 234) the rate of false-negative results with HE staining that could be corrected by additional IHC was 23% 32 . The prognostic significance of such micrometastases remains unclear up to the present time. In the GROINSS-V-I study, 27% of the patients with HE-positive SLN, but only 5% of patients with HE-negative/ultrastaging-positive SLN biopsy had lymphatic metastasis 19 . Patients with HE-positive SLN had significantly reduced 5-year survival of 65%. By contrast, the 5-year survival of patients with isolated micrometastasis on ultrastaging and previously negative HE result was nearly unaffected in the GROINSS-V-I study at 92% (p < 0.0001).
While the clinical significance of micrometastases in the SLN biopsy cannot be determined, a clearly positive SLN is associated with a limited clinical prognosis. The authors observed a general correlation between the extent of SLN metastasis with the probability of further lymph node involvement. A prognostically valid cut-off for the size of the SLN metastases has not been established to date 19 .
In an updated analysis of the GROINSS-V-I study (median follow-up: 105 months) the 5-year recurrence rate for SLN-negative patients was 25% (36% after ten years) compared with 33% (46% after ten years) in patients with initial SLN positivity 33 . In addition, the disease-specific 10-year overall survival of SLN-negative patients was significantly raised compared with SLN-positive patients (91 vs. 65%, p < 0.0001).
Initial data from the GROINSS-V-II (n = 1552) follow-up study were presented at the best oral abstract session of the ESGO annual conference in 2019 34 . This prospective study investigated whether adjuvant radiotherapy could be a safe and effective therapeutic alternative for patients with smaller SLN metastases. Inguinal recurrence occurred in only two of 129 patients (1.6%) with positive SLN results < 2 mm in the observation period (≥ 2 years) after radiotherapy alone. The authors of the study conclude accordingly that radiotherapy can be an effective and less traumatic alternative to ILND for patients with SLN metastases < 2 mm.
The position of the primary tumour relative to the anatomic midline is of crucial significance in locating the SLN. Recent studies confirm that the lymphatic drainage can deviate from the expected anatomy in individual cases 35 , 36 . Using preoperative lymphoscintigraphy, the GOG-173 study showed that 22% of patients with a primary tumour located laterally (> 2 cm from the midline) had bilateral drainage. At the same time, unilateral drainage was found in 30% of patients with a midline tumour (< 2 cm from the midline) 32 . In summary, additional lymphoscintigraphy provides further assistance in detecting the exact SLN location in patients with midline tumours.
The need for bilateral ILND with unilateral evidence of metastasis and contralateral negative SLN has not yet been conclusively clarified 4 . The SLN technique could be an approach for avoiding contralateral ILND, especially in clinically asymptomatic patients with contralateral metastasis-free SLN biopsy 37 .
Cervical cancer
In 2016 ~ 4400 women in Germany were diagnosed with cervical cancer. This is equivalent to ~ 2% of all female malignancies 38 . In > 85% of cases, the diagnosis is made at an early stage (T1, T2) 39 . The treatment of cervical cancer is either surgical or by combined chemoradiotherapy, depending on the FIGO classification. Lymphatic metastasis is present in roughly one in four patients at the early stage (≤ FIGO IB) 40 . Staging is conducted by means of systematic pelvic lymph node dissection (PLND). The American National Comprehensive Cancer Network (NCCN) recommends that this should be used for selected patients with early-stage disease (tumour diameter ≤ 2 cm) 41 . The prognostic status of SLN biopsy compared with PLND is currently being investigated in two prospective clinical studies (SENTIX [NCT02494063] and SENTICOL-3 [NCT03386734]).
Current practice
While SLN biopsy has been established as part of diagnostic practice for many solid tumours, its status in cervical cancer staging remains unclear 24 . According to the joint DGGG/DKG S3 guideline from 2014 the SLN technique is insufficiently standardised (note: the guideline is currently being revised in this regard). At the same time, its application appears justifiable if the SLN can be identified bilaterally by preoperative scintigraphy and by surgery and if the procedure is used in patients without risk factors with a primary tumour size < 2 cm 5 . The reason for this is the anatomic classification of cervical cancer as a “midline tumour” which necessitates bilateral SLN diagnosis 5 . According to the S3 guideline of the DGGG/DKG, surgical staging by means of para-aortic lymph node dissection should be performed if the SLN is positive. Moreover, all identified SLNs should be removed. If SLN identification is unsuccessful on one side, pelvic lymph node dissection should be performed on the affected side for further staging.
Method
At present, SLN biopsy in cervical cancer is not yet performed according to a uniform procedure ( Table 3 ). A radioactive tracer substance is injected preoperatively into the cervix at four or two points ( Fig. 1 ). 99m Technetium nanocolloid combined with patent blue is used typically. Alternatively, according to the ESGO guideline, indocyanine green (ICG) can also be used as a radiation-tree tracer substance with few side effects 18 , 42 , 43 , 44 ( Fig. 2 ). The current S3 guideline does not contain a clear recommendation in this respect. In a 2016 study, ICG was shown to be superior to 99m technetium nanocolloid and patent blue with regard to the SLN detection rate (100%) and bilateral identification of drainage pathways (99%) (detection rate 96%, bilateral identification 76%) 45 .
Table 3 SLN mapping and status of ultrastaging in cervical cancer.
| n | Section thickness | false-negative | LN metastases | Upstaging by ultrastaging | Reference |
|---|---|---|---|---|---|
| * with bilateral positive SLN biopsy, ** Follow-up analysis with secondary ultrastaging | |||||
| 48 | 40 µM | 6% | 31% | 19% | Euscher et al. 2008 36 |
| 139 | 200 µM | 8%/0%* | 18% | – | Lécuru et al. 2011 49 |
| 211 | 40 µM | 0%* | 16% | 33% | Roy et al. 2011 40 |
| 645 | 250 µM | 3% | 33%* | 11% | Cibula et al. 2012 59 |
| 188 | 250 µM | 4% | 19% | 22% | Salvo et al. 2017 51 |
| 139** | 200 µM | 1% | 17% | – | Mathevet et al. 2020 64 |
Fig. 1.
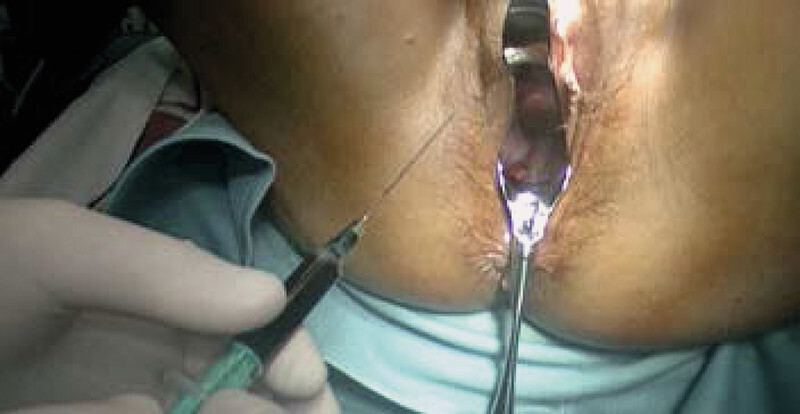
Preoperative injection of patent blue (intracervical).
Fig. 2.

Sentinel node detection in cervical cancer by means of indocyanine green (ICG). Marking: view of the pelvic wall on the left with white light ( a ) and fluorescence ( b ).
Identified lymph nodes should be embedded completely along their long axis in sections c. 0.2 cm thick to allow better identification of micrometastases and isolated tumour cells (ITC) in the next step 40 , 46 . Since detection of a positive SLN has a direct therapeutic consequence (para-aortic lymph node dissection, discontinuation of therapy and indication for radiotherapy), some authors recommend intraoperative frozen section analysis 46 , 47 . It must be noted that frozen section analysis is not sufficiently sensitive for the detection of micrometastases. In a Canadian study with 211 patients in total, micrometastasis remained unidentified in > 40% of biopsies analysed intraoperatively 46 . In a joint analysis of the French SENTICOL-1 and SENTICOL-2 studies (n = 313) the sensitivity of intraoperative frozen section analysis was only 42% 48 . Tissue that was used for frozen sections also contains a lot of artefacts and is no longer available for further definitive pathological examination 24 . To ensure adequate diagnosis, frozen section analysis should therefore be omitted when SLN biopsy is used as the sole staging method 24 . Beyond intraoperative frozen section analysis, various ultrastaging protocols, which are not yet standardised, are available for detection of micrometastases ( Table 3 ). Typically, at least three sections are made from the paraffin blocks at intervals of 40 – 250 µM and stained with HE ( Table 1 ). If the result is negative with HE staining, additional assessment takes place by IHC using the pan-cytokeratin antibodies AE1 and/or AE3. In this way, metastases up to a size of only 100 µM are detected with a sensitivity of 70% 40 . Supplementary antibodies to p16 can be used as indirect markers for HPV aetiology 5 .
Advantages of sentinel lymph node biopsy
SLN biopsy offers a minimally invasive procedure for standardised detection of micrometastases, which are a common metastasis pattern especially in young patients 5 . The diagnostic validity of SLN biopsy compared with diagnostic imaging was investigated in a meta-analysis of 72 studies with a total of 5042 patients 49 . The SLN technique was shown to be superior in sensitivity (91%) and specificity (100%) to CT (58%/92%), MRI (56%/93%) and PET-CT (75%/98%).
The risk of lymphatic metastasis is < 20% in early cervical cancer (FIGO stage IA) and increases to 31% in FIGO stage IB 40 . Since patients with early-stage disease without risk factors therefore usually have no lymphatic metastasis, staging by PLND is not required for the majority of these patients and could be replaced by SLN biopsy. In addition, SLN biopsy is associated with a markedly lower rate of intra- and postoperative complications compared with operative staging 50 , 51 .
Studies
Despite its socioeconomic and diagnostic advantages, many relevant aspects of SLN biopsy have not yet been sufficiently standardised and the procedure cannot yet be recommended for sole use in patients with early-stage cervical cancer. Unanswered questions include
the anatomic site of the SLN,
the diagnostic accuracy of intraoperative frozen section analysis,
the introduction of uniform ultrastaging analyses,
the predictive significance of SLN micrometastases with regard to further pelvic lymph node involvement,
the prognostic significance of micrometastases for long-term survival and
the therapeutic equivalence of SLN biopsy and PLND for selected groups of patients.
The lymphatic drainage of cervical cancer cannot always be determined due to its anatomic location 52 . More precise localisation can be obtained by lymphoscintigraphy. In a subanalysis of the French SENTICOL-1 study (n = 133) 88% of SLNs were detected by lymphoscintigraphy 53 . Approximately 40% of these SLNs identified preoperatively were located outside the interiliac drainage pathways along the common iliac artery (20%), in para-aortic location (11%) and in the parametrium (6%). Similarly great variability was found in a retrospective study by the Gynaecological Oncology Working Group (AGO, n = 151) 54 . Given this data, preoperative lymphoscintigraphy should be considered as a crucial diagnostic instrument for detecting SLNs even when the anatomy differs as this may help to reduce the rate of false-negative results 53 .
Several studies have confirmed that the SLN-technique allows for high sensitivity with a low rate of false-negative results 46 , 55 , 56 . In the 2011 SENTICOL-1 study, sensitivity of 100% and a false-negative rate of 0% was observed for patients with bilateral SLN detection by additional ultrastaging of SLN biopsies 55 . Similarly high sensitivity (97%) and a low rate of false-negative results (2.3%) was confirmed in a multinational study by Cibula et al. (n = 645) 56 . Without supplementary ultrastaging the sensitivity of SLN biopsy alone was only 80% in this study. This illustrates the importance of ultrastaging for the diagnostic reliability of SLN biopsy.
The rate of false-negative results depends on the size of the metastasis in the SLN which has been stated as < 4 cm 57 or < 2 cm 41 . A multicentre analysis by the AGO study group showed that sensitivity > 90% and a negative predictive value of 99% can be achieved with tumours < 2 cm 58 . In this study, however, stratification into tumours < 2 cm and > 2 cm only took place subsequently so prospective validation remains to be demonstrated. A recent study by the French research group shows that detectability of bilateral SLNs diminishes with increasing age (> 70 years), body weight (≥ 30 kg/m 2 ) and tumour size (≥ 20 mm) 59 .
The definition in the TNM classification for cervical cancer distinguished between macrometastases (> 2 mm, pN1), micrometastases (0.2 – 2 mm, pN1[mi]) and ITC (pN0) 60 . Recent studies do not yet take into account these different lymph node metastasis classifications. The majority of studies that examine the significance of SLN micrometastases with regard to metastasis to other pelvic lymph nodes have method-related weaknesses, mostly since only SLN biopsies are adjudged by ultrastaging in most centres. When studies that also analysed pelvic lymph nodes by ultrastaging were considered, it became apparent that micrometastases in the SLN are associated with both macro- and micrometastasis of pelvic lymph nodes 61 , 62 , 63 , 64 .
The significance of micrometastases and ITC for the long-term overall prognosis of patients with cervical cancer is controversial. Cibula et al. identified micrometastasis in the SLN as an independent risk factor for overall survival (HR 6.86, p = 0.002) 65 . In this study, micrometastasis did not represent a negative prognostic factor for progression-free survival. By contrast, a Brazilian study (n = 83) identified the detection of lymphatic micrometastases as the strongest prognostic factor for progression-free survival (OR 11.73, p = 0.017) 66 . The detection of micrometastases was retrospective, i.e. previously negative pelvic lymph nodes underwent secondary examination by ultrastaging. In both the SENTICOL-1 and SENTICOL-2 study, a negative prognostic effect regarding progression-free survival was not detected for micrometastases or for ITC in the SLN 67 , 68 .
A subanalysis of the SENTICOL-1 and SENTICOL-2 studies was presented at the annual conference of the American Society of Clinical Oncology (ASCO) 2020. In this analysis, the prognostic outcome was compared after bilateral SLN biopsy and PLND in patients with negative SLN results (n = 259) 69 . With a median follow-up of 47 months, there was no clinically significant difference in progression-free survival (94 and 98%, p = 0.14). The authors concluded that bilateral SLN biopsy could replace PLND in selected patients with early-stage cervical cancer. The SENTIX (NCT02494063) and SENTICOL-3 studies (NCT03386734) prospectively compare the prognostic outcome after SLN biopsy alone versus systematic PLND. Results are expected in 2020 and 2025.
Conclusion
SLN biopsy is a procedure that enables minimally invasive staging of lymphatic tumour spread by examining the sentinel lymph node. It therefore offers a more complication-free and cost-effective alternative to systematic lymph node dissection with equivalent diagnostic sensitivity.
While SLN biopsy is already included in the guidelines of the DGGG/DKG and ESGO for selected patients with early-stage vulvar cancer, there is no such recommendation for cervical cancer. Recent studies in both malignancies aim to further investigate and standardize the SLN technique, especially with regard to
the reliability of intraoperative frozen section analysis,
the use of uniform ultrastaging protocols,
the prognostic significance of micrometastases and
its therapeutic value compared with systematic lymph node dissection.
For the treating clinician, future guidelines and current studies will have to define more precisely which groups of patients might benefit from SLN biopsy as a suitable diagnostic and therapeutic procedure.
For vulvar cancer, the prospective GROINSS-V-II study is examining at which tumour stage adjuvant radiotherapy could represent a safe and effective treatment alternative to ILND.
For cervical cancer, the SENTIX (NCT02494063) and SENTICOL-3 (NCT03386734) studies are examining the prognostic outcome after SLN biopsy alone compared with PLND. Initial results of these prospective studies are expected in 2020 and 2025.
In German-speaking countries, revision of the expiring S2k guideline for vulvar cancer (valid until 31.10.2020) and the S3 guideline for cervical cancer (valid until 31.10.2019) is being eagerly awaited. These updates will contribute to further standardisation of SLN biopsy in clinical use.
Footnotes
Conflict of Interest/Interessenkonflikt The authors declare that they have no conflict of interest./Die Autorinnen/Autoren geben an, dass kein Interessenkonflikt besteht.
References/Literatur
- 1.Morton D L, Wen D R, Wong J H. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg. 1992;127:392–399. doi: 10.1001/archsurg.1992.01420040034005. [DOI] [PubMed] [Google Scholar]
- 2.Cody H S. Sentinel lymph node mapping in breast cancer. Breast Cancer. 1999;6:13–22. doi: 10.1007/BF02966901. [DOI] [PubMed] [Google Scholar]
- 3.Mocellin S, Hoon D SB, Pilati P. Sentinel lymph node molecular ultrastaging in patients with melanoma: a systematic review and meta-analysis of prognosis. J Clin Oncol. 2007;25:1588–1595. doi: 10.1200/JCO.2006.09.4573. [DOI] [PubMed] [Google Scholar]
- 4.AWMF Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e.V. (DGGG) Langfassung der Leitlinie „Vulvakarzinom und seine Vorstufen, Diagnostik und Therapie“ 01November2015. Accessed September 27, 2020 at:https://www.awmf.org/leitlinien/detail/ll/015-059.html
- 5.AWMF; Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e.V. (DGGG) Deutsche Krebsgesellschaft (DKG) Langfassung der Leitlinie „Diagnostik, Therapie und Nachsorge der Patientin mit Zervixkarzinom“ 15October2014. Accessed September 27, 2020 at:https://www.awmf.org/leitlinien/detail/ll/032-033OL.html
- 6.AWMF; Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e.V. (DGGG) Deutsche Krebsgesellschaft (DKG) Langfassung der Leitlinie „Diagnostik, Therapie und Nachsorge der Patientin mit Endometriumkarzinom“ 30April2018. Accessed September 27, 2020 at:https://www.awmf.org/leitlinien/detail/ll/032-034OL.html
- 7.Siegel R L, Miller K D, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017;67:7–30. doi: 10.3322/caac.21387. [DOI] [PubMed] [Google Scholar]
- 8.Robert Koch-Institut Zentrum der Krebsregisterdaten Vulva: Übersicht über die wichtigsten epidemiologischen Maßzahlen für Deutschland, ICD-10 C51 Berlin: Robert Koch-Institut; 2016. Accessed September 27, 2020 at:https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2019/kid_2019_c51_vulva.pdf?__blob=publicationFile [Google Scholar]
- 9.Mahner S, Jueckstock J, Hilpert F. Adjuvant therapy in lymph node-positive vulvar cancer: the AGO-CaRE-1 study. J Natl Cancer Inst. 2015;107:dju426. doi: 10.1093/jnci/dju426. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Hyde S E, Valmadre S, Hacker N F. Squamous cell carcinoma of the vulva with bulky positive groin nodes-nodal debulking versus full groin dissection prior to radiation therapy. Int J Gynecol Cancer. 2007;17:154–158. doi: 10.1111/j.1525-1438.2006.00769.x. [DOI] [PubMed] [Google Scholar]
- 11.Levenback C, Burke T W, Gershenson D M. Intraoperative lymphatic mapping for vulvar cancer. Obstet Gynecol. 1994;84:163–167. [PubMed] [Google Scholar]
- 12.Van der Zee A GJ, Oonk M H, De Hullu J A. Sentinel node dissection is safe in the treatment of early-stage vulvar cancer. J Clin Oncol. 2008;26:884–889. doi: 10.1200/JCO.2007.14.0566. [DOI] [PubMed] [Google Scholar]
- 13.European Society of Gynecological Oncology (ESGO) ESGO Guidelines for the Management of Vulvar Cancer 2017. Accessed September 27, 2020 at:https://guidelines.esgo.org/vulvar-cancer/guidelines/recommendations
- 14.Hassanzade M, Attaran M, Treglia G. Lymphatic mapping and sentinel node biopsy in squamous cell carcinoma of the vulva: systematic review and meta-analysis of the literature. Gynecol Oncol. 2013;130:237–245. doi: 10.1016/j.ygyno.2013.04.023. [DOI] [PubMed] [Google Scholar]
- 15.Hampl M, Hantschmann P, Michels W. Validation of the accuracy of the sentinel lymph node procedure in patients with vulvar cancer: results of a multicenter study in Germany. Gynecol Oncol. 2008;111:282–288. doi: 10.1016/j.ygyno.2008.08.007. [DOI] [PubMed] [Google Scholar]
- 16.Soergel P, Hertel H, Nacke A K. Sentinel Lymphadenectomy in Vulvar Cancer Using Near-Infrared Fluorescence From Indocyanine Green Compared With Technetium 99m Nanocolloid. Int J Gynecol Cancer. 2017;27:805–812. doi: 10.1097/IGC.0000000000000996. [DOI] [PubMed] [Google Scholar]
- 17.Papadia A, Gasparri M L, Buda A. Sentinel lymph node mapping in endometrial cancer: comparison of fluorescence dye with traditional radiocolloid and blue. J Cancer Res Clin Oncol. 2017;143:2039–2048. doi: 10.1007/s00432-017-2501-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Hackethal A, Hirschburger M, Eicker S O. Role of Indocyanine Green in Fluorescence Imaging with Near-Infrared Light to Identify Sentinel Lymph Nodes, Lymphatic Vessels and Pathways Prior to Surgery – A Critical Evaluation of Options. Geburtshilfe Frauenheilkd. 2018;78:54–62. doi: 10.1055/s-0043-123937. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Oonk M H, van Hemel B M, Hollema H. Size of sentinel-node metastasis and chances of non-sentinel-node involvement and survival in early stage vulvar cancer: results from GROINSS-V, a multicentre observational study. Lancet Oncol. 2010;11:646–652. doi: 10.1016/S1470-2045(10)70104-2. [DOI] [PubMed] [Google Scholar]
- 20.Vidal-Sicart S, Puig-Tintoré L M, Lejárcegui J A. Validation and application of the sentinel lymph node concept in malignant vulvar tumours. Eur J Nucl Med Mol Imaging. 2007;34:384–391. doi: 10.1007/s00259-006-0237-9. [DOI] [PubMed] [Google Scholar]
- 21.Achimas-Cadariu P, Harter P, Fisseler-Eckhoff A. Assessment of the sentinel lymph node in patients with invasive squamous carcinoma of the vulva. Acta Obstet Gynecol Scand. 2009;88:1209–1214. doi: 10.3109/00016340903317982. [DOI] [PubMed] [Google Scholar]
- 22.Devaja O, Mehra G, Coutts M. A prospective study of sentinel lymph node detection in vulval carcinoma: is it time for a change in clinical practice? Int J Gynecol Cancer. 2011;21:559–564. doi: 10.1097/IGC.0b013e3182119d8d. [DOI] [PubMed] [Google Scholar]
- 23.Levenback C F, Ali S, Coleman R L. Lymphatic mapping and sentinel lymph node biopsy in women with squamous cell carcinoma of the vulva: a gynecologic oncology group study. J Clin Oncol. 2012;30:3786–3791. doi: 10.1200/JCO.2011.41.2528. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Euscher E D, Malpica A. Gynaecological malignancies and sentinel lymph node mapping: an update. Histopathology. 2020;76:139–150. doi: 10.1111/his.14017. [DOI] [PubMed] [Google Scholar]
- 25.Covens A, Vella E T, Kennedy E B. Sentinel lymph node biopsy in vulvar cancer: Systematic review, meta-analysis and guideline recommendations. Gynecol Oncol. 2015;137:351–361. doi: 10.1016/j.ygyno.2015.02.014. [DOI] [PubMed] [Google Scholar]
- 26.Moore R G, Granai C O, Gajewski W. Pathologic evaluation of inguinal sentinel lymph nodes in vulvar cancer patients: a comparison of immunohistochemical staining versus ultrastaging with hematoxylin and eosin staining. Gynecol Oncol. 2003;91:378–382. doi: 10.1016/j.ygyno.2003.07.006. [DOI] [PubMed] [Google Scholar]
- 27.Meads C, Sutton A J, Rosenthal A N. Sentinel lymph node biopsy in vulval cancer: systematic review and meta-analysis. Br J Cancer. 2014;110:2837–2846. doi: 10.1038/bjc.2014.205. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Reade C J, Jimenez W, OʼReilly D. Sentinel lymph node biopsy in vulvar cancer: a health technology assessment for the canadian health care context. J Obstet Gynaecol Can. 2012;34:1053–1065. doi: 10.1016/S1701-2163(16)35435-4. [DOI] [PubMed] [Google Scholar]
- 29.Oonk M HM, van Os M A, de Bock G H. A comparison of quality of life between vulvar cancer patients after sentinel lymph node procedure only and inguinofemoral lymphadenectomy. Gynecol Oncol. 2009;113:301–305. doi: 10.1016/j.ygyno.2008.12.006. [DOI] [PubMed] [Google Scholar]
- 30.Brammen L, Staudenherz A, Polterauer S. Sentinel lymph node detection in vulvar cancer patients: a 20 years analysis. Hell J Nucl Med. 2014;17:184–189. doi: 10.1967/s002449910143. [DOI] [PubMed] [Google Scholar]
- 31.Hefler L A, Grimm C, Six L. Inguinal sentinel lymph node dissection vs. complete inguinal lymph node dissection in patients with vulvar cancer. Anticancer Res. 2008;28:515–517. [PubMed] [Google Scholar]
- 32.Coleman R L, Ali S, Levenback C F. Is bilateral lymphadenectomy for midline squamous carcinoma of the vulva always necessary? An analysis from Gynecologic Oncology Group (GOG) 173. Gynecol Oncol. 2013;128:155–159. doi: 10.1016/j.ygyno.2012.11.034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Te Grootenhuis N C, van der Zee A GJ, van Doorn H C. Sentinel nodes in vulvar cancer: Long-term follow-up of the GROningen INternational Study on Sentinel nodes in Vulvar cancer (GROINSS-V) I. Gynecol Oncol. 2016;140:8–14. doi: 10.1016/j.ygyno.2015.09.077. [DOI] [PubMed] [Google Scholar]
- 34.Oonk M, Slomovitz B, Baldwin P. Radiotherapy instead of inguinofemoral lymphadenectomy in vulvar cancer patients with a metastatic sentinel node: results of GROINSS-V II. Int J Gynecol Cancer. 2019;29:A14. [Google Scholar]
- 35.Lindell G, Jonsson C, Ehrsson R J. Evaluation of preoperative lymphoscintigraphy and sentinel node procedure in vulvar cancer. Eur J Obstet Gynecol Reprod Biol. 2010;152:91–95. doi: 10.1016/j.ejogrb.2010.05.011. [DOI] [PubMed] [Google Scholar]
- 36.Louis-Sylvestre C, Evangelista E, Leonard F. Sentinel node localization should be interpreted with caution in midline vulvar cancer. Gynecol Oncol. 2005;97:151–154. doi: 10.1016/j.ygyno.2004.12.013. [DOI] [PubMed] [Google Scholar]
- 37.Woelber L, Eulenburg C, Grimm D. The Risk of Contralateral Non-sentinel Metastasis in Patients with Primary Vulvar Cancer and Unilaterally Positive Sentinel Node. Ann Surg Oncol. 2016;23:2508–2514. doi: 10.1245/s10434-016-5114-6. [DOI] [PubMed] [Google Scholar]
- 38.Robert Koch-Institut Startseite Zentrum für Krebsregisterdaten 2016. Accessed July 27, 2020 at:https://www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Gebaermutterhalskrebs/gebaermutterhalskrebs_node.html
- 39.Robert Koch-Institut Startseite Zentrum für Krebsregisterdaten 2013. Accessed July 27, 2020 at:http://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2013/krebs_in_deutschland_2013.pdf;jsessionid=46DBFE3D158B3FAC7325A798CA3A803F.2_cid372?__blob=publicationFile
- 40.Euscher E D, Malpica A, Atkinson E N. Ultrastaging improves detection of metastases in sentinel lymph nodes of uterine cervix squamous cell carcinoma. Am J Surg Pathol. 2008;32:1336–1343. doi: 10.1097/PAS.0b013e31816ecfe4. [DOI] [PubMed] [Google Scholar]
- 41.Koh W-J, Abu-Rustum N R, Bean S. Cervical Cancer, Version 3.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2019;17:64–84. doi: 10.6004/jnccn.2019.0001. [DOI] [PubMed] [Google Scholar]
- 42.European Society of Gynecological Oncology (ESGO) ESGO Guidelines for the Management of Cervical Cancer 2017. Accessed September 27, 2020 at:https://guidelines.esgo.org/cervical-cancer/guidelines/recommendations
- 43.Darin M C, Gómez-Hidalgo N R, Westin S N. Role of Indocyanine Green in Sentinel Node Mapping in Gynecologic Cancer: Is Fluorescence Imaging the New Standard? J Minim Invasive Gynecol. 2016;23:186–193. doi: 10.1016/j.jmig.2015.10.011. [DOI] [PubMed] [Google Scholar]
- 44.Buda A, Crivellaro C, Elisei F. Impact of Indocyanine Green for Sentinel Lymph Node Mapping in Early Stage Endometrial and Cervical Cancer: Comparison with Conventional Radiotracer (99m)Tc and/or Blue Dye. Ann Surg Oncol. 2016;23:2183–2191. doi: 10.1245/s10434-015-5022-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Buda A, Papadia A, Zapardiel I. From Conventional Radiotracer Tc-99(m) with Blue Dye to Indocyanine Green Fluorescence: A Comparison of Methods Towards Optimization of Sentinel Lymph Node Mapping in Early Stage Cervical Cancer for a Laparoscopic Approach. Ann Surg Oncol. 2016;23:2959–2965. doi: 10.1245/s10434-016-5227-y. [DOI] [PubMed] [Google Scholar]
- 46.Roy M, Bouchard-Fortier G, Popa I. Value of sentinel node mapping in cancer of the cervix. Gynecol Oncol. 2011;122:269–274. doi: 10.1016/j.ygyno.2011.04.002. [DOI] [PubMed] [Google Scholar]
- 47.Bats A-S, Buénerd A, Querleu D. Diagnostic value of intraoperative examination of sentinel lymph node in early cervical cancer: a prospective, multicenter study. Gynecol Oncol. 2011;123:230–235. doi: 10.1016/j.ygyno.2011.08.010. [DOI] [PubMed] [Google Scholar]
- 48.Balaya V, Guani B, Benoit L. Diagnostic value of frozen section examination of sentinel lymph nodes in early-stage cervical cancer at the time of ultrastaging. Gynecol Oncol. 2020;158:576–583. doi: 10.1016/j.ygyno.2020.05.043. [DOI] [PubMed] [Google Scholar]
- 49.Selman T J, Mann C, Zamora J. Diagnostic accuracy of tests for lymph node status in primary cervical cancer: a systematic review and meta-analysis. CMAJ. 2008;178:855–862. doi: 10.1503/cmaj.071124. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Niikura H, Tsuji K, Tokunaga H. Sentinel node navigation surgery in cervical and endometrial cancer: a review. Jpn J Clin Oncol. 2019;49:495–500. doi: 10.1093/jjco/hyz062. [DOI] [PubMed] [Google Scholar]
- 51.Gianoni M, Mathevet P, Uzan C. Does the Sentinel Lymph Node Sampling Alone Improve Quality of Life in Early Cervical Cancer Management? Front Surg. 2020;7:31. doi: 10.3389/fsurg.2020.00031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Bats A-S, Mathevet P, Buenerd A. The sentinel node technique detects unexpected drainage pathways and allows nodal ultrastaging in early cervical cancer: insights from the multicenter prospective SENTICOL study. Ann Surg Oncol. 2013;20:413–422. doi: 10.1245/s10434-012-2597-7. [DOI] [PubMed] [Google Scholar]
- 53.Bats A-S, Frati A, Mathevet P. Contribution of lymphoscintigraphy to intraoperative sentinel lymph node detection in early cervical cancer: Analysis of the prospective multicenter SENTICOL cohort. Gynecol Oncol. 2015;137:264–269. doi: 10.1016/j.ygyno.2015.02.018. [DOI] [PubMed] [Google Scholar]
- 54.Marnitz S, Köhler C, Bongardt S. Topographic distribution of sentinel lymph nodes in patients with cervical cancer. Gynecol Oncol. 2006;103:35–44. doi: 10.1016/j.ygyno.2006.01.061. [DOI] [PubMed] [Google Scholar]
- 55.Lécuru F, Mathevet P, Querleu D. Bilateral negative sentinel nodes accurately predict absence of lymph node metastasis in early cervical cancer: results of the SENTICOL study. J Clin Oncol. 2011;29:1686–1691. doi: 10.1200/JCO.2010.32.0432. [DOI] [PubMed] [Google Scholar]
- 56.Cibula D, Abu-Rustum N R, Dusek L. Bilateral ultrastaging of sentinel lymph node in cervical cancer: Lowering the false-negative rate and improving the detection of micrometastasis. Gynecol Oncol. 2012;127:462–466. doi: 10.1016/j.ygyno.2012.08.035. [DOI] [PubMed] [Google Scholar]
- 57.Salvo G, Ramirez P T, Levenback C F. Sensitivity and negative predictive value for sentinel lymph node biopsy in women with early-stage cervical cancer. Gynecol Oncol. 2017;145:96–101. doi: 10.1016/j.ygyno.2017.02.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Altgassen C, Hertel H, Brandstädt A. Multicenter validation study of the sentinel lymph node concept in cervical cancer: AGO Study Group. J Clin Oncol. 2008;26:2943–2951. doi: 10.1200/JCO.2007.13.8933. [DOI] [PubMed] [Google Scholar]
- 59.Balaya V, Bresset A, Guani B. Risk factors for failure of bilateral sentinel lymph node mapping in early-stage cervical cancer. Gynecol Oncol. 2020;156:93–99. doi: 10.1016/j.ygyno.2019.10.027. [DOI] [PubMed] [Google Scholar]
- 60.Cibula D, McCluggage W G. Sentinel lymph node (SLN) concept in cervical cancer: Current limitations and unanswered questions. Gynecol Oncol. 2019;152:202–207. doi: 10.1016/j.ygyno.2018.10.007. [DOI] [PubMed] [Google Scholar]
- 61.Popa I, Plante M, Renaud M-C. Negative sentinel lymph node accurately predicts negative status of pelvic lymph nodes in uterine cervix carcinoma. Gynecol Oncol. 2006;103:649–653. doi: 10.1016/j.ygyno.2006.04.022. [DOI] [PubMed] [Google Scholar]
- 62.Barranger E, Cortez A, Commo F. Histopathological validation of the sentinel node concept in cervical cancer. Ann Oncol. 2004;15:870–874. doi: 10.1093/annonc/mdh227. [DOI] [PubMed] [Google Scholar]
- 63.Okamoto S, Niikura H, Yoshinaga K. Detection of micrometastases in cervical cancer with a system that evaluates both sentinel and nonsentinel lymph nodes. Int J Gynecol Cancer. 2009;19:708–711. doi: 10.1111/IGC.0b013e3181a39112. [DOI] [PubMed] [Google Scholar]
- 64.Cibula D, Zikan M, Slama J. Risk of micrometastases in non-sentinel pelvic lymph nodes in cervical cancer. Gynecol Oncol. 2016;143:83–86. doi: 10.1016/j.ygyno.2016.07.101. [DOI] [PubMed] [Google Scholar]
- 65.Cibula D, Abu-Rustum N R, Dusek L. Prognostic significance of low volume sentinel lymph node disease in early-stage cervical cancer. Gynecol Oncol. 2012;124:496–501. doi: 10.1016/j.ygyno.2011.11.037. [DOI] [PubMed] [Google Scholar]
- 66.Colturato L F, Signorini Filho R C, Fernandes R CM. Lymph node micrometastases in initial stage cervical cancer and tumoral recurrence. Int J Gynaecol Obstet. 2016;133:69–75. doi: 10.1016/j.ijgo.2015.08.019. [DOI] [PubMed] [Google Scholar]
- 67.Guani B, Dorez M, Magaud L. Impact of micrometastasis or isolated tumor cells on recurrence and survival in patients with early cervical cancer: SENTICOL Trial. Int J Gynecol Cancer. 2019;29:447–452. doi: 10.1136/ijgc-2018-000089. [DOI] [PubMed] [Google Scholar]
- 68.Guani B, Balaya V, Magaud L. The Clinical Impact of Low-Volume Lymph Nodal Metastases in Early-Stage Cervical Cancer: The Senticol 1 and Senticol 2 Trials. Cancers (Basel) 2020;12:1061. doi: 10.3390/cancers12051061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Balaya V, Guani B, Magaud L. Long-term oncological safety of sentinel lymph node biopsy in early-stage cervical cancer. JCO. 2020;38:6006–6006. [Google Scholar]




