嵌合抗原受体T细胞(CAR-T细胞)的诞生是人类与肿瘤的斗争中具有里程碑意义的事件。从首个人工改造TCR嵌合T细胞的出现并验证其有特异性抗原识别活性,到嵌合入特异性抗体单链可变区(scFv)片段和共刺激分子区域的CAR-T细胞成为主流,再到CAR-T细胞被临床公认为一种安全、有效、持续杀伤肿瘤细胞的免疫细胞疗法,其过程复杂又艰辛。CAR-T细胞的演变历程是CAR-T细胞结构完善的历史,亦是CAR-T细胞经历体外实验、动物体内实验最终进入临床试验的发展史。本文我们就CAR-T细胞的结构演变及CAR-T细胞的结构创新综述如下。
一、CAR-T细胞结构演变历程
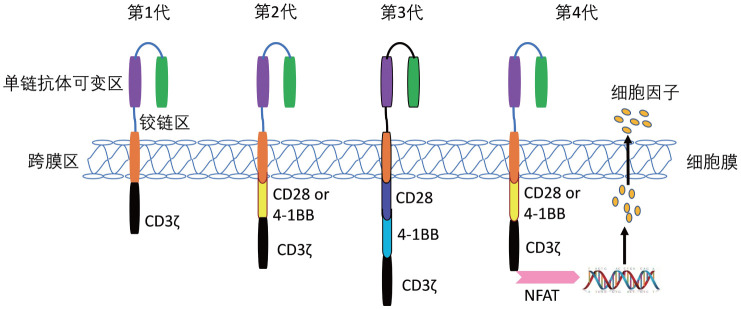
为提高CAR-T细胞的杀伤效率、降低体内不良反应发生率、杀伤肿瘤效果更持久,研究者们对CAR的结构不断进行改进和完善,并根据CAR的结构特点对其命名,从最初的第一代CAR-T细胞发展到目前第四代CAR-T细胞经历了近30年的时间(图1)。
图1. 嵌合抗原受体T细胞(CAR-T细胞)细胞结构演变.
1.第一代CAR-T细胞简介:第一代CAR-T细胞指嵌合入经典的scFv片段并由铰链区串联胞内信号CD3ζ结构域的T细胞(图1)。在将Fv嵌合入TCR恒定区赋予T细胞类抗体识别特性后,Eshhar团队致力于改良嵌合受体的组成和结构以提高T细胞的靶向杀伤能力。1993年该团队报道,其设计了编码TNP抗体重链和轻链的scFv,分别与TCR-CD3复合体中胞内ζ信号转导片段和免疫球蛋白Fc受体γ链(FcγR ⅢA)结合,构建scFvRζ和scFvRγ后转染到T细胞内,使T细胞同时具备了抗体样直接识别和细胞免疫活性的双重特征[1]。至此,由scFv-铰链区-CD3ζ组成的CAR-T细胞基本结构被广泛研究应用。包含此结构的CAR-T细胞公认为第一代CAR-T细胞。
2.第二代CAR-T细胞结构:第一代CAR-T细胞在设计中并未包含共刺激分子片段,致使其无法完全激活,表现为在动物体内增殖、存活时间短,肿瘤杀伤效果不能维持,虽然第一代CAR-T细胞可延长荷瘤动物生存期,但最终实验动物仍因肿瘤细胞的持续生长而死亡。第二代CAR-T细胞是指串联scFv、一个CD28或4-1BB共刺激分子片段及下游CD3ζ的人工嵌合T细胞。在2002年Maher等[2]首先报道其团队制备了识别前列腺特异膜抗原(prostate-specific membrane antigen,PSMA)的特异性CD3ζ-CD28 CAR-T细胞,自此包含共刺激分子的第二代CAR-T细胞诞生。2004年Imai等[3]报道包含T细胞共刺激分子4-1BB信号片段的anti-CD19-BB-ζ CAR-T细胞对急性淋巴细胞白血病(ALL)细胞强有效的特异性杀伤效应。串联共刺激分子片段的CAR-T细胞比第一代CAR-T细胞显示了突出的优越性,开启了第二代CAR-T细胞研究和应用的大门。至此,包含特异性抗体ScFv、一个共刺激分子4-1BB或CD28及TCR-CD3ζ的第二代CAR-T结构明确。
3.第三代CAR-T细胞结构:第三代CAR-T细胞是指在第二代CAR-T细胞基础上再增加一个共刺激分子片段构建的CAR-T细胞,其中共刺激分子可为经典的CD28和4-1BB,也可由经典信号分子联合OX40、ICOS、CD27、CD40-MyD88等组成,即由ScFv、2个共刺激分子和CD3ζ结构域串联而成。2009年,June团队研究结果显示在CAR中加入2个共刺激分子CD28与4-1BB后得到的CAR-T细胞具有分泌细胞因子水平更高与增殖活性更强的特征[4]。随后,Tammana等[5]研究结果亦证实包含共刺激分子4-1BB和CD28的CAR-T细胞具有良好的靶细胞杀伤活性。研究者将这种包含2个或者2个以上共刺激分子的CAR-T称为第三代CAR-T细胞,其与第二代CAR-T细胞相比,其细胞毒性及增殖活性更强。2018年June团队在《JCI insight》发表数据表明,由ICOS联合4-1BB制备的第三代CAR-T细胞在体内展示了超强的抗肿瘤能力,而且延长其在体内的存活寿命[6]。2018年15例B细胞淋巴瘤和白血病患者应用CD19-CD28-BB-ζ CAR-T细胞的Ⅰ/Ⅱa期临床试验数据公布,证实了第三代CAR-T细胞人体应用的安全性和有效性[7]。相比于第二代CAR-T细胞,第三代CAR-T细胞在前临床试验数据中表现出更强更持久的作用活性[8]。但也有报道指出,第三代CAR-T细胞可能有T细胞刺激阈值的降低、T细胞活化过度、细胞因子过量释放等风险。
4.第四代CAR-T细胞结构:2010年Dotti团队将IL-15基因嵌合入CD19 CAR-T细胞中,展现出了很好的细胞增殖活性并下调PD-1表达,体内抗肿瘤效果显著[9]。2011年Chmielewski等[10]构建了IL-12可诱导分泌型CAR-T细胞(iIL-12 CAR-T细胞),在肿瘤环境中募集并增强巨噬细胞功能,在动物体内实现了CAR-T细胞杀伤靶抗原阴性肿瘤细胞的良好效果。2014年Abken团队对第四代CAR-T细胞描述时提出TRUCK T细胞(T-cells redirected for universal cytokine killing)的概念[11]。第四代CAR-T细胞指含有一个活化T细胞核因子(NFAT)转录相应元件,可以使CAR-T细胞在肿瘤区域分泌特定的转基因蛋白,如细胞因子IL-12、IL-18、趋化因子等,从而修饰肿瘤微环境,募集并活化其他免疫细胞进行免疫应答的T细胞。由于肿瘤细胞具有异质性,或者肿瘤细胞在免疫治疗过程中靶抗原丢失,导致这部分肿瘤细胞不具有可被T细胞特异性识别的抗原,无法被传统的CAR-T细胞识别并清除。这一问题或可通过第四代CAR-T技术,募集除CAR-T细胞以外的免疫细胞至肿瘤所在区域来解决。更为重要的是TRUCK T细胞的应用也不再仅限于肿瘤治疗,其在病毒感染、自身免疫病、代谢性疾病中的应用前景值得期待。
二、CAR-T细胞结构研究的一些方向
1.scFv新靶点的挖掘:由于血液系统肿瘤细胞的异质性大,有效靶点的选择是设计和构建CAR-T细胞最关键的一环。选择一个理想的靶点并非易事,作为CAR-T细胞的靶点最好能具备下列特征:①靶抗原应有很强的特异性,在正常组织上不表达或在很少的正常组织上有微弱表达;②绝大多数该种血液系统肿瘤患者有此抗原表达;③靶抗原最好能表达在恶性克隆细胞的表面;④患者所患的恶性肿瘤细胞上靶抗原能均一表达;⑤所选的靶点在该肿瘤的发生和发展中起着关键的作用;⑥在免疫治疗的选择性压力下,靶抗原的表达能较少下调。
CD19靶点是目前B细胞肿瘤CAR-T细胞治疗中使用最成熟、最广泛的靶点。2003年Cooper等[12]就报道,其团队构建的CD19特异性CAR-T细胞可以有效识别并杀伤CD19+急性B淋巴细胞白血病(B-ALL)和淋巴瘤细胞[12]。2004年含4-1BB共刺激分子片段的CD19 ScFV-BB-ζ CAR-T细胞发表[3]。2006年,含CD28共刺激分子片段的CD19 ScFV-CD28-ζ CAR-T细胞被报道[13]。CD19 CAR-T细胞已成为B细胞肿瘤CAR-T细胞治疗的主要产品。除CD19之外,针对CD20、CD22、CD79b、ROR-1等设计研发的CAR-T细胞,其临床应用的数据也在不断积累(表1)。2019年Qin等[14]报道了BAFF CAR-T细胞可以消灭CD19 CAR-T细胞治疗阳性和阴性复发的肿瘤。寻找新的替代靶点,可为CAR-T治疗后复发的患者带来新的希望。
表1. 血液系统肿瘤嵌合抗原T细胞(CAR-T细胞)靶点汇总.
| 靶抗原 | CAR结构 | 靶向疾病名称 |
| CD19 | CD3ζ, CD28 or 4-1BB | 急性淋巴细胞白血病、慢性淋巴细胞白血病、B细胞型非霍奇金淋巴瘤、多发性骨髓瘤 |
| CD3ζ, CD28 and 4-1BB | ||
| CD20 | CD3ζ or CD3ζ and 4-1BB | CD20+恶性肿瘤 |
| CD22 | CD3ζ and CD28 | 急性B淋巴细胞白血病、B细胞型非霍奇金淋巴瘤 |
| CD23 | CD3ζ and CD28 | 慢性B淋巴细胞白血病 |
| CD30 | CD3ζ and CD28 | 霍奇金淋巴瘤、非霍奇金淋巴瘤 |
| CD33 | CD3ζ and 4-1BB | 急性髓系白血病 |
| CD38 | CD3ζ and 4-1BB | 多发性骨髓瘤、急性B淋巴细胞白血病 |
| CD44v6 | CD3ζ and CD28 | 急性髓系白血病、多发性骨髓瘤 |
| CD56 | CD3ζ and CD28 | 多发性骨髓瘤 |
| CD70 | CD3ζ and CD28 | 多发性骨髓瘤、弥漫大B细胞淋巴瘤 |
| CD79b | CD3ζ and 4-1BB | 弥漫大B细胞淋巴瘤、套细胞淋巴瘤 |
| CD117(c-kit) | CD3ζ and CD28 | 急性髓系白血病 |
| CD123 | CD3ζ and CD28 | 急性髓系白血病 |
| CD138 | CD3ζ and 41BB | 多发性骨髓瘤 |
| CD319(CS1, SLAMF7) | CD3ζ and CD28 | 多发性骨髓瘤 |
| CD371(CLL-1) | CD3ζ, CD28 and 4-1BB | 急性髓系白血病 |
| BCMA | CD3ζ and 41BB | 多发性骨髓瘤 |
| BAFF-R | CD3ζ and 41BB | B细胞恶性肿瘤 |
| FLT3 | CD3ζ, CD28 or 4-1BB | 急性髓系白血病 |
| FRβ | CD3ζ or CD3ζ and CD28 | 急性髓系白血病 |
| GPRC5D | CD3ζ, CD28 and 4-1BB | 多发性骨髓瘤 |
| Igκ | CD3ζ and CD28 | 慢性淋巴细胞白血病、B细胞恶性肿瘤, 多发性骨髓瘤 |
| IL1RAP | CD3ζ and CD28 | 急性髓系白血病 |
| Lewis Y | CD3ζ and CD28 | 急性髓系白血病 |
| LMP1 | CD3ζ, CD28 or/and 4-1BB | B细胞淋巴瘤 |
| MMG49 | CD3ζ and CD28 | 多发性骨髓瘤 |
| NKG2D | CD3ζ | 多发性骨髓瘤、淋巴瘤 |
| ROR1 | CD3ζ and 41BB | 慢性淋巴细胞白血病、小淋巴细胞淋巴瘤 |
2013年,Carpenter等[15]比较了B细胞成熟抗原(BCMA)在正常人和多发性骨髓瘤(MM)患者中的表达,结果发现除了浆细胞外,正常人体其他组织及CD34+造血干细胞表面均未检测到BCMA,而在5例MM患者骨髓瘤细胞表面均检测到BCMA高表达,以BCMA为靶点的CAR-T细胞在动物体内显示了良好的杀伤MM细胞的效果。其后,抗BCMA CAR-T细胞治疗的临床试验广泛开展[16]–[19]。除了BCMA靶点外,CD19靶点的CAR-T也有一定的抗MM作用;CD38、CD138、κ轻链CAR-T细胞治疗的临床试验正在进行;针对CS1、CD44v6等靶点的CAR-T研究也在不断推进。根据2016年《Nature review》报道及近年的文献报道总结血液系统肿瘤CAR-T细胞靶点见表1。
2.scFv靶点的特异性:目前针对scFv片段序列多为从鼠源性现有抗体信息中获得,虽然其可识别人源肿瘤细胞表面抗原,但动物来源属性的CAR-T细胞应用于人体仍存在特异性较差及具有免疫原性的风险。为避免受机体产生抗CAR-T细胞免疫风险,保障CAR-T细胞在患者免疫系统内长期存活,构建人源性CAR-T是更好的选择之一。本团队应用人源CD19 scFv代替鼠源序列,连接4-1BB-ζ片段构建的CAR-T细胞在临床应用中显示了良好的疗效,14例无CAR-T细胞治疗史的难治/复发ALL患者中13例在输注后30 d内获得完全缓解(CR),且3例患者经过鼠源CAR-T治疗无效后再次输注人源CAR-T细胞,1例获得CR[20]。人源化CD19修饰的CAR-T细胞在临床应用中崭露头角。2019年本团队再次发布应用人源化CD19 CAR-T联合BCMA CAR-T细胞治疗21例难治/复发MM的研究,总体反应率达95%,包括9例获严格意义上的完全应答,3例获CR,5例获得非常好的部分缓解,3例达部分缓解,再次证实了人源化CAR-T细胞在临床应用中的良好效果[18]。
3.CAR-T细胞活化/清除开关的应用:CAR-T细胞输注是个不可逆的过程,这种生物活性药物可在人体内长期存活,当有抗原暴露时其可经历几个周期的扩增、衰竭过程。CAR-T细胞应用后一个最常见的急性毒性反应就是细胞因子释放综合征(CRS)。为此,怎样有效控制体内CAR-T细胞的活性及功能的问题值得深入探讨。早在2010年可诱导型caspase9自杀基因(iC9)系统被导入CD19 CAR-T细胞,药物开启iC9自杀活性后,可有效将CAR-T细胞从体内清除[9]。2019年Raje等[21]证实了在CAR-T细胞结构中嵌入淋巴细胞特异性酪氨酸激酶(LCK)片段控制CD3ζ的磷酸化,可实现调控CD28-ζ或者4-1BB-ζ型CAR-T细胞的免疫活性。研究结果表明,应用酪氨酸激酶抑制剂达沙替尼可迅速关闭CD8+和CD4+ CAR-T细胞的功能,此关闭状态可持续几天且并不影响CAR-T细胞的生存能力。可根据酪氨酸激酶抑制剂的用量实现对CAR-T细胞功能的部分或全部关闭,更重要的是此抑制作用是迅速、且可逆的。这种对CAR-T细胞实行的功能开关调控模式,在动物体内已经能较好控制致死性CRS的发生。此CAR-T细胞的结构模式能否安全、有效地应用到人体,获得类似的临床效果,仍需大量试验去验证。
4.复合CAR-T细胞的构建:目前临床上常用的CAR-T细胞为识别单一靶抗原的scFv片段的CAR-T细胞,然而同一种类的肿瘤细胞表达特异性抗原的丰度和种类并不一致,因此有研究者提出设计复合CAR-T把2个或以上scFv识别区的序列联合嵌入构建CAR-T细胞,以期此CAR-T细胞能够对同一类型肿瘤中各亚型细胞的杀伤范围更广泛。早在2016年Grill团队在《J Clin Invest》提出CD19和CD123双靶点CAR-T细胞预防CD19单靶点CAR-T细胞治疗中肿瘤细胞CD19抗原丢失导致CAR-T细胞治疗失败的理论,并验证了CD19-CD23 CAR-T细胞在动物体内杀伤B-ALL细胞的优越性[22]。Zah等[23]报道了利用CD19和CD20双抗原特异性CAR-T细胞(OR-gate CAR-T)杀伤B细胞淋巴瘤的数据,表明此OR-gate CAR-T可以杀伤自发性丢失CD19的B淋巴瘤细胞而优于单CD19 CAR-T细胞。此外,2018年Chen等[24]报道应用BCMA联合CS1抗体片段制备的BCMA-CS1 cCAR-T细胞,在动物体内显示出良好的杀伤MM细胞效应。上述复合CAR-T细胞理念的提出,弥补了单一CAR-T细胞靶向性的不足,前期动物实验的成功为临床应用奠定了基础,复合CAR-T细胞在临床实践中的安全性、有效性评价也有待更多的临床试验来验证。
5.转换型CAR-T细胞的构建:很多的实体肿瘤都表达高水平的抑制性配体比如PD-L1等。利用针对抑制性配体的受体序列构建的CAR-T细胞则有可能将此抑制性信号转换为T细胞活化信号,从而介导肿瘤细胞的杀伤作用。由此观点出发PD-1-CD28转换型CAR-T细胞应运而生,此PD-1-CD28 CAR-T细胞可实现良好的增殖和细胞因子释放等T细胞活化行为,在小鼠体内可有效清除肿瘤细胞并保留一定的记忆特性;且可竞争性结合肿瘤细胞表面高表达的PD-L1配体,从而将原本PD-L1/PD-1传导的抑制性信号转换为CD28介导的T细胞活化信号,最终实现对肿瘤细胞的杀伤效应[25]。此大胆创新的实践,不再苦于肿瘤异质性高而靶抗原特异性不强的局限,借助肿瘤发生后恶性细胞自身的特征为切入点设计CAR-T细胞。肿瘤细胞表面其他高表达的免疫抑制受体也将成为被尝试的对象。
6.通用型CAR-T细胞(UCART)的构建:目前大部分CAR-T细胞来源于患者自身T细胞,可能出现T细胞数目不足、扩增不良等状况,且这种个体化定制的CAR-T细胞制备成本昂贵,因此利用基因编辑技术构建出既能针对肿瘤抗原又不产生移植物抗宿主病(GVHD)的同种异体UCART将是未来的努力方向。现有研究多使用ZFN、TALEN及CRISPR/Cas9等基因编辑工具,敲除异体T细胞上的TCR、MHC及相关信号通路基因,从而防止异体型CAR-T的排斥反应,达到制备现成CAR-T细胞的目的[26]。2017年Qasim等[27]报道利用TALEN系统构建的UCART19治疗了2例B-ALL患者,28 d达到分子生物学缓解。另外,针对CD123靶点构建的UCART123治疗急性髓系白血病(AML)的Ⅰ期临床试验(NCT02159495)也正在进行。除了上述UCART的基本结构构建之外,还可以敲除PD1、CTLA4等T细胞抑制信号分子,进一步增强UCART细胞的功能。这种带有抗原识别适配器的UCART细胞,通过基因手段改变了CAR-T细胞个体化制备的局面,使其成为一种现货储备的即用型细胞疗法。但是,目前UCART细胞也面临一定的技术挑战,如微量TCR阳性的CAR-T细胞仍可引起GVHD反应、基因编辑过程的脱靶效应等,仍需要进一步探索。
三、展望
CAR-T细胞治疗在临床应用的开展到如今初具规模不过短短10年时间,随着CAR-T细胞结构的逐步改进和完善,众多病例已从中获益。面对CAR-T细胞治疗中遇到的问题,研究者一直在积极寻找解决的途径。为寻找AML的特异性靶抗原,Grill团队于2018年在《Cell》报道,利用基因编辑工具CRISPR/Cas9移除健康造血干细胞的CD33分子,使CD33 CAR-T细胞特异性靶向AML肿瘤细胞,获得良好治疗效果[28],提示基因工程改造将使CAR-T细胞应用于更广阔的领域。2018年June团队在《Nature》报告,CAR序列被无意插入到了TET2基因中,赋予了这个CAR-T细胞更强的增殖能力、抗癌能力和持久的寿命,该例接受CAR-T治疗的CLL患者的病情得到了长期(随访5年)控制[29]。未来是否可在CAR-T结构中加入细胞定向插入引导序列,从而调控CAR-T细胞的体内功能等研究也指日可待。另外,2019年发表于《Nature》上的研究表明,重编程上调CAR-T细胞的c-Jun基因,使得CAR-T细胞在体内抵抗细胞衰竭,表现出更强的抗癌活性[30]。在实体肿瘤的研究中,为增强CAR-T细胞杀伤肿瘤效果,给CAR-T细胞引入趋化因子受体基因如CXCR2、CCR4、CCL17和CCL2等,使T细胞能定向迁移到预定靶点。综上所述,CAR-T细胞在基因结构层面具有良好的拓展潜力,未来在此方面的研究价值可观。
Funding Statement
基金项目:国家自然科学基金重点项目(81930005);国家自然科学基金面上项目(81871263、81671584);江苏省高校自然科学研究重大项目(16KJA320003);江苏省“科教强卫”青年医学人才(QNRC2016792);江苏省“青蓝工程”中青年学术带头人
References
- 1.Eshhar Z, Waks T, Gross G, et al. Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors[J] Proc Natl Acad Sci U S A. 1993;90(2):720–724. doi: 10.1073/pnas.90.2.720. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Maher J, Brentjens RJ, Gunset G, et al. Human T-lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRzeta/CD28 receptor[J] Nat Biotechnol. 2002;20(1):70–75. doi: 10.1038/nbt0102-70. [DOI] [PubMed] [Google Scholar]
- 3.Imai C, Mihara K, Andreansky M, et al. Chimeric receptors with 4-1BB signaling capacity provoke potent cytotoxicity against acute lymphoblastic leukemia[J] Leukemia. 2004;18(4):676–684. doi: 10.1038/sj.leu.2403302. [DOI] [PubMed] [Google Scholar]
- 4.Carpenito C, Milone MC, Hassan R, et al. Control of large, established tumor xenografts with genetically retargeted human T cells containing CD28 and CD137 domains[J] Proc Natl Acad Sci U S A. 2009;106(9):3360–3365. doi: 10.1073/pnas.0813101106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Tammana S, Huang X, Wong M, et al. 4-1BB and CD28 signaling plays a synergistic role in redirecting umbilical cord blood T cells against B-cell malignancies[J] Hum Gene Ther. 2010;21(1):75–86. doi: 10.1089/hum.2009.122. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Guedan S, Posey AD, Jr, Shaw C, et al. Enhancing CAR T cell persistence through ICOS and 4-1BB costimulation[J] JCI Insight. 2018;3(1):e96976. doi: 10.1172/jci.insight.96976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Enblad G, Karlsson H, Gammelgård G, et al. A Phase I/IIa Trial Using CD19-Targeted Third-Generation CAR T Cells for Lymphoma and Leukemia[J] Clin Cancer Res. 2018;24(24):6185–6194. doi: 10.1158/1078-0432.CCR-18-0426. [DOI] [PubMed] [Google Scholar]
- 8.Ramos CA, Rouce R, Robertson CS, et al. In Vivo Fate and Activity of Second- versus Third-Generation CD19-Specific CAR-T Cells in B Cell Non-Hodgkin's Lymphomas[J] Mol Ther. 2018;26(12):2727–2737. doi: 10.1016/j.ymthe.2018.09.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Hoyos V, Savoldo B, Quintarelli C, et al. Engineering CD19-specific T lymphocytes with interleukin-15 and a suicide gene to enhance their anti-lymphoma/leukemia effects and safety[J] Leukemia. 2010;24(6):1160–1170. doi: 10.1038/leu.2010.75. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Chmielewski M, Kopecky C, Hombach AA, et al. IL-12 release by engineered T cells expressing chimeric antigen receptors can effectively Muster an antigen-independent macrophage response on tumor cells that have shut down tumor antigen expression[J] Cancer Res. 2011;71(17):5697–5706. doi: 10.1158/0008-5472.CAN-11-0103. [DOI] [PubMed] [Google Scholar]
- 11.Chmielewski M, Hombach AA, Abken H. Of CARs and TRUCKs: chimeric antigen receptor (CAR) T cells engineered with an inducible cytokine to modulate the tumor stroma[J] Immunol Rev. 2014;257(1):83–90. doi: 10.1111/imr.12125. [DOI] [PubMed] [Google Scholar]
- 12.Cooper LJ, Topp MS, Serrano LM, et al. T-cell clones can be rendered specific for CD19: toward the selective augmentation of the graft-versus-B-lineage leukemia effect[J] Blood. 2003;101(4):1637–1644. doi: 10.1182/blood-2002-07-1989. [DOI] [PubMed] [Google Scholar]
- 13.Kowolik CM, Topp MS, Gonzalez S, et al. CD28 costimulation provided through a CD19-specific chimeric antigen receptor enhances in vivo persistence and antitumor efficacy of adoptively transferred T cells[J] Cancer Res. 2006;66(22):10995–11004. doi: 10.1158/0008-5472.CAN-06-0160. [DOI] [PubMed] [Google Scholar]
- 14.Qin H, Dong Z, Wang X, et al. CAR T cells targeting BAFF-R can overcome CD19 antigen loss in B cell malignancies[J] Sci Transl Med. 2019;11(511):eaaw9414. doi: 10.1126/scitranslmed.aaw9414. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Carpenter RO, Evbuomwan MO, Pittaluga S, et al. B-cell maturation antigen is a promising target for adoptive T-cell therapy of multiple myeloma[J] Clin Cancer Res. 2013;19(8):2048–2060. doi: 10.1158/1078-0432.CCR-12-2422. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Sidaway P. Haematological cancer: Anti-BCMA CAR T cells show promise in MM[J] Nat Rev Clin Oncol. 2016;13(9):530. doi: 10.1038/nrclinonc.2016.125. [DOI] [PubMed] [Google Scholar]
- 17.Killock D. Anti-BCMA CAR T cells for MM. Nat Rev Clin Oncol. 2019;16(8):465. doi: 10.1038/s41571-019-0229-x. [DOI] [PubMed] [Google Scholar]
- 18.Yan Z, Cao J, Cheng H, et al. A combination of humanised anti-CD19 and anti-BCMA CAR T cells in patients with relapsed or refractory multiple myeloma: a single-arm, phase 2 trial[J] Lancet Haematol. 2019;6(10):e521–e529. doi: 10.1016/S2352-3026(19)30115-2. [DOI] [PubMed] [Google Scholar]
- 19.Raje N, Berdeja J, Lin Y, et al. Anti-BCMA CAR T-Cell Therapy bb2121 in Relapsed or Refractory Multiple Myeloma[J] N Engl J Med. 2019;380(18):1726–1737. doi: 10.1056/NEJMoa1817226. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cao J, Wang G, Cheng H, et al. Potent anti-leukemia activities of humanized CD19-targeted Chimeric antigen receptor T (CAR-T) cells in patients with relapsed/refractory acute lymphoblastic leukemia[J] Am J Hematol. 2018;93(7):851–858. doi: 10.1002/ajh.25108. [DOI] [PubMed] [Google Scholar]
- 21.Mestermann K, Giavridis T, Weber J, et al. The tyrosine kinase inhibitor dasatinib acts as a pharmacologic on/off switch for CAR T cells[J] Sci Transl Med. 2019;11(499):eaau5907. doi: 10.1126/scitranslmed.aau5907. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Ruella M, Barrett DM, Kenderian SS, et al. Dual CD19 and CD123 targeting prevents antigen-loss relapses after CD19-directed immunotherapies[J] J Clin Invest. 2016;126(10):3814–3826. doi: 10.1172/JCI87366. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Zah E, Lin MY, Silva-Benedict A, et al. ADDENDUM: T Cells Expressing CD19/CD20 Bispecific Chimeric Antigen Receptors Prevent Antigen Escape by Malignant B Cells[J] Cancer Immunol Res. 2016;4(7):639–641. doi: 10.1158/2326-6066.CIR-16-0108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Chen KH, Wada M, Pinz KG, et al. A compound chimeric antigen receptor strategy for targeting multiple myeloma[J] Leukemia. 2018;32(2):402–412. doi: 10.1038/leu.2017.302. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Kobold S, Grassmann S, Chaloupka M, et al. Impact of a New Fusion Receptor on PD-1-Mediated Immunosuppression in Adoptive T Cell Therapy[J] J Natl Cancer Inst. 2015;107(8):djv146. doi: 10.1093/jnci/djv146. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Zhao J, Lin Q, Song Y, et al. Universal CARs, universal T cells, and universal CAR T cells[J] J Hematol Oncol. 2018;11(1):132. doi: 10.1186/s13045-018-0677-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Qasim W, Zhan H, Samarasinghe S, et al. Molecular remission of infant B-ALL after infusion of universal TALEN gene-edited CAR T cells[J] Sci Transl Med. 2017;9(374):eaaj2013. doi: 10.1126/scitranslmed.aaj2013. [DOI] [PubMed] [Google Scholar]
- 28.Kim MY, Yu KR, Kenderian SS, et al. Genetic Inactivation of CD33 in Hematopoietic Stem Cells to Enable CAR T Cell Immunotherapy for Acute Myeloid Leukemia[J] Cell. 2018;173(6):1439–1453.e19. doi: 10.1016/j.cell.2018.05.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Fraietta JA, Nobles CL, Sammons MA, et al. Disruption of TET2 promotes the therapeutic efficacy of CD19-targeted T cells[J] Nature. 2018;558(7709):307–312. doi: 10.1038/s41586-018-0178-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Lynn RC, Weber EW, Sotillo E, et al. c-Jun overexpression in CAR T cells induces exhaustion resistance[J] Nature. 2019;576(7786):293–300. doi: 10.1038/s41586-019-1805-z. [DOI] [PMC free article] [PubMed] [Google Scholar]