Abstract
Hintergrund
Die diabetische Ketoacidose (DKA) ist ein lebensbedrohlicher Notfall bei Manifestation eines Diabetes mellitus Typ 1 (DM1) bei Kindern und Jugendlichen, häufig bei verspäteter Diagnosestellung oder vorheriger Fehldiagnose. Während der Zeit des „Coronavirus-disease-2019(COVID-19)-Lockdowns“ in Deutschland stellten sich weniger Patienten in Notfallambulanzen und Arztpraxen vor.
Fragestellung
Hat sich der Anteil der DKA bei Manifestation eines DM1 in der pädiatrischen Population in diesem Zeitraum verändert, und welche Gruppen sind besonders gefährdet, eine DKA zu erleiden?
Material und Methoden
Die DKA-Häufigkeit in der Zeit vom 13.03.2020 bis 13.05.2020 wurde bei Patienten <18 Jahren mit DM1-Manifestation in pädiatrischen Diabeteszentren untersucht. Die Diabeteszentren dokumentierten ihre Einschätzung, ob durch COVID-19 die Vorstellung verzögert war. Um den Einfluss von Risikofaktoren auf die DKA-Häufigkeit zu analysieren, erfolgte ein Vergleich der Daten aus dem Jahr 2020 mit denselben Zeiträumen der Jahre 2018 und 2019 mit linearen und logistischen Regressionsmodellen.
Ergebnisse
Die Daten von 532 Patienten aus 216 Diabeteszentren zeigten, dass das Risiko für eine DKA im Vergleich zu den Jahren 2018/2019 um 84,7 % und für eine schwere DKA um 45,3 % erhöht war. Kinder <6 Jahren waren mit einer Steigerung einer DKA um 141,6 % bzw. einer schweren DKA um 97,0 % besonders betroffen. Migrationshintergrund war ein COVID-19-unabhängiger Risikofaktor. Insgesamt wurden 31 % der Patienten verspätet vorgestellt, oder ihre Diagnose wurde zuvor verkannt.
Diskussion
In der Zeit des „COVID-19-Lockdowns“ war die Häufigkeit der DKA bei DM1-Manifestation für Kinder und Jugendliche signifikant erhöht. Alter <6 Jahre, Migrationshintergrund und verzögerte Vorstellung waren die Hauptrisikofaktoren.
Schlüsselwörter: Kinder < 6 Jahren, Migrationshintergrund, „COVID-19-Lockdown“, Verspätete Vorstellung, Verkannte Diagnose
Abstract
Background
Diabetic ketoacidosis (DKA) is a life-threatening emergency in children and adolescents with manifestation of type 1 diabetes mellitus (DM1) and often associated with delayed diagnosis or previous diagnostic errors. During the coronavirus disease 2019 (COVID-19) lockdown period in Germany, less patients presented at emergency departments and private practices.
Objective
The aim of this study was to investigate the DKA risk in children and adolescents with DM1 manifestation during the COVID-19 lockdown and associated risk factors.
Material and methods
The frequency of DKA at DM1 onset in patients <18 years between 13 March and 13 May 2020 in pediatric diabetes centers was analyzed. The centers also documented their assessment, if the presentation was delayed or the diagnosis was not made on the first medical consultation. In order to analyze the influence of the risk factors on the frequency of DKA, the data from 2020 were compared with the same periods in 2018 and 2019 using multivariable linear and logistic regression.
Results
The data of 532 patients from 216 diabetes centers showed that the risk for DKA increased by 84.7% and the risk for severe DKA increased by 45.3% compared to the years 2018/2019. Children <6 years had the highest risk with an 141.6% increase for DKA and 97.0% for severe DKA compared to the previous years. Migration background was a risk factor independent of COVID-19. Of the patients 31% had either a delayed presentation or a missed diagnosis.
Conclusion
During the COVID-19 lockdown the frequency of DKA and severe DKA at DM1 onset was significantly increased for children and adolescents in Germany. Age <6 years, migration background and delayed diagnosis were the main risk factors.
Keywords: Children < 6 years, Migration background, COVID-19 lockdown, Delayed presentation, Missed diagnosis
Die diabetische Ketoacidose (DKA) bei Manifestation eines Diabetes mellitus Typ 1 (DM1) ist ein lebensbedrohlicher Notfall, der mit erhöhter Morbidität assoziiert ist und durch verzögerte Diagnosestellung begünstigt wird [25]. Während der COVID-19-Pandemie in Deutschland zeigte sich ein deutlicher Anstieg von DKA bei pädiatrischen Patienten zum Zeitpunkt der Manifestation eines DM1 [14]. Wie kann die Erkrankung zukünftig früher erkannt werden, und wie können Manifestationen mit DKA vermieden werden?
Hintergrund
Die zur Eindämmung der COVID-19-Pandemie in Deutschland beschlossenen Beschränkungen im Sinne eines „Lockdowns“ vom März bis Mai 2020 stellten für Kinder und Jugendliche und ihre Familien eine große Herausforderung dar [3]. Gleichzeitig veränderten sich die Versorgungsstrukturen mit einer auch in der Öffentlichkeit wahrgenommen Fokussierung auf die Pandemiesituation. Durch politische Debatten, mediale Berichterstattung und soziale Medien gestaltete sich die öffentliche Wahrnehmung derart, dass die Bevölkerung vermeintlich unnötige Arztbesuche zu vermeiden suchte. Telemedizinische Versorgungsangebote wurden intensiviert. Dieser Artikel soll mit dazu beitragen, dass Ärzte im Notdienst eine Diabeteserkrankung möglichst nicht übersehen.
Symptome einer DKA bei Manifestation werden bei Kindern häufig verkannt und die Diagnose DM1 dadurch verzögert gestellt [5, 20]. Die DKA bei Manifestation kann mit einer kürzeren Remission [4] und langfristig mit neurologischen Beeinträchtigungen [6] sowie einer dauerhaft schlechteren Stoffwechsellage [10] assoziiert sein. Daher muss das Ziel sein, diese Patienten rechtzeitig zu erkennen und frühzeitig zu behandeln. Im April 2020 berichteten Ärzte aus China [13] und Italien [16] über Kinder und Jugendliche mit DKA bei Manifestation eines DM1, weil die Patienten möglicherweise verzögert ärztlich vorgestellt worden waren.
Fragestellung
Ist in Deutschland die Rate der DKA bei Manifestation eines DM1 während des „COVID-19-Lockdowns“ vom März bis Mai 2020 angestiegen? Welche Gruppen waren hiervon besonders betroffen? Diese deutschsprachige Publikation erweitert und interpretiert die Ergebnisse eines englischsprachigen Kurzberichtes [14] mit dem Ziel, Ursachen für den DKA-Anstieg in Zeiten der Pandemie zu ergründen, um dann nach Möglichkeiten zu suchen, die Häufigkeit dieser lebensbedrohlichen Komplikation zukünftig in Deutschland zu senken.
Methodik
Die an der bundesweiten prospektiven Diabetes-Patienten-Verlaufsdokumentation (DPV) teilnehmenden Diabeteszentren (Kliniken und Praxen) wurden gebeten, die Diabetesmanifestationen in der Zeit vom 13.03.2020 bis zum 13.05.2020 zeitnah zu übermitteln. Die Zentren wurden von der DPV-Koordination über etwa 2 Wochen regelmäßig per E‑Mail angeschrieben; wenn dies zu keiner Rückmeldung geführt hatte, wurden sie durch das Autorenteam angerufen. Erfasst wurden Alter, Geschlecht und Migrationshintergrund sowie der pH-Wert und die Bikarbonatkonzentration im Blut bei Aufnahme. Ergänzend wurde gefragt, ob die Inanspruchnahme des Gesundheitssystems durch die Familie aufgrund der COVID-19-Situationen verzögert erfolgt sein könnte. Weiterhin wurde nach einer möglichen Verkennung der Symptome der Ketoacidose im Rahmen eines telefonischen/telemedizinischen Kontaktes sowie nach anderen möglichen Gründen für die verspätete Diagnose gefragt.
Daten von über 90 % der Kinder und Jugendlichen mit DM1, die in Deutschland betreut werden und deren Familien eingewilligt haben, werden im DPV-Register dokumentiert und durch die teilnehmenden Zentren 2‑mal jährlich anonymisiert in eine Datenbank am Institut für Epidemiologie und Medizinische Biometrie (ZIBMT) der Universität Ulm übertragen [15]. An der Datenerhebung zu dieser Studie beteiligten sich deutschlandweit 217 kinderdiabetologische Zentren.
Eingeschlossen wurden Patienten <18 Jahren mit Manifestation eines DM1. Als Ketoacidose wurde ein pH < 7,3 oder eine Bikarbonatkonzentration <15 mmol/l definiert, als schwere Ketoacidose ein pH < 7,1 oder eine Bikarbonatkonzentration <5 mmol/l [7]. Eine Migrationsbiografie wurde angenommen, wenn mindestens ein Elternteil außerhalb Deutschlands geboren wurde.
Statistik
Zur Beurteilung der Einflussfaktoren auf die Häufigkeit einer DKA wurden die erhobenen Daten für das Jahr 2020 analysiert und in linearen und logistischen Regressionsmodellen mit den zusammengefassten Daten aus denselben Zeiträumen der Jahre 2018 und 2019 verglichen. Die Daten wurden in deskriptiven Statistiken dargestellt (Mittelwert ± Standardabweichung (SD), Prozentangaben). Nichtparametrische Methoden (Kruskal-Wallis-Test oder χ2-Test) wurden für den Vergleich zwischen Gruppen angewandt und die p-Werte nach Holm und Bonferroni für multiple Vergleiche adjustiert. Die jeweiligen Regressionsberechnungen wurden für Alter, Geschlecht und Migrationshintergrund adjustiert; eine Gruppeneinteilung nach Alter (<6 Jahre, 6 bis 11 Jahre, 12 bis 18 Jahre) wurde vorgenommen. Die Ergebnisse wurden als adjustierte Mittelwerte bzw. Prozentwerte mit dem entsprechenden 95 %-Konfidenzintervall (KI) angegeben. Ein p-Wert (2-seitig) <0,05 wurde als statistisch signifikant gewertet. Die statistische Analyse erfolgte mit SAS für Windows (Version 9.4, SAS Institute, Cary, NC, USA). Die Analyse der anonymisierten Daten des DPV-Registers wurde durch die Ethikkommission der Universität Ulm genehmigt.
Ergebnisse
Von den 217 dokumentierenden Zentren haben 216 an der retrospektiven Studie teilgenommen. 21 Zentren meldeten keine Manifestationen in dem Zeitraum. Es konnten Daten von 532 Patienten analysiert werden.
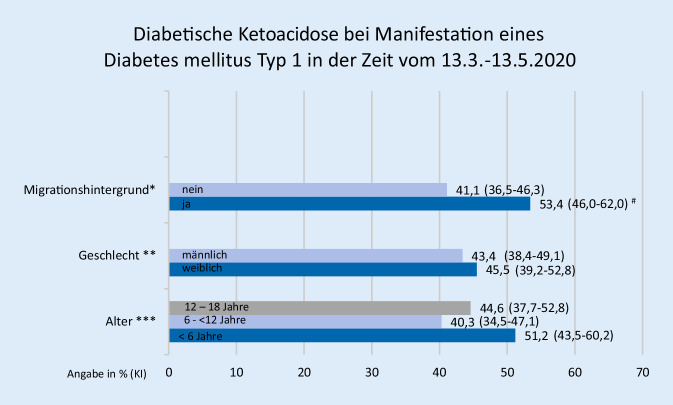
Den Einfluss von Alter, Geschlecht und Migrationshintergrund auf die Häufigkeit der DKA in der Zeit des „COVID-19-Lockdowns“ in Deutschland zeigt Abb. 1. Das höchste DKA-Risiko hatten Kinder und Jugendliche mit Migrationshintergrund sowie Kleinkinder unter 6 Jahren.
Für die Darstellung der Risikofaktoren für eine DKA wurden die Daten der beiden Vorjahre mit jenen von 2020 verglichen (Tab. 1) und der adjustierte prozentuale Anstieg der DKA innerhalb der Gruppen verglichen.
| 13.03.–13.05.2020 n = 532 |
13.03.–13.05.2018/2019 n = 959 |
p | Adjustierter mittlerer Anstieg in % |
|
|---|---|---|---|---|
| Ketoacidosen in % (95 %-KI) | ||||
| Alle Patienten | 44,6 (40,5–49,0) | 24,1 (21,6–27,0) | <0,0001 | 84,7 |
| Altersgruppena | ||||
| ≤6 Jahre | 50,8 (43,0–60,1) | 21,0 (16,7–26,6) | <0,0001 | 141,6 |
| 6–11 Jahre | 40,8 (34,9–47,6) | 26,8 (22,7–31,5) | 0,0002 | 52,3 |
| 12–18 Jahre | 44,7 (37,7–53,0) | 23,3 (18,9–28,7) | <0,0001 | 91,8 |
| Migrationshintergrundb | ||||
| Ja | 53,9 (46,3–62,6) | 28,0 (22,9–34,3) | <0,0001 | 92,4 |
| Nein | 41,5 (36,8–46,7) | 22,9 (20,1–26,2) | <0,0001 | 80,8 |
| Geschlechtc | ||||
| Männlich | 43,7 (38,7–49,5) | 23,2 (19,9–27,2) | <0,0001 | 88,2 |
| Weiblich | 45,6 (39,3–53,0) | 25,2 (21,4–30,0) | <0,0001 | 81,3 |
|
Schwere Ketoacidose in % (95 %-KI) | ||||
| Alle Patienten | 18,8 (15,8–22,5) | 13,0 (11,0–15,3) | 0,0021 | 45,3 |
| Altersgruppena | ||||
| ≤6 Jahre | 23,4 (17,3–31,8) | 11,9 (8,6–16,5) | 0,0027 | 97,0 |
| 6–11 Jahre | 17,9 (13,6–23,5) | 13,4 (10,5–17,2) | 0,120 | 33,1 |
| 12–18 Jahre | 15,7 (11,1–22,4) | 13,2 (9,9–17,7) | 0,46 | 19,1 |
| Migrationshintergrundb | ||||
| Ja | 25,6 (19,4–33,8) | 15,8 (11,8–21,1) | 0,017 | 62,2 |
| Nein | 16,5 (13,2–20,7) | 12,1 (9,9–14,8) | 0,042 | 36,5 |
| Geschlechtc | ||||
| Männlich | 19,6 (15,8–24,4) | 14,0 (11,3–17,3) | 0,028 | 40,4 |
| Weiblich | 17,9 (13,3-24,0) | 11,7 (9,1–15,1) | 0,032 | 52,6 |
Diabetische Ketoacidose: pH < 7,3 und/oder Bikarbonat <15 mmol/l
Schwere diabetische Ketoacidose: pH < 7,1 und/oder Bikarbonat <5 mmol/l
Rohdaten ohne Adjustierung für Patientencharakteristika: [14]
KI Konfidenzintervall
aAdjustiert für Migrationshintergrund und Geschlecht
bAdjustiert für Alter und Geschlecht
cAdjustiert für Alter und Migrationshintergrund
Das Risiko für eine DKA war in allen Gruppen zwischen dem 13.03.2020 und dem 13.05.2020 im Vergleich zu den Jahren 2018/2019 signifikant erhöht. Insbesondere zeigte sich ein Anstieg des Risikos für eine DKA bei Manifestation für Kinder unter 6 Jahren um 141,6 % und für eine schwere DKA um 97 %. Dieser prozentuale Anstieg war für die Gruppe der Kinder unter 6 Jahren mit schwerer DKA im Vergleich zu den Jugendlichen mit schwerer DKA in der Zeit des „COVID-19-Lockdowns“ überproportional erhöht (p = 0,02). Die Adoleszenten und die Grundschüler hatten im Vergleich zu den Vorjahren kein signifikant erhöhtes Risiko für eine schwere DKA.
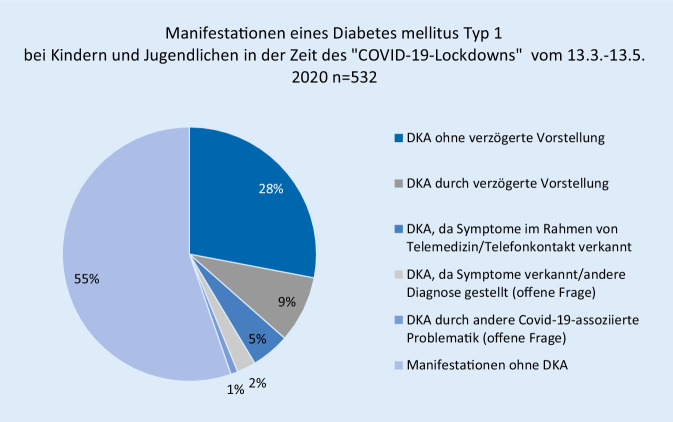
Die Einschätzung der Diabeteszentren zu möglichen pandemiebezogenen Gründen für die Entstehung einer DKA zeigt Abb. 2.
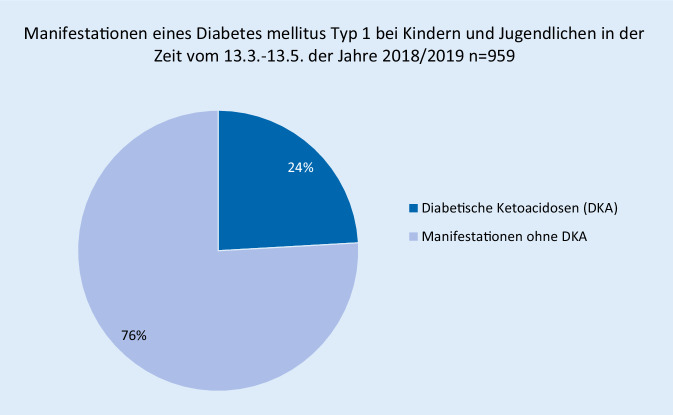
Bei 45 (19 %) der Patienten mit DKA gaben die Diabetesteams an, dass die Familie wegen der COVID-19-Situation verzögert Kontakt zum Gesundheitssystem aufgenommen hätte. In 26 (11 %) der Fälle seien die Symptome einer DKA bei einem telemedizinischen Kontakt verkannt worden. Eine initial falsche Diagnose war bei 16 (7 %) der DKA-Patienten gestellt worden, bei 5 (2 %) Patienten war eine andere COVID-19-bezogene Problematik dokumentiert worden (Abb. 2). 69 (37 %) von 238 DKA-Patienten waren in der Zeit des „COVID-19-Lockdowns“ entweder verspätet vorgestellt, oder die Diagnose war im Rahmen einer telemedizinischen Versorgung verkannt worden. Bei früherer Diagnosestellung des Diabetes läge die DKA-Rate in diesem Zeitraum bei 28 % anstatt bei 44,6 % (149 von 532 Manifestationen). Im Vergleich dazu zeigt Abb. 3, dass während derselben Zeiträume der Jahre 2018/2019 24,1 % der Patienten bei Manifestation eine DKA hatten.
Diskussion
Die Analyse dieser bislang größten und überregional untersuchten Kohorte von Kindern und Jugendlichen mit Manifestation eines DM1 während der Zeit des „COVID-19-Lockdowns“ zeigt einen deutlichen Anstieg der Ketoacidoserate von 24,1 % (95-KI % 21,5–27,0 %) in den Jahren 2018/2019 auf 44,6 % (95 %-KI 40,6–48,9 %). Hierbei zeigte sich in diesem Zeitraum kein Anstieg an Neuerkrankungen über das prädizierte Maß hinaus [26]. Die Häufigkeit einer DKA bzw. schweren DKA bei Manifestation in der pädiatrischen Population ist in Deutschland in der Zeit von 2006 bis 2016 etwas angestiegen [7]. Insofern aggravierte die Zeit des „COVID-19-Lockdowns“ ein bislang ungelöstes gesundheitspolitisches Problem: die Vermeidung einer lebensbedrohlichen Komplikation bei Manifestation einer der häufigsten Stoffwechselerkrankung im Kindes- und Jugendalter.
Risikogruppen für eine DKA bei Manifestation
Kinder unter 6 Jahren zeigten den höchsten Risikoanstieg für eine DKA und für eine schwere DKA im Vergleich zu derselben Zeitspanne der Jahre 2018/2019. Im Vergleich zu den Jugendlichen zeigte diese Altersgruppe einen überproportionalen Anstieg für das Risiko einer schweren DKA. Diese Ergebnisse stimmen mit den Ergebnissen anderer Studien überein, die für dieses Alter eine erhöhte DKA-Rate zeigten [7], und das Risiko einer raschen metabolischen Dekompensation, die zu einer schweren DKA führen kann [19].
Bei jungen Patienten ist die DKA mit verändertem Gehirnwachstum und einer schlechteren kognitiven Leistungsfähigkeit assoziiert [2, 6]. Die initialen Diabetessymptome, wie beispielsweise Einnässen, beginnen oft schleichend, während Symptome wie Bauchschmerzen, Übelkeit oder eine teils als Bronchitis oder Pneumonie fehlgedeutete Kußmaul-Atmung als Hinweise einer DKA aufgrund der relativen Häufigkeit dieser Symptome bei Vorschulkindern oft fehlgedeutet werden [5, 20].
Kinder und Jugendliche mit Migrationshintergrund hatten ein signifikant erhöhtes Risiko für eine DKA bei Manifestation eines DM1 im Vergleich zu Kindern und Jugendlichen ohne Migrationshintergrund während der Zeit des „COVID-19-Lockdowns“. Zwar stieg das Risiko für eine DKA bei Manifestation während der Pandemie im Vergleich zu den Jahren 2018/2019 um 92,4 % und für eine schwere DKA um 62,2 % an, allerdings war dieser Anstieg im Vergleich zu Kindern und Jugendlichen ohne Migrationshintergrund nicht signifikant stärker ausgeprägt. Somit haben Kinder und Jugendliche mit Migrationshintergrund per se ein erhöhtes Risiko für eine DKA bei Manifestation, welches jedoch durch die Pandemiesituation nicht überproportional anstieg. Dieses Ergebnis geht mit nationalen [15] und internationalen Untersuchungen [7] konform, in denen der Migrationsstatus bzw. die Zughörigkeit zu einer ethnischen Minorität neben dem Sozial- und dem Versichertenstatus ein wichtiger Risikofaktor für eine DKA bei Manifestation ist. Neben Barrieren, die verhindern, das Gesundheitssystem in Anspruch zu nehmen, könnten auch eine kulturell bedingte andere Bewertung der Symptome und eine niedrigere Sensibilisierung für den DM1 eine Rolle spielen [7]. Der Sozialstatus wurde in unserer Studie nicht erfasst. Andere nationale Studien zum Zusammenhang zwischen dem Sozialstatus und dem DKA-Risiko bei Kindern und Jugendlichen mit Diabetes zeigen, dass Deprivationen, die dem Migrationshintergrund zugeschrieben wurden, zu großen Teilen durch einen niedrigen Sozialstatus erklärt werden können [18].
Die Jugendlichen hatten im Vergleich zu denselben Zeitabschnitten der Jahre 2018/2019 ein um 91,8 % signifikant erhöhtes DKA-Risiko. Das Risiko für eine schwere DKA war nicht signifikant erhöht. Dazu passend ist das Risiko für eine rasche Dekompensation im Vergleich zu Kleinkindern geringer [19].
Verzögerte Vorstellungen in Zeiten der COVID-19-Pandemie
Die kinderdiabetologischen Zentren gingen bei 31 % der Patienten von einer verzögerten Vorstellung aufgrund des „COVID-19-Lockdowns“ oder einer zuvor verkannten Diagnose aus. Dies sind zwei der wichtigsten Risikofaktoren für die Entstehung der DKA bei Manifestation [5, 25, 27]. Würden diese Patienten als Manifestation ohne DKA gewertet, läge die DKA-Häufigkeit mit 28 % im Bereich der erwarteten Häufigkeit in Deutschland [7].
In Italien berichteten 53 Zentren retrospektiv über insgesamt 160 Patienten mit Manifestation eines DM1 in der 8‑wöchigen „Lockdown“-Phase. Der Anteil der schweren DKA hatte signifikant zugenommen; der Anteil der DM1-Manifestationen war im Vergleich zu 2019 um 23 % gesunken. Die Autoren vermuten die verspätete Vorstellung als Ursache der schwereren DKA [22]. In einem webbasierten internationalen Survey der „International Society for Pediatric and Adolescent Diabetes (ISPAD)“ berichteten 215 pädiatrische Diabeteszenten aus 75 Ländern von 22 % verzögert vorgestellten Patienten in Zeiten der Pandemie. 15 % der Zentren dokumentierten häufigere Ketoacidosen [8]. Der vergleichsweise höhere Anstieg in der DKA-Rate in unserer Kohorte kann dadurch bedingt sein, dass wir pädiatrische Patienten mit DM1-Manifestation in Deutschland nahezu vollständig erfasst haben.
Präventionsmaßnahmen
In Italien hatten öffentliche Aufklärungsmaßnahmen zu einer Reduktion der schweren DKA um 21,3 % bei jüngeren Kindern geführt, nicht aber bei Kindern über 6 Jahren [21].
Weltweit haben öffentliche Aufklärungskampagnen zu DM1 und DKA bei Kindern und Jugendlichen uneinheitliche Erfolgsquoten gezeigt. Am erfolgreichsten sind jene, die mehrere Komponenten integrieren [9]. So konnten in Stuttgart im Rahmen einer 3‑jährigen Kampagne die Gesundheitsämter, Kinderarztpraxen, Kindergärten, Kindertagestätten und die Öffentlichkeit mit Flyern und Postern einbezogen hatte, die DKA-Rate bei Kindern unter 6 Jahren signifikant von 28 % auf 16 % reduziert werden, nicht aber die Rate schwerer DKA [12]. Dieses Modell wird als „Kampagne zur Früherkennung des Diabetes und zur Vermeidung einer diabetischen Ketoacidose bei Kleinkindern“ ab Januar 2021 deutschlandweit von der Arbeitsgemeinschaft Pädiatrische Diabetologie (AGPD) gemeinsam mit dem Berufsverband der Kinder- und Jugendärzte initiiert [1]. Die Kinder- und Jugendärzte sollen die Eltern bei der U6 und U7a im Gespräch und mittels Flyern über die 4 Hauptsymptome einer Diabetesmanifestation („ständiger Durst, häufiges Wasserlassen, Müdigkeit und Gewichtsabnahme“) informieren. Die Wirksamkeit dieser auf die Risikogruppe der jungen Kinder zielenden Aufklärungskampagne wird über mehrere Jahre im Rahmen der DPV-Dokumentation evaluiert werden. Neben der Frage nach der Reduktion der DKA als Zielvariable ist auch die Frage zu klären, wie häufig diese Kampagnen wiederholt werden müssen, bzw. ob sie sich als fester Bestandteil der Vorsorgeuntersuchungen etablieren werden. Sollte sich die DKA-Rate bei den jüngeren Kindern langfristig durch diese Maßnahme reduzieren, wäre ein wesentliches Ziel der DKA-Prävention in Deutschland erreicht.
Kinder aus Familien mit Diabeteserfahrung haben seltener eine Ketoacidose bei Manifestation [27]. Bei Teilnehmern eines regionalen Screeningprogramms auf DM1-assoziierte Autoantikörper in Bayern (0,31 % positive B‑Zell-AK) war die DKA-Rate bei DM1-Manifestation mit <5 % extrem niedrig [29]. Auch die psychische Belastung der Studienteilnehmer und ihrer Familien war bei Diabetesdiagnose geringer als bei Familien, in denen kein Screening stattgefunden hatte. Seit Kurzem gibt es auch in einigen Bundesländern die Möglichkeit, ein erhöhtes genetisches Risiko für Typ-1-Diabetes in den ersten Lebenswochen festzustellen. Kindern mit erhöhtem Risiko wird die Teilnahme an einer Interventionsstudie mit oralem Insulin angeboten mit dem Ziel, den Diabetes zu verzögern oder gar zu verhindern [28]. Auch frühere Studien haben bereits gezeigt, dass Kinder aus Familien, die an einer Studie teilnehmen und bezüglich eines erhöhten DM1-Risikos informiert sind, ein geringeres Risiko für eine DKA haben, sodass Screeningprogramme daher geeignet sein könnten, die DKA-Rate zu senken [11].
Welchen Beitrag Aufklärungskampagnen oder Früherkennungsmaßnahmen langfristig und auf Populationsebene leisten werden, bei dem Ziel, die DKA-Rate bei Manifestation deutlich zu reduzieren, kann heute noch nicht beantwortet werden. Immanent wichtig sind sicherlich zusätzlich vermehrte Anstrengungen im Medizinstudium sowie in der ärztlichen Fort- und Weiterbildung, damit die Diabetesmanifestation bei Kindern und Jugendlichen frühzeitig erkannt wird.
DKA als Modell für die Gesundheitsversorgung in der COVID-19-Pandemie
Die DKA als akute lebensbedrohliche Stoffwechselentgleisung aufgrund einer verspäteten Diagnose eignet sich als Modell einer verzögerten medizinischen Versorgung in Zeiten der COVID-19-Pandemie. Als „corona collateral damage syndrome“ wird der klinische Zustand eines Patienten bezeichnet, der durch die Verzögerung bzw. das Fehlen von medizinischer Versorgung von akuten „Nicht-COVID-19-Notfällen“ entsteht [24]. In einer Umfrage gaben 32 % der befragten Pädiater aus Großbritannien und Irland an, während einer 2‑wöchigen Phase im April 2020 verzögerte Vorstellungen gesehen zu haben. Die Diabetesmanifestation und die DKA waren die Hauptdiagnosen, gefolgt von Sepsis und malignen Erkrankungen [17]. Auch in Deutschland wurden Mitte März 40 % und Mitte Mai 20 % weniger Patienten in Notfallambulanzen vorgestellt [23]. Zusammenfassend könnte der Anstieg der Häufigkeit der DKA bei Diabetesmanifestation im Zusammenhang mit den gesamtgesellschaftlichen Veränderungen im Rahmen der Infektionsschutzmaßnahmen während der ersten Welle der „COVID-19-Pandemie“ stehen. Es ist davon auszugehen, dass weitere Erkrankungen ebenso verspätet diagnostiziert wurden.
Limitationen der Studie
Die Daten zur Diagnosestellung wurden retrospektiv mithilfe eines Fragebogens an die Diabeteszentren erfasst. Sozialstatus, Diabeteserfahrung in der Familie und die Symptome vor der Manifestation wurden als wesentliche Risikofaktoren nicht eingeschlossen.
Fazit für die Praxis
Die Diabetische Ketoacidose (DKA) als lebensbedrohliche Komplikation einer Diabetes Mellitus Typ 1(DM1)-Manifestation bei Kindern und Jugendlichen wird in Deutschland nach wie vor häufig verkannt; dieses Risiko war in Zeiten des „COVID-19-Lockdowns“ deutlich erhöht.
Alter unter 6 Jahren, Migrationshintergrund und eine verspätete Diagnosestellung sind wichtige Risikofaktoren für eine DKA.
Die Symptome der Diabetesmanifestation werden bei einer DKA häufig von unspezifischen Symptomen wie Übelkeit, Erbrechen, Bauchschmerzen und gesteigerter Atmung verdeckt. Bei schwer erkrankten Kleinkindern mit diesen unspezifischen Symptomen sollte die Anamnese um gezielte Fragen zur DM1-Manifestation erweitert werden; eine Untersuchung auf Glucose und Ketone im Urin sollte großzügig erfolgen.
Öffentliche Aufklärung und ärztliche Fortbildung könnten eine Möglichkeit darstellen, um die DKA-Häufigkeit bei DM1-Manifestation zu reduzieren.
Screeninguntersuchungen in Verbindung mit Schulung und Betreuung betroffener Familien könnten dazu beitragen, die DKA-Rate auf Populationsebene zu senken.
In Zeiten einer Pandemie, die mit sozialer Distanzierung und Reduktion des öffentlichen Lebens einhergeht, müssen die Zugänge zur Gesundheitsversorgung für Kinder und Jugendliche – v. a. auch in der öffentlichen Kommunikation als „sichere Krankenhäuser und sichere Kinderarztpraxen“ – gewährleistet werden.
Acknowledgments
Danksagung
Wir danken A. Hungele und R. Ranz für ihre Unterstützung und die Entwicklung und ständige Weiterentwicklung der DPV-Software, E. Bollow für das Datenmanagement und die Auswertung und A. Eckert für die Unterstützung bei der Datenanalyse (alle im DPV-Team der Universität Ulm). Herzlich danken wir allen Diabetesteams, die trotz der schwierigen Zeiten engagiert ihre Daten schnell an uns übermittelt haben: Aachen – Uni-Kinderklinik RWTH, Ahlen St. Franziskus Kinderklinik, Altötting Kinderklinik Zentrum Inn-Salzach, Amberg Kinderklinik St. Marien, Arnsberg-Hüsten Karolinenhospital, Kinderabteilung, Aue Helios Kinderklink, Augsburg Josefinum Kinderklinik, Augsburg Uni-Kinderklinik, Aurich Kinderklinik, Bad Hersfeld Kinderklinik, Bad Kreuznach Diakonie Kinderklinik, Bad Oeynhausen Herz- und Diabeteszentrum NRW, Bad Mergentheim Diabetesklinik, Bautzen Oberlausitz KK, Berlin Charité, Berlin DRK-Kliniken Pädiatrie, Berlin Lichtenberg – Kinderklinik, Bielefeld Kinderarztpraxis, Bielefeld Kinderklinik Gilead, Bocholt Kinderklinik, Bochum Universitätskinderklinik St. Josef, Bonn Uni-Kinderklinik, Braunschweig Kinderarztpraxis, Bremen – Kinderklinik Nord, Bremen Zentralkrankenhaus Kinderklinik, Bremerhaven Kinderklinik, Böblingen Kinderklinik, Celle Kinderklinik, Chemnitz Kinderklinik, Coburg Kinderklinik, Coesfeld Kinderklinik, Darmstadt Kinderklinik Prinz. Margaret, Datteln Vestische Kinderklinik, Deggendorf, Deggendorf Medizinische Klinik II, Dessau Kinderklinik, Detmold Kinderklinik, Dortmund Kinderklinik, Dresden Uni-Kinderklinik, Duisburg Sana Kinderklinik, Duisburg-St. Johannes Helios, Düren-Birkesdorf Kinderklinik, Düsseldorf Uni-Kinderklinik, Erfurt Kinderklinik, Erlangen Uni-Kinderklinik, Essen Elisabeth Kinderklinik, Essen Kinderarztpraxis, Esslingen Klinik für Kinder und Jugendliche, Filderstadt Kinderklinik, Frankfurt Diabeteszentrum Rhein-Main-pädiatrische Diabetologie (Clementine-Hospital), Frankfurt Uni-Kinderklinik, Freiburg Uni-Kinderklinik, Freudenstadt Kinderklinik, Fulda Kinderklinik, Fürth Kinderklinik, Garmisch-Partenkirchen Kinderklinik, Gelnhausen Kinderklinik, Gelsenkirchen Kinderklinik Marienhospital, Gera Kinderklinik, Gießen Uni-Kinderklinik, Greifswald Uni-Kinderklinik, Gummersbach Oberbergklinikum, Görlitz Städtische Kinderklinik, Göttingen Uni-Kinderklinik, Hagen Kinderklinik, Halle Uni-Kinderklinik, Hamburg Altonaer Kinderklinik, Hamburg Kinderklinik Wilhelmstift, Hamburg-Nord Kinder-MVZ, Hameln Kinderklinik, Hamm Kinderklinik, Hanau Kinderklinik, Hannover Kinderklinik MHH, Hannover Kinderklinik auf der Bult, Haren Kinderarztpraxis, Heide Kinderklinik, Heidelberg Uni-Kinderklinik, Heidenheim Kinderklinik, Heilbronn Kinderklinik, Herdecke Kinderklinik, Herford Kinderarztpraxis, Herford Klinikum Kinder & Jugendliche, Hildesheim Bernward Krankenhaus Kinderheilkunde, Hildesheim Kinderklinik, Hildesheim Kinderklinik, Homburg Uni-Kinderklinik Saarland, Itzehoe Kinderklinik, Jena Uni-Kinderklinik, Kaiserslautern Kinderarztpraxis, Kaiserslautern-Westpfalzklinikum Kinderklinik, Karlsburg Klinik für Diabetes & Stoffwechsel, Karlsruhe Städtische Kinderklinik, Kassel Klinikum Kinder- und Jugendmedizin, Kiel Städtische Kinderklinik, Kiel Universitäts-Kinderklinik, Kinderklinik San, Koblenz Kinderklinik Kemperhof, Konstanz Kinderklinik, Krefeld Kinderklinik, Köln Kinderklinik Amsterdamer Straße, Köln Uni-Kinderklinik, Landshut Kinderklink, Leer Klinikum – Klinik Kinder & Jugendmedizin, Leipzig Uni-Kinderklinik, Leverkusen Kinderklinik, Lingen Kinderklinik St. Bonifatius, Lippstadt Evangelische Kinderklinik, Ludwigsburg Kinderklinik, Ludwigshafen Kinderklinik St. Anna-Stift, Lübeck Uni-Kinderklinik, Lüdenscheid Märkische Kliniken – Kinder & Jugendmedizin, Magdeburg Uni-Kinderklinik, Mainz Uni-Kinderklinik, Mannheim Uni-Kinderklinik, Marburg Uni-Kinderklinik, Mechernich Kinderklinik, Meissen Kinderklinik Elblandklinikum, Memmingen Kinderklinik, Minden Kinderklinik, Moers Kinderklinik, München 3. Orden Kinderklinik, München von Haunersche Kinderklinik, München-Gauting Kinderarztzentrum, München-Schwabing Kinderklinik, Münster St. Franziskus Kinderklinik, Münster Uni-Kinderklinik, Neubrandenburg, Neuburg Kinderklinik, Neunkirchen Gemeinschaftspraxis Kinderheilkunde, Neunkirchen Marienhausklinik Kohlhof Kinderklinik, Neuruppin Kinderklinik, Neuss Lukas-Krankenhaus Kinderklinik, Neuwied Kinderklinik Elisabeth, Nürnberg Cnopfsche Kinderklinik, Nürnberg Uniklinik Zentrum f Neugeborene/Kinder & Jugendliche, Oberhausen Kinderklinik, Offenburg Kinderklinik, Oldenburg Kinderklinik, Oldenburg Schwerpunktpraxis Pädiatrie, Osnabrück Christliches Kinderhospital, Paderborn St. Vincenz Kinderklinik, Paderborn St. Vincenz Kinderklinik, Passau Kinderklinik, Pforzheim Kinderklinik, Plauen Vogtlandklinikum, Ravensburg Kinderklink St. Nikolaus, Regensburg Kinderklinik St. Hedwig, Rendsburg Kinderklinik, Reutlingen Kinderklinik, Rheine Mathiasspital Kinderklinik, Rosenheim Kinderklinik, Rostock Uni-Kinderklinik, Rotenburg/Wümme Agaplesion Diakonieklinikum Kinderabteilung, Rüsselsheim Kinderklinik, Rüsselsheim MVZ, Saarbrücken Kinderklinik Winterberg, Schleswig Heliosklinik Kinderklinik, Schweinfurt Kinderklinik, Schwerin Kinderklinik, Schwäbisch Hall Diakonie Kinderklinik, Siegen Kinderklinik, Singen – Hegauklinikum Kinderklinik, Solingen Kinderklinik, Speyer Diakonissen Stiftungskrankenhaus Pädiatrie, St. Augustin Kinderklinik, Stade Kinderklinik, Stolberg Kinderklinik, Stuttgart Olgahospital Kinderklinik, Suhl Kinderklinik, Traunstein Kinderklinik, Trier Kinderklinik der Borromäerinnen, Tübingen Uni-Kinderklinik, Ulm Uni-Kinderklinik, Vechta Kinderklinik, Viersen Kinderkrankenhaus St. Nikolaus, Villingen-Schwenningen Schwarzwald Baar Klinikum Kinderklinik, Waren-Müritz Kinderklinik, Weiden Kinderklinik, Wesel Marienhospital Kinderklinik, Wiesbaden Helios Horst-Schmidt-Kinderkliniken, Wilhelmshaven Klinikum Kinderklinik, Winnenden Rems-Murr Kinderklinik, Witten Kinderarztpraxis, Wittenberg Kinderklinik, Worms Kinderklinik, Wuppertal Kinderklinik.
Förderung
Das DPV-Register wird vom Deutschen Ministerium für Bildung und Forschung im Rahmen des Deutschen Zentrums für Diabetesforschung e. V. (DZD, Förderkennzeichen: 82DZD14A02) gefördert. Weitere Förderung wurde vom Robert Koch-Institut (RKI) und der Deutschen Diabetes Gesellschaft (DDG) gewährt.
Einhaltung ethischer Richtlinien
Interessenkonflikt
K. Raile hat Beraterhonorare von DexCom, Lilly, Abbott Diabetes Care und Novo Nordisk erhalten, aufgrund derer kein Interessenskonflikt mit der publizierten Arbeit besteht. T. Biester hat Vortragshonorare von AstraZeneca, DexCom, Medtronic, Novo Nordisk, Roche, Sanofi, Ypsomed, aufgrund derer kein Interessenkonflikt besteht, erhalten. K. Mönkemöller hat Unterstützung für eine Fortbildung von Medtronic erhalten, aufgrund derer kein Interessenskonflikt mit dem Inhalt dieses Forschungsprojekts besteht. C. Kamrath, J. Hammersen, K. Warncke, A. Pappa, K. Fink, T. R. Rohrer und R. W. Holl geben an, dass kein Interessenkonflikt besteht.
Alle beschriebenen Untersuchungen am Menschen oder an menschlichem Gewebe wurden mit Zustimmung der zuständigen Ethikkommission, im Einklang mit nationalem Recht sowie gemäß der Deklaration von Helsinki von 1975 (in der aktuellen, überarbeiteten Fassung) durchgeführt. Von allen beteiligten Patienten liegt eine Einverständniserklärung vor.
Footnotes
Die Autoren Kirsten Mönkemöller und Clemens Kamrath haben zu gleichen Teilen zum Manuskript beigetragen.
Literatur
- 1.Arbeitsgemeinschaft pädiatrische Diabetologie (2020) Kampagne zur Früherkennung des Diabetes und zur Vermeidung einer diabetischen Ketoazidose bei Kleinkindern. https://diabetes-kinder.de/news/Diabetische-Ketoazidose-bei-Kleinkindern.html. Zugegriffen: 20. Nov. 2020
- 2.Aye T, Mazaika PK, Mauras N, Marzelli MJ, Shen H, Hershey T, Cato A, Weinzimer SA, White NH, Tsalikian E, Jo B, Reiss AL. Impact of early diabetic ketoacidosis on the developing brain. Diabetes Care. 2019;42(3):443–449. doi: 10.2337/dc18-1405. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Brandt A (2020) Psychische Gesundheit von Kindern hat sich während der Corona-Pandemie verschlechtert. https://www.uke.de/allgemein/presse/pressemitteilungen/detailseite_96962.html. Zugegriffen: 8. Sept. 2020. (Pressemitteilung UKE Hamburg)
- 4.Bowden SA, Duck MM, Hoffman RP. Young children ( < 5 yr) and adolescents (> 12 yr) with type 1 diabetes mellitus have low rate of partial remission: diabetic ketoacidosis is an important risk factor. Pediatr Diabetes. 2008;9(3 Pt 1):197–201. doi: 10.1111/j.1399-5448.2008.00376. [DOI] [PubMed] [Google Scholar]
- 5.Bui H, To T, Stein R, Fung K, Daneman D. Is diabetic ketoacidosis at disease onset a result of missed diagnosis? J Pediatr. 2010;156(3):472–477. doi: 10.1016/j.jpeds.2009.10.001. [DOI] [PubMed] [Google Scholar]
- 6.Cameron FJ, Scratch SE, Nadebaum C, Northam EA, Koves I, Jennings J, Finney K, Neil JJ, Wellard RM, Mackay M, Inder TE. Neurological consequences of diabetic ketoacidosis at initial presentation of type 1 diabetes in a prospective cohort study of children. Diabetes Care. 2014;37(6):1554–1562. doi: 10.2337/dc13-1904. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cherubini V, Grimsmann JM, Åkesson K, Birkebæk NH, Cinek O, Dovč K, Gesuita R, Gregory JW, Hanas R, Hofer SE, Holl RW, Jefferies C, Joner G, King BR, Mayer-Davis EJ, Peña AS, Rami-Merhar B, Schierloh U, Skrivarhaug T, Sumnik Z, Svensson J, Warner JT, Bratina N, Dabelea D. Temporal trends in diabetic ketoacidosis at diagnosis of paediatric type 1 diabetes between 2006 and 2016: results from 13 countries in three continents. Diabetologia. 2020;63(8):1530–1541. doi: 10.1007/s00125-020-05152-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Dayal D, Gupta S, Raithatha D, Muralidharan J. Missing during COVID-19 lockdown: children with onset of type 1 diabetes. Acta Paediatr. 2020 doi: 10.1111/apa.15443. [DOI] [PubMed] [Google Scholar]
- 9.Deylami R, Townson J, Mann M, Gregory JW. Systematic review of publicity interventions to increase awareness amongst healthcare professionals and the public to promote earlier diagnosis of type 1 diabetes in children and young people. Pediatr Diabetes. 2018;19(3):566–573. doi: 10.1111/pedi.12565. [DOI] [PubMed] [Google Scholar]
- 10.Duca LM, Reboussin BA, Pihoker C, Imperatore G, Saydah S, Mayer-Davis E, Rewers A, Dabelea D. Diabetic ketoacidosis at diagnosis of type 1 diabetes and glycemic control over time: the SEARCH for diabetes in youth study. Pediatr Diabetes. 2019;20(2):172–179. doi: 10.1111/pedi.12809. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Elding Larsson H, Vehik K, Bell R, Dabelea D, Dolan L, Pihoker C, Knip M, Veijola R, Lindblad B, Samuelsson U, Holl R, Haller MJ. Reduced prevalence of diabetic ketoacidosis at diagnosis of type 1 diabetes in young children participating in longitudinal follow-up. Diabetes Care. 2011;34(11):2347–2352. doi: 10.2337/dc11-1026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Holder M, Ehehalt S. Significant reduction of ketoacidosis at diabetes onset in children and adolescents with type 1 diabetes – The Stuttgart Diabetes Awareness Campaign, Germany. Pediatr Diabetes. 2020 doi: 10.1111/pedi.13064. [DOI] [PubMed] [Google Scholar]
- 13.International Society of Pediatric and Adolescent Diabetes Summary of recommendations regarding COVID-19 in children with diabetes: keep calm and mind your diabetes care and public health advice. Pediatr Diabetes. 2020;21(3):413–414. doi: 10.1111/pedi.13013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Kamrath C, Mönkemöller K, Biester T, Rohrer TR, Warncke K, Hammersen J, Holl RW. Ketoacidosis in children and adolescents with newly diagnosed type 1 diabetes during the COVID-19 pandemic in Germany. JAMA. 2020;324(8):801–804. doi: 10.1001/jama.2020.13445. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Karges B, Neu A, Hofer SE, Rosenbauer J, Kiess W, Rütschle H, Dost A, Kentrup H, Holl RW. Häufigkeit und Einflussfaktoren der Ketoazidose bei Diabetesmanifestation im Kindes- und Jugendalter – eine Langzeitstudie von 1995 bis 2009. Klin Padiatr. 2011;223(2):70–73. doi: 10.1055/s-0030-1269884. [DOI] [PubMed] [Google Scholar]
- 16.Lazzerini M, Barbi E, Apicella A, Marchetti F, Cardinale F, Trobia G. Delayed access or provision of care in Italy resulting from fear of COVID-19. Lancet Child Adolesc Health. 2020;4(5):e10–e11. doi: 10.1016/S2352-4642(20)30108-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Lynn RM, Avis JL, Lenton S, Amin-Chowdhury Z, Ladhani SN. Delayed access to care and late presentations in children during the COVID-19 pandemic: a snapshot survey of 4075 paediatricians in the UK and Ireland. Arch Dis Child. 2020 doi: 10.1136/archdischild-2020-319848. [DOI] [PubMed] [Google Scholar]
- 18.Mönkemöller K, Müller-Godeffroy E, Lilienthal E, Heidtmann B, Becker M, Feldhahn L, Freff M, Hilgard D, Krone B, Papsch M, Schumacher A, Schwab KO, Schweiger H, Wolf J, Bollow E, Holl RW. The association between socio-economic status and diabetes care and outcome in children with diabetes type 1 in Germany: the DIAS study (diabetes and social disparities) Pediatr Diabetes. 2019;20(5):637–644. doi: 10.1111/pedi.12847. [DOI] [PubMed] [Google Scholar]
- 19.Mortensen HB, Swift PG, Holl RW, Hougaard P, Hansen L, Bjoerndalen H, de Beaufort CE, Knip M, Hvidoere Study Group on Childhood Diabetes Multinational study in children and adolescents with newly diagnosed type 1 diabetes: association of age, ketoacidosis, HLA status, and autoantibodies on residual beta-cell function and glycemic control 12 months after diagnosis. Pediatr Diabetes. 2010;11(4):218–226. doi: 10.1111/j.1399-5448.2009.00566.x. [DOI] [PubMed] [Google Scholar]
- 20.Muñoz C, Floreen A, Garey C, Karlya T, Jelley D, Alonso GT, McAuliffe-Fogarty A. Misdiagnosis and diabetic ketoacidosis at diagnosis of type 1 diabetes: patient and caregiver perspectives. Clin Diabetes. 2019;37(3):276–281. doi: 10.2337/cd18-0088. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Rabbone I, Maltoni G, Tinti D, Zucchini S, Cherubini V, Bonfanti R, Scaramuzza A. Diabetic ketoacidosis at the onset of disease during a national awareness campaign: a 2-year observational study in children aged 0–18 years. Arch Dis Child. 2020;105(4):363–366. doi: 10.1136/archdischild-2019-316903. [DOI] [PubMed] [Google Scholar]
- 22.Rabbone I, Schiaffini R, Cherubini V, Maffeis C, Scaramuzza A, Diabetes Study Group of the Italian Society for Pediatric Endocrinology and Diabetes Has COVID-19 delayed the diagnosis and worsened the presentation of type 1 diabetes in children? Diabetes Care. 2020;10:dc201321. doi: 10.2337/dc20-1321. [DOI] [PubMed] [Google Scholar]
- 23.Robert Koch-Institut (2020) Täglicher Lagebericht des RKI zur Coronavirus-Krankheit-2019 (COVID-19). https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/2020-08-20-de.pdf?__blob=publicationFile. Zugegriffen: 11. Sept. 2020
- 24.Stock L, Brown M, Bradley G. First do no harm with COVID-19: corona collateral damage syndrome. West J Emerg Med. 2020;21(4):746–747. doi: 10.5811/westjem.2020.5.48013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Sundaram PCB, Day E, Kirk JMW. Delayed diagnosis in type 1 diabetes mellitus. Arch Dis Child. 2009;94:151–152. doi: 10.1136/adc.2007.133405. [DOI] [PubMed] [Google Scholar]
- 26.Tittel SR, Rosenbauer J, Kamrath C, Ziegler J, Reschke F, Hammersen J, Mönkemöller K, Pappa A, Kapellen T, Holl RW. Did the COVID-19 lockdown affect the incidence of pediatric type 1 diabetes in Germany? Diabetes Care. 2020;43(11):e172–e173. doi: 10.2337/dc20-1633. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Usher-Smith JA, Thompson MJ, Sharp SJ, Walter FM. Factors associated with the presence of diabetic ketoacidosis at diagnosis of diabetes in children and young adults: a systematic review. BMJ. 2011;343:d4092. doi: 10.1136/bmj.d4092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Winkler C, Haupt F, Heigermoser M, et al. Identification of infants with increased type 1 diabetes genetic risk for enrollment into Primary Prevention Trials-GPPAD-02 study design and first results. Pediatr Diabetes. 2019;20(6):720–727. doi: 10.1111/pedi.12870. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Ziegler AG, Kick K, Bonifacio E, Haupt F, Hippich M, Dunstheimer D, Lang M, Laub O, Warncke K, Lange K, Assfalg R, Jolink M, Winkler C, Achenbach P. Yield of a public health screening of children for islet autoantibodies in Bavaria, Germany. JAMA. 2020;323(4):339–351. doi: 10.1001/jama.2019.21565. [DOI] [PMC free article] [PubMed] [Google Scholar]