Abstract
Bislang sind nur wenige Medikamente zur pharmakologischen Rückfallprophylaxe der Alkoholabhängigkeit zugelassen. Neben dem in Deutschland nicht mehr vertriebenen Disulfiram sind es die Opioidantagonisten Naltrexon und Nalmefen sowie das vermutlich über glutamaterge Neurone wirkende Acamprosat. Baclofen und γ‑Hydroxybutyrat (GHB) sind in einzelnen Ländern zugelassen. Wirkstoffe wie z. B. Vareniclin, Gabapentin und Topiramat können für die Rückfallprophylaxe der Alkoholabhängigkeit von Interesse sein, jedoch ist bislang keine Zulassung erfolgt. Vor dem Hintergrund der zur Revision anstehenden S3-Leitlinie zur Diagnose und Behandlung alkoholbezogener Störungen wird der heutige Kenntnisstand zur Pharmakotherapie der Alkoholabhängigkeit dargestellt.
Schlüsselwörter: Alkoholgebrauchsstörungen, Anti-Craving-Medikamente, Rückfall, Acamprosat, Naltrexon
Abstract
So far few medications are approved for prophylactic treatment of alcohol dependence relapse. Apart from disulfiram, which is no longer marketed in Germany, the opioid antagonists naltrexone, nalmefene and the putative glutamate antagonist acamprosate are approved. In some other countries, baclofen and gamma-hydroxybutyrate (GHB) are licensed. Possible other drugs of interest for prophylaxis of alcohol dependence relapse are vareniclin, gabapentin, and topiramate, but so far none of them have received approval. In the light of the currently running revision of the German guidelines for the diagnosis and treatment of alcohol related disorders, an update on the pharmacotherapy of alcohol dependence is presented.
Keywords: Alcohol use disorders, Anti-Craving-Drugs, Relapse, Acamprosate, Naltrexone
Einleitung
Während in der ICD-10 [22] schädlicher Gebrauch und Abhängigkeit von Alkohol unterschieden werden, folgte das DSM‑5 ([8], Übersicht in [53]) einem dimensionalen Ansatz und definiert Alkoholkonsumstörungen anhand von 11 Kriterien, von denen mindestens 2 bis 3 für eine leichte Störung definiert sein müssen. Die 2022 in Kraft tretende ICD-11 wird an der Unterscheidung schädlicher Gebrauch und Abhängigkeit festhalten. Alkoholgebrauchsstörungen sind häufig. In vielen epidemiologischen Untersuchungen werden Prävalenzraten von 6 bis 7 % mitgeteilt [34, 53]. Etwa 2 bis 3 % der Erwachsenenbevölkerung sind alkoholabhängig. Zu den zahlreichen körperlichen und neurologischen Folgeschäden gehören Lebererkrankungen, eine erhöhte Krebsrate, ein signifikantes Unfall- und Suizidrisiko, aber auch das Risiko für Gewalttaten, zahlreiche psychiatrische Folgestörungen sowie soziale Probleme [81]. Die Prognose ist bei hoher Mortalität/Morbidität in vielen Fällen immer noch ungünstig [24, 61]. Die verfügbaren Ansätze zur Therapie von Alkoholkonsumstörungen umfassen ein breites und umfangreiches Spektrum [59, 63, 64, 71]. Trotz erwiesener Effizienz etablierter Therapien sind Konsum- und Rückfallereignisse häufig.
Die 2016 publizierte S3-Leitlinie zu Screening, Diagnose und Behandlung alkoholbezogener Störungen [59] befindet sich derzeit in Revision. Als übergeordnete Therapieziele wurden in der S3-Leitlinie aus 2016 neben abstinenzorientierten Therapien auch Harm-reduction-Strategien (Verminderung der Trinkmenge) als mögliche Behandlungsziele definiert.
Als wirksame psychosoziale und psychotherapeutische Behandlungsansätze in der Entwöhnungsbehandlung der Alkoholabhängigkeit sind Interventionskomponenten wie z. B. motivationale Interventionsformen, Verhaltenstherapie und kognitive Verhaltenstherapie wie Kontingenzmanagement, Angehörigenarbeit und Paartherapie mit hohem Empfehlungsgrad genannt. Mitunter wird bei insgesamt moderaten Effekten eine leichte Überlegenheit der kognitiven Verhaltenstherapien gegenüber anderen spezifischen Therapien vermutet, die jedoch in einer aktuellen Metaanalyse [58] nicht bestätigt wurde. Darüber hinaus finden in der S3-Leitlinie die psychotherapeutische Kurzzeittherapie, kognitives Training sowie andere Psychotherapieformen Erwähnung.
Als Medikamente sind Acamprosat, Naltrexon und Disulfiram empfohlen. Für Acamprosat und Naltrexon war bei einer sehr guten Evidenzbasierung (Level 1a) allerdings nur der Empfehlungsgrad B („sollte gegeben werden“) ausgesprochen worden. Disulfiram erhielt bei Evidenzbasierung 1b den Empfehlungsgrad 0. Die Datenlage zur Empfehlung von Nalmefen war bei Erstellung der Leitlinien noch nicht ausreichend. Tab. 1 gibt einen Überblick über die zur Pharmakotherapie der Alkoholabhängigkeit eingesetzten Substanzen.
| Medikamente | Dosis | Wirkmechanismus | Andere Indikationen |
|---|---|---|---|
| Acamprosat | 1998 mg/Tag | Unklar, NMDA-Rezeptor-Agonist, Modulator hyperaktiver glutamaterger Neurone? Rolle von Kalzium? | – |
| Disulfiram | 250–500 mg/Tag | Inhibition der Acetaldehyddehydrogenase | – |
| Naltrexon | 50 mg/Tag | µ‑Opioid-Rezeptor-Antagonist | Opioidabhängigkeit |
| Nalmefen | 18 mg/Tag | µ- und δ‑Opioid-Rezeptor-Antagonist, partieller Agonist am κ‑Opioid-Rezeptor | – |
| Baclofen | 3–80 mg/Tag (bis 270 mg) | GABAB-Rezeptor-Agonist (metabotrop) | Spastik |
| Gabapentin | 900–1800 mg/Tag | Unklar, blockiert spannungsabhängige Kanäle. Keine Wirkung über GABA-Rezeptoren | Epilepsie, neuropathischer Schmerz |
| Ondansetron | 0,5 mg/Tag | 5‑HT3-Antagonist | Antiemetikum bei Krebs (Chemotherapie) |
| Prazosin/Doxazosin | Bis zu 16 mg/Tag | α1-Rezeptor-Agonist | – |
| Topiramat | Bis 300 mg/Tag | Nicht völlig klar, antikonvulsives Medikament, erhöht die GABAA-vermittelte neuronale Aktivität und antagonisiert AMPA- und Kainat-Glutamat-Rezeptoren, außerdem spannungsabhängige Kanäle, schwacher Inhibitor verschiedener anderer Enzyme | Epilepsie, Migräne, Lennox-Gastaut-Syndrom |
| Vareniclin | 2 mg/Tag | Partieller Agonist am nikotinischen α4β2-Acetylcholinrezeptorsubtyp | Rauchen |
| γ‑Hydroxy-Buttersäure, GHB | – | Präkursor von GABA (schwacher Agonist am GABAB-Rezeptor) Glutamat, Glycin | Narkolepsie |
Die neurobiologischen und neurochemischen Grundlagen der Alkoholabhängigkeit sind komplex, werden aber mittlerweile gut verstanden (Übersicht in [95]). Zentrale Strukturen bei der Wirkung von Rauschdrogen sind dopaminerge Neurone im mesolimbischen Bereich (ventrales Tegmentum, Nucleus accumbens) und ihre Projektion in den präfrontalen Kortex, der für Kontrollfunktionen und die Inhibition dysfunktionalen Verhaltens verantwortlich ist. Für Belohnung und Belohnungsantizipation spielt die Ausschüttung von Dopamin im mesolimbischen Bereich eine entscheidende Rolle. Ein abhängiger Konsum von Alkohol entwickelt sich aus einem Zusammenspiel von positiven (z. B. alkoholinduzierte Entspannung, Euphorie) und negativen Konsequenzen (z. B. Entzugssyndrome). Kurz zusammengefasst werden neurochemisch für die positiv verstärkenden Wirkungen vor allem Effekte auf Dopamin, das endogene Opioidsystem, das serotonerge und GABAerge sowie das endogene Cannabinoidsystem verantwortlich gemacht, für die negative Verstärkung vor allem die vermehrte Freisetzung von Kortikotropin-Releasing-Faktor, die GABAerge Down-Regulierung sowie Veränderungen im glutamatergen System (Übersicht in [105]). Aber auch appetitregulierende Hormone wie Ghrelin scheinen von Bedeutung zu sein [27]. Chronischer Alkoholkonsum führt zu erheblichen adaptiven Veränderungen und Anpassungen, vor allem der Rezeptorfunktionen im Gehirn, wobei es beim Alkoholentzug zu einer vermehrten Freisetzung exzitatorischer Neurotransmitter bei erhöhter Rezeptorempfindlichkeit und einer Übererregbarkeit des Gehirns kommt.
Bislang sind nur wenige Medikamente zur Alkoholentwöhnung zugelassen, obwohl mittlerweile eine ganze Reihe von Substanzen untersucht wurde (Übersicht in [23, 33, 53, 57]). Es gibt etablierte methodische Standards für die Durchführung von Pharmakotherapiestudien bei Alkoholabhängigkeit, wobei primäre Outcome- oder Responderkriterien entweder eine Verbesserung der Abstinenzrate, eine Erhöhung der Zeit bis zum ersten Konsum, eine Verminderung der Rückfallraten oder eine Trinkmengenreduktion sind (siehe [48, 88]). In verschiedenen Therapiestudien werden dabei sehr unterschiedliche Outcomekriterien verwendet [6, 25, 40, 76]. Sekundäre Outcomekriterien sind biologische Marker (Transaminasen, Carbohydrate-defizientes Transferrin [CDT], Ethylglukuronid), sozioökonomische Faktoren („health care utilization“) oder Wiederaufnahmen in Kliniken (Übersicht in [99]). Zuletzt wurde von einer Expertengruppe die WHO-Klassifikation unterschiedlicher Risikoniveaus („drinking risk levels“) als Outcomekriterium für Pharmakotherapiestudien empfohlen [26].
Voraussetzung für einen positiven Wirksamkeitsnachweis in klinischen Studien ist unter anderem, dass die pharmakologischen Interventionen auch ausreichend implementiert werden. Hohe Missing- und Drop-out-Raten, wie sie für den Bereich der Alkoholentwöhnung typisch sind, verhindern eine ausreichende Treatment-Implementierung und damit auch die Chancen, in Studien einen tatsächlich vorhandenen Effekt nachweisen zu können [88]. Wichtig ist zudem, dass die Auswahl der Outcomekriterien dem Wirkmechanismus der Substanz angepasst ist.
Substanzen
Disulfiram
Viele Jahrzehnte war Disulfiram das einzige zur Behandlung der Alkoholabhängigkeit zugelassene Medikament, welches wegen geringer Verschreibungszahlen in Deutschland nicht mehr vertrieben wird. Disulfiram beeinflusst nicht die biochemischen Effekte von Alkohol, sondern inhibiert das Enzym Aldehyddehydrogenase, welches das ansonsten schnell verstoffwechselte erste Abbauprodukt von Alkohol, Acetaldehyd, metabolisiert. Toxische erhöhte Acetaldehydspiegel führen zur sogenannten Disulfiram-Alkohol-Reaktion, einer künstlich herbeigeführten Vergiftung mit Übelkeit, Erbrechen, Kreislaufproblemen, Schweißausbrüchen, Hypertension, in schweren Fällen auch kardiovaskulären Reaktionen oder Kollaps (Übersicht in [70, 87]). Die therapeutische Wirkung von Disulfiram basiert primär auf dessen Unverträglichkeit mit Alkohol; dadurch nimmt die Substanz als Aversivtherapeutikum eine Sonderstellung unter den pharmakologischen Therapien der Alkoholabhängigkeit ein. Die klinische Wirkung von Disulfiram basiert auf der Antizipation dieser unerwünschten Effekte. Entscheidend für die therapeutische Wirkung scheint primär die gedankliche Vorwegnahme der Unverträglichkeit mit Alkohol zu sein, nicht die pharmakologische Wirkung der Substanz bzw. das tatsächliche Auftreten einer Alkohol-Disulfiram-Reaktion selbst.
Die größte zur Frage der Wirksamkeit von Disulfiram durchgeführte Untersuchung [30] konnte keinen Wirknachweis erbringen. Die Behandlungsergebnisse bei Supervision der Einnahme von Disulfiram scheinen der nichtsupervidierten Einnahme überlegen zu sein. Eine gute Compliance konnte im Rahmen des Projekts ALITA (Ambulante Langzeit-Intensivtherapie für Alkoholkranke) bei überwachter Einnahme nachgewiesen werden [49].
Wie eine Metaanalyse [92] mit Subgruppenanalyse unter Berücksichtigung des Studiendesigns deutlich macht, zeigt Disulfiram in offenen, nicht aber in randomisierten Doppelblindstudien positive Effekte. Dies ist auf den erwartungsvermittelten Wirkmechanismus der Substanz zurückzuführen: Indem die abstinenzunterstützenden Effekte von Disulfiram im Gegensatz zu anderen pharmakologischen Methoden der Rückfallprophylaxe nicht pharmakologisch, sondern ausschließlich durch Erwartung vermittelt sind, treten die erwartungsinduzierten Therapieeffekte in Studien mit verblindetem Design sowohl in der Interventions- als auch in der Kontrollgruppe auf. Dadurch ist ein Effektnachweis in randomisierten Doppelblindstudien für Disulfiram aus theoretischer Sicht gar nicht möglich [70, 87]. So zeigte sich in einer randomisierten Cross-over-Studie, in der die Erwartung, Disulfiram eingenommen zu haben, experimentell manipuliert wurde, auch bei placebobehandelten Probanden eine Abnahme der Reizreaktivität („cue reactivity“) auf alkoholassoziierte Reize [91]. Entgegen den methodischen Standards, wie wir sie aus der Wirksamkeitsprüfung anderer Substanzen kennen, sind die Aussagen über die Wirkeffekte zu Disulfiram aus Studien mit offenem Design zuverlässiger [87].
Trotz einer wieder zunehmenden Verordnung von Disulfiram hat die Herstellerfirma Nycomed im Jahr 2011 auf die Erneuerung der Zulassung verzichtet und die Produktion von Disulfiram eingestellt. Der Wirkstoff besitzt in Deutschland derzeit keine Zulassung, kann jedoch auf Basis patientenbezogener Anforderungen über internationale Apotheken bezogen werden. Der spezifische Wirkmechanismus von Disulfiram und die enge Verzahnung von therapeutischem Nutzen und gesundheitlicher Gefährdung erfordert eine besondere Sorgfaltspflicht bei der Information und Aufklärung des Patienten. So ist in jedem Fall sicherzustellen, dass sich der Patient der Notwendigkeit einer absoluten Abstinenz bewusst ist und eine hohe Abstinenzzuversicht unter Disulfiramtherapie signalisiert. Darüber hinaus sollte die Therapie mit Disulfiram der persönlichen Therapiepräferenz des Patienten entsprechen. Dessen Beteiligung an der Therapieplanung im Sinne einer partizipativen Entscheidungsfindung erweist sich vor dem Hintergrund des Wirkmechanismus von Disulfiram nicht nur im Hinblick auf die Compliance relevant, sondern determiniert darüber hinaus auch das individuelle Risiko einer Therapie mit Disulfiram.
Acamprosat
Die Substanz ist jetzt seit über 20 Jahren klinisch verfügbar, ihr Wirkmechanismus aber immer noch nicht vollständig geklärt. Acamprosat interagiert nicht mit Alkohol oder anderen Psychopharmaka und hat auch keine psychotropen Effekte, die Substanz wird schlecht resorbiert, sodass bei einem Körpergewicht von über 60 kg die Einnahme von 6 × 330 mg (1998 mg) notwendig ist, was mitunter auch zu Compliance-Problemen beitragen kann. Für Acamprosat wird eine Wirkung über glutamaterge Neurone vermutet, auch wurde die Vermutung geäußert, wonach die Wirkung ausschließlich auf das Kalziumatom des Acamprosatmoleküls zurückführen ist [96].
Acamprosat wurde intensiv untersucht. Es gibt mehrere Metaanalysen ([23, 43, 57, 85]; vgl. Tab. 2). In den beiden größeren Metaanalysen wurden 27 Studien mit über 7000 Patienten eingeschlossen [43, 57]. Das Cochrane-Review zu Acamprosat [85] zeigt unter anderem eine signifikante Reduktion des Konsumrisikos auf 81 % des entsprechenden Risikos in der Kontrollgruppe (relatives Risiko [RR] = 0,86; 95 %-KI 0,81–0,91). Bei insgesamt heterogenen Behandlungsergebnissen wurde im Vergleich zu Placebo eine Reduktion der Trinktage gezeigt. Acamprosat ist in Europa von der European Medicines Agency und in den USA von der FDA zugelassen worden. Acamprosat wird üblicherweise gut toleriert, die häufigste milde Nebenwirkung von Acamprosat ist Durchfall (weicher Stuhl), der nach einigen Tagen häufig abklingt.
| Autor | Jahr | RCT (gesamt) | N (gesamt) | Konsum – Gesamteffekt | Konsum – KI | Rückfall – Gesamteffekt | Rückfall – KI |
|---|---|---|---|---|---|---|---|
| Rösner et al. [85] | 2010 | 24 | 6915 | 0,86 (RR) | 0,81 bis 0,91 | 0,99 (RR) | 0,94 bis 1,04 |
| Maisel et al. [57] | 2013 | 16 | 4349 | 0,36 (Hedges g) | 0,25 bis 0,47 | 0,07 (Hedges g) | −0,08 bis −0,22 |
| Jonas et al. [43] | 2014 | 16 | 4847 | −0,09 (RD) | −0,14 bis −0,04 | −0,01 (RD) | −0,04 bis −0,03 |
| Donoghue et al. [23] | 2015 | 22 | 5236 | 0,83 (RR) | 0,78 bis 0,89 | – | – |
RCT „Randomized controlled trial“, N Stichprobenumfang, KI Konfidenzintervall, RR relatives Risiko, RD Risikodifferenz
Es gibt zahlreiche placebokontrollierte Doppelblindstudien mit Acamprosat, wenige Vergleichsstudien zu Naltrexon, wobei die größte Untersuchung, die in den USA durchgeführte COMBINE-Studie [9], keinen Wirknachweis von Acamprosat erbrachte. Auch die deutsche Studie [46] zeigte bessere Behandlungsergebnisse für den Opiatantagonisten Naltrexon als für Acamprosat bei gleichzeitigem Vorteil einer kombinierten Behandlung unter Nutzung beider Substanzen.
Opiatantagonisten (Naltrexon, Nalmefen)
Naltrexon ist ein nichtselektiver Opioidantagonist am µ‑, κ‑ und δ‑Opioidrezeptor. Zahlreiche pharmakologische Untersuchungen haben gezeigt, dass Naltrexon die subjektiven Effekte von Alkohol vermindern kann, z. B. Alkoholverlangen (Craving), alkoholinduzierte Stimulation, Sedation und auch negative Stimmungen nach Alkoholkonsum [80]. Naltrexon blockiert die positiv verstärkenden „hedonischen“ Effekte von Alkohol, darüber sind über die Beeinflussung des mesolimbischen Dopaminsystems auch motivationale Effekte anzunehmen. Die Interaktionen zwischen Opioidrezeptorblockade und Dopaminausschüttung sind komplex und dynamisch, gesichert ist aber, dass durch die Blockade des Opioidendorphinsystems indirekt auch die Ausschüttung von Dopamin im Nucleus accumbens reguliert wird (Übersicht in [37]).
In Untersuchungen wurde üblicherweise eine Dosis von 50 mg (1 Tbl. oral) untersucht. Die ersten Untersuchungen wurden von O’Malley et al. [73] und Volpicelli et al. [104] durchgeführt, zahlreiche andere placebokontrollierte Doppelblindstudien haben sich angeschlossen. Metaanalysen haben gezeigt, dass Naltrexon vor allem die Trinkmenge bzw. die Rückfallrate zu schwerem Trinken vermindert ([23, 43, 57, 86]; vgl. Tab. 3) und weniger Einfluss auf die Abstinenzrate hat. Das Cochrane-Review zu Naltrexon [86] zeigt eine signifikante Reduktion des Risikos für einen Rückfall (= Konsum von 5 „standard drink units“ oder mehr) auf 83 % des Risikos in der Kontrollgruppe (RR = 0,83; 95 %-KI 0,76–0,90). Eine Depotform von Naltrexon ist in den USA, nicht aber in Deutschland zur Behandlung der Alkoholabhängigkeit zugelassen [32].
| Autor | Jahr | RCT (gesamt) | N (gesamt) | Konsum – Gesamteffekt | Konsum – KI | Rückfall – Gesamteffekt | Rückfall – KI |
|---|---|---|---|---|---|---|---|
| Rösner et al. | 2010 | 50 | 7793 | 0,96 (RR) | 0,92 bis 1,00 | 0,83 (RR) | 0,76 bis 0,90 |
| Maisel et al. [57] | 2013 | 45 | 5434 | 0,12 (Hedges g) | 0,05 bis 0,18 | 0,19 (Hedges g) | 0,12 bis 0,25 |
| Jonas et al. [43] | 2014 | 19 | 2875 | −0,05 (RD) | −0,10 bis −0,002 | −0,09 (RD) | −0,13 bis −0,04 |
| Donoghue et al. [23] | 2015 | 27 | 4199 | 0,92 (RR) | 0,86 bis 1,00 | 0,85 (RR) | 0,78 bis 0,93 |
RCT „Randomized controlled trial“, N Stichprobenumfang, KI Konfidenzintervall, RR relatives Risiko, RD Risikodifferenz
Basierend auf dem Datensatz der Cochrane-Analyse [86] wurde vor kurzem eine Metaanalyse über 38 Studien mit 11.194 Teilnehmern publiziert [13], die eine Reihe von Nebenwirkungen identifizierte, die bei Naltrexon häufiger sind als bei Placebo (verminderter Appetit, Schläfrigkeit, Übelkeit, Benommenheit, Schwitzen und Erbrechen). Bei Opiatabhängigkeit führt die Gabe von Naltrexon zur Auslösung eines Opioidentzugssyndroms.
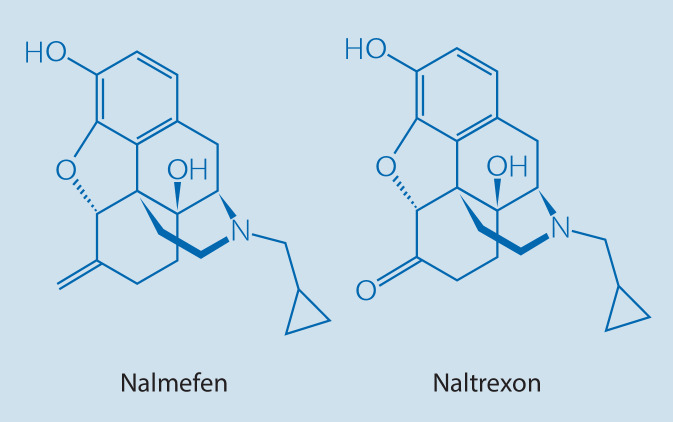
Nalmefen hat bis auf ein Atom eine ähnliche Struktur wie Naltrexon, aber ein etwas anderes Rezeptorprofil (Abb. 1). Nalmefen ist wie Naltrexon ein Antagonist am µ‑Opioidrezeptor und Modulator am δ‑Opioidrezeptorsubtyp. Die Wirkung von Nalmefen wird darüber hinaus über den κ‑Rezeptor vermittelt, wo sich partiell agonistische und antagonistische Wirkungen zeigen [94].
Basierend auf einer Reihe von kleineren Studien wurde Nalmefen in den vergangenen Jahren ausschließlich zur Trinkmengenreduktion eingesetzt. In den letzten Jahren wurde die Wirksamkeit von Nalmefen zur Trinkmengenreduktion in drei größeren placebokontrollierten Untersuchungen zur Trinkmengenreduktion unter Verwendung eines „As-needed“-Ansatzes geprüft [35, 60, 100, 101]. Dabei wird Nalmefen bei Bedarf, also zum Beispiel in Situationen eines erhöhten Cravings oder anderer Risikofaktoren, eingesetzt. Die Untersuchungen zeigen insgesamt eine mäßige Reduktion der Trinkmenge. Allerdings ist zu berücksichtigen, dass in die Studien nur Patienten mit leichterem und moderatem Schweregrad einer Alkoholabhängigkeit eingeschlossen wurden.
2013 wurde die Substanz von der European Medicines Agency zugelassen, in den USA ist Nalmefen nicht verfügbar. Auch wenn Harm-reduction-Strategien bei Alkoholabhängigkeit prinzipiell als sinnvoll zu bewerten sind [28, 72, 98], müssen die Ergebnisse auch vor dem Hintergrund methodischer Aspekte interpretiert werden. So ergeben sich in einer Metaanalyse mit 5 randomisierten, kontrollierten Studien zu Nalmefen [75] Hinweise auf selektive Drop-out-Raten sowie eine mangelnde Repräsentativität der Stichprobe. So liegt die durchschnittliche Trinkmenge der Probanden unter den üblichen Durchschnittswerten alkoholabhängiger Samples.
Positive Ergebnisse wurden aber vor Kurzem von einer weiteren Arbeitsgruppe publiziert [66], die Nalmefen 10 und 20 mg gegen Placebo in einer großen Studie über 24 Wochen bei alkoholabhängigen Patienten untersuchte und dabei erneut eine Reduktion des „heavy drinking“ im Vergleich zu Placebo fand. Auch offene Studien mit Nalmefen haben einen positiven Effekt gezeigt [16]. Der „As-needed“-Ansatz, vor allem bei weniger schwer betroffenen Patienten mit Alkoholkonsumstörungen, ist ein interessanter, den es weiter zu untersuchen gilt.
Eine Reihe von anderen Substanzen habt ein Potenzial im Hinblick auf die pharmakologische Rückfallprophylaxe bei Alkoholabhängigkeit, wobei die wichtigsten Medikamente aus anderen Indikationsbereichen stammen und die neurochemischen Effekte extrem unterschiedlich sind – was unterstreicht, dass die neurobiologische Alkoholforschung bislang keine „magic bullets“ entwickelt hat (Tab. 1).
Baclofen
Baclofen ist ein selektiver GABAB-Rezeptor-Agonist, der als Arzneistoff aus der Gruppe der Muskelrelaxanzien zur Behandlung von Spastizität und bei multipler Sklerose eingesetzt wird. Das Interesse ist nach einem Eigenbericht eines mittlerweile verstorbenen französischen Arztes, der seine „Heilung“ vom Alkoholismus auf eine Hochdosistherapie mit Baclofen bis 250 mg/Tag zurückführte [7], gestiegen. Baclofen wird rasch resorbiert.
Eine Reihe von randomisierten Therapiestudien mit verschiedenen Dosierungen und auch unterschiedlichen Ergebnissen wurde durchgeführt [1–3, 31, 67]. Die Ergebnisse der US-amerikanischen Studie [31], der australischen [67], der holländischen [11] und der israelischen Studien [78] konnten keine Überlegenheit gegenüber Placebo nachweisen. In der BacALD-Studie war Baclofen ein wirksames Medikament, höhere Dosen waren mit schwereren Nebenwirkungen assoziiert [68]. Eine deutsche Untersuchung [69] mit Baclofen bis 270 mg/Tag zeigte deutlich positive Effekte auf die Abstinenzraten.
Baclofen ist in Frankreich zugelassen, auch wenn das Sicherheitsprofil der Substanz kritisch diskutiert wird [84, 90]. Nebenwirkungen sind Müdigkeit, Schlafstörungen, Übelkeit und Benommenheit. Vor allem die Hochdosisgabe erscheint problematisch [17] und ist für eine höhere Rate von Hospitalisierungen und Todesfällen verantwortlich. Aufgrund alkoholähnlicher Wirkungen von Baclofen im Gehirn wird diskutiert, inwieweit die Therapie mit Baclofen als Substitutionsbehandlung bei Alkoholismus bezeichnet werden kann [20]. In Frankreich wurden zwei sehr große Untersuchungen durchgeführt. In der ALPADIR-Studie [82] konnte keine Überlegenheit von Baclofen gegenüber Placebo nachgewiesen werden, in der BACLOVILLE-Studie [41] zeigte sich ein signifikanter Effekt in der Baclofengruppe für Abstinenz und die Reduktion der WHO-Risikoniveaus.
In einer Metaanalyse mit 14 randomisierten klinischen Studien wurden keine signifikanten Effekte von Baclofen nachgewiesen, dies ebenso in einer Post-hoc-Analyse der Studien mit höheren Dosen [15]. Eine aktuelle Cochrane-Analyse [65] mit insgesamt 12 randomisierten klinischen Studien konnte die Wirksamkeit von Baclofen ebenfalls nicht bestätigen. Allerdings wurde auch eine starke Heterogenität der Effektstärken deutlich, die für den Einfluss von Stichproben und Designmerkmalen spricht. Die in einigen Studien mit hoher Studienqualität nachgewiesenen positiven Effekte (z. B. [69]) sprechen weiter für eine mögliche Wirksamkeit von Baclofen. In weiteren Studien ist zu prüfen, inwieweit bestimmte Merkmale der Behandlung (z. B. individuelle Dosisanpassung) die Wirksamkeit von Baclofen beeinflussen.
Antikonvulsiva (Gabapentin, Pregabalin, Topiramat)
Gabapentin ist als Antiepileptikum und zur Behandlung der Neuralgie und des Restless-legs-Syndroms zugelassen (Dosierungen 300 bis 1800 mg/Tag). Die American Psychiatric Association (APA) empfiehlt Gabapentin und das unten besprochene Topiramat bei Unverträglichkeit von Acamprosat und Naltrexon oder bei fehlendem therapeutischem Ansprechen auf die gängigen Anti-Craving-Medikamente. Der Wirkmechanismus von Gabapentin ist nicht völlig klar, es beeinflusst spannungsabhängige Ca-Kanäle [62] und verstärkt die GABAerge Aktivität, bindet aber nicht an GABA-Rezeptoren.
Eine kürzlich erschienene Metaanalyse [52] mit 7 randomisierten, kontrollierten Therapiestudien zu Gabapentin fand einen mittelgradigen Effekt auf die Anzahl der „heavy drinking days“, alle anderen Outcomekriterien waren nicht signifikant. Eine weitere Metaanalyse [5] konnte auf der Grundlage von 10 Studien einen moderaten Effekt auf die Symptome eines Alkoholentzugs und auf das Alkoholcraving nachweisen. Pharmacovigilance-Meldungen des FDA Adverse Events Reporting System finden Hinweise auf ein Missbrauchspotenzial der Substanz [103], das vermutlich auf den GABAergen Wirkmechanismus von Gabapentin und seine entspannenden Effekte zurückzuführen ist.
Für Pregabalin liegen nur einige wenige Befunde für die Behandlung des Alkoholentzugssyndroms vor [29], nichts zur Rückfallprophylaxe. Ohnehin wäre diese Substanz wegen ihres Suchtpotenzials als Anti-Craving-Medikament kritisch zu bewerten.
Topiramat ist ein Antiepileptikum, dass am GABA-Rezeptor wirkt und gleichzeitig auch die Aktivität glutamaterger Rezeptorsubtypen reduziert [50, 51]. Es gibt eine Reihe randomisierter Studien zur Wirksamkeit von Topiramat, meist wurden Dosen von 200 bis 300 mg eingesetzt. Wie Metaanalysen zeigen, sind die therapeutischen Effekte mit denen etablierter Anti-Craving-Substanzen vergleichbar, die Datenlage ist jedoch nicht ausreichend, um aussagekräftige Schlussfolgerungen abzuleiten (z. B. [12, 77]). Als häufigste Nebenwirkung zeigen sich unter anderem Schwindel, Müdigkeit, Parästhesien und Appetitverlust, welche hinsichtlich Verträglichkeit und Compliance problematisch sind.
Ketamin
Zu den interessanten neuen Ansätzen gehört der nichtkompetitive glutamaterge NMDA-Rezeptor-Antagonist Ketamin [18]. Hier konnte experimentell gezeigt werden, dass Ketamin verstärkende Effekte von Alkohol vermindern kann [19]. Kontrollierte klinische Studien stehen noch aus.
Vareniclin
Vareniclin ist ein partieller Agonist am α4β2-Nikotin-Rezeptor und ein voller Agonist an nikotinischen Acetylcholinrezeptoren (nAChR) und für die Behandlung von Nikotinabhängigkeit zugelassen. Es gibt auch einige wenige Untersuchungen zur Wirksamkeit bei alkoholabhängigen Patienten [54, 56], darunter auch Untersuchungen mit negativem Ergebnis [21]. Der Einsatz bei komorbiden Rauchern ist naheliegend. Aktuell laufen einige Studien, auch Vergleichsuntersuchungen zu Naltrexon [54]. Eine aktuelle Metaanalyse mit über 9 placebokontrollierten Doppelblindstudien (N = 585, Behandlungsdauer 4–13 Wochen) zeigt, dass Vareniclin im Vergleich zu Placebo nicht die Zahl der „heavy drinking days“, aber die Menge des konsumierten Alkohols insgesamt vermindern konnte [74].
γ-Hydroxybutyrat (GHB)
Kontrovers wird der Einsatz von „sodium oxybate“ (SMO) und γ‑Hydroxybutyrat (GHB), einer über den GABA-Rezeptor wirkenden stark psychotropen Substanz, bewertet, die in Österreich und in Italien zur Behandlung von Alkoholentzugssyndromen und Alkoholabhängigkeit zugelassen ist (Übersicht in [44]). GHB hat selber ein starkes Suchtpotenzial und traurige Berühmtheit als „rape drug“ erlangt, als Substanz, die im Rahmen von Straftaten genutzt wird und Amnesie hervorruft, sodass sich die Opfer nicht mehr an die Tat oder den Tathergang erinnern können. Eine Metaanalyse [14] zeigt unter Einschluss von 7 randomisierten, kontrollierten Studien eine signifikante Überlegenheit von GHB gegenüber Placebo für verschiedene Outcomes der Alkoholentwöhnung, im niedrigen Dosisbereich scheint die Substanz zudem gut verträglich zu sein [44]. Dem Wirksamkeitsnachweis steht das vergleichsweise hohe Missbrauchspotenzial von GHB gegenüber, welches die Eignung der Substanz als pharmakologische Unterstützung der Alkoholentwöhnung stark einschränkt. Zusätzlich problematisch für die Verwendung der Substanz im Bereich der Alkoholtherapie ist die potenzierende Wirkung von GHB auf Alkohol (Übersicht in [102]).
Antidepressiva und Antipsychotika
Konventionelle psychotrope Substanzen wie z. B. Antidepressiva oder Antipsychotika, die das Dopaminsystem blockieren [47], haben sich in der pharmakologischen Rückfallprophylaxe zumindest bei nicht psychisch kranken Alkoholabhängigen als nicht wirksam erwiesen (Übersicht in [93]).
Weitere Substanzen
Andere Untersuchungen, bei denen verschiedene Substanzen eingesetzt worden sind, umfassen Ondansetron [42, 45], den α1-Rezeptor-Blocker Prazosin und Doxazin [36], den Glukuronidrezeptorblocker Mifepriston, außerdem Oxytozin und weitere Substanzen [105]. Für Prazosin liegen einige Untersuchungen vor [54], die letzte von Simpson et al. [89], die 92 Patienten mit 16 mg Prazosin oder Placebo behandelte und einen gewissen klinischen Effekt auf die Trinkmenge beschreiben konnte. Als Nebenwirkung tritt Benommenheit relativ häufig auf.
Pharmakogenetik
Hier liegen bislang nur relativ wenig neue Befunde vor (Übersicht in [38, 39, 79, 83]), was angesichts der bislang begrenzten Auswahl pharmakotherapeutischer Optionen nicht überrascht. Am ehesten auch von klinischem Interesse waren bislang funktionelle Polymorphismen im OPRM1- und OPRK1-Gen, die wahrscheinlich die Effekte von Opiatantagonisten wie Naltrexon modifizieren. Dazu liegt inzwischen eine Reihe experimenteller und klinischer Befunde vor [79, 83]. Eine aktuelle Metaanalyse mit 7 randomisierten, kontrollierten Studien fand einen moderaten Effekt des Asn40Asp-SNP für das Outcome „drinks per day“, ansonsten keine weiteren Hinweise, dass das rs1799971-G-Allel im OPRM1-Gen einen Einfluss auf das Ansprechen auf eine Therapie mit Naltrexon hat [39]. Für Acamprosat könnten Variationen in den glutamatergen Rezeptoren (GATA4, GREN2b) von Bedeutung sein, für Topiramat Polymorphismen in den glutamatergen AMPA- und Kainatrezeptoren (GRIK1 und 2).
Eine Übersichtsarbeit über den Einfluss serotonerger Genvariationen auf das Ansprechen pharmakotherapeutischer Methoden der Rückfallprophylaxe bei Abhängigkeitserkrankungen weist auf die Bedeutung von Genen für das Enzym Tryptophanhydroxylase 2 (TPH2) und den Serotonintransporter (SLC6A4) hin, welche die Wirkung von Ondansetron und Disulfiram modulieren [10].
In der BacALD-Studie wurde für Baclofen die Relevanz des RS29220-SNP im GABAB-Rezeptor für den Therapieerfolg und möglicherweise auch für Unverträglichkeitsreaktionen für Baclofen gezeigt [68].
Schlussfolgerung
Bislang sind nur wenige Medikamente zur Pharmakotherapie der Alkoholabhängigkeit zugelassen, einige andere Substanzen, die überwiegend aus anderen medizinischen Indikationsbereichen stammen, wie Baclofen, Topiramat, Vareniclin oder Gabapentin, könnten künftig eine größere Rolle spielen. Die neurochemischen Effekte und Grundlagen der einzelnen Substanzen unterscheiden sich erheblich. Lückenhaft sind die klinischen Daten insbesondere auch bezüglich der Wirksamkeit von Anti-Craving-Substanzen bei komorbider psychischer Störung.
Klinisch von Bedeutung ist aber, dass bereits die bislang verfügbaren Substanzen kaum eingesetzt werden, stattdessen werden häufig konventionelle Psychopharmaka (ohne Wirkungsnachweis in diesem Bereich) eingesetzt, namentlich Antidepressiva, obwohl sie zur Trinkmengenreduktion unwirksam sind [4]. Somit wird eine bereits verfügbare pharmakotherapeutische Option zur Rückfallprophylaxe bei Alkoholabhängigen nicht genützt, man könnte auch sagen „verschenkt“. Stellt man die Verordnungszahlen in Relation zu der hohen Zahl der von Alkoholabhängigkeit betroffenen Personen, kann hier von einer deutlichen Unterversorgung abhängiger Patienten mit pharmakologischen Interventionen gesprochen werden [97]. Diese sind natürlich stets als adjuvante Strategie zur Begleitung und Ergänzung psychotherapeutischer Methoden zu verstehen.
Die immer noch zögerliche Verordnung von Anti-Craving-Substanzen ist durch die Datenlage kaum begründbar. So werden mit Anti-Craving-Substanzen Effekte erzielt, die in ihrer Ausprägung durchaus mit etablierten Therapien anderer psychiatrischer und somatischer Behandlungsbereiche vergleichbar sind (vgl. z. B. [55]). Hinzu kommt, dass die tatsächlichen Effekte der Anti-Craving-Behandlung aufgrund methodischer Besonderheiten im Bereich der Abhängigkeitstherapie durch klinische Studien eher unterschätzt als überschätzt werden dürften [88].
An der zurückhaltenden therapeutischen Nutzung von Anti-Craving-Substanzen dürften vermutlich auch psychologische Faktoren wie eine geringe Erfolgserwartung oder die Befürchtung einer eventuellen „Suchtverlagerung“ beteiligt sein. Die Prüfung eigener Vorbehalte, das offene Ansprechen etwaiger Bedenken des Patienten und dessen Beteiligung an einer gemeinsamen Entscheidungsfindung sind im Bereich der Anti-Craving-Behandlung von besonderer Bedeutung.
Auch wenn sich die Basis der klinisch wirksamen Substanzen nur zaghaft zu verbreitern scheint, kann eine zunehmende Anpassung der Strategien an die individuellen Bedürfnisse und Präferenzen des Patienten eine Zunahme der Compliance erzielen. Damit sollte auch das klinische und wissenschaftliche Interesse an den Substanzen wieder stärker in den Fokus rücken.
Funding
Open Access funding provided by Projekt DEAL.
Einhaltung ethischer Richtlinien
Interessenkonflikt
M. Soyka war für Amomed, Camurus, Lundbeck und Indiviorals als Berater tätig oder hat Forschungsunterstützung oder Referentenhonorare erhalten. S. Rösner gibt an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Addolorato G, Caputo F, Capristo E, et al. Baclofen efficacy in reducing alcohol craving and intake: a preliminary double-blind study randomized controlled study. Alcohol Alcohol. 2002;37:123–135. doi: 10.1093/alcalc/37.5.504. [DOI] [PubMed] [Google Scholar]
- 2.Addolorato G, Leggio L, Ferulli A, et al. Effectiveness and safety of baclofen for maintenance of alcohol abstinence in alcohol-dependent patients with liver cirrhosis: randomized, double-blind controlled study. Lancet. 2007;370:1915–1922. doi: 10.1016/S0140-6736(07)61814-5. [DOI] [PubMed] [Google Scholar]
- 3.Addolorato G, Leggio L, Ferrulliu A, et al. Dose-response effect of baclofen in reducing daily alcohol intake in alcohol dependence: secondary analysis of a randomized, double-blind, placebo-controlled trial. Alcohol Alcohol. 2011;46:312–317. doi: 10.1093/alcalc/agr017. [DOI] [PubMed] [Google Scholar]
- 4.Agabio R, Trogu E, Pani PP. Antidepressants for the treatment of people with co-occurring depression and alcohol dependence. Cochrane Database Syst Rev. 2018;4(4):CD008581. doi: 10.1002/14651858.CD008581.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Ahmed S, Stanciu CN, Kotapati PV. Effectiveness of gabapentin in reducing cravings and withdrawal in alcohol use disorder: a meta-analytic review. Prim Care Companion CNS Disord. 2019;21(4):19r02465. doi: 10.4088/PCC.19r02465. [DOI] [PubMed] [Google Scholar]
- 6.Allen JP. Measuring outcome in interventions for alcohol dependence and problem drinking: executive summary of a conference sponsored by the national institute on alcohol abuse and alcoholism. Alcohol Clin Exp Res. 2003;27(10):1657–1660. doi: 10.1097/01.ALC.0000091223.72517.13. [DOI] [PubMed] [Google Scholar]
- 7.Ameisen O. Complete and prolonged suppression of symptoms and consequences of alcohol-dependence using high-dose baclofen: a self-case report of a physician. Alcohol Alcohol. 2005;40:147–150. doi: 10.1093/alcalc/agh130. [DOI] [PubMed] [Google Scholar]
- 8.American Psychiatric Association . Diagnostische und Statistische Manual Psychischer Störungen. 5. Arlington, VA: American Psychiatric Publishing; 2013. [Google Scholar]
- 9.Anton RF, O’Malley SS, Ciraulo DA, et al. Combined pharmacotherapies and behavioral interventions for alcohol dependence: the COMBINE study: a randomized controlled trial. JAMA. 2006;295(17):2003–2017. doi: 10.1001/jama.295.17.2003. [DOI] [PubMed] [Google Scholar]
- 10.Bauer IE, Graham DP, Soares JC, et al. Serotonergic gene variation in substance use pharma-cotherapy: a systematic review. Pharmacogenomics. 2015;16(11):1307–1314. doi: 10.2217/pgs.15.72. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Beraha EM, Salemink E, Goudriaan AE, et al. Efficacy and safety of high-dose baclofen for the treatment of alcohol dependence: a multicentre, randomised, double-blind controlled trial. Eur Neuropsychopharmacol. 2016;26(12):1950–1959. doi: 10.1016/j.euroneuro.2016.10.006. [DOI] [PubMed] [Google Scholar]
- 12.Blodgett JC, Del Re AC, Maisel NC, et al. A meta-analysis of topiramate’s effects for individuals with alcohol use disorders. Alcohol Clin Exp Res. 2014;38:1481–1488. doi: 10.1111/acer.12411. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Bolton M, Hodkinson A, Boda S, et al. Serious adverse events reported in placebo randomised controlled trials of oral naltrexone: a systematic review and meta-analysis. BMC Med. 2019;17(1):10. doi: 10.1186/s12916-018-1242-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Brambilla R, Vigna-Taglianti F, Avanzi G, et al. Il gamma-idrossibutirrato (GHB) nel trattamento a medio/lungo termine della dipendenza da alcol: una revisione sistematica [gamma-hydroxybutyrate (GHB) for mid/long term treatment of alcohol dependence: a systematic review. Riv Psichiatr. 2012;47(4):269–280. doi: 10.1708/1139.12554. [DOI] [PubMed] [Google Scholar]
- 15.Bschor T, Henssler J, Müller M, et al. Baclofen for alcohol use disorder—a systematic meta-analysis. Acta Psychiatr Scand. 2018;138(3):232–242. doi: 10.1111/acps.12905. [DOI] [PubMed] [Google Scholar]
- 16.Castera P, Stewart E, Großkopf J, et al. Nalmefene, given as needed, in the routine treatment of patients with alcohol dependence: an interventional, open-label study in primary care. Eur Addict Res. 2018;24(6):293–303. doi: 10.1159/000494692. [DOI] [PubMed] [Google Scholar]
- 17.Chaignot C, Zureik M, Rey G, et al. Risk of hospitalization and death related to baclofen for alcohol use disorders: comparison with nalmefene, acamprosate, and naltrexone in a cohort study of 165334 patients between 2009 and 2015 in France. Pharmacoepidemiol Drug Saf. 2018;27:1239–1248. doi: 10.1002/pds.4635. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Crowley NA, Magee SN, Feng M, et al. Ketamine normalizes binge drinking-induced defects in glutamatergic synaptic transmission and ethanol drinking behavior in female but not male rats. Neuropharmacology. 2019;149:35–44. doi: 10.1016/j.neuropharm.2019.02.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Das RK, Gale G, Walsh K, et al. Ketamine can reduce harmful drinking by pharmacologically rewriting drinking memories. Nat Commun. 2019;10(1):5187. doi: 10.1038/s41467-019-13162-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.de Beaurepaire R. A review of the potential mechanisms of action of baclofen in alcohol use disorder. Front Psychiatry. 2018;9:506. doi: 10.3389/fpsyt.2018.00506. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.de Bejczy A, Lof E, Walther L, et al. Varenicline for treatment of alcohol dependence: a randomized, placebo-controlled trial. Alcohol Clin Exp Res. 2015;39:2189–2199. doi: 10.1111/acer.12854. [DOI] [PubMed] [Google Scholar]
- 22.Dilling H, Mombour W, Schmidt M. Internationale Klassifikation psychischer Störungen. 10. Bern: Huber; 2015. [Google Scholar]
- 23.Donoghue K, Elzerbi C, Saunders R. The efficacy of acamprosate and naltrexone in the treatment of alcohol dependence, Europe versus the rest of the world: a meta-analysis. Addiction. 2015;110(6):920–930. doi: 10.1111/add.12875. [DOI] [PubMed] [Google Scholar]
- 24.Edwards G, Brown D, Oppenheimer E, et al. Long term outcome for patients. With drinking problems: the search for predictors. Br J Addict. 1988;83:917–927. doi: 10.1111/j.1360-0443.1988.tb01584.x. [DOI] [PubMed] [Google Scholar]
- 25.European Medicines Agency . Guideline on the development of medicinal products for the treatment of alcohol dependence. London: European Medicines Agency; 2010. [Google Scholar]
- 26.Falk DE, O’Malley SS, Witkiewitz K, et al. Alcohol clinical trials initiative (ACTIVE) workgroup. Evaluation of drinking risk levels as outcomes in alcohol pharmacotherapy trials: a secondary analysis of 3 randomized clinical trials. JAMA Psychiatry. 2019;76(4):374–381. doi: 10.1001/jamapsychiatry.2018.3079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Farokhnia M, Faulkner ML, Piacentino D, et al. From a gut hormone to a potential therapeutic target for alcohol use disorder. Physiol. Behav. 2019;204:49–57. doi: 10.1016/j.physbeh.2019.02.008. [DOI] [PubMed] [Google Scholar]
- 28.Fitzgerald N, Angus K, Elders A, et al. Weak evidence on nalmefene creates dilemmas for clinicians and poses questions for regulators and researchers. Addiction. 2016;111:14477–11487. doi: 10.1111/add.13438. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Freynhagen R, Backonja M, Schug S, et al. Pregabalin for the treatment of drug and alcohol withdrawal symptoms: a comprehensive review. CNS Drugs. 2016;30:1191–1200. doi: 10.1007/s40263-016-0390-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Fuller RK, Branchey L, Brightwell DR, et al. Disulfiram treatment of alcoholism. A veterans administration cooperative study. JAMA. 1986;256(11):1449–1455. [PubMed] [Google Scholar]
- 31.Garbutt JC, Kampov-Polevoy AB, Gallop P. Efficacy and safety of baclofen for alcohol dependence: a randomized, double-blind, placebo-controlled trial. Alcohol Clin Exp Res. 2010;34:1849–1857. doi: 10.1111/j.1530-0277.2010.01273.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Garbutt JC, Kranzler HR, O’Malley SS, Vivitrex Study Group et al. Efficacy and tolerability of long-acting injectable naltrexone for alcohol dependence: a randomized controlled trial. JAMA. 2005;293(13):1617–1625. doi: 10.1001/jama.293.13.1617. [DOI] [PubMed] [Google Scholar]
- 33.Goh ET, Morgan MY. Review article: pharmacotherapy for alcohol dependence—the why, the what and the wherefore. Aliment Pharmacol Ther. 2017;45:865–882. doi: 10.1111/apt.13965. [DOI] [PubMed] [Google Scholar]
- 34.Grant BF, Goldstein RB, Saha TD, et al. Epidemiology of DSM-5 alcohol use disorder: results from the national epidemiologic survey on alcohol and related conditions III. JAMA Psychiatry. 2015;72(8):757–766. doi: 10.1001/jamapsychiatry.2015.0584. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Gual A, He Y, Torup L, et al. A randomized, double-blind, placebo-controlled, efficacy study of nalmefene, as-needed use, in patients with alcohol dependence. Eur Neuropsychopharmacol. 2013;23:1432–1442. doi: 10.1016/j.euroneuro.2013.02.006. [DOI] [PubMed] [Google Scholar]
- 36.Haass-Koffler CL, Swift RM. Noradrenergic targets for the treatment of alcohol use disorder. Psychopharmacology. 2018;235:1625–1634. doi: 10.1007/s00213-018-4843-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Hansson AC, Gründer G, Hirth N, et al. Dopamine and opioid systems adaptation in alcoholism revisited: convergent evidence from positron emission tomography and postmortem studies. Neurosci Biobehav Rev. 2019;106:141–164. doi: 10.1016/j.neubiorev.2018.09.010. [DOI] [PubMed] [Google Scholar]
- 38.Hartwell EE, Kranzler KR. Pharmacogenetics of alcohol use disorder treatments: an update. Expert Opin Drug Metab Toxicol. 2019;15:553–564. doi: 10.1080/17425255.2019.1628218. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Hartwell EE, Feinn R, Morris PE. Systematic review and meta-analysis of the moderating effect of rs1799971 in OPRM1, the Mu-opioid receptor gene, on response to naltrexone treatment of alcohol use disorder. Addiction. 2020 doi: 10.1111/add.14975. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Hasin DS, Wall M, Witkiewitz K, et al. Change in non-abstinent, WHO drinking risk levels and alcohol dependence, A 3 year follow-up results in the US general polulation. Alcohol Clin Exp Res. 2018;42:2256–2265. doi: 10.1111/acer.13884. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Jaury P. Bacloville: clinical efficacy study of high dose baclofen in reducing alcohol consumption in high risk drinkers. 2016. [Google Scholar]
- 42.Johnson BA, Ait-Daoud C, Seneviratne J, et al. Pharmacogenetic approach at the serotonin transporter gene as a method of reducing the severity of alcohol drinking. Am J Psychiatry. 2011;168:265275. doi: 10.1176/appi.ajp.2010.10050755. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Jonas DE, Amick HR, Feltner C, et al. Pharmacotherapy for adults with alcohol use disorders in outpatient settings: a systematic review and meta-analysis. JAMA. 2014;311(18):1889–1900. doi: 10.1001/jama.2014.3628. [DOI] [PubMed] [Google Scholar]
- 44.Keating GM. Sodium oxybate: a review of its use in alcohol withdrawal syndrome and in the maintenance of abstinence in alcohol dependence. Clin Drug Investig. 2014;34:63–80. doi: 10.1007/s40261-013-0158-x. [DOI] [PubMed] [Google Scholar]
- 45.Kenna GA, Zywiak WH, Swift RM, et al. Ondansetron reduces naturalistic drinking in non-treatment-seeking alcohol-dependent individuals with the LL 5’-HTTLPR genotype: a laboratory study. Alcohol Clin Exp Res. 2014;38:1567–1574. doi: 10.1111/acer.12410. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Kiefer F, Jahn H, Tarnaske T, et al. Comparing and combining naltrexone and acamprosate in relapse prevention of alcoholism: a double-blind, placebo-controlled study. Arch Gen Psychiatry. 2003;60(1):92–99. doi: 10.1001/archpsyc.60.1.92. [DOI] [PubMed] [Google Scholar]
- 47.Kishi T, Devy S, Chekuri R, et al. Antipsychotics for primary alcohol dependence: a systematic review and meta-analysis of placebo-controlled trials. J Clin Psychiatry. 2013;74(7):e642–54. doi: 10.4088/JCP.12r08178. [DOI] [PubMed] [Google Scholar]
- 48.Klemperer EM, Hughes JR, Naud S. Study characteristics influence the efficacy of substance abuse treatments: a meta-analysis of medications for alcohol use disorder. Drug Alcohol Depend. 2018;190:229–234. doi: 10.1016/j.drugalcdep.2018.06.015. [DOI] [PubMed] [Google Scholar]
- 49.Krampe H, Spies CD, Ehrenreich H. Supervised disulfiram in the treatment of alcohol use disorder: a commentary. Alcohol Clin Exp Res. 2011;35(10):1732–1736. doi: 10.1111/j.1530-0277.2011.01519.x. [DOI] [PubMed] [Google Scholar]
- 50.Kranzler HR, Covault J, Feinn R, et al. Topiramate treatment for heavy drinkers: moderation by a GRIK1 polymorphism. Am J Psychiatry. 2014;171:445–452. doi: 10.1176/appi.ajp.2013.13081014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Kranzler HR, Armeli S, Feinn R, et al. GRIK1 genotype moderates topiramate’s effects on daily drinking level, expectations of alcohols positive effects and desire to drink. Int J Neuropsychopharmacol. 2014;17:1549–1556. doi: 10.1017/S1461145714000510. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Kranzler HR, Feinn R, Morris P, et al. A meta-analysis of the efficacy of gabapentin for treating alcohol use disorder. Addiction. 2019;114:1547–1555. doi: 10.1111/add.14655. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Kranzler HR, Soyka M. Diagnosis and pharmacotherapy of alcohol use disorder. A review. JAMA. 2018;320:815–826. doi: 10.1001/jama.2018.11406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Leggio L, Falk DE, Ryan ML. Medication development for alcohol use disorder: a focus on clinical studies. Handb Exp Pharmacol. 2019 doi: 10.1007/164_2019_295. [DOI] [PubMed] [Google Scholar]
- 55.Leucht S, Hierl S, Kissling W. Putting the efficacy of psychiatric and general medicine medication into perspective: review of meta-analyses. Br J Psychiatry. 2012;200(2):97–106. doi: 10.1192/bjp.bp.111.096594. [DOI] [PubMed] [Google Scholar]
- 56.Litten RZ, Ryan ML, Fertig JR, et al. A double-blind, placebo-controlled trial assessing the efficacy of varenicline tartrate for alcohol dependence. J Addict Med. 2013;7:277–286. doi: 10.1097/ADM.0b013e31829623f4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Maisel NC, Blodgett JC, Wilbourne PL, et al. Meta-analysis of naltrexone and acamprosate for treating alcohol use disoorders: when are these medications most helpful? Addiction. 2013;108(2):275–293. doi: 10.1111/j.1360-0443.2012.04054.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Magill M, Ray L, Kiluk B, et al. A meta-analysis of cognitive-behavioral therapy for alcohol or other drug use disorders: treatment efficacy by contrast condition. J Consult Clin Psychol. 2019;87:10931105. doi: 10.1037/ccp0000447. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Mann K, Hoch E, Batra A. S3-Leitlinie Screening, Diagnose und Behandlung alkoholbezogener Störungen. Heidelberg, Berlin: Springer; 2016. [Google Scholar]
- 60.Mann K, Bladström A, Torup L, et al. Extending the treatment options in alcohol dependence: a randomized controlled study of as-needed nalmefene. Biol Psychiatry. 2013;73:706–713. doi: 10.1016/j.biopsych.2012.10.020. [DOI] [PubMed] [Google Scholar]
- 61.Marshall EJ, Edwards G, Taylor C. Mortality in men with drinking problems: a 20-year follow-up. Addiction. 1994;89:1293–1298. doi: 10.1111/j.1360-0443.1994.tb03308.x. [DOI] [PubMed] [Google Scholar]
- 62.Mason BJ, Quello S, Shadan F. Gabapentin for the treatment of alcohol use disorder. Expert Opin Investig Drugs. 2018;27:113–124. doi: 10.1080/13543784.2018.1417383. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.McCrady BS, Owens MD, Borders AZ. Psychosocial approaches to alcohol use disorders since 1940: a review. J Stud Alcohol Drugs Suppl. 2014;75(17):68–78. doi: 10.15288/jsads.2014.s17.68. [DOI] [PubMed] [Google Scholar]
- 64.Miller WR, Wilbourne PL. Mesa grande: a methodological analysis of clinical trials of treatments for alcohol use disorders. Addiction. 2002;27:867–886. doi: 10.1046/j.1360-0443.2002.00019.x. [DOI] [PubMed] [Google Scholar]
- 65.Minozzi S, Saulle R, Rösner S. Baclofen for alcohol use disorder. Cochrane Database Syst Rev. 2018;11:CD012557. doi: 10.1002/14651858.CD012557.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Miyata H, Takahashi M, Murai Y, et al. Nalmefene in alcohol-dependent patients with a high drinking risk: randomized controlled trial. Psychiatry Clin Neurosci. 2019;73:697–706. doi: 10.1111/pcn.12914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Morley KC, Baillie A, Leung S, et al. Baclofen for the treatment of alcohol dependence and possible role of comorbid anxiety. Alcohol Alcohol. 2014;49:654–660. doi: 10.1093/alcalc/agu062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Morley KC, Luquin N, Baillie A. Moderation of baclofen response by a GABAB receptor polymorphism: results from the BacALD randomized controlled trial. Addiction. 2018;113(12):2205–2213. doi: 10.1111/add.14373. [DOI] [PubMed] [Google Scholar]
- 69.Müller CA, Geisel O, Pelz P, et al. High-dose baclofen for the treatment of alcohol dependence (BACLAD study): a randomized, placebo-controlled trial. Eur Neuropsychopharmacol. 2015;25:1167–1177. doi: 10.1016/j.euroneuro.2015.04.002. [DOI] [PubMed] [Google Scholar]
- 70.Mutschler J, Grosshans M, Soyka M. Current findings and mechanisms of action of disulfiram in the treatment of alcohol dependence. Pharmacopsychiatry. 2016;49(4):137–141. doi: 10.1055/s-0042-103592. [DOI] [PubMed] [Google Scholar]
- 71.National Institute for Health and Care Excellence . Alcohol use disorders: diagnosis, assessment and management of harmful drinking and alcohol dependence. London: National Institute for Health and Care Excellence; 2011. [Google Scholar]
- 72.Naudet F, Palpaceur V, Boussageon R. Evaluation in alcohol use disorders—insights from the nalmefene experience. BMC Med. 2016;14:119–127. doi: 10.1186/s12916-016-0664-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.O’Malley SS, Jaffe AJ, Chang G. Naltrexone and coping skills therapy for alcohol dependence. A controlled study. Arch Gen Psychiatry. 1992;49(11):881–887. doi: 10.1001/archpsyc.1992.01820110045007. [DOI] [PubMed] [Google Scholar]
- 74.Oon-Arom A, Likhitsathian S, Srisuraparont M. Efficacy and acceptability of varenicline for alcoholism: a systematic review and meta-analysis of randomized-controlled trials. Drug Alcohol Depend. 2019;205:107631. doi: 10.1016/j.drugalcdep.2019.107631. [DOI] [PubMed] [Google Scholar]
- 75.Palpacuer C, Laviolle B, Boussageon R, et al. Risks and benefits of nalmefene in the treatment of adult alcohol dependence: a systematic literature review and meta-analysis of published and unpublished double-blind randomized controlled trials. PLoS Med. 2015;12:e1001924. doi: 10.1371/journal.pmed.1001924. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Palpacuer C, Duprez R, Huneau A, et al. Pharmacologically controlled drinking in the treatment of alcohol dependence or alcohol use disorders: a systematic review with direct and network meta-analyses on nalmefene, naltrexone, acamprosate, baclofen and topiramate. Addiction. 2018;113(2):220–237. doi: 10.1111/add.13974. [DOI] [PubMed] [Google Scholar]
- 77.Pani PP, Trogu E, Pacini M, et al. Anticonvulsants for alcohol dependence. Cochrane Database Syst Rev. 2014;2:Cd008544. doi: 10.1002/14651858.CD008544.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Ponizovsky AM, Rosca P, Aronovich E, et al. Baclofen as add-on to standrard psychosocial treatment for alcohol dependence: a randomized, double-blind, placebo controlled trial with 1 year follow-up. J Subst Abuse Treat. 2015;52:24–30. doi: 10.1016/j.jsat.2014.11.007. [DOI] [PubMed] [Google Scholar]
- 79.Ragia G, Manopoulos VG. Personalized medicine of alcohol addiction: pharmacogenomics and beyond. Curr Pharm Biotechnol. 2017;18:221–230. doi: 10.2174/1389201018666170224105025. [DOI] [PubMed] [Google Scholar]
- 80.Ray LA, Green RJ, Roche DJO, et al. Naltrexone effects on subjective responses to alcohol in the human laboratory: a systematic review and meta-analysis. Addict Biol. 2019;24:1138–1152. doi: 10.1111/adb.12747. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Rehm J, Dawson D, Frick U, et al. Burden of disease associated with alcohol use disorders in the United States. Alcohol Clin Exp Res. 2014;38(4):1068–1077. doi: 10.1111/acer.12331. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Reynaud M, Aubin H-J, Trinquet F, et al. A randomized, placebo-controlled study of high-dose baclofen in alcohol-dependent patients—the ALPADIR study. Alcohol Alcohol. 2017;52(4):439446. doi: 10.1093/alcalc/agx030. [DOI] [PubMed] [Google Scholar]
- 83.Roche DJO, Ray LA. Subjective response as a consideration in the pharmacogenetics of alcoholism treatment. Pharmacogenomics. 2015;16:721–726. doi: 10.2217/pgs.14.143. [DOI] [PubMed] [Google Scholar]
- 84.Rolland B, Labreuche J, Duhamel A, et al. Baclofen for alcohol dependence: relationships between baclofen and alcohol dosing and the occurrence of major sedation. Eur Neuropsychopharmacol. 2015;25:1631–1636. doi: 10.1016/j.euroneuro.2015.05.008. [DOI] [PubMed] [Google Scholar]
- 85.Rösner S, Hackl-Herrwerth A, Leucht S, et al. Acamprosate for alcohol dependence. Cochrane Database Syst Rev. 2010;9:CD004332. doi: 10.1002/14651858.CD004332.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Rösner S, Hackl-Herrwerth A, Leucht S, et al. Opioid antagonists for alcohol dependence. Cochrane Database Syst Rev. 2010;12:CD001867. doi: 10.1002/14651858.CD001867.pub3. [DOI] [PubMed] [Google Scholar]
- 87.Rösner S, Grosshans M, Mutschler JH. Disulfiram: Aktuelle Befunde und Wirkmechanismen. Suchtmedizin. 2014;16(2):47–52. [Google Scholar]
- 88.Rösner S, Soyka M. Outcome assessment in trials of pharmacological treatments for alcohol use disorders. CNS Drugs. 2019;33:649–657. doi: 10.1007/s40263-019-00644-0. [DOI] [PubMed] [Google Scholar]
- 89.Simpson TL, Saxon AJ, Stappenbeck C, et al. Double-blind randomized clinical trial of prazosin for alcohol use disorder. Am J Psychiatry. 2018;175(12):1216–1224. doi: 10.1176/appi.ajp.2018.17080913. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Sinclair JM, Chambers SE, Shiles CJ, et al. Safety and tolerability of pharmacological treatment of alcohol dependence: comprehensive review of evidence. Drug Saf. 2016;39:627–645. doi: 10.1007/s40264-016-0416-y. [DOI] [PubMed] [Google Scholar]
- 91.Skinner MD, Coudert M, Berlin I, et al. Effect of the threat of a disulfiram-ethanol reaction on cue reactivity in alcoholics. Drug Alcohol Depend. 2010;112(3):239–246. doi: 10.1016/j.drugalcdep.2010.06.011. [DOI] [PubMed] [Google Scholar]
- 92.Skinner MD, Lahmek P, Pham H, et al. Disulfiram efficacy in the treatment of alcohol dependence: a meta-analysis. PLoS One. 2014;9(2):e87366. doi: 10.1371/journal.pone.0087366. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 93.Soyka M, Müller CA. Pharmacotherapy of alcoholism—an update on approved and off-label medications. Expert Opin Pharmacother. 2017;18(12):1187–1199. doi: 10.1080/14656566.2017.1349098. [DOI] [PubMed] [Google Scholar]
- 94.Soyka M. Nalmefene for the treatment of alcohol use disorders: recent data and clinical potential. Expert Opin Pharmacother. 2016;7(4):619–626. doi: 10.1517/14656566.2016.1146689. [DOI] [PubMed] [Google Scholar]
- 95.Soyka M, Batra A, Heinz A, et al., editors. Suchtmedizin. München: Elsevier; 2019. [Google Scholar]
- 96.Spanagel R, Vengeliene V, Jandeleit B, et al. Acamprosate produces its anti-relapse effects via calcium. Neuropsychopharmacology. 2014;39(4):783–791. doi: 10.1038/npp.2013.264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Stanciu C, Penders T, Wuensch K, et al. Underutilization of pharmacotherapy for treatment of alcohol use disorders part II-results from a survey of practices among North Carolina mental health providers and brief review of efficacy of available pharmacotherapies. J Alcohol Drug Depend. 2017;5(5):285. [Google Scholar]
- 98.Stevenson M, Pandor A, Stevens JW, et al. Nalmefene for reducing alcohol consumption in people with alcohol dependence: an evidence review group perspective of a NICE single technology appraisal. PharmacoEconomics. 2015;33:833–847. doi: 10.1007/s40273-015-0272-0. [DOI] [PubMed] [Google Scholar]
- 99.Tiffany ST, Friedman L, Greenfield SF. Beyond drug use: a systematic consideration of other outcomes in evaluations of treatments for substance use disorders. Addiction. 2012;107(4):709–718. doi: 10.1111/j.1360-0443.2011.03581.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 100.van den Brink W, Aubin HJ, Bladström A, et al. Effiaccy of as-needed nalmefene in alcohol-dependent patients with at least a high drinking risk level: results from a subgroup analysis of two randomized controlled 6-month studies. Alcohol Alcohol. 2013;48:570–578. doi: 10.1093/alcalc/agt061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.van den Brink W, Sorensen P, Torup L, et al. Long-term efficacy, tolerability and safety of nalmefene as-needed in patients with alcohol dependence: a 1-year, randomized controlled study. J Psychopharmacol. 2014;28:733–744. doi: 10.1177/0269881114527362. [DOI] [PubMed] [Google Scholar]
- 102.van den Brink W, Addolorato G, Aubin H-J, et al. Efficacy and safety of sodium oxybate in alcohol-dependent patients with a very high drinking risk level. Addict Biol. 2018;23:969–986. doi: 10.1111/adb.12645. [DOI] [PubMed] [Google Scholar]
- 103.Vickers-Smith R, Sun J, Charnigo RJ, et al. Gabapentin drug misuse signals: a pharmacovig-ilance assessment using the FDA adverse event reporting system. Drug Alcohol Depend. 2020;206:107709. doi: 10.1016/j.drugalcdep.2019.107709. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Volpicelli JR, Alterman AI, Hayashida M, et al. Naltrexone in the treatment of alcohol dependence. Arch Gen Psychiatry. 1992;49(11):876–880. doi: 10.1001/archpsyc.1992.01820110040006. [DOI] [PubMed] [Google Scholar]
- 105.Witkiewitz K, Litten RZ, Leggio L. Advances in the science and treatment of alcohol use disorder. Sci Adv. 2019;5(9):eaax4043. doi: 10.1126/sciadv.aax4043. [DOI] [PMC free article] [PubMed] [Google Scholar]