Abstract
Die organisierende Pneumonie (OP) beschreibt ein histologisches Muster des akuten bzw. subakuten Lungenschadens. Klinisch fallen die Patienten mit Husten, Fieber und Dyspnoe auf. Es wird zwischen der idiopathischen bzw. kryptogen organisierenden (COP) und der sekundären organisierenden Pneumonie (OP) unterschieden. Bei der COP kann weder klinisch/radiologisch noch histologisch eine Ursache bestimmt werden. Sie wird zu den interstitiellen idiopathischen Pneumonien (IIP) gezählt nach Kriterien der American Thoracic Society (ATS) und der European Respiratory Society (ERS). Bei der sekundären organisierenden Pneumonie liegt ein bekannter auslösender Mechanismus vor, wie z. B. infektiöse Erreger, bestimmte Medikamente oder auch Begleiterscheinungen anderer primär pulmonaler Erkrankungen und Erkrankungen anderer Organsysteme. Beiden Formen gemeinsam ist das histologische Bild der intraalveolären Mesenchymknospen. Diese sind Myofibroblastenproliferate, welche sich zopfartig entlang der Alveolarräume verzweigen. Sie werden in der Regel von einem bis mäßigen interstitiellen und alveolären, chronischen und makrophagenreichen Entzündungszellinfiltrat begleitet. Wichtigste Differenzialdiagnose ist die gewöhnliche interstitielle Pneumonie (UIP). Diese zeigt ebenfalls Fibroblastenproliferate, welche allerdings interstitiell liegen. Die korrekte Zuordnung einer IIP als COP mittels klinischer, radiologischer und histologischer Befunderhebung ist essenziell, da die COP im Gegensatz zur UIP sehr gut auf Kortikosteroide anspricht und somit gegenüber der UIP eine exzellente Prognose hat. Der Verlauf sekundärer organisierender Pneumonien hängt von der jeweiligen Grunderkrankung ab. Hier ist es wichtig, dass der Pathologe histologische Begleitcharakteristika einer OP korrekt identifiziert, um Hinweise auf eine mögliche Ursache geben zu können.
Schlüsselwörter: Idiopathische organisierende Pneumonie, Masson-Körper, Mesenchymknospen, Idiopathische interstitielle Pneumonie, Bronchiolitis obliterans mit organisierender Pneumonie (BOOP)
Abstract
Organizing pneumonia (OP) describes a histological pattern of acute or subacute lung damage. Clinically, patients present with cough, fever, and dyspnea. A distinction is made between idiopathic or cryptogenic organizing pneumonia (COP) and secondary organizing pneumonia (OP). In COP, neither clinical/radiological nor histological causes can be determined. It is classified as an interstitial idiopathic pneumonia (IIP) according to the criteria of the American Thoracic Society (ATS) and the European Respiratory Society (ERS). Secondary organizing pneumonia has a known triggering mechanism, such as infectious agents, certain medications, or concomitant symptoms of other primary pulmonary diseases and diseases of other organ systems. Common to both forms is the histological picture of intra-alveolar mesenchymal buds. These are myofibroblast proliferates that branch out along the alveolar spaces. They are usually accompanied by a moderate interstitial and alveolar, chronic, and macrophage-rich inflammatory cell infiltrate. The most important differential diagnosis is common interstitial pneumonia (UIP). It also shows fibroblast proliferates, which are, however, located in the interstitium. The correct classification of an IIP as a COP by means of clinical, radiological, and histological findings is essential, since the COP, in contrast to the UIP, responds very well to corticosteroids and therefore has an excellent prognosis compared to the UIP. The course of secondary organizing pneumonia depends on the respective underlying disease. Here it is important for the pathologist to correctly identify potential accompanying histological characteristics in order to be able to provide clues to a possible cause of OP.
Keywords: Idiopathic organizing pneumonia, Masson bodies, Fibroblast proliferation, Idiopathic interstitial pneumonia, Bronchiolitis obliterans organizing pneumonia (BOOP)
Hintergrund
Die organisierende Pneumonie (OP) repräsentiert gemeinsam mit dem diffusen Alveolarschaden („diffuse alveolar damage“, DAD) die 2 histologischen Hauptmanifestationen des akuten Lungenschadens („acute lung injury“, ALI) [22]. Sie hat inzwischen den Begriff der Bronchiolitis obliterans mit organisierender Pneumonie (BOOP) abgelöst, um Verwechslungen mit der konstriktiven Bronchiolitis obliterans (CBO) zu vermeiden. Die OP wird weiter eingeteilt in die idiopathische oder kryptogene OP („cryptogenic OP“, COP), welche eine primäre Form einer interstitiellen Lungenerkrankung darstellt. Daneben gibt es diverse sekundäre Formen der OP, welche auf spezifische Ursachen zurückgeführt werden können bzw. innerhalb eines bestimmten klinischen Kontexts entstehen. Das klinische und pathologische Bild der OP wurde 1901 das erste Mal von dem deutschen Pathologen W. Lange anhand zweier Patienten mit Husten, Fieber und Dyspnoe diagnostiziert, welche im Krankenhaus verstarben. In der histologischen Post-mortem-Aufarbeitung beschreibt Lange Lungenveränderungen mit Nachweis von Granulationsgewebszapfen in Alveolen und Bronchiolen entsprechend dem Bild der heutigen OP und bezeichnete die Erkrankung als „Bronchitis et Bronchiolitis obliterans“ [19]. Der Begriff COP wurde 1983 von Davison et al. geprägt, welche damit eine Abgrenzung zur postinfektiösen OP darstellen wollten [8]. Sie beschrieben damals weiterhin die hohe Glukokortikoidsensitivität der OP und ihren Neigung zum Rezidiv bei zu frühzeitigen Absetzen der Medikation [5]. Insgesamt ist die Epidemiologie der OP schlecht dokumentiert. Eine isländische Studie spricht von einer Inzidenz von 1,10/100.000 Einwohner für die COP und 0,87/100.000 für sekundäre Formen der OP [13]. Nichtsdestotrotz ist die OP eine häufig beobachtbare histologische Veränderung bei der pathologischen Aufarbeitung interstitieller Lungenerkrankungen oder sekundär im Rahmen anderer primärer Lungenerkrankungen. Klinisch zeigen COP-Patienten subakute Symptome wie über Wochen, meist über Monate andauerndes Fieber, Husten und/oder Dyspnoe. Das histologische Hauptcharakteristikum der OP sind Mesenchymknospen aus Granulationsgewebe, sogenannte Masson-Körper, welche in einem bronchiolozentrischen Verteilungsmuster die Lungenalveolen ausfüllen. Differenzialdiagnostisch sind die organisierende Form des DAD und die gewöhnliche interstitielle Pneumonie („usual interstitial pneumonia“, UIP) zu berücksichtigen. Auch hier sind Fibroblastenproliferate zu finden, welche aber intraseptal und nicht intraalveolar verordnet sind. Die COP ist glukokortikoidsensitiv und hat eine exzellente Prognose. Therapie und Prognose anderer Formen der OP richten sich nach der beteiligten Grunderkrankung.
COP
Die idiopathische oder kryptogene OP („cryptogenic organizing pneumonia“, COP) wurde 2002 durch eine Arbeitsgruppe der American Thoracic Society (ATS) und der European Respiratory Society (ERS) als eine Form der idiopathischen interstitiellen Pneumonien (IIP) oder auch interstitiellen Lungenerkrankungen („interstitial lung disease“, ILD) definiert [1]. Im Jahr 2013 erfolgte eine Überarbeitung der IIP-Einteilung durch die ATS/ERS. Die COP wird seitdem zu einer der 6 häufigsten IIPs gezählt. In diese Gruppe fallen weiterhin die idiopathische pulmonale Fibrose (IPF), die nichtspezifische interstitielle Pneumonie (NSIP), die respiratorische Bronchiolitis mit interstitieller Lungenerkrankung (RBILD), die desquamative interstitielle Pneumonie (DIP) und die akute interstitielle Pneumonie (AIP) [26].
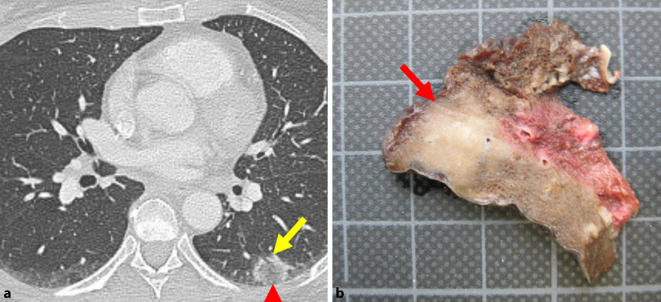
Abzugrenzen hiervon sind umschriebene einzelne oder mehrere Foci einer organisierenden Pneumonie, welche zwar nicht auf eine bestimmte Ursache oder klinische Konstellation im Sinne einer sekundären organisierenden Pneumonie zurückgeführt werden können, sich aber aufgrund ihrer herdförmigen Begrenzung auch nicht für die Diagnose einer IIP qualifizieren (vgl. Abb. 1).
Klinik
Beide Geschlechter sind in gleicher Häufigkeit von einer COP betroffen. Allerdings ist der Anteil an Nichtrauchern 2‑mal häufiger im Vergleich zu Rauchern. Das mittlere Erkrankungsalter liegt bei 55 Jahren. In der Regel zeigen die Patienten subakute Symptome von Husten und Dyspnoe über eine Dauer von ca. 3 Monaten. Ein Teil der Patienten beschreibt zusätzlich vorausgegangene grippeähnliche Symptome wie Fieber, Halsschmerzen oder Schwäche. Weitere unspezifische Symptome sind Brustschmerzen, Nachtschweiß und milde Arthralgien. Ein Lungenfunktionstest zeigt milde bis mäßige restriktive Ventilationseinschränkungen [4, 14, 17]. In der bronchoalveolären Lavage (BAL) findet sich unter anderem eine erhöhte Gesamtzellzahl mit einer Lymphozytose und einer vermehrten Anzahl an Granulozyten. Zusätzlich lassen sich schaumzellige Makrophagen nachweisen. Die CD4/CD8-Ratio ist reduziert (mindestens < 0,9). Insgesamt ähnelt das Bild der BAL bei einer Hypersensitivitätspneumonie [24].
Radiologie
In der Computertomographie (CT) ist die OP mit zahlreichen unterschiedlichen Bildmustern assoziiert. Die Verteilung der Befunde ist meist diffus und bilateral. Es treten jedoch auch fokale oder einseitige Anomalien auf [18]. Zu den häufigsten CT-Merkmalen gehören unscharf berandete fleckige Konsolidierung mit einer vorwiegend subpleuralen oder peribronchialen Verteilung. Die Unterlappen sind in der Regel stärker betroffen. Seltener finden sich zentrilobuläre Mikronoduli und Rundherde [10]. Als hochspezifischer Befund gilt das Atoll-Zeichen (umgekehrtes Halozeichen, siehe Abb. 1a), wenngleich die Sensitivität gering ist und es nur bei ca. 20 % der Patienten mit einer OP auftritt [16].
Als CT-morphologische Differenzialdiagnosen sind die chronische eosinophile Pneumonie, das invasive Adenokarzinom, pulmonale Lymphome sowie die Sarkoidose zu nennen [10].
Histologie
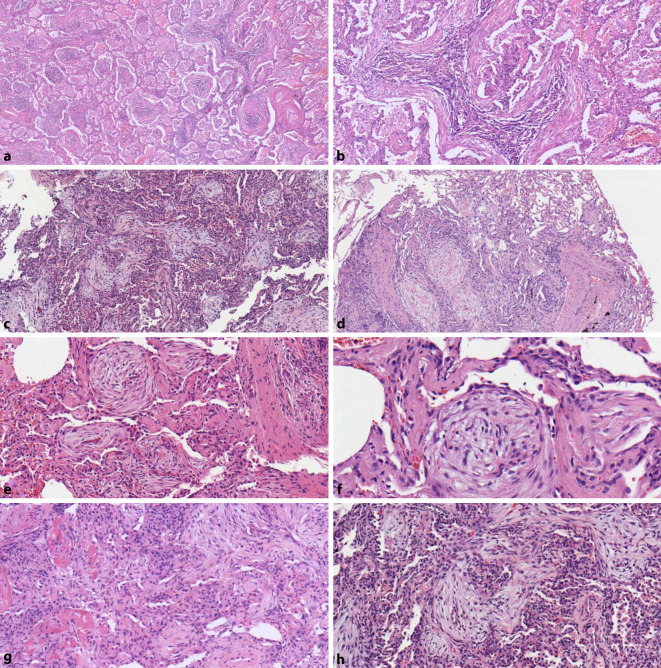
Histologisches Leitmerkmal der OP sind Myofibroblastenproliferate (Masson-Körper) in Form zopfartiger Mesenchymknospen, welche die Alveolen zum Teil vollständig ausfüllen (vgl. Abb. 2). Hierbei handelt es sich um Granulationsgewebe aus spindelzelligem, fibromyxoidem Bindegewebe. Die Mesenchymknospen folgen dem Verlauf der Alveolarlichtungen und der respiratorischen Bronchioli. Sie bilden rundliche und ovale Zapfen in den Alveolen und können sich entlang der Alveolen in gewundenen Strukturen verzweigen. Schon in der Übersicht lassen sich diese Myofibroblastenproliferate gut erkennen, da die natürliche Struktur der Alveolarräume erhalten bleibt [22, 23]. Die intraalveoläre Lokalisation ist auch das wichtigste Unterscheidungsmerkmal der Mesenchymknospen der OP gegenüber den Fibroblastenfoci der UIP (vgl. Differenzialdiagnosen). Bislang ist die Pathophysiologie der Mesenchymknospen nicht endgültig geklärt. Der OP und der UIP gemeinsam ist eine mehr oder weniger defekte Wundheilung. Eine Verletzung von Alveolarepithelien führt zum Austritt von Fibrin und zum Einwandern von Entzündungszellen. Fibroblasteneinsprossungen aus den Alveolarsepten bilden im nächsten Schritt ein umgebendes Fasernetzwerk. Im weiteren Verlauf der Organisation entwickelt sich Granulationsgewebe mit Myofibroblasten sowie z. T. auch Kapillargefäßen zu dem charakteristischen Erscheinungsmuster der Mesenchymknospen [3]. Je nach Stadium ergeben sich somit unterschiedliche histologische Bilder mit einem variablen Entzündungszellinfiltrat aus Lymphozyten, Plasmazellen und Makrophagen innerhalb dieser Knospen. Zu einem frühen Zeitpunkt der Erkrankung können zusätzlich chronisch-entzündlich durchsetzte Fibrinexsudate in den Alveolen zu finden sein, welche von den hyalinen Membranen der DAD abgegrenzt werden müssen (vgl. Differenzialdiagnosen), oder auch schaumzellige Makrophagen [15]. Als eine Art Zwischenform von DAD und OP ist die akute fibrinöse und organisierende Pneumonie (AFOP) zu erwähnen. Hier finden sich neben intraalveolären Fibrinansammlungen (sogenannte Fibrinbälle) zusätzlich lockere Fibroblastenproliferate der OP in einem fleckförmigen Verteilungsmuster [20].
Die Veränderungen der OP sind entlang der respiratorischen Bronchiolen und peribronchial lokalisiert und werden zusätzlich von einem variablen, meist nur schwachen bis mäßigen interstitiellen Entzündungszellinfiltrat aus Lymphozyten und Plasmazellen begleitet. Typischerweise ist die Lunge fleckförmig befallen mit dazwischen gelegenen Arealen von regelhaftem Lungenparenchym. Selten kann auch ein diffuser, flächiger Befall der Lunge vorliegen [23].
Es ist wichtig zu betonen, dass das histologische Bild der OP lediglich ein spezifisches Muster beschreibt. Die Differenzierung einer COP von einer sekundären OP erfolgt dann durch den Nachweis zusätzlicher histologischer Charakteristika (vgl. sekundäre OP), wie zum Beispiel den Nachweis von Granulomen und mehrkernigen Riesenzellen als Zeichen einer Hypersensitivitätspneumonie. Alternativ müssen für die finale Diagnose einer COP alternative Ursachen eines OP-Musters unter Kenntnis der pathologischen, radiologischen und klinischen Befunde ausgeschlossen werden. Dementsprechend sollte im pathologischen Befundbericht bei ausschließlichem Vorliegen eines OP-Musters und ohne Kenntnis weiterer klinischer, anamnestischer oder bildgebender Informationen zur Genese dann der Terminus OP/COP verwendet werden [26].
Differenzialdiagnosen
Die UIP ist wahrscheinlich die wichtigste Differenzialdiagnose der OP aufgrund ihres deutlichen Unterschieds hinsichtlich Therapie und Prognose. In Lungenteilresektaten und größeren Biopsien solle die Differenzierung keine Schwierigkeiten bereiten. Durch das zwar fleckförmige, aber in sich homogene Bild der OP ohne eine zeitliche Heterogenität und mit erhaltener Grundstruktur des Lungenparenchyms unterscheidet sie sich in der Regel schon in der Übersicht deutlich von einer UIP. Schwieriger ist die Interpretation bei kleinen bzw. gequetschten Biopsien, in denen nur einzelne Merkmale der beiden IIPs repräsentiert sind. OP und UIP sind beide gekennzeichnet durch Fibroblastenproliferate mit einem bisweilen sehr ähnlichen histologischen Erscheinungsbild (vgl. Abb. 3). Unterschiedlich ist jedoch ihre Lokalisation. Die Mesenchymknospen der OP liegen in den Alveolen und respiratorischen Bronchioli und zeigen nur abschnittsweise eine Verbindung zu benachbarten Alveolarsepten. Im Gegensatz hierzu befinden sich die Fibroblastenfoci der UIP im Interstitium und sind dementsprechend durch Typ-2-Pneumozyten überkleidet. Leider hat sich dies nicht als diagnostisches Unterscheidungskriterium einer OP von einer UIP bewährt, da auch Mesenchymknospen der OP häufig im Verlauf eine sekundäre Überkleidung durch Typ-2-Pneumozyten zeigen (vgl. Abb. 2f). Somit ist auch eine CK7- oder TTF1-Färbung zur Unterscheidung von Fibroblastenfoci und Mesenchymknospen nicht hilfreich. Tab. 1 gibt eine Übersicht der Charakteristika, welche auch im Falle von kleinen Biopsien bei der korrekten Unterscheidung von Mesenchymknospen der OP und Fibroblastenfoci der UIP unterstützen können. Wichtig hierbei ist zu betonen, dass es zwar legitim ist, eine OP auch an kleinen Lungengewebefragmenten zu diagnostizieren, die Diagnose eines UIP-Musters sollte im Gegensatz hierzu jedoch ausschließlich an größeren Gewebeproben wie Kryobiopsaten oder Lungenteilresektaten, erfolgen.
| OP | UIP | |
|---|---|---|
| Veränderungsmuster | ||
| Fleckförmige Verteilung | Ja | Ja |
| Zeitliche Heterogenität | Nein | Ja |
| Fibroblastenproliferate | ||
| Verteilung | Flächig | Einzeln |
| Lokalisation | Intraalveolär | Interstitiell |
| Form | Polypoid | Kuppelartig |
| Entzündung | Unterschiedlich, plasmazellreich | Unterschiedlich, eher wenig |
Eine weitere differenzialdiagnostische Schwierigkeit kann der DAD in organisierender Phase darstellen. Zu diesem Zeitpunkt liegen die für den DAD typischen hyalinen Membranen allenfalls nur noch vereinzelt vor. Dagegen sind in den Alveolarsepten Fibroblastenproliferate zu finden, welche zu Verwechslungen mit den Mesenchymknospen der OP führen können. Histologisch hilft hier der fokale Nachweis von hyalinen Membranen weiter, welche für den DAD diagnostisch sind. Ferner sind die Veränderungen des DAD im Stadium der Organisation durch meist längliche, in den Septen verzweigte Fibroblastenproliferate charakterisiert, die in aller Regel nicht bis in die Alveolarräume hineinreichen. Weiteren Aufschluss geben klinische und radiologische Informationen, wie ein Z. n. Beatmung oder eine diffuse Veränderung beider Lungen in der Bildgebung [22].
Eine differenzialdiagnostische Herausforderung kann das NSIP (nichtspezifische interstitielle Pneumonie)/OP-Überlappungsmuster darstellen. Hier findet sich histologisch, neben intraalveolären Mesenchymknospen der OP, eine räumlich und zeitlich homogene alveolarseptale Fibrose mit interstitieller Entzündung entsprechend eines NSIP-Musters [11]. Hilfreich für die Abgrenzung einer OP von einem NSIP/OP-Überlappungsmuster ist dann die radiologische Bildgebung. Während Konsolidierungen eher für eine OP sprechen, sind Milchglastrübungen, Retikulationen und Traktionsbronchiektasen in differenzialdiagnostisch schwierigen Fällen hinweisende Veränderungen für ein NSIP/OP-Überlappungsmuster [25].
Therapie und Prognose
Die COP ist glukokortikoidsensitiv und hat eine sehr gute Prognose. Therapeutisch werden orale oder auch venöse Kortikosteroide mit konstanter Initialdosis für 4–8 Wochen eingesetzt, gefolgt von einem langsamen Ausschleichen über 3–12 Monate. COP-Patienten sollten ein schnelles Ansprechen (innerhalb von Tagen) auf die Therapie zeigen. Rezidive sind häufig (13–58 %) und entstehen in der Regel bei Beendigung der Therapie. Sie haben allerdings keinen Einfluss auf die exzellente Prognose der COP. Aber sie legen ein enges klinisches und radiologisches Monitoring der Patienten während der Therapiephase nahe. Zusätzlich sollten ein Rezidiv oder ein fehlendes Ansprechen auf Glukokortikoide Anlass geben, die Diagnose einer COP noch einmal genau zu überprüfen und andere Ursachen einer OP sicher auszuschließen. Die fokale COP in Form eines umschriebenen Lungenrundherds bedarf keiner weiteren Therapie nach Exzision [3, 6].
Sekundäre OP
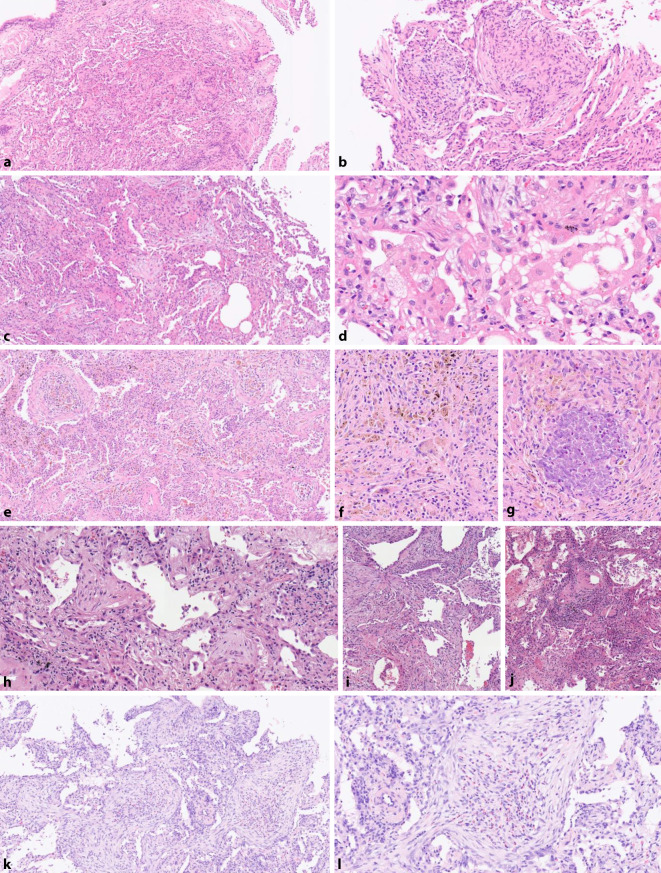
Sekundäre OP umfassen eine heterogene Gruppe unterschiedlicher infektiöser und nichtinfektiöser Erkrankungen, deren Gemeinsamkeit das radiologische und histologische OP-Muster ist. In vergleichenden Studien sind COPs in der Regel etwas häufiger vertreten als sekundäre OPs (ca. 2/3 zu 1/3) [2, 9, 21]. Signifikante Unterschiede hinsichtlich Patientencharakteristika sowie klinischen Symptomen und ihre Schweregrade finden sich jedoch nicht zwischen den beiden Formen. Auch die radiologische Bildgebung kann häufig nicht weiter zwischen den beiden Gruppen differenzieren, wobei Baha et al. in ihrer Studie angeben, dass Lungenveränderungen in Patienten mit sekundärer OP häufiger in zentralen und mittleren Lungenabschnitten zu finden sind [2]. Drakopanagiotakis et al. fanden in ihrer vergleichenden Analyse neben Unterschieden in der Blutserumanalyse (z. B. höherer Kalium‑, Natriumgehalt, höhere Thrombozytenkonzentration etc.) in der BAL von Patienten mit einer sekundären OP häufiger eine Lymphozytose [9]. Diesbezüglich sind aber sicherlich weder radiologische noch laborchemische Parameter allein geeignet zwischen den beiden Formen der OP zu unterscheiden. COPs und sekundäre OPs sind in der Regel beide glukokortikoidsensitiv, wobei nach einer Studie von Lohr et al. Therapieansprechen und Prognose bei COPs besser ist [21]. Hier stellt bei sekundären OPs sicherlich die jeweils assoziierte Grunderkrankung den entscheidenden Faktor dar bezüglich Therapieverhalten und Langzeitüberleben. Tab. 2 enthält eine Zusammenfassung der wichtigsten Ursachen einer sekundären OP, deren histologische Charakteristika und relevante Unterschiede hinsichtlich Therapie und Prognose. Neben erregerbedingten Ursachen (diverse Bakterien, Pilze, Viren) spielen exogene Noxen wie zahlreiche Medikamente oder ionisierende Strahlung eine Rolle. Eine Reihe primärer pulmonaler Erkrankungen (z. B. Aspirationspneumonien, Tumore, Granulomatose mit Polyangiitis/Wegener-Granulomatose) können ein OP-Muster zeigen. Zusätzlich kann sich ein OP-Muster bei anderen IIPs finden, wie bei einer akuten Exazerbation einer UIP, was bei kleinen Biopsien schwer von einem NSIP-Muster zu unterscheiden sein kann. Zuletzt gibt es zahlreiche primär nicht pulmonale Krankheiten, z. B. hämatologische Neoplasien oder Erkrankungen aus dem rheumatischen Formenkreis, welche sich unter anderem auch durch eine OP manifestieren können [7]. Wichtig zu erwähnen sind hier insbesondere systemische Bindegewebserkrankungen (Kollagenosen), die bei pulmonaler Beteiligung neben einem OP-Muster unter anderem auch ein NSIP/OP-Überlappungsmuster zeigen können im Rahmen einer interstitiellen Pneumonie mit autoimmunen Eigenschaften („interstitial pneumonia with autoimmune features“, IPAF) [12]. In der Zusammenschau kann die Histologie nur in einem Teil der Fälle bei der korrekten Entitätszuordnung helfen (Abb. 4). Wichtige Hilfestellung für den betreuenden Kliniker kann der Pathologe zum Beispiel durch das Erkennen einer Hypersensitivitätspneumonie oder einer Aspirationspneumonie geben. In der Regel ist für die abschließende Einordnung einer sekundären OP die enge Korrelation mit den klinischen und anamnestischen Befunden sowie der Bildgebung notwendig. Dies ist relevant, da sich unterschiedliche Formen der sekundären OP deutlich hinsichtlich ihrer Therapiestrategie und ihrer Prognose unterscheiden.
| Ursachen | Details | Anmerkungen |
|---|---|---|
| Infektiös | Erreger | – |
| Bakterien | Streptococcus pneumoniae, atypische Mykobakterien (Mycobacterium avium), Actinomyces israelii, Chlamydia pneumoniae, Coxiella burnetii, Legionella pneumophila, Mycoplasma pneumonia, Nocardia asteroides, Staphylococcus aureus, Serratia marcescens, Pseudomonas aeruginosa |
Häufige Ursache eines OP-Musters bei länger zurückliegender, nicht mehr aktiver Infektion mit inkompletter Remission Korrelation zu Anamnese und laborchemischen Parametern (Antikörpertiter) |
| Viren | HIV, Influenza, Parainfluenza, Herpes, HCV, SARS-CoV‑2 | Korrelation zu klinischen und laborchemischen Parametern |
| Parasiten | Plasmodium vivax | – |
| Pilze | Cryptococcus neoformans, Penicillium janthinellum, Pneumocystis jiroveci (bei AIDS) | Pilznachweis mit Sonderfärbungen (PAS, Versilberung), Korrelation Mikrobiologie oder Erregernachweis am Paraffinmaterial durch PCR |
| Exogene Noxen | Auslöser | – |
| Medikamente | www.pneumotox.com, aktuell mit 114 Kausalmedikamenten, z. B.: Amiodaron, Nitrofurantoin, Bleomycin, Chemotherapeutika, Immuncheckpoint-Inhibitoren | Klinische Korrelation notwendig → Besserung nach Absetzen? |
| Bei Chemotherapeutika und Immuncheckpoint-Inhibitoren Ausschluss Malignität bzw. Tumorprogress | ||
| Inhalative Noxen | Kokain, E‑Zigaretten, NO, Ammoniak | Klinische Korrelation |
| Bestrahlung | v. a. 3–6 Monate nach Brustbestrahlung in 2,5 % der Mammakarzinompatienten mit Radiatio | Kann außerhalb des Bestrahlungsfensters liegen und ist GK-sensitiv ↔ Abgrenzung zur Strahlenpneumonitis |
| Systemische Erkrankungen und Begleitreaktionen bei anderen Organerkrankungen | Grunderkrankung | – |
| Kollagenosen | v. a. rheumatoide Arthritis, Dermatomyositis/Polymyositis, aber auch SLE, CREST-, Sjögren-Syndrom | Klinische Korrelation |
| CED u. ähnl. | UC, MC, PBC | Klinische Korrelation, andere Organbefunde |
| Transplantation | Lunge, Leber, Knochenmark | Z. B. bei akuter Abstoßung n. Lungentransplantation |
| Hämatologische Neoplasien | Z. B. bei Hodgkin und Non-Hodgkin-Lymphomen, AML, MDS | V. a. nach Chemotherapie und Knochenmarkstransplantation |
| Begleiterscheinung bei anderen pulmonalen Erkrankungen | – | – |
| Malignom, Abszess, Infarkt, Pilzinfektion (z. B. Aspergillom) | Randbereich eines Herdes mit umgebender OP als Begleitreaktion | Achtung vor falsch benignen Ergebnissen bei V. a. BC → Korrelation mit Radiologie und ggf. erneute Probenentnahme |
| Granulomatose mit Polyangiitis (GPA, Wegener-Granulomatose) | 2 Formen: | Zusätzlich Fibrose mit chronischer, granulomatöser Entzündung, Riesenzellen und nekrotisierender Vaskulitis |
| GPA mit Nekrosen und Aspekten einer OP | ||
| BOOP-artige Granulomatose mit minimalen bzw. keinen Nekrosen | ||
| Aspirationspneumonie | Häufige Ursache einer OP, klinisch oft nicht bekannt | Peribronchiales Verteilungsmuster, Fremdkörpergranulome mit mehrkernigen Riesenzellen (polarisationsoptischer Nachweis von z. B. Nahrungsbestandteilen) und Neutrophile |
| Hypersensitivitätspneumonitis | OP mit: | Erkennen der histologischen Merkmale als wichtiger Beitrag zur korrekten Einordnung |
| Chronischer interstitieller Entzündung | ||
| Nichtnekrotisierenden Epitheloidzellgranulomen | ||
| Mehrkernige Riesenzellen | ||
| IIP mit OP | Histologie | – |
| UIP | DAD- oder OP-Muster bei akuter Exazerbation einer bekannten UIP oder bei Erstdiagnose mit akutem Lungenversagen | Suche nach präexistentem UIP-Muster (Fibrose, Honigwabenmuster) |
| Sonderformen der OP | Histologie | – |
| Akute fibrinöse und OP (AFOP) | OP mit intraalveolären Fibrinpropfen mit fleckförmiger Verteilung und Typ-2-Pneumozyten-Hyperplasie | Ähnliche Klinik wie DAD, aber histologisch keine hyalinen Membranen |
| Langzeitveränderung bei SARS-CoV‑2 | ||
| Fibrosierende COP | Seltene Erkrankung mit OP und interstitieller Fibrose | Progredientes Atemversagen, reagiert nicht auf GK |
| Akute fulminante COP | OP-Muster ohne Fibrose | Klinisch wie ARDS mit akutem Atemwegsversagen, in der Regel GK-sensitiv |
| Chronische eosinophile Pneumonie mit OP | Überschneidungssyndrom von chronischer eosinophiler Pneumonie und OP mit intraalveolärer Ansammlung von Eosinophilen und OP-Muster | Ursachen: idiopathisch, infektiös, medikamentös, Immunreaktion, GK-sensitiv |
AML akute myeloische Leukämie, ARDS „acute respiratory distress syndrome“, BC Bronchialkarzinom, BOOP Bronchiolitis obliterans mit organisierender Pneumonie, CED chronisch entzündliche Darmerkrankung, COP kryptogen organisierende Pneumonie, DAD diffuser Alveolarschaden, IIP interstitielle idiopathische Pneumonie, GK Glukokortikoide, MC Morbus Crohn, MDS myelodysplastisches Syndrom, OP organisierende Pneumonie, PBC primäre biliäre Zirrhose, SLE systemischer Lupus erythematodes, UC Colitis ulcerosa, UIP gewöhnliche interstitielle Pneumonie
Fazit für die Praxis
Die organisierende Pneumonie (OP) ist ein histologisches Muster, welches idiopathisch als kryptogen organisierende Pneumonie (COP) auftreten kann oder sekundär im Rahmen einer Reihe von pulmonalen und nichtpulmonalen Grunderkrankungen.
Die COP wird zu den idiopathischen interstitiellen Pneumonien (IIP) nach ATS/ERS-Leitlinien gezählt.
Das histologische Hauptmerkmal der OP sind intraalveoläre Mesenchymknospen.
Wichtigste Differenzialdiagnose ist die gewöhnliche interstitielle Pneumonie (UIP) mit intraseptalen Fibroblastenfoci.
Die COP ist glukokortikoidsensitiv und hat eine exzellente Prognose.
Die Histologie kann bei der korrekten Zuordnung einer sekundären OP eine wichtige Rolle spielen.
Einhaltung ethischer Richtlinien
Interessenkonflikt
R. Krupar, C. Kümpers, A. Haenel, S. Perner und F. Stellmacher geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.American Thoracic Society. European Respiratory Society American thoracic society/European respiratory society international multidisciplinary consensus classification of the idiopathic interstitial pneumonias. This joint statement of the American thoracic society (ATS), and the European respiratory society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS executive committee, June 2001. Am J Respir Crit Care Med. 2002;165:277–304. doi: 10.1164/ajrccm.165.2.ats01. [DOI] [PubMed] [Google Scholar]
- 2.Baha A, Yıldırım F, Köktürk N, et al. Cryptogenic and secondary organizing pneumonia: clinical presentation, radiological and laboratory findings, treatment, and prognosis in 56 cases. Turk Thorac J. 2018;19:201–208. doi: 10.5152/TurkThoracJ.2018.18008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Chandra D, Maini R, Hershberger DM. Cryptogenic organizing pneumonia. Treasure Island (FL): StatPearls Publishing; 2020. [PubMed] [Google Scholar]
- 4.Cordier JF, Loire R, Brune J. Idiopathic bronchiolitis obliterans organizing pneumonia. Definition of characteristic clinical profiles in a series of 16 patients. Chest. 1989;96:999–1004. doi: 10.1378/chest.96.5.999. [DOI] [PubMed] [Google Scholar]
- 5.Costabel U, Guzman J. BOOP: what is old, what is new? Eur Respir J. 1991;4:771–773. [PubMed] [Google Scholar]
- 6.Cottin V, Cordier J-F. Cryptogenic organizing pneumonia. Semin Respir Crit Care Med. 2012;33:462–475. doi: 10.1055/s-0032-1325157. [DOI] [PubMed] [Google Scholar]
- 7.Daniels CE, Myers JL, Utz JP, et al. Organizing pneumonia in patients with hematologic malignancies: a steroid-responsive lesion. Respir Med. 2007;101:162–168. doi: 10.1016/j.rmed.2006.03.035. [DOI] [PubMed] [Google Scholar]
- 8.Davison AG, Heard BE, McAllister WA, Turner-Warwick ME. Cryptogenic organizing pneumonitis. Q J Med. 1983;52:382–394. [PubMed] [Google Scholar]
- 9.Drakopanagiotakis F, Paschalaki K, Abu-Hijleh M, et al. Cryptogenic and secondary organizing pneumonia: clinical presentation, radiographic findings, treatment response, and prognosis. Chest. 2011;139:893–900. doi: 10.1378/chest.10-0883. [DOI] [PubMed] [Google Scholar]
- 10.Elicker BM, Webb WR. Fundamentals of high-resolution lung CT: common findings, common patterns, common diseases, and differential diagnosis. 1. Philadelphia, PA: Lippincott Williams & Wilkins; 2013. [Google Scholar]
- 11.Enomoto N, Sumikawa H, Sugiura H, et al. Clinical, radiological, and pathological evaluation of “NSIP with OP overlap” pattern compared with NSIP in patients with idiopathic interstitial pneumonias. Respir Med. 2020;174:106201. doi: 10.1016/j.rmed.2020.106201. [DOI] [PubMed] [Google Scholar]
- 12.Fischer A, Antoniou KM, Brown KK, et al. An official European respiratory society/American thoracic society research statement: interstitial pneumonia with autoimmune features. Eur Respir J. 2015;46:976–987. doi: 10.1183/13993003.00150-2015. [DOI] [PubMed] [Google Scholar]
- 13.Gudmundsson G, Sveinsson O, Isaksson HJ, et al. Epidemiology of organising pneumonia in Iceland. Thorax. 2006;61:805–808. doi: 10.1136/thx.2006.059469. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Izumi T, Kitaichi M, Nishimura K, Nagai S. Bronchiolitis obliterans organizing pneumonia. Clinical features and differential diagnosis. Chest. 1992;102:715–719. doi: 10.1378/chest.102.3.715. [DOI] [PubMed] [Google Scholar]
- 15.Katzenstein A-LA. Diagnostic atlas of non-neoplastic lung disease: a practical guide for surgical pathologists. 1. New York, NY: DEMOS HEALTH; 2016. [Google Scholar]
- 16.Kim SJ, Lee KS, Ryu YH, et al. Reversed halo sign on high-resolution CT of cryptogenic organizing pneumonia: diagnostic implications. AJR Am J Roentgenol. 2003;180:1251–1254. doi: 10.2214/ajr.180.5.1801251. [DOI] [PubMed] [Google Scholar]
- 17.King TE, Mortenson RL. Cryptogenic organizing pneumonitis. The North American experience. Chest. 1992;102:8S–13S. doi: 10.1378/chest.102.1.8S. [DOI] [PubMed] [Google Scholar]
- 18.Kligerman SJ, Franks TJ, Galvin JR. From the radiologic pathology archives: organization and fibrosis as a response to lung injury in diffuse alveolar damage, organizing pneumonia, and acute fibrinous and organizing pneumonia. Radiographics. 2013;33:1951–1975. doi: 10.1148/rg.337130057. [DOI] [PubMed] [Google Scholar]
- 19.Lange W. Ueber eine eigenthumliche Erkrankung der kleinen Bronchien und Bronchiolen (Bronchitis et Bronchiolits Obliterans) Dtsch Arch Klin Med. 1901;70:342–364. [Google Scholar]
- 20.Leslie KO, Wick MR. Practical pulmonary pathology: a diagnostic approach. 2011. [Google Scholar]
- 21.Lohr RH, Boland BJ, Douglas WW, et al. Organizing pneumonia. Features and prognosis of cryptogenic, secondary, and focal variants. Arch Intern Med. 1997;157:1323–1329. doi: 10.1001/archinte.157.12.1323. [DOI] [PubMed] [Google Scholar]
- 22.Mukhopadhyay S (2016) Non-neoplastic pulmonary pathology with online resource, 1. Aufl. Cambridge University Press,
- 23.Perner S, Stellmacher F, Jongik D, Rabe K‑F (2018) Nicht-neoplastische/interstitielle Lungenerkrankungen. Internationale Akademie für Pathologie Deutsche Abteilung e .V., Herbsttutorial 2018:516
- 24.Poletti V, Cazzato S, Minicuci N, et al. The diagnostic value of bronchoalveolar lavage and transbronchial lung biopsy in cryptogenic organizing pneumonia. Eur Respir J. 1996;9:2513–2516. doi: 10.1183/09031936.96.09122513. [DOI] [PubMed] [Google Scholar]
- 25.Todd NW, Marciniak ET, Sachdeva A, et al. Organizing pneumonia/non-specific interstitial pneumonia overlap is associated with unfavorable lung disease progression. Respir Med. 2015;109:1460–1468. doi: 10.1016/j.rmed.2015.09.015. [DOI] [PubMed] [Google Scholar]
- 26.Travis WD, Costabel U, Hansell DM, et al. An official American thoracic society/European respiratory society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med. 2013;188:733–748. doi: 10.1164/rccm.201308-1483ST. [DOI] [PMC free article] [PubMed] [Google Scholar]