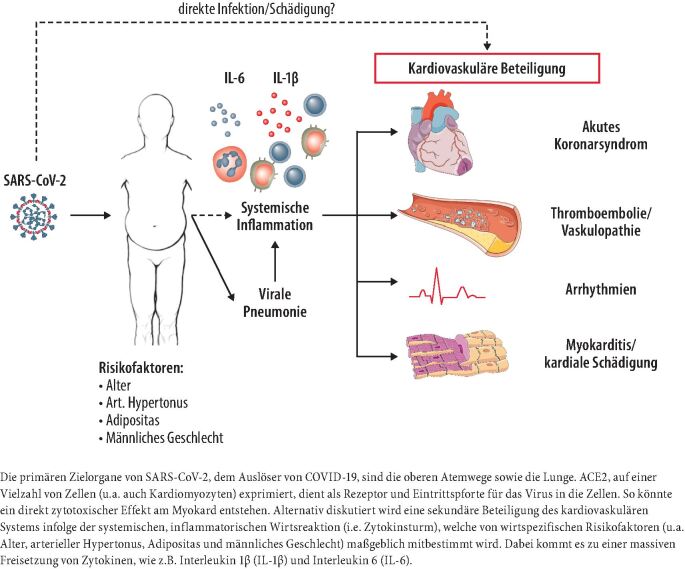
COVID-19 ist eine Multisystemerkrankung mit kardiovaskulärer Beteiligung. Der Schweregrad des klinischen Verlaufs wird mitbestimmt durch Grunderkrankungen, wobei der entscheidende Amplifikator für kardiovaskuläre Manifestationen systemische, inflammatorische Prozesse zu sein scheinen. Therapeutische Optionen sind begrenzt, und über die Langzeitfolgen ist noch wenig bekannt.
SARS-CoV-2, der Auslöser von COVID-19 mit Ursprung im chinesischen Wuhan, hat bis November 2020 weltweit mehr als 45 Mio. Menschen infiziert und mehr als 1 Mio. Todesfälle gefordert [1]. Nachdem zunächst wenig bekannt war, begreift man COVID-19 zunehmend als Multiorganerkrankung unterschiedlicher Ausprägung.
SARS-CoV-2 verschafft sich Eintritt in Wirtszellen durch Bindung an das Angiotensin Converting Enzyme 2 (ACE2) [2], welches auf einer Vielzahl von Zellen, z. B. Pneumozyten, Kardiomyozyten und Enterozyten exprimiert wird. Als Folge können zytotoxische Effekte auftreten. Der klinische Verlauf scheint jedoch maßgeblich von der Schwere der immunologischen Wirtsreaktion bestimmt zu werden. Entsprechend wurden insbesondere bei Menschen mit einer dysregulierten und überschießenden generalisierten Immunreaktion, z. B. im höheren Lebensalter [3], bei vorbestehenden chronisch-entzündlichen Grunderkrankungen [4] sowie bei genetisch bedingten Wirtsfaktoren [5] sehr schwere Krankheitsverläufe beobachtet.
Die Beobachtung, dass systemische Therapien mit immunmodulatorischem bzw. antiinflammatorischem Ansatz [6] mit einem günstigen Einfluss auf Krankheitsverlauf und Überleben assoziiert sein könnten, erscheint somit plausibel.
Kardiale Beteiligung
Kardiovaskuläre Erkrankungen spielen eine besondere Rolle in der COVID-19-Pandemie: Sie sind einerseits Risikofaktoren für einen schweren Verlauf [7], andererseits können sie als Folge der Erkrankung auftreten. Eine kardiale Schädigung oder Mitbeteiligung wurde bei bis zu 17% der hospitalisierten und bei bis zu 31% der Patienten, die auf einer Intensivstation behandelt werden mussten, beschrieben [3, 8]. Erhöhte kardiale Biomarker lassen selbst bei oligosymptomatischen und nicht hospitalisierten Patienten eine höhere Rate an kardialen Manifestationen vermuten [9]. Erhöhtes Troponin T/I wurde bereits frühzeitig mit einer erhöhten Mortalität assoziiert, wobei diese Beobachtung unabhängig vom Vorliegen kardiovaskulärer Grunderkrankungen war [10].
COVID-19-assoziierte Myokarditis?
Obwohl Kardiomyozyten ACE2 exprimieren und ein direkter zytotoxischer Effekt am Myokard plausibel erscheint, ist es bislang nicht gelungen, Viruspartikel oder das SARS-CoV-2-Genom in Kardiomyozyten nachzuweisen. In Fallberichten wurden Viruspartikel in interstitiellen Zellen des Myokards detektiert [11]. Autopsieproben eines Hamburger Kollektivs haben ferner gezeigt, dass trotz Nachweis von SARS-CoV-2-RNA in myokardialem Gewebe histopathologisch keine klare Diagnose einer Myokarditis gestellt werden konnte [12]. Ob die myokardiale Manifestation eine Folge direkter Virustoxizität an Kardiomyozyten oder der immunologischen Wirtsreaktion ist, wird aktuell untersucht.
Zur Myokarditis im Rahmen von COVID-19 liegen mehrheitlich nur Fallberichte vor [13, 14]. Die klinische Symptomatik ist heterogen und umfasst u. a. Angina pectoris, Dyspnoe, Fieber, trockenen Husten und Abgeschlagenheit. EKG, laborchemische und bildgebende Verfahren können Auffälligkeiten zeigen, die höchste Spezifität in der Bildgebung einer Myokarditis hat die kardiale MRT [15]. Kardiale Arrhythmien wurden im Rahmen von COVID-19 beschrieben [16], wobei die Pathophysiologie bislang ungeklärt ist. Therapeutische Maßnahmen beinhalten eine leitliniengerechte Herzinsuffizienztherapie und ggf. kreislaufunterstützende Maßnahmen bei fulminantem Verlauf [15].
Über Langzeitfolgen von COVID-19 ist bislang wenig bekannt. Erste Untersuchungen zeigen im kurz- bis mittelfristigen Verlauf bildmorphologisch eine persistierende kardiale Beteiligung bei bis zu 78% der Patienten mit überstandener COVID-19-Erkrankung, unabhängig von (kardiovaskulären) Vorerkrankungen oder vom Schweregrad der Erkrankung [9].
Akutes Koronarsyndrom
Für Influenzainfektionen wurde gezeigt, dass sie durch die systemische Inflammation [17] das Risiko eines akuten Myokardinfarktes deutlich erhöhen können [18]. Ein weiterer denkbarer Mechanismus ist die Dysbalance zwischen kardialer Reserve und metabolischem Bedarf bei einer schweren Infektion. Hier kommt es, v .a. bei einer vorbestehenden kardiovaskulären Grunderkrankung, zu einer relativen Koronarinsuffizienz [19]. In Autopsien von an COVID-19 verstorbenen Patienten wurden Myokardinfarkte diagnostiziert [3].
Paradoxerweise wurde weltweit [20] und in Deutschland [21] zu Beginn der Pandemie eine erniedrigte Inzidenz von akuten Koronarsyndromen beobachtet. Bisher ist unklar, ob die Angst vor einer potenziellen Infektion mit SARS-CoV-2 im Krankenhaus oder eine tatsächliche Reduktion der Inzidenz von akuten Koronarsyndromen hierfür ursächlich ist [21]. Denkbar wäre auch eine Reduktion alltagsbedingter Stressoren während des Lockdowns im Frühjahr 2020 [21]. Die Bevölkerung sollte auf alle Fälle darüber informiert werden, dass auch während der Pandemie eine sichere Versorgung in Brustschmerzambulanzen gewährleistet ist.
Systemische Inflammation und thrombotische Dysregulation
Bedingt durch eine überschießende Aktivierung des Gerinnungssystems [22] entwickeln Patienten mit schwerem Krankheitsverlauf oft unentdeckte venöse (und arterielle) thromboembolische Komplikationen, z. B. eine tiefe Beinvenenthrombose oder Lungenarterienembolie [23, 24]. Insbesondere bei Patienten mit schwerem Verlauf wurde eine exzessive Aktivierung von Thrombozyten und neutrophilen Granulozyten in mehreren Organen, u. a. im Herz beobachtet [25]. So sind erhöhte D-Dimere, eine moderate Thrombopenie und eine verlängerte Prothrombinzeit zu beobachten [22], wobei die Thrombopenie geringer und der D-Dimer-Anstieg stärker ausgeprägt ist als z. B. bei Sepsis anderer Genese. Diese immunothrombotische Dysregulation bei COVID-19 scheint ein zentraler Ausdruck der Erkrankungsschwere zu sein [25] und könnte der Beobachtung eines erhöhten Sterblichkeitsrisikos bei Patienten mit COVID-19 und Koagulopathie zugrunde liegen.
Bei COVID-19 hat sich ein Überlebensvorteil mit Antikoagulation gezeigt [26, 27]. Daher wird bei hospitalisierten Patienten ohne Kontraindikation eine prophylaktische Antikoagulation (z. B. mit niedermolekularen Heparinen [NMH]) empfohlen [22].
Medikation - protektiv oder schädlich?
Nachdem ACE2 als Rezeptor für SARS-CoV-2 identifiziert wurde [2], bestand die Sorge, dass insbesondere Hemmer des Renin-Angiotensin-Aldosteron-Systems (RAAS-Blocker), die experimentell mit einer gesteigerten Expression von ACE2 assoziiert wurden [28], oder Statine und Metformin das Erkrankungsrisiko sowie das Risiko für einen deletären Verlauf erhöhen könnten [29, 30, 31]. Mehrere Beobachtungsstudien und eine prospektive Analyse konnten indes zeigen, dass diese Medikamente nicht mit einer erhöhten Mortalität assoziiert sind [32, 33, 34] und ein Absetzen mit einer erhöhten Mortalität einhergehen kann [29, 30, 32, 35].
Therapeutische Optionen sind im Wesentlichen auf eine supportive Therapie begrenzt. Lediglich für Remdesivir und Dexamethason konnte ein Nutzen gezeigt werden. So wurde bei hospitalisierten Patienten in der Frühphase der Erkrankung durch Remdesivir eine Verkürzung des Krankheitsverlaufes beobachtet [36]. Für Dexamethason wurde bei sauerstoffpflichtigen bzw. beatmeten Patienten ein günstiger Effekt auf das Überleben gezeigt [6].

Autoren: Dr. med. Alexander Dutsch, Dr. med. Katharina Lechner.
Klinik für Herz- und Kreislauferkrankungen, Deutsches Herzzentrum München, Technische Universität München, München; DZHK e.V. (German Centre for Cardiovascular Research), Partner site Munich Heart Alliance, München
Prof. Dr. med. Heribert Schunkert.
Klinik für Herz- und Kreislauferkrankungen, Deutsches Herzzentrum München, Technische Universität München, Lazarettstraße 36, D-80636 München DZHK e.V. (German Centre for Cardiovascular Research), Partner site Munich Heart Alliance, München, E-Mail: schunkert@dhm.mhn.de
Fazit für die Praxis.
Insbesondere bei Patienten nach schwerem klinischen Verlauf von COVID-19 sowie bei Patienten mit persistierenden Beschwerden bietet sich eine kardiologische Verlaufsbeurteilung an, um im wenig wahrscheinlichen Fall einer nachhaltigen kardialen Funktionseinschränkung eine protektive Therapie (bspw. leitliniengerechte medikamentöse Herzinsuffizienztherapie) einzuleiten.
Electronic supplementary material
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.