Abstract
Die idiopathische Lungenfibrose (IPF) kommt bei jungen Menschen nicht vor. Es überrascht daher wenig, dass die 9 Kennzeichnen des biologischen Alters sich allesamt in der Pathogenese der IPF wiederfinden lassen. Damit verbunden, gerät bei IPF die Homöostase von Synthese, Degradierung und Recycling zellulärer Proteine aus dem Gleichgewicht, sodass bei einer akuten Schädigung die Reparatur fehlgeleitet wird. Auch bei SARS-CoV-2-Infektionen werden die schweren COVID-19-Pneumonien im Alter gesehen. Hier spielt die zelluläre Lungenalterung ebenfalls eine Rolle. Zusätzlich ist aber auch die Alterung des Immunsystems von herausragender Bedeutung. Die Immunseneszenz geht mit einem Verlust an naiven T‑Zellen einher. Außerdem gibt es einen geschlechtsspezifischen Unterschied mit Verlust von B‑Zellen bei Männern, was die schlechteren COVID-19-Verläufe bei älteren Männern erklärt.
Schlüsselwörter: SARS-CoV‑2, Pandemie, Interstitielle Lungenerkrankung, Viruspneumonie, Lungenentzündung
Abstract
Idiopathic pulmonary fibrosis (IPF) does not occur in younger persons. Therefore, it is not surprising that the nine hallmarks of biological aging can all be found in the pathomechanism of IPF. In this respect the homeostasis of cellular protein synthesis, degradation and recycling becomes unbalanced, which causes a dysregulation of repair mechanisms in the case of lung damage. Severve acute respiratory syndrome coronarvius type 2 (SARS-CoV-2) infections may also predominantyl seen in aged persons. In this situation cellular aging of the lungs also plays a role but additionally, the aging of the immune system is also of great importance. Immunosenescence is associated with a loss of naïve T‑cells. Moreover, there are gender-specific differences with a loss of B‑cells only in men but not in women, which partly explains the more severe course of COVID-19 pneumonia in older men.
Keywords: SARS-CoV‑2; Pandemic; Interstitial lung disease; Pneumonia, viral; Pulmonary inflammation
Seneszenz in der Pathogenese der idiopathischen Lungenfibrose
Die idiopathische Lungenfibrose (IPF) kommt bei Jugendlichen und jungen Erwachsenen nicht vor. Frühere Definitionen hatten ein Alter über 50 Jahre als Minor-Kriterium mit in die Definition aufgenommen [1]. Alterung ist daher schon früh in Modelle zur Pathogenese des IPF gerückt. Im Jahr 2013 wurden 9 Kennzeichnen des biologischen Alterns beschrieben [2], die sich allesamt in der Pathogenese der IPF finden lassen (Tab. 1; [3]).
| Genomische Instabilität | Nachweis von Mikrosatelliteninstabilität (MSI), Verlust der Heterozygotie im Sputum |
| Verkürzung der Telomere | Bei familiären Formen der IPF neben einer Verkürzung der Telomere auch Mutationen der Telomerasen |
| Epigenetische Veränderungen | DNA-Methylierung |
| Verlust der Proteostase | Mutationen im Surfactant |
| Deregulierter Metabolismus | IGF-1-Überexpression |
| Dysfunktion von Mitochondrien | Dysfunktionale Mitochondrien in Lungenepithelien |
| Zellalterung | Reduktion von CD4- und CD8-Zellen |
| Erschöpfung der Stammzellen | Veränderte Genexpressionsprofile bei IPF |
| Veränderte zelluläre Kommunikation | Gestörte Interaktion zwischen Fibroblasten und Epithel |
DNA Desoxyribonukleinsäure, IGF „insulin-like growth factor“
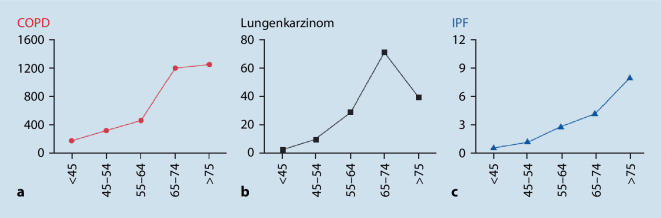
Altern ist gekennzeichnet durch einen fortschreitenden Verlust funktioneller Integrität mit der Folge einer erhöhten Wahrscheinlichkeit für Erkrankung und Tod [4]. Lungenalterung spielt auch bei der Pathogenese der COPD (chronisch obstruktive Lungenerkrankung) und des Lungenkarzinoms eine Rolle, wenn auch etwas weniger stark ausgeprägt (Abb. 1; [5]). Es ist außerdem auffällig, dass diese Erkrankungen gehäuft gemeinsam auftreten, wenn auch die Einzelfaktoren der Alterung unterschiedliche Schwerpunkt aufweisen [6].
Typisch für Alterungsprozesse ist ferner, dass die physiologische Homöostase von Synthese, Degradierung und Recycling zellulärer Proteine aus dem Gleichgewicht gerät. Für eine funktionierende Homöostase bedarf es einer funktionierenden Autophagie, die beschädigte Zellstrukturen erkennt, zerlegt und entweder wiederverwendet oder entsorgt. Dies ist besonders wichtig für die Entsorgung von fehlgefalteten Proteinen im endoplasmatischen Retikulum (ER-Stress). Es wird diskutiert, dass eine gestörte Autophagie wenigstens anteilig an der Pathogenese der IPF beteiligt ist [7]. Die im Alter beobachtete nichtenzymatische Glykosylierung (AGE [„advanced glycation endproduct“]) von Pentosin und N‑Carboxymethyl-Lysin findet sich auch bei IPF. Zusätzlich sind die Rezeptoren für AGE vermindert. Beide zusammen sind als Schlüsselfaktoren einer gestörten Wundheilung identifiziert [8].
Organalterung spielt für die Pathogenese der Lungenfibrose eine wichtige Rolle
Das aktuelle Verständnis geht davon aus, dass es eine genetische Anfälligkeit für IPF gibt und diese Patienten im Alter und durch Exposition von Umweltfaktoren, v. a. Zigarettenrauch, erkranken. Die bei IPF beobachtete Schädigung des Genoms mit Mikrosatelliten-DNA-Instabilität (MSI) und Verlust der Heterozygotie sind klassische Altersphänomene. Ein weiteres Charakteristikum, die Verkürzung von Telomeren, ist sogar ein Hauptmerkmal der Alterung mit der Folge von Apoptose und Zellalterung.
Auch im Tiermodell lässt sich eine Assoziation von Organalterung und Lungenfibrose herstellen. Lungenfibroblasten von gealterten Mäusen neigen nach Schädigung zur Fibrosierung, und die Infektion alter Mäuse (>18 Monate) mit γ‑Herpesviren führt zu einer schweren Inflammation und Fibrosierung der Lunge. Die Folge der Alterung ist damit eine verminderte Fähigkeit zur Reparatur nach Lungenschädigung durch Stressoren [9].
Das altersbedingte Absterben der Alveolarepithelzellen führt zu pathologischer Reepithelialisierung, Epitheldysfunktion und Verlust der normalen Lungenarchitektur. Ergänzt wird dies von einer Fehlregulation der extrazellulären Matrix, ebenfalls ein typisches Altersmerkmal, das zu einer gestörten Zell-Matrix-Interaktion führt [10].
Einführung in das Immunsystem
Die effektive Abwehr von Erregern ist für den menschlichen Körper überlebenswichtig. Besonders die Grenzflächen zur Außenwelt wie die Haut, der Urogenital‑, Respirations- und Gastrointestinaltrakt sind pathogenen und kommensalen Mikroorganismen ausgesetzt. Die wichtigste Barriere gegen Infektionen sind dabei die Epithelien. Da Schleimhäute dünner und vulnerabler als Epithelien sind, werden diese durch Mukus und durch Abwehrstoffe als Bestandteile des Mukus verstärkt (Ig[Immunglobulin]A, Komplement). Defensine wie humanes beta-Defensin 1 sind Peptide, die von Epithelien gebildet werden und als endogene Antibiotika Krankheitserreger abwehren [11]. Die Regulation der Defensine wird unter anderem durch das körpereigene Mikrobiom beeinflusst.
Permanent wird der menschliche Organismus von T‑Zellen durchwandert, die die Membranzusammensetzung körpereigener Zellen kontrollieren. Dendritische Zellen oder B‑Zellen präsentieren auf ihrer Oberfläche krankhafte Antigene über MHC-Moleküle. Trifft eine T‑Zelle mit dem passenden Rezeptor für genau diese Struktur, wird die T‑Zelle aktiviert. Es kommt zur Zytokinausschüttung. B‑Zellen, die ebenfalls passende Rezeptoren für das gleiche pathologische Antigen aufweisen, wandern zu den Keimzentren in den Lymphknoten (LK) und in der Milz und differenzieren dort zu Plasmazellen, die in Folge spezifische Antikörper (IgA, IgE, IgG, IgM) bilden. Die Antiköper neutralisieren das Antigen oder hüllen es ein, damit es von anderen Immunzellen phagozytiert werden kann. Außerdem aktivieren Antikörper das Komplementsystem und NK-Zellen (natürliche Killerzellen). Eine weitere Möglichkeit der Wirkung von Antikörpern ist die Agglutination. Die Tab. 2 gibt einen Überblick über unspezifische und spezifische Immunabwehr.
| Angeborene unspezifische Abwehr | Adaptive spezifische Abwehr |
|---|---|
| Granulozyten | B‑Lymphozyten: Plasmazellen/Antikörperbildung |
| Monozyten | T‑Gedächtniszellen |
| Makrophagen | T‑Helferzellen (z. B. CD4+): Zytokinfreisetzung für Chemotaxis |
| Natürliche Killerzellen | Zytotoxische T‑Zellen (z. B. CD8+): induzieren Apoptose von virusbefallenen Zellen über deren physiologische Signalwege |
| Naive T‑Zellen: unstimulierte T‑Zellen | |
| Natürliche Killer T‑Zellen |
Die historische Einteilung der T‑Zellen in T‑Helferzellen und zytotoxische T‑Zellen ist heute einem Verständnis hoher Plastizität der Differenzierung von T‑Zellen gewichen, in dem Mediatoren zu vielen verschiedenen Unterarten von T‑Zellen führen mit jeweils eigenem Zytokinprofil
Betrachtet man die Abläufe des Immunsystems longitudinal, lassen sich folgende Phasen unterteilen:
Homöostase: Das gesunde Immunsystem ist in der Lage, ein physiologisches Gleichgewicht zwischen Immunsystem und Eindringen oder Wachstum von Krankheitserregern im Sinne einer permanenten Auseinandersetzung mit Erregern aufrechtzuerhalten [12].
Primäre Immunreaktion: Bei einem akuten Infekt mit einem unbekannten Erreger kommt es zur primären Immunreaktion, die wie oben beschrieben abläuft.
Immungedächtnis: Der beste Schutz gegen eine Infektion sind bereits existierende spezifische Antikörper für einen bestimmten Erreger. Diese müssen eine ausreichend hohe Konzentration und Affinität haben, um optimal zu wirken. Auch wenn die Immunantwort im Körper theoretisch lebenslang vorhanden bleibt, sind die antikörperbildenden Plasmazellen kurzlebig (1 bis 5 Tage). Spezifische protektive Antikörper sind nicht kreuzreaktiv bezüglich einer suffizienten Immunantwort auf ähnliche Erreger [13].
Sekundäre Immunreaktion: Hierunter versteht man die immunologische Reaktion nach vorangegangener Sensibilisierung gegenüber einem bestimmten Antigen. Die Immunantwort erfolgt schneller, und die gebildete Antikörperkonzentration (IgG) ist höher als bei einer primären Reaktion.
Abenddämmerung der Abwehrkräfte: Immunseneszenz [14]
Der Begriff Immunseneszenz umschreibt eine Reihe altersabhängiger Veränderungen des Immunsystems, die über kurz oder lang zu einer erhöhten Infektanfälligkeit führen. Dies betrifft die Immunzellen, Lymphorgane und zirkulierende Substanzen (Chemokine und Zytokine).
Milz
Wie alle Blutzellen werden auch die Vorläufer der T‑Zellen im Knochenmark gebildet. Im Zuge der Reifung bilden sich MHC-Rezeptoren auf der Oberfläche der T‑Zellen aus. Diese Reifung erfolgt im Thymus. Solange die T‑Zellen nicht durch ein Antigen stimuliert worden sind, spricht man von naiven T‑Zellen.
Die altersbedingte Atrophie des Thymus ist ein wichtiger Faktor der Immunseneszenz
Wie bei fast allen Säugetieren bildet sich der Thymus mit Einsetzen der Pubertät zurück (Involution). Schon in der Pubertät wird im Vergleich mit der frühen Kindheit durch den Thymus nur noch ein Zehntel der naiven T‑Zellen bereitgestellt. Die Rückbildung beginnt mit einem rapiden Rückgang in der frühen Pubertät, gefolgt von einem eher linearen Rückgang von etwa 3 % pro Jahr im mittleren Alter und 1 % im höheren Alter, bis der Thymus bei Personen über 85 Jahre kaum noch nachweisbar ist [15]. Die altersbedingte Atrophie des Thymus ist ein wichtiger Faktor der Immunseneszenz und führt zu einer Abnahme der Zellzahl, der Gewebemasse und einem Verlust der Organorganisation. Resultat ist eine Reduktion der Produktion und Abgabe naiver T‑Zellen. Die Vermehrung der spezifischen T‑Zellen erfolgt dann stattdessen in Lymphknoten und Milz [16].
Der mit dem Rückgang des Thymus einhergehende Verlust von naiven T‑Zellen hat erheblichen Einfluss auf die Zusammensetzung des zirkulierenden T‑Zell-Pools. Mit Änderung des T‑Zell-Phänotyps geht auch eine Änderung der Diversität und Funktion des T‑Zell-Pools einher. Funktionell ist dies ein entscheidender Faktor der Immunseneszenz, was die Rolle des Thymus im Immungeschehen zentral herausstellt.
Nicht nur die Thymusmasse reduziert sich mit dem Alter. Auch die Qualität des verbleibenden Thymus verändert sich mikrostrukturell [17]. Der Thymus fibrosiert und wird fettgewebig umgebaut. Es kommt zur Reduktion von Thymusmarkern wie Keratin und MHC Klasse II und zu einer Änderung des Genexpressionsprofils des Thymusstromas [18]. Die Einschränkung der Thymopoese durch gealterte Thymozyten ist ein weiterer Schlüsselfaktor der Thymusinvolution [19].
T-Zellen und Monozyten
Die 4 häufigsten mononukleären Zellen im peripheren Blut sind CD4-, CD8-, CD19-B-Zellen und CD14-Monozyten [20].
Gegenüber dem Säuglingsalter fällt die Anzahl der naiven T‑Zellen bereits in der Kindheit ab und beträgt zu Beginn der Pubertät nur noch 1/10. Im Alter von 40 bis 50 Jahren fällt die Anzahl weiter auf 1/100. Dies erschwert im Senium eine adäquate Immunantwort auf unbekannte Erreger.
Die einzelnen Zellpopulationen entwickeln sich nicht uniform. Nicht betroffen sind beispielsweise T‑Gedächtniszellen, sodass bei einem bereits bekannten Erreger weiterhin eine rasche Immunantwort möglich ist. Auch die Monozyten bleiben im Alter konstant.
CD4-, CD-8- und CD28-positive T‑Zellen vermindern sich im Alter, während CD28-negative-T-Zellen erhöht sind. Letzteres wird als Ausdruck chronisch inflammatorischer Prozesse verstanden. CD28-negative T‑Zellen können dann wie Zellen der angeborenen Immunabwehr fungieren (analog NK-Zellen) [21].
B-Zellen
Ein Abfall der B‑Zellen wird bei Männern über 65 Jahren beobachtet, nicht bei Frauen [21].
„Inflammaging“: Überproduktion von Zytokinen im Alter
Die Zytokinproduktion nimmt im Alter zu. Die Zunahme verläuft beschleunigt Ende 30 Jahre und der zweite mit Mitte 60 Jahren mit deutlich stärkerer Ausprägung dieser Phasen bei Männern [20]. Ältere Männer weisen deshalb eine stärkere Immunreaktion der angeborenen Abwehr auf (v. a. Interleukin‑6 und -18) als junge Männer.
Die Unterschiede im Immunsystem von Männern und Frauen sind markant [22]. Typischerweise zeigt das Immunsystem von Frauen eine stärkere Reaktion. Die Folgen sind ein bessere Infektabwehr und ein besseres Ansprechen auf Impfungen. Andererseits treten 80 % der Autoimmunerkrankungen bei Frauen auf.
SARS-CoV-2-Infektion, COVID-19 und Immunseneszenz
Ältere Menschen weisen eine höhere Viruslast und schwerere Verläufe auf [23] auf. Die oben beschriebenen Veränderungen im Rahmen der Lungenalterung haben einen wichtigen Anteil an der hohen Morbidität und Mortalität von COVID-19 im Alter. Hinzu kommen die Folgen der Immunseneszenz (Abb. 2).
Auch geschlechtsspezifische Unterschiede sind auffällig: Erkrankte Männer werden häufiger als Frauen im Krankenhaus behandelt und zeigen mehr schwere intensivpflichtige Verläufe und mit einer höheren Wahrscheinlichkeit, an einer COVID-19-Pneumonie zu versterben [24]. Die Geschlechtsunterschiede nehmen mit dem Alter zu.
Erkrankte Männer haben eine höhere Wahrscheinlichkeit an einer COVID-19-Pneumonie zu versterben
Die Immunseneszenz kann dies in Teilen erklären: Die T‑Gedächtniszellen sind zwar erhalten, der Erreger ist aber neu. Denn obwohl Corona-Viren als einfache Erkältungsviren bekannt sind, ist der Unterschied zu SARS-CoV‑2 zu groß, als dass hierdurch eine Immunität erzeugt werden konnte, ganz ähnlich wie es von den verschiedenen Influenzastämmen auch bekannt ist. Bei neuem Erreger sind die naiven T‑Zellen von besonderer Bedeutung, aber gerade diese sind im Alter stark reduziert. Das trifft auch für die Reduktion von B‑Zellen bei Männern und entsprechend auch auf die Antikörperproduktion zu. Die Reaktion der adaptiven Immunabwehr fällt somit insgesamt schwächer aus.
Die Zytokinüberproduktion im Alter scheint bei Covid-19 besonders nachteilig zu sein, was daran zu erkennen ist, dass manche Patienten einen regelrechten Zytokinsturm entwickeln [25].
Zusätzlich zu diesen immunspezifischen Veränderungen im Senium spielt bei COVID-19 der Geschlechterunterschied des TMPRSS2(„transmembrane protease serine subtype 2“)-getriggerten Eindringens von SARS-CoV‑2 in die Wirtszelle eine Rolle. Die Transkription von TMPRSS‑2 wird durch Androgene modifiziert.
Der kritische Verlauf der COVID-19-Infektion bei alten Patienten weist schlussendlich die bekannten Risikofaktoren für schwere Krankheitsverläufe auf. Dazu zählen Frailty (Gebrechlichkeit) und Komorbiditäten (Bluthochdruck, Diabetes, vaskuläre Erkrankungen, chronische Lungen- und Bronchialerkrankungen).
Fazit für die Praxis
Die zelluläre Alterung des Lungengewebes und die Alterung des Immunsystems sind wichtige Schlüsselfaktoren für die Gesundheit. Ersteres bedingt chronische Lungenerkrankungen, hier am Beispiel der idiopathischen Lungenfibrose dargestellt. Letzteres führt zu häufigerem Auftreten von Lungeninfektionen mit schwerwiegenderen Verläufen.
Hinsichtlich COVID-19 trifft ein bislang unbekanntes Virus auf ein alterndes Immunsystem, was die schweren Verläufe erklärt. Da alte Patienten Symptome oft vermindert wahrnehmen, die Bedeutung fehldeuten und sprachliche Schwierigkeiten (z. B. nach Schlaganfall) bestehen können, ist diese Personengruppe besonders sorgfältig zu untersuchen und im Falle eines akuten Infekts engmaschig zu überwachen.
Eine voreilige Intubation sollte vermieden werden und stattdessen sichergestellt werden, dass das Portfolio nichtinvasiver Maßnahmen (nichtinvasive Beatmung, „high flow nasal cannula“) ausgeschöpft worden ist.
Abkürzungen
- AGE
Advanced glycation endproduct
- COPD
Chronisch obstruktive Lungenerkrankung
- DNA
Desoxyribonukleinsäure
- ER
Endoplasmatisches Retikulum
- Ig
Immunglobulin
- IGF
Insulin-like growth factor
- IL
Interleukin
- IPF
Idiopathische Lungenfibrose
- LK
Lymphknoten
- MSI
Mikrosatelliteninstabilität
- NK-Zellen
Natürliche Killerzellen
- TMPRSS2
Transmembrane protease serine subtype 2
Einhaltung ethischer Richtlinien
Interessenkonflikt
S. Stieglitz und H. Frohnhofen geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.American Thoracic S. European Respiratory S American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. This joint statement of the American Thoracic Society (ATS), and the European Respiratory Society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS Executive Committee, June 2001. Am J Respir Crit Care Med. 2002;165(2):277–304. doi: 10.1164/ajrccm.165.2.ats01. [DOI] [PubMed] [Google Scholar]
- 2.Lopez-Otin C, Blasco MA, Partridge L, Serrano M, Kroemer G. The hallmarks of aging. Cell. 2013;153(6):1194–1217. doi: 10.1016/j.cell.2013.05.039. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Stieglitz S. Die alternde Lunge – zwischen Physiologie und Pathologie. Pneumologe. 2018;15(2):113–118. doi: 10.1007/s10405-017-0160-8. [DOI] [Google Scholar]
- 4.Selman M, Buendia-Roldan I, Pardo A. Aging and pulmonary fibrosis. Rev Invest Clin. 2016;68(2):75–83. [PubMed] [Google Scholar]
- 5.Morty RE, Prakash YS. Senescence in the lung: Is this getting old? Am J Physiol Lung Cell Mol Physiol. 2019;316(5):L822–L825. doi: 10.1152/ajplung.00081.2019. [DOI] [PubMed] [Google Scholar]
- 6.Meiners S, Eickelberg O, Konigshoff M. Hallmarks of the ageing lung. Eur Respir J. 2015;45(3):807–827. doi: 10.1183/09031936.00186914. [DOI] [PubMed] [Google Scholar]
- 7.Kuwano K, Araya J, Hara H, Minagawa S, Takasaka N, Ito S, Kobayashi K, Nakayama K. Cellular senescence and autophagy in the pathogenesis of chronic obstructive pulmonary disease (COPD) and idiopathic pulmonary fibrosis (IPF) Respir Investig. 2016;54(6):397–406. doi: 10.1016/j.resinv.2016.03.010. [DOI] [PubMed] [Google Scholar]
- 8.Machahua C, Montes-Worboys A, Llatjos R, Escobar I, Dorca J, Molina-Molina M, Vicens-Zygmunt V. Increased AGE-RAGE ratio in idiopathic pulmonary fibrosis. Respir Res. 2016;17(1):144. doi: 10.1186/s12931-016-0460-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Pardo A, Selman M. Lung fibroblasts, aging, and idiopathic pulmonary fibrosis. Ann Am Thorac Soc. 2016;13(Suppl 5):S417–S421. doi: 10.1513/AnnalsATS.201605-341AW. [DOI] [PubMed] [Google Scholar]
- 10.Alvarez D, Cardenes N, Sellares J, Bueno M, Corey C, Hanumanthu VS, Peng Y, D’Cunha H, Sembrat J, Nouraie M, Shanker S, Caufield C, Shiva S, Armanios M, Mora AL, Rojas M. IPF lung fibroblasts have a senescent phenotype. Am J Physiol Lung Cell Mol Physiol. 2017;313(6):L1164–L1173. doi: 10.1152/ajplung.00220.2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Alvarez AH, Martinez Velazquez M, Prado Montes de Oca E. Human beta-defensin 1 update: potential clinical applications of the restless warrior. Int J Biochem Cell Biol. 2018;104:133–137. doi: 10.1016/j.biocel.2018.09.007. [DOI] [PubMed] [Google Scholar]
- 12.Mowel WK, Kotzin JJ, McCright SJ, Neal VD, Henao-Mejia J. Control of immune cell homeostasis and function by lncRNas. Trends Immunol. 2018;39(1):55–69. doi: 10.1016/j.it.2017.08.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zinkernagel RM. Immunological memory not equal protective immunity. Cell Mol Life Sci. 2012;69(10):1635–1640. doi: 10.1007/s00018-012-0972-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Nikolich-Zugich J. The twilight of immunity: emerging concepts in aging of the immune system. Nat Immunol. 2018;19(1):10–19. doi: 10.1038/s41590-017-0006-x. [DOI] [PubMed] [Google Scholar]
- 15.Mitchell WA, Lang PO, Aspinall R. Tracing thymic output in older individuals. Clin Exp Immunol. 2010;161(3):497–503. doi: 10.1111/j.1365-2249.2010.04209.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Palmer DB. The effect of age on thymic function. Front Immunol. 2013;4:316. doi: 10.3389/fimmu.2013.00316. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Steinmann GG, Klaus B, Muller-Hermelink HK. The involution of the ageing human thymic epithelium is independent of puberty. A morphometric study. Scand J Immunol. 1985;22(5):563–575. doi: 10.1111/j.1365-3083.1985.tb01916.x. [DOI] [PubMed] [Google Scholar]
- 18.Griffith AV, Fallahi M, Venables T, Petrie HT. Persistent degenerative changes in thymic organ function revealed by an inducible model of organ regrowth. Aging Cell. 2012;11(1):169–177. doi: 10.1111/j.1474-9726.2011.00773.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Gui J, Zhu X, Dohkan J, Cheng L, Barnes PF, Su DM. The aged thymus shows normal recruitment of lymphohematopoietic progenitors but has defects in thymic epithelial cells. Int Immunol. 2007;19(10):1201–1211. doi: 10.1093/intimm/dxm095. [DOI] [PubMed] [Google Scholar]
- 20.Marquez EJ, Chung CH, Marches R, Rossi RJ, Nehar-Belaid D, Eroglu A, Mellert DJ, Kuchel GA, Banchereau J, Ucar D. Sexual-dimorphism in human immune system aging. Nat Commun. 2020;11(1):751. doi: 10.1038/s41467-020-14396-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Pawelec G, Barnett Y, Forsey R, Frasca D, Globerson A, McLeod J, Caruso C, Franceschi C, Fulop T, Gupta S, Mariani E, Mocchegiani E, Solana R. T cells and aging. Front Biosci. 2002;7:d1056–d1183. doi: 10.2741/a831. [DOI] [PubMed] [Google Scholar]
- 22.Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol. 2016;16(10):626–638. doi: 10.1038/nri.2016.90. [DOI] [PubMed] [Google Scholar]
- 23.Vellas C, Delobel P, de Souto Barreto P, Izopet J. COVID-19, virology and geroscience: a perspective. J Nutr Health Aging. 2020;24(7):685–691. doi: 10.1007/s12603-020-1416-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Gebhard C, Regitz-Zagrosek V, Neuhauser HK, Morgan R, Klein SL. Impact of sex and gender on COVID-19 outcomes in Europe. Biol Sex Differ. 2020;11(1):29. doi: 10.1186/s13293-020-00304-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Guaraldi G, Meschiari M, Cozzi-Lepri A, Milic J, Tonelli R, Menozzi M, Franceschini E, Cuomo G, Orlando G, Borghi V, Santoro A, Di Gaetano M, Puzzolante C, Carli F, Bedini A, Corradi L, Fantini R, Castaniere I, Tabbi L, Girardis M, Tedeschi S, Giannella M, Bartoletti M, Pascale R, Dolci G, Brugioni L, Pietrangelo A, Cossarizza A, Pea F, Clini E, Salvarani C, Massari M, Viale PL, Mussini C. Tocilizumab in patients with severe COVID-19: a retrospective cohort study. Lancet Rheumatol. 2020;2(8):e474–e484. doi: 10.1016/S2665-9913(20)30173-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Birch J, Barnes PJ, Passos JF. Mitochondria, telomeres and cell senescence: implications for lung ageing and disease. Pharmacol Ther. 2018;183:34–49. doi: 10.1016/j.pharmthera.2017.10.005. [DOI] [PubMed] [Google Scholar]
- 27.Sarantopoulos S. Allogeneic stem-cell transplantation—A T-cell balancing ACT. N Engl J Med. 2018;378(5):480–482. doi: 10.1056/NEJMcibr1713238. [DOI] [PubMed] [Google Scholar]
- 28.Walker JA, McKenzie ANJ. TH2 cell development and function. Nat Rev Immunol. 2018;18(2):121–133. doi: 10.1038/nri.2017.118. [DOI] [PubMed] [Google Scholar]