Die adaptiven Immunantworten werden normalerweise in den peripheren Lymphknoten ausgelöst, die Flüssigkeit aus den infizierten Geweben ableiten. Die meisten inneren Gewebe sind frei von mikrobiellem Wachstum, während die Haut und die verschiedenen Schleimhäute, welche die Organe auskleiden, die in direktem Kontakt mit der äußeren Umgebung stehen, ständig mit Mikroorganismen von dort konfrontiert sind. Die meisten Mikroorganismen dringen auch über diese Oberflächen in den Körper ein. In diesem Kapitel wollen wir die besonderen Eigenschaften des Immunsystems besprechen, das die mucosalen Oberflächen versorgt – das mucosale Immunsystem .
Wahrscheinlich war das mucosale Immunsystem, insbesondere das des Darms , bei den Vertebraten der erste Teil des adaptiven Immunsystems, das sich im Lauf der Evolution entwickelt hat, möglicherweise aufgrund der Notwendigkeit, die riesigen Populationen der kommensalen Mikroorganismen in den Griff zu bekommen, die sich gemeinsam mit den Vertebraten entwickelt haben. Organisierte Lymphgewebe und Immunglobulinantikörper hat man bei den Vertebraten als früheste Form im Darm von primitiven Knorpelfischen entdeckt. Die beiden zentralen lymphatischen Organe – der Thymus und die Bursa Fabricii der Vögel – leiten sich aus dem embryonalen Darm ab. Fische verfügen auch über eine einfache Form von sezernierten Antikörpern, die die Körperoberfläche schützen und möglicherweise ein Vorläufer der IgA-Antikörper der Säuger sind. So ist die Vorstellung entstanden, dass das mucosale Immunsystem dem ursprünglichen Immunsystem der Vertebraten entspricht und Milz und Lymphknoten eine spätere Spezialisierung sind.
Aufbau und Funktionsweise des mucosalen Immunsystems
Die erste Abwehrlinie gegen das Eindringen potenzieller Krankheitserreger und kommensaler Mikroorganismen ist die dünne Epithelschicht, die alle mucosalen Körperoberflächen bedeckt. Das Epithel kann jedoch relativ leicht durchbrochen werden, weshalb für die Barrierefunktion weitere Abwehrmaßnahmen erforderlich sind, in Form von Zellen und Molekülen des mucosalen Immunsystems. Die angeborenen Abwehrmechanismen der mucosalen Gewebe, beispielsweise antimikrobielle Peptide und Zellen, die invariante Rezeptoren für die Pathogenerkennung tragen, wurden in Kap. 10.1007/978-3-662-56004-4_2 und 10.1007/978-3-662-56004-4_3 beschrieben. In diesem Kapitel wollen wir uns mit dem adaptiven mucosalen Immunsystem beschäftigen und dabei nur diejenigen angeborenen Reaktionen besonders betonen, die für dieses Thema von Bedeutung sind. Viele der anatomischen und immunologischen Grundlagen des mucosalen Immunsystems sind bei allen zugehörigen Geweben gleich. Hier werden wir uns beispielhaft mit dem Darm befassen und der Leser sei für die Besonderheiten der übrigen Regionen auf die Literaturstellen am Ende des Kapitels hingewiesen.
Das mucosale Immunsystem schützt die inneren Oberflächen des Körpers
Das Immunsystem der Schleimhäute umfasst die inneren Körperoberflächen, die mit einem schleimsezernierenden Epithel bedeckt sind – den Gastrointestinaltrakt, die oberen und unteren Atemwege, den Urogenitaltrakt sowie das Mittelohr. Dazu gehören auch die exokrinen Drüsen, die mit diesen Organen assoziiert sind, das heißt die Bindehaut und die Tränendrüsen der Augen, die Speicheldrüsen und die Milchdrüsen der Brust (Abb. 12.1). Die Schleimhautoberflächen bilden einen riesigen Bereich, der geschützt werden muss. Der Dünndarm des Menschen hat beispielsweise eine Oberfläche von 400 m2, das heißt 200-mal so groß wie die Haut.
Das mucosale Immunsystem bildet den größten Teil der Immungewebe im Körper. Es enthält etwa drei Viertel aller Lymphocyten und produziert bei gesunden Individuen die meisten Immunglobuline. Es ist zudem ständig Antigenen und anderen Substanzen ausgesetzt, die aus der Umgebung kommen. Im Vergleich zu den Lymphknoten und der Milz (die wir in diesem Kapitel insgesamt als systemisches Immunsystem bezeichnen) besitzt das mucosale Immunsystem viele einzigartige und ungewöhnliche Eigenschaften (Abb. 12.2).
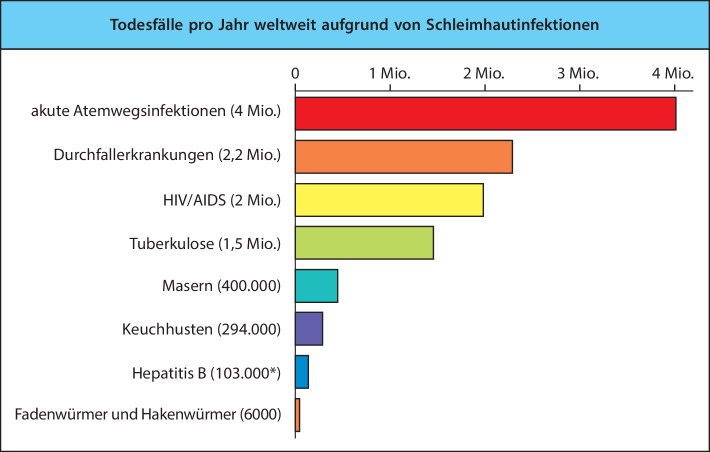
Aufgrund ihrer physiologischen Funktionen in Bezug auf Gasaustausch (Lunge), Nährstoffabsorption (Verdauungstrakt), sensorische Aktivitäten (Augen, Nase, Mund und Rachen) und der Reproduktion (Uterus und Vagina) sind die Schleimhautoberflächen dünne und durchlässige Barrieren zum Inneren des Körpers. Die Bedeutung dieser Gewebe für das Leben erfordert unbedingt, dass hier wirksame Abwehrmechanismen zur Verfügung stehen, die vor einer Invasion schützen. Ebenso ist von Bedeutung, dass die Fragilität und Durchlässigkeit der Schleimhäute offenbar eine Anfälligkeit für Infektionen mit sich bringen. Es ist daher nicht verwunderlich, dass die überwiegende Mehrheit der Krankheitserreger über diese Wege in den menschlichen Körper eindringt (Abb. 12.3). Durchfallerkrankungen, akute Infektionen der Atemwege, Lungentuberkulose, Masern, Keuchhusten und Wurmbefall sind weiterhin die bedeutendsten Todesursachen weltweit, vor allem für Kinder in den Entwicklungsländern. Hierzu zählt auch das humane Immunschwächevirus HIV, ein Pathogen, dessen natürlicher Eintrittsweg über mucosale Oberflächen häufig übersehen wird, sowie andere sexuell übertragbare Krankheiten wie die Syphilis.
Ein großer Teil der durch die Schleimhautoberflächen gelangenden Fremdantigene ist gar nicht pathogen. Das lässt sich am besten am Darm erkennen, der erheblichen Mengen von Nahrungsproteinen ausgesetzt ist – nach einer Schätzung 30–35 kg pro Person und Jahr. Gleichzeitig wird der gesunde Dickdarm von mindestens 1000 Bakterienspezies besiedelt, die mit ihrem Wirt in Symbiose leben und deshalb als kommensale Mikroorganismen oder Mikroflora bezeichnet werden. Diese Bakterien erreichen im Inhalt des Dickdarms eine Dichte von 1012 Organismen pro Milliliter. Damit sind sie um den Faktor zehn die zahlreichsten Zellen im Körper. In einem gesunden Darm kommen auch bedeutsame Populationen von Viren und Pilzen vor. Unter normalen Bedingungen richten sie keinen Schaden an und viele sind für ihren Wirt auf verschiedene Weise nützlich, indem sie wichtige Stoffwechselfunktionen besitzen und auch für die normale Immunfunktion essenziell sind. Die übrigen mucosalen Oberflächen werden auch von umfangreichen Populationen aus residenten kommensalen Organismen besiedelt (Abb. 12.4).
Da Proteine aus der Nahrung und die Mikroflora viele fremde Antigene enthalten, können sie vom adaptiven Immunsystem erkannt werden. Die Erzeugung einer schützenden Immunantwort gegen diese harmlosen Antigene wäre jedoch unangemessen und eine Verschwendung von Ressourcen. Man nimmt heute an, dass solche fehlgeleiteten Immunantworten die Ursache für einige relativ häufige Krankheiten sind, beispielsweise die Zöliakie (die auf eine Reaktion gegen das Weizenprotein Gluten zurückzuführen ist; Kap. 10.1007/978-3-662-56004-4_14) sowie entzündliche Erkrankungen des Darms wie Morbus Crohn (eine Reaktion auf kommensale Bakterien). Wie wir noch erfahren werden, hat das mucosale Immunsystem des Darms im Lauf der Evolution die Mechanismen entwickelt, schädliche Krankheitserreger von Antigenen in der Nahrung und in der normalen Darmflora zu unterscheiden. An anderen Schleimhautoberflächen wie den Atemwegen und dem weiblichen Genitaltrakt treten ähnliche Herausforderungen auf. Hier ist ein Immunschutz gegen Krankheitserreger essenziell, aber viele der Antigene, die in diese Gewebe gelangen, stammen ebenfalls von kommensalen Organismen, Pollen und anderem harmlosen Material aus der Umgebung sowie im unteren Urogenitaltrakt aus der Samenflüssigkeit. Der Fetus ist eine weitere bedeutsame Quelle für fremde Antigene, mit denen das normale mucosale Immunsystem in Kontakt kommt, sodass Immunreaktionen dagegen unter Kontrolle gehalten werden müssen.
Die Zellen des mucosalen Immunsystems kommen in anatomisch definierten Kompartimenten, aber auch überall in den mucosalen Geweben verstreut vor
Lymphocyten und andere Zellen des Immunsystems wie Makrophagen und dendritische Zellen kommen überall im Darmtrakt vor, sowohl in den organisierten Geweben als auch verstreut über das gesamte Oberflächenepithel der Mucosa und in der darunterliegenden Schicht aus Bindegewebe, die man als Lamina propria bezeichnet. Die organisierten Lymphgewebe bilden zusammen mit den mesenterialen und caudalen Lymphknoten eine Gruppe von Organen, die man als darmassoziierte lymphatische Gewebe (gut associated lymphoid tissues, GALT) bezeichnet (Abb. 12.5). Die GALT und die mesenterialen Lymphknoten besitzen die anatomisch kompartimentierte Struktur, die für die peripheren lymphatischen Organe charakteristisch ist. Hier werden auch die Immunantworten ausgelöst. Die Zellen, die über das gesamte Epithel und in der Lamina propria verstreut sind, machen die Effektorzellen der lokalen Immunantwort aus.
Zu den GALT gehören die Peyer-Plaques , die nur im Dünndarm vorkommen, die isolierten Lymphfollikel (ILFs), die überall im Darm vorkommen, der Blinddarm (beim Menschen) sowie die Gaumen- und Rachenmandeln im Rachen. Gaumenmandeln , Rachenmandeln und Zungenmandeln sind große Aggregationen von sekundärem lymphatischem Gewebe, das von einer Schicht aus Schuppenepithel umgeben ist, und bilden einen Ring. Dieser liegt an der Rückseite des Mundes am Eingang zum Verdauungstrakt und zu den Atemwegen (Abb. 12.6) und man bezeichnet ihn als Waldeyer-Rachenring . Bei Kindern vergrößern sich diese Organe aufgrund wiederholter Infektionen häufig in extremer Weise; deshalb hat man sie früher häufig chirurgisch entfernt. Bei Kindern, denen die Mandeln entfernt wurden, hat man eine verringerte IgA-Reaktion auf die orale Polioimpfung beobachtet.
Die Peyer-Plaques des Dünndarms , die Lymphgewebe des Blinddarms sowie die isolierten Lymphfollikel liegen innerhalb der Darmwand. Die Peyer-Plaques sind für das Auslösen von Immunantworten im Darm von großer Bedeutung. Die Plaques sind mit bloßem Auge sichtbar und haben ein besonderes Erscheinungsbild. Sie bilden gewölbeförmige Aggregationen aus lymphatischen Zellen, die in das Lumen des Darms hineinragen (Abb. 10.1007/978-3-662-56004-4_1#Fig24). Im Dünndarm des Menschen gibt es 100–200 Peyer-Plaques. Sie enthalten deutlich mehr B-Zellen als die systemischen peripheren lymphatischen Organe, wobei jeder Peyer-Plaque aus einer großen Anzahl von B-Zell-Follikeln mit Keimzentren sowie aus kleineren T-Zell-Regionen besteht, die sich zwischen den Follikeln und unmittelbar darunter befinden (Abb. 12.5). Der subepitheliale Dom enthält zahlreiche dendritische Zellen, T-Zellen und B-Zellen. Zwischen den Lymphgeweben liegt als Abtrennung zum Darmlumen eine Schicht aus follikelassoziiertem Epithel . Diese enthält normale Darmepithelzellen, die man als Enterocyten bezeichnet, sowie eine geringere Anzahl von spezialisierten Epithelzellen, die Mikrofaltenzellen (M-Zellen) (Abb. 10.1007/978-3-662-56004-4_1#Fig24). Die Entwicklung der M-Zellen wird von den lokalen B-Zellen und dem RANK-Liganden (RANKL) kontrolliert, der wie CD40L zur Superfamilie der Tumornekrosefaktoren (TNFs) gehört (Abschn. 10.1007/978-3-662-56004-4_7#Sec28). Anders als die Enterocyten, die den größten Teil des Darmepithels ausmachen, besitzen die M-Zellen an der Seite zum Darmlumen anstelle der Mikrovilli eine gefaltete Oberfläche und sezernieren keine Verdauungsenzyme und keine Mucine, sodass sie an der Oberfläche keine dicke Schleimschicht (die Glykokalyx) aufweisen, wie sie bei den konventionellen Epithelzellen vorhanden ist (Abb. 10.1007/978-3-662-56004-4_1#Fig24). Sie sind deshalb den Mikroorganismen und Partikeln im Darmlumen direkt ausgesetzt und dadurch der bevorzugte Eintrittsweg für Antigene wie Mikroorganismen aus dem Lumen zu den Peyer-Plaques (Abb. 12.7). Das follikelassoziierte Epithel enthält ebenfalls Lymphocyten und dendritische Zellen.
Im Dünn - und Dickdarm sind im Mikroskop mehrere Tausend isolierte Lymphfollikel zu erkennen, wobei sie im Dickdarm häufiger sind. Das entspricht auch der dort jeweils vorkommenden Anzahl an Mikroorganismen. Diese Follikel besitzen wie die Peyer-Plaques ein Epithel, das M-Zellen enthält und sich oberhalb des organisierten Lymphgewebes befindet. Die Follikel enthalten jedoch vor allem B-Zellen und sie entwickeln sich nur nach der Geburt als Reaktion auf die Antigenstimulation, die durch die Besiedlung des Darms mit kommensalen Mikroorganismen hervorgerufen wird. Die Peyer-Plaques sind hingegen bereits im fetalen Darm vorhanden, wobei sie nach der Geburt noch nicht vollständig entwickelt sind. Im Darm von Mäusen gehen die isolierten Lymphfollikel anscheinend aus kleinen Aggregationen in der Darmwand hervor, die man als Cryptoplaques bezeichnet. Diese enthalten dendritische Zellen und Lymphgewebeinduktorzellen (lymphoid tissue inducer cells, LTi-Zellen ) (Abschn. 10.1007/978-3-662-56004-4_9#Sec3). Im Darm des Menschen wurden noch keine Cryptoplaques nachgewiesen. Die Peyer-Plaques und die isolierten Lymphfollikel sind durch Lymphgefäße mit ableitenden Lymphknoten verbunden.
Die Gewebe des Dünndarms leiten die Flüssigkeit in die mesenterialen Lymphknoten ab, die im Bindegewebe liegen, das den Darm an der Rückwand des Abdomens befestigt. Dies sind die größten Lymphknoten im Körper und sie sind für das Auslösen und die Ausformung der Immunantworten gegen Antigene aus dem Darm von entscheidender Bedeutung. Die mucosale Oberfläche und die lymphatischen Aggregationen des Dickdarms leiten die Flüssigkeit teilweise zu den mesenterialen Lymphknoten ab, aber auch zu davon unabhängigen Knoten, die man als caudale Lymphknoten bezeichnet und die sich an der Bifurkationsstelle der Aorta befinden.
Die mesenterialen Lymphknoten und die Peyer-Plaques differenzieren sich während der Embryonalentwicklung unabhängig vom systemischen Immunsystem. Daran sind spezielle Cytokine und Rezeptoren der Tumornekrosefaktor-(TNF-)Familie (Abschn. 10.1007/978-3-662-56004-4_9#Sec3) beteiligt. Die Unterschiede zwischen den GALT und den systemischen lymphatischen Organen bilden sich schon sehr früh im Leben heraus.
Bei einigen Spezies, beispielsweise bei der Maus, kommen isolierte Lymphfollikel auch in der auskleidenden Schicht der Nase und in der Wand der oberen Atemwege vor. Die Lymphfollikel in der Nase bezeichnet man als nasenassoziierte lymphatische Gewebe (NALT) , die in den oberen Atemwegen als bronchienassoziierte lymphatische Gewebe (bronchus-associated lymphatic tissues, BALT). Die Bezeichnung mucosaassoziiertes lymphatisches Gewebe (MALT) wird gelegentlich verwendet, um diese einander ähnlichen Gewebe in den mucosalen Organen zusammenzufassen. Bei erwachsenen Menschen treten erkennbar organisierte Lymphgewebe in der Nase und in den Atemwegen allerdings nur bei Infektionen auf.
Der Darm besitzt spezielle Wege und Mechanismen für die Aufnahme von Antigenen
Antigene an den mucosalen Oberflächen müssen durch die Epithelbarriere transportiert werden, bevor sie das Immunsystem stimulieren können. Die Peyer-Plaques und die isolierten Lymphfollikel sind für die Aufnahme von Antigenen aus dem Darmlumen stark spezialisiert. Die M-Zellen des follikelassoziierten Epithels nehmen durch Endocytose oder Phagocytose ständig Moleküle und Partikel aus dem Darmlumen auf (Abb. 12.7). Bei bestimmten Bakterien kann es hier dazu kommen, dass das bakterielle FimH-Protein , das in Typ-1-Pili vorkommt, von dem Glykoprotein GP2 auf der M-Zelle erkannt wird. Dieses Material wird in membranenumschlossenen Vesikeln durch die Zelle zur basalen Zellmembran transportiert, wo es in den Extrazellularraum freigesetzt wird; diesen Vorgang bezeichnet man als Transcytose . Da die M-Zellen keine Glykokalyx besitzen und dadurch viel zugänglicher sind als die Enterocyten, greift eine Reihe von Bakterien die M-Zellen an, um durch sie in den Subepithelialraum zu gelangen, obwohl sich die Bakterien dann in der Zentrale des adaptiven Immunsystems des Darms wiederfinden. Das sind beispielsweise der Typhuserreger Salmonella enterica Serotyp Typhi oder auch andere Serotypen von Salmonella enterica , die die Hauptursache für bakterielle Lebensmittelvergiftungen sind, Shigella-Spezies, die Dysenterie (Ruhr) hervorrufen, und Yersinia pestis, der Pesterreger. Das Poliovirus, Reoviren, einige Retroviren wie HIV und auch Prionen, die Ursache von Scrapie (Traberkrankheit), dringen alle über diesen Weg in den Körper ein. Nachdem Bakterien in eine M-Zelle gelangt sind, produzieren sie Proteine, die das Cytoskelett der M-Zelle umstrukturieren, wodurch die Transcytose gefördert wird.
Die basale Zellmembran einer M-Zelle ist stark gefaltet und bildet eine Tasche, die Lymphocyten umschließt und mit lokalen myeloischen Zellen, beispielsweise mit dendritischen Zellen (Abb. 12.7), enge Kontakte ausbildet. Makrophagen und dendritische Zellen nehmen das transportierte Material auf, das die M-Zellen freisetzen, und verarbeiten es, um es den T-Lymphocyten zu präsentieren. Die lokalen dendritischen Zellen befinden sich an einer günstigen Stelle, um Antigene aus dem Darm aufzunehmen. Sie werden von Chemokinen, die von den Epithelzellen konstitutiv freigesetzt werden, zum follikelassoziierten Epithel oder sogar dort hinein gelockt. Zu den Chemokinen gehören CCL20 (MIP-3α) und CCL9 (MIP-1γ), die an die Rezeptoren CCR6 beziehungsweise CCR1 auf dendritischen Zellen binden (Anhang IV enthält eine Liste der Chemokine und ihrer Rezeptoren). Die antigenbeladenen dendritischen Zellen wandern dann aus dem Bereich des subepithelialen Doms in die T-Zell-Regionen der Peyer-Plaques, wo sie auf naive antigenspezifische T-Zellen treffen. Die dendritischen Zellen und die primär geprägten T-Zellen aktivieren dann zusammen B-Zellen und lösen einen Isotypwechsel aus. Alle diese Vorgänge – die Antigenaufnahme durch die M-Zellen, die Wanderung der dendritischen Zellen in die Epithelschicht, die Produktion von Chemokinen und die anschließende Wanderung der dendritischen Zellen in die T-Zell-Zonen – nehmen in Gegenwart pathogener Organismen und ihrer Produkte deutlich zu, da Mustererkennungsrezeptoren auf Epithelzellen und Immunzellen quervernetzt werden (Abschn. 10.1007/978-3-662-56004-4_3#Sec6). Ähnliche Vorgänge spielen auch bei der Induktion von Immunantworten in den isolierten Lymphfollikeln des Darms und in den MALT anderer Schleimhäute eine Rolle.
Das Immunsystem der Schleimhäute enthält eine große Zahl von Effektorlymphocyten, selbst wenn keine Erkrankung vorliegt
Neben den organisierten lymphatischen Organen enthalten Schleimhautoberflächen , etwa im Darm oder in der Lunge, große Mengen an Lymphocyten und anderen Leukocyten, die sich im gesamten Gewebe verteilen. Die meisten der verstreuten Lymphocyten sehen aus wie Zellen, die durch ein Antigen aktiviert wurden; sie machen die T-Effektorzellen und Plasmazellen des mucosalen Immunsystems aus. Im Darm kommen Effektorzellen in zwei Hauptkompartimenten vor: im Epithel und in der Lamina propria (Abb. 12.5).
Diese Gewebe unterscheiden sich immunologisch ziemlich deutlich voneinander, wobei sie nur durch die dünne Schicht der Basalmembran getrennt sind. Der lymphatische Anteil des Epithels enthält vor allem Lymphocyten, von denen im Dünndarm fast alle CD8-T-Zellen sind. Die Lamina propria enthält viele Arten von Immunzellen, beispielsweise IgA-produzierende Plasmazellen, konventionelle CD4- und CD8-T-Zellen mit Effektor- und Gedächtniszelltypen, angeborene lymphatische Zellen, dendritische Zellen, Makrophagen und Mastzellen. Die T-Zellen in der Lamina propria des Dünndarms exprimieren das α4:β7-Integrin und den Chemokinrezeptor CCR9 (Abb. 12.8), durch den sie aus dem Blutkreislauf in die Gewebe gelenkt werden. Intraepitheliale Lymphocyten (IELs) sind größtenteils CD8-T-Zellen und exprimieren entweder die konventionelle α:β-Form von CD8 oder das CD8α:α-Homodimer, das wahrscheinlich dazu dient, die Aktivierung von T-Zellen abzuschwächen. Diese IEL-Zellen exprimieren CCR9 und das αE:β7-Integrin (CD103 ), das an E-Cadherin auf Epithelzellen bindet (Abb. 12.9). Im Gegensatz dazu dominieren in der Lamina propria die CD4-T-Zellen.
Die gesunde Darmschleimhaut zeigt deshalb viele Merkmale einer chronischen Entzündungsreaktion wie das Vorhandensein von zahlreichen Effektorlymphocyten und anderen Leukocyten in den Geweben. Für ein gesundes, nichtlymphatisches Gewebe wäre diese große Anzahl von Effektorzellen ungewöhnlich, diese zeigt aber beim Darm nicht notwendigerweise eine Entzündung an. Es handelt sich vielmehr um eine lokale Reaktion gegen die Unzahl von harmlosen Antigenen, die im Normalfall an Schleimhautoberflächen vorkommen. Dies ist für die Aufrechterhaltung der vorteilhaften Symbiose zwischen Wirt und Mikroflora essenziell. Dabei kommt es zu einer ausbalancierten Bildung von T-Effektorzellen und regulatorischen T-Zellen. Falls es jedoch notwendig wird, kann auch eine vollständige adaptive Immunantwort gegen einen eindringenden Krankheitserreger ausgelöst werden.
Das Zirkulieren der Lymphocyten innerhalb des mucosalen Immunsystems wird von gewebespezifischen Adhäsionsmolekülen und Chemokinrezeptoren reguliert
Wenn Effektorlymphocyten in der Oberflächenschleimhaut ankommen, so ist dies das Ergebnis von Veränderungen der Homing-Eigenschaften von Lymphocyten während ihrer Aktivierung. Naive T-Zellen und B-Zellen, die im Blutkreislauf zirkulieren, sind nicht darauf festgelegt, in welches Kompartiment des Immunsystems sie letztendlich gelangen. Sie gelangen über die Venolen mit hohem Endothel in die Peyer-Plaques und die mesenterialen Lymphknoten (Abb. 10.1007/978-3-662-56004-4_9#Fig4). Wie beim systemischen Immunsystem wird dies von den Chemokinen CCL21 und CCL19 kontrolliert, die aus den Lymphgeweben freigesetzt werden und an den Rezeptor CCR7 auf den naiven Lymphocyten binden. Im Fall der Peyer-Plaques und der isolierten Lymphfollikel wird dies noch durch die Bindung des Adressins MAdCAM-1 auf dem hohen Endothel der mucosalen Blutgefäße an das L-Selektin auf den naiven T-Zellen unterstützt. Für die Rekrutierung naiver B-Zellen zu den Peyer-Plaques und den isolierten Lymphfollikeln des Darms ist zudem der Rezeptor CXCR5 von Bedeutung, der auf CXCL13 reagiert, das in den B-Zell-Follikeln produziert wird. Wenn die naiven Lymphocyten nicht auf ihr Antigen treffen, verlassen sie wie bei anderen sekundären Lymphgeweben diese ebenfalls über die efferenten Lymphgefäße und kehren in das Blut zurück. Wenn sie in den GALT auf ein Antigen treffen, werden die Lymphocyten aktiviert, und sie exprimieren CCR7 und L-Selektin nicht mehr. Das bedeutet, dass sie die Fähigkeit zum Homing in die peripheren lymphatischen Organe verlieren, sobald sie diese verlassen, da sie nicht mehr über die Venolen mit hohem Endothel dorthin zurückkehren können (Abschn. 10.1007/978-3-662-56004-4_9#Sec6).
Lymphocyten, die in den lymphatischen Organen der Schleimhäute aktiviert wurden, wandern zurück in die Schleimhaut, wo sie sich in Form von Effektorzellen ansammeln. Einige der T- und B-Lymphocyten, die in den Peyer-Plaques aktiviert werden, können zwar direkt in angrenzende Bereiche der Lamina propria einwandern, die meisten verlassen aber die Peyer-Plaques über die Lymphgefäße, wandern durch die mesenterialen Lymphknoten und gelangen schließlich in den Ductus thoracicus . Von dort aus zirkulieren sie im Blutkreislauf (Abb. 12.8) und kehren über kleine Blutgefäße selektiv in die Lamina propria des Darms zurück. Antigenspezifische naive B-Zellen in den follikulären Bereichen der Peyer-Plaques wechseln dort von der IgM- zur IgA-Produktion, aber sie differenzieren sich erst vollständig zu IgA-produzierenden Plasmazellen, sobald sie in die Lamina propria zurückgekehrt sind. Das führt dazu, dass in den Peyer-Plaques nur wenige Plasmazellen vorkommen, genauso wie die T-Effektorzellen, die sich auch erst nach ihrer Ankunft in der Schleimhaut vollständig differenzieren.
Das darmspezifische Homing von antigenspezifischen T- und B-Zellen wird zu einem großen Teil durch die Expression des Adhäsionsmoleküls α4:β7-Integrin auf den Lymphocyten bestimmt. Es bindet das mucosale gefäßspezifische Adressin MAdCAM-1 , das auf den Endothelzellen vorkommt, die die Blutgefäße im Darm auskleiden (Abb. 12.9). Die Lymphocyten, die ursprünglich im Darm primär geprägt wurden, werden ebenfalls aufgrund einer gewebespezifischen Expression von Chemokinen durch das Darmepithel wieder zurückgelockt. CCL25 (TECK) wird von den Epithelzellen des Dünndarms konstitutiv exprimiert und ist ein Ligand für den Rezeptor CCR9, den T- und B-Zellen exprimieren, die beim Homing auf den Darm festgelegt sind. Innerhalb des Verdauungstrakts besteht eine regionale Spezialisierung der Chemokinexpression, da CCL25 außerhalb des Dünndarms nicht exprimiert wird und CCR9 nicht für die Wanderung in den Dickdarm erforderlich ist. Der Dickdarm, die Milchdrüsen der Brust und die Speicheldrüsen exprimieren CCL28 (MEC, mucosales Epithelchemokin ), das ein Ligand des Rezeptors CCR10 auf darmbasierten Lymphocyten ist und die IgA-produzierenden B-Lymphoblasten anlockt. Die Adressine und Chemokinrezeptoren, die bei der Wanderung von aktivierten Lymphocyten zu anderen mucosalen Oberflächen eine Rolle spielen, sind unbekannt.
Unter normalen Bedingungen werden nur Lymphocyten, die in den darmassoziierten sekundären lymphatischen Organen zum ersten Mal auf ein Antigen treffen, stimuliert, darmspezifische Homing-Rezeptoren und Integrine zu exprimieren. Wie wir im nächsten Abschnitt erfahren, regen dendritische Zellen des Darms , während sie ihr Antigen präsentieren, T-Lymphocyten an (imprinting), diese Moleküle zu exprimieren. Im Gegensatz dazu veranlassen dendritische Zellen aus nichtmucosalen Lymphgeweben die T-Lymphocyten, andere Adhäsionsmoleküle und Chemokinrezeptoren zu exprimieren – beispielsweise das α4:β1-Integrin (VLA-4 ), welches an VCAM-1 bindet, das kutane lymphocytenassoziierte Antigen (cutaneous lymphoid antigen, CLA), das an E-Selektin bindet, und den Chemokinrezeptor CCR4. Diese Moleküle lenken die Zellen in die Gewebe, etwa in die Haut (Abschn. 10.1007/978-3-662-56004-4_11#Sec5). Durch diese gewebespezifischen Auswirkungen des Primings von Lymphocyten in den GALT lässt sich erklären, warum eine wirksame Impfung gegen Darminfektionen eine Immunisierung über einen mucosalen Weg erfordert – bei anderen Verfahren wie der subkutanen oder intramuskulären Immunisierung sind keine dendritischen Zellen mit den passenden Prägungsmerkmalen beteiligt.
Das Priming von Lymphocyten in einem mucosalen Gewebe kann an anderen mucosalen Oberflächen einen Immunschutz herbeiführen
Nicht alle Bereiche des mucosalen Immunsystems nutzen dieselben gewebespezifischen Chemokine, sodass eine lokalisierte Kompartimentierung der Lymphocytenzirkulation innerhalb des Systems möglich ist. Deshalb kehren T- und B-Effektorzellen, die in den ableitenden lymphatischen Organen des Dünndarms (mesenteriale Lymphknoten und Peyer-Plaques) ihr Priming durchlaufen haben, mit der größten Wahrscheinlichkeit in den Dünndarm zurück; entsprechend wandern die in den Atemwegen primär geprägten Lymphocyten am effektivsten wieder in die dortige Mucosa. Dieses Homing ist offensichtlich hilfreich, denn die antigenspezifischen Effektorzellen gelangen wieder in die mucosalen Organe, in denen sie eine Infektion am wirksamsten bekämpfen oder die Immunantworten gegen fremde Proteine und kommensale Organismen am besten regulieren können. Einige Lymphocyten jedoch, die beispielsweise in den GALT primär geprägt wurden, können als Effektorzellen auch zu anderen mucosalen Geweben wandern, etwa in die Atemwege, den Urogenitaltrakt und die Milchdrüsen der Brust. Diese Überlagerung der mucosalen Zirkulationswege ließ die Vorstellung eines gemeinsamen mucosalen Immunsystems entstehen, das sich von den übrigen Teilen des Immunsystems unterscheidet. Man weiß zwar inzwischen, dass es sich hier um eine zu starke Vereinfachung handelt, aber es ergeben sich daraus doch mehrere wichtige Konsequenzen für die Entwicklung von Impfstoffen, da so die Immunisierung über eine beliebige Schleimhaut möglich sein kann und der Schutz vor Infektionen auch an einer anderen Stelle besteht. Ein wichtiges Beispiel dafür ist das Auslösen der IgA-Antikörper-Produktion in der milchproduzierenden Brust durch eine natürliche Infektion oder Impfung an mucosalen Oberflächen, etwa im Darm. Das liegt daran, dass die Blutgefäße in der milchproduzierenden Brust MAdCAM-1 exprimieren; dieses Phänomen ist ein entscheidender Mechanismus, durch den Säuglinge die Antikörper passiv mit der Milch aufnehmen. Ein weiteres Beispiel dafür ließ sich an Versuchstieren veranschaulichen, bei denen durch eine Immunisierung über die Nase Immunantworten im Urogenitaltrakt gegen HIV primär geprägt werden konnten. Der zugrundeliegende Mechanismus ist nicht bekannt.
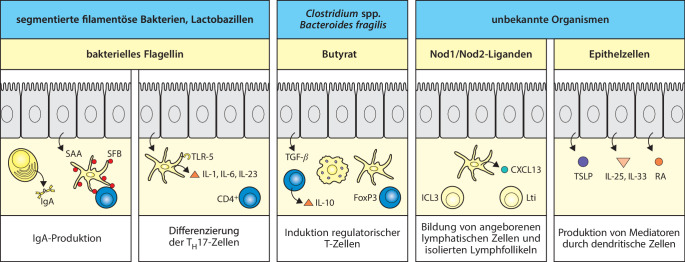
Abgegrenzte Populationen von dendritischen Zellen kontrollieren die mucosalen Immunantworten
Dendritische Zellen sind wie überall auch in den mucosalen Geweben für die Initiation und Ausformung der Immunantworten von großer Bedeutung. Sie kommen in den sekundären lymphatischen Organen der Schleimhäute vor, sind aber auch verstreut auf allen mucosalen Oberflächen anzutreffen. Innerhalb der Peyer-Plaques kommen dendritische Zellen in zwei Hauptregionen vor. Dendritische Zellen können im subepithelialen Dom von den M-Zellen Antigene aufnehmen (Abb. 12.10). Im Darm sind die beiden vorherrschenden Subpopulationen der dendritischen Zellen vertreten (Abschn. 10.1007/978-3-662-56004-4_6#Sec6 und 10.1007/978-3-662-56004-4_9#Sec2). Bei Mäusen exprimiert die am häufigsten vorkommende Untergruppe der dendritischen Zellen CD11b (αM-Integrin) und nach ihrer Aktivierung besteht auch die Neigung zur Produktion von IL-23 . Dadurch wird die Entwicklung der TH17-Zellen gefördert und die ILC3-Zellen werden stimuliert. Beide produzieren wiederum IL-17 und IL-22 (Abschn. 10.1007/978-3-662-56004-4_3#Sec26 und 10.1007/978-3-662-56004-4_11#Sec3). Diese dendritischen Zellen exprimieren den Rezeptor CCR6 für das von follikelassoziierten Epithelzellen exprimierte CCL20. Im Ruhezustand halten sie sich unterhalb der Epithelien auf und produzieren IL-10 als Reaktion auf die Aufnahme von Antigenen, sodass eine nichtentzündliche Umgebung aufrechterhalten wird. Während einer Infektion mit einem Krankheitserreger wie Salmonella werden dendritische Zellen als Reaktion auf CCL20 schnell zur Epithelschicht des Peyer-Plaques geleitet. Beim Auftreten von Bakterien setzen die Epithelzellen erhöhte Mengen von CCL20 frei. Auch bakterielle Produkte aktivieren die dendritischen Zellen, costimulierende Moleküle zu exprimieren, wodurch sie pathogenspezifische naive T-Zellen anregen, sich zu Effektorzellen zu differenzieren. In der T-Zell-Zone der Peyer-Plaques kommt auch die am wenigsten häufige Untergruppe von CD11b-negativen dendritischen Zellen vor, für deren Entwicklung der Faktor BATF3 notwendig ist; sie produzieren das Cytokin IL-12 (Abschn. 10.1007/978-3-662-56004-4_6#Sec6 und 10.1007/978-3-662-56004-4_9#Sec10). CD11b-exprimierende dendritische Zellen besitzen bei vielen Darminfektionen eine Schutzfunktion.

Dendritische Zellen kommen auch in der Wand des Dünndarms außerhalb der Peyer-Plaques vor, hauptsächlich in der Lamina propria. Sie nehmen aus dem Lumen und dem umgebenden Gewebe Antigene auf und halten sich im Darm nur relativ kurze Zeit auf, bevor sie mit der afferenten Lymphe zu einem ableitenden mesenterialen Lymphknoten wandern, wo sie den naiven T-Zellen Antigene präsentieren. Die Wanderung der dendritischen Zellen hängt auch hier wie überall vom Chemokinrezeptor CCR7 ab (Abb. 10.1007/978-3-662-56004-4_9#Fig17). Nach Schätzungen wandern pro Tag 5–10 % der Population der mucosalen dendritischen Zellen zu den mesenterialen Lymphknoten im ruhenden Darm , sodass den T-Zellen ständig Antigene von der Oberfläche des Darms präsentiert werden. Ohne eine Infektion oder Entzündung bringt das Zusammentreffen der wandernden dendritischen Zellen mit naiven T-Zellen in den mesenterialen Lymphknoten antigenspezifische regulatorische FoxP3+-T-Zellen hervor, die die darmspezifischen Homing-Moleküle CCR9 und das oben beschriebene Integrin α4:β7 exprimieren (Abschn. 12.1.4). Diese „primär geprägten“ Treg-Zellen verlassen dann den Lymphknoten und kehren zur Dünndarmwand zurück, wo sie entzündliche Reaktionen gegen harmlose Antigene aus der Nahrung unterdrücken.
Für die Entwicklung der Treg-Zellen und deren Expression von darmspezifischen Homing-Molekülen ist es notwendig, dass die dendritischen Zellen Retinsäure produzieren, die im Stoffwechsel von Retinal-Dehydrogenasen aus Vitamin A der Nahrung gebildet wird. Retinsäure wird auch von den Stromazellen in den mesenterialen Lymphknoten synthetisiert, wodurch die Wirkung der wandernden dendritischen Zellen weiter verstärkt wird. Retinsäureproduzierende dendritische Zellen kommen auch in den Peyer-Plaques vor und sind wahrscheinlich ebenfalls für die Entwicklung der regulatorischen T-Zellen von Bedeutung, entweder im Peyer-Plaque selbst oder nach der Wanderung in die mesenterialen Lymphknoten. Die Induktion von regulatorischen T-Zellen in den Darmgeweben wird durch den transformierenden Wachstumsfaktor β (TGF-β) unterstützt, der von dendritischen Zellen produziert wird. Wanderende Populationen der dendritischen Zellen, die in den Geweben ständig lokale Antigene aufnehmen und zu den ableitenden Lymphknoten transportieren, kommen ebenfalls im Dickdarm und an anderen mucosalen Oberflächen vor, etwa in der Lunge. Man nimmt zwar an, dass die dendritischen Zellen aus diesen Geweben auch bei der Aufrechterhaltung der Toleranz gegenüber harmlosem Material (etwa von kommensalen Bakterien) beteiligt sind, aber sie produzieren keine Retinsäure und es ist nicht bekannt, wie sie die Differenzierung und das Homing der T-Zellen beeinflussen.
Die beiden oben beschriebenen vorherrschenden Subpopulationen gehören auch zu den dendritischen Zellen der Lamina propria im Darm. Insgesamt erzeugen die Eigenschaften der dendritischen Zellen des Darms eine vor allem tolerogene Umgebung, die unnötige und zerstörerische Reaktionen auf Nahrungsmittel und kommensale Mikroorganismen verhindert. Das antiinflammatorische Verhalten der mucosalen dendritischen Zellen im gesunden Darm wird von Faktoren gefördert, die in der mucosalen Umgebung konstitutiv produziert werden. Dazu gehören das thymusstromale Lymphopoetin (TSLP ), der von dendritischen und epithelialen Zellen produzierte TGF-β , Prostaglandin PGE2 aus den Stromazellen sowie IL-10, das von Makrophagen und CD4-T-Zellen des Darms gebildet wird. Retinol, das in der Leber gespeichert und über die Gallenflüssigkeit in den Dünndarm transportiert wird, bildet eine weitere Quelle für die lokale Produktion von Retinsäure, um die dendritischen Zellen in der Wand des Dünndarms zu konditionieren.
Makrophagen und dendritische Zellen besitzen bei mucosalen Immunantworten unterschiedliche Funktionen
Die Lamina propria des gesunden Darms enthält die größte Population der Makrophagen im Körper. Sie exprimieren wie die dendritischen Zellen CD11c und MHC-Klasse-II-Moleküle, jedoch anders als diese kein CD103, aber FcγRI (CD64, Abb. 10.1007/978-3-662-56004-4_10#Fig38) und CX3CR1, den Rezeptor für CX3CL1 (Fractalkin ). Makrophagen können zudem nicht vom Darm zu den ableitenden Lymphknoten wandern und präsentieren den naiven T-Zellen keine Antigene. Anders als viele andere geweberesidente Makrophagen, etwa die im Gehirn oder in der Leber, die aus embryonalen Vorläufern hervorgehen (Abschn. 10.1007/978-3-662-56004-4_3#Sec2), müssen die Makrophagen des Darms ständig durch Monocyten aus dem Blut erneuert werden.
Makrophagen sind für die Aufrechterhaltung des gesunden Darms von großer Bedeutung. Sie befinden sich direkt unter dem Epithel und besitzen eine hohe phagocytotische Aktivität. Deshalb sind sie besonders dafür geeignet, alle Mikroorganismen, die durch die Epithelbarriere eindringen, aufzunehmen und abzubauen. Sie können auch absterbende Epithelzellen beseitigen, die im Darm in großer Zahl vorkommen. Dies ist eine unvermeidliche Folge eines sich schnell erneuernden Gewebes. Die Makrophagen des Darms erzeugen jedoch, abweichend von den Makrophagen in anderen Körperregionen, als Reaktion auf eine Phagocytose oder äußere Reize wie Bakterien oder TLR-Liganden keine nennenswerten Mengen an inflammatorischen Cytokinen oder reaktiven Sauerstoff- oder Stickstoffspezies. Das liegt daran, dass sie konstitutiv große Mengen IL-10 produzieren, wodurch sie Entzündungen begrenzen können, während sie als wirksame Fresszellen (Scavenger) fungieren. Das IL-10 der Makrophagen trägt auch dazu bei, dass die antigenspezifische Toleranz in der Schleimhaut aufrechterhalten wird. Diese ist notwendig, um das Überleben und die sekundäre Vermehrung der FoxP3+-Treg-Zellen zu ermöglichen, die in den Darm zurückgekehrt sind, nachdem sie von tolerogenen dendritischen Zellen im Lymphknoten primär geprägt wurden. Tatsächlich besitzen sie Eigenschaften beider Populationen und ihre Funktionen sind an die Bedingungen in ihrer lokalen Umgebung angepasst. Makrophagen und dendritische Zellen besitzen im Fließgleichgewicht des Darms unterschiedliche, aber sich ergänzende Funktionen. Die wandernden dendritischen Zellen sorgen für das anfängliche Priming und die Ausformung von T-Zell-Reaktionen in den sekundären lymphatischen Organen, und die sesshaften Makrophagen beseitigen Zellreste und Mikroorganismen und stimmen wahrscheinlich die Aktivitäten von bereits primär geprägten T-Zellen in der Schleimhaut ab.
Antigenpräsentierende Zellen in der Darmschleimhaut nehmen Antigene auf verschiedenen Wegen auf
Die Gesamtfläche zur Aufnahme von Antigenen, die M-Zellen in den Peyer-Plaques für das Immunsystem des Darms zur Verfügung stellen, ist begrenzt, und die Lamina propria selbst ist vollständig vom Epithel bedeckt. Man hat verschiedene zusätzliche Mechanismen postuliert, um zu erklären, wie Antigene das Epithel durchqueren können, sodass sie zu den Makrophagen und dendritischen Zellen gelangen können (Abb. 12.10). Lösliche Antigene wie Proteine aus der Nahrung werden möglicherweise durch Epithelzellen oder durch Lücken transportiert, die dadurch entstehen, dass absterbende Zellen beseitigt werden. Andererseits können M-Zellen auch außerhalb der Peyer-Plaques im Oberflächenepithel der Schleimhaut vorkommen. Einige Darmbakterien, beispielsweise die enteropathogenen und enterohämolytischen Stämme von E. coli, verfügen über spezielle Mechanismen, mit denen sie sich an Epithelzellen heften und in diese eindringen können, um auf diese Weise direkt die darunterliegende Lamina propria zu erreichen. Antigene aus dem Lumen können dadurch zu den dendritischen Zellen der Lamina propria gelangen, dass Epithelzellen, die den neonatalen Fc-Rezeptor (FcRn) exprimieren, mit Antikörpern umhüllte Antigene aufnehmen. Antigene aus apoptotischen Epithelzellen werden möglicherweise von kreuzpräsentierenden dendritischen Zellen prozessiert (Abschn. 10.1007/978-3-662-56004-4_6#Sec6). Dadurch werden Immunantworten gegen enterische Viren (beispielsweise Rotaviren) ausgelöst. Diese Viren verursachen Durchfallerkrankungen aufgrund ihrer besonderen Fähigkeit, Enterocyten zu infizieren.
Makrophagen in der Lamina propria nehmen ebenfalls lokale Antigene auf, indem sie transepitheliale Dendriten zwischen den Epithelzellen hindurchstrecken, mit denen sie das Darmlumen erreichen und Bakterien aufgreifen (Abb. 12.10). Die Makrophagen der Lamina propria nehmen offensichtlich auch lösliche Antigene aus dem Lumen auf und leiten sie an dendritische Zellen weiter, die sie anschließend den T-Zellen präsentieren. Einige Untersuchungen deuten auch darauf hin, dass dendritische Zellen oder Makrophagen sogar einen Weg in das Lumen finden und dort Antigene wie Bakterien aufnehmen, mit denen sie dann in die Lamina propria zurückkehren.
Die sezernierten IgA-Antikörper bilden den Isotyp, der mit dem mucosalen Immunsystem verknüpft ist
Der im mucosalen Immunsystem vorherrschende Isotyp der Antikörper ist IgA. Diese Antikörper werden lokal von Plasmazellen produziert, die in der Schleimhautwand vorkommen. In den beiden Hauptkompartimenten, dem Blut und den Schleimhäuten, in denen IgA lokalisiert ist, besitzt das Molekül eine unterschiedliche Struktur. Im Blut liegt es vor allem als Monomer (mIgA) vor, das von Plasmazellen im Knochenmark produziert wird. Diese gehen aus B-Zellen hervor, die in den Lymphknoten aktiviert wurden. In den mucosalen Geweben wird IgA fast ausschließlich als Polymer, normalerweise als Dimer, produziert, dessen monomere Bausteine durch eine J-Kette verknüpft sind (Abschn. 10.1007/978-3-662-56004-4_5#Sec21).
Die naiven B-Zell-Vorläufer der IgA-produzierenden Plasmazellen werden in den Peyer-Plaques und den mesenterialen Lymphknoten aktiviert. Der Isotypwechsel von aktivierten B-Lymphocyten zur IgA-Produktion erfolgt unter der Kontrolle des Cytokins TGF-β . Im Darm des Menschen hängt dieser Isotypwechsel ausschließlich von T-Zellen ab und kommt nur in den organisierten Lymphgeweben vor, wo follikuläre T-Helferzellen (TFH) den B-Zellen über dieselben Mechanismen Signale übermitteln, wie sie in Kap. 10.1007/978-3-662-56004-4_10 besprochen wurden. Die anschließende Vermehrung und Differenzierung der B-Zellen, die nun IgA exprimieren, werden von IL-5, IL-6, IL-10 und IL-21 in Gang gesetzt. In einem normalen Darm des Menschen sind bis zu 75.000 IgA-produzierende Plasmazellen vorhanden und pro Tag sezernieren die mucosalen Gewebe 3–4 g IgA-Antikörper, der hier der vorherrschende Isotyp. Diese ständige Produktion von großen Mengen IgA erfolgt ohne Anwesenheit von eingedrungenen Pathogenen und wird fast ausschließlich durch die Erkennung der kommensalen Mikroflora angeregt.
Beim Menschen kommen sowohl monomere als auch dimere IgA-Antikörper in Form von zwei Isotypen vor: IgA1 und IgA2. Das Verhältnis von IgA1 zu IgA2 variiert stark in Abhängigkeit vom Gewebe. Im Blut und in den oberen Atemwegen beträgt es 10:1, im Dünndarm 3:2 und im Dickdarm 2:3. Einige weit verbreitete Pathogene der Schleimhaut der Atemwege (etwa Haemophilus influenzae) und der Schleimhäute in den Genitalien (etwa Neisseria gonorrhoeae) produzieren proteolytische Enzyme, die IgA1 spalten können, während IgA2 einer Spaltung widersteht. Der höhere Anteil von Plasmazellen im Dickdarm, die IgA2 produzieren, ist wahrscheinlich eine Folge der höheren Dichte von kommensalen Mikroorganismen, die die Produktion von Cytokinen anregen, sodass es zu einem selektiven Isotypwechsel kommt. Bei Mäusen gibt es nur einen IgA-Isotyp und dieser ist dem IgA2-Isotyp des Menschen am ähnlichsten.
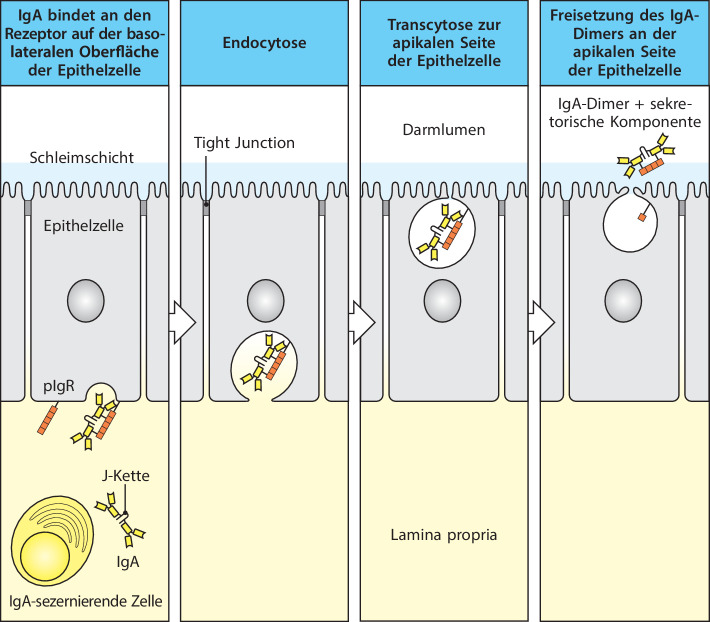
Nach ihrer Aktivierung und Differenzierung exprimieren die so gebildeten B-Lymphoblasten das mucosale Homing-Integrin α4:β7 sowie die Chemokinrezeptoren CCR9 und CCR10 . Die Lokalisierung von IgA-freisetzenden Plasmazellen in den mucosalen Geweben wird durch die oben besprochenen Mechanismen erreicht. Sobald die Plasmazellen in die Lamina propria gelangt sind, durchlaufen die B-Zellen die abschließende Differenzierung zu Plasmazellen, die IgA-Dimere synthetisieren und in den Subepithelialraum sezernieren (Abb. 12.11). Um ihre Zielantigene im Darmlumen zu erreichen, müssen IgA-Antikörper durch das Epithel transportiert werden. Das geschieht mithilfe des Immunglobulinpolymerrezeptors (Poly-Ig-Rezeptor , pIgR ), der in Abschn. 10.1007/978-3-662-56004-4_10#Sec18 vorgestellt wurde. pIgR wird auf den basolateralen Oberflächen der unreifen Epithelzellen an der Basis der Darmkrypten konstitutiv exprimiert und bindet kovalent an den Fc-Anteil der durch die J-Kette verknüpften polymeren Immunglobuline, etwa an das dimere IgA und das pentamere IgM, und transportiert die Antikörper durch Transcytose an die Epitheloberfläche des Darmlumens, wo sie durch proteolytische Spaltung der extrazellulären Domäne des Rezeptors freigesetzt werden. Ein Teil des gespaltenen Rezeptors bleibt mit IgA assoziiert, man bezeichnet ihn daher als sekretorische Komponente (häufig mit SC abgekürzt). Den entstandenen Antikörper bezeichnet man als sekretorisches IgA (sIgA).
Bei einigen Tieren gibt es einen zweiten Weg der IgA-Freisetzung in den Darm – den Leber-Gallen-Weg (hepatobiliärer Weg ). Dimere IgA-Antikörper , die nicht an den Poly-Ig-Rezeptor auf Epithelzellen binden, werden in Venolen in der Lamina propria aufgenommen, die das Blut aus dem Darm über die Pfortader in die Leber leiten. In der Leber sind diese kleinen Venen (Sinusoide) innen mit einem Endothel beschichtet, durch das die Antikörper zu Hepatocyten gelangen können, die pIgR auf ihrer Oberfläche tragen. IgA wird von den Hepatocyten aufgenommen und gelangt durch Transcytose in die angrenzenden Gallengänge. Auf diese Weise können sekretorische IgA -Antikörper über den gemeinsamen Gallengang direkt in den oberen Dünndarm freigesetzt werden. Durch den Leber-Gallen-Weg können dimere IgA-Antikörper Antigene neutralisieren, die in die Lamina propria eingedrungen sind und dort von IgA gebunden werden. Dieser Weg ist zwar bei Ratten, Kaninchen und Hühnern sehr wirksam, nicht jedoch beim Menschen und bei anderen Primaten, bei denen die Hepatocyten pIgR nicht exprimieren.
IgA , das in das Darmlumen freigesetzt wird, bindet über Kohlenhydratdeterminanten in der sekretorischen Komponente an die Schleimschicht, die die Epitheloberfläche bedeckt. Dort wirkt IgA dabei mit, das Eindringen von Krankheitserregern zu verhindern. Außerdem besitzt IgA bei der Aufrechterhaltung des homöostatischen Gleichgewichts zwischen dem Wirt und der kommensalen Mikroflora eine ebenso wichtige Funktion. Das geschieht auf verschiedene Weise (Abb. 12.12). Zum einen verhindert IgA, dass sich Mikroorganismen an das Epithel heften. Dabei wird die Fähigkeit von IgA, Bakterien zu binden, durch den ungewöhnlich großen und flexiblen Winkel zwischen den Fab-Fragmenten des IgA-Moleküls unterstützt; das gilt vor allem für den IgA1-Isotyp (Abschn. 10.1007/978-3-662-56004-4_5#Sec17). So können große Antigene, beispielsweise Bakterien, sehr effizient bivalent gebunden werden. IgA kann auch Toxine und Enzyme von Mikroorganismen neutralisieren.
Neben dieser Aktivität im Darmlumen kann IgA anscheinend auch in den Endosomen innerhalb von Epithelzellen bakterielle Lipopolysaccharide und Viren neutralisieren, außerdem durch die Epithelbarriere der Lamina propria, nachdem Bakterien und Viren dort eingedrungen sind. Die entstehenden IgA:Antigen-Komplexe werden in das Darmlumen zurücktransportiert, von wo sie dann aus dem Körper ausgeschieden werden (Abb. 12.12). Komplexe, die dimere IgA-Antikörper enthalten und in der Lamina propria gebildet wurden, können auch über den Leber-Gallen-Weg (siehe oben) ausgeschieden werden. Die Bildung von IgA:Antigen-Komplexen kann nicht nur die Beseitigung von Antigenen ermöglichen, sondern auch die Aufnahme von Antigenen aus dem Lumen durch die M-Zellen und lokale dendritische Zellen verstärken. Indem die Kohlenhydratreste auf IgA von Lektinrezeptoren wie Dectin-1 und DC-SIGN gebunden werden. Neben dieser antigenspezifischen Wirkung können sekretorische IgA-Antikörper auch das Eindringen von Bakterien durch einen unspezifischen Mechanismus verhindern. Das liegt an dem hohen Kohlenhydratanteil auf dem Fc-Fragment der schweren IgA-Kette, durch den IgA als „Köder“ für Rezeptoren fungiert, mit deren Hilfe Bakterien an Kohlenhydrate auf Epithelien binden. Die sekretorischen IgA-Antikörper besitzen nur ein geringes Potenzial, den klassischen Weg der Komplementaktivierung auszulösen, und auch die Wirksamkeit als Opsonin ist nur gering, sodass sie keine Entzündung auslösen. Die Aufnahme von IgA:Antigen-Komplexen durch dendritische Zellen veranlasst diese Zellen zudem, das antiinflammatorische IL-10 zu produzieren. Insgesamt führen diese Eigenschaften dazu, dass IgA das Eindringen von Mikroorganismen in die Schleimhaut begrenzen kann, ohne dass die Gefahr besteht, dass diese empfindlichen Gewebe durch eine Entzündung geschädigt werden, denn das hätte potenziell negative Auswirkungen auf den Darm. Aus demselben Grund ist IgA von entscheidender Bedeutung für die vorteilhafte Symbiose zwischen dem Wirtsorganismus und den kommensalen Bakterien im Darm (Abschn. 12.2.6).
Zur IgA-Produktion können bei einigen Spezies auch T-unabhängige Prozesse beitragen
Bei Mäusen entsteht, anders als beim Menschen, ein relevanter Anteil der IgA -Antikörper des Darms durch B-Zell-Aktivierung und Isotypwechsel, die beide von T-Zellen unabhängig sind. Das beruht auf der Aktivierung des angeborenen Immunsystems durch die Produkte von kommensalen Bakterien und ist wahrscheinlich die Folge einer direkten Wechselwirkung zwischen B-Zellen und konventionellen wie auch follikulären dendritischen Zellen in isolierten Lymphfollikeln. An dieser Antikörperproduktion sind anscheinend Lymphocyten der B1-Subpopulation beteiligt (Abschn. 10.1007/978-3-662-56004-4_8#Sec10), die aus B-Zell-Vorläufern in der Bauchhöhle hervorgehen und als Reaktion auf mikrobielle Bestandteile wie Lipopolysaccharide zur Darmwand wandern. Sobald diese B-Zellen die Schleimhaut erreicht haben, kommt es zu einem TGF-β-abhängigen Isotypwechsel zu IgA, bei dem auch lokale Faktoren ausschlaggebend sind, beispielsweise IL-6 , Retinsäure sowie BAFF und APRIL (Abb. 10.1007/978-3-662-56004-4_10#Fig6), die an TACI auf B-Zellen binden. Diese wirken anstelle der Signale, die normalerweise von den CD4-T-Helferzellen übermittelt werden (Abschn. 10.1007/978-3-662-56004-4_10#Sec2). Die Darmepithelzellen können BAFF und APRIL produzieren, und wahrscheinlich steuern auch lokale eosinophile Zellen APRIL, IL-6 und TGF-β bei. Andere myeloische Zellen können Stickstoffmonoxid (NO) und TNF-α erzeugen, die beide die Prozessierung und Aktivierung von TGF-β unterstützen.
Die bei diesen T-Zell-unabhängigen Reaktionen produzierten IgA -Antikörper zeigen nur eine begrenzte Diversität und eine generell niedrige Affinität sowie kaum Anzeichen einer somatischen Hypermutation. Dennoch sind sie als „natürliche“ Antikörper, die gegen die kommensalen Bakterien gerichtet sind, von großer Bedeutung. Bis jetzt gibt es nur wenige Hinweise darauf, dass der Mensch auch über solche IgA-Antikörper verfügt, da hier somatische Hypermutationen bei allen sekretorischen IgA-Reaktionen auftreten, die zudem anscheinend T-Zell-abhängig sind. Die aktivierungsinduzierte Cytidin-Desaminase (AID ), die für den Isotypwechsel erforderlich ist (Kap. 10.1007/978-3-662-56004-4_5), lässt sich in der Lamina propria des menschlichen Darms nicht nachweisen, was darauf hindeutet, dass der Isotypwechsel dort wahrscheinlich nicht stattfindet. Da dies aber bei den B-Zellen in der Lamina propria von Mäusen der Fall ist, können wir hier einen kurzen Einblick in die Evolutionsgeschichte der spezifischen Antikörperantworten in den Schleimhäuten gewinnen. So lassen sich vielleicht auch Hinweise auf Reaktionswege finden, die aktiviert werden können, wenn bei einem Menschen die T-Zell-abhängige IgA-Produktion gestört ist, etwa im Fall von AIDS. Jedenfalls kommt es wahrscheinlich in der Lamina propria zu einer sekundären Reaktivierung von auf IgA festgelegten B-Lymphoblasten, die sich dann vollständig zu Plasmazellen differenzieren. Daran sind wahrscheinlich auch myeloische Zellen und Epithelzellen beteiligt, die APRIL, BAFF und andere Mediatoren produzieren.
Beim Menschen kommt es relativ häufig zu einem IgA-Defekt, der sich jedoch durch sekretorische IgM-Antikörper ausgleichen lässt
Ein selektiver Mangel an IgA-Produktion ist eine der am meisten verbreiteten primären Immunschwächen beim Menschen und tritt mit einer Häufigkeit von 1:700 bis 1:500 bei Bevölkerungsgruppen europäischer Herkunft auf, wobei die Rate bei anderen ethnischen Gruppen etwas niedriger ist. Man hat festgestellt, dass in diesem Zusammenhang am häufigsten TACI , der Rezeptor für BAFF, von einer Mutation betroffen ist. Bei älteren Menschen mit einem IgA-Defekt kommt es etwas häufiger zu Infektionen der Atemwege, zu Atopien (der Neigung zu allergischen Reaktionen auf harmlose Antigene) und zu Autoimmunkrankheiten. Die meisten Menschen mit einem IgA-Defekt sind jedoch für Infektionen nicht übermäßig anfällig, wenn nicht auch ein Defekt der IgG2-Produktion vorliegt. IgA ist wahrscheinlich deswegen nicht unbedingt notwendig, weil IgM in Sekreten IgA als vorherrschenden Antikörper ersetzen kann, und tatsächlich ist bei Menschen mit einem IgA-Defekt die Anzahl der IgM-produzierenden Plasmazellen in der Darmschleimhaut erhöht. Da IgM ein durch J-Ketten verknüpftes Polymer ist, werden IgM-Antikörper, die in der Darmschleimhaut erzeugt werden, von pIgR effektiv gebunden und als sekretorische IgM-Antikörper durch die Epithelzellen in das Darmlumen transportiert. Die Bedeutung dieses Absicherungsmechanismus ließ sich bei Knockout-Mäusen zeigen. Tiere, denen nur IgA fehlt, besitzen einen normalen Phänotyp, während es bei einem Fehlen von pIgR zu einer Anfälligkeit für Infektionen der Schleimhaut kommt. Bei diesen Tieren dringen jedoch auch kommensale Bakterien verstärkt in die Gewebe ein und es kommt zu einer systemischen Immunantwort gegen diese Bakterien. Einen genetisch bedingten pIgR-Mangel hat man allerdings noch nie bei Menschen festgestellt, was darauf hindeutet, dass dieser Defekt letal ist.
Die Lamina propria des Darms enthält T-Zellen mit „Antigenerfahrung“ und ungewöhnliche angeborene lymphatische Zellen
Die meisten Zellen in der gesunden Lamina propria wurden von dendritischen Zellen aktiviert und exprimieren Marker von T-Effektor- oder T-Gedächtniszellen, wie etwa beim Menschen CD45RO . Außerdem werden darmspezifische Homing-Marker produziert, beispielsweise CCR9 und das α4:β7-Integrin, sowie Rezeptoren für proinflammatorische Chemokine wie CCL5 (RANTES). Das Zahlenverhältnis von CD4- zu CD8-T-Zellen liegt in der T-Zell-Population der Lamina propria bei 3:1 oder höher, ähnlich dem Verhältnis in den systemischen Lymphgeweben.
Die CD4-T-Zellen der Lamina propria sezernieren große Mengen an Cytokinen wie Interferon-γ (IFN-γ), IL-17 und IL-22, selbst wenn keine Infektion vorliegt. Dies entspricht wahrscheinlich dem normalen Dauerzustand der Erkennung der Mikroflora und anderer Antigene aus der Umgebung durch das Immunsystem. Die Bedeutung der CD4-T-Zellen zeigt sich an opportunistischen Infektionen des Darms bei Personen, die keine CD4-T-Zellen besitzen, wie es bei einer HIV-Infektion der Fall ist (Abschn. 10.1007/978-3-662-56004-4_13#Sec26). TH17-Effektorzellen besitzen in der Darmschleimhaut eine besondere Stellung, da ihre Produkte wichtige Bestandteile der lokalen Immunantwort sind. IL-17 wird für die vollständige Expression des Immunglobulinpolymerrezeptors benötigt, der bei der IgA-Sekretion in das Darmlumen eine Rolle spielt. IL-22 stimuliert die Zellen des Darmepithels , antimikrobielle Peptide zu produzieren, die dazu beitragen, die Integrität der Epithelbarriere aufrechtzuerhalten. CD8-T-Effektorzellen kommen in der normalen Lamina propria ebenfalls vor; sie können Cytokine produzieren und ihre cytotoxische Aktivität entfalten, sobald eine schützende Immunantwort gegen ein Pathogen erforderlich ist.
In jeder anderen Situation würde die Anwesenheit so vieler differenzierter T-Effektorzellen darauf hindeuten, dass hier ein Pathogen eingedrungen ist und eine Entzündung droht. Dass es in der Lamina propria nicht dazu kommt, liegt daran, dass die Erzeugung von TH1- und TH17-Zellen sowie der cytotoxischen T-Zellen von einer hinreichenden Anzahl von IL-17-produzierenden regulatorischen T-Zellen ausbalanciert wird. Im Dünndarm sind dies vor allem FoxP3-negative, im Dickdarm vor allem FoxP3-positive Treg-Zellen. Die meisten induzierbaren Treg-Zellen erkennen Antigene von Organismen der Mikroflora.
Die gesunde Lamina propria enthält auch viele angeborene lymphatische Zellen (ILCs ) (Abschn. 10.1007/978-3-662-56004-4_1#Sec25 und 10.1007/978-3-662-56004-4_9#Sec22). Die ILC3-Untergruppe in der Darmschleimhaut ist sowohl beim Menschen als auch bei Mäusen von besonderer Bedeutung. Reife ILC3-Zellen produzieren IL-17 und IL-22, einige exprimieren auch die NK-Zell-Rezeptoren NKp44 und NKp46 . Ihre Entwicklung wird durch den Arylkohlenhydratrezeptor und den Transkriptionsfaktor RORγt kontrolliert (Abschn. 10.1007/978-3-662-56004-4_9#Sec23). ILC3-Zellen kommen in den sekundären lymphatischen Organen des Darms vor und sind für die Entwicklung ihres Lymphgewebes dort von großer Bedeutung. Als Reaktion auf das Cytokin IL-23 , das von lokalen dendritischen Zellen sezerniert wird, produzieren die ILC3-Zellen IL-22. Dieses wiederum stimuliert das Epithel, antimikrobielle Peptide zu produzieren, die die lokale Abwehr von pathogenen Bakterien und Pilzen im Darm fördern. Im Verlauf entzündlicher Erkrankungen können ILC3-Zellen die Fähigkeit entwickeln, als Reaktion auf IL-12 IFN-γ zu erzeugen. In Kombination mit ihrer Produktion von IL-17 besitzen sie dann ein signifikantes pathologisches Potenzial. Die von ILC2-Zellen synthetisierten Cytokine IL-5 und IL-13 bilden einen wichtigen Bestandteil der T-Zell-unabhängigen Reaktionen auf parasitische Helminthen im Darm, und eine entsprechende Population spielt auch bei allergischen Reaktionen in den Atemwegen eine Rolle.
CD1-restringierte iNKT-Zellen (Abschn. 10.1007/978-3-662-56004-4_6#Sec23) und mucosaassoziierte invariante T-Zellen (MAIT-Zellen ) (Abschn. 10.1007/978-3-662-56004-4_6#Sec24) kommen ebenfalls in der Lamina propria vor; sie machen 2–3 % der T-Zellen in der Lamina propria des menschlichen Dünndarms aus. MAIT-Zellen exprimieren eine invariante TCRα-Kette, die mit einem begrenzten Spektrum an TCRβ-Ketten in gepaarter Form vorliegt. Sie erkennen Stoffwechselprodukte von Vitamin B, die vor allem aus dem Riboflavinstoffwechsel von Mikroorganismen stammen und von MR1-Molekülen präsentiert werden.
Das Darmepithel ist ein einzigartiges Kompartiment des Immunsystems
Wir haben uns bereits kurz damit beschäftigt, dass es im Darmgewebe eine große Anzahl von intraepithelialen Lymphocyten (IELs) gibt. Im gesunden Dünndarm kommen pro 100 Epithelzellen 10–15 Lymphocyten vor, sodass die IEL-Zellen eine der größten Einzelpopulationen von Lymphocyten im Körper bilden (Abb. 12.13). Über 90 % der IELs im Dünndarm sind T-Zellen, und etwa 80 % davon tragen CD8, ganz anders als die Situation in der Lamina propria. IELs kommen auch im Dickdarm vor, wobei sie hier im Verhältnis zu den Epithelzellen in geringerer Anzahl auftreten als im Dünndarm und der Anteil von CD4-T-Zellen zudem größer ist als dort.
Die meisten IELs befinden sich wie die Lymphocyten der Lamina propria auch ohne Vorhandensein einer Infektion in einem aktivierten Zustand. Sie besitzen wie die konventionellen cytotoxischen CD8-T-Effektorzellen intrazelluläre Granula, die Perforin und Granzyme enthalten. Die T-Zell-Rezeptoren der meisten CD8-IELs zeigen Anzeichen von Oligoklonalität, es kommt nur eine begrenzte Zahl von V(D)J-Gensegmenten zum Einsatz. Das deutet darauf hin, dass sie sich nur lokal als Reaktion auf eine relativ geringe Anzahl von Antigenen vermehren. Die IEL-Zellen des Dünndarms exprimieren den Chemokinrezeptor CCR9 und das αE:β7-Integrin (CD103 ), das mit E-Cadherin auf Epithelzellen interagiert und so dazu beiträgt, dass die IEL-Zellen im Epithel zurückgehalten werden (Abb. 12.9).
Es gibt zwei Hauptgruppen der intraepithelialen CD8-T-Zellen – Typ a („induzierbar“) und Typ b („natürlich“). Sie lassen sich daran unterscheiden, in welcher Form sie CD8 exprimieren. Das Zahlenverhältnis der beiden Gruppen verändert sich in Abhängigkeit vom Alter, von der Fortpflanzungslinie (bei Mäusen) und von der Anzahl der Bakterien im Darm. Die induzierbaren Typ-a-IELs exprimieren α:β-T-Zell-Rezeptoren und das CD8α:β-Heterodimer. Sie gehen aus naiven CD8-T-Zellen hervor und werden in den Peyer-Plaques oder den mesenterialen Lymphknoten durch Antigene aktiviert, und sie fungieren als konventionelle MHC-Klasse-I-restringierte cytotoxische T-Zellen, die beispielsweise virusinfizierte Zellen töten (Abb. 12.14, obere Reihe). Sie sezernieren auch Effektorcytokine wie IFN-γ.
(Natürliche) CD8-IELs vom Typ b können entweder den α:β- oder den γ:δ-T-Zell-Rezeptor exprimieren, ihr besonderes Merkmal ist jedoch die Expression des CD8α:α-Homodimers. Die γ:δ-T-Zellen im Darm aktivieren nur bestimmte Vγ- und Vδ-Gene und sie unterscheiden sich von den γ:δ-T-Zellen in den übrigen Geweben (Abb. 10.1007/978-3-662-56004-4_8#Fig23). Einige der α:β-T-Zell-Rezeptoren, die die IELs exprimieren, binden nichtkonventionelle Liganden, beispielsweise solche, die auch von MHC-Klasse-Ib-Molekülen präsentiert werden (Abschn. 10.1007/978-3-662-56004-4_6#Sec22). Typ-b-IELs exprimieren auch Moleküle, die für natürliche Killerzellen charakteristisch sind, etwa das aktivierende C-Typ-Lektin NKG2D , das die beiden MHC-ähnlichen Moleküle bindet. Diese werden auf Darmepithelzellen als Reaktion auf zelluläre Schädigungen, zellulären Stress oder die Zusammenlagerung von TLRs induziert. Die geschädigten Zellen können dann von den IELs erkannt und getötet werden. Dieser Vorgang wird noch dadurch verstärkt, dass die geschädigten Epithelzellen IL-15 produzieren. Die Typ-b-IELs exprimieren wie die angeborenen Immunzellen bestimmte Gene konstitutiv, die mit Entzündungen im Zusammenhang stehen, etwa mit der Produktion von großen Mengen an cytotoxischen Molekülen, NO sowie proinflammatorischen Cytokinen und Chemokinen. Ihre Funktion im Darm besteht wahrscheinlich darin, Epithelzellen, die als Ergebnis von Stress oder einer Infektion einen anormalen Phänotyp exprimieren, schnell zu erkennen und zu beseitigen (Abb. 12.14, untere Bildreihe). Man nimmt an, dass Typ-b-IELs bei der Reparatur von Schleimhäuten mitwirken, die durch eine Entzündung geschädigt wurden: Sie stimulieren die Freisetzung von antimikrobiellen Peptiden und unterstützen so die Beseitigung des Entzündungsherdes. Außerdem setzen sie Cytokine frei, beispielsweise den Keratinocytenwachstumsfaktor, der die Barrierefunktion der Epithelien verstärkt, und TGF-β, der an der Gewebereparatur mitwirkt und auch lokale Entzündungsreaktionen hemmt.
Typ-b-IELs werden durch ihre Coexpression von inhibitorischen Signalmolekülen kontrolliert, beispielsweise das immunmodulierende Cytokin TGF-β und inhibitorische Rezeptoren, die auch auf NK-Zellen vorkommen. Die Bedeutung dieser Kontrollmechanismen zeigt sich daran, dass eine unpassende oder übermäßige Aktivierung der Typ-b-IELs zu Krankheiten führen kann. So treten beispielsweise bei der Zöliakie (celiac disease) in größerer Anzahl IEL-Zellen auf, die einen γ:δ-T-Zell-Rezeptor exprimieren. Zöliakie wird durch eine anormale Immunantwort auf das Weizenprotein Gluten ausgelöst (Abschn. 10.1007/978-3-662-56004-4_14#Sec20). Die MIC-A-abhängige Cytotoxizität der intraepithelialen T-Zellen trägt bei dieser Erkrankung zu einer Schädigung des Darms bei, da bestimmte Glutenbestandteile die Produktion von IL-15 durch Epithelzellen stimulieren und die Expression von MIC-A steigern können. Diese Vorgänge führen dazu, dass Epithelzellen wie oben beschrieben durch die aktivierten IELs getötet werden (Abb. 12.14, untere Bildreihe).
Der Ursprung und die Entwicklung der Typ-b-IELs waren früher umstritten und sind beim Menschen noch unerforscht. Viele Typ-b-IELs, die im Gegensatz zu Typ-a-IELs einen α:β-T-Zell-Rezeptor exprimieren, haben anscheinend keine konventionelle positive und negative Selektion durchlaufen (Kap. 10.1007/978-3-662-56004-4_8) und exprimieren offensichtlich autoreaktive T-Zell-Rezeptoren. Das Fehlen des CD8α:β-Heterodimers bedeutet jedoch, dass diese T-Zellen für die konventionellen Peptid:MHC-Komplexe nur eine geringe Affinität besitzen, da die CD8β-Kette stärker an die klassischen MHC-Moleküle bindet als die CD8α-Kette. Typ-b-IELs, die einen α:β-T-Zell-Rezeptor exprimieren, können deshalb nicht als autoreaktive Effektorzellen wirken. Diese geringe Affinität für Selbst-MHC-Moleküle ist wahrscheinlich der Grund dafür, dass diese Zellen der negativen Selektion im Thymus entgehen. Sie entwickeln sich jedoch anscheinend in einem Prozess, den man als Agonistenselektion bezeichnet. Dabei werden späte doppelt negative/frühe doppelt positive T-Zellen im Thymus von unbekannten Liganden positiv selektiert und unmittelbar danach freigesetzt und zum Darm gelenkt. Hier reifen sie heran und werden von TGF-β, der von den Epithelzellen erzeugt wird, zur Produktion des CD8α:α-Homodimers angeregt. Nichtklassische MHC-Moleküle, die vom Darmepithel exprimiert werden, sind ebenfalls für die Reifung der Typ-b-IELs von Bedeutung. Ein Beispiel für diese Art von Selektionsmolekülen ist das Thymusleukämieantigen (TL), ein weiteres nichtklassisches MHC-Klasse-I-Molekül (Abb. 10.1007/978-3-662-56004-4_6#Fig26). Man hat es bei bestimmten Mäusestämmen nachgewiesen, die keine Peptide präsentieren. TL wird von den Zellen des Darmepithels exprimiert und bindet mit hoher Affinität direkt an CD8α:α.
Typ-b-IELs , die einen γ:δ-T-Zell-Rezeptor exprimieren, entwickeln sich durch Agonistenselektion ebenfalls im Thymus. Dies ist Bestandteil der „programmierten“ Entwicklungswelle der γ:δ-T-Zellen (Abb. 10.1007/978-3-662-56004-4_8#Fig23). Die Expression dieses Rezeptors wird im Thymus von spezifischen Liganden stimuliert und verleiht den Zellen die spezifische Fähigkeit, in das Darmepithel zu wandern, wo sie dann durch den gleichen Agonistenliganden weiter geprägt werden.
Die lokale Differenzierungsereignisse, bei der Typ-b-IELs eine Rolle spielen, sind von dem Cytokin IL-15 abhängig, das als Reaktion auf die Mikroflora produziert und in einem Komplex mit dem IL-15-Rezeptor auf den Epithelzellen den IELs „transpräsentiert“ wird. Die Entwicklung der Typ-b-IELs hängt von dem Arylkohlenwasserstoffrezeptor (AhR) ab, einem Transkriptionsfaktor, der von verschiedenen Liganden aus der Umgebung aktiviert wird, die aus Kohl und anderen Gemüsepflanzen in der Nahrung stammen. Mäuse, die AhR nicht exprimieren, verfügen nur über eine geringe Anzahl von ILC3- und Typ-b-IEL-Zellen. Bei diesen Mäusen kommt es zu einer anormalen Reparatur von Epithelbarrieren, was die Annahme unterstützt, dass diese ungewöhnlichen Lymphocyten bei der angeborenen Immunantwort auf lokale Substanzen im Darm von großer Bedeutung sind.
Zusammenfassung
Die mucosalen Gewebe des Körpers wie der Darm und die Atemwege werden ständig mit riesigen Mengen von verschiedenen Antigenen konfrontiert. Diese können entweder eindringende Krankheitserreger, harmloses Material wie die Nahrung oder kommensale Organismen sein. Potenzielle Immunantworten gegen diese Antigenbelastung werden von einem eigenen Kompartiment des Immunsystems kontrolliert, dem Immunsystem der Schleimhäute (mucosales Immunsystem). Es ist das größte Kompartiment des Immunsystems im Körper. Zu dessen einzigartigen Merkmalen gehören die speziellen Wege und Prozesse für die Aufnahme und Präsentation von Antigenen, die Nutzung von M-Zellen der Peyer-Plaques für den Transport von Antigenen durch das Epithel sowie retinsäureproduzierende dendritische Zellen, die T- und B-Zellen bei der Aktivierung so prägen, dass sie in den Verdauungstrakt wandern (Homing). Dendritische Zellen fördern auch im normalen Darm die Entwicklung von FoxP3-positiven Treg-Zellen. Mit der Phagocytose von Antigenen tragen geweberesidente Makrophagen des Darms zu diesen regulatorischen Vorgängen bei, indem sie aufgrund ihrer Produktion von IL-10 keine Entzündung hervorrufen. Lymphocyten, die in den mucosaassoziierten lymphatischen Geweben primär geprägt werden (Priming), exprimieren spezifische Homing-Rezeptoren, sodass sie als Effektorzellen bevorzugt an die mucosalen Oberflächen zurückkehren können. Die adaptive Immunantwort in mucosalen Geweben ist gekennzeichnet durch die Produktion von sekretorischen IgA-Dimeren und durch das Auftreten von speziellen Populationen von T-Gedächtnis‑/Effektorzellen im Epithel der Lamina propria. CD4-T-Zellen in der Lamina propria produzieren proinflammatorische Cytokine wie IL-17 und IFN-γ, selbst wenn gar keine erkennbare Infektion vorhanden ist. Dies wird jedoch normalerweise von IL-10-produzierenden Treg-Zellen ausbalanciert. IELs zeigen cytolytische Aktivitäten und weitere angeborene Immunfunktionen, die dazu beitragen, dass eine intakte Epithelbarriere erhalten bleibt.
Die mucosale Reaktion auf eine Infektion und die Regulation der Immunantworten
Die wichtigste Funktion der mucosalen Immunantwort ist die Abwehr von Infektionen. Das betrifft alle Formen von Mikroorganismen, Viren bis hin zu vielzelligen Parasiten. Das bedeutet, dass der Körper in der Lage sein muss, ein großes Spektrum von Immunantworten hervorzubringen, die so zugeschnitten sind, dass sie den Besonderheiten der verschiedenen Pathogene Rechnung tragen. Es ist nicht verwunderlich, dass viele Mikroorganismen in der Evolution Mechanismen entwickelt haben, mit denen sie sich an die Wirtsreaktion anpassen und diese unterlaufen. Damit gegenüber Krankheitserregern die geeigneten Reaktionen erfolgen können, muss das mucosale Immunsystem jedes fremde Antigen erkennen und darauf reagieren, darf gegen ein harmloses Antigen (aus der Nahrung oder von den kommensalen Bakterien) aber nicht dieselben Effektorreaktionen entwickeln wie gegen Pathogene. Eine wichtige Funktion des mucosalen Immunsystems besteht darin, das Gleichgewicht zwischen diesen konkurrierenden Anforderungen aufrechtzuerhalten. In diesem Teil des Kapitels wollen wir uns damit beschäftigen, wie das geschieht.
Enterische Krankheitserreger verursachen eine lokale Entzündungsreaktion und führen zur Entwicklung eines Immunschutzes
Trotz der zahlreichen Mechanismen der angeborenen Immunität im Verdauungstrakt und der besonders starken Konkurrenz der dort angesiedelten körpereigenen Mikroflora kommt es im Darm häufig zu Infektionen mit einem breiten Spektrum von pathogenen Mikroorganismen. Dazu gehören zahlreiche Viren, enterische Bakterien wie Vibrio-, Salmonella- und Shigella-Arten, Protozoen wie Entamoeba histolytica und vielzellige parasitische Helminthen wie Band- und Madenwürmer. Diese Krankheitserreger verursachen auf vielfache Weise Krankheiten und wie überall im Körper müssen die geeigneten Komponenten des angeborenen Immunsystems aktiviert werden, um einen Immunschutz entwickeln zu können.
Die Effektormechanismen des angeborenen Immunsystems können von sich aus die meisten Darminfektionen schnell und ohne dass sie sich bedeutsam jenseits des Darms ausbreiten, beseitigen. Die grundlegenden Eigenschaften dieser Reaktionen in den Epitheloberflächen werden in Abschn. 10.1007/978-3-662-56004-4_2#Sec3 besprochen. Hier wollen wir uns nur mit den Komponenten beschäftigen, die für den Darm einzigartig oder ungewöhnlich sind (Abb. 12.15). Die Tight Junctions dieser Zellen bilden eine Barriere, die normalerweise für Makromoleküle und Eindringlinge undurchlässig ist. Die ständige Erzeugung von neuen Epithelzellen aus Stammzellen in den Krypten ermöglicht ebenfalls eine schnelle Reparatur der Barriere nach einer mechanischen Schädigung oder einem Verlust von Zellen. Pathogene haben jedoch Mechanismen entwickelt, mit deren Hilfe sie in diese Barrieren eindringen können. Einige solcher Mechanismen, die von Salmonella genutzt werden, sind in Abb. 12.16 dargestellt, die Mechanismen von Shigella in Abb. 12.17.
Epithelzellen tragen Toll-like-Rezeptoren (TLRs) sowohl auf ihrer apikalen als auch auf der basalen Oberfläche. Dadurch können sie Bakterien im Darmlumen erkennen, aber auch Bakterien, die durch das Epithel hindurchgelangt sind. Darüber hinaus tragen die Epithelzellen in den intrazellulären Vakuolen TLR-Moleküle, die intrazelluläre Pathogene oder extrazelluläre Pathogene und ihre Produkte erkennen, die durch Endocytose in die Zellen aufgenommen wurden. Epithelzellen besitzen auch intrazelluläre Sensoren (Kap. 10.1007/978-3-662-56004-4_3) und können reagieren, wenn Pathogene oder ihre Produkte in das Cytoplasma gelangen. Zu diesen Sensoren gehören die Proteine NOD1 und NOD2 , die eine nucleotidbindende Oligomerisierungsdomäne (NOD ) enthalten (Abschn. 10.1007/978-3-662-56004-4_3#Sec9 und Abb. 10.1007/978-3-662-56004-4_3#Fig17). NOD1 erkennt ein diaminopimelinsäurehaltiges Peptid, das nur in den Zellwänden gramnegativer Bakterien vorkommt. NOD2 erkennt ein Muraminsäuredipeptid, das in den Peptidoglykanen der meisten Bakterien vorkommt. Epithelzellen mit einem NOD2-Defekt können einer Infektion mit intrazellulären Bakterien weniger gut widerstehen. Bei Mäusen, die NOD2 nicht exprimieren, kommt es zu einer erhöhten Translokation von Bakterien durch das Epithel und aus den Peyer-Plaques heraus. Ein Defekt bei der Erkennung der kommensalen Mikroflora durch NOD2 ist anscheinend bei Morbus Crohn von Bedeutung, da bis zu 25 % der Patienten eine Mutation im NOD2-Gen tragen, die das NOD2-Protein funktionslos macht.
Die Oligomerisierung von TLR- oder NOD-Proteinen der Epithelzellen stimuliert die Produktion von Cytokinen, beispielsweise IL-1 und IL-6, und auch die Produktion von Chemokinen, etwa CXCL8, das auf neutrophile Zellen als starker Chemoattraktor wirkt, sowie CCL2, CCL3, CCL4 und CCL5, die wiederum Monocyten, eosinophile Zellen und T-Zellen aus dem Blut anlocken. Stimulierte Epithelzellen erhöhen auch ihre Produktion des Chemokins CCL20, das unreife dendritische Zellen zur Epitheloberfläche lockt (Abschn. 12.1.4 und 12.1.7).
Epithelzellen exprimieren auch Vertreter der Familie der intrazellulären NOD-like-Rezeptoren (NLR), beispielsweise gNLRP3, NLRC4 und NLRP6, die Inflammasomen bilden können (Abb. 12.15). Wie in Abschn. 10.1007/978-3-662-56004-4_3#Sec10 besprochen, führt die Bildung eines Inflammasoms zur Aktivierung der Caspase 1 , die Pro-IL-1 und Pro-IL-18 spaltet, sodass die aktiven Cytokine entstehen (Abb. 10.1007/978-3-662-56004-4_3#Fig19). Beide Cytokine tragen zu Abwehrreaktionen des Epithels gegen das Eindringen von Bakterien bei, indem sie die Integrität der Barriere fördern, wobei sie bei längerem Auftreten Gewebeschäden hervorrufen können.
Erst vor Kurzem hat man erkannt, wie wichtig der Mechanismus der Autophagie (deren Beziehung zur Antigenprozessierung in Abschn. 10.1007/978-3-662-56004-4_6#Sec7 besprochen wurde) für Abwehrreaktionen der Epithelien ist. Dabei nimmt ein im Querschnitt sichelförmiges Fragment einer Doppelmembran, das man als Isolierungsmembran oder Phagophor bezeichnet, Teile des Cytoplasmas in sich auf und bildet ein vollständiges Vesikel, das Autophagosom . Dieses fusioniert mit Lysosomen, sodass der Inhalt abgebaut wird (Abb. 12.15). Wenn die Autophagie gestört ist, können Bakterien nicht wirksam eingedämmt werden und die Epithelzellen stehen unter Stress. Dadurch können Bakterien vermehrt in den Körper eindringen und es kommt zu einer von NFκB hervorgerufenen Entzündung. Die Autophagie wird von den intrazellulären Bakteriensensoren NOD1 und NOD2 stimuliert. Beim Menschen führen Mutationen der ebenfalls mit der Autophagie zusammenhängenden Gene ATG16L1 und IRGM1 genauso wie Mutationen im Gen für NOD2 zu einer erhöhten Wahrscheinlichkeit, an Morbus Crohn zu erkranken.
Bestimmte spezialisierte Populationen von Epithelzellen sind für die angeborene Immunabwehr im Darm von besonderer Bedeutung. Die Paneth-Zellen kommen nur im Dünndarm vor, wo sie antimikrobielle Peptide wie RegIIIγ und Defensine produzieren, wenn sie mit IL-22 in Kontakt kommen, das von CD4-TH17- oder ILC3-Zellen freigesetzt wird. Sie können auch direkt auf Mikroorganismen reagieren, da sie TLRs und NOD-Rezeptoren exprimieren und stark autophagisch sind. Defekte in der Funktion der Paneth-Zellen führen zu einer geschwächten Abwehr gegen Bakterien und sind wahrscheinlich für die Anfälligkeit von Menschen gegenüber entzündlichen Darmerkrankungen von Bedeutung. Die Becherzellen sind eine weitere Art von spezialisierten Epithelzellen; sie produzieren Schleim als Reaktion auf Cytokine der CD4-TH2- oder ILC2-Zellen. Der Schleim ist ein komplexes Gemisch aus stark geladenen Glykoproteinen (Mucinen) und bildet in allen mucosalen Oberflächen einen essenziellen Bestandteil der Immunabwehr. Durch seine Dichte, Ladung und Adhäsivität bildet der Schleim eine ausgezeichnete Barriere gegen das Eindringen von Mikroorganismen und anderen Partikeln, die davon festgehalten werden. Zudem dient der Schleim als Gerüst, das IgA-Antikörper und antimikrobielle Peptide bindet, die von dem Epithel in das Lumen freigesetzt werden. Schleim dient zudem als Gleitmittel, sodass darin festgehaltenes Material durch die normale Peristaltik einfach ausgeschieden werden kann. Im Darm besteht der Schleim aus zwei Schichten, aus einer äußeren, aufgelockerten Schicht und einer inneren, viel dichteren Schicht, die vor allem im Dickdarm vorkommt. Bakterien können die aufgelockerte Schleimschicht zwar durchdringen, werden aber normalerweise von der inneren, dichten Schicht von den Oberflächen der Epithelzellen ferngehalten. Defekte in dieser Struktur beeinträchtigen die antimikrobielle Abwehr.
Wie bereits besprochen, enthält die Darmschleimhaut auch viele Zellen des angeborenen Immunsystems, die schnell auf eine Infektion reagieren können. Zu diesen gehören Makrophagen, Eosinophile, Mast‑, ILC-, MAIT-, NKT- und γ:δ-T-Zellen.
Krankheitserreger induzieren adaptive Immunantworten, sobald die angeborenen Abwehrmechanismen überwunden wurden
Wenn pathogene Bakterien und Viren in den Subepithelialraum gelangen, können sie mit TLRs auf Entzündungszellen in den darunterliegenden Geweben in Wechselwirkung treten. Zusammen mit der Kaskade der Entzündungsmediatoren führt das zu einer erheblichen Veränderung der Umgebung in der Schleimhaut und zu einem anderen Verhalten der lokalen antigenpräsentierenden Zellen, etwa der dendritischen Zellen. Wie in Abschn. 10.1007/978-3-662-56004-4_9#Sec9 beschrieben, exprimieren aktivierte dendritische Zellen große Mengen an costimulierenden Molekülen und Cytokinen, etwa IL-1, IL-6, IL-12 und IL-23, und fördern die Entwicklung von T-Effektorzellen. Dendritische Zellen, die in den Peyer-Plaques aktiviert werden, wandern in die T-Zell-Zonen ihrer Plaques. Andererseits wandern dendritische Zellen, die in der Lamina propria auf Antigene treffen, von CCR7 gesteuert in die mesenterialen Lymphknoten. Die auf diese Weise aktivierten T-Effektorzellen exprimieren unter dem Einfluss von Retinsäure darmspezifische Homing-Moleküle wie α4:β7 und CCR9, sodass sie sicher in die Darmwand zurückkehren, um dann dort auf eindringende Organismen zu treffen. Entsprechend werden in den Peyer-Plaques und den mesenterialen Lymphknoten IgA-produzierende B-Lymphocyten erzeugt. Daraus gehen Plasmazellen hervor, die sich in der Lamina propria ansammeln. Die Sekretion von IgA in das Lumen wird als Reaktion auf eine Infektion verstärkt, da die pIgR-Expression durch TLR-Liganden und proinflammatorische Cytokine erhöht wird. Bei einigen Infektionen kommen jetzt auch IgG-Antikörper in den Darmsekreten vor; diese stammen jedoch aus dem Serum. Dafür notwendig ist, dass eingedrungene Organismen in die systemischen Immungewebe gelangen.
Die aktivierten myeloischen Zellen, die in der entzündeten Schleimhaut auftreten, tragen ebenfalls dazu bei, die Funktionen der T- und B-Effektorzellen aufrechtzuerhalten, nachdem sie in der Schleimhaut angekommen sind. Die von soeben eingetroffenen Monocyten produzierten Cytokine IL-1 und IL-6 sind von großer Bedeutung, um das Überleben und die Funktionen der lokalen TH17-Zellen zu stabilisieren. Proinflammatorische myeloische Zellen produzieren ebenfalls Mediatoren wie IL-6, TNF-α und Stickstoffmonoxid, die zum IgA-Isotypwechsel und zu einer sekundären Vermehrung der mucosalen B-Zellen beitragen.
Die Reaktionen der T-Effektorzellen im Darm schützen die Epithelfunktion
Nach ihrer Aktivierung verhalten sich die T-Effektorzellen , die sich im Darm ansammeln, wie ihre Gegenstücke in den übrigen Körperregionen, indem sie Cytokine produzieren und cytolytische Aktivitäten entwickeln, die für das jeweilige Pathogen angemessen sind. Der Unterschied besteht darin, dass die schützende Immunantwort im Darm darauf ausgerichtet und zugeschnitten ist, dass die Integrität und Funktion der Epithelbarriere erhalten bleibt. Das wird, abhängig von der Art des Krankheitserregers, auf verschiedene Weise erreicht. Bei Virusinfektionen töten die cytotoxischen CD8-T-Zellen, die zu den intraepithelialen Lymphocyten gehören, infizierte Epithelzellen (Abb. 12.14) und bewirken, dass diese durch nichtinfizierte Zellen ersetzt werden, die aus den sich schnell teilenden Stammzellen in den Krypten hervorgehen. Bei anderen Formen der schützenden Immunantworten kann es zu einem ähnlichen Prozess kommen. Dabei stimulieren Cytokine von CD4-T-Effektorzellen direkt die Teilung von Epithelzellen. Dadurch werden infizierte Zellen schneller ersetzt und es entsteht ein „bewegliches Ziel“ für Organismen, die versuchen, sich an die Epitheloberfläche zu heften. Ein Beispiel für ein Cytokin dieser Art ist IL-13 , das bei einer Infektion durch Parasiten von den TH2-Zellen (und ILC2-Zellen) produziert wird. IL-22 , das von TH17-Zellen gebildet wird, trägt neben der Fähigkeit, die Produktion antimikrobieller Peptide durch die Paneth-Zellen zu stimulieren, zur Abwehr von extrazellulären Bakterien und Pilzen bei. Dabei werden die Tight Junctions zwischen den Epithelzellen verstärkt, sodass die Barriere stabil bleibt. Für den Schutz der Epithelbarriere ist auch der Schleim von zentraler Bedeutung. Die Schleimproduktion der Becherzellen wird durch die Cytokine IL-13 und IL-22 der CD4-T-Zellen erhöht, außerdem durch Produkte der Mastzellen und anderer angeborener Effektorzellen, die von T-Zellen rekrutiert werden. Darüber hinaus können diese und andere Mediatoren die Peristaltik und die Flüssigkeitsabsonderung des Darms verstärken, sodass Pathogene im Darmlumen ausgewaschen werden. Diese Vorgänge sind insgesamt darauf ausgerichtet, eine für die Pathogene feindliche und instabile Umgebung zu erzeugen, sodass sie die Epithelbarriere weniger gut angreifen und ihr schaden können.
Das mucosale Immunsystem muss die Toleranz gegenüber harmlosen körperfremden Antigenen aufrechterhalten
Antigene aus der Nahrung und von kommensalen Bakterien lösen normalerweise keine entzündliche Immunantwort aus, obwohl für sie keine zentrale Toleranz besteht (Abb. 12.18). Die Umgebung des mucosalen Immunsystems ist in sich tolerogen. Dies stellt eine Barriere dar für nichtlebende Impfstoffe, die lokale regulatorische Mechanismen überwinden müssen. Nahrungsproteine werden im Darm nicht vollständig verdaut; nicht vernachlässigbare Mengen werden in einer immunologisch relevanten Form durch Absorption in den Körper aufgenommen. Die Standardreaktion auf die orale Aufnahme eines Proteinantigens ist die Entwicklung eines Phänomens, das man als orale Toleranz bezeichnet. Dabei handelt es sich um eine Form der peripheren Toleranz , die dazu führt, dass das systemische und das mucosale Immunsystem auf dasselbe Antigen relativ unempfindlich reagieren. Das lässt sich im Experiment zeigen, indem man Mäuse mit einem fremden Protein, beispielsweise Ovalbumin, füttert (Abb. 12.19). Wenn den Tieren dann dieses Antigen auf einem nichtmucosalen Weg verabreicht wird, etwa durch eine Injektion in die Haut oder in das Blut, ist die zu erwartende Immunantwort stark geschwächt. Diese Unterdrückung der systemischen Immunantwort erfolgt langfristig und antigenspezifisch: Reaktionen auf andere Antigene sind davon nicht betroffen. Eine ähnliche Unterdrückung einer späteren Immunantwort lässt sich nach der Verabreichung von Proteinen in die Atemwege beobachten. Daraus leitete man für die normale Reaktion auf solche Antigene, die über eine Schleimhautoberfläche in den Körper gelangen, den Begriff der mucosalen Toleranz ab. Wenn man einem Menschen Proteinantigene verabreicht, zu denen er noch keinen Kontakt hatte, lassen sich systemische T-Zell-Reaktionen unterdrücken.


Die orale Toleranz kann alle Elemente der peripheren Immunantwort beeinflussen, beispielsweise die T-Zell-abhängigen Effektorreaktionen und die IgE-Produktion. Reaktionen der T-Effektorzellen in den Schleimhäuten werden durch die orale Toleranz ebenfalls abgeschwächt, wobei man bei Menschen geringe Mengen von IgA-Antikörpern nachweisen kann, die gegen Proteine aus der Nahrung gerichtet sind, aber nicht zu einer Entzündung führen.
Wahrscheinlich sind für die orale Toleranz gegenüber Proteinantigenen mehrere verschiedene Mechanismen verantwortlich, beispielsweise Anergie, die Ausdünnung antigenspezifischer T-Zellen und die Entwicklung regulatorischer T-Zellen, die in den mesenterialen Lymphknoten ausgelöst wird. So werden dann durch Retinsäure und TGF-β , die von wandernden dendritischen Zellen (Abschn. 12.1.7) produziert werden, antigenspezifische FoxP3 -positive Treg-Zellen gebildet, die in den Darm zurückkehren. Man weiß zwar, dass diese Vorgänge für die Unterdrückung von systemischen Immunantworten essenziell sind, aber die Mechanismen, die für diese Kopplung zwischen mucosalem und peripherem Immunsystem verantwortlich sind, kennt man noch nicht. Gelegentlich kann die orale Toleranz auch versagen, wie bei der Zöliakie (Abschn. 10.1007/978-3-662-56004-4_14#Sec20) oder bei Allergien gegen Erdnüsse (Abschn. 10.1007/978-3-662-56004-4_14#Sec12 und 10.1007/978-3-662-56004-4_14#Sec14) vermutet wird.
Mithilfe der mucosalen Toleranz lassen sich Entzündungskrankheiten zwar in experimentellen Tiermodellen für Diabetes mellitus, Arthritis und Encephalomyelitis unterdrücken, aber klinische Studien am Menschen waren weniger erfolgreich. Hier werden inzwischen andere Therapieformen bevorzugt, etwa mit monoklonalen Antikörpern (Kap. 10.1007/978-3-662-56004-4_16).
Der normale Darm enthält große Mengen an Bakterien, die für die Gesundheit notwendig sind
Die Oberflächen des gesunden Körpers werden von einer großen Zahl von Mikroorganismen besiedelt, die man auch als Mikrobiota oder Mikrobiom bezeichnet. Diese Mikroflora besteht vor allem aus Bakterien, enthält aber auch Archaeen, Viren, Pilze und Protozoen. Der Darm ist das größte Reservoir dieser Organismen, wobei alle übrigen mucosalen Gewebe ihre eigenen speziellen Populationen von Mikroorganismen beherbergen. Wir alle besitzen über 1000 Spezies von kommensalen Bakterien in unserem Darm, die meisten davon im Dickdarm und im unteren Ileum. Viele dieser Spezies lassen sich nicht in Kultur vermehren, ihre genauen Zahlen und Identitäten werden erst jetzt allmählich mithilfe von Sequenzierungsmethoden mit hohem Durchsatz erforscht. Beim Menschen gibt es mehrere vorherrschende Phyla von Bakterien sowie die Archaeen. Das sind in abnehmender Anzahl Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria und Archaea. Es gibt mindestens 1014 dieser Mikroorganismen, die zusammen etwa 1 kg wiegen. Die Mikroflora des Darms lebt mit uns normalerweise in einer gegenseitig vorteilhaften oder symbiontischen Beziehung, die man als Mutualismus bezeichnet. Die Beziehung hat sich beim Menschen im Verlauf von vielen Jahrtausenden etabliert und zusammen mit den Vertebraten im Verlauf der Evolution gemeinsam entwickelt. Das hat dazu geführt, dass sich die Populationen dieser Mikroorganismen, die man in den verschiedenen systematischen Gruppen der Tiere vorfindet, voneinander unterscheiden und jeweils an ihre eigenen Wirte hochgradig angepasst sind.
Die Darmflora besitzt eine wichtige Funktion für die Aufrechterhaltung der Gesundheit. Die Organismen wirken beim Metabolismus der Nahrungsbestandteile wie der Cellulose mit, sie bauen Toxine ab und produzieren essenzielle Cofaktoren wie Vitamin K1. Kurzkettige Fettsäuren (short chain fatty acids, SCFAs) wie Acetat, Proprionat und insbesondere Butyrat werden von kommensalen Bakterien gebildet, die Kohlenhydrate der Nahrung anaerob metabolisieren, und sind eine wichtige Energiequelle für die Enterocyten im Dickdarm, da diese Produkte als Substrate in den Citratzyklus eingehen. Durch chirurgische Eingriffe wie eine Ileostomie (Anlegen eines künstlichen Ausgangs des Ileums zur Hautoberfläche) wird der normale Fluss der Fäzes durch den Dickdarm unterbrochen. Das kann zu einer Diversionscolitis führen, bei der die Enterocyten, die einem Mangel an SCFAs ausgesetzt sind, Entzündungen und Nekrosen hervorrufen. Wenn man den betroffenen Dickdarmabschnitt mit SCFAs versorgt, lässt sich dieser Zustand rückgängig machen. Eine weitere wichtige Eigenschaft der kommensalen Organismen besteht darin, dass sie die Fähigkeit von pathogenen Bakterien beeinträchtigen, in den Darm einzudringen und diesen zu besiedeln, vor allem durch die Konkurrenz um Lebensraum und Nährstoffe. Sie können auch proinflammatorische Signalwege direkt unterdrücken, die Pathogene in den Epithelzellen auslösen und die für ein Eindringen ins Gewebe notwendig sind. Wenn das Gleichgewicht zwischen den verschiedenen Bakterienspezies der Mikroflora gestört wird (Dysbiose ), erhöht sich die Anfälligkeit für eine Reihe verschiedener Krankheiten (Abschn. 12.2.7 und 12.2.8).
Die Schutzfunktion der kommensalen Mikroflora zeigt sich besonders drastisch an den Nebenwirkungen von Breitbandantibiotika. Diese Antibiotika können die kommensalen Darmbakterien in großer Zahl abtöten und erzeugen dadurch eine ökologische Nische für Bakterien, die normalerweise nicht in der Lage wären, erfolgreich im Darm zu bestehen. Ein Beispiel für ein Bakterium, das sich nach einer Antibiotikabehandlung im Darm vermehren kann, ist Clostridium difficile (Abb. 12.20). Dieser Mikroorganismus stellt in Ländern, in denen Breitbandantibiotika vielfach angewendet werden, zunehmend ein Problem dar. Es produziert Toxine, die schweren Durchfall und Schädigungen der Schleimhaut hervorrufen. Durch Übertragung von Fäzes einer gesunden Person lässt sich eine Infektion mit C. difficile behandeln.
Die Bedeutung der lokalen Abwehrmechanismen gegen kommensale Bakterien für die Gesundheit zeigt sich bei Experimenten mit Tieren, denen einer oder mehrere der beteiligten Faktoren fehlen. So dringen bei Mäusen, die keine sekretorischen Antikörper exprimieren, kommensale Bakterien in größerer Zahl in die Darmschleimhaut ein und breiten sich jenseits der ableitenden Lymphgewebe aus. Auch die Zusammensetzung der Mikroflora ist bei diesen Mäusen verändert, die Anzahl der Bakterien nimmt zu, die Vielfalt der Spezies nimmt hingegen ab. Eine ähnliche Dysbiose hat man bei Mäusen festgestellt, die keine regulatorischen FoxP3+-T-Zellen oder eosinophilen Zellen besitzen.
Das angeborene und das adaptive Immunsystem kontrollieren die Mikroflora und verhindern Entzündungen, ohne dass die Fähigkeit zur Reaktion auf Eindringlinge beeinträchtigt ist
Trotz ihrer vorteilhaften Wirkung stellen die kommensalen Bakterien eine potenzielle Bedrohung dar. Das zeigt sich dann, wenn das Darmepithel geschädigt ist. In solchen Fällen können normalerweise harmlose Bakterien wie das nichtpathogene Bakterium Escherichia coli die Schleimhaut durchqueren, in den Blutkreislauf eindringen und eine gefährliche systemische Infektion hervorrufen. Das Immunsystem des Darms muss also eine bestimmte Form von Reaktion aufrechterhalten, um die kommensalen Mikroorganismen zu kontrollieren (Abb. 12.21). Da unangebrachte Reaktionen zu einer chronischen Entzündung und zu einer Schädigung des Darms führen können, muss das Immunsystem die Erkennung der kommensalen Bakterien und die Reaktionen darauf mit der Abwendung von Gewebeschäden aufgrund einer Entzündung in einem Gleichgewicht halten. Kommensale Bakterien lösen antigenspezifische Reaktionen aus, die das lokale Gleichgewicht zwischen Wirt und Mikroflora aufrechterhalten und größtenteils allein auf den Darm begrenzt sind. Anders als lösliche Antigene aus der Nahrung können kommensale Bakterien im Immunsystem keinen Zustand der systemischen Reaktionslosigkeit hervorrufen. Wenn diese Organismen in den Blutkreislauf gelangen, können sie eine normale systemische Immunantwort auslösen.
Die Erkennung der Mikroflora durch das adaptive Immunsystem beruht auf der Aufnahme und dem intrazellulären Transport der Mikroorganismen durch lokale dendritische Zellen, die in den Peyer-Plaques bleiben oder nicht weiter als bis zum nächsten mesenterialen Lymphknoten wandern (Abb. 12.21), der dafür sorgt, dass sich die Mikroflora nicht weiter ausbreitet. Da kommensale Bakterien nicht invasiv sind, werden dendritische Zellen von ihnen nicht vollständig aktiviert und induzieren eine genau ausbalancierte Reaktion mit sekretorischen IgA-Antikörpern, die in die Darmsekrete gelangen und gegen kommensale Bakterien gerichtet sind. Anscheinend sind bis zu 50 % der kommensalen Bakterien im Darmlumen mit IgA bedeckt (Abb. 12.21). Dadurch ist ihre Fähigkeit eingeschränkt, sich an das Epithel zu heften und dort einzudringen. Darüber hinaus kann das Einhüllen der Mikroflora mit sIgA deren Genexpression verändern. Viele der in großer Zahl differenzierten TH1- und TH17-Zellen, die im gesunden Darm vorkommen, sind ebenfalls gegen die Mikroflora gerichtet. Diese Zellen produzieren Mediatoren, die die Beseitigung von Bakterien durch Makrophagen und Epithelzellen unterstützen, aber das Risiko mit sich bringen, eine Entzündung und damit einhergehende Schäden hervorzurufen. Dazu kommt es jedoch nicht, da im Darm IL-10 vorhanden ist, das von TH17-Zellen und regulatorischen FoxP3+-Zellen erzeugt wird, die sich in der Mucosa befinden. Die TH17-Zellen und die regulatorischen FoxP3+-Zellen im Darm können in Keimzentren der Peyer-Plaques eintreten und die Funktionen von follikulären T-Helferzellen annehmen, was zu einem selektiven IgA-Isotypwechsel führt.
Zudem sind die auf kommensalen Bakterien vorkommenden Endotoxine anscheinend für eine Neutralisierung durch Enzyme im Darm, wie die alkalische Phosphatase, ungewöhnlich empfindlich, was auch zu einer Abschwächung der Immunantwort führt. Wenn kommensale Bakterien das Epithel in geringer Anzahl durchqueren, bedeutet die Abwesenheit von Virulenzfaktoren, dass sie der Aufnahme und dem Abtöten durch phagocytotischen Zellen nicht widerstehen können und schnell zerstört werden. Anders als bei den übrigen Geweben führt die Aufnahme von kommensalen Bakterien in den Darm nicht zu einer Entzündung. Wenn Makrophagen nicht auf die inhibitorische Wirkung von IL-10 reagieren können, entwickelt sich im Darm eine spontane Entzündung. Die eosinophilen Zellen im gesunden Darm unterstützen den antigenspezifischen Isotypwechsel zu IgA, indem sie die Faktoren APRIL, IL-6 und TGF-β produzieren, wenn sie mit kommensalen Mikroorganismen in Kontakt kommen (Abschn. 12.1.11). Die kommensalen Organismen assoziieren deshalb mit der Oberfläche der Schleimhaut, ohne einzudringen oder eine Entzündung hervorzurufen. Diese Symbiose umfasst viele angeborene und adaptive Immuneffektorzellen, die normalerweise mit chronischen Entzündungen in Zusammenhang stehen, im Darm jedoch einen Zustand hervorrufen, den man gelegentlich als physiologische Entzündung bezeichnet.
Die Mikroflora im Darm spielt bei der Ausformung der darmspezifischen und systemischen Immunfunktion die Hauptrolle
Kommensale Bakterien und ihre Produkte sind für die normale Entwicklung des Immunsystems von entscheidender Bedeutung. Dieser Effekt lässt sich anhand von Untersuchungen mit keimfreien (gnotobiotischen ) Tieren veranschaulichen, bei denen keine Besiedlung des Darms durch Mikroorganismen stattgefunden hat. Diese Tiere zeigen eine starke Verkleinerung aller peripheren lymphatischen Organe, geringe Immunglobulinspiegel im Serum, eine geringere Zahl gereifter T-Zellen und deutlich schwächere Immunantworten, insbesondere bei den TH1- und TH17-Reaktionen. Diese Mäuse neigen dazu, TH2-Reaktionen mit IgE-Antikörpern zu entwickeln, und sie sind für bestimmte Krankheiten anfälliger, etwa für Diabetes mellitus Typ 1. Die Peyer-Plaques im Darm entwickeln sich nicht normal und die isolierten Lymphfollikel fehlen ganz. Keimfreie Mäuse zeigen auch eine stark verringerte Anzahl von T-Lymphocyten und ILC-Zellen in der Lamina propria und im Epithel, außerdem fast vollständig fehlende IgA-sezernierende Plasmazellen und weniger Mediatoren der lokalen Immunität, wie antimikrobielle Peptide, Retinsäure, IL-7, IL-22, IL-25, IL-33 und TSLP. Andererseits kommen im keimfreien Darm invariante NKT-Zellen in größerer Anzahl vor und tragen wahrscheinlich zum TH2-Überhang bei, der bei keimfreien Tieren festzustellen ist.
Die Wirkung der Mikroflora im Darm reicht weit über den Darm hinaus (Abb. 12.22). So treten beispielsweise einige Autoimmunkrankheiten bei keimfreien Tieren häufiger auf. Bei einem genetischen Modell für Diabetes mellitus Typ 1 verstärken sich die Symptome im keimfreien Zustand. Die Zusammensetzung der Mikroflora beeinflusst die Anfälligkeit für viele verschiedene immunologische Erkrankungen, Stoffwechselstörungen (beispielsweise Fettleibigkeit), Krebs, Herz-Kreislauf-Erkrankungen und selbst psychische Erkrankungen. Die Grundlagen für diese Zusammenhänge sind nicht bekannt und man konnte nur wenige individuelle kommensale Spezies bestimmten Krankheiten zuordnen. Einige betroffene Patienten weisen jedoch tatsächlich eine ungewöhnliche Zusammensetzung der wichtigsten Bakterien auf, die normalerweise die Mikroflora ausmachen. Dies ist eine Form von Dysbiose , wie wir sie auch schon in Abschn. 12.2.5 kennengelernt haben. In Versuchstiermodellen lässt sich eine Krankheitsanfälligkeit übertragen, indem man Darmbakterien von einem erkrankten Tier auf ein gesundes überträgt. Das stützt die Vorstellung, nach der eine Veränderung der Mikroflora ein ausschlaggebender Faktor sein kann und nicht das Symptom einer bereits existierenden Krankheit. Diese Beobachtung spricht auch für die Anwendung von Probiotika, die aus einem besonderen Gemisch von lebenden Bakterien und Hefen bestehen, die als vorteilhaft angesehen werden. Ihre Anwendung kann die Mikroflora im Darm verändern, um dadurch Krankheiten vorzubeugen und die Gesundheit zu fördern, wobei hier allerdings in Bezug auf die mögliche positive Wirkung noch vieles unerforscht ist.

An den Auswirkungen der Mikroflora sind anscheinend viele verschiedene Mechanismen beteiligt (Abb. 12.23). Die Quervernetzung von Toll-like- und NOD-like-Rezeptoren ist zweifellos für viele der lokalen Effekte auf Epithelzellen und myeloische Zellen von Bedeutung. Flagellin, das auf vielen Bakterienspezies im Darm vorkommt, kann TLR-5 auf mucosalen CD11b-exprimierenden dendritischen Zellen stimulieren, sodass die Produktion von IL-6 und IL-23 angeregt wird und TH17- und IgA-Reaktionen gefördert werden. Es gibt auch Beispiele für bestimmte Bakterienspezies, die sich in spezifischer Weise auf die Immunfunktion auswirken. Die Besiedlung von Mäusen mit segmentierten filamentösen Bakterien (SFBs) führt zu einer erhöhten IgA-Produktion, einer verstärkten Ansammlung von IEL-Zellen und einer Vermehrung der TH17-Effektorzellen im Darm (Abb. 12.23). Die Umwandlung von Tryptophan aus der Nahrung durch Lactobazillen in Kynureninmetaboliten kann den Arylkohlenwasserstoffrezeptor (Abschn. 12.1.14) aktivieren und die IL-22-Produktion durch ILC3-Zellen steigern. Polysaccharid A (PSA) von Bacteroides fragilis stimuliert die Differenzierung von Treg-Zellen über einen TLR-2-abhängigen Mechanismus. Außerdem stimulieren mehrere Clostridium-Spezies die Entwicklung von regulatorischen FoxP3+-T-Zellen im Dickdarm, möglicherweise indem eine mit TGF-β angereicherte Umgebung erzeugt wird und kurzkettige Fettsäuren (SCFAs) produziert werden. Die Mechanismen, durch die die SCFAs die Funktionen der Immunzellen direkt beeinflussen, sind zurzeit noch unbekannt. Bis jetzt hat man nur wenige spezifische Organismen identifiziert, für die sich die Auswirkungen einer Dysbiose auf Krankheiten des Menschen erklären lassen. Allerdings hat man festgestellt, dass bestimmte Spezies von E. coli, die man insgesamt als enteroadhäsive Escherichia coli bezeichnet, bei Patienten mit Morbus Crohn vorherrschend sind. Vor Kurzem durchgeführte Untersuchungen haben zudem gezeigt, dass Prevotella copri bei einer Reihe von Patienten mit einer Erstdiagnose auf rheumatoide Arthritis vermehrt auftritt. Hier ist aber noch viel Forschungsarbeit notwendig, um diese Zusammenhänge zu bestätigen und herauszufinden, ob es bei weiteren Krankheiten ähnliche Effekte gibt.
Vollständige Immunantworten gegen kommensale Bakterien führen zu Erkrankungen des Darms
Gut durchdachte Experimente in den 1990er-Jahren führten zu der inzwischen allgemein anerkannten Vorstellung, dass die potenziell aggressiven T-Zellen, die auf kommensale Bakterien reagieren können, in Tieren normalerweise immer vorkommen, aber durch eine aktive Regulation in Schach gehalten werden (Abb. 12.24). Wenn diese regulatorischen Mechanismen versagen, führen uneingeschränkte Immunantworten gegen die kommensalen Organismen zu einer entzündlichen Darmerkrankung (IBD) wie Morbus Crohn . Zahlreiche Gene für Proteine, die die angeborene Immunität regulieren, stehen in Zusammenhang mit der Anfälligkeit für diese Erkrankung. Wenn diese Regulation nicht funktioniert, kommt es zu systemischen Immunantworten gegen Antigene der kommensalen Bakterien, beispielsweise gegen Flagellin. In der Schleimhaut werden zudem T-Zell-Reaktionen in Gang gesetzt, die das Darmgewebe erheblich schädigen. Bei diesen Vorgängen ist IL-23 von großer Bedeutung, das die Differenzierung der TH17-Effektorzellen stimuliert. IL-23 und IL-12 können gemeinsam im Darm auch entzündliche TH1-Reaktionen auslösen, wobei einige CD4-T-Effektorzellen unter diesen Bedingungen offensichtlich sowohl IFN-γ als auch IL-17 produzieren. Diese Versuchsergebnisse passen zu klinischen Befunden, nach denen beim Menschen zwischen Polymorphismen beim IL-23-Rezeptor und dem Auftreten von Morbus Crohn ein Zusammenhang besteht. Bei allen Versuchsmodellen sind Schädigungen des Darms auf kommensale Bakterien zurückzuführen, können aber durch die Verabreichung von Antibiotika verhindert werden und treten nicht bei keimfreien Tieren auf.
Patienten mit Morbus Crohn und der verwandten Colitis ulcerosa weisen eine Dysbiose auf und beherbergen im Darm ungewöhnliche Populationen der Mikroflora. Jedoch ist es mit Ausnahme der oben erwähnten enteroadhäsiven Escherichia coli noch nicht gelungen, einzelne Spezies der kommensalen Bakterien als Ursache für Schädigungen zu identifizieren. Zudem gibt es experimentelle Befunde, dass lokale Reaktionen auf bestimmte pathogene Viren oder Parasiten wie Toxoplasma gondii die „Zuschaueraktivierung“ von T-Effektorzellen auslösen, die für kommensale Organismen spezifisch sind, und dadurch eine dauerhafte Entzündung hervorrufen.
Zusammenfassung
Das Immunsystem in der Schleimhaut muss zwischen potenziellen Krankheitserregern und harmlosen Antigenen unterscheiden, indem es gegen Krankheitserreger starke Effektorreaktionen auslöst, aber gegenüber Antigenen aus der Nahrung und von kommensalen Bakterien unempfindlich ist. Nahrungsproteine verursachen im systemischen und im mucosalen Immunsystem eine aktive Form von immunologischer Toleranz, die durch regulatorische T-Zellen, die IL-10 und/oder TGF-β produzieren, vermittelt werden kann. Das Immunsystem erkennt auch kommensale Bakterien, was sich jedoch auf die Mucosa und dessen ableitende Lymphgewebe beschränkt, da die kommensalen Antigene den T-Zellen durch noch unvollständig gereifte dendritische Zellen präsentiert werden, die aus der Darmwand in die mesenterialen Lymphknoten wandern, welche die Lymphe aufnehmen. So entsteht eine aktive mucosale Toleranz und es werden lokale IgA-Antikörper produziert, die die Besiedlung durch Mikroorganismen begrenzen, aber diese Antigene werden vom systemischen Immunsystem „ignoriert“. Da die kommensalen Bakterien viele vorteilhafte Auswirkungen für den Wirt haben, sind diese immunologischen Vorgänge sehr wichtig, damit die Bakterien in einer Coexistenz mit dem Immunsystem leben können.
Wenn die normalen Regulationsmechanismen versagen, werden lokale dendritische Zellen vollständig aktiviert und regen in den mesenterialen Lymphknoten die Differenzierung von naiven T-Zellen zu T-Effektorzellen an. Dies ist für den Immunschutz gegen Pathogene von großer Bedeutung, wenn es jedoch unter unpassenden Bedingungen geschieht, kann es zu einer entzündlichen Erkrankung kommen, beispielsweise zu Morbus Crohn oder einer Zöliakie. Folge dieser gegensätzlichen aber ineinandergreifenden Anforderungen an die Immunantwort ist, dass der Darm normalerweise das Erscheinungsbild einer physiologischen Entzündung zeigt, die dazu beiträgt, seine eigene normale Funktion wie auch die des Immunsystems aufrechtzuerhalten. Diesem Vorgang liegt die Notwendigkeit zugrunde, die Mikroflora des Darms unter Kontrolle zu halten, ohne sie vollständig zu beseitigen und ohne eine schädliche Entzündung hervorzurufen. Dabei kommt es koordiniert zur Produktion von IgA, zur Aktivierung regulatorischer T-Zellen und T-Effektorzellen und zu verschiedenen Reaktionen der angeborenen Immunität. Durch Anomalien bei den Reaktionen des Wirtes können sich die Zusammensetzung und das Verhalten der Mikroflora ändern, und Veränderungen der Mikroflora können die Entwicklung und den Verlauf vieler Krankheiten außerhalb des Darms beeinflussen.
Kapitelzusammenfassung
Das mucosale Immunsystem ist eine große und komplexe Maschinerie, die für die Gesundheit von grundlegender Bedeutung ist, nicht allein dadurch, dass physiologisch lebensnotwendige Organe geschützt werden, sondern auch dadurch, dass es den Charakter des gesamten Immunsystems reguliert und Krankheiten abwendet. Die peripheren lymphatischen Organe, mit denen sich die meisten Immunologen heute beschäftigen, sind möglicherweise eine vor Kurzem erfolgte Spezialisierung einer ursprünglichen Form, die sich im Verlauf der Evolution in den Schleimhautgeweben entwickelt hat. Die Schleimhautoberflächen des Körpers sind für Infektionen außerordentlich anfällig und verfügen über ein komplexes Repertoire von angeborenen und adaptiven Mechanismen der Immunität. Das adaptive Immunsystem der mucosaassoziierten lymphatischen Gewebe unterscheidet sich in mehrfacher Hinsicht vom übrigen peripheren lymphatischen System: in der unmittelbaren Nähe des mucosalen Epithels zum Lymphgewebe, in der Ausbildung eines unstrukturierten lymphatischen Gewebes und stärker strukturierter lymphatischer Organe, in spezialisierten Mechanismen zur Antigenaufnahme und verschiedenen dendritischen Zellen und Makrophagen, in der Vorherrschaft von aktivierten und Gedächtnislymphocyten und verschiedenen angeborenen lymphatischen Zellen, selbst wenn keine Infektion vorliegt, in der Produktion von dimerem, sekretorischem IgA als hauptsächlichem Antikörper sowie in der Abschwächung der Immunantworten auf harmlose Antigene, wie Nahrungsantigene oder kommensale Mikroorganismen. Auf diese Antigene ist normalerweise keine systemische Immunantwort festzustellen. Pathogene Mikroorganismen lösen hingegen starke Immunantworten aus. Der zentrale Faktor, der zwischen Toleranz und der Entwicklung von wirkungsvollen adaptiven Immunantworten entscheidet, ist der Kontext, in dem die Antigene den T-Lymphocyten im mucosalen Immunsystem präsentiert werden. Liegt keine Entzündung vor, präsentieren die dentitischen Zellen die Antigene gegenüber den T-Zellen und regen dadurch die Differenzierung regulatorischer T-Zellen an. Pathogene Mikroorganismen hingegen, die die Schleimhaut passieren, lösen in den Geweben eine Entzündungsreaktion aus, die die Reifung der antigenpräsentierenden Zellen und die Expression ihrer costimulierenden Moleküle in Gang setzt, und es kommt zu einer schützenden T-Zell-Reaktion. Dieser entscheidende Vorgang wird vor allem dadurch reguliert, auf welche Weise die spezialisierten dendritischen Zellen auf ihre Umgebung reagieren, bevor sie zu wandern beginnen und den naiven T-Zellen Antigene präsentieren. Die mutualistische Rückkopplung zwischen der Immunantwort der Körpers und der lokalen Mikroflora ist für die Aufrechterhaltung der Gesundheit und bei der Entwicklung von Krankheiten von entscheidender Bedeutung.
Aufgaben
12.1 Multiple Choice
Welche Aussage trifft nicht zu?
-
A.
Mikrofaltenzellen besitzen eine gefaltete luminale Oberfläche und eine dicke Schleimschicht, durch die Mikroorganismen in die Peyer-Plaques gelangen können.
-
B.
Mikrofaltenzellen erkennen verschiedene bakterielle Proteine durch GP2 und setzen mithilfe der Transcytose Material in den Extrazellularraum frei.
-
C.
Mit dem Darm assoziierte lymphatische Gewebe locken mithilfe von Chemokinen wie CCL20 und CCL9 dendritische Zellen an.
-
D.
Pathogene wie Yersinia pestis und Shigella steuern Mikrofaltenzellen an und können dadurch in den Subepithelialraum gelangen.
12.2 Richtig oder falsch
Die intraepithelialen Lymphocyten umfassen vor allem CD4-T-Zellen, während in der Lamina propria CD8-T-Zellen vorherrschend sind.
12.3 Bitte zuordnen
Welches Chemokin beziehungsweise welcher Chemokinrezeptor gehört zu welcher gewebespezifischen Homing-Funktion?
| A. | CXCL13 _____ | i. | Rekrutierung von Lymphocyten in den Dickdarm, in die Milchdrüse der Brust und in die Speicheldrüsen |
| B. | CCL25 _____ | ii. | Rekrutierung von B- und T-Zellen in den Dünndarm |
| C. | CCL28 _____ | iii. | Lenkung der Lymphocyten in die Haut |
| D. | CCR4 _____ | iv. | Rekrutierung naiver B-Zellen in die Peyer-Plaques |
12.4 Multiple Choice
Welche Aussage trifft zu?
-
A.
Dendritische CD11b+-Zellen stimulieren ILC3-Zellen und sind in den Peyer-Plaques die wichtigste Quelle für IL-12.
-
B.
Dendritische CD11b−-Zellen benötigen BATF3 für ihre Entwicklung.
-
C.
Die Produktion von Retinsäure durch naive T-Zellen ist notwendig für dendritische Zellen, damit Treg-Zellen gebildet werden können.
-
D.
CCL20 verhindert, dass dendritische Zellen in die Epithelschicht der Peyer-Plaques gelangen.
12.5 Kurze Antwort: IgA:Antigen-Komplexe können zurück in das Darmlumen transportiert werden, wodurch dort die Ausscheidung von Pathogenen aus dem Körper verstärkt wird. Andererseits kann die Bildung von IgA
Antigen-Komplexen auch die Aufnahme von Antigenen aus dem Lumen erhöhen. Inwieweit ist die Aufnahme von Antigenen für den Körper vorteilhaft?
12.6 Kurze Antwort
B-Zellen und Plasmazellen im Darm produzieren große Mengen an IgA. Diese werden in das Lumen freigesetzt, sodass die Mikroflora in Schach gehalten und ein Eindringen von Pathogenen verhindert wird. Allerdings sind die meisten Personen mit einem IgA-Mangel gegenüber Infektionen nicht übermäßig anfällig. Warum ist das so?
12.7 Multiple Choice
Welche Aussage beschreibt intraepitheliale Lymphocyten (iELs) am besten?
-
A.
Expression von CCR9 und α4:β7-Integrin
-
B.
Expression von CCR9 und αE:β7-Integrin (CD103)
-
C.
Das Verhältnis CD4- zu CD8-T-Zellen beträgt 3:1.
-
D.
Dazu gehören auch CD4+-T-Zellen, die IFN-γ, IL-17 und IL-22 produzieren.
-
E.
bestehen zu 90 % aus T-Zellen, von denen 80 % CD8 als α:α-Homodimer oder α:β-Heterodimer exprimieren
-
F.
Antwort A und C
-
G.
Antwort B und E
-
H.
Antwort A, C und D
12.8 Multiple Choice
Bei welchem der folgenden Zelltypen hängt die korrekte Entwicklung von der Expression des Arylkohlenwasserstoffrezeptors ab?
-
A.
intraepitheliale Lymphocyten vom Typ b
-
B.
ILC1
-
C.
B-Zellen
-
D.
Makrophagen
-
E.
ILC2
-
F.
neutrophile Zellen
12.9 Bitte zuordnen
Welche Krankheit des Menschen geht mit welcher pathologischen Symptomatik einher?
| A. | anormale Reaktion auf das Weizenprotein Gluten, was zu einem vermehrten Auftreten von IEL-Zellen mit einer MIC-A-abhängigen cytotoxischen Aktivität gegen Darmepithelzellen führt | i. | Infektion mit Clostridium difficile |
| B. | Unterbrechung des normalen Flusses der Fäzes im Dickdarm, sodass die Enterocyten Entzündungen und Nekrosen entwickeln, da kurzkettige Fettsäuren (SCFAs) fehlen, die von kommensalen Bakterien produziert werden | ii. | Zöliakie |
| C. | Eine Behandlung mit Antibiotika beseitigt einen großen Teil der kommensalen Mikroflora, sodass sich eine bestimmte Spezies übermäßig vermehrt und Toxine produziert, die schweren Durchfall verursachen und die Schleimhaut schädigen. | iii. | entzündliche Darmerkrankung (Morbus Crohn und Colitis ulcerosa) |
| D. | übermäßig aktive Immunantworten gegen kommensale Bakterien aufgrund eines Defekts in Genen der angeborenen Immunität | iv. | Diversionscolitis |
12.10 Richtig oder falsch
Die CD4+-T-Zellen in der Lamina propria sezernieren große Mengen an Cytokinen wie IFN-γ, IL-17 und IL-22 nur als Reaktion auf Krankheitserreger und Schädigungen durch eine Entzündung.
12.11 Richtig oder falsch
Die meisten Treg-Zellen im Dünndarm exprimieren kein FoxP3.
Literatur
Allgemeine Literatur
■ Hooper, L.V., Littman, D.R., and Macpherson, A.J.: Interactions between the microbiota and the immune system. Science 2012, 336:1268–1273.
■ MacDonald, T.T., Monteleone, I., Fantini, M.C., and Monteleone, G.: Regulation of homeostasis and inflammation in the intestine. Gastroenterology 2011, 140: 1768–1775.
■ Mowat, A.M.: Anatomical basis of tolerance and immunity to intestinal anti-gens. Nat. Rev. Immunol. 2003, 3:331–341.
■ Society for Mucosal Immunology: Principles of Mucosal Immunology, 1st edu. New York, Garland Science, 2013.
Literatur zu den einzelnen Abschnitten
Abschnitt 12.1.1
■ Brandtzaeg, P.: Function of mucosa-associated lymphoid tissue in antibody formation. Immunol. Invest. 2010, 39:303–355.
■ Cerutti, A., Chen, K., and Chorny, A.: Immunoglobulin responses at the mucosal interface. Annu. Rev. Immunol. 2011, 29:273–293.
■ Corthesy, B.: Role of secretory IgA in infection and maintenance of homeotasis. Autoimmun. Rev. 2013, 12:661–665.
■ Fagarasan, S., Kawamoto, S., Kanagawa, O., and Suzuki, K.: Adaptive immune regulation in the gut: T cell-dependent and T cell-independent IgA synthesis. Annu. Rev. Immunol. 2010, 28:243–273.
■ Matsunaga, T. and Rahman, A.: In search of the origin of the thymus: the thymus and GALT may be evolutionarily related. Scand. J. Immunol. 2001, 53:1–6.
■ Naz, R.K.: Female genital tract immunity: distinct immunological challenges for vaccine development. J .Reprod. Immunol. 2012, 93:1–8.
■ Randall, T.D.: Bronchus-associated lymphoid tissue (BALT) structure and function. Adv. Immunol. 2010, 107:187–241.
■ Sato, S. and Kiyono, H. The mucosal immune system of the respiratory tract. Curr. Opin. Virol. 2012, 2:225–232.
Abschnitt 12.1.2
■ Baptista, A.P., Olivier, B.J., Goverse, G., Greuter, M., Knippenberg, M., Kusser, K., Domingues, R.G., Veiga-Fernandes, H., Luster, A.D., Lugering, A., et al.: Colonic patch and colonic SILT development are independent and differentially regulated events. Mucosal Immunol. 2013, 6:511–521.
■ Brandtzaeg, P., Kiyono, H., Pabst, R., and Russell, M.W.: Terminology: nomenclature of mucosa-associated lymphoid tissue. Mucosal. Immunol. 2008, 1:31–37.
■ Eberl, G. and Sawa, S.: Opening the crypt: current facts and hypotheses on the function of cryptopatches. Trends Immunol. 2010, 31:50–55.
■ Lee, J.S., Cella, M., McDonald, K.G., Garlanda, C., Kennedy, G.D., Nukaya, M., Mantovani, A., Kopan, R., Bradfield, C.A., Newberry, R.D., et al.: AHR drives the development of gut ILC22 cells and postnatal lymphoid tissues via pathways dependent on and independent of Notch. Nat. Immunol. 2012, 13:144–151.
■ Macpherson, A.J., McCoy, K.D., Johansen, F.E., and Brandtzaeg, P.: The immune geography of IgA induction and function. Mucosal. Immunol. 2008, 1:11–22.
■ Pabst, O., Herbrand, H., Worbs, T., Friedrichsen, M., Yan, S., Hoffmann, M.W., Korner, H., Bernhardt, G., Pabst, R., and Forster, R.: Cryptopatches and isolated lymphoid follicles: dynamic lymphoid tissues dispensable for the generation of intraepithelial lymphocytes. Eur. J. Immunol. 2005, 35:98–107.
■ Randall, T.D.: Bronchus-associated lymphoid tissue (BALT) structure and function. Adv. Immunol. 2010, 107:187–241.
■ Randall, T.D. and Mebius, R.E.: The development and function of mucosal lymphoid tissues: a balancing act with micro-organisms. Mucosal Immunol. 2014, 7:455–466.
■ Suzuki, K., Kawamoto, S., Maruya, M., and Fagarasan, S.: GALT: organization and dynamics leading to IgA synthesis. Adv. Immunol. 2010, 107:153–185.
Abschnitt 12.1.3
■ Anosova, N.G., Chabot, S., Shreedhar, V., Borawski, J.A., Dickinson, B.L., and Neutra, M.R.: Cholera toxin, E. coli heat-labile toxin, and non-toxic derivatives induce dendritic cell migration into the follicle-associated epithelium of Peyer’s patches. Mucosal Immunol. 2008, 1:59–67.
■ Hase, K., Kawano, K., Nochi, T., Pontes, G.S., Fukuda, S., Ebisawa, M., Kadokura, K., Tobe, T., Fujimura, Y., Kawano, S., et al.: Uptake through glycoprotein 2 of FimH+ bacteria by M cells initiates mucosal immune response. Nature 2009, 462:226–230.
■ Jang, M.H., Kweon, M.N., Iwatani, K., Yamamoto, M., Terahara, K., Sasakawa, C., Suzuki, T., Nochi, T., Yokota, Y., Rennert, P.D., et al.: Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proc. Natl Acad. Sci. USA 2004, 101:6110–6115.
■ Lelouard, H., Fallet, M., de Bovis, B., Meresse, S., and Gorvel, J.P.: Peyer’s patch dendritic cells sample antigens by extending dendrites through M cell-specific transcellular pores. Gastroenterology 2012, 142:592–601.
■ Mabbott, N.A., Donaldson, D.S., Ohno, H., Williams, I.R., and Mahajan, A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunol. 2013, 6:666–677.
■ Sato, S., Kaneto, S., Shibata, N., Takahashi, Y., Okura, H., Yuki, Y., Kunisawa, J., and Kiyono, H.: Transcription factor Spi-B-dependent and -independent pathways for the development of Peyer’s patch M cells. Mucosal Immunol. 2013, 6:838–846.
■ Salazar-Gonzalez, R.M., Niess, J.H., Zammit, D.J., Ravindran, R., Srinivasan, A., Maxwell, J.R., Stoklasek, T., Yadav, R., Williams, I.R., Gu, X., et al.: CCR6-mediated dendritic cell activation of pathogen-specific T cells in Peyer’s patches. Immunity 2006, 24:623–632.
■ Zhao, X., Sato, A., Dela Cruz, C.S., Linehan, M., Luegering, A., Kucharzik, T., Shirakawa, A.K., Marquez, G., Farber, J.M., Williams, I., et al.: CCL9 is secreted by the follicle-associated epithelium and recruits dome region Peyer’s patch CD11b+ dendritic cells. J. Immunol. 2003, 171:2797–2803.
Abschnitt 12.1.4
■ Belkaid, Y., Bouladoux, N., and Hand, T.W.: Effector and memory T cell responses to commensal bacteria. Trends Immunol. 2013, 34:299–306.
■ Brandtzaeg, P.: Mucosal immunity: induction, dissemination, and effector functions. Scand. J. Immunol. 2009, 70:505–515.
■ Cao A.T., Yao S., Gong B., Elson C.O., and Cong Y.: Th17 cells upregulate polymeric Ig receptor and intestinal IgA and contribute to intestinal homeostasis. J. Immunol. 2012, 189:4666–4673.
■ Cheroutre, H. and Lambolez, F.: Doubting the TCR coreceptor function of CD8αα. Immunity 2008, 28:149–159.
■ Cauley, L.S. and Lefrancois, L.: Guarding the perimeter: protection of the mucosa by tissue-resident memory T cells. Mucosal Immunol. 2013, 6:14–23.
■ Maynard, C.L. and Weaver, C.T.: Intestinal effector T cells in health and disease. Immunity 2009, 31:389–400.
■ Sathaliyawala, T., Kubota, M., Yudanin, N., Turner, D., Camp, P., Thome, J.J., Bickham, K.L., Lerner, H., Goldstein, M., Sykes, et al.: Distribution and compart-mentalization of human circulating and tissue-resident memory T cell subsets. Immunity 2013, 38:187–197.
Abschnitt 12.1.5
■ Agace, W.: Generation of gut-homing T cells and their localization to the small intestinal mucosa. Immunol. Lett. 2010, 128:21–23.
■ Hu, S., Yang, K., Yang, J., Li, M., and Xiong, N.: Critical roles of chemokine receptor CCR10 in regulating memory IgA responses in intestines. Proc. Natl Acad. Sci. USA 2011, 108:E1035–1044.
■ Kim, S.V., Xiang, W.V., Kwak, C., Yang, Y., Lin, X.W., Ota, M., Sarpel, U., Rifkin, D.B., Xu, R. and Littman, D.R.: GPR15-mediated homing controls immune homeostasis in the large intestine mucosa. Science 2013, 340:1456–1459.
■ Macpherson, A.J., Geuking, M.B., Slack, E., Hapfelmeier, S., and McCoy, K.D.: The habitat, double life, citizenship, and forgetfulness of IgA. Immunol. Rev. 2012, 245:132–146.
■ Mikhak, Z., Strassner, J.P., and Luster, A.D.: Lung dendritic cells imprint T cell lung homing and promote lung immunity through the chemokine receptor CCR4. J. Exp. Med. 2013, 210:1855–1869.
■ Mora, J.R. and von Andrian, U.H.: Differentiation and homing of IgA-secreting cells. Mucosal Immunol. 2008, 1:96–109.
■ Pabst, O. and Bernhardt, G.: On the road to tolerance-generation and migration of gut regulatory T cells. Eur. J. Immunol. 2013, 43:1422–1425.
Abschnitt 12.1.6
■ Agnello, D., Denimal, D., Lavaux, A., Blondeau-Germe, L., Lu, B., Gerard, N.P., Gerard, C., and Pothier, P.: Intrarectal immunization and IgA antibody-secreting cell homing to the small intestine. J. Immunol. 2013, 190:4836–4847.
■ Brandtzaeg, P.: Induction of secretory immunity and memory at mucosal surfaces. Vaccine 2007, 25:5467–5484.
■ Czerkinsky, C. and Holmgren, J.: Mucosal delivery routes for optimal immunization: targeting immunity to the right tissues. Curr. Top. Microbiol. Immunol. 2012, 354:1–18.
■ Ruane, D., Brane, L., Reis, B.S., Cheong, C., Poles, J., Do, Y., Zhu, H., Velinzon, K., Choi, J.H., Studt, N., et al.: Lung dendritic cells induce migration of protective T cells to the gastrointestinal tract. J. Exp. Med. 2013, 210:1871–1888.
Abschnitt 12.1.7
■ Cerovic, V., Bain, C.C., Mowat, A.M., and Milling, S.W.F.: Intestinal macrophages and dendritic cells: what’s the difference? Trends Immunol. 2014, 35:270–277.
■ Goto, Y., Panea, C., Nakato, G., Cebula, A., Lee, C., Diez, M.G., Laufer, T.M., Ignatowicz, L., and Ivanov, I.I.: Segmented filamentous bacteria antigens presented by intestinal dendritic cells drive mucosal Th17 cell differentiation. Immunity 2014, 40:594–607.
■ Guilliams, M., Lambrecht, B.N., and Hammad, H.: Division of labor between lung dendritic cells and macrophages in the defense against pulmonary infections. Mucosal Immunol. 2013, 6:464–473.
■ Jaensson-Gyllenback, E., Kotarsky, K., Zapata, F., Persson, E.K., Gundersen, T.E., Blomhoff, R., and Agace, W.W.: Bile retinoids imprint intestinal CD103+ dendritic cells with the ability to generate gut-tropic T cells. Mucosal Immunol. 2011, 4:438–447.
■ Matteoli, G.: Gut CD103+ dendritic cells express indoleamine 2,3-dioxygenase which influences T regulatory/T effector cell balance and oral tolerance induction. Gut 2010, 59:595–604.
■ Schlitzer, A., McGovern, N., Teo, P., Zelante, T., Atarashi, K., Low, D., Ho, A.W., See, P., Shin, A., Wasan, P.S., et al.: IRF4 transcription factor-dependent CD11b+ dendritic cells in human and mouse control mucosal IL-17 cytokine responses. Immunity 2013, 38:970–983.
■ Scott, C.L., Bain, C.C., Wright, P.B., Schien, D., Kotarsky, K., Persson, E.K., Luda, K., Guilliams, M., Lambrecht, B.N., Agace, W.W., et al.: CCR2+CD103-intestinal dendritic cells develop from DC-committed precursors and induce interleukin-17 production by T cells. Mucosal Immunol. 2015, 8:327–239.
■ Travis, M.A., Reizis, B., Melton, A.C., Masteller, E., Tang, Q., Proctor, J.M., Wang, Y., Bernstein, X., Huang, X., Reichardt, L.F., et al.: Loss of integrin αVβ8 on dendritic cells causes autoimmunity and colitis in mice. Nature 2007, 449:361–365.
■ Vicente-Suarez, I., Larange, A., Reardon, C., Matho, M., Feau, S., Chodaczek, G., Park, Y., Obata, Y., Gold, R., Wang-Zhu, Y., et al.: Unique lamina propria stromal cells imprint the functional phenotype of mucosal dendritic cells. Mucosal Immunol. 2015, 8:141–151.
■ Watchmaker, P.B., Lahl, K., Lee, M., Baumjohann, D., Morton, J., Kim, S.J., Zeng, R., Dent, A., Ansel, K.M., Diamond, B., et al.: Comparative transcriptional and functional profiling defines conserved programs of intestinal DC differentiation in humans and mice. Nat. Immunol. 2014, 15:98–108.
Abschnitt 12.1.8
■ Bain, C.C., Bravo-Blas, A., Scott, C.L., Geissmann, F., Henri, S., Malissen, B., Osborne, L.C., Artis, D., and Mowat, A.M.: Constant replenishment from circulating monocytes maintains the macrophage pool in adult intestine. Nat. Immunol. 2014, 15:929–937.
■ Guilliams, M., Lambrecht, B.N., and Hammad, H.: Division of labor between lung dendritic cells and macrophages in the defense against pulmonary infections. Mucosal Immunol. 2013, 6:464–473.
■ Hadis, U., Wahl, B., Schulz, O., Hardtke-Wolenski, M., Schippers, A., Wagner, N., Muller, W., Sparwasser, T., Forster, R., and Pabst, O.: Intestinal tolerance requires gut homing and expansion of FoxP3+ regulatory T cells in the lamina propria. Immunity 2011, 34:237–246.
■ Mortha, A., Chudnovskiy, A., Hashimoto, D., Bogunovic, M., Spencer, S.P., Belkaid, Y., and Merad, M.: Microbiota-dependent crosstalk between macrophages and ILC3 promotes intestinal homeostasis. Science 2014, 343:1249288.
Abschnitt 12.1.9
■ Farache, J., Zigmond, E., Shakhar, G., and Jung, S.: Contributions of dendritic cells and macrophages to intestinal homeostasis and immune defense. Immunol. Cell Biol. 2013, 91:232–239.
■ Jang, M.H., Kweon, M.N., Iwatani, K., Yamamoto, M., Terahara, K., Sasakawa, C., Suzuki, T., Nochi, T., Yokota, Y., Rennert, P.D., et al.: Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proc. Natl Acad. Sci. USA 2004, 101:6110–6115.
■ Mazzini, E., Massimiliano, L., Penna, G., and Rescigno, M.: Oral tolerance can be established via gap junction transfer of fed antigens from CX3CR1+ macrophages to CD103+ dendritic cells. Immunity 2014, 40:248–261.
■ McDole, J.R., Wheeler, L.W., McDonald, K.G., Wang, B., Konjufca, V., Knoop, K. A., Newberry, R.D., and Miller, M.J.: Goblet cells deliver luminal antigen to CD103+ dendritic cells in the small intestine. Nature 2012, 483:345–349.
■ Schulz, O. and Pabst, O.: Antigen sampling in the small intestine. Trends Immunol. 2013, 34:155–161.
■ Yoshida, M., Claypool, S.M., Wagner, J.S., Mizoguchi, E., Mizoguchi, A., Roopenian, D.C., Lencer, W.I., and Blumberg, R.S.: Human neonatal Fc receptor mediates transport of IgG into luminal secretions for delivery of antigens to mucosal dendritic cells. Immunity 2004, 20:769–783.
Abschnitt 12.1.10
■ Fritz, J.H., Rojas, O.L., Simard, N., McCarthy, D.D., Hapfelmeier, S., Rubino, S., Robertson, S.J., Larijani, M., Gosselin, J., Ivanov, II, et al.: Acquisition of a multi-functional IgA+ plasma cell phenotype in the gut. Nature 2012, 481:199–203.
■ Kawamoto, S., Maruya, M., Kato, L.M., Suda, W., Atarashi, K., Doi, Y., Tsutsui, Y., Qin, H., Honda, K., Okada, T., et al.: Foxp3 T cells regulate immunoglobulin A selection and facilitate diversification of bacterial species responsible for immune homeostasis. Immunity 2014, 41:152–165.
■ Lin, M., Du, L., Brandtzaeg, P., and Pan-Hammarstrom, Q.: IgA subclass switch recombination in human mucosal and systemic immune compartments. Mucosal Immunol. 2014, 7:511–520.
■ Woof, J.M. and Russell, M.W.: Structure and function relationships in IgA. Mucosal Immunol. 2011, 4:590–597.
Abschnitt 12.1.11
■ Barone, F., Vossenkamper, A., Boursier, L., Su, W., Watson, A., John, S., Dunn-Walters, D.K., Fields, P., Wijetilleka, S., Edgeworth, J.D., et al.: IgA-producing plasma cells originate from germinal centers that are induced by B-cell receptor engagement in humans. Gastroenterology 2011, 140:947–956.
■ Fagarasan, S., Kawamoto, S., Kanagawa, O., and Suzuki, K.: Adaptive immune regulation in the gut: T cell-dependent and T cell-independent IgA synthesis. Annu. Rev. Immunol. 2010, 28:243–273.
■ Lin, M., Du, L., Brandtzaeg, P., and Pan-Hammarstrom, Q.: IgA subclass switch recombination in human mucosal and systemic immune compartments. Mucosal Immunol. 2014, 7:511–520.
■ Tezuka, H., Abe, Y., Asano, J., Sato, T., Liu, J., Iwata, M., and Ohteki, T.: Prominent role for plasmacytoid dendritic cells in mucosal T cell-independent IgA induction. Immunity 2011, 34:247–257.
Abschnitt 12.1.12
■ Karlsson, M.R., Johansen, F.E., Kahu, H., Macpherson, A., and Brandtzaeg, P.: Hypersensitivity and oral tolerance in the absence of a secretory immune system. Allergy 2010, 65:561–570.
■ Yel, L.: Selective IgA deficiency. J. Clin. Immunol. 2010, 30:10–16.
Abschnitt 12.1.13
■ Buonocore, S., Ahern, P.P., Uhlig, H.H., Ivanov, I.I., Littman, D.R., Maloy, K.J., and Powrie, F.: Innate lymphoid cells drive interleukin-23-dependent innate intestinal pathology. Nature 2010, 464:1371–1375.
■ Satpathy, A.T., Briseño, C.G., Lee, J.S., Ng, D., Manieri, N.A., Kc, W., Wu, X., Thomas, S.R., Lee, W.L., Turkoz, M., et al.: Notch2-dependent classical dendritic cells orchestrate intestinal immunity to attaching-and-effacing bacterial pathogens. Nat. Immunol. 2013, 14:937–948.
■ Klose, C.S., Kiss, E.A., Schwierzeck, V., Ebert, K., Hoyler, T., d’Hargues, Y., Goppert, N., Croxford, A.L., Waisman, A., Tanriver, Y., et al.: A T-bet gradient controls the fate and function of CCR6-RORγt+ innate lymphoid cells. Nature 2013, 494:261–265.
■ Kruglov, A.A., Grivennikov, S.I., Kuprash, D.V., Winsauer, C., Prepens, S., Seleznik, G.M., Eberl, G., Littman, D.R., Heikenwalder, M., Tumanov, A.V., et al.: Nonredundant function of soluble LTα3 produced by innate lymphoid cells in intestinal homeostasis. Science 2013, 342:1243–1246.
■ Le Bourhis, L., Dusseaux, M., Bohineust, A., Bessoles, S., Martin, E., Premel, V., Core, M., Sleurs, D., Serriari, N.E., and Treiner, E.: MAIT cells detect and efficiently lyse bacterially-infected epithelial cells. PLoS Pathog. 2013, 9:e1003681.
■ Spits, H. and Cupedo, T.: Innate lymphoid cells: emerging insights in development, lineage relationships, and function. Annu. Rev. Immunol. 2012, 30:647–675.
Abschnitt 12.1.14
■ Agace, W.W., Roberts, A.I., Wu, L., Greineder, C., Ebert, E.C., and Parker, C.M.: Human intestinal lamina propria and intraepithelial lymphocytes express receptors specific for chemokines induced by inflammation. Eur. J. Immunol. 2000, 30:819–826.
■ Cheroutre, H., Lambolez, F., and Mucida, D.: The light and dark sides of intestinal intraepithelial lymphocytes. Nat. Rev. Immunol. 2011, 11:445–456.
■ Eberl, G. and Sawa, S.: Opening the crypt: current facts and hypotheses on the function of cryptopatches. Trends Immunol. 2010, 31:50–55.
■ Hayday, A., Theodoridis, E., Ramsburg, E., and Shires, J.: Intraepithelial lymphocytes: exploring the Third Way in immunology. Nat. Immunol. 2001, 2:997–1003.
■ Jiang, W., Wang, X., Zeng, B., Liu, L., Tardivel, A., Wei, H., Han, J., MacDonald, H.R., Tschopp, J., Tian, Z., et al.: Recognition of gut microbiota by NOD2 is essential for the homeostasis of intestinal intraepithelial lymphocytes. J. Exp. Med. 2013, 210:2465–2476.
■ Li, Y., Innocentin, S., Withers, D.R., Roberts, N.A., Gallagher, A.R., Grigorieva, E.F., Wilhelm, C., and Veldhoen, M.: Exogenous stimuli maintain intraepithelial lymphocytes via aryl hydrocarbon receptor activation. Cell 2011, 147:629–640.
■ Pobezinsky, L.A., Angelov, G.S., Tai, X., Jeurling, S., Van Laethem, F., Feigenbaum, L., Park, J.H., and Singer, A.: Clonal deletion and the fate of autoreactive thymocytes that survive negative selection. Nat. Immunol. 2012, 13:569–578.
Abschnitt 12.2.1
■ Clevers, H.C. and Bevins, C.L.: Paneth cells: maestros of the small intestinal crypts. Annu. Rev. Physio. 2013, 75:289–311.
■ Conway, K.L., Kuballa, P., Song, J.H., Patel, K.K., Castoreno, A.B., Yilmaz, O.H., Jijon, H.B., Zhang, M., Aldrich, L.N., Villablanca, E.J., et al.: Atg16l1 is required for autophagy in intestinal epithelial cells and protection of mice from Salmonella infection. Gastroenterology 2013, 145:1347–1357.
■ Geddes, K., Rubino, S.J., Magalhaes, J.G., Streutker, C., Le Bourhis, L., Cho, J.H., Robertson, S.J., Kim, C.J., Kaul, R., Philpott, D.J., et al.: Identification of an innate T helper type 17 response to intestinal bacterial pathogens. Nat. Med. 2011, 17:837–844.
■ Lassen, K.G., Kuballa, P., Conway, K.L., Patel, K.K., Becker, C.E., Peloquin, J.M., Villablanca, E.J., Norman, J.M., Liu, T.C., Heath, R.J., et al.: Atg16L1 T300A variant decreases selective autophagy resulting in altered cytokine signaling and decreased antibacterial defense. Proc. Natl Acad. Sci. USA 2014, 111:7741–7746.
■ Prescott, D., Lee, J., and Philpott, D.J.: An epithelial armamentarium to sense the microbiota. Semin. Immunol. 2013, 25:323–333.
■ Song-Zhao, G.X., Srinivasan, N., Pott, J., Baban, D., Frankel, G., and Maloy, K.J.: Nlrp3 activation in the intestinal epithelium protects against a mucosal pathogen. Mucosal Immunol. 2014, 7:763–774.
Abschnitt 12.2.2
■ Bain, C.C. and Mowat, A.M.: Macrophages in intestinal homeostasis and inflammation. Immunol. Rev. 2014: 260:102–117.
■ Farache, J., Koren, I., Milo, I., Gurevich, I., Kim, K.W., Zigmond, E., Furtado, G.C., Lira, S.A., and Shakhar, G.: Luminal bacteria recruit CD103+ dendritic cells into the intestinal epithelium to sample bacterial antigens for presentation. Immunity 2013, 38:581–595.
■ Persson, E.K., Scott, C.L., Mowat, A.M., and Agace, W.W.: Dendritic cell subsets in the intestinal lamina propria: Ontogeny and function. Eur. J. Immunol. 2013, 43:3098–3107.
■ Salazar-Gonzalez, R.M., Niess, J.H., Zammit, D.J., Ravindran, R., Srinivasan, A., Maxwell, J.R., Stoklasek, T., Yadav, R., Williams, I.R., Gu, X., et al.: CCR6-mediated dendritic cell activation of pathogen-specific T cells in Peyer’s patches. Immunity 2006, 24:623–632.
■ Uematsu, S., Jang, M.H., Chevrier, N., Guo, Z., Kumagai, Y., Yamamoto, M., Kato, H., Sougawa, N., Matsui, H., Kuwata, H., et al.: Detection of pathogenic intestinal bacteria by Toll-like receptor 5 on intestinal CD11c+ lamina propria cells. Nat. Immunol. 2006, 7:868–874.
Abschnitt 12.2.3
■ Cliffe, L.J., Humphreys, N.E., Lane, T.E., Potten, C.S., Booth, C., and Grencis, R.K.: Accelerated intestinal epithelial cell turnover: a new mechanism of parasite expulsion. Science 2005, 308:1463–1465.
■ Kinnebrew, M.A., Buffie, C.G., Diehl, G.E., Zenewicz, L.A., Leiner, I., Hohl, T.M., Flavell, R.A., Littman, D.R., and Pamer, E. G.: Interleukin 23 production by intestinal CD103+CD11b+ dendritic cells in response to bacterial flagellin enhances mucosal innate immune defense. Immunity 2012, 36:276–287.
■ Sokol, H., Conway, K.L., Zhang, M., Choi, M., Morin, B., Cao, Z., Villablanca, E.J., Li, C., Wijmenga, C., Yun, S.H., et al.: Card9 mediates intestinal epithelial cell restitution, T-helper 17 responses, and control of bacterial infection in mice. Gastroenterology 2013, 145:591–601.
■ Sonnenberg, G.F., Fouser, L.A., and Artis, D.: Functional biology of the IL-22-IL-22R pathway in regulating immunity and inflammation at barrier surfaces. Adv. Immunol. 2010, 107:1–29.
■ Turner, J.E., Stockinger, B., and Helmby, H.: IL-22 mediates goblet cell hyperplasia and worm expulsion in intestinal helminth infection. PLoS Pathog. 2013, 9:e1003698.
Abschnitt 12.2.4
■ Cassani, B., Villablanca, E.J., Quintana, F.J., Love, P.E., Lacy-Hulbert, A., Blaner, W.S., Sparwasser, T., Snapper, S.B., Weiner, H.L., and Mora, J.R.: Gut-tropic T cells that express integrin α4β7 and CCR9 are required for induction of oral immune tolerance in mice. Gastroenterology 2011, 141:2109–2118.
■ Coombes, J.L., Siddiqui, K.R., Arancibia-Carcamo, C.V., Hall, J., Sun, C.M., Belkaid, Y., and Powrie, F.: A functionally specialized population of mucosal CD103+ DCs induces Foxp3+ regulatory T cells via a TGF-β and retinoic acid-dependent mechanism. J. Exp. Med. 2007, 204:1757–1764.
■ Du Toit, G., Roberts, G., Sayre, P.H., Bahnson, H.T., Radulovic, S., Santos, A. F., Brough, H.A., Phippard, D., Basting, M., Feeney, M., et al.: Randomized trial of peanut consumption in infants at risk for peanut allergy. N. Engl. J. Med. 2015, 372:803–813.
■ Huang, G., Wang, Y., and Chi, H.: Control of T cell fates and immune tolerance by p38α signaling in mucosal CD103+ dendritic cells. J. Immunol. 2013, 191:650–659.
■ Mowat, A.M., Strobel, S., Drummond, H.E., and Ferguson, A.: Immunological responses to fed protein antigens in mice. I. Reversal of oral tolerance to ovalbumin by cyclophosphamide. Immunology 1982, 45:105–113.
Abschnitte 12.2.5 und 12.2.6
■ Arpaia, N., Campbell, C., Fan, X., Dikiy, S., van der Veeken, J., deRoos, P., Liu, H., Cross, J.R., Pfeffer, K., Coffer, P.J., et al.: Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature 2013, 504:451–455.
■ Atarashi, K., Tanoue, T., Oshima, K., Suda, W., Nagano, Y., Nishikawa, H., Fukuda, S., Saito, T., Narushima, S., Hase, K., et al.: Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota. Nature 2013, 500:232–236.
■ Belkaid, Y. and Hand, T.W.: Role of the microbiota in immunity and inflammation. Cell 2014, 157:121–141.
■ Harig, J.M., Soergel, K.H., Komorowski, R.A., and Wood, C.M.: Treatment of diversion colitis with short-chain-fatty acid irrigation. N. Engl. J. Med. 1989, 320:23–28.
■ Hirota, K., Turner, J.E., Villa, M., Duarte, J.H., Demengeot, J., Steinmetz, O.M., and Stockinger, B.: Plasticity of Th17 cells in Peyer’s patches is responsible for the induction of T cell-dependent IgA responses. Nat. Immunol. 2013, 14:372–379.
■ Kato, L.M., Kawamoto, S., Maruya, M., and Fagarasan, S.: The role of the adaptive immune system in regulation of gut microbiota. Immunol. Rev. 2014, 260:67–75.
■ Macia, L., Thorburn, A.N., Binge, L.C., Marino, E., Rogers, K.E., Maslowski, K.M., Vieira, A.T., Kranich, J., and Mackay, C.R.: Microbial influences on epithelial integrity and immune function as a basis for inflammatory diseases. Immunol. Rev. 2012, 245:164–176.
■ Maynard, C.L., Elson, C.O., Hatton, R.D., and Weaver, C.T.: Reciprocal interactions of the intestinal microbiota and immune system. Nature 2012, 489:231–241.
■ Peterson, D.A., McNulty, N.P., Guruge, J.L., and Gordon, J.I.: IgA response to symbiotic bacteria as a mediator of gut homeostasis. Cell Host Microbe 2007, 2:328–339.
■ Round, J.L. and Mazmanian, S.K.: Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota. Proc. Natl Acad. Sci. USA 2010, 107:12204–12209.
■ Scher, J.U., Sczesnak, A., Longman, R.S., Segata, N., Ubeda, C., Bielski, C., Rostron, T., Cerundolo, V., Pamer, E. G., Abramson, S.B., et al.: Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis. eLife 2013, 2:e01202.
■ Zigmond, E., Bernshtein, B., Friedlander, G., Walker, C.R., Yona, S., Kim, K.W., Brenner, O., Krauthgamer, R., Varol, C., Müller, W., et al.: Macrophage-restricted interleukin-10 receptor deficiency, but not IL10 deficiency, causes severe spontaneous colitis. Immunity 2014, 40:720–733.
Abschnitte 12.2.7 und 12.2.8
■ Adolph, T.E., Tomczak, M.F., Niederreiter, L., Ko, H.J., Bock, J., Martinez-Naves, E., Glickman, J.N., Tschurtschenthaler, M., Hartwig, J., Hosomi, S., et al.: Paneth cells as a site of origin for intestinal inflammation. Nature 2013, 503:272–276.
■ Alexander, K.L., Targan, S.R., and Elson, C.O.: Microbiota activation and regulation of innate and adaptive immunity. Immunol. Rev. 2014, 260:206–220.
■ Arenas-Hernández, M.M., Martínez-Laguna, Y., and Torres, A.G.: Clinical implications of enteroadherent Escherichia coli. Curr. Gastroenterol. Rep. 2012, 14:386–394.
■ Chung, H., Pamp, S.J., Hill, J.A., Surana, N.K., Edelman, S.M., Troy, E.B., Reading, N.C., Villablanca, E.J., Wang, S., Mora, J.R., et al.: Gut immune maturation depends on colonization with a host-specific microbiota. Cell 2012, 149:1578–1593.
■ Coccia, M., Harrison, O.J., Schiering, C., Asquith, M.J., Becher, B., Powrie, F., and Maloy, K.J.: IL-1β mediates chronic intestinal inflammation by promoting the accumulation of IL-17A secreting innate lymphoid cells and CD4+ Th17 cells. J. Exp. Med. 2012, 209:1595–1609.
■ Knights, D., Lassen, K.G., and Xavier, R.J.: Advances in inflammatory bowel disease pathogenesis: linking host genetics and the microbiome. Gut 2013, 62:1505–1510.
■ Kullberg, M.C., Jankovic, D., Feng, C.G., Hue, S., Gorelick, P.L., McKenzie, B.S., Cua, D.J., Powrie, F., Cheever, A.W., Maloy, K.J., et al.: Intestinal epithelial cells: regulators of barrier function and immune homeostasis. J. Exp. Med. 2006, 203:2485–2494.
■ Peterson, L.W. and Artis, D.: Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat. Rev. Immunol. 2014, 14:141–153.
■ Shale, M., Schiering, C., and Powrie, F.: CD4+ T-cell subsets in intestinal inflammation. Immunol. Rev. 2013, 252:164–182.
■ Zelante, T., Iannitti, R.G., Cunha, C., De Luca, A., Giovannini, G., Pieraccini, G., Zecchi, R., D’Angelo, C., Massi-Benedetti, C., Fallarino, F., et al.: Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22. Immunity 2013, 39:372–385.
Contributor Information
Kenneth Murphy, Email: Lydia.lundbeck@springer.com.
Casey Weaver, Email: lydia.lundbeck@springer.com.
Collaborators: Lothar Seidler