In der Immunologie untersucht man die Abwehr einer Infektion durch den Körper. Wir sind ständig Mikroorganismen ausgesetzt, von denen viele Krankheiten verursachen. Trotzdem werden wir nur selten krank. Wie kann sich der Körper selbst verteidigen? Wie kann der Körper bei einer Infektion den Eindringling entfernen und sich selbst heilen? Und wie können wir gegen viele Infektionskrankheiten, von denen wir nur einmal betroffen waren und die wir überwunden haben, eine lang andauernde Immunität entwickeln? Diese Fragen werden in der Immunologie behandelt, mit der wir uns beschäftigen wollen, um zu verstehen, wie die Abwehrmechanismen unseres Körpers gegen Infektionen auf zellulärer und molekularer Ebene funktionieren.
Der Beginn der Immunologie als Wissenschaft wird üblicherweise Edward Jenner und seinen Arbeiten im späten 18. Jahrhundert zugeschrieben (Abb. 1.1). Das Grundprinzip der Immunologie, dass man vor einer Krankheit besser geschützt ist, wenn man sie einmal überlebt hat, war schon im antiken Griechenland bekannt. Die sogenannte Variolation , also die Einnahme oder die Übertragung in oberflächliche Hautwunden von Material aus Pockenpusteln, wurde spätestens seit dem 15. Jahrhundert im Mittleren Osten und in China angewendet, um Menschen vor der Krankheit zu schützen. Auch Jenner war dies bekannt. Er hatte beobachtet, dass die relativ harmlos verlaufende Krankheit Kuhpocken (Vaccinia ) anscheinend einen Schutz vor der häufig tödlichen Krankheit Pocken vermittelte. 1796 zeigte er, dass eine Impfung mit Kuhpocken tatsächlich vor den Pocken schützen konnte. Sein wissenschaftlicher Beweis bestand darin, dass die geimpfte Person zwei Monate nach der Impfung absichtlich infektiöses Pockenmaterial verabreicht bekam. Dieser wissenschaftliche Versuch war sein eigentlicher Forschungsbeitrag.

Jenner bezeichnete sein Verfahren als vaccination; dieser Begriff steht im Englischen und in der Fachsprache (Vakzinierung ) auch heute noch für die Schutzimpfung einer gesunden Person mit abgeschwächten oder attenuierten Krankheitserregern. Obwohl Jenner mit seinem gewagten Experiment Erfolg hatte, vergingen fast zwei Jahrhunderte, bis die Schutzimpfung gegen Pocken überall auf der Welt eingeführt war. 1979 gab die Weltgesundheitsorganisation (WHO) schließlich bekannt, die Pocken seien ausgerottet, was zweifellos den größten Triumph der modernen Medizin darstellt (Abb. 1.2).

Die Entdeckungen anderer bedeutender Mikrobiologen des 19. Jahrhunderts ermöglichten die Übertragung von Jenners Impfverfahren auf andere Krankheiten. Robert Koch bewies, dass Infektionskrankheiten durch spezifische Mikroorganismen verursacht werden. In den Achtzigerjahren des 19. Jahrhunderts stellte Louis Pasteur in Hühnern einen Choleraimpfstoff her. Des Weiteren gelang ihm mit einem Impfstoff gegen die Tollwut ein spektakulärer Erfolg, als er erstmals einen Jungen impfte, den ein tollwutkranker Hund gebissen hatte.
Dem Durchbruch in der Praxis folgten die Suche nach den Schutzmechanismen, die Impfungen zugrunde liegen, und die Entwicklung der immunologischen Wissenschaft. In den frühen 1890er-Jahren fanden Emil von Behring und Shibasaburo Kitasato heraus, dass das Blutserum von Tieren, die gegen Tetanus oder Diphtherie immun waren, eine spezifische „antitoxische Aktivität“ enthielt, die bei Menschen einen kurzzeitigen Schutz gegen die Auswirkungen des Diphtherie- oder Tetanustoxins herbeiführen konnte. Diese Aktivität konnte man später auf Proteine zurückführen, die wir heute als Antikörper bezeichnen, welche spezifisch an die Toxine binden und ihre Aktivität neutralisieren. Die Entdeckung des Komplements , eines Serumbestandteils, der bei der Vernichtung von pathogenen Bakterien mit den Antikörpern zusammenwirkt, durch Jules Bordet im Jahr 1899 bestätigte dann, dass diese Antikörper für die Immunität von entscheidender Bedeutung sind.
Wird eine spezifische Immunantwort (oder Immunreaktion ) ausgelöst, wie die Erzeugung von Antikörpern gegen ein bestimmtes Pathogen oder seine Produkte, spricht man von einer adaptiven oder erworbenen Immunantwort , da ein Mensch sie während seines Lebens als Anpassung an eine Infektion mit einem spezifischen Krankheitserreger entwickelt. Davon unterscheidet sich die angeborene Immunantwort oder angeborene Immunität, die bereits in der Zeit bekannt war, in der von Behring seine Serumtherapie gegen Diphtherie entwickelte, vor allem durch die Arbeiten des großen russischen Immunologen Ilja Metchnikoff . Er fand heraus, dass phagocytotische Zellen Mikroorganismen aufnehmen und vernichten können, also eine unspezifische Abwehr von Infektionen bewerkstelligen. Diese Zellen, die Metchnikoff als Makrophagen bezeichnete, sind immer vorhanden und bereit aktiv zu werden. Sie gehören zur vorderen Verteidigungslinie der angeborenen Immunantworten. Im Gegensatz dazu benötigt eine adaptive Immunantwort Zeit, um sich zu entwickeln, und sie ist hochspezifisch.
Bald stellte sich heraus, dass der Körper spezifische Antikörper gegen ein enorm breites Spektrum von Substanzen hervorbringen kann, die man als Antigene bezeichnete, da sie die Bildung von Antikörpern auslösen können. Paul Ehrlich entwickelte die Anwendung eines Antiserums zur Diphtheriebehandlung weiter und entwickelte auch Methoden, um therapeutische Seren zu standardisieren. Die Bezeichnung Antigen bezieht sich heute auf jede Substanz, die vom adaptiven Immunsystem erkannt werden kann. Typische Antigene sind häufig vorkommende Proteine, Glykoproteine und Polysaccharide von Krankheitserregern, aber dazu gehört noch ein viel größeres Spektrum von chemischen Verbindungen, etwa Metalle wie Nickel, Wirkstoffe wie Penicillin und organische chemische Verbindungen wie die Urushiole (ein Gemisch aus Pentadecylcatecholen) in den Blättern des Giftsumachs. Ehrlich und Metchnikoff teilten sich 1908 den Nobelpreis für ihre beachtlichen Arbeiten zur Immunität.
Dieses Kapitel gibt zunächst eine Einführung in die Grundlagen der angeborenen und adaptiven Immunität, die Zellen des Immunsystems und die Gewebe, in denen sie sich entwickeln und zirkulieren. Danach beschreiben wir die spezifischen Funktionen der verschiedenen Zelltypen und die Mechanismen, mit deren Hilfe sie Infektionen beseitigen.
Der Ursprung der Immunzellen bei den Wirbeltieren
Der Körper ist durch eine Reihe verschiedener Effektorzellen und Moleküle, die zusammen das Immunsystem bilden, vor Krankheitserregern, ihren Toxinen und den Schäden, die sie verursachen, geschützt. Sowohl die angeborenen als auch die adaptiven Immunantworten basieren auf Aktivitäten der weißen Blutzellen oder Leukocyten . Die meisten dieser Zellen gehen aus dem Knochenmark hervor und viele von ihnen entwickeln sich und reifen dort auch heran. Einige jedoch, vor allem bestimmte geweberesidente Populationen von Makrophagen (etwa die Mikroglia des zentralen Nervensystems), entstehen während der Embryonalentwicklung im Dottersack oder in der fetalen Leber. Diese besiedeln die Gewebe vor der Geburt und bleiben während des gesamten Lebens als unabhängige, sich selbst erneuernde Populationen erhalten. Sobald Immunzellen gereift sind, halten sie sich in den peripheren Geweben auf, zirkulieren im Blut oder in einem spezialisierten Gefäßsystem, das man als Lymphsystem bezeichnet. Es leitet extrazelluläre Flüssigkeit und freie Zellen aus den Geweben ab, transportiert sie als Lymphflüssigkeit durch den Körper und führt sie schließlich in das Blut zurück.
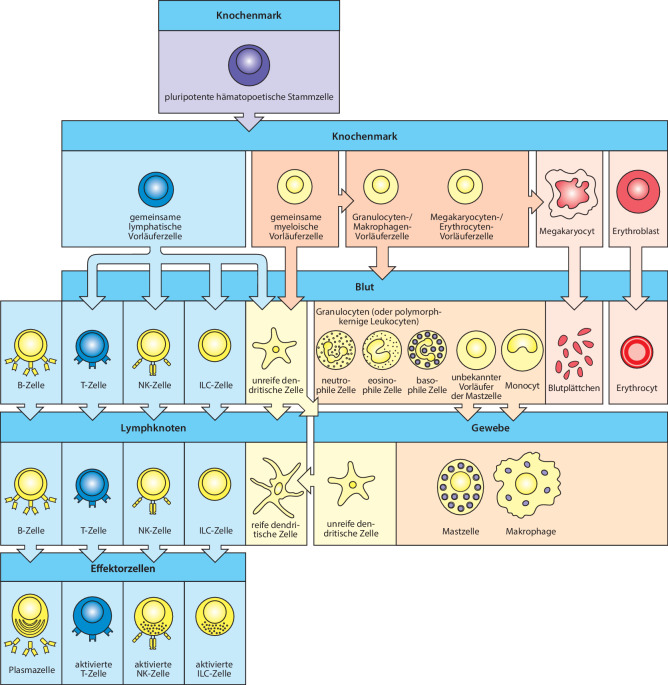
Alle zellulären Bestandteile des Blutes – zu ihnen gehören die roten Blutkörperchen, die den Sauerstoff transportieren, die Blutplättchen, die in verletzten Geweben die Blutgerinnung auslösen, und die weißen Blutzellen des Immunsystems – stammen letztendlich von den gleichen Vorstufen oder Vorläuferzellen ab: den hämatopoetischen Stammzellen (HSCs) im Knochenmark. Da aus diesen Stammzellen alle Blutzelltypen entstehen können, bezeichnet man sie häufig auch als pluripotent. Aus ihnen entwickeln sich Stammzellen mit eingeschränktem Potenzial: die direkten Vorläuferzellen der roten Blutkörperchen, der Blutplättchen und der beiden Hauptgruppen der weißen Blutzellen, der lymphatischen und der myeloischen Zelllinie . Abb. 1.3 fasst die verschiedenen Blutzelltypen und ihre Entwicklungslinien zusammen.
Grundlagen der angeborenen Immunität
In diesem Teil des Kapitels wollen wir uns mit den Grundzügen der angeborenen Immunität beschäftigen und die Moleküle und Zellen beschreiben, die eine ständige Abwehr gegen das Eindringen von Krankheitserregern bilden. Die weißen Blutzellen, die als Lymphocyten bezeichnet werden, besitzen die äußerst wirksame Fähigkeit, pathogene Mikroorganismen zu erkennen und anzugreifen. Sie benötigen die Mitwirkung des angeborenen Immunsystems, um ihre Aktivität in Gang zu setzen und zu entwickeln. Tatsächlich bedienen sich die adaptive und die angeborene Immunität vielfach derselben Zerstörungsmechanismen, um eingedrungene Mikroorganismen zu beseitigen.
Kommensale Organismen verursachen beim Wirt nur geringe Schäden, während Krankheitserreger durch verschiedene Mechanismen Gewebe zerstören
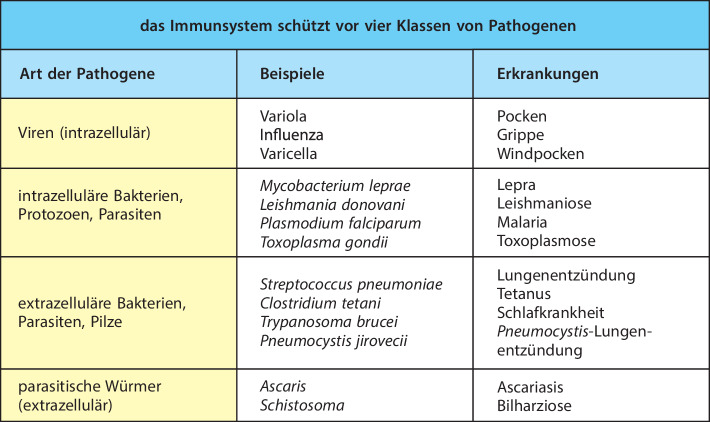
Wir kennen vier große Gruppen von Pathogenen , also Mikroorganismen , die Krankheiten hervorrufen: Viren, Bakterien und Archaeen, Pilze sowie ein- und vielzellige eukaryotische Organismen, die man insgesamt als Parasiten bezeichnet (Abb. 1.4). Diese Mikroorganismen unterscheiden sich außerordentlich in der Größe und auch darin, wie sie die Gewebe des Wirts schädigen. Am kleinsten sind die Viren . Ihre Größe reicht von fünf bis zu wenigen Hundert Nanometern und sie sind grundsätzlich intrazelluläre Krankheitserreger. Viren können Zellen direkt töten, indem sie während ihrer Replikation die Lyse der Zelle auslösen. Etwas größer sind intrazelluläre Bakterien und Mycobakterien . Diese können Zellen direkt töten oder durch die Produktion von Toxinen schädigen. Viele einzellige intrazelluläre Parasiten, etwa Spezies aus der Gattung Plasmodium , die Malaria hervorrufen, töten infizierte Zellen ebenfalls direkt. Pathogene Bakterien und Pilze, die sich im extrazellulären Raum vermehren, können einen Schock oder eine Sepsis hervorrufen, indem sie im Blut oder in Geweben Toxine freisetzen. Die größten Krankheitserreger – parasitische Würmer oder Helminthen – sind zu groß, um Wirtszellen zu infizieren, aber sie können das Gewebe verletzen, indem sie Cysten erzeugen, die in den Geweben, in die der Wurm eindringt, schädliche Zellreaktionen in Gang setzen.
Nicht alle Mikroorganismen sind Krankheitserreger. Viele Gewebe, vor allem Haut, Mundschleimhaut, Bindehaut der Augen und der Verdauungstrakt sind dauerhaft von mikrobiellen Gemeinschaften besiedelt. Dieses sogenannte Mikrobiom umfasst Archaeen, Bakterien und Pilze, fügt aber dem Wirt keinen Schaden zu. Man spricht hier auch von kommensalen Mikroorganismen , da sie mit dem Wirt in einer Symbiose leben. Tatsächlich besitzen einige kommensale Organismen wichtige Funktionen, etwa die Bakterien, die in den Mägen der Wiederkäuer zur Verdauung von Cellulose beitragen. Der Unterschied zwischen kommensalen Organismen und Krankheitserregern besteht darin, ob sie Schäden hervorrufen oder nicht. Selbst die riesige Anzahl von Mikroorganismen im Mikrobiom des Darms verursacht normalerweise keine Schäden, da die Mikroben im Darm von einer schützenden Schleimschicht umgeben sind, während pathogene Bakterien diese Barriere durchdringen, Zellen des Darmepithels schädigen und sich in die darunter befindlichen Gewebe ausbreiten können.
Anatomische und chemische Barrieren bilden die erste Abwehrlinie gegen Krankheitserreger
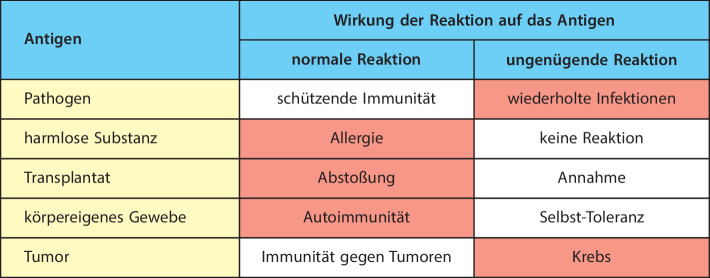
Ein Wirtsorganismus kann mit drei verschiedenen Strategien auf die Bedrohung reagieren, die von Mikroorganismen ausgeht: Vermeidung, Abwehr und Toleranz. Mechanismen zur Vermeidung verhindern, dass der Körper mit Mikroorganismen in Kontakt kommt. Dazu gehören sowohl anatomische Barrieren als auch Veränderungen des Verhaltens. Wenn es zu einer Infektion gekommen ist, zielt die Abwehr darauf ab, die Zahl der Krankheitserreger zu verringern oder den Erreger vollständig zu beseitigen. Um die große Vielfalt von Mikroorganismen abzuwehren, besitzt das Immunsystem zahlreiche molekulare und zelluläre Funktionen, die man insgesamt als Mediatoren oder Effektormechanismen bezeichnet. Sie sind gut geeignet, die verschiedenen Arten von Krankheitserregern abzuwehren. Sie zu beschreiben ist ein zentrales Anliegen dieses Buches. Die Toleranz schließlich umfasst Reaktionen, die es den Geweben ermöglichen, Schädigungen durch Mikroorganismen besser zu widerstehen. In diesem Sinn wurde der Begriff „Toleranz “ bis jetzt vor allem im Zusammenhang mit der Krankheitsanfälligkeit von Pflanzen verwendet und weniger bei der Immunität von Tieren. So ist beispielsweise die Aktivierung von ruhenden Meristemen, also von undifferenzierten Zellen, zu neuem Wachstum, das neue Pflanzenteile hervorbringt, ein häufiger Toleranzmechanismus als Reaktion auf eine Schädigung. Davon ist der Begriff der immunologischen Toleranz zu unterscheiden, der sich auf Mechanismen bezieht, die eine Immunreaktion gegen körpereigene Gewebe verhindern.
Anatomische und chemische Barrieren sind die erste Abwehrlinie gegen eine Infektion (Abb. 1.5). Die Haut und die Oberflächen der Schleimhäute dienen einer Vermeidungsstrategie, die verhindert, dass innere Gewebe mit Mikroorganismen in Kontakt kommen. Bei den meisten anatomischen Barrieren verstärken zusätzliche Verteidigungsmechanismen die körpereigene Abwehr. So erzeugen beispielsweise Schleimhäute eine Reihe unterschiedlicher antimikrobieller Proteine , die als natürliche Antikörper fungieren und Mikroorganismen daran hindern, in den Körper zu gelangen.
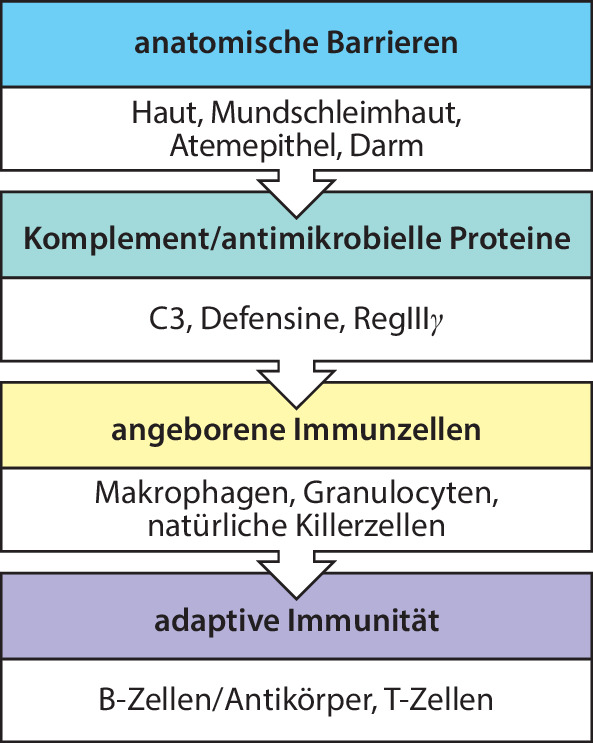
Werden diese Barrieren durchbrochen oder umgangen, kommen weitere Bestandteile des angeborenen Immunsystems zum Einsatz. Wir haben bereits die Entdeckung des Komplements durch Jules Bordet erwähnt, das mit Antikörpern zusammenwirkt, um Bakterien zu lysieren. Das Komplementsystem umfasst eine Gruppe von etwa 30 verschiedenen Plasmaproteinen, die zusammen agieren und im Serum und im Darmgewebe einen der wichtigsten Effektormechanismen bilden. Das Komplement wirkt nicht nur gemeinsam mit Antikörpern, sondern kann Fremdorganismen auch dann angreifen, wenn kein spezifischer Antikörper vorhanden ist. So trägt es sowohl zu Reaktionen des angeborenen als auch des erworbenen Immunsystems bei. In Kap. 10.1007/978-3-662-56004-4_2 wollen wir uns genauer mit anatomischen Barrieren, antimikrobiellen Proteinen und dem Komplement beschäftigen.
Das Immunsystem wird durch Entzündungsinduktoren aktiviert, die das Auftreten von Krankheitserregern oder Gewebeschäden anzeigen
Ein Krankheitserreger, der die anatomischen und chemischen Barrieren des Körpers überwindet, trifft auf die zelluläre Abwehr der angeborenen Immunität. Zellvermittelte Immunreaktionen entstehen, wenn Entzündungsinduktoren von Sensorzellen erkannt werden (Abb. 1.6). Die Sensorzellen umfassen viele Zelltypen, die Entzündungsmediatoren erkennen, indem sie viele angeborene Erkennungsrezeptoren exprimieren, die wiederum von einer relativ geringen Anzahl von Genen codiert werden. Diese Gene bleiben während der gesamten Lebenszeit eines Menschen unverändert. Zu den Entzündungsinduktoren, die diese Rezeptoren aktivieren, gehören molekulare Komponenten, die nur bei Bakterien oder Viren vorkommen, etwa bakterielle Lipopolysaccharide , oder Moleküle wie ATP, die normalerweise nicht im extrazellulären Raum vorhanden sind. Die Aktivierung dieser Rezeptoren kann Zellen des angeborenen Immunsystems dazu anregen, verschiedene Mediatoren zu erzeugen, die entweder eingedrungene Mikroorganismen direkt zerstören oder auf andere Zellen einwirken, die die Immunantwort voranbringen. So können beispielsweise Makrophagen Mikroorganismen aufnehmen und toxische chemische Mediatoren produzieren, die sie töten, zum Beispiel durch abbauende Enzyme oder reaktive Sauerstoffspezies. Dendritische Zellen können Cytokinmediatoren hervorbringen, beispielsweise viele Cytokine , die Zielgewebe wie Epithelien oder andere Immunzellen aktivieren, sodass sie eingedrungenen Mikroorganismen wirksamer widerstehen. Wir werden diese Rezeptoren hier nur kurz und dann in Kap. 10.1007/978-3-662-56004-4_3 genauer besprechen.
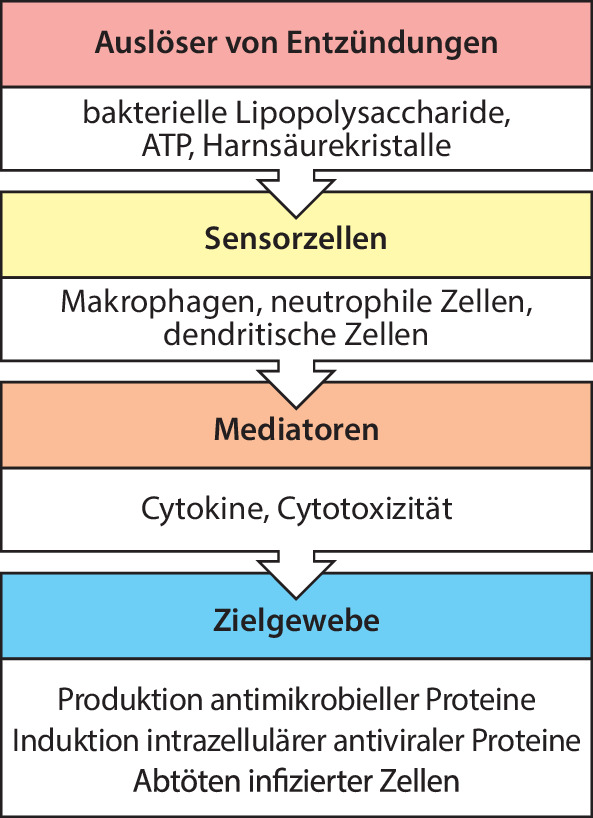
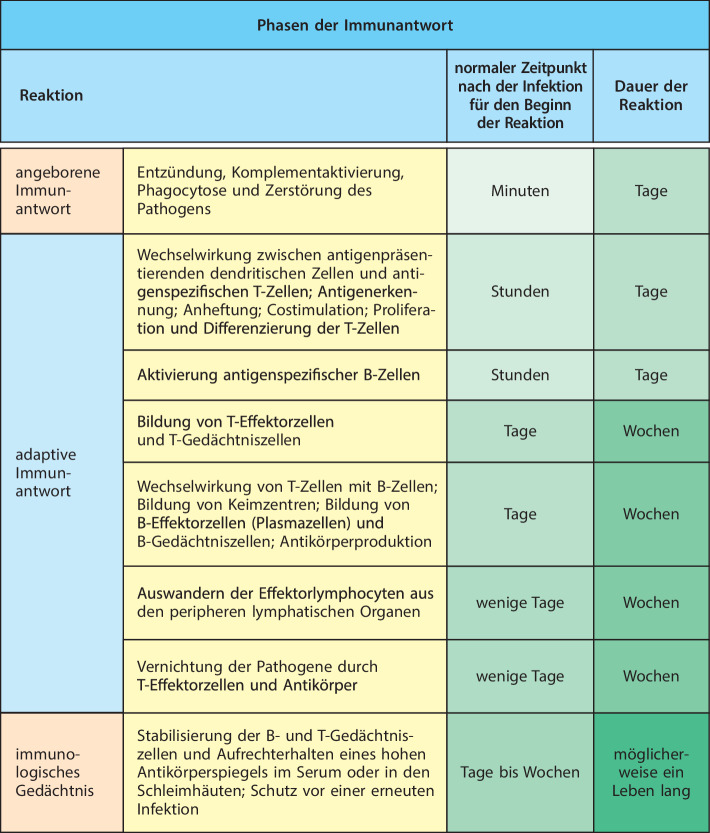
Die Reaktionen des angeborenen Immunsystems erfolgen schnell, sobald es zum Kontakt mit einem infektiösen Organismus kommt (Abb. 1.7). Im Gegensatz dazu benötigen die Reaktionen des adaptiven Immunsystems nicht nur wenige Stunden, sondern mehrere Tage, um sich zu entwickeln. Dennoch kann das adaptive Immunsystem Infektionen viel wirksamer bekämpfen, da die Antigenerkennung durch die Lymphocyten außerordentlich spezifisch ist. Anders als bei dem begrenzten Repertoire von Rezeptoren, die das angeborene Immunsystem produziert, exprimieren die Lymphocyten hoch spezialisierte Antigenrezeptoren , die insgesamt eine riesige Bandbreite an Spezifitäten abdecken. Dadurch kann das adaptive Immunsystem im Prinzip auf jeden Krankheitserreger reagieren und die Ressourcen wirksam darauf konzentrieren, Krankheitserreger zu vernichten, die der angeborenen Immunität entkommen sind beziehungsweise diese überrannt haben. Das adaptive Immunsystem interagiert jedoch mit Zellen des angeborenen Immunsystems und nutzt viele von dessen Funktionen. In den nächsten Abschnitten werden die Hauptbestandteile des angeborenen Immunsystems eingeführt, auch als Vorbereitung für die Besprechung der adaptiven Immunität weiter unten in diesem Kapitel.
Die myeloische Zelllinie umfasst die meisten Zellen des angeborenen Immunsystems
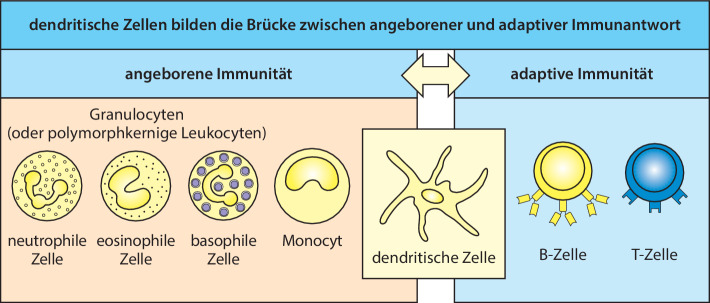
Die gemeinsame myeloische Vorläuferzelle (common myeloid progenitor, CMP) ist die Vorstufe der Makrophagen, Granulocyten (die zusammenfassende Bezeichnung der neutrophilen, basophilen und eosinophilen weißen Blutzellen), Mastzellen und dendritischen Zellen des angeborenen Immunsystems. Makrophagen, Granulocyten und dendritische Zellen bilden die drei Arten der Phagocyten im Immunsystem. Die CMP bringt auch noch die Megakaryocyten und roten Blutkörperchen hervor, mit denen wir uns aber hier nicht beschäftigen werden. Die Zellen der myeloischen Zelllinie sind in Abb. 1.8 dargestellt.
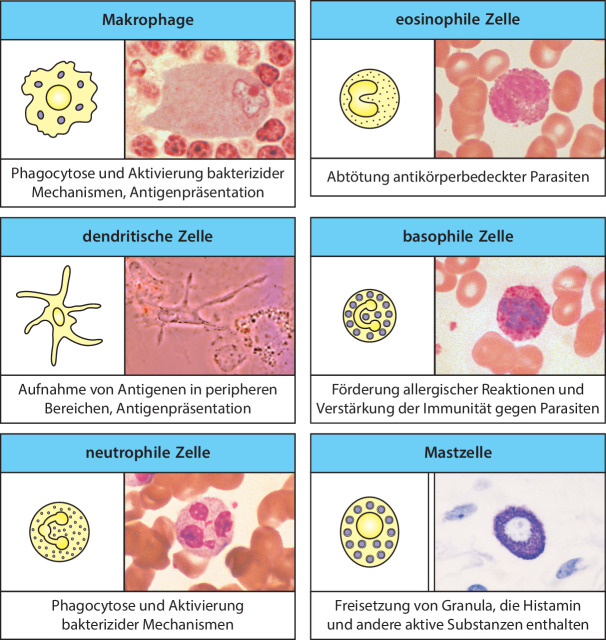
Makrophagen kommen in fast allen Geweben vor. Viele geweberesidente Makrophagen entstehen während der Embryonalentwicklung, aber einige Makrophagen, die sich erst im ausgewachsenen Tier bilden, sind die gereifte Form der Monocyten , die im Blut zirkulieren und ständig in die Gewebe einwandern, wo sie sich ausdifferenzieren. Makrophagen sind relativ langlebige Zellen, sie sind in der gesamten angeborenen und der anschließenden adaptiven Immunantwort für verschiedene Funktionen zuständig. Eine besteht darin, eindringende Mikroorganismen aufzunehmen und zu töten. In dieser Funktion als Phagocyten bilden sie eine wichtige erste Abwehrlinie der angeborenen Immunität, und sie beseitigen auch Krankheitserreger und infizierte Zellen, die von der adaptiven Immunantwort angegriffen werden. Sowohl Monocyten als auch Makrophagen sind Phagocyten, aber die meisten Infektionen treten im Gewebe auf, sodass es vor allem die Makrophagen sind, die diese wichtige Schutzfunktion übernehmen. Eine weitere und entscheidende Funktion der Makrophagen ist die maßgebliche Beteiligung bei Immunantworten: Sie tragen zur Entstehung von Entzündungen bei, die – wie wir feststellen werden – eine Voraussetzung für eine erfolgreiche Immunantwort ist, und sie produzieren viele Entzündungsmediatoren, die Zellen des Immunsystems aktivieren und zu einer Immunantwort rekrutieren.
Lokale Entzündungen und die Phagocytose von eingedrungenen Bakterien können auch durch die Aktivierung des Komplementsystems ausgelöst werden. Die Oberflächen von Bakterien können das Komplementsystem aktivieren, wobei eine Kaskade von proteolytischen Reaktionen in Gang gesetzt wird, die die Mikroorganismen mit Fragmenten von spezifischen Komplementproteinen umhüllen. Auf diese Weise markierte Mikroben werden von spezifischen Komplementrezeptoren auf Makrophagen und neutrophilen Zellen erkannt, über Phagocytose aufgenommen und zerstört. Neben ihrer besonderen Funktion im Immunsystem fungieren Makrophagen im Körper als allgemeine Fresszellen (scavenger cells), indem sie tote Zellen und Zelltrümmer beseitigen.
Die Granulocyten erhielten ihre Bezeichnung aufgrund der deutlich anfärbbaren Granula im Cytoplasma. Wegen ihres unregelmäßig geformten Zellkerns nennt man sie manchmal auch polymorphkernige Leukocyten . Die drei Arten von Granulocyten – neutrophile, eosinophile und basophile Zellen – unterscheidet man aufgrund der verschiedenen Färbungseigenschaften ihrer Granula, die jeweils besondere Funktionen besitzen. Alle Granulocyten sind verhältnismäßig kurzlebig, das heißt, sie existieren nur wenige Tage. Sie reifen im Knochenmark heran und werden während einer Immunantwort in zunehmender Zahl produziert, wenn sie zu Infektions- oder Entzündungsherden wandern. Die phagocytotischen neutrophilen Zellen bilden die umfangreichste und wichtigste zelluläre Komponente der angeborenen Immunantwort: Sie nehmen durch Phagocytose unterschiedliche Mikroorganismen auf und zerstören sie effizient in intrazellulären Vesikeln. Das geschieht mithilfe von abbauenden Enzymen und anderen antimikrobiellen Molekülen, die in cytoplasmatischen Granula gespeichert sind. Bei erblichen Fehlfunktionen der neutrophilen Zellen können bakterielle Infektionen überhand nehmen, die ohne eine Behandlung tödlich enden. Ihre Funktion wird in Kap. 10.1007/978-3-662-56004-4_3 genauer besprochen.
Eosinophile und basophile Zellen sind weniger häufig als neutrophile Zellen, besitzen aber wie diese Granula, die eine Reihe verschiedener Enzyme und toxischer Proteine enthalten, die bei Aktivierung der Zellen freigesetzt werden. Man nimmt an, dass beide Zelltypen vor allem bei der Abwehr von Parasiten, die zu groß sind, um von Makrophagen oder neutrophilen Zellen aufgenommen zu werden, eine Rolle spielen. Sie können aber zu allergischen Entzündungsreaktionen beitragen. Hier wirken sie eher zerstörend als schützend.
Mastzellen beginnen ihre Entwicklung im Knochenmark, aber sie wandern als unreife Vorläuferzellen und reifen in den peripheren Geweben heran, vor allem in der Haut, im Darm und in den Schleimhäuten der Atemwege. Ihre Granula enthalten zahlreiche Entzündungsmediatoren, etwa Histamin und unterschiedliche Proteasen, die dazu beitragen, die inneren Körperoberflächen gegen Krankheitserreger zu schützen, unter anderem gegen parasitische Würmer. Wir beschäftigen uns mit den eosinophilen und basophilen Zellen sowie mit den Mastzellen in Kap. 10.1007/978-3-662-56004-4_10 und 10.1007/978-3-662-56004-4_14.
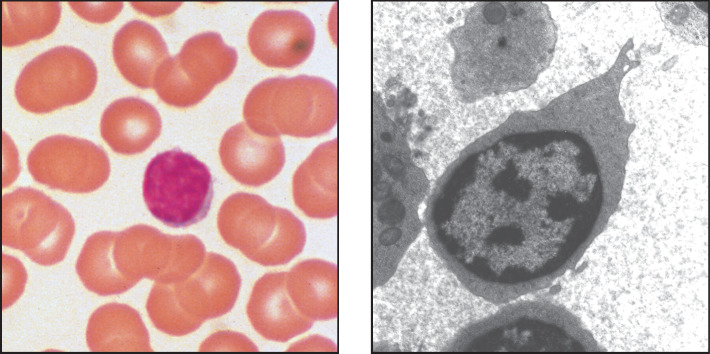
Die dendritischen Zellen wurden in den 1970er-Jahren von Ralph Steinman entdeckt, wofür er im Jahr 2011 den Nobelpreis erhielt. Diese Zellen sind die dritte Klasse von phagocytotischen Zellen des Immunsystems. Zu ihnen gehören mehrere verwandte Zelllinien, deren verschiedene Funktionen noch untersucht werden. Die meisten dendritischen Zellen besitzen komplexe membranöse Fortsätze, ähnlich den Dendriten der Nervenzellen. Unreife dendritische Zellen wandern vom Knochenmark über das Blut in die Gewebe. Sie nehmen sowohl partikuläres Material durch Phagocytose als auch große Mengen an extrazellulärer Flüssigkeit und deren Inhaltsstoffe durch die sogenannte Makropinocytose auf. Sie zerstören die aufgenommenen Krankheitserreger, aber ihre Hauptfunktion im Immunsystem ist nicht die Beseitigung von Mikroorganismen. Stattdessen sind dendritische Zellen eine wichtige Gruppe von Sensorzellen, die beim Zusammentreffen mit Krankheitserregern angeregt werden, Mediatoren zu produzieren, die wiederum andere Immunzellen aktivieren. Die dendritischen Zellen wurden aufgrund ihrer Funktion entdeckt, eine besondere Gruppe von Lymphocyten des adaptiven Immunsystems zu aktivieren – die T-Lymphocyten. Wir werden uns mit diesen Aktivitäten in Abschn. 1.3.8 weiter beschäftigen, wenn wir die Aktivierung der T-Zellen besprechen. Aber die dendritischen Zellen und die Mediatoren, die sie produzieren, spielen auch bei der Kontrolle von Zellreaktionen des angeborenen Immunsystems eine wichtige Rolle.
Sensorzellen exprimieren Mustererkennungsrezeptoren, die an einer ersten Unterscheidung zwischen körpereigen und nicht körpereigen beteiligt sind
Lange bevor die Mechanismen der angeborenen Immunerkennung entschlüsselt wurden, hatte man beobachtet, dass aufgereinigte Antigene wie Proteine bei einem Immunisierungsexperiment keine Immunreaktion hervorriefen – das heißt, die Antigene waren nicht immunogen . Das Auslösen einer starken Immunantwort gegen aufgereinigte Proteine erforderte vielmehr den Zusatz von mikrobiellen Bestandteilen, beispielsweise abgetöteten Bakterien oder Bakterienextrakten. Charles Janeway nannte dies das „schmutzige kleine Geheimnis“ des Immunologen (Anhang I, Abschn. A.1 bis Abschn. A.4). Dieses hinzugefügte Material bezeichnete man als Adjuvans , da es dazu beitrug, die Reaktion auf ein immunisierendes Antigen zu verstärken (Lateinisch adjuvare für „helfen“). Wir wissen heute, dass Adjuvanzien zumindest teilweise notwendig sind, um die Rezeptoren der verschiedenen angeborenen Sensorzellen zu aktivieren, die wiederum zur Aktivierung von T-Zellen beitragen, selbst wenn keine Infektion vorliegt.
Makrophagen, neutrophile und dendritische Zellen sind wichtige Gruppen von Sensorzellen , die Infektionen erkennen und Reaktionen des angeborenen Immunsystems auslösen, indem sie Entzündungsmediatoren produzieren, wobei andere Zellen, sogar Zellen des adaptiven Immunsystems, auch zu dieser Funktion beitragen können. Wie in Abschn. 1.2.3 erwähnt, exprimieren diese Zellen eine begrenzte Anzahl von unveränderlichen Erkennungsrezeptoren des angeborenen Immunsystems, durch die Krankheitserreger oder die von ihnen verursachten Schäden erkannt werden können. Man bezeichnet diese auch als Mustererkennungsrezeptoren (pattern recognition receptors, PRRs), die einfache Moleküle und regelmäßige Muster molekularer Strukturen erkennen, die als pathogenassoziierte molekulare Muster (pathogen-associated molecular patterns, PAMPs ) bekannt und Bestandteile zahlreicher Mikroorganismen, jedoch nicht der körpereigenen Zellen, sind. Zu diesen Strukturen gehören mannosereiche Oligosaccharide, Peptidoglykane und Lipopolysaccharide der bakteriellen Zellwand, außerdem unmethylierte CpG-DNA, die bei vielen Krankheitserregern vorkommt. Alle diese mikrobiellen Bestandteile wurden im Lauf der Evolution konserviert, sodass sie aufgrund ihrer Unveränderlichkeit ausgezeichnete Erkennungssignale darstellen (Abb. 1.9). Einige PRRs sind Transmembranproteine, beispielsweise die Toll-like-Rezeptoren (TLRs ), die PAMPs erkennen, welche aus extrazellulären Bakterien stammen oder von Bakterien, die durch Phagocytose in die vesikulären Reaktionswege aufgenommen wurden. Die Funktion des Toll-Rezeptors für die Immunität wurde zuerst von Jules Hoffmann bei Drosophila melanogaster entdeckt und später von Charles Janeway und Bruce Beutler in Form der homologen TLRs bei Mäusen nachgewiesen. Hoffman und Beutler teilten sich für ihre Arbeiten über die Aktivierung der angeborenen Immunität die andere Hälfte des Nobelpreises im Jahr 2011 (Abschn. 1.2.4). Weitere PRRs sind cytoplasmatische Proteine wie die NOD-like-Rezeptoren (NLRs ), die eine intrazelluläre Invasion von Bakterien erkennen. Noch andere cytoplasmatische Rezeptoren erkennen Virusinfektionen aufgrund der unterschiedlichen Struktur und Lokalisierung der mRNA der Wirtszelle und der viralen RNA, Ähnliches gilt für die verschiedenen DNA-Moleküle. Einige Rezeptoren, die von Sensorzellen exprimiert werden, erkennen zelluläre Schäden, die von Krankheitserregern hervorgerufen werden, und weniger die Krankheitserreger selbst. Ein großer Teil unserer Erkenntnisse über die angeborene Immunerkennung stammt aus den vergangenen 15 Jahren und es wird auf diesem Gebiet noch aktiv geforscht. Wir beschäftigen uns mit dieser angeborenen Immunerkennung auch in Kap. 10.1007/978-3-662-56004-4_3 und in Kap. 10.1007/978-3-662-56004-4_16 besprechen wir, wie Adjuvanzien als Bestandteile von Impfstoffen eingesetzt werden.

Sensorzellen lösen Entzündungsreaktionen aus, indem sie Mediatoren wie Chemokine und Cytokine freisetzen
Die Aktivierung von PRRs auf Sensorzellen , etwa auf Makrophagen und neutrophilen Zellen, können direkt in diesen Zellen Effektorfunktionen auslösen, beispielsweise die Phagocytose und die Zerstörung der aufgenommenen Bakterien. Sensorzellen verstärken aber auch die Immunantwort, indem sie Entzündungsmediatoren produzieren. Zwei bedeutende Gruppen dieser Mediatoren sind sezernierte Proteine, die man als Cytokine und Chemokine bezeichnet. Sie wirken ähnlich wie Hormone, da sie anderen Immunzellen wichtige Signale übermitteln.
Cytokine ist die allgemeine Bezeichnung für alle Proteine, die von Zellen sezerniert werden und das Verhalten von nahe gelegenen Zellen beeinflussen, welche geeignete Rezeptoren besitzen. Es gibt über 60 verschiedene Cytokine; einige werden von vielen verschiedenen Zelltypen produziert, andere nur von wenigen spezifischen. Einige Cytokine beeinflussen viele unterschiedliche Arten von Zellen, andere wiederum nur einige wenige, abhängig vom Expressionsmuster jedes spezifischen Cytokinrezeptors. Die Reaktion, die ein Cytokin in einer Zielzelle auslöst, dient normalerweise dazu, in der Zielzelle einen Effektormechanismus zu verstärken, wie im nächsten Abschnitt veranschaulicht werden soll. Wir wollen hier nicht alle Cytokine auf einmal vorstellen, sondern jedes einzeln einführen, sobald wir bei unserer Beschreibung der zellulären und funktionellen Reaktionen darauf stoßen. Alle Cytokine, die sie erzeugenden Zellen, die Zielzellen sowie ihre allgemeinen Funktionen sind in Anhang III aufgeführt.
Chemokine sind eine spezialisierte Untergruppe von sezernierten Proteinen, die als Chemoattraktoren wirken, indem sie Zellen, die Chemokinrezeptoren tragen, beispielsweise neutrophile Zellen und Monocyten, aus dem Blut zu Infektionsherden locken (Abb. 1.10). Darüber hinaus tragen Chemokine dazu bei, die verschiedenen Zellen in den abgegrenzten Regionen der Lymphgewebe zu organisieren, wo dann die spezifischen Reaktionen stattfinden. Es gibt etwa 50 unterschiedliche Chemokine, die alle in ihrer Struktur verwandt sind, aber zwei große Gruppen bilden. In Anhang IV sind alle Chemokine, ihre Zielzellen und ihre allgemeinen Funktionen aufgeführt. Wir werden die Chemokine immer dann besprechen, wenn die Beschreibung bestimmter zellulärer Immunprozesse dies erfordert.
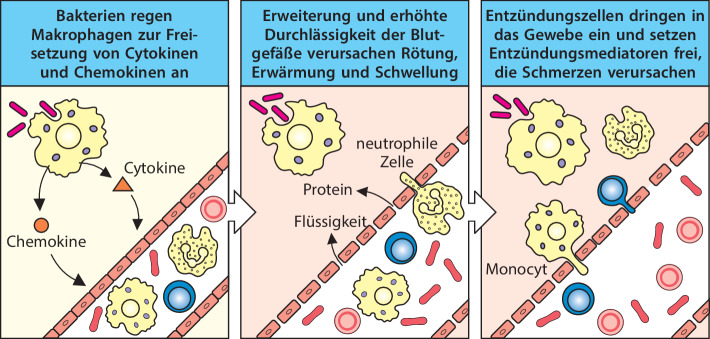
Die Cytokine und Chemokine , die von aktivierten Makrophagen freigesetzt werden, dienen dazu, Zellen aus dem Blut zu infizierten Geweben zu locken. Dies bezeichnet man als Entzündung ; diese trägt dazu bei, Krankheitserreger zu vernichten. Durch eine Entzündung verstärkt sich der Strom der Lymphflüssigkeit. Diese transportiert Mikroorganismen oder Zellen, die deren Antigene tragen, aus den infizierten Geweben in die nahe gelegenen Lymphgewebe, wo die adaptive Immunantwort ausgelöst wird. Sobald die adaptive Immunität aktiviert wurde, lenkt die Entzündung auch diese Effektorkomponenten zum Infektionsherd.
Eine Entzündung wird klinisch durch die vier lateinischen Begriffe calor, dolor, rubor und tumor (Wärme, Schmerz, Rötung und Schwellung) beschrieben. Diese Symptome beruhen sämtlich auf Auswirkungen von Cytokinen und anderen Entzündungsmediatoren auf die lokalen Blutgefäße. Hitze, Rötung und Schwellung entstehen durch die Erweiterung und zunehmende Durchlässigkeit der Blutgefäße während einer Entzündung, sodass sich der lokale Blutfluss verstärkt und Flüssigkeit und Blutproteine in die Gewebe austreten. Cytokine und Komplementfragmente haben bedeutsame Auswirkungen auf das Endothel , das die Blutgefäße auskleidet. Die Endothelzellen erzeugen als Reaktion auf eine Infektion ihrerseits Cytokine . Diese verändern die Adhäsionseigenschaften der Endothelzellen und veranlassen zirkulierende Leukocyten, sich an die Endothelzellen zu heften und zwischen ihnen hindurch zum Infektionsherd zu wandern, indem sie von Chemokinen dorthin gelockt werden. Das Einwandern von Zellen ins Gewebe und ihre Aktivitäten vor Ort verursachen die Schmerzen.
Die vorherrschenden Zelltypen, die man während der ersten Phasen einer Entzündungsreaktion beobachten kann, sind Makrophagen und neutrophile Zellen, wobei Letztere in großer Zahl in das entzündete, infizierte Gewebe gelockt werden. Deshalb bezeichnet man Makrophagen und neutrophile Zellen auch als Entzündungszellen . Kurz nach dem Zustrom der neutrophilen Zellen treten verstärkt Monocyten hinzu, die sich rasch zu Makrophagen differenzieren und so die angeborene Immunantwort verstärken und aufrechterhalten. Im weiteren Verlauf der Entzündung wandern auch eosinophile Zellen in die entzündeten Gewebe ein und tragen zur Zerstörung der eingedrungenen Mikroorganismen bei.
Die Lymphocyten der angeborenen Immunität und die natürlichen Killerzellen sind Effektorzellen, die mit lymphatischen Zelllinien des adaptiven Immunsystems übereinstimmende Merkmale besitzen
Aus der gemeinsamen lymphatischen Vorläuferzelle (common lymphoid progenitor, CLP) im Knochenmark gehen die antigenspezifischen Lymphocyten des adaptiven Immunsystems und mehrere angeborene Zelllinien hervor, die keine antigenspezifischen Rezeptoren besitzen. Die B- und T-Lymphocyten wurden zwar bereits in den 1960er-Jahren entdeckt, die natürlichen Killerzellen (NK-Zellen ) (Abb. 1.11) des angeborenen Immunsystems jedoch erst in den 1970er-Jahren. NK-Zellen sind große, den Lymphocyten ähnliche Zellen, die ein charakteristisches granuläres Cytoplasma besitzen. Sie wurden durch ihre Fähigkeit identifiziert, bestimmte Tumorzellen und mit Herpesviren infizierte Zellen zu erkennen und zu töten. Zuerst war der Unterschied zwischen diesen Zellen und den T-Lymphocyten unklar. Heute wissen wir aber, dass NK-Zellen eine eigene Zelllinie bilden, die im Knochenmark aus der CLP-Zelle hervorgeht. Sie besitzen keine antigenspezifischen Rezeptoren wie die Zellen des adaptiven Immunsystems, sondern exprimieren Rezeptoren der angeborenen Immunität, die zu verschiedenen Molekülfamilien gehören. NK-Zellen reagieren auf zellulären Stress und auf Infektionen durch spezifische Viren. Sie sind von Bedeutung bei der frühen angeborenen Immunantwort auf Virusinfektionen, bevor sich die adaptive Immunreaktion entwickelt hat.

Vor Kurzem hat man weitere Zelllinien identifiziert, die mit den NK-Zellen verwandt sind. Insgesamt bezeichnet man diese Zellen als angeborene lymphatische Zellen (innate lymphoid cells, ILCs). Sie gehen aus der CLP-Zelle hervor und halten sich in den peripheren Geweben auf, beispielsweise im Darm, wo sie Mediatoren für Entzündungsreaktionen freisetzen. Die Funktionen der NK- und der ILC-Zellen werden in Kap. 10.1007/978-3-662-56004-4_3 besprochen.
Zusammenfassung
Vermeidungs‑, Abwehr- und Toleranzmechanismen sind verschiedene Arten, mit Krankheitserregern umzugehen. Anatomische und diverse chemische Barrieren wie das Komplementsystem und antimikrobielle Proteine lassen sich als eine primitive Art der Vermeidung auffassen und bilden die erste Abwehrlinie gegen das Eindringen von kommensalen Organismen und von Krankheitserregern in Körpergewebe. Wenn diese Barrieren durchbrochen werden, verlagert sich der Schwerpunkt der Aktivität des Immunsystems bei Wirbeltieren auf die Abwehr. Entzündungsinduktoren, das heißt entweder für Mikroorganismen charakteristische chemische Strukturen (PAMPs) oder chemische Signale, die Gewebeschäden anzeigen, wirken auf Rezeptoren, die von Sensorzellen exprimiert werden, wodurch das Immunsystem über eine Infektion „informiert“ wird. Sensorzellen sind typische Zellen des angeborenen Immunsystems, wie Makrophagen oder dendritische Zellen. Sie können entweder direkt durch Effektoraktivitäten oder durch Freisetzung von Entzündungsmediatoren wirken. Diese sind meistens Cytokine und Chemokine, die andere Immunzellen beeinflussen, beispielsweise die angeborenen NK- und ILC-Zellen. Diese Zellen werden dann in Zielgewebe gelenkt, wo sie bestimmte Arten von Effektoraktivitäten der Immunantwort ausführen, etwa das Abtöten von Zellen oder die Produktion von Cytokinen, die eine direkte antivirale Aktivität besitzen. Das alles zielt darauf ab, die Infektion durch die Krankheitserreger abzuschwächen oder zu beseitigen. Durch Mediatoren ausgelöste Reaktionen in den Zielgeweben können verschiedene Arten von Entzündungszellen aktivieren, die jeweils auf die Vernichtung von Viren, intrazellulären Bakterien, extrazellulären Krankheitserregern oder Parasiten spezialisiert sind.
Grundlagen der adaptiven Immunität
Wir kommen nun zu den Bestandteilen der adaptiven Immunität , den antigenspezifischen Lymphocyten. Sofern nicht anders angegeben, verwenden wir ab hier den Begriff Lymphocyten ausschließlich für die antigenspezifischen Lymphocyten. Lymphocyten sind in der Lage, auf eine riesige Zahl von Antigenen der verschiedenen Krankheitserreger zu reagieren, mit denen ein Mensch im Laufe seines Lebens in Kontakt kommen kann, und eine wichtige Eigenschaft ist, dass sie ein immunologisches Gedächtnis entwickeln. Die Lymphocyten ermöglichen das gemeinsam mithilfe der hoch variablen Antigenrezeptoren an ihrer Oberfläche, durch die sie Antigene erkennen und binden können. Jeder Lymphocyt reift heran und trägt dabei eine spezifische Variante eines Antigenrezeptorprototyps, sodass die Population von Lymphocyten ein riesiges Repertoire von Rezeptoren exprimiert. Unter den etwa eine Milliarde Lymphocyten, die im Körper zu einem beliebigen Zeitpunkt zirkulieren, werden sich immer einige befinden, die ein bestimmtes fremdes Antigen erkennen können.
Eine besondere Eigenschaft des adaptiven Immunsystems besteht darin, dass es ein immunologisches Gedächtnis hervorbringen kann. Das heißt, sobald ein Mensch mit einem Krankheitserreger in Kontakt gekommen ist, wird die Reaktion auf dieses Pathogen schneller und stärker ausfallen, wenn es erneut auftritt. Dieser Mensch besitzt dann eine schützende Immunität gegen dieses Pathogen. Herauszufinden, wie sich eine lang andauernde Immunität gegen solche Krankheitserreger erzeugen lässt, die das nicht auf natürliche Weise tun, ist heute eine der größten Aufgaben der Immunologie.
Die Wechselwirkung von Antigenen mit ihren Antigenrezeptoren veranlasst die Lymphocyten, Effektor- und Gedächtnisfunktionen auszuführen
Im Immunsystem der Wirbeltiere gibt es zwei Gruppen von Lymphocyten – B-Lymphocyten (B-Zellen ) und T-Lymphocyten (T-Zellen ), Diese exprimieren unterschiedliche Arten von Antigenrezeptoren und besitzen sehr unterschiedliche Funktionen im Immunsystem, wie man in den 1960er-Jahren herausgefunden hat. Die meisten Lymphocyten, die im Körper zirkulieren, wirken als unscheinbare kleine Zellen mit wenigen Organellen im Cytoplasma und einem kondensierten, offensichtlich wenig aktiven Chromatin im Zellkern (Abb. 1.12). Lymphocyten zeigen nur eine geringe funktionelle Aktivität, bis sie auf ein spezifisches Antigen treffen, das mit dem Antigenrezeptor an ihrer Oberfläche in Wechselwirkung tritt. Lymphocyten, die noch nicht von einem Antigen aktiviert wurden, bezeichnet man als naive (ungeprägte) Lymphocyten . Diejenigen, die mit ihrem Antigen in Kontakt gekommen sind, werden aktiviert und differenzieren sich weiter zu voll funktionsfähigen Lymphocyten, die man als Effektorlymphocyten bezeichnet.
B-Zellen und T-Zellen unterscheiden sich durch die Strukturen ihrer Antigenrezeptoren, die sie exprimieren. Der B-Zell-Antigenrezeptor oder B-Zell-Rezeptor (B-cell receptor, BCR) wird von denselben Genen produziert, die die Antikörper, eine Gruppe von Proteinen, die man auch als Immunglobuline (Ig) bezeichnet, codieren (Abb. 1.13). Den Antigenrezeptor von B-Lymphocyten bezeichnet man daher auch als Membranimmunglobulin (mIg) oder Oberflächenimmunglobulin (surface immunglobulin, sIg). Der T-Zell-Antigenrezeptor oder T-Zell-Rezeptor (T-cell receptor, TCR) ist mit den Immunglobulinen verwandt, unterscheidet sich aber in der Struktur und den Bindungseigenschaften.
Nachdem ein Antigen an den B-Zell-Antigenrezeptor oder B-Zell-Rezeptor (BCR) gebunden hat, bildet der Lymphocyt durch Proliferation und Differenzierung Plasmazellen . Das ist die Effektorform von B-Lymphocyten, die Antikörper produziert. Diese sind die sezernierte Form des B-Zell-Rezeptors und besitzen dieselbe Antigenspezifität wie der B-Zell-Rezeptor der Plasmazelle. Das Antigen, das eine bestimmte B-Zelle aktiviert, wird also zum Ziel für die Antikörper, die von den Nachkommen dieser Zelle produziert werden.
Wenn eine T-Zelle zum ersten Mal mit einem Antigen in Kontakt tritt, das an ihren Rezeptor binden kann, bildet sie durch Proliferation und Differenzierung einen von mehreren Typen der T-Effektorlymphocyten. Wenn T-Effektorzellen in der Folge auf das Antigen treffen, können sie drei generelle Arten von Aktivitäten entwickeln. Cytotoxische T-Zellen töten andere Zellen, die mit Viren oder anderen intrazellulären Krankheitserregern infiziert sind und die das Antigen tragen. T-Helferzellen liefern Signale, häufig in Form von spezifischen Cytokinen, welche die Funktionen anderer Zellen aktivieren, etwa die Antikörperproduktion durch B-Zellen und das Abtöten von Krankheitserregern durch Makrophagen, die diese Pathogene aufgenommen haben. Regulatorische T-Zellen unterdrücken die Aktivität von anderen Lymphocyten und unterstützen die Kontrolle der Immunantworten; sie werden in Kap. 10.1007/978-3-662-56004-4_9, 10.1007/978-3-662-56004-4_11, 10.1007/978-3-662-56004-4_12 und 10.1007/978-3-662-56004-4_15 besprochen.
Einige der durch das Antigen aktivierten B- und T-Zellen differenzieren sich zu Gedächtniszellen . Diese Lymphocyten sind für die lang anhaltende Immunität verantwortlich, die nach dem Kontakt mit einer Krankheit oder nach einer Impfung folgt. Gedächtniszellen differenzieren sich bei einem zweiten Kontakt mit ihrem spezifischen Antigen leicht zu Effektorzellen. Das immunologische Gedächtnis wird in Kap. 10.1007/978-3-662-56004-4_11 beschrieben.
Antikörper und T-Zell-Rezeptoren bestehen aus konstanten und variablen Regionen, die jeweils für bestimmte Funktionen zuständig sind
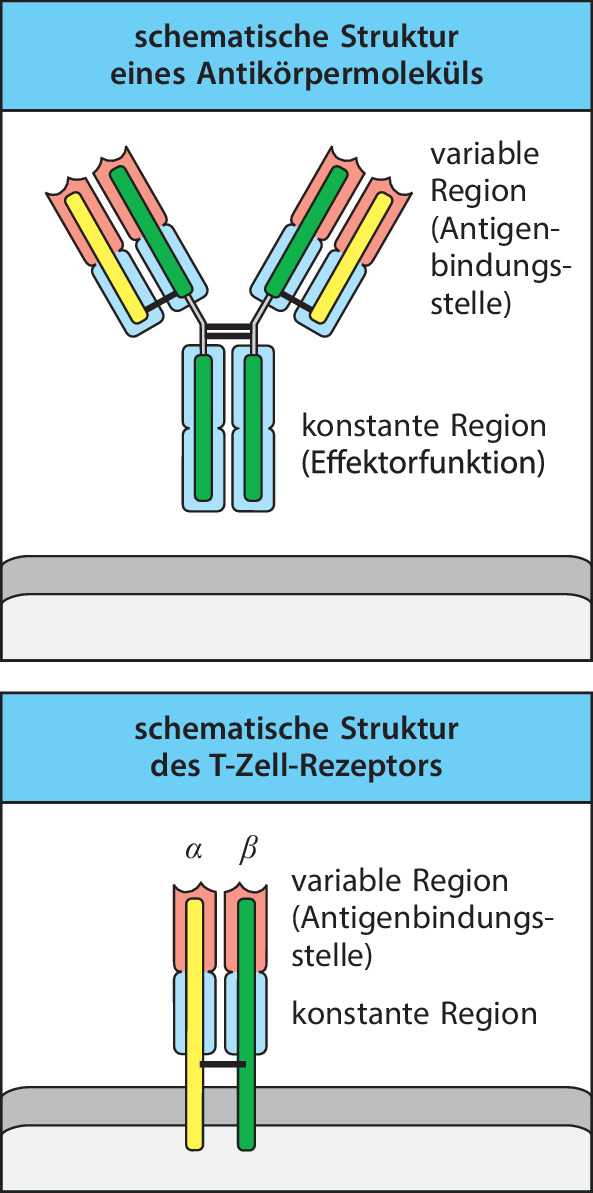
Antikörper hat man mithilfe herkömmlicher biochemischer Methoden analysiert, lange Zeit bevor es durch die DNA-Rekombinationstechnik möglich wurde, die membrangebundenen Formen der Antigenrezeptoren der B- und T-Zellen zu untersuchen. Dabei stellte sich heraus, dass Antikörpermoleküle aus zwei unterschiedlichen Regionen bestehen. Die eine ist die konstante Region , die man auch als Fc-Fragment (Fc für fragment crystallizable) bezeichnet und die nur in vier oder fünf biochemisch unterschiedlichen Formen vorkommt (Abb. 1.13). Im Gegensatz dazu kann die variable Region aus einer riesigen Zahl verschiedener Aminosäuresequenzen bestehen, durch die Antikörper eine fast ebenso große Zahl verschiedener Antigene erkennen können. Aufgrund der Einheitlichkeit der Fc-Region im Vergleich zur variablen Region konnten Gerald Edelman und Rodney Porter schon in früher Zeit eine Röntgenstrukturanalyse durchführen. Sie wurden im Jahr 1972 mit dem Nobelpreis für ihre Arbeiten über die Struktur von Antikörpern ausgezeichnet.
Das Antikörpermolekül besteht aus zwei identischen schweren Ketten und zwei identischen leichten Ketten . Schwere und leichte Ketten enthalten variable und konstante Regionen. Die variablen Regionen einer schweren und einer leichten Kette bilden zusammen die Antigenbindungsstelle, welche die Antigenspezifität des Antikörpers bestimmt. So tragen sowohl die schwere als auch die leichte Kette zur Antigenspezifität des Antikörpermoleküls bei. Auch besitzt jeder Antikörper zwei identische variable Regionen und damit zwei identische Antigenbindungsstellen. Die konstante Region bestimmt die Effektorfunktion des Antikörpers, das heißt, wie der Antikörper mit den verschiedenen Immunzellen in Wechselwirkung tritt und dabei mit dem Antigen agiert, sobald es einmal gebunden ist.
Der T-Zell-Rezeptor ähnelt in vielfacher Hinsicht dem B-Zell-Rezeptor und dem Antikörper (Abb. 1.13). Er besteht aus zwei Ketten, der TCRα- und der TCRβ-Kette . Diese besitzen etwa die gleiche Größe und durchspannen die Membran der T-Zelle. Wie der Antikörper besitzt auch die T-Zell-Rezeptor-Kette eine variable und eine konstante Region, und durch die Kombination der variablen α- und β-Kette entsteht eine einzelne Antigenbindungsstelle. Die Strukturen der Antikörper und T-Zell-Rezeptoren werden in Kap. 10.1007/978-3-662-56004-4_4 genauer besprochen, die Funktionseigenschaften der konstanten Regionen der Antikörper in Kap. 10.1007/978-3-662-56004-4_5 und 10.1007/978-3-662-56004-4_10.
Antikörper und T-Zell-Rezeptoren erkennen Antigene auf grundlegend unterschiedliche Weise
Im Prinzip kann das adaptive Immunsystem jede chemische Struktur als Antigen erkennen, aber die Antigene, die üblicherweise bei einer Infektion auftreten, sind Proteine, Glykoproteine und Polysaccharide der Krankheitserreger. Ein einzelner Antigenrezeptor oder Antikörper erkennt einen kleinen Teil der molekularen Struktur eines Antigenmoleküls, den man als Antigendeterminante oder Epitop bezeichnet (Abb. 1.14). Proteine und Glykoproteine enthalten normalerweise viele verschiedene Epitope, die von unterschiedlichen Antigenrezeptoren erkannt werden können.

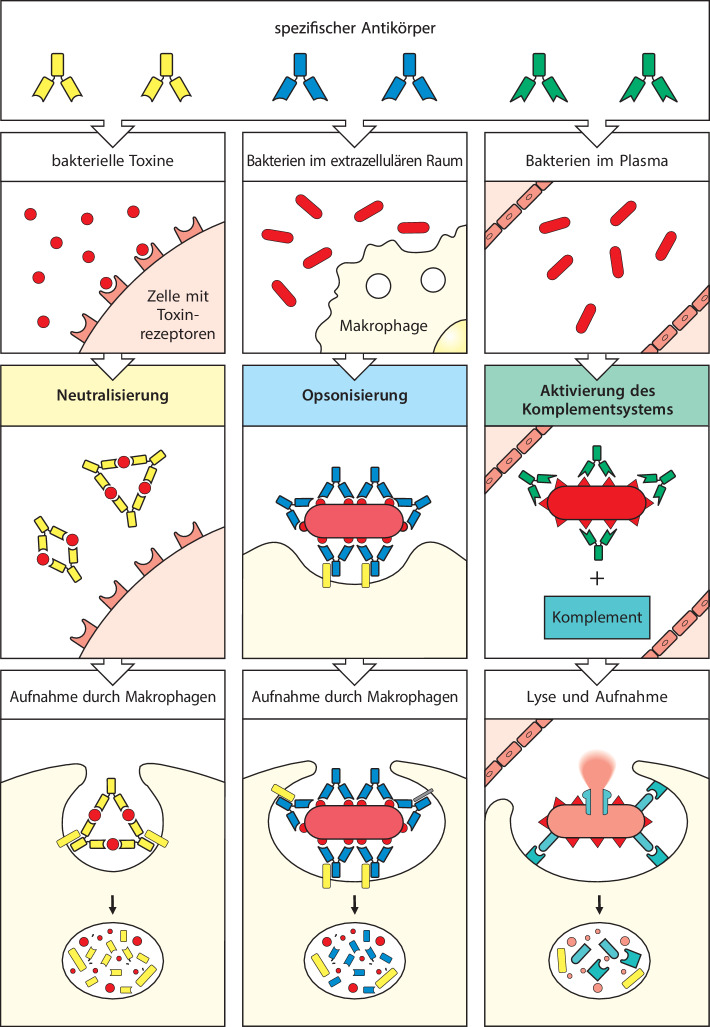
Antikörper und B-Zell-Rezeptoren erkennen Epitope von nativen Antigenen im Serum oder im extrazellulären Raum. Es ist möglich, dass verschiedene Antikörper ein Antigen gleichzeitig an seinen unterschiedlichen Epitopen erkennen; die Beseitigung oder Neutralisierung des Antigens ist dadurch effektiver.
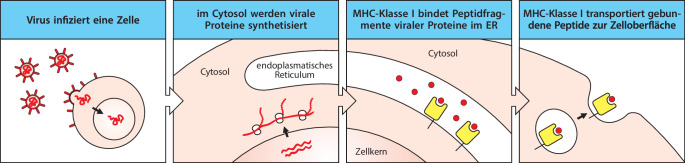
Während Antikörper fast jede Art von chemischen Strukturen erkennen können, binden T-Zell-Rezeptoren normalerweise nur Proteinantigene und unterscheiden sich dadurch deutlich von Antikörpern. Der T-Zell-Rezeptor erkennt ein Peptidepitop, das aus einem teilweise abgebauten Protein stammt, jedoch nur dann, wenn das Peptid an spezielle Glykoproteine der Zelloberfläche gebunden ist, die MHC-Moleküle (Abb. 1.15). Die Mitglieder dieser großen Glykoproteinfamilie werden von einer Gruppe von Genen codiert, die man als Haupthistokompatibilitätskomplex (major histocompatibility complex, MHC) bezeichnet. Die von T-Zellen erkannten Antigene können von Proteinen aus intrazellulären Krankheitserregern, beispielsweise Viren, oder von extrazellulären Krankheitserregern stammen. Ein weiterer Unterschied zum Antikörpermolekül besteht darin, dass es von den T-Zell-Rezeptoren keine sezernierte Form gibt. Die Funktion des T-Zell-Rezeptors ist nur, der T-Zelle zu signalisieren, dass er ein Antigen gebunden hat. Die anschließenden immunologischen Effekte beruhen auf den Aktivitäten der T-Zellen selbst. Wir werden uns in Kap. 10.1007/978-3-662-56004-4_6 noch genauer damit befassen, wie Epitope von Antigenen an MHC-Proteine gebunden werden, und in Kap. 10.1007/978-3-662-56004-4_9 geht es darum, wie T-Zellen ihre weiteren Funktionen ausführen.
Die Gene der Antigenrezeptoren werden durch somatische Genumlagerungen von unvollständigen Gensegmenten neu zusammengesetzt
Das angeborene Immunsystem erkennt Signale einer Entzündung mithilfe einer relativ begrenzten Anzahl von Sensoren, beispielsweise TLR- oder NOD-Proteinen; insgesamt sind es weniger als 100 verschiedene Arten. Antigenspezifische Rezeptoren des adaptiven Immunsystems umfassen eine fast unbegrenzte Zahl von Spezifitäten, die aber von einer begrenzten Anzahl von Genen codiert werden. Die Grundlage für diese außerordentliche Vielzahl an Spezifitäten wurde im Jahr 1976 von Susumu Tonegawa entdeckt, wofür er 1987 den Nobelpreis erhielt. Die variablen Regionen der Immunglobuline werden als Gruppen von Gensegmenten vererbt, von denen jedes einen Teil der variablen Region in einer der Immunglobulinketten codiert. Während der Entwicklung der B-Zellen im Knochenmark werden diese Gensegmente durch einen Vorgang, den man als DNA-Rekombination bezeichnet, irreversibel miteinander verknüpft. Dadurch entsteht ein DNA-Abschnitt, der eine vollständige variable Region codiert. Bei den Genen für die T-Zell-Rezeptoren gibt es einen ähnlichen Mechanismus während der Entwicklung der T-Zellen im Thymus.
Nur einige wenige Hundert unterschiedliche Gensegmente können auf verschiedene Weise miteinander verknüpft werden, aber es entstehen dadurch Tausende von unterschiedlichen Rezeptorketten. Durch diese kombinatorische Vielfalt ist es möglich, dass eine geringe Menge an genetischem Material eine wirklich beeindruckende Vielfalt von Rezeptoren codieren kann. Während des Rekombinationsvorgangs werden an den Verknüpfungsstellen der Gensegmente in einem Zufallsprozess Nucleotide hinzugefügt oder entfernt; so entsteht zusätzlich noch eine junktionale Diversität . Die Vielfältigkeit wird noch dadurch verstärkt, dass jeder Antigenrezeptor zwei verschiedene variable Ketten enthält, die jeweils von einer anderen Gruppe von Gensegmenten codiert werden. Wir befassen uns mit diesem Vorgang der Genumlagerung, aus dem die vollständigen Antigenrezeptoren hervorgehen, in Kap. 10.1007/978-3-662-56004-4_5.
Lymphocyten werden durch Antigene aktiviert, wobei Klone antigenspezifischer Zellen entstehen, die für die adaptive Immunität verantwortlich sind
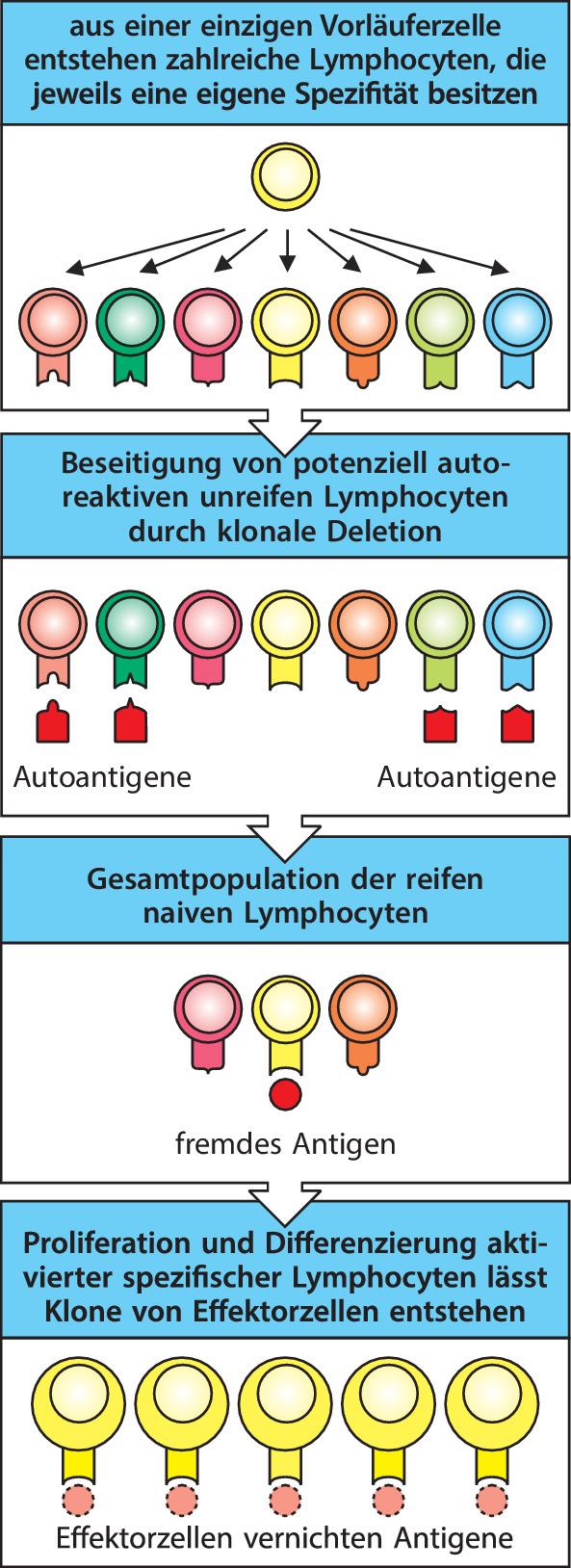
Die Entwicklung der Lymphocyten ist durch zwei Eigenschaften gekennzeichnet, durch die sich die adaptive Immunität von der angeborenen unterscheidet. Zum einen erfolgt der oben beschriebene Prozess, der die Antigenrezeptoren aus unvollständigen Gensegmenten zusammensetzt, in einer Weise, die sicherstellt, dass jeder sich entwickelnde Lymphocyt nur eine einzige Rezeptorspezifität exprimiert. Während die Zellen des angeborenen Immunsystems viele verschiedene Mustererkennungsrezeptoren exprimieren und Merkmale erkennen, die viele Krankheitserreger gemeinsam haben, erfolgt die Expression der Antigenrezeptoren bei den Lymphocyten „klonal“. Dadurch unterscheidet sich jeder gereifte Lymphocyt aufgrund der Spezifität seines Antigenrezeptors von den übrigen Lymphocyten. Da zum anderen der Vorgang der Genumlagerung die DNA irreversibel verändert, erben alle Nachkommen des Lymphocyten dieselbe Rezeptorspezifität. Daher entsteht aufgrund der Proliferation eines einzelnen Lymphocyten ein Klon mit identischen Antigenrezeptoren.
Ein einziger Mensch verfügt zu jedem beliebigen Zeitpunkt über mindestens 108 unterschiedliche Spezifitäten, die zusammen das Repertoire der Lymphocytenrezeptoren bilden. Diese Lymphocyten durchlaufen ständig einen Prozess, der der natürlichen Selektion ähnlich ist: Nur diejenigen Lymphocyten, die mit einem Antigen in Kontakt kommen, das an ihren Rezeptor bindet, werden aktiviert, wodurch sie proliferieren und sich zu Effektorzellen differenzieren. Diesen Selektionsmechanismus formulierte erstmals Frank Macfarlane Burnet in den 1950er-Jahren und er postulierte das Vorhandensein vieler verschiedener Zellen, die potenziell dazu in der Lage sind, Antikörper zu produzieren. Jede dieser Zellen kann Antikörper einer anderen Spezifität hervorbringen, die auf der Zelloberfläche in membrangebundener Form vorliegen. Der Antikörper dient dabei als Rezeptor für ein Antigen. Durch die Bindung eines Antigens wird die Zelle zur Teilung angeregt und sie erzeugt auf diese Weise viele identische Nachkommen, ein Vorgang, den man als klonale Expansion bezeichnet. Dieser Klon aus identischen Zellen kann nun klonotypische Antikörper mit derselben Spezifität wie der Oberflächenrezeptor freisetzen, der zu Beginn die Aktivierung und klonale Expansion ausgelöst hat (Abb. 1.16). Burnet nannte dies die Theorie der klonalen Selektion der Produktion von Antikörpern. Seine vier grundlegenden Hypothesen sind in Abb. 1.17 aufgeführt.
Lymphocyten mit autoreaktiven Rezeptoren werden normalerweise während der Entwicklung beseitigt oder in ihrer Funktion inaktiviert
Als Burnet seine Theorie formulierte, waren weder Antigenrezeptoren noch die Funktionsweise der Lymphocyten selbst bekannt. In den frühen 1960er-Jahren entdeckte James Gowans , dass es durch Entfernen der kleinen Lymphocyten aus Ratten zu einem Verlust aller bekannten adaptiven Immunreaktionen kam. Ersetzte man die kleinen Lymphocyten wieder, wurden auch die Immunreaktionen wiederhergestellt. Das führte zu der Erkenntnis, dass es sich bei den Lymphocyten um die Grundeinheiten der klonalen Selektion handelt. Die Biologie dieser Zellen wurde zum Schwerpunkt des neuen Forschungsgebiets der zellulären Immunologie .
Die klonale Selektion von Lymphocyten mit verschiedenen Rezeptoren lieferte zwar eine elegante Erklärung für die adaptive Immunität, verursachte jedoch ein bedeutendes gedankliches Problem: Wenn die Antigenrezeptoren der Lymphocyten während der Lebensdauer eines Organismus nach einem Zufallsprinzip entstehen, besteht die Möglichkeit, dass einige Rezeptoren auf körpereigene Antigene (Autoantigene ) reagieren. Wie lässt sich dann verhindern, dass die Lymphocyten Antigene der körpereigenen Gewebe erkennen und angreifen? Ray Owen hatte bereits in den späten 1940er-Jahren gezeigt, dass genetisch unterschiedliche Zwillingskälber mit einer gemeinsamen Plazenta und damit mit einem gemeinsamen Blutkreislauf gegen das Gewebe des jeweils anderen Tieres tolerant waren. Peter Medawar zeigte dann 1953, dass Mäuse, die man während ihrer Embryonalentwicklung mit fremden Geweben in Kontakt brachte, gegenüber diesen Geweben immunologisch tolerant wurden. Burnet postulierte, dass sich entwickelnde Lymphocyten, die potenziell autoreaktiv sind, vor der Reifung vernichtet werden; diesen Vorgang kennt man heute unter der Bezeichnung klonale Deletion . Medawar und Burnet teilten sich 1960 den Nobelpreis für ihre Arbeiten zur immunologischen Toleranz. In den späten 1980er-Jahren ließ sich dieser Vorgang auch im Experiment nachweisen. Einige Lymphocyten, die während ihrer Entwicklung über ihre Antigenrezeptoren entweder zu starke oder zu schwache Signale empfangen, werden durch einen Mechanismus der Selbsttötung eliminiert. Diesen Vorgang bezeichnet man als Apoptose (nach dem griechischen Wort für den Blätterfall von Bäumen) oder als programmierten Zelltod. Man hat seit damals weitere Mechanismen der immunologischen Toleranz entdeckt, die darauf beruhen, dass ein inaktiver Zustand erzeugt wird, die sogenannte Anergie . Auch kennt man inzwischen Mechanismen, die eine aktive Suppression von autoreaktiven Lymphocyten bewirken. Kap. 10.1007/978-3-662-56004-4_8 behandelt die Lymphocytenentwicklung und die Toleranzmechanismen, die das Rezeptorrepertoire der Lymphocyten bestimmen. In Kap. 10.1007/978-3-662-56004-4_14 und 10.1007/978-3-662-56004-4_15 besprechen wir dann, wie die angeborenen Mechanismen der Immuntoleranz auch versagen können.
Lymphocyten reifen im Knochenmark oder im Thymus und sammeln sich dann überall im Körper in den Lymphgeweben
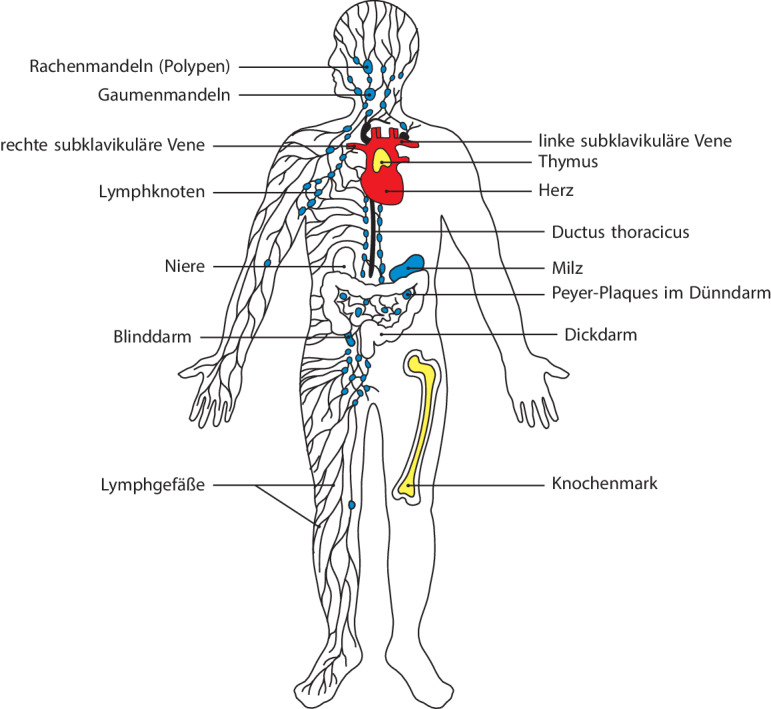
Lymphocyten zirkulieren im Blut und in der Lymphflüssigkeit, und sie kommen in großer Zahl in den lymphatischen Geweben oder lymphatischen Organen vor. Dies sind strukturierte Ansammlungen von Lymphocyten in einem Netzwerk von nichtlymphatischen Zellen. Die lymphatischen Organe lassen sich grob unterteilen in die zentralen oder primären lymphatischen Organe , wo die Lymphocyten entstehen, und die peripheren oder sekundären lymphatischen Organe , in denen reife naive Lymphocyten stabilisiert und adaptive Immunantworten ausgelöst werden. Die zentralen lymphatischen Organe sind das Knochenmark und der Thymus (ein großes Organ im oberen Brustbereich). Die peripheren lymphatischen Organe umfassen die Lymphknoten , die Milz und die mucosalen lymphatischen Gewebe des Darms, der Nasen- und Atemwege, des Urogenitaltrakts und von anderen Schleimhäuten. Die Lage der wichtigsten Lymphgewebe ist in Abb. 1.18 schematisch dargestellt; die einzelnen lymphatischen Organe werden weiter unten in diesem Kapitel genauer beschrieben. Lymphknoten sind untereinander durch ein System von Lymphgefäßen verbunden, die über die Lymphknoten extrazelluläre Flüssigkeit aus den Geweben ableiten und in das Blut zurückführen.
Die Vorläuferzellen, aus denen die B- und T-Lymphocyten hervorgehen, stammen aus dem Knochenmark. B-Lymphocyten reifen dort auch heran. Das „B“ der B-Lymphocyten stand ursprünglich für Bursa Fabricii , ein lymphatisches Organ bei jungen Küken, in dem die Lymphocyten reifen; es kann aber auch für den englischen Begriff bone marrow (Knochenmark ) stehen. Die unreifen Vorläufer der T-Lymphocyten wandern in den Thymus, nach dem sie auch bezeichnet werden, und reifen dort. Nach ihrer vollständigen Reifung gelangen beide Arten von Lymphocyten als reife naive Lymphocyten in das Blut. Sie zirkulieren durch die peripheren lymphatischen Gewebe.
Adaptive Immunreaktionen werden in den sekundären lymphatischen Geweben durch Antigene und antigenpräsentierende Zellen ausgelöst
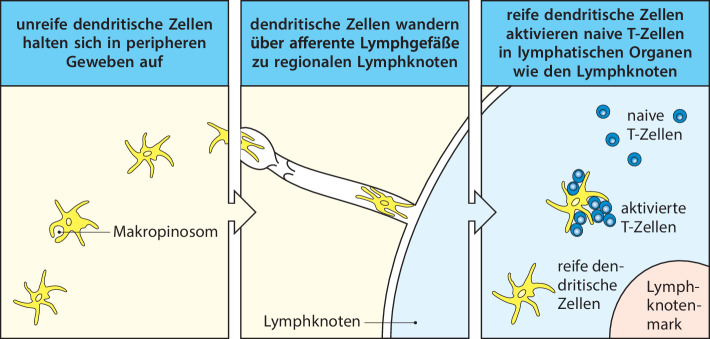
Adaptive Immunantworten werden ausgelöst, wenn B- oder T-Lymphocyten mit Antigenen in Kontakt kommen, auf die ihre Rezeptoren spezifisch reagieren, unter der Voraussetzung, dass passende Entzündungssignale vorhanden sind, die die Aktivierung unterstützen. Bei den T-Zellen erfolgt die Aktivierung über Kontakte mit dendritischen Zellen, die an Infektionsherden Antigene aufgenommen haben und zu den sekundären lymphatischen Geweben gewandert sind. Die Aktivierung der PRR-Rezeptoren durch PAMPs am Infektionsherd stimuliert die dendritischen Zellen in den Geweben, den Krankheitserreger aufzunehmen und in der Zelle abzubauen. Diese Zellen nehmen auch durch rezeptorunabhängige Makropinocytose extrazelluläres Material auf, beispielsweise Viruspartikel und Bakterien. Diese Vorgänge führen dazu, dass die dendritischen Zellen Peptidantigene auf MHC-Molekülen präsentieren. Dadurch werden die Antigenrezeptoren von Lymphocyten aktiviert. Die Aktivierung von PRRs veranlasst dendritische Zellen auch dazu, auf der Zelloberfläche bestimmte Proteine, sogenannte costimulierende Moleküle , zu exprimieren. Diese unterstützen die T-Lymphocyten bei der Proliferation und Differenzierung zu ihrer endgültigen und vollständig funktionsfähigen Form (Abb. 1.19). Deshalb bezeichnet man die dendritischen Zellen auch als antigenpräsentierende Zellen (APCs) . Damit bilden sie eine entscheidende Schnittstelle zwischen der angeborenen Immunantwort und dem adaptiven Immunsystem (Abb. 1.20). In bestimmten Situationen können Makrophagen und B-Zellen auch als antigenpräsentierende Zellen fungieren, aber die dendritischen Zellen sind darauf spezialisiert, die adaptive Immunantwort auszulösen. Freie Antigene können ebenfalls die Antigenrezeptoren der B-Zellen stimulieren, aber die meisten B-Zellen benötigen noch die „Hilfe“ von aktivierten T-Helferzellen, um eine optimale Antikörperreaktion zu bewerkstelligen. Die Aktivierung von naiven T-Lymphocyten ist deshalb bei praktisch allen adaptiven Immunreaktionen die erste essenzielle Phase. Kap. 10.1007/978-3-662-56004-4_6 widmet sich erneut den dendritischen Zellen; dort geht es darum, wie Antigene prozessiert werden, damit T-Zellen sie präsentieren können. Kap. 10.1007/978-3-662-56004-4_7 und 10.1007/978-3-662-56004-4_9 befassen sich mit der Costimulation und Lymphocytenaktivierung und in Kap. 10.1007/978-3-662-56004-4_10 besprechen wir, wie T-Zellen die B-Zellen bei der Aktivierung unterstützen.
![]() Video 1.1
Video 1.1
Lymphocyten treffen in den peripheren lymphatischen Organen auf Antigene und reagieren darauf
Antigene und Lymphocyten kommen schließlich in den peripheren lymphatischen Organen – den Lymphknoten, der Milz und den lymphatischen Geweben der Schleimhäute (Abb. 1.18) – miteinander in Kontakt. Reife naive Lymphocyten zirkulieren kontinuierlich durch diese Gewebe, in die auch Antigene der Krankheitserreger vor allem durch dendritische Zellen aus Infektionsherden transportiert werden. Die peripheren lymphatischen Gewebe sind darauf spezialisiert, antigentragende dendritische Zellen festzuhalten und das Auslösen von adaptiven Immunantworten zu ermöglichen. Die peripheren lymphatischen Organe bestehen aus Ansammlungen von Lymphocyten in einem Netzwerk von Stromazellen, die keine Leukocyten sind. Diese bilden die grundlegende Organisationsstruktur des Gewebes und geben Überlebenssignale ab, um das Überleben der Lymphocyten zu sichern. Neben den Lymphocyten enthalten die peripheren lymphatischen Organe auch dauerhaft dort befindliche Makrophagen und dendritische Zellen.
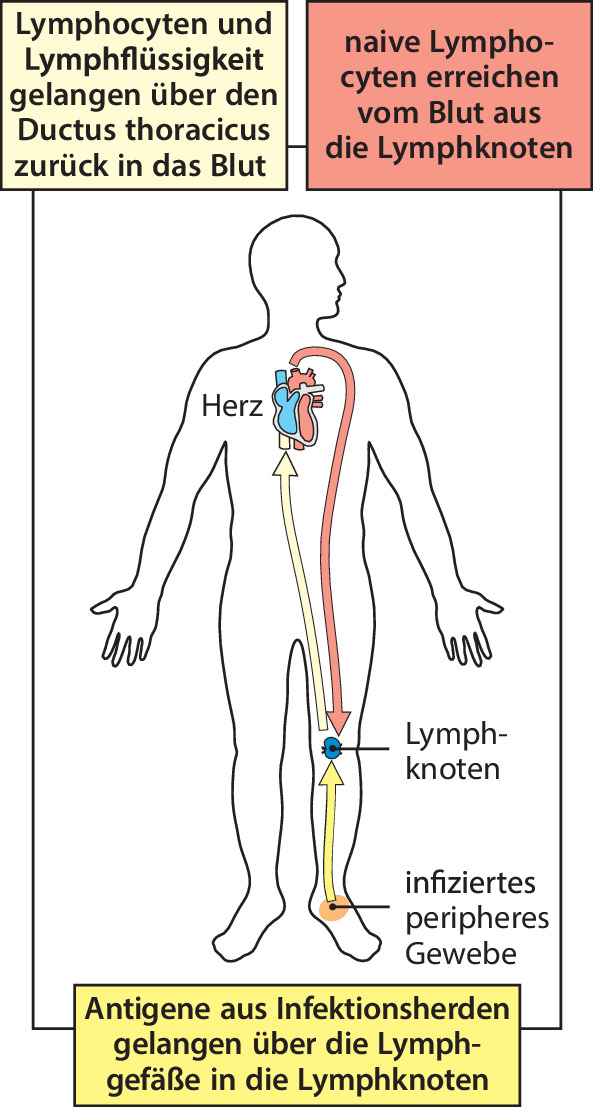
Wenn es in einem Gewebe, beispielsweise in der Haut, zu einer Infektion kommt, wandern freie Antigene und antigentragende dendritische Zellen vom Infektionsherd durch afferente Lymphgefäße in die ableitenden Lymphknoten (Abb. 1.21), die peripheren lymphatischen Gewebe, wo sie antigenspezifische Lymphocyten aktivieren. Die aktivierten Lymphocyten durchlaufen eine Phase der Proliferation und Differenzierung. Danach verlassen die meisten dieser Zellen als Effektorzellen die Lymphknoten über das efferente Lymphgefäß. Dieses bringt sie schließlich in den Blutkreislauf zurück (Abb. 1.18), durch den sie dann in die Gewebe gelangen, in denen sie aktiv werden. Der gesamte Vorgang dauert ab Erkennen des Antigens vier bis sechs Tage. Das bedeutet, dass eine adaptive Immunantwort auf ein Antigen, mit dem der Körper noch nie in Kontakt gekommen ist, nicht vor einer Woche nach Beginn der Infektion wirksam wird (Abb. 1.7). Naive Lymphocyten, die ihr Antigen nicht erkennen, verlassen den Lymphknoten ebenfalls durch das efferente Lymphgefäß und werden in das Blut zurückgeführt. Von dort aus zirkulieren sie wieder durch die Lymphgewebe, bis sie ein Antigen erkennen oder absterben.
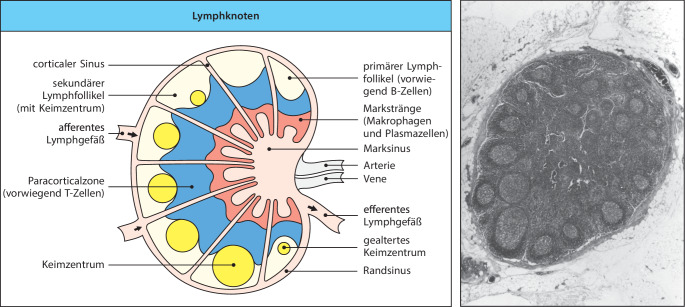
Die Lymphknoten sind hoch organisierte lymphatische Organe und befinden sich dort, wo die Gefäße des Lymphsystems zusammenlaufen. Dies ist ein ausgedehntes Gefäßsystem, das die extrazelluläre Flüssigkeit aus den Geweben sammelt und in das Blut zurückführt (Abb. 1.18). Die extrazelluläre Flüssigkeit entsteht durch fortwährende Filtration aus dem Blut – man bezeichnet sie als Lymphe . Die Lymphe fließt aufgrund des Drucks der ständigen Neuproduktion aus den peripheren Geweben ab und wird in den Lymphgefäßen transportiert. Ventilklappen in den Lymphgefäßen verhindern einen Rückfluss und die Bewegungen von einem Teil des Körpers im Verhältnis zu einem anderen tragen in bedeutender Weise zur Bewegung der Lymphe bei.
Wie oben bereits erwähnt, leiten die afferenten Lymphgefäße Flüssigkeit aus den Geweben ab und transportieren auch Krankheitserreger und antigentragende Zellen aus infizierten Geweben in die Lymphknoten (Abb. 1.22). Freie Antigene diffundieren einfach durch die extrazelluläre Flüssigkeit in den Lymphknoten . Die dendritischen Zellen hingegen wandern, angelockt von Chemokinen , aktiv in den Lymphknoten. Dieselben Chemokine locken auch Lymphocyten aus dem Blut an. Diese gelangen in die Lymphknoten, indem sie sich durch die Wände von spezialisierten Blutgefäßen hindurchdrücken, die man aufgrund des dickeren und stärker abgerundeten Erscheinungsbilds der Endothelzellen (im Vergleich zu anderen Regionen) als Venolen mit hohem Endothel (high endothelial venules, HEVs) bezeichnet. Die B-Zellen sind in den Lymphknoten in Follikeln lokalisiert, die den äußeren Cortex des Lymphknotens bilden, während die T-Zellen eher unregelmäßig auf die umgebenden Paracorticalzonen verteilt sind, die man auch als tiefer liegenden Cortex oder T-Zell-Zonen bezeichnet (Abb. 1.22). Lymphocyten , die vom Blut in die Lymphknoten wandern, gelangen zuerst in die Paracorticalzonen. Dort sind auch antigenpräsentierende dendritische Zellen und Makrophagen lokalisiert, da diese von denselben Chemokinen angelockt werden. Freie Antigene, die durch den Lymphknoten diffundieren, können dort von diesen dendritischen Zellen und Makrophagen festgehalten werden. Dieses Zusammentreffen von Antigenen, antigenpräsentierenden Zellen und naiven T-Zellen erzeugt die geeignete Umgebung im T-Zell-Bereich, in der die naiven T-Zellen ihr Antigen binden und so aktiviert werden.
Wie bereits erwähnt, erfordert die Aktivierung von B-Zellen normalerweise nicht nur ein Antigen, das an den B-Zell-Rezeptor bindet, sondern auch die Unterstützung durch aktivierte T-Helferzellen, die zu den T-Effektorzellen gehören. Der Aufenthaltsort der B- und T-Zellen im Lymphknoten wird aufgrund ihres Aktivierungszustands dynamisch reguliert. Nach ihrer Aktivierung wandern B- und T-Zellen an den Rand des Follikels und der T-Zell-Zone, wo die T-Zellen zum ersten Mal ihre Helferfunktion an den B-Zellen ausführen. Einige B-Zell-Follikel enthalten Keimzentren , in denen die B-Zellen stark proliferieren und sich zu Plasmazellen differenzieren. Diese Vorgänge werden in Kap. 10.1007/978-3-662-56004-4_10 im Einzelnen beschrieben.
Beim Menschen ist die Milz ein Organ von der Größe einer Faust, das direkt hinter dem Magen liegt (Abb. 1.18). Die Milz hat keine direkte Verbindung zum Lymphsystem; sie sammelt stattdessen die Antigene aus dem Blut und wirkt bei Immunantworten gegen Krankheitserreger im Blut mit. Lymphocyten gelangen durch die Blutgefäße in die Milz und verlassen sie so auch wieder. Die Struktur des Organs ist in Abb. 1.23 schematisch dargestellt. Ein Großteil der Milz besteht aus der roten Pulpa , in der die roten Blutkörperchen abgebaut werden. Die Lymphocyten umgeben die Arteriolen, die das Organ durchziehen, und bilden so die Bereiche der weißen Pulpa . Die Hülle der Lymphocyten um eine Arteriole bezeichnet man als PALS-Region (PALS für periarteriolar lymphoid sheath); sie enthält hauptsächlich T-Zellen. In bestimmten Abständen befinden sich Lymphfollikel, die vor allem B-Zellen enthalten. Der Follikel ist von einer Randzone umgeben, in der nur einige wenige T-Zellen, aber zahlreiche Makrophagen vorkommen, außerdem eine ortsfeste, nichtzirkulierende Population von B-Zellen, die man als B-Zellen der Randzone bezeichnet. Diese B-Zellen können schnell Antikörper produzieren, die eine geringe Affinität für Polysaccharide von Bakterienkapseln besitzen. Diese Antikörper, die in Kap. 10.1007/978-3-662-56004-4_8 besprochen werden, bieten einen gewissen Schutz, bevor die adaptive Immunantwort vollständig in Gang gesetzt ist. In der Randzone filtern Makrophagen und unreife dendritische Zellen Mikroorganismen, lösliche Antigene und Antigen:Antikörper-Komplexe aus dem Blut. Genauso wie unreife dendritische Zellen aus den peripheren Geweben in die T-Zell-Bereiche der Lymphknoten wandern, so wandern dendritische Zellen aus der Randzone der Milz in die T-Zell-Bereiche der Milz, sobald sie Antigene aufgenommen haben und aktiviert wurden; in der Milz präsentieren sie die Antigene dann den T-Zellen.
Die Schleimhäute besitzen spezialisierte Immunstrukturen, die Reaktionen auf Kontakte mit Mikroorganismen aus der Umgebung steuern
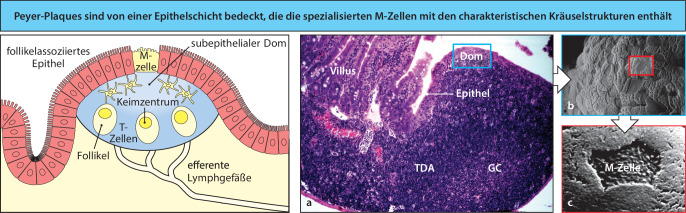
Die meisten Krankheitserreger dringen über die Schleimhäute in den Körper ein. Diese sind zudem einer sehr großen Belastung durch andere potenzielle Antigene aus der Luft, der Nahrung und der natürlichen mikrobiellen körpereigenen Mikroflora ausgesetzt. Mucosale Oberflächen werden von einem ausgedehnten System von lymphatischen Geweben geschützt, die man allgemein als mucosales Immunsystem oder mucosaassoziiertes lymphatisches Gewebe (mucosa-associated lymphoid tissues, MALT) bezeichnet. Das mucosale Immunsystem enthält schätzungsweise insgesamt so viele Lymphocyten wie der übrige Körper. Diese bilden eine spezielle Population von Zellen, die teilweise hinsichtlich der Rezirkularisierung anderen Mechanismen unterliegt als die Zellen in den übrigen peripheren lymphatischen Organen. Die darmassoziierten lymphatischen Gewebe (gut-associated lymphoid tissues, GALT), zu denen die Rachenmandeln , die Gaumenmandeln und der Blinddarm sowie spezialisierte Strukturen (die Peyer-Plaques ) im Dünndarm gehören, sammeln Antigene von den Oberflächenepithelien des Gastrointestinaltrakts. In den Peyer-Plaques – den wichtigsten und am höchsten organisierten unter den genannten Geweben – werden die Antigene von spezialisierten Epithelzellen gesammelt, den M-Zellen (Mikrofaltenzellen) (Abb. 1.24). Die Lymphocyten bilden einen Follikel, bestehend aus einer zentralen Wölbung aus B-Lymphocyten, die von einer geringeren Anzahl von T-Lymphocyten umgeben ist. Dendritische Zellen, die sich in den Peyer-Plaques aufhalten, präsentieren den T-Lymphocyten Antigene. Die Lymphocyten gelangen über das Blut in die Peyer-Plaques und verlassen sie durch die efferenten Lymphgefäße. Effektorlymphocyten, die sich in den Peyer-Plaques gebildet haben, wandern durch das lymphatische System und in den Blutkreislauf, von wo aus sie sich wieder auf die mucosalen Gewebe verteilen und ihre Effektoraktivitäten ausführen.
Ähnliche, aber weniger gut organisierte Ansammlungen von Lymphocyten kommen auf den Schleimhäuten der Atemwege und auf anderen Schleimhäuten vor: das nasenassoziierte lymphatische Gewebe (NALT) und das bronchienassoziierte lymphatische Gewebe (BALT) befinden sich in den Atemwegen. Diese Lymphgewebe werden wie die Peyer-Plaques ebenfalls von M-Zellen bedeckt, durch die eingeatmete Mikroorganismen und Antigene, die im Schleim festgehalten werden, hindurchgelangen können. Das mucosale Immunsystem wird in Kap. 10.1007/978-3-662-56004-4_12 besprochen.
Obwohl sich Lymphknoten, Milz und die mucosaassoziierten lymphatischen Gewebe deutlich in ihrem Erscheinungsbild unterscheiden, zeigen sie doch alle denselben Grundaufbau. Jedes der Gewebe funktioniert nach demselben Prinzip. Antigene und antigenpräsentierende Zellen aus Infektionsherden werden festgehalten, sodass den wandernden kleinen Lymphocyten Antigene präsentiert werden können. Diese wiederum lösen dann adaptive Immunantworten aus. Die peripheren lymphatischen Gewebe geben auch den Lymphocyten, die nicht sofort auf ihr spezifisches Antigen treffen, stabilisierende Signale, sodass sie überleben und weiter zirkulieren.
Da sie beim Auslösen der adaptiven Immunantworten mitwirken, sind die peripheren lymphatischen Gewebe keine statischen Strukturen, sondern unterliegen starken Veränderungen, abhängig davon, ob eine Infektion vorliegt oder nicht. Die undeutlichen lymphatischen Gewebe der Schleimhäute können als Reaktion auf eine Infektion in Erscheinung treten und danach wieder verschwinden, während sich der Aufbau von organisierten Geweben bei einer Infektion auf genauer festgelegte Weise ändert. So dehnen sich beispielsweise die B-Zell-Follikel der Lymphknoten bei der Proliferation der B-Zellen aus und bilden Keimzentren (Abb. 1.22). Außerdem vergrößert sich der gesamte Lymphknoten, ein Effekt, den man umgangssprachlich als „geschwollene Drüsen“ bezeichnet.
Schließlich gibt es noch spezialisierte Populationen von Lymphocyten und lymphatischen Zellen des angeborenen Immunsystems, die sich an bestimmten Stellen über den Körper verteilen und nicht in Form von Lymphgeweben organisiert sind. Solche Bereiche sind die Leber und die Lamina propria des Darms, außerdem die Basis des inneren Darmepithels, Epithelien der Fortpflanzungsorgane, sowie bei Mäusen, aber nicht beim Menschen, die Epidermis. Diese Lymphocytenpopulationen spielen anscheinend für den Schutz dieser Organe vor Infektionen eine wichtige Rolle (Kap. 10.1007/978-3-662-56004-4_8 und 10.1007/978-3-662-56004-4_12).
Lymphocyten, die durch ein Antigen aktiviert wurden, proliferieren in den peripheren lymphatischen Organen und erzeugen dadurch Effektorzellen und das immunologische Gedächtnis
Aufgrund der großen Vielfalt der Lymphocytenrezeptoren gibt es normalerweise immer einige Lymphocyten, die einen Rezeptor für ein bestimmtes fremdes Antigen besitzen. Neuere Experimente deuten darauf hin, dass in einer Maus vielleicht jeweils wenige Hundert solcher Zellen vorhanden sind, was für die Entwicklung einer Immunantwort gegen einen Krankheitserreger bestimmt nicht ausreichen würde. Um genügend spezifische Effektorlymphocyten zur Bekämpfung einer Infektion zu erzeugen, wird ein Lymphocyt mit der richtigen Rezeptorspezifität zuerst aktiviert, um zu proliferieren. Erst wenn ein großer Klon aus identischen Zellen erzeugt wurde, differenzieren sich diese schließlich zu Effektorzellen. Ein solcher Vorgang dauert vier bis fünf Tage. Das bedeutet, dass die adaptive Immunantwort gegen einen Krankheitserreger mehrere Tage nach der ersten Infektion, die vom angeborenen Immunsystem erkannt wurde, in Erscheinung tritt.
Nachdem ein naiver Lymphocyt sein Antigen auf einer aktivierten antigenpräsentierenden Zelle erkannt hat, hört er auf zu wandern, das Volumen des Zellkerns und des Cytoplasmas nimmt zu und eine Neusynthese von RNA und Proteinen setzt ein. Nach wenigen Stunden hat sich das Aussehen der Zelle vollständig verändert und man bezeichnet sie als Lymphoblast. Sich teilende Lymphoblasten können sich drei bis fünf Tage lang alle 24 Stunden zwei- bis viermal verdoppeln. Ein ungeprägter Lymphocyt kann also etwa 1000 Tochterzellen identischer Spezifität hervorbringen. Diese differenzieren sich zu Effektorzellen. Die B-Zellen sezernieren als differenzierte Effektorzellen (Plasmazellen ) Antikörper; die T-Effektorzellen sind entweder cytotoxische Zellen, die infizierte Zellen zerstören, oder Helferzellen, die andere Zellen des Immunsystems aktivieren (Abschn. 1.3.1).
Effektorlymphocyten zirkulieren nicht wie naive Lymphocyten. Einige Effektorzellen erkennen Infektionsherde und wandern aus dem Blut dorthin; andere bleiben in den lymphatischen Geweben, wo sie B-Zellen aktivieren. Einige antikörperfreisetzende Plasmazellen verbleiben in den peripheren lymphatischen Organen, aber die meisten Plasmazellen, die in den Lymphknoten und der Milz erzeugt werden, wandern in das Knochenmark und halten sich dann dort auf, wobei sie große Mengen an Antikörpern in den Blutkreislauf abgeben. Effektorzellen, die im mucosalen Immunsystem gebildet werden, verbleiben im Allgemeinen in den mucosalen Geweben. Die meisten Lymphocyten, die bei einer klonalen Expansion entstehen, sterben schließlich ab. Es bleibt jedoch eine relevante Anzahl von aktivierten antigenspezifischen B- und T-Zellen erhalten, nachdem das Antigen beseitigt wurde. Diese Zellen bezeichnet man als Gedächtniszellen ; sie bilden die Grundlage für das immunologische Gedächtnis. Sie können viel rascher als naive Lymphocyten aktiviert werden und stellen so sicher, dass die Reaktion auf eine erneute Infektion mit demselben Krankheitserreger schneller und wirksamer erfolgt. So bildet sich normalerweise eine lang anhaltende Immunität heraus.
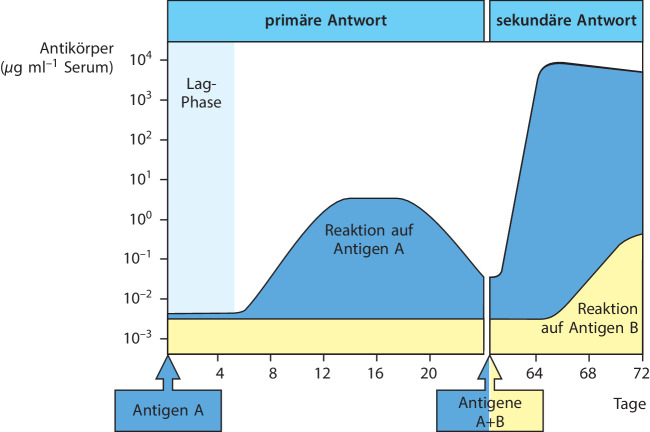
Die Besonderheiten des immunologischen Gedächtnisses lassen sich gut beobachten, indem man die Antikörperantwort eines Lebewesens bei einer ersten oder primären Immunisierung mit der Reaktion desselben Lebewesens auf eine zweite oder sekundäre Immunisierung (Booster-Immunisierung ) mit dem gleichen Antigen vergleicht. Wie Abb. 1.25 zeigt, setzt die sekundäre Antikörperantwort nach einer kürzeren Verzögerungsphase ein und erreicht ein deutlich höheres Niveau als bei der primären Immunantwort. Bei der sekundären Immunantwort können Antikörper von stärkerer Affinität oder Bindungsstärke für das Antigen entstehen. Diesen Vorgang bezeichnet man als Affinitätsreifung . Sie erfolgt in spezialisierten Keimzentren in den B-Zell-Follikeln (Abschn. 1.3.9). Wichtig ist dabei, dass T-Helferzellen für die Affinitätsreifung erforderlich sind, T-Zell-Rezeptoren jedoch keine Affinitätsreifung durchlaufen. Im Vergleich zu naiven T-Zellen besitzen T-Gedächtniszellen eine niedrigere Aktivierungsschwelle. Dies ist eine Folge der erhöhten Reaktivität der Zelle und nicht einer Veränderung des Rezeptors. Kap. 10.1007/978-3-662-56004-4_5 und 10.1007/978-3-662-56004-4_10 beschreiben die zugrunde liegenden Mechanismen der Affinitätsreifung.
Die klonale Expansion und die klonale Differenzierung von Zellen, die für das auslösende Antigen spezifisch sind, bilden die zelluläre Grundlage für das immunologische Gedächtnis , das demnach vollständig antigenspezifisch ist. Erst das immunologische Gedächtnis ermöglicht eine erfolgreiche Impfung und verhindert die erneute Infektion mit Krankheitserregern, die bereits einmal von der adaptiven Immunantwort abgewehrt wurden. In Kap. 10.1007/978-3-662-56004-4_11 werden wir uns noch einmal mit dem immunologischen Gedächtnis beschäftigen, das die wichtigste biologische Folge der Entwicklung der adaptiven Immunität ist.
Zusammenfassung
Während das angeborene Immunsystem auf unveränderlichen Mustererkennungsrezeptoren beruht, die häufig auftretende mikrobielle Strukturen oder die durch Krankheitserreger verursachten Schäden erfassen, basiert das adaptive Immunsystem auf einem Repertoire von Antigenrezeptoren, die Strukturen erkennen, welche für bestimmte Krankheitserreger spezifisch sind. Dadurch besitzt die adaptive Immunität eine größere Sensitivität und Spezifität. Die klonale Expansion von auf ein Antigen reagierenden Lymphocyten ermöglicht außerdem ein immunologisches Gedächtnis, das den Schutz gegen eine erneute Infektion mit demselben Pathogen verstärkt.
Es gibt zwei Haupttypen von Lymphocyten: B-Zellen reifen im Knochenmark und sind der Ursprung der zirkulierenden Antikörper. T-Zellen reifen im Thymus und erkennen Peptide von Krankheitserregern, die von MHC-Molekülen auf infizierten oder antigenpräsentierenden Zellen präsentiert werden. Bei einer adaptiven Immunantwort kommt es zu einer Selektion und Amplifizierung von Klonen aus Lymphocyten, die Rezeptoren für das fremde Antigen tragen. Mit dieser Theorie der klonalen Selektion der Lymphocyten lassen sich alle Schlüsselmerkmale der erworbenen Immunität verstehen.
Jeder Lymphocyt trägt an seiner Oberfläche Rezeptoren einer einzigen Spezifität. Diese Rezeptoren entstehen durch die zufällige Kombination variabler Rezeptorgensegmente und die paarweise Zusammenlagerung verschiedener variabler Proteinketten – der schweren und der leichten Kette bei den Immunglobulinen oder der zwei Ketten der T-Zell-Rezeptoren. Das große Antigenrezeptorrepertoire der Lymphocyten kann praktisch jedes Antigen erkennen. Die adaptive Immunität wird ausgelöst, wenn die angeborene Immunantwort eine neue Infektion nicht beseitigen kann und aktivierte antigenpräsentierende Zellen – normalerweise dendritische Zellen, die Antigene von Krankheitserregern und costimulierende Rezeptoren tragen – in das ableitende Lymphgewebe gelangen.
Immunreaktionen werden in mehreren Lymphgeweben ausgelöst. Die Milz dient als Filter für Infektionen im Blut. Die Lymphknoten leiten aus verschiedenen Geweben Flüssigkeit ab. Die mucosa- und darmassoziierten lymphatischen Gewebe (MALT und GALT) sind in Form spezifischer Bereiche organisiert, in denen B- und T-Zellen durch antigenpräsentierende Zellen oder T-Helferzellen wirksam aktiviert werden können.
Trifft ein zirkulierender Lymphocyt in den peripheren lymphatischen Geweben auf ein fremdes Antigen, wird er zur Proliferation angeregt, wobei sich die Nachkommen zu T- und B-Effektorzellen differenzieren, die einen Erreger vernichten können. Ein Teil dieser proliferierenden Lymphocyten differenziert sich zu Gedächtniszellen, die schnell auf ein erneutes Auftreten desselben Krankheitserregers reagieren können. Die Einzelheiten der Vorgänge bei Erkennung, Entwicklung und Differenzierung bilden die Hauptthemen in den mittleren drei Teilen des Buches.
Effektormechanismen der Immunität
Damit die aktivierten Immunzellen der angeborenen und adaptiven Immunität Krankheitserreger vernichten können, benötigen sie für jedes Pathogen geeignete Effektormechanismen . Die unterschiedlichen Typen der Krankheitserreger (Abb. 1.26) haben verschiedene Lebensweisen und erfordern unterschiedliche Reaktionen, sowohl um sie zu erkennen als auch um sie zu vernichten. Deshalb verwundert es nicht, dass die Abwehrmechanismen gegen die unterschiedlichen Pathogene in Form von Effektormodulen strukturiert sind, die den verschiedenen Lebensweisen entsprechen. Ein Effektormodul dieser Art ist eine Kombination von zellulären und humoralen Mechanismen, sowohl angeborenen als auch erworbenen, die zusammenwirken und so die Vernichtung von Krankheitserregern einer bestimmten Kategorie bewerkstelligen. So kann beispielsweise die Abwehr von extrazellulären Pathogenen durch phagocytotische Zellen und B-Zellen erfolgen. Letztere erkennen extrazelluläre Antigene und werden zu Plasmazellen, die Antikörper in die extrazelluläre Umgebung freisetzen. Die Abwehr von intrazellulären Krankheitserregern erfordert T-Zellen, die Peptide erkennen, welche im Inneren einer infizierten Zelle erzeugt wurden. Einige T-Effektorzellen töten Zellen, die mit intrazellulären Krankheitserregern wie Viren infiziert sind, direkt ab. Darüber hinaus differenzieren sich aktivierte T-Zellen zu drei Arten von T-Helferzellen , die verschiedene Kombinationen von Cytokinen produzieren. Diese drei Zelltypen, die im Folgenden besprochen werden, spezialisieren sich allgemein so, dass sie die Abwehr von Krankheitserregern unterstützen, die zu drei unterschiedlichen Lebensformen gehören. Die T-Helferzellen können intrazelluläre Infektionen bekämpfen, extrazelluläre Bakterien und Pilze vernichten oder gegen Parasiten eine Immunbarriere aufbauen. T-Zellen stimulieren auch die Abwehr von extrazellulären Pathogenen, indem sie B-Zellen dabei unterstützen, Antikörper zu produzieren.
Die meisten anderen Effektormechanismen der adaptiven Immunantwort , die Krankheitserreger bei einer adaptiven Immunantwort beseitigen, sind mit denen der angeborenen Immunität identisch. Dabei sind Zellen wie Makrophagen und neutrophile Zellen sowie Proteine wie das Komplement von Bedeutung. Wahrscheinlich hat sich die adaptive Immunantwort der Vertebraten in Form spezifischer Erkennungsmechanismen in der Evolution als Ergänzung der bereits vorhandenen angeborenen Immunität entwickelt. Dies wird durch neuere Befunde unterstützt, die besagen, dass die angeborenen lymphatischen Zellen (ILCs ) bei der Entwicklung verschiedener cytokinproduzierender Zellen ähnliche Differenzierungsmuster zeigen wie die T-Zellen.
Den angeborenen Immunreaktionen stehen zur Abwehr der verschiedenen Typen von Krankheitserregern mehrere Effektormodule zur Auswahl
Wie bereits in Abschn. 1.2.7 erwähnt, umfasst das angeborene Immunsystem unterschiedliche Zelltypen – NK- und ILC-Zellen –, die den Lymphocyten, insbesondere den T-Zellen, ähnlich sind. NK-Zellen besitzen, anders als die T-Zellen, keine antigenspezifischen Rezeptoren, können aber die Cytotoxizität der T-Zellen entfalten und einige Cytokine produzieren, die auch T-Effektorzellen freisetzen. ILC-Zellen entstehen im Knochenmark aus denselben Vorläuferzellen wie die NK-Zellen und besitzen ebenfalls keine antigenspezifischen Rezeptoren. Neueste Untersuchungen deuten darauf hin, dass die ILCs mehrere eng verwandte Zelllinien umfassen, die sich durch die spezifischen Cytokine unterscheiden, welche sie bei ihrer Aktivierung produzieren. Eine Besonderheit ist dabei, dass sich die Muster der Cytokine, die von den Untergruppen der ILCs und der T-Helferzellen produziert werden, auffällig ähneln (siehe oben). Anscheinend sind die einzelnen ILC-Untergruppen homologe Formen ihrer Gegenstücke bei den T-Helferzellen und die NK-Zellen sind die angeborene homologe Form der cytotoxischen T-Zellen.
Wie Bereits in Abschn. 1.2.6 erwähnt, gibt es eine große Zahl von Cytokinen mit jeweils unterschiedlichen Funktionen (Anhang III). Es ist durchaus sinnvoll, die Wirkungen der Cytokine systematisch einzuordnen, indem man die Effektormodule zugrunde legt, die die einzelnen Cytokine jeweils unterstützen. Einige wirken zum Beispiel bei der Bekämpfung von intrazellulären Krankheitserregern mit, wie Interferon-γ (IFN-γ ). Dieses Molekül aktiviert Phagocyten, intrazelluläre Pathogene wirksamer zu töten, und es bewirkt in bestimmten Geweben, dass intrazelluläre Krankheitserreger besser abgewehrt werden. Das bezeichnet man als Immunität vom Typ 1 . IFN-γ wird von einigen, aber nicht von allen Subtypen der angeborenen und adaptiven Lymphocyten produziert; die Untergruppe der ILCs, die IFN-γ freisetzt, bezeichnet man als ILC1 . Andere ILC-Subtypen produzieren Cytokine, die vor allem die Effektormodule unterstützen, die zu einer Immunität vom Typ 2 und Typ 3 führen. Diese koordinieren die Bekämpfung von parasitischen beziehungsweise extrazelluären Krankheitserregern. Der modulare Aufbau der Effektorfunktionen des Immunsystems wird uns in diesem Buch immer wieder beschäftigen. Eine Grundregel scheint darin zu bestehen, dass aktivierte Sensorzellen, entweder des angeborenen oder des adaptiven Immunsystems, verschiedene Untergruppen der angeborenen oder adaptiven Lymphocyten aktivieren können. Diese wiederum sind darauf spezialisiert, bestimmte Effektormodule zu verstärken, die gegen die unterschiedlichen Arten von Krankheitserregern gerichtet sind (Abb. 1.27).
Antikörper richten sich gegen extrazelluläre Krankheitserreger und ihre toxischen Produkte
Antikörper kommen im flüssigen Bestandteil des Blutes (Plasma) und in extrazellulären Flüssigkeiten vor. Da die Körperflüssigkeit früher als Humor bezeichnet wurde, spricht man auch von der humoralen Immunität .
Antikörper sind Y-förmige Moleküle mit zwei identischen Antigenbindungsstellen und einer konstanten Fc-Region. Wie bereits in Abschn. 1.3.2 erwähnt, gibt es fünf Formen der konstanten Region eines Antikörpers, die man als Klassen oder Isotypen bezeichnet. Die konstante Region bestimmt die funktionellen Eigenschaften eines Antikörpers – also welche Effektormechanismen er in Gang setzt, die dann das Antigen beseitigen, nachdem es erkannt wurde. Jede Klasse führt ihre spezifische Funktion aus, indem sie eine bestimmte Kombination von Effektormechanismen auslöst. Kap. 10.1007/978-3-662-56004-4_5 und 10.1007/978-3-662-56004-4_10 beschreiben die Isotypen und ihre Reaktionen im Einzelnen.
Die erste und direkteste Reaktion, mit deren Hilfe Antikörper einen Organismus vor Krankheitserregern oder ihren toxischen Produkten schützen können, ist die Bindung der Antigene, um deren Wechselwirkung mit Zellen, die sie infizieren oder zerstören würden, zu blockieren (Abb. 1.28, links). Man bezeichnet diesen Vorgang als Neutralisierung . Sie ist für die Abwehr von Krankheitserregern wie Viren von Bedeutung, die so daran gehindert werden, in Zellen einzudringen und sich zu replizieren, außerdem werden bakterielle Toxine neutralisiert.
Die Bindung von Antikörpern reicht jedoch allein nicht aus, um die Vermehrung von Bakterien zu stoppen. In diesem Fall besteht die Aufgabe des Antikörpers darin, einem Phagocyten, etwa einem Makrophagen oder einer neutrophilen Zelle, zu ermöglichen, das Bakterium aufzunehmen und zu zerstören. Viele Bakterien entgehen dem angeborenen Immunsystem, da sie eine äußere Hülle besitzen, die von den Mustererkennungsrezeptoren der Phagocyten nicht erkannt wird. Antigene in der Hülle können jedoch von Antikörpern erkannt werden und Phagocyten besitzen Fc-Rezeptoren , die an die konstante Region von Antikörpern binden und so die Phagocytose ermöglichen (Abb. 1.28, Mitte). Man bezeichnet das Einhüllen von Krankheitserregern und Fremdpartikeln mit Antikörpern als Opsonisierung .
Die dritte Funktion der Antikörper ist die Komplementaktivierung . In Abschn. 1.2.2 sind wir kurz auf Bordets Entdeckung des Komplementsystems als Serumfaktor eingegangen, das die Aktivität von Antikörpern ergänzt (komplementiert). Das Komplementsystem kann auch ohne Unterstützung durch Antikörper allein durch die Oberflächen von Mikroorganismen aktiviert werden. Dadurch kommt es zur kovalenten Anlagerung bestimmter Komplementproteine auf der Bakterienoberfläche. Wenn jedoch ein Antikörper zuerst an die Oberfläche eines Bakteriums bindet, bildet seine konstante Region eine Plattform, die das Komplementsystem viel wirksamer aktiviert als die mikrobiellen Strukturen allein. Sobald also Antikörper erzeugt werden, kann die Komplementaktivierung erheblich zunehmen.
Bestimmte Komplementfaktoren, die an die Oberfläche von Bakterien binden, können bei einigen Bakterien die Membranen direkt zerstören, was bei einigen bakteriellen Infektionen von großer Bedeutung ist (Abb. 1.28, rechts). Die Hauptfunktion des Komplementsystems – wie auch der Antikörper selbst – besteht jedoch darin, die Oberfläche von Krankheitserregern zu bedecken und so den Phagocyten die Aufnahme und Zerstörung von Bakterien zu ermöglichen, die sie sonst nicht erkennen würden. Die meisten Phagocyten produzieren Komplementrezeptoren , die bestimmte Komplementproteine erkennen können. Diese Rezeptoren binden an die Komplementproteine auf der Oberfläche der Bakterien und ermöglichen so deren Phagocytose. Einige weitere Komplementproteine verstärken ebenfalls bakterizide Wirkung der Phagocyten. Letztendlich werden alle Krankheitserreger und freien Moleküle, an die Antikörper gebunden haben, durch Phagocyten aufgenommen, abgebaut und aus dem Körper entfernt (Abb. 1.28, unten). Das Komplementsystem und die Phagocyten , die durch Antikörper aktiviert werden, sind selbst nicht antigenspezifisch. Ihre Wirkung beruht darauf, dass Antikörpermoleküle die Partikel als fremd markieren.
T-Zellen steuern die zellvermittelte Immunität und regulieren die B-Zell-Reaktionen auf die meisten Antigene
Einige Bakterien und Parasiten sowie alle Viren vermehren sich innerhalb der Zellen, wo sie nicht von den Antikörpern erreicht werden können, die nur im Blut und in der extrazellulären Flüssigkeit vorkommen. Die Vernichtung von intrazellulären Eindringlingen ist die Aufgabe der T-Lymphocyten, die für die zellulären Immunantworten der adaptiven Immunität zuständig sind. Die T- Lymphocyten sind jedoch an den Reaktionen gegen ein breites Spektrum von Krankheitserregern beteiligt, etwa auch gegen extrazelluläre Organismen, sodass sie eine große Vielfalt von Effektoraktivitäten entfalten müssen.
Es gibt mehrere Arten von T-Lymphocyten, die sich alle im Thymus entwickeln. Sie sind durch den Typ des T-Zell-Rezeptors gekennzeichnet, den sie exprimieren, außerdem durch die Bildung bestimmter Markermoleküle. Die beiden Hauptgruppen der T-Zellen exprimieren ein bestimmtes Protein auf der Zelloberfläche, entweder CD8 oder CD4 . Das sind keine willkürlich ausgewählten Moleküle, sondern sie sind für die Funktion der T-Zellen von Bedeutung, da sie bestimmen, welche Wechselwirkungen sie mit anderen Zellen eingehen. In Abschn. 1.3.3 haben wir bereits besprochen, dass T-Zellen Peptide erkennen können, die von fremden Antigenen stammen und von MHC-Molekülen auf der Zelloberfläche präsentiert werden. CD8 und CD4 sind an der Erkennung von Antigenen beteiligt, wobei sie an unterschiedliche Regionen der MHC-Moleküle binden. Außerdem wirken sie bei der Signalgebung des T-Zell-Rezeptors mit, der mit seinem Antigen in Wechselwirkung tritt. CD4 und CD8 bezeichnet man deshalb auch als Corezeptoren . Sie sind für die Funktionsunterschiede zwischen CD8- und CD4-Zellen verantwortlich.
Wichtig ist dabei auch, dass es zwei verschiedene Arten von MHC-Molekülen gibt, die man mit MHC-Klasse I und MHC-Klasse II bezeichnet. Sie besitzen etwas unterschiedliche Strukturen, enthalten jedoch beide an der Oberfläche eine längere Furche, die ein Peptid binden kann (Abb. 1.29). Das Peptid wird während der Synthese und des Zusammenbaus des MHC-Moleküls im Inneren der Zelle in der Furche befestigt. Anschließend wird der Peptid:MHC-Komplex zur Zelloberfläche transportiert und den T-Zellen präsentiert (Abb. 1.30). Da CD8 eine Region im MHC-Klasse-I-Protein erkennt, CD4 jedoch im MHC-Klasse-II-Protein, unterscheiden sich die T-Zellen aufgrund ihrer beiden Corezeptoren. Deshalb erkennen CD8-T-Zellen ausschließlich Peptide, die an MHC-Klasse-I-Moleküle gebunden sind, CD4-T-Zellen nur Peptide, die von MHC-Klasse-II-Molekülen präsentiert werden.
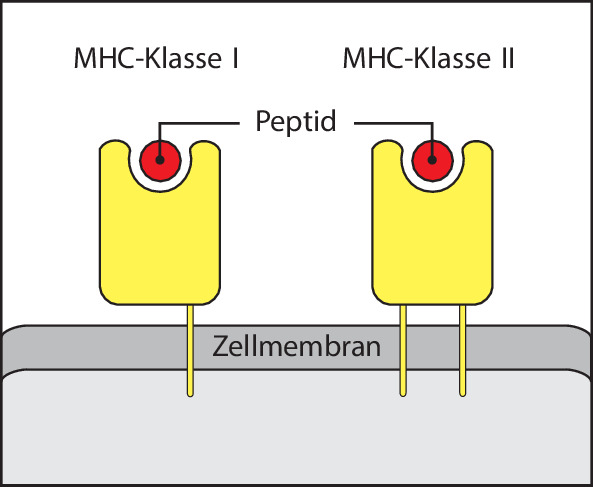
Die unmittelbarste Aktivität der T-Zellen ist die Cytotoxizität. Cytotoxische T-Zellen sind T-Effektorzellen , die virusinfizierte Zellen bekämpfen. Antigene der Viren, die sich im Inneren einer infizierten Zelle vermehren, werden auf der Zelloberfläche präsentiert, wo sie von den Antigenrezeptoren der cytotoxischen T-Zellen erkannt werden. Diese T-Zellen können die Infektion unter Kontrolle bringen, indem sie die infizierten Zellen direkt töten, bevor die Vermehrung der Viren abgeschlossen ist und die Viren freigesetzt werden (Abb. 1.31). Cytotoxische T-Zellen tragen CD8 und erkennen deshalb Antigene, die von MHC-Klasse-I-Molekülen präsentiert werden. Die MHC-Klasse-I-Moleküle werden von fast allen Körperzellen exprimiert und dienen so einem bedeutsamen Mechanismus zur Abwehr von Virusinfektionen . MHC-Klasse-I-Moleküle, die virale Peptide tragen, werden von CD8-tragenden cytotoxischen T-Zellen erkannt, die dann die infizierte Zelle töten (Abb. 1.32).
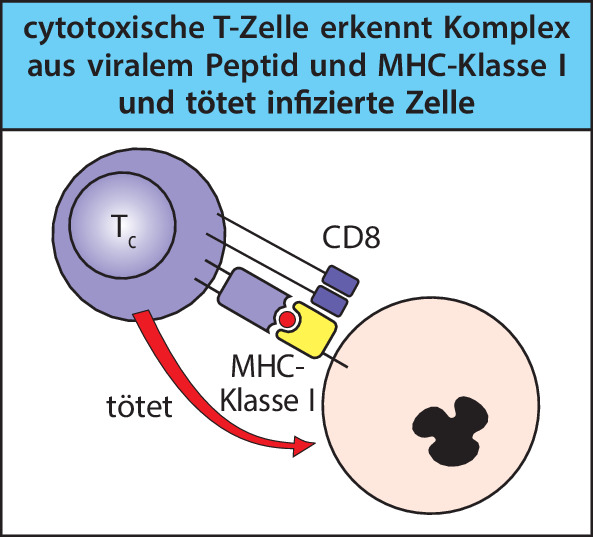
CD4-T-Zellen erkennen Antigene, die von MHC-Klasse-II-Proteinen präsentiert werden. Diese MHC-Moleküle werden von den meisten antigenpräsentierenden Zellen des Immunsystems exprimiert: von dendritischen Zellen, Makrophagen und B-Zellen (Abb. 1.33). CD4-T-Zellen erkennen also vor allem Antigene, die durch Phagocytose aus der extrazellulären Umgebung aufgenommen werden. CD4-T-Zellen sind die Helferzellen die in diesem Kapitel bereits erwähnt wurden. Sie entwickeln sich zu einer Reihe verschiedener Untergruppen von Effektorzellen. Diese bezeichnet man als TH1 (T-Helferzelle Typ 1), TH2- , TH17 und so weiter. Sie produzieren Cytokine nach einem ähnlichen Muster wie die ILC-Untergruppen (siehe oben), die Effektormodule aktivieren, welche vor unterschiedlichen Krankheitserregern schützen können. Diese zellulären Untergruppen sind vor allem an Infektionsherden und an verletzten Stellen in den peripheren Geweben aktiv. In den Lymphgeweben interagiert eine Untergruppe der CD4-T-Zellen , die follikulären T-Helferzellen (TFH-Zellen ), mit den B-Zellen und reguliert so die Antikörperproduktion während der Immunantwort. Mit den verschiedenen Untergruppen der T-Helferzellen befasst sich Kap. 10.1007/978-3-662-56004-4_9.
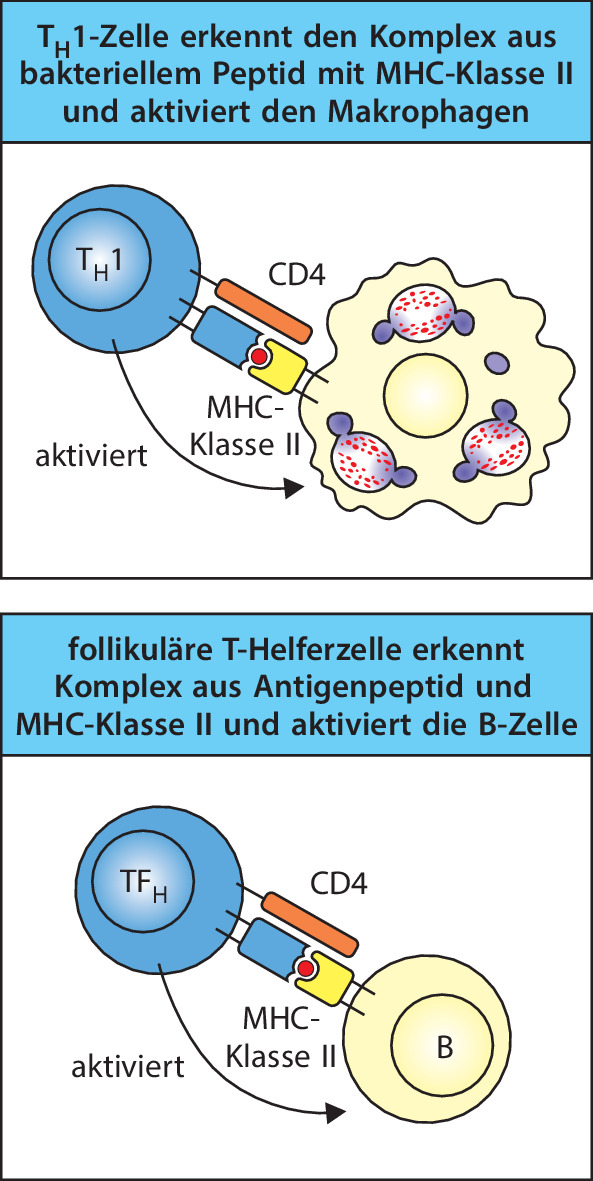
Beispielsweise wirken CD4-T-Zellen der TH1- Untergruppe bei der Bekämpfung bestimmter Bakterien mit, die sich in membranumschlossenen Vesikeln innerhalb von Makrophagen aufhalten. Sie produzieren IFN-γ , dasselbe Cytokin wie die ILC1-Zellen, das Makrophagen aktivieren kann, um ihr intrazelluläres Abtötungspotenzial zu verstärken und diese Bakterien zu vernichten. Wichtige Infektionskrankheiten, die durch diese Funktion eingedämmt werden, sind Tuberkulose und Lepra , die von den Bakterien Mycobacterium tuberculosis beziehungsweise M. leprae verursacht werden. Mycobakterien können in den Zellen überleben, weil sie verhindern, dass die von ihnen besetzten Vesikel mit den Lysosomen fusionieren, welche unterschiedliche abbauende Enzyme und antimikrobielle Substanzen enthalten (Abb. 1.34). An seiner Oberfläche präsentiert ein infizierter Makrophage dennoch Antigene der Mycobakterien , die von aktivierten antigenspezifischen TH1-Zellen erkannt werden und daraufhin den Makrophagen veranlassen, die Blockade der Vesikelfusion aufzuheben. Die Untergruppen TH2 und TH17 produzieren spezielle Cytokine, die Reaktionen gegen Parasiten beziehungsweise extrazelluläre Bakterien und Pilze stimulieren. CD4-T-Zellen und ihre spezialisierten Untergruppen sind in der adaptiven Immunität von besonderer Bedeutung und wir werden ihnen in diesem Buch immer wieder begegnen, etwa in Kap. 10.1007/978-3-662-56004-4_8, 10.1007/978-3-662-56004-4_9, 10.1007/978-3-662-56004-4_11 und 10.1007/978-3-662-56004-4_12.
Angeborene und erworbene Defekte des Immunsystems führen zu einer erhöhten Anfälligkeit für Infektionen
Wir halten die Fähigkeit unseres Immunsystems, den Körper von Infektionen zu befreien und ihr erneutes Auftreten zu verhindern, oft für selbstverständlich. Bei einigen Menschen versagen jedoch Teile des Immunsystems . Bei den schwersten dieser Immunschwächekrankheiten fehlt die adaptive Immunität vollständig, sodass überhandnehmende Infektionen bereits im Kleinkindalter zum Tod führen, wenn man nicht umfangreiche Gegenmaßnahmen ergreift. Bei anderen, weniger katastrophalen Fehlfunktionen kommt es immer wieder zu Infektionen mit bestimmten Pathogenen, was von der jeweiligen Art der Immunschwäche abhängt. Durch die Erforschung dieser Immunkrankheiten, von denen viele durch erbliche genetische Defekte verursacht werden, konnte man vieles über die Bedeutung der verschiedenen Komponenten des Immunsystems des Menschen erfahren. Um die Besonderheiten von Immunschwächekrankheiten zu verstehen, sind genaue Kenntnisse der normalen Immunmechanismen erforderlich. Deshalb besprechen wir die meisten dieser Krankheiten erst in Kap. 10.1007/978-3-662-56004-4_13.
Vor über 30 Jahren trat eine verheerende Form der Immunschwäche in Erscheinung, das erworbene Immunschwächesyndrom (acquired immune deficiency syndrome, AIDS), das von bestimmten Krankheitserregern ausgelöst wird, den humanen Immunschwächeviren HIV-1 und HIV-2 . Die Krankheit zerstört T-Zellen, dendritische Zellen und Makrophagen, die CD4 tragen, sodass es zu Infektionen durch intrazelluläre Bakterien und andere Krankheitserreger kommt, die normalerweise von diesen Zellen in Schach gehalten werden. Diese Infektionen sind die hauptsächliche Todesursache bei dieser immer weiter um sich greifenden Erkrankung. Mit ihr sowie mit den erblichen Immunschwächen befasst sich Kap. 10.1007/978-3-662-56004-4_13.
Kenntnisse über die adaptive Immunantwort sind wichtig für die Bekämpfung von Allergien, Autoimmunkrankheiten und der Abstoßung von transplantierten Organen
Die wichtigste Funktion unseres Immunsystems besteht darin, den menschlichen Körper vor Krankheitserregern zu schützen. Viele medizinisch bedeutsame Krankheiten sind jedoch mit einer unangemessenen Immunreaktion gegen bestimmte Antigene verknüpft, oft ohne dass eine Infektionskrankheit vorliegt. Immunantworten gegen nichtinfektiöse Antigene treten bei Allergien auf (hier ist das Antigen eine an sich unschädliche Fremdsubstanz), bei Autoimmunerkrankungen (als Reaktion auf ein Autoantigen) und bei der Transplantatabstoßung (das Antigen befindet sich auf einer übertragenen fremden Zelle, Kap. 10.1007/978-3-662-56004-4_15). Die wichtigsten Antigene, die eine Transplantatabstoßung hervorrufen, sind tatsächlich die MHC-Moleküle, da beide in der menschlichen Population in vielen verschiedenen Formen vorkommen – das heißt, sie sind hochgradig polymorph – und die meisten nichtverwandten Menschen exprimieren eine andere Kombination von MHC-Molekülen. Dies bezeichnet man als den jeweiligen „Gewebetyp“. Der MHC-Locus wurde ursprünglich von Peter Goren in den 1930er-Jahren bei den Mäusen als Genlocus entdeckt, der sogenannte H-2-Locus , der die Annahme oder Abstoßung von übertragenen Geweben kontrolliert. Später untersuchte George Snell die Bedeutung der MHC-Moleküle für die Gewebetransplantation, indem er Mäusestämme entwickelte, die sich nur an diesen Histokompatibilitätsloci unterschieden. Die humanen MHC-Moleküle entdeckte man hingegen während des Zweiten Weltkriegs bei Versuchen, Piloten und Bombenopfern mit schweren Verbrennungen durch Hauttransplantate zu helfen. Die Patienten stießen das übertragene Gewebe ab, das als „fremd“ erkannt wurde. Wann wir von einer erfolgreichen Immunantwort oder deren Versagen sprechen, oder ob wir eine Immunantwort als schädlich oder vorteilhaft für den Körper erachten, hängt nicht von der Reaktion selbst ab, sondern von der Art des Antigens und den Bedingungen, unter denen eine Immunantwort auftritt (Abb. 1.35). Snell erhielt 1980 den Nobelpreis für seine Arbeiten über den MHC, gemeinsam mit Banuj Benacerraf und Jean Dausset .
Allergische Erkrankungen, zu denen auch das Asthma gehört, sind in den Industrieländern immer häufiger der Grund für Arbeitsunfähigkeit. Bei vielen bedeutsamen Krankheiten wird inzwischen eine Autoimmunität als Ursache erkannt. Eine Autoimmunreaktion gegen die β-Zellen des Pankreas ist die häufigste Ursache von juvenilem Diabetes. Bei Allergien und Autoimmunkrankheiten führen die sonst so wirkungsvollen Schutzmechanismen der adaptiven Immunantwort zu gravierenden Gesundheitsschäden.
Immunantworten gegen „harmlose“ Antigene, körpereigene Gewebe oder Transplantate sind wie alle anderen Immunreaktionen hochspezifisch. Zurzeit behandelt man solche Reaktionen mit Immunsuppressiva , die alle Immunantworten unterbinden – ob erwünscht oder unerwünscht. Wäre es möglich, nur diejenigen Lymphocytenklone zu unterdrücken, die für eine unerwünschte Reaktion verantwortlich sind, könnte man eine solche Krankheit heilen oder ein transplantiertes Organ schützen, ohne notwendige Immunreaktionen zu unterbinden. Zum heutigen Zeitpunkt ist eine antigenspezifische Immunregulation mit einer medikamentösen Behandlung nicht möglich. Wie wir jedoch in Kap. 10.1007/978-3-662-56004-4_16 besprechen werden, hat man in letzter Zeit viele neue Wirkstoffe entwickelt, mit denen eine selektivere Immunsuppression möglich ist, um Autoimmunkrankheiten und andere unerwünschte Immunreaktionen unter Kontrolle zu bringen. Dazu gehören auch Therapieformen, die auf hochspezifischen monoklonalen Antikörpern basieren; diese wurden ermöglicht durch Georges Köhler und César Milstein , die sich im Jahr 1984 für die Entwicklung des Herstellungsverfahrens den Nobelpreis teilten. Wir wollen den aktuellen Stand der Erforschung von Allergien, Autoimmunkrankheiten, Gewebeabstoßung und Immunsuppressiva in Kap. 10.1007/978-3-662-56004-4_14 bis 10.1007/978-3-662-56004-4_16 besprechen, und in Kap. 10.1007/978-3-662-56004-4_15 werden wir erfahren, wie die Mechanismen der Immunregulation aufgrund tiefgreifenderer Erkenntnisse über die funktionellen Untergruppen der Lymphocyten und der Cytokine, die sie steuern, allmählich klarer erkannt werden.
Impfung ist die wirksamste Methode, Infektionskrankheiten unter Kontrolle zu bringen
Die Immunologie hat innerhalb der zwei Jahrhunderte seit Jenners bahnbrechendem Experiment in der Praxis zahlreiche Erfolge auf dem Gebiet der beabsichtigten Stimulation einer Immunantwort, das heißt der Immunisierung , Impfung oder Schutzimpfung, erzielt. Massenimpfungsprogramme haben praktisch zur Ausrottung mehrerer Krankheiten geführt, die immer mit hohen Erkrankungshäufigkeiten (Morbidität ) und Sterberaten (Mortalität ) verknüpft waren (Abb. 1.36). Die Immunisierung gilt als so sicher und wichtig, dass zum Beispiel in den meisten Bundesstaaten der USA eine Impfpflicht für Kinder gegen bis zu sieben der häufigsten Kinderkrankheiten besteht. So beeindruckend das Erreichte auch ist, es gibt immer noch viele Krankheiten, für die wirksame Impfstoffe fehlen. Und selbst wenn in den Industrieländern Impfstoffe zum Beispiel gegen Masern wirksam eingesetzt werden können, verhindern technische und wirtschaftliche Probleme unter Umständen eine breite Anwendung in den Entwicklungsländern, in denen die Sterberate bei diesen Krankheiten immer noch hoch ist.

Die Methoden der modernen Immunologie und der Molekularbiologie werden eingesetzt, um neue Impfstoffe zu entwickeln und die alten zu verbessern; Kap. 10.1007/978-3-662-56004-4_16 befasst sich mit den Fortschritten auf diesen Gebieten. Die Aussicht auf eine Bekämpfung dieser gravierenden Krankheiten ist ausgesprochen erfreulich. Eine gute Gesundheitsversorgung ist ein entscheidender Schritt in Richtung einer Kontrolle des Bevölkerungswachstums und einer wirtschaftlichen Entwicklung. Mit nur wenigen Cent pro Person lassen sich viel Not und Leid lindern.
Viele gefährliche Krankheitserreger haben den Bemühungen widerstanden, Impfstoffe gegen sie zu entwickeln, häufig weil sie den Schutzmechanismen der adaptiven Immunantwort ausweichen können oder sie unterlaufen. In Kap. 10.1007/978-3-662-56004-4_13 untersuchen wir einige Ausweichstrategien von erfolgreichen Krankheitserregern. Die Überwindung von vielen weltweit vorherrschenden Krankheiten wie auch die neuere Bedrohung durch AIDS hängt davon ab, dass wir die Krankheitserreger, die die Erkrankungen verursachen, und ihre Wechselwirkungen mit dem Immunsystem besser kennenlernen.
Zusammenfassung
Die Reaktionen auf eine Infektion lassen sich verschiedenen Effektormodulen zuordnen, die gegen unterschiedliche Lebensweisen von Krankheitserregern gerichtet sind. Sensorzellen der angeborenen Immunität, die eine Infektion erkennen, erzeugen Mediatoren, die angeborene lymphatische Zellen (ILCs) und T-Zellen aktivieren, die wiederum die Immunantwort verstärken und auch verschiedene Effektormodule in Gang setzen. Zu den angeborenen lymphatischen Zellen gehören unterschiedliche Untergruppen, die verschiedene Cytokine produzieren und diverse Effektormodule aktivieren. T-Zellen umfassen zwei Hauptklassen, die auf der Expression der Corezeptoren CD8 und CD4 basieren. Diese T-Zellen erkennen Antigene, die von MHC-Klasse-I- beziehungsweise MHC-Klasse-II-Proteinen präsentiert werden. Diese Untergruppen der T-Zellen unterstützen wie die entsprechenden ILCs außerdem die Aktivitäten der einzelnen Effektormodule. NK-Zellen und CD8-T-Zellen können eine cytotoxische Wirkung entfalten und so gegen intrazelluläre Infektionen, beispielsweise durch Viren, aktiv vorgehen. Andere Untergruppen der angeborenen lymphatischen Zellen und der T-Helferzellen können Mediatoren freisetzen, die weitere Effektorfunktionen aktivieren, welche gegen intrazelluläre Bakterien, extrazelluläre Bakterien und Pilze sowie gegen Parasiten gerichtet sind. T-Zellen geben auch Signale, die die Regulation der B-Zellen unterstützen und diese stimulieren, Antikörper zu produzieren. Spezifische Antikörper führen zur Bekämpfung und Beseitigung von löslichen Toxinen und extrazellulären Krankheitserregern. Sie interagieren nicht nur mit den Toxinen oder Antigenen auf Mikroorganismen, sondern auch über ihre Fc-Region mit spezifischen Rezeptoren, die viele Arten von Phagocyten exprimieren. Phagocyten produzieren außerdem Rezeptoren für Komplementproteine, die sich an die Oberfläche von Mikroorganismen heften, besonders in Gegenwart von Antikörpern.
Ein Versagen der Immunität kann durch genetische Defekte oder Infektionen hervorgerufen werden, die wichtige Komponenten des Immunsystems angreifen. Fehlgeleitete Immunreaktionen können Körpergewebe zerstören, etwa bei einer Autoimmunität oder Allergie, oder auch zum Versagen transplantierter Organe führen. Während die Impfung weiterhin die wichtigste Methode der Immunologie ist, um Krankheiten zu bekämpfen, sind durch die moderne Forschung neue Instrumente hinzugekommen, etwa die monoklonalen Antikörper, die in den vergangenen zwei Jahrzehnten für Therapien immer wichtiger geworden sind.
Kapitelzusammenfassung
Das Immunsystem verteidigt den Organismus gegen Infektionen. Die angeborene Immunität dient der ersten Abwehr. Sie kann jedoch Krankheitserreger nicht spezifisch erkennen und auch keinen gezielten Schutz gegen eine erneute Infektion entwickeln. Die adaptive (erworbene) Immunität basiert auf der klonalen Selektion von Lymphocyten, die eine Vielzahl hochspezifischer Rezeptoren besitzen, aus einem bestehenden Repertoire. Dadurch kann das Immunsystem jedes beliebige fremde Antigen erkennen. Bei der adaptiven Immunantwort vermehren sich die antigenspezifischen Lymphocyten und differenzieren sich zu Effektorzellen, welche die Krankheitserreger vernichten. In Abb. 1.7 sind die Phasen der Immunantwort und ihre ungefähre zeitliche Abfolge dargestellt. Die Immunabwehr benötigt unterschiedliche Erkennungssysteme und ein breites Spektrum an Effektormechanismen, um Krankheitserreger, die in großer Vielfalt überall im Körper und an dessen Oberfläche vorkommen können, aufzufinden und zu zerstören. Die adaptive Immunantwort kann nicht nur Krankheitserreger beseitigen. Sie erzeugt gleichzeitig durch klonale Selektion eine erhöhte Zahl ausdifferenzierter Gedächtniszellen. Dies ermöglicht bei einer erneuten Infektion eine schnellere und wirksamere Reaktion. Immunantworten regulieren zu können – das heißt, sie zu unterdrücken, wenn sie unerwünscht sind, oder sie zur Vorbeugung einer Infektionskrankheit zu stimulieren – ist das wichtigste medizinische Ziel der immunologischen Forschung.
Aufgaben
1.1 Multiple Choice
Welches der folgenden Beispiele beschreibt den Vorgang der Impfung?
-
A.
Eine Person wird mit Kuhpocken infiziert, um sie vor den Pocken zu schützen.
-
B.
Man verabreicht einer ansteckungsgefährdeten Person Serum aus einem Tier, das gegen Diphtherie immun ist, um die Person vor dem Diphtherietoxin zu schützen.
-
C.
Eine Infektion durch Bakterien, die zur Aktivierung des Komplementsystems führt, wodurch die Krankheitserreger beseitigt werden.
-
D.
Eine Person erkrankt an Windpocken, entwickelt diese Krankheit danach allerdings nicht mehr, weil sich ein immunologisches Gedächtnis gebildet hat.
1.2 Multiple Choice
Welche der folgenden Definitionen beschreibt das immunologische Gedächtnis?
-
A.
Der Mechanismus, durch den ein Organismus verhindert, dass sich eine Immunreaktion gegen körpereigenes Gewebe entwickelt.
-
B.
Der Mechanismus, durch den ein Organismus verhindert, mit Mikroorganismen in Kontakt zu kommen.
-
C.
Das Fortbestehen pathogenspezifischer Antikörper und Lymphocyten, nachdem die ursprüngliche Infektion abgeklungen ist, wodurch eine erneute Infektion mit dem Krankheitserreger verhindert wird.
-
D.
Der Vorgang, durch den ein Krankheitserreger in der Anzahl verringert oder ganz beseitigt wird.
1.3 Richtig oder falsch
Toll-like-Rezeptoren (TLRs) erkennen intrazelluläre Bakterien, während NOD-like-Rezeptoren (NLRs) extrazelluläre Bakterien erkennen.
1.4 Bitte zuordnen
Welche der folgenden Zellen gehören zur lymphatischen, welche zur myeloischen Linie?
-
A.
eosinophile Zellen
-
B.
B-Zellen
-
C.
neutrophile Zellen
-
D.
NK-Zellen
-
E.
Mastzellen
-
F.
Makrophagen
-
G.
rote Blutkörperchen
1.5 Multiple Choice
Mit dem „schmutzigen kleinen Geheimnis“ des Immunologen ist gemeint, dass man Bestandteile von Mikroorganismen zusetzt, um eine starke Immunantwort gegen ein bestimmtes Proteinantigen hervorzurufen. Welche der folgenden Moleküle sind keine Rezeptoren und keine Rezeptorfamilie, die mikrobielle Produkte erkennen und eine starke Immunantwort auslösen können?
-
A.
Toll-like-Rezeptoren (TLRs)
-
B.
T-Zell-Antigenrezeptoren (TCRs)
-
C.
NOD-like-Rezeptoren (NLRs)
-
D.
Mustererkennungsrezeptoren (PRRs)
1.6 Richtig oder falsch
Hämatopoetische Stammzellen können sich zu jeder beliebigen Körperzelle entwickeln.
1.7 Bitte zuordnen
Welche der Aussagen 1–4 gehört zu welchem der Begriffe A–D?
| A. | Allergien ___ | 1. | Immunreaktion gegen ein Antigen, das sich auf einer transplantierten fremden Zelle befindet |
| B. | Immuntoleranz ___ | 2. | Immunreaktion gegen ein Antigen, das eine eingedrungene fremde Substanz ist |
| C. | Autoimmunkrankheit ___ | 3. | Immunprozess, der eine Immunreaktion auf körpereigene Antigene verhindert |
| D. | Transplantatabstoßung ___ | 4. | Immunreaktion gegen ein körpereigenes Antigen |
1.8 Multiple Choice
Welcher der folgenden Mechanismen dient nicht dazu, eine Immuntoleranz aufrechtzuerhalten?
-
A.
klonale Deletion
-
B.
Anergie
-
C.
klonale Expansion
-
D.
Unterdrückung autoreaktiver Lymphocyten
1.9 Bitte zuordnen
Welche der folgenden lymphatischen Organe sind als zentral/primär zu bezeichnen, welche als peripher/sekundär?
-
A.
Knochenmark
-
B.
Lymphknoten
-
C.
Milz
-
D.
Thymus
-
E.
Blinddarm
1.10 Bitte zuordnen
Welcher der folgenden Begriffe (Region, Struktur, Kompartiment) gehört zu welchem Organ?
| A. | Lymphknoten ___ | 1. | PALS-Region (PALS für periarteriolar lymphoid sheath) |
| B. | Milz ___ | 2. | Peyer-Plaques |
| C. | Schleimhaut des Dünndarms ___ | 3. | Venolen mit hohem Endothel |
1.11 Multiple Choice
Welches der folgenden Phänomene tritt bei einer Entzündung nicht auf?
-
A.
Freisetzung von Cytokinen
-
B.
Freisetzung von Chemokinen
-
C.
Rekrutierung von Zellen des angeborenen Immunsystems
-
D.
Verengung der Blutgefäße
1.12 Bitte ergänzen
T-Zellen können infizierte Zellen abtöten, während T-zellen andere Zellen des Immunsystems aktivieren.
1.13 Richtig oder falsch
Sowohl T- als auch B-Zell-Rezeptoren durchlaufen den Prozess der Affinitätsreifung, wodurch sie während einer Immunantwort eine höhere Affinität zu einem Antigen entwickeln.
1.14 Richtig oder falsch
Jeder Lymphocyt trägt Rezeptoren mit multipler Antigenspezifität an seiner Zelloberfläche.
1.15 Multiple Choice
Welcher Zelltyp bildet eine wichtige Verbindung zwischen der angeborenen und der adaptiven Immunantwort?
-
A.
dendritische Zellen
-
B.
neutrophile Zellen
-
C.
B-Zellen
-
D.
angeborene lymphatische Zellen (ILCs)
1.16 Multiple Choice
Welcher der folgenden Mechanismen hat nichts damit zu tun, dass ein Antikörper vor einem Krankheitserreger schützen kann?
-
A.
Neutralisierung
-
B.
Costimulation von T-Zellen
-
C.
Opsonisierung
-
D.
Aktivierung des Komplementsystems und Anlagerung seiner Komponenten
1.17 Richtig oder falsch
TH2-Zellen besitzen keine MHC-Klasse-I-Moleküle.
Literatur
Historischer Hintergrund
■ Burnet, F.M.: The Clonal Selection Theory of Acquired Immunity. London: Cambridge University Press, 1959.
■ Gowans, J.L.: The lymphocyte—a disgraceful gap in medical knowledge. Immunol. Today 1996, 17:288–291.
■ Landsteiner, K.: The Specificity of Serological Reactions, 3rd ed. Boston: Harvard University Press, 1964.
■ Metchnikoff, É.: Immunity in the Infectious Diseases, 1st ed. New York: Macmillan Press, 1905.
■ Silverstein, A.M.: History of Immunology, 1st ed. London: Academic Press, 1989.
Biologischer Hintergrund
■ Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., and Walter, P.: Molecular Biology of the Cell, 6th ed. New York: Garland Science, 2015.
■ Berg, J.M., Stryer, L., and Tymoczko, J.L.: Biochemistry, 5th ed. New York: W.H. Freeman, 2002.
■ Geha, R.S., and Notarangelo, L.D.: Case Studies in Immunology: A Clinical Companion, 7th ed. New York: Garland Science, 2016.
■ Harper, D.R.: Viruses: Biology, Applications, Control. New York: Garland Science, 2012.
■ Kaufmann, S.E., Sher, A., and Ahmed, R. (eds): Immunology of Infectious Diseases. Washington, DC: ASM Press, 2001.
■ Lodish, H., Berk, A., Kaiser, C.A., Krieger, M., Scott, M.P., Bretscher, A., Ploegh, H., and Matsudaira, P.: Molecular Cell Biology, 6th ed. New York: W.H. Freeman, 2008.
■ Lydyard, P., Cole, M., Holton, J., Irving, W., Porakishvili, N., Venkatesan, P., and Ward, K.: Case Studies in Infectious Disease. New York: Garland Science, 2009.
■ Mims, C., Nash, A., and Stephen, J.: Mims’ Pathogenesis of Infectious Disease, 5th ed. London: Academic Press, 2001.
■ Ryan, K.J. (ed): Medical Microbiology, 3rd ed. East Norwalk, CT: Appleton-Lange, 1994.
Lehrbücher für Fortgeschrittene, Kompendien und so weiter
■ Lachmann, P.J., Peters, D.K., Rosen, F.S., and Walport, M.J. (eds): Clinical Aspects of Immunology, 5th ed. Oxford: Blackwell Scientific Publications, 1993.
■ Mak, T.W., and Saunders, M. E.: The Immune Response: Basic and Clinical Principles. Burlington: Elsevier/Academic Press, 2006.
■ Mak, T.W., and Simard, J.J.L.: Handbook of Immune Response Genes. New York: Plenum Press, 1998.
■ Paul, W.E. (ed): Fundamental Immunology, 7th ed. New York: Lippincott Williams & Wilkins, 2012.
■ Roitt, I.M., and Delves, P.J. (eds): Encyclopedia of Immunology, 2nd ed. (4 vols.). London and San Diego: Academic Press, 1998.
Contributor Information
Kenneth Murphy, Email: Lydia.lundbeck@springer.com.
Casey Weaver, Email: lydia.lundbeck@springer.com.
Collaborators: Lothar Seidler