Abstract
Neben der jährlich saisonal auftretenden Influenzaendemie stellt das sich pandemisch verbreitende SARS-CoV-2-Virus die weltweiten Gesundheitssysteme als vaskuläre Multiorganerkrankung COVID-19 vor ganz neue medizinische und sozioökonomische Herausforderungen. Bei beiden Viruserkrankungen kommt es insbesondere bei schweren Krankheitsverläufen zu einem fulminanten Lungenversagen, dem „acute respiratory distress syndrome“ (ARDS), welchem morphologisch meist ein unspezifischer diffuser Alveolarschaden mit hyalinen Membranen, Fibrinexsudaten und einem intraalveolären Ödem zugrunde liegt. Neben einer Infektion des Alveolarepithels und von Makrophagen durch das SARS-CoV-2-Virus scheint die COVID-19-Erkrankung zusätzlich durch eine vaskulozentrische Entzündungsreaktion mit Mikroangiopathie und aberranter Blutgefäßneubildung durch die sog. intussuszeptive Angiogenese charakterisiert zu sein. Zudem finden sich wahrscheinlich auf dem Boden dieser primär systemischen angiozentrischen Entzündung in vielen weiteren Organen, z. B. dem Herzen, im unterschiedlichen Ausmaß Gewebeschädigungen.
Schlüsselwörter: Humane Influenza, Pneumonie, Lungenversagen, SARS-CoV‑2, Angiogenese
Abstract
Viral respiratory diseases constitute the most common reasons for hospitalization with more than half of all acute illnesses worldwide. Progressive respiratory failure with pronounced diffuse alveolar damage has been identified as the primary cause of death in COVID-19. COVID-19 pneumonia shares common histopathological hallmarks with influenza (H1N1)-related ARDS, like diffuse alveolar damage (DAD) with edema, hemorrhage, and intra-alveolar fibrin deposition. The lungs with COVID-19 pneumonia revealed perivascular inflammation, an endothelial injury, microangiopathy, and an aberrant blood vessel neoformation by intussusceptive angiogenesis. While this pronounced angiocentric inflammation is likely be found – to varying degrees – in numerous other organs, e.g., the heart, COVID-19 is hypothesized to be not just a pulmonary, but rather a systemic “vascular disease.”
Keywords: Human influenza, Pneumonia, Respiratory distress syndrome, SARS-CoV‑2, Angiogenesis
Corona- und Influenzaviren – 2 ungleiche Geschwister
Virale Atemwegserkrankungen stellen mit mehr als der Hälfte aller akuten Krankheitsfälle weltweit die häufigsten Hospitalisierungsgründe dar. Jedes Jahr kommt es weltweit in 5–15 % der Bevölkerung zu saisonalen, influenzabedingten Infektionen der Atemwege, welche bei schwerem Verlauf mit einer erheblichen Mortalität assoziiert sind und weltweit nach Schätzungen der WHO für mindestens 3–5 Mio. Todesfälle verantwortlich sind [1]. Die Dunkelziffer dürfte hierbei allerdings erheblich höher sein, da in den meisten Fällen keine virologische Testung erfolgt und die Erregerdiagnostik trotz verbesserter Nachweisverfahren bei viralen Atemwegsinfektionen häufig nicht zu einem spezifischen Nachweis führt.
Die schwersten pandemischen Ausbrüche, wie z. B. die Spanische Grippe 1918/1919, welche Schätzungen zufolge bis zu 50 Mio. Menschen das Leben gekostet hat, treten ungefähr alle 10 bis 15 Jahre auf und werden meist durch das Influenza-A-Virus ausgelöst. Influenzaviren gehören zur Familie der Orthomyxoviridiae und werden anhand ihrer Kapselantigene Hämagglutinin (H) und Neuramidase (N) in die Substämme Influenza A, B und C unterteilt. Saisonale Antigenveränderungen führen über einen „antigen drift“ oder „antigen shift“ zu teils nur geringgradigen Veränderungen und Sprüngen der Oberflächenantigenstrukturen, welche aber trotzdem mutmaßlich allen großen Pandemiewellen vorausgehen, v. a. wenn es zu einem Genrearrangement zwischen humanen und tierpathogenen Viren kommt.
Viele Studien legen nahe, dass auch ein solcher evolutionärer „antigen shift“ Ursprung des von der Weltgesundheitsorganisation WHO als globale Pandemie eingestuften SARS-CoV-2-Ausbruchs anzusehen ist [2]. Nach Beschreibung von schweren, zunächst unklaren Pneumonien in Wuhan in China im Dezember 2019 wurde nach Sequenzierung das SARS-CoV-2-Virus phylogenetisch der Familie der Coronaviren zugeordnet. Bei den Coronaviridae handelt es sich um Einzelstrang-RNA-Viren mit einem Durchmesser von 80–120 nm, welche schon für die SARS-CoV-1-Epidemie 2003 und den epidemischen Ausbruch von MERS-CoV im Jahr 2013 verantwortlich waren. Das aktuelle SARS-CoV-2-Virus weist allerdings im Vergleich zu SARS-CoV‑1 und MERS-CoV eine höhere Reproduktionsrate bei gleichzeitig geringerer Mortalität auf. Wie bei nahezu allen Coronaviren besteht ein ausgeprägter Tropismus für den ACE(Angiotensin-konvertierendes Enzym)-Rezeptor 2, der neben dem Epithel des oberen und unteren Respirationstraktes unter anderem auch auf Endothelien und den Epithelien viszeraler Organe zu finden ist. Obgleich bei schweren Verläufen die SARS-CoV-2-Pneumonie zu einem akuten Lungenversagen führen kann, zeigen sich bei vielen Patienten in unterschiedlicher Häufigkeit auch andere Organmanifestationen in Herz, Niere, Gehirn und Leber, sodass man bei COVID-19 von einer vaskulären Multiorganerkrankung sprechen kann [3, 4].
COVID-19 wird häufig mit einer schweren Influenza verglichen und bei bis zu 20 % der Patienten mit SARS-CoV-2-Infektion werden schwere Verläufe beobachtet, die eine intensivmedizinische Versorgung im Rahmen eines „acute respiratory distress syndrome“ (ARDS, akutes Lungenversagen) erforderlich machen [5]. In schweren Fällen kommt es bei beiden Erkrankungen zu einem akuten Lungenversagen, welches mit einer Störung des pulmonalen Gasaustausches einhergeht und häufig eine mechanische Beatmung erforderlich macht. Allerdings zeigt COVID-19 interessanterweise keine klinischen Merkmale eines „typischen“ ARDS, wie es anästhesiologisch gemäß der Berlin-Kriterien (u. a. verminderte Lungencompliance, Horovitz-Quotient aus arteriellem Sauerstoff-Partialdruck [PaO2] und der inspiratorischen Sauerstofffraktion [FiO2], bilaterale Verdichtungen im CT) klassifiziert wurde, da viele Patienten trotz signifikanter Hypoxämie keine Dyspnoesymptomatik aufweisen und mechanische Compliancewerte im Normbereich zeigen. Es wird vermutet, dass hier die respiratorische Insuffizienz über eine Umverteilung der Ventilation und Perfusion kompensiert wird. Pathophysiologisch kann dies durch den Euler-Liljestrand-Mechanismus erklärt werden, bei dem es wechselseitig zu einer reflektorischen Vasokonstriktion der pulmonalarteriellen Strombahn und Hypoventilation der Lungenläppchen kommt.
COVID-19-Pneumonie
Der Verlauf eines klassischen ARDS folgt meist 3 Phasen:
exsudative Phase (Tag 1–3 post infectionem),
proliferative Phase (bis zu einer Woche nach Infektion),
fibrotisches Remodeling (ab Tag 7 bis 10 post infectionem).
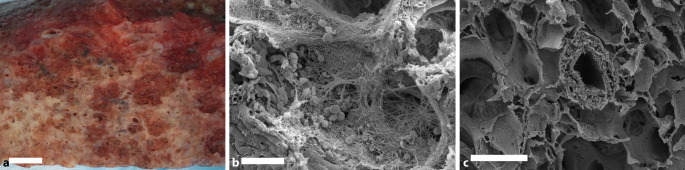
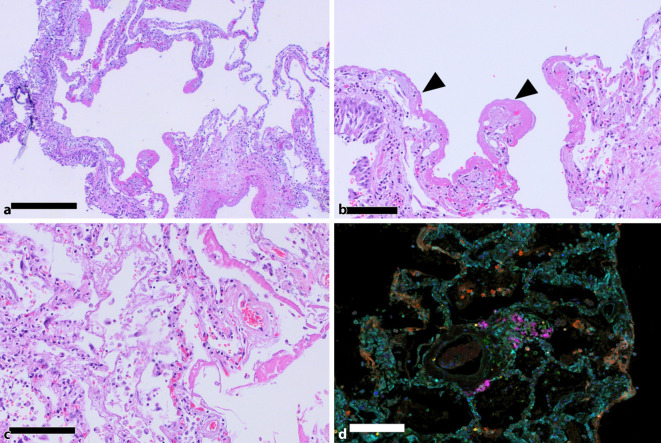
Auch wenn die COVID-19-Pneumonie in ihren initialen Phasen Ähnlichkeiten zu anderen viralen Atemwegserkrankungen aufweist, sind jedoch im weiteren Verlauf Unterschiede zu beobachten. In der Akutphase (bis zum 10. Tag post infectionem) kommt es zu einer serofibrinösen Entzündungsreaktion in Form einer exsudativen Alveolitis durch progrediente Schädigung der Pneumozyten und Kapillarendothelien [3]. Durch die Destruktion der alveolokapillären Membran, die Freisetzung von Entzündungsmediatoren im Rahmen des Zytokinsturms und eine erhöhte vaskuläre Permeabilität wird ein überwiegend interstitielles, teils im schwerem Verlauf auch intraalveoläres Ödem ausgelöst, welches die autoptisch durchweg erhöhten postmortalen Lungengewichte von COVID-19 von kombiniert meist über 2 kg erklärt (Abb. 1; [3, 6, 7]). Das histopathologische Korrelat des klinisch meist als todesursächlich beschriebenen akuten Lungenversagens stellt ein unspezifischer diffuser Alveolarschaden dar, der insbesondere durch hyaline Membranen, interstitielle Ödembildung, Einblutungen und intraalveoläre Fibrinablagerungen (Abb. 1) charakterisiert ist. In der Spätphase kommt es bei der anhaltenden Schädigung zu Mikro- und Makroatelektasen, einer Hyperplasie der Typ-2-Pneumozyten sowie im Interstitium herdförmig zur Ansammlung von Myofibroblasten (Abb. 2). Diese morphologischen Schädigungsmuster sind allerdings nicht pathognomonisch für die COVID-19-Pneumonie, sondern werden auch bei anderen Lungenerkrankungen, wie z. B. bei der Influenzapneumonie, vorgefunden [3].
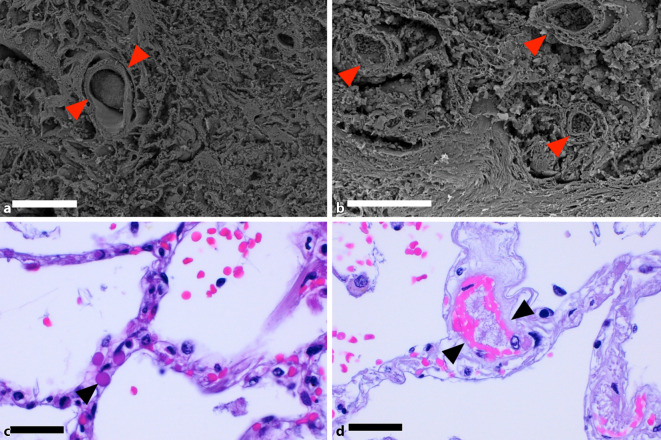
Neben der komplexen Schädigung des Alveolarepithels hebt sich die COVID-19-Pneumonie insbesondere durch die ausgeprägte angiozentrische Inflammation von anderen Pneumonien ab (Abb. 2). SARS-CoV‑2 kann über virale Spikeproteine (Spike Glykoprotein S1 der Rezeptorbindungsdomäne) an die Bindungsstelle des Rezeptors von ACE2 sowie an den Korezeptor Neuropilin‑1 binden, welches in der Lunge neben Alveolar- und Bronchusepithel und Makrophagen insbesondere auf Endothelzellen und Perizyten exprimiert wird (Abb. 3; [3]). Nach Eintritt von SARS-CoV‑2 in die Wirtszelle kommt es in kürzester Zeit zu einer viralen Replikation im endoplasmatischen Retikulum, der Assemblierung mit viralen Strukturproteinen und der Exozytose aus der Wirtszelle, was eine ausgeprägte Virämie ab ca. dem 5. Tag nach Infektion zur Folge hat. Neben einer direkten apoptotischen Schädigung durch die Replikation von SARS-CoV‑2 kommt es ebenfalls zu einer adaptiven und T‑Zell-vermittelten Immunreaktion. In eigenen morphometrischen Untersuchungen [3] konnten wir mittels Multiplex-Immunofluoreszenzanalyse eine annähernd gleich dichte Infiltration CD3-positiver T‑Zellen im Interstitium von Lungengewebe COVID-19- oder Influenza-Verstorbener feststellen (Abb. 2). Während jedoch in den Influenzaproben vermehrt zytotoxische, CD8-positive T‑Lymphozyten und CD15-positive, neutrophile Granulozyten nachweisbar waren, zeigte sich in der COVID-19-Pneumonie vorwiegend eine perivaskuläre Akkumulation von CD4-positiven T‑Helferzellen (Abb. 2). Die ausgeprägte perivaskuläre T‑Zell-vermittelte Entzündung bzw. Endothelialitis korreliert mit der klinischerseits häufig beschriebenen Leukopenie, die sich vorwiegend bei schweren Krankheitsverläufen manifestiert [8]. Die Wechselwirkung zwischen aktivierten T‑Zellen und Endothelzellen scheint zum prolongierten interstitiellen Entzündungsverlauf bei COVID-19 beizutragen [9], da aktivierte T‑Zellen eine starke Adhärenz an Endothelzellen aufweisen, welche vorwiegend über die Sekretion von chemotaktischen Chemokinen vermittelt wird. Darüber hinaus exprimieren entzündlich aktivierte Endothelzellen vermehrt Toll-like-Rezeptoren und MYD88 als wichtige Regulatoren des angeborenen Immunsystems. Diese setzen bei Aktivierung vermehrt proinflammatorische Zytokine (wie z. B. Interferone, TNF-α), Gefäßzelladhäsionsmoleküle (z. B. E‑Selektin, ICAM1, VCAM), prokoagulante Mediatoren (wie z. B. Fibrin, Von-Willebrand-Faktor) und proangiogene Wachstumsfaktoren frei [10]. SARS-CoV-2-assoziierte Endothelschädigungen und Endothelialitis verursachen in Konsequenz der Schädigung eine überschießende Thrombin- und Fibrinfreisetzung, was die in der Pandemie klinisch sehr früh beschriebenen Thrombembolien in mittelgroßen Gefäßen (Abb. 4) und im Kapillarendstromgebiet (Abb. 4) erklärbar macht. Insgesamt fanden wir 9‑mal mehr Mikrothromben in COVID-19-Lungen als bei H1N1-Pneumonien [3]. Neben dieser thrombotischen Mikroangiopathie kann sich in schweren Verläufen zusätzlich noch eine disseminierte intravasale Gerinnung (DIC) entwickeln und es können Immunthromben auftreten [11]. Hierbei kommt es zur Rekrutierung von neutrophilen Granulozyten, die über eine Aktivierung von reaktiven Sauerstoffspezies (ROS) eine Vielzahl ihrer Enzyme, Chromatin sowie knäuelförmige DNA freisetzen. Diese vor einem Jahrzehnt entdeckte Immunantwort der „neutrophil extracellular traps“ (NET) bildet somit eine Art „immunologisches Fangnetz“ für Bakterien, Viren und Parasiten, welche über die freigelegten Enzyme enzymatisch degradiert werden.
Endotheliale Dysfunktion und Angiogenese
Das komplexe Blutgefäßsystem des Körpers, welches sich in seiner Länge über eine Gesamtdistanz von weit mehr als 100.000 km erstreckt, stellt nicht nur ein elementares Versorgungsnetzwerk des Körpers dar, sondern bildet mit einem Gesamtgewicht von mehr als 2 kg meist vasoaktiver Endothelzellen eines der größten stoffwechselaktiven Gewebe des Organismus [9]. Im Verlauf der COVID-19-Pandemie wurden klinisch sehr früh neben den pulmonalen Manifestationen auch weitere Gefäßbeteiligungen mit anderen Endorganschädigungen, wie z. B. akutes Nierenversagen, beschrieben [12]. Die SARS-CoV-2-assoziierte Funktionsstörung der Endothelzellen scheint bei der Pathogenese dieser schweren klinischen Manifestationen in COVID-19 [3, 9, 12] von zentraler Bedeutung zu sein. Der zelluläre Eintritt von SARS-CoV‑2 wird wie bei anderen SARS-Viren zum großen Teil über den ACE2-Rezeptor vermittelt, der auch von Endothelzellen in Lunge und Niere exprimiert wird [12]. Die in praktisch allen Organen vorkommende Expression von ACE2 auf Endothelzellen, glatten Muskelzellen und perivaskulären Perizyten legt nahe, dass sich SARS-CoV‑2, sobald es im Kreislauf vorhanden ist, leicht im Körper ausbreiten kann [13]. Für einen schweren Verlauf einer COVID-19-Pneumonie werden zumeist als Risikofaktoren das Vorliegen einer Arteriosklerose oder Diabetes mellitus diskutiert, denen beide jeweils eine Mikro- und Makroangiopathie mit vorgeschädigtem Endothel zugrunde liegt. Nach Infektion der Alveolarepithelzellen und der Endothelzellen kommt es zur intrazellulären viralen Replikation im endoplasmatischen Retikulum [15–17]. Gleichermaßen unterliegen Zellbestandteile, wie z. B. Zellmembran, Golgi-Apparat oder Mitochondrien, sowie das Zytoskelett virolytischen Veränderungen und Umbauvorgängen [15, 16]. Nach mehrfacher Replikation und Ausschleusung der Viruspartikel aus der Zelle [17] kommt es zur Apoptose [15, 16]. Die apoptotische Endothelzelle [14, 15] löst sich durch Aufklaffen der engen Zellkontakten, wie z. B. über „tight junctions“, Desmosomen und Hemidesmosomen, von den Nachbarzellen und der Basalmembran. Zusätzlich führt die Freisetzung von Zytokinen zum Vascular-Leak-Syndrom, bei dem es durch die erhöhte Permeabilität zu einem interstitiellen bzw. intraalveolären Ödem kommt.
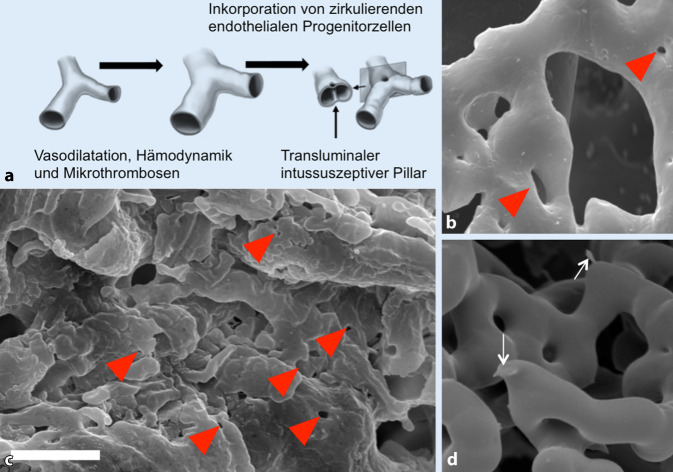
Das ubiquitär geschädigte Endothel unterliegt einem Reparaturmechanismus, der vorwiegend über die Angiogenese bewerkstelligt wird. Die Blutgefäßneubildung kann grundsätzlich auf 2 Arten erfolgen: Bei der sprossenden Angiogenese („sprouting angiogenesis“) kommt zur Proliferation von Endothelzellen aus einem existenten Kapillarbett entlang eines Wachstumsfaktorgradienten (z. B. VEGF oder FGF). Dieser morphogenetische Prozess nimmt teils mehrere Tage in Anspruch. Bei der intussuszeptiven Angiogenese („intussusceptive angiogenesis“; Abb. 3) erfolgt hingegen der Umbau und die Expansion des Gefäßbaumes im Gegensatz zur sprossenden Angiogenese ohne Proliferation von Endothelzellen, sondern durch Rekrutierung und Inkorporation von zirkulierenden Progenitorzellen [18]. Die Expansion des Gefäßsystems mittels Intussuszeption tritt dabei überwiegend im venösen Gefäßschenkel oder im Kapillarbett auf. Das morphologische Korrelat dieser endothelialen Invagination bilden transluminale Gewebesäulen („pillars“), die in den entsprechenden Gefäßausgusspräparaten in der Rasterelektronenmikroskopie als kleine Löcher mit einem Durchmesser von 1–2 µm imponieren (Abb. 3). Durch eine Endothelprotrusion entsteht eine intraluminale Gewebefalte, die sich über Myofibroblasten und Perizyten lumenwärts einstülpt, bis sich die beiden gegenüberliegenden Gewebeschichten berühren. Es kommt zur Verschmelzung und Fusion der beiden Membranen der Endothelzellen, bis dies in eine komplette Septierung der neu entstandenen Gefäße mündet. Gleichermaßen werden zirkulierende endotheliale Progenitorzellen bei der Integration in die Gefäßwand beschrieben [18]. Diese zirkulierenden Vorläuferzellen exprimieren unter anderem Merkmale von endothelialen Antigenen, wie z. B. CD34, CD133 und VEGFR‑2, und weisen phänotypische Ähnlichkeiten zu ausgereiften Endothelzellen auf.
Die intussuszeptive Angiogenese tritt bei normalen Entwicklungsprozessen sowie bei vielen pathologischen Zuständen wie Geweberegeneration [19], Entzündung bei Kolitis [20], Myokarditis [21], interstitiellen Lungenerkrankungen [22] und Tumoren [23] auf. Die von uns im Gefäßsystem von COVID-19 beschriebene Neoangiogenese mittels Intussuszeption scheint somit ein aberranter Reparaturmechanismus als Antwort auf die latente endotheliale Schädigung und die hämodynamische Mikroangiopathie zu sein. Die überschießenden Reparaturmechanismen wurden in der Lunge ebenfalls bei vielen Formen interstitieller Lungenerkrankungen beschrieben. So zeigten wir die Bedeutung der intussuszeptiven Angiogenese insbesondere bei den morphologischen Subtypen der nichtspezifischen interstitiellen Pneumonie (NSIP) und der alveolären Fibroelastose (AFE) [22], aber auch in Formen der pulmonalen Hypertonie und bei pulmonalen venookklusiven Erkrankungen auf [24]. Obgleich die molekularen Mechanismen, die dem fibrotischen Umbau nach Mikrothrombembolien zugrunde liegen, noch unzureichend verstanden sind, legen die bisherigen Ergebnisse eine entscheidende Rolle der endothelial-mesenchymalen Transition nahe, zumal die Lunge neben der Leber und dem Knochenmark ein Reservoir von endothelialen Progenitorzellen zu sein scheint [25]. Eine besondere Rolle wird residualen und zirkulierenden endothelialen Progenitorzellen in der Rekonvaleszenzphase von Patienten mit Heilungsverlauf nach akutem Lungenversagen oder bei bakterieller Pneumonie zugeschrieben [26, 27].
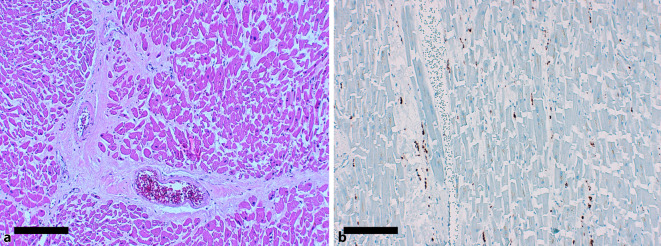
Kardiovaskuläre Beteiligung
Auch wenn bei COVID-19 die respiratorischen Einschränkungen akutmedizinisch die maßgebliche klinische Herausforderung darstellen, lassen sich bei zahlreichen COVID-19-Patienten im Laufe der Erkrankung auch kardiovaskuläre Komplikationen feststellen [24]. Klinisch wird diese kardiale Mitbeteiligung meist über eine akute Erhöhung der Troponinspiegel evident, welche bei ungefähr jedem zehnten hospitalisierten Patienten beobachtet wird und die wahrscheinlich in einem direkten Zusammenhang mit einer erhöhten Mortalität anzusehen ist [28]. Als Ursache für diese myokardiale Schädigung wird ein möglicher direkter toxischer Effekt über eine aberrante systemische Freisetzung von Chemokinen (wie z. B. TNF‑α, SDF1, CCL2, CCL3 oder CXCL10), Interferonen und Interleukinen (wie z. B. Interleukin 6) im Rahmen des sog. Zytokinsturmes diskutiert [29]. Auch wenn kardiovaskuläre Vorerkrankungen als Risikofaktor für einen schweren Verlauf der COVID-19-Erkrankung angesehen werden, könnte auch eine direkte Schädigung des Myokards durch die SARS-CoV-2-Virämie ursächlich sein. Untermauert wird diese Hypothese von einer Studie an Autopsien, die im Herzmuskelgewebe eine direkte Replikation von SARS-CoV‑2 nachweisen konnte. Erstaunlicherweise wurde in Studien aber überwiegend die Replikation des Virus in interstitiellen Zellen wie Makrophagen beobachtet. In einer weiteren Autopsiestudie wurde in über 85 % der Fälle rechts- wie auch linksventrikulär eine diffuse Infiltration durch CD68+-positive Makrophagen beschrieben. Pathognomonisch ist die diffuse Makrophageninfiltration für COVID-19 (Abb. 5) aber nicht, da diese u. a. auch häufig, z. B. bei Verstorbenen, im Rahmen einer bakteriellen Sepsis gesehen wird und über die systemischen Spiegel von proinflammatorischen Zytokinen erklärt werden kann [28, 29]. In einem weitaus kleineren Anteil von Patienten wird eine äußerst seltene lymphozytäre Myokarditis beobachtet, welche multifokal eine Expression von CD3+-T-Lymphozyten aufweist und keine Riesenzellen, Granulome oder Eosinophilie beinhaltet. Fallstudien, die von einem fulminanten Verlauf einer Myokarditis oder von Takotsubo-Kardiomyopathien berichten, scheinen Einzelfälle zu sein, die nicht unbedingt in direkten kausalen Zusammenhang zu einer SARS-CoV-2-Infektion stehen [28, 29]. Fulminante Myokarditisverläufe, wie sie nach anderen viralen Atemwegserkrankungen, wie z. B. Influenza-[30] oder Parvovirus-B19-Infektionen, [21] gefunden werden, scheint es im Verlauf der COVID-19-Erkrankung nicht in vergleichbarem Umfang zu geben.
Fazit für die Praxis
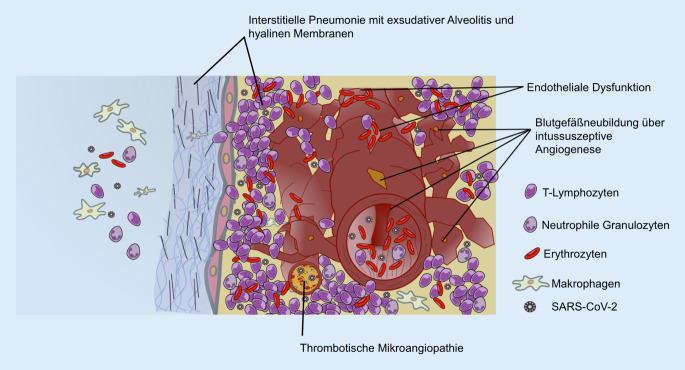
COVID-19 und Influenza führen im Erkrankungsverlauf beide zu einem diffusen Alveolarschaden mit exsudativer Alveolitis und Organisationsphänomenen wie einer organisierenden Pneumonie (Abb. 6)
COVID-19 stellt eine vaskuläre Systemerkrankung dar und weist im Rahmen der Infektion der Alveolarepithelzellen ebenso eine prominente Gefäßbeteiligung im Sinne einer Endothelialitis mit systemischer thrombotischer Mikroangiopathie auf (Abb. 6).
Diese angiozentrische Entzündung induziert einen aberranten Reparaturmechanismus mit Gefäßneubildung mittels intussuszeptiver Angiogenese (Abb. 6).
COVID-19 führt in schwerwiegenden Verläufen auch zu kardiovaskulären Schädigungen, die in ihrem vollen Umfang noch unverstanden sind und meist durch eine diskrete Infiltration von Makrophagen und wenigen T‑Lymphozyten charakterisiert sind.
Acknowledgments
Förderung
Diese Arbeit wurde unterstützt durch das Deutsche Register für COVID-19 Obduktionen (DeRegCOVID, www.DeRegCOVID.ukaachen.de; finanziert durch das Bundesministerium für Gesundheit – ZMVI1-2520COR201) und das Bundesministerium für Bildung und Forschung im Rahmen des Netzwerkes Universitätsmedizin (DEFEAT PANDEMIcs, 01KX2021). Grants: PD Dr. Maximilian Ackermann: National Institutes of Health (HL94567 and HL134229); Prof. Dr. Danny Jonigk: European Research Council consolidation Grants (XHale; 771883, D3)
Einhaltung ethischer Richtlinien
Interessenkonflikt
M. Ackermann, C. Werlein, F. Länger, M. P. Kühnel und D. D. Jonigk geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Contributor Information
Maximilian Ackermann, Email: maximilian.ackermann@helios-gesundheit.de, http://www.intussusception.org.
Danny D. Jonigk, Email: Jonigk.Danny@MH-Hannover.de.
Literatur
- 1.Forum of International Respiratory Societies . The global impact of respiratory disease. 2. Sheffield: European Respiratory Society; 2017. [Google Scholar]
- 2.Boni MF, Lemey P, Jiang X, Lam TT, Perry BW, Castoe TA, Rambaut A, Robertson DL. Evolutionary origins of the SARS-CoV-2 sarbecovirus lineage responsible for the COVID-19 pandemic. Nat Microbiol. 2020;5(11):1408–1417. doi: 10.1038/s41564-020-0771-4. [DOI] [PubMed] [Google Scholar]
- 3.Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, Vanstapel A, Werlein C, Stark H, Tzankov A, Li WW, Li VW, Mentzer SJ, Jonigk D. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120–128. doi: 10.1056/NEJMoa2015432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Gupta A, Madhavan MV, Sehgal K, Nair N, Mahajan S, Sehrawat TS, Bikdeli B, Ahluwalia N, Ausiello JC, Wan EY, Freedberg DE, Kirtane AJ, Parikh SA, Maurer MS, Nordvig AS, Accili D, Bathon JM, Mohan S, Bauer KA, Leon MB, Krumholz HM, Uriel N, Mehra MR, Elkind MSV, Stone GW, Schwartz A, Ho DD, Bilezikian JP, Landry DW. Extrapulmonary manifestations of COVID-19. Nat Med. 2020;26(7):1017–1032. doi: 10.1038/s41591-020-0968-3. [DOI] [PubMed] [Google Scholar]
- 5.Ortiz-Prado E, Simbaña-Rivera K, Gómez-Barreno L, Rubio-Neira M, Guaman LP, Kyriakidis NC, Muslin C, Jaramillo AMG, Barba-Ostria C, Cevallos-Robalino D, Sanches-SanMiguel H, Unigarro L, Zalakeviciute R, Gadian N, López-Cortés A. Clinical, molecular, and epidemiological characterization of the SARS-CoV-2 virus and the Coronavirus Disease 2019 (COVID-19), a comprehensive literature review. Diagn Microbiol Infect Dis. 2020;98(1):115094. doi: 10.1016/j.diagmicrobio.2020.115094. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Lax SF, Skok K, Zechner P, Kessler HH, Kaufmann N, Koelblinger C, Vander K, Bargfrieder U, Trauner M. Pulmonary arterial thrombosis in COVID-19 with fatal outcome : results from a prospective, single-center, clinicopathologic case series. Ann Intern Med. 2020;173(5):350–361. doi: 10.7326/M20-2566. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kommoss FKF, Schwab C, Tavernar L, Schreck J, Wagner WL, Merle U, Jonigk D, Schirmacher P, Longerich T. The pathology of severe COVID-19-related lung damage. Dtsch Arztebl Int. 2020;117(29-30):500–506. doi: 10.3238/arztebl.2020.0500. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Terpos E, Ntanasis-Stathopoulos I, Elalamy I, Kastritis E, Sergentanis TN, Politou M, Psaltopoulou T, Gerotziafas G, Dimopoulos MA. Hematological findings and complications of COVID-19. Am J Hematol. 2020;95(7):834–847. doi: 10.1002/ajh.25829. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Ackermann M, Mentzer SJ, Kolb M, Jonigk D. Inflammation and intussusceptive angiogenesis in COVID-19: everything in and out of flow. Eur Respir J. 2020 doi: 10.1183/13993003.03147-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Khakpour S, Wilhelmsen K, Hellman J. Vascular endothelial cell Toll-like receptor pathways in sepsis. Innate Immun. 2015;21(8):827–846. doi: 10.1177/1753425915606525. [DOI] [PubMed] [Google Scholar]
- 11.Leppkes M, Knopf J, Naschberger E, Lindemann A, Singh J, Herrmann I, Stürzl M, Staats L, Mahajan A, Schauer C, Kremer AN, Völkl S, Amann K, Evert K, Falkeis C, Wehrfritz A, Rieker RJ, Hartmann A, Kremer AE, Neurath MF, Muñoz LE, Schett G, Herrmann M. Vascular occlusion by neutrophil extracellular traps in COVID-19. EBioMedicine. 2020;58(2020):102925–102931. doi: 10.1016/j.ebiom.2020.102925. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Libby P, Lüscher T. COVID-19 is, in the end, an endothelial disease. Eur Heart J. 2020;41(32):3038–3044. doi: 10.1093/eurheartj/ehaa623. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science. 2020;367(6485):1444–1448. doi: 10.1126/science.abb2762. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004;203(2):631–637. doi: 10.1002/path.1570. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Cortese M, Lee JY, Cerikan B, Neufeldt CJ, Oorschot VMJ, Köhrer S, Hennies J, Schieber NL, Ronchi P, Mizzon G, Romero-Brey I, Santarella-Mellwig R, Schorb M, Boermel M, Mocaer K, Beckwith MS, Templin RM, Gross V, Pape C, Tischer C, Frankish J, Horvat NK, Laketa V, Stanifer M, Boulant S, Ruggieri A, Chatel-Chaix L, Schwab Y, Bartenschlager R. Integrative imaging reveals SARS-coV-2-induced reshaping of subcellular morphologies. Cell Host Microbe. 2020;28(6):853–866.e5. doi: 10.1016/j.chom.2020.11.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Jin Y, Ji W, Yang H, Chen S, Zhang W, Duan G. Endothelial activation and dysfunction in COVID-19: from basic mechanisms to potential therapeutic approaches. Signal Transduct Target Ther. 2020;5(1):293. doi: 10.1038/s41392-020-00454-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Ackermann M, Mentzer SJ, Jonigk D. Pulmonary vascular pathology in Covid-19. Reply. N Engl J Med. 2020;383(9):888–889. doi: 10.1056/NEJMc2022068. [DOI] [PubMed] [Google Scholar]
- 18.Mentzer SJ, Konerding MA. Intussusceptive angiogenesis: expansion and remodeling of microvascular networks. Angiogenesis. 2014;17(3):499–509. doi: 10.1007/s10456-014-9428-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Ackermann M, Houdek JP, Gibney BC, Ysasi A, Wagner W, Belle J, Schittny JC, Enzmann F, Tsuda A, Mentzer SJ, Konerding MA. Sprouting and intussusceptive angiogenesis in postpneumonectomy lung growth: mechanisms of alveolar neovascularization. Angiogenesis. 2014;17(3):541–551. doi: 10.1007/s10456-013-9399-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Ackermann M, Tsuda A, Secomb TW, Mentzer SJ, Konerding MA. Intussusceptive remodeling of vascular branch angles in chemically-induced murine colitis. Microvasc Res. 2013;87:75–82. doi: 10.1016/j.mvr.2013.02.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Ackermann M, Wagner WL, Rellecke P, Akhyari P, Boeken U, Reinecke P. Parvovirus B19-induced angiogenesis in fulminant myocarditis. Eur Heart J. 2020;41(12):1309. doi: 10.1093/eurheartj/ehaa092. [DOI] [PubMed] [Google Scholar]
- 22.Ackermann M, Stark H, Neubert L, Schubert S, Borchert P, Linz F, Wagner WL, Stiller W, Wielpütz M, Hoefer A, Haverich A, Mentzer SJ, Shah HR, Welte T, Kuehnel M, Jonigk D. Morphomolecular motifs of pulmonary neoangiogenesis in interstitial lung diseases. Eur Respir J. 2020;55(3):1900933–1900912. doi: 10.1183/13993003.00933-2019. [DOI] [PubMed] [Google Scholar]
- 23.Ackermann M, Morse BA, Delventhal V, Carvajal IM, Konerding MA. Anti-VEGFR2 and anti-IGF-1R-Adnectins inhibit Ewing’s sarcoma A673-xenograft growth and normalize tumor vascular architecture. Angiogenesis. 2012;15(4):685–695. doi: 10.1007/s10456-012-9294-9. [DOI] [PubMed] [Google Scholar]
- 24.Neubert L, Borchert P, Shin HO, Linz F, Wagner WL, Warnecke G, Laenger F, Haverich A, Stark H, Hoeper MM, Kuehnel M, Ackermann M, Jonigk D. Comprehensive three-dimensional morphology of neoangiogenesis in pulmonary veno-occlusive disease and pulmonary capillary hemangiomatosis. J Pathol Clin Res. 2019;5(2):108–114. doi: 10.1002/cjp2.125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Schniedermann J, Rennecke M, Buttler K, Richter G, Städtler AM, Norgall S, Badar M, Barleon B, May T, Wilting J, Weich HA. Mouse lung contains endothelial progenitors with high capacity to form blood and lymphatic vessels. BMC Cell Biol. 2010;11:50. doi: 10.1186/1471-2121-11-50. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Rafat N, Tönshoff B, Bierhaus A, Beck GC. Endothelial progenitor cells in regeneration after acute lung injury: do they play a role? Am J Respir Cell Mol Biol. 2013;48(4):399–405. doi: 10.1165/rcmb.2011-0132TR. [DOI] [PubMed] [Google Scholar]
- 27.Yamada M, Kubo H, Ishizawa K, Kobayashi S, Shinkawa M, Sasaki H. Increased circulating endothelial progenitor cells in patients with bacterial pneumonia: evidence that bone marrow derived cells contribute to lung repair. Thorax. 2005;60(5):410–413. doi: 10.1136/thx.2004.034058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Lindner D, Fitzek A, Bräuninger H, Aleshcheva G, Edler C, Meissner K, Scherschel K, Kirchhof P, Escher F, Schultheiss HP, Blankenberg S, Püschel K, Westermann D. Association of cardiac infection with SARS-coV-2 in confirmed COVID-19 autopsy cases. JAMA Cardiol. 2020;27:e203551. doi: 10.1001/jamacardio.2020.3551. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Basso C, Leone O, Rizzo S, De Gaspari M, van der Wal AC, Aubry MC, Bois MC, Lin PT, Maleszewski JJ, Stone JR. Pathological features of COVID-19-associated myocardial injury: a multicentre cardiovascular pathology study. Eur Heart J. 2020;41(39):3827–3835. doi: 10.1093/eurheartj/ehaa664. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Mamas MA, Fraser D, Neyses L. Cardiovascular manifestations associated with influenza virus infection. Int J Cardiol. 2008;130(3):304–309. doi: 10.1016/j.ijcard.2008.04.044. [DOI] [PubMed] [Google Scholar]