Sr. Editor:
Actualmente, el «estándar oro» para el diagnóstico de la infección por SARS-CoV-2 es la detección de ARN viral mediante una PCR en tiempo real (rt-PCR) o una técnica molecular equivalente. En España pueden utilizarse los test rápidos antigénicos (TRA) debidamente validados (sensibilidad ≥ 80% y especificidad ≥ 97%) en los 5 primeros días de la aparición de síntomas en pacientes que no sean grandes inmunodeprimidos o no tengan criterios de ingreso en la UCI1. El TRA tiene menos sensibilidad que la rt-PCR en todos los estadios de la infección, y todavía menos en casos asintomáticos, pero su uso en ausencia de síntomas no está descartado en todos los escenarios1, 2, 3. Un reciente informe del European Centre for Disease prevention and Control (ECDC) aconseja emplearlos en pacientes con o sin síntomas si se prevé una proporción de pruebas positivas ≥ 10%2. También los recomienda en entornos de alto riesgo para identificar rápidamente a los infectados y aplicar medidas de prevención y control que eviten la transmisión, aunque aconseja que los casos negativos se confirmen con una prueba rt-PCR1, 2, 3.
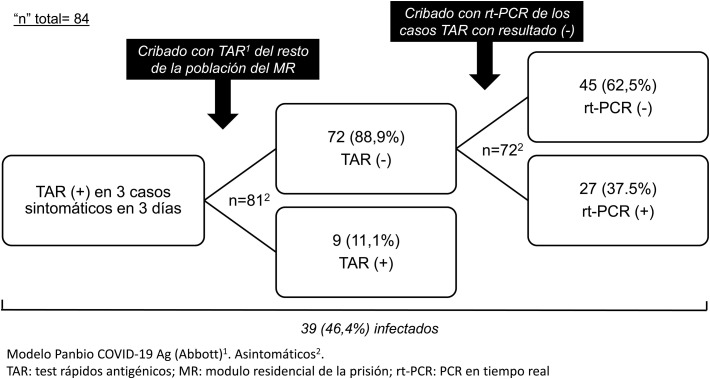
Presentamos los resultados del uso de los TRA en un brote de SARS-CoV-2 ocurrido en un módulo residencial (MR) de la prisión de Figueras (Girona) a finales de 2020. Entre el 23 y el 25 de diciembre se diagnosticó la infección mediante TRA (modelo PanbioTM COVID-19 Ag, Abbott) en 3 reclusos con sintomatología respiratoria leve. Se aisló el MR y la tarde del 25 de diciembre se cribó con TRA al resto de la población (n = 81). Hubo 9 (11,1%) con resultado positivo. Se separaron los infectados del resto, se mantuvo el aislamiento, y el MR se consideró una unidad COVID de baja complejidad dado el número de asintomáticos o sintomáticos leves sin criterio de ingreso hospitalario. La unidad se dotó de requisitos organizativos y funcionales para garantizar la seguridad, la calidad y la eficiencia de los cuidados. La limpieza, la lavandería, el manejo de residuos y la distribución de alimentos y medicación se organizó según las recomendaciones del Servicio Catalán de la Salud4. Se indicó: a) el aislamiento estricto de la unidad con entradas y salidas de los profesionales, sanitarios y no sanitarios, imprescindibles; b) el uso obligatorio de equipo de protección individual (EPI), y c) la realización de controles clínicos (de saturación de O2, temperatura e interrogatorio sobre posible aparición de síntomas) 2 veces al día.
El 28 de diciembre se realizó rt-PCR a los 72 casos con TRA previo negativo, obteniéndose 27 (37,5%) resultados positivos (fig. 1 ). Todos evolucionaron correctamente y no hubo ingresos hospitalarios.
Figura 1.
Cribados y resultados obtenidos en el brote del módulo residencial de la prisión de Figueras.
La prevalencia de infección (46,4%) fue alta al tratarse de un espacio cerrado. En situaciones de confinamiento se estima que la tasa de contagio («R0»: media de personas contagiadas por una persona infectada) puede ser entre 5 y 14 veces mayor de la habitual, que normalmente es de 1,5-3,05, lo que explica el alto número de infectados detectado en el brote. Las medidas adoptadas fueron satisfactorias y se obtuvo resultado negativo de la rt-PCR en todos los contactos a los 7 y 14 días.
Respecto al uso de TRA en contactos estrechos asintomáticos, algunos estudios (un original6, una carta el editor7 y varios «preprint»8, 9, 10) han mostrado una especificidad de la prueba del 100% o próxima7, 8, 9, 10, pero una sensibilidad mucho menor, entre el 33 y el 66%6, 7, 8, 9, 10. Ninguno de estos estudios se efectuó en los contactos de un brote ni en colectivos confinados. En los casos del MR la sensibilidad fue del 25% y el valor predictivo negativo, un índice clave en escenarios en los que la prevalencia puede considerarse moderada o alta, del 63%. Aunque el uso del TRA es atractivo al ser una técnica rápida y sencilla que no precisa de operadores cualificados, el riesgo de falsos negativos es alto, incluso en un brote en un espacio confinado con alta prevalencia de resultados positivos como el presentado. Por consiguiente, la rt-PCR debería ser la prueba de elección en el cribado de pacientes asintomáticos. Solo si no puede disponerse del resultado de la rt-PCR de forma rápida y ante una situación de alto riesgo de transmisión, podría ser aconsejable cribar inicialmente con TRA. En esos casos, los resultados negativos deberían confirmarse con una rt-PCR posterior, como se deduce de este trabajo y sugieren las guías y protocolos del Ministerio de Sanidad de España1, del ECDC2 y de los CDC3.
Financiación
Los autores declaran no haber recibido financiación para la realización de este trabajo.
Bibliografía
- 1.Estrategia de detección precoz, vigilancia y control de COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Ministerio de Sanidad. Actualizado a 18 de diciembre de 2020 [consultado 2 Ene 2021] Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/COVID19_Estrategia_vigilancia_y_control_e_indicadores
- 2.European Centre for Disease Prevention and Control: Options for the use of rapid antigen tests for COVID-19 in the EU/EEA and the UK; 19 November 2020 [consultado 3 Ene 2021] Disponible en: https://www.ecdc.europa.eu/en/publications-data/options-use-rapid-antigen-tests-covid-19-eueea-and-uk
- 3.Centers for Disease Control and Prevention (CDC). Interim Guidance for Antigen Testing for SARS-CoV-2. Update Dec. 16, 2020 [consultado 4 Ene 2021] Disponible en: Interim Guidance for Antigen Testing for SARS-CoV-2 | CDC
- 4.Servei Català de la Salut. Guia d’actuació enfront de casos d’infecció pel nou coronavirus SARS-CoV-2 a les residències. [consultado 3 Ene 2021] Disponible en: https://canalsalut.gencat.cat/web/.content/_A-Z/C/coronavirus-2019-ncov/ material-divulgatiu/guia-actuacio-residencies.pdf
- 5.Dietz L., Horve P.F., Coil D.A., Fretz M., Eisen J.A., van den Wymelenberg K. 2019 Novel Coronavirus (COVID-19) Pandemic: Built Environment Considerations To Reduce Transmission. mSystems. 2020;5:e00375–e420. doi: 10.1128/mSystems.00245-20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Linares M., Pérez-Tanoira R., Carrero A., Romanyk J., Pérez-García F., Gómez-Herruz P., et al. Panbio antigen rapid test is reliable to diagnose SARS-CoV-2 infection in the first 7 days after the onset of symptoms. J Clin Virol. 2020;133:104659. doi: 10.1016/j.jcv.2020.104659. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Fenollar F., Bouam A., Ballouche M., Fuster L., Prudent E., Colson P., et al. Evaluation of the Panbio Covid -19 rapid antigen detection test device for the screening of 2 patients with Covid -19. J Clin Microbiol. 2020 doi: 10.1128/JCM.02589-20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Masiá M., Fernández-González M., Sánchez M., Carvajal M., García J.A., Gonzalo N., et al. Nasopharyngeal Panbio COVID-19 antigen performed at point-of-care has a high sensitivity in symptomatic and asymptomatic patients with higher risk for transmission and older age. medRxiv. 2020 doi: 10.1101/2020.11.16.20230003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Torres I., Poujois S., Albert E., Colomina J., Navarro D. Real-life evaluation of a rapid antigen test (Panbio™ COVID-19 Ag Rapid Test Device) for SARS-CoV-2 detection in asymptomatic close contacts of COVID-19 patients. medRxiv. 2020 doi: 10.1101/2020.12.01.20241562. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Builete O., Lorente P., Leiva A., Carandell E., Oliver A., Rojo E., et al. Evaluation of the Panbio™ rapid antigen test for SARS-CoV-2 in primary health care centers and test sites. medRxiv. 2020 doi: 10.1101/2020.11.13.20231316. [DOI] [Google Scholar]