Abstract
Hintergrund
Die COVID-19-Pandemie stellt die medizinische Fachwelt vor eine bislang ungekannte Herausforderung. Obduktionen sind für die Erforschung dieser neuen Krankheit wesentlich, ihre sichere Durchführbarkeit wurde aber anfangs infrage gestellt.
Fragestellung
Unter welchen rechtlichen Rahmenbedingungen und unter welchen Schutzmaßnahmen können COVID-19-Obduktionen durchgeführt werden?
Material und Methoden
Das obduktionstechnische Vorgehen in 5 Zentren in Deutschland, Österreich und der Schweiz wird unter Berücksichtigung der jeweiligen rechtlichen Grundlagen und der ergriffenen Schutzmaßnahmen dargestellt.
Ergebnisse
In allen Institutionen konnten die Obduktionen in technisch geeigneten Räumen sicher durchgeführt werden. Die persönliche Schutzausrüstung umfasste Augenschutz, Mund-Nasen-Masken (mindestens FFP2), Kopfhauben, Funktionskleidung, Mäntel, Schürzen und 2 Paar Handschuhe. In 4 Instituten wurden die Leichen nach unterschiedlichen Techniken eröffnet. In einem Institut wurde ein minimal-invasives Verfahren, die postmortale ultraschallunterstützte Gewebeentnahme im Rahmen des „postmortal imaging and biopsy programs“, durchgeführt. Letztere gibt zwar keine makroskopischen Einblicke in die inneren Organe, ermöglicht aber eine standardisierte bioptische Gewinnung von Gewebe für Diagnostik und Forschung. Aus den Obduktionen resultierten mehrere Arbeiten in hochrangigen Journalen, die profunde Einblicke in die Organveränderungen ermöglichten und wesentliche Schlüsse auf die Pathomechanismen zuließen. Virus-RNA konnte häufig in COVID-19-Verstorbenen nachgewiesen werden. Vereinzelt gelang auch die Anzüchtung der Viren. Die Frage nach der postmortalen Infektiosität bleibt aber unklar und bei Ct-Werten über 30 umstritten.
Fazit
Unter Beachtung geeigneter Schutzmaßnahmen sind Obduktionen von COVID-19-Verstorbenen sicher durchführbar und für die medizinische Forschung hoch relevant.
Zusatzmaterial online
Zusätzliche Informationen sind in der Online-Version dieses Artikels (10.1007/s00292-021-00925-w) enthalten.
Schlüsselwörter: Biomedizinische Forschung, Referenzstandards, Sicherheitsmanagement, SARS-CoV‑2, Ultrasonographie
Abstract
Background
The COVID-19 pandemic represents a so far unknown challenge for the medical community. Autopsies are important for studying this disease, but their safety was challenged at the beginning of the pandemic.
Objectives
To determine whether COVID-19 autopsies can be performed under existing legal conditions and which safety standards are required.
Materials and methods
The autopsy procedure undertaken in five institutions in Germany, Austria, and Switzerland is detailed with respect to legal and safety standards.
Results
In all institutions the autopsies were performed in technically feasible rooms. The personal equipment consisted of functional clothing including a disposable gown and apron, a surgical cap, eye protection, FFP‑3 masks, and two pairs of gloves. In four institutions, complete autopsies were performed; in one institution the ultrasound-guided biopsy within the postmortal imaging and biopsy program. The latter does not allow the appreciation of gross organ pathology; however, it is able to retrieve standardized biopsies for diagnostic and research purposes. Several scientific articles in highly ranked journals resulted from these autopsies and allowed deep insights into organ damage and conclusions to better understand the pathomechanisms. Viral RNA was frequently detectable in the COVID-19 deceased, but the issue of infectivity remains unresolved and it is questionable if Ct values are greater than 30.
Conclusions
With appropriate safeguards, autopsies of people who have died from COVID-19 can be performed safely and are highly relevant to medical research.
Keywords: Biomedical research, Reference standards, Safety management, SARS-CoV‑2, Ultrasonography
Die COVID-19-Pandemie stellt die globalisierte Gesellschaft vor eine bislang ungekannte Herausforderung. Gesellschaftliche und medizinische Fragen können nur durch möglichst exakte Kenntnisse der Biologie des Virus und der Auswirkungen auf den befallenen Organismus beantwortet werden. Der Nutzen autoptisch gewonnener Erkenntnisse, der zu Beginn der Pandemie nicht richtig eingeschätzt wurde, steht jetzt allerdings außer Frage. Im deutschsprachigen Raum wurden an mehreren Zentren sehr früh systematische autoptische Untersuchungen von an COVID-19 Verstorbenen durchgeführt, deren Ergebnisse von außerordentlich hohem wissenschaftlichem Wert sind.
Obduktionen als Möglichkeit, neue Erkrankungen besser zu verstehen
Obduktionen bieten die einzigartige Möglichkeit, die unterschiedlichen Verlaufsformen einer Erkrankung, aber auch wenig bekannte und neuartige Krankheiten genau zu untersuchen. Dabei können Organveränderungen studiert und Rückschlüsse auf Pathomechanismen gezogen werden. Im Falle von COVID-19 waren es vor allem Institute aus dem deutschsprachigen Raum, die in Europa die ersten systematischen Obduktionen von an COVID-19-Erkrankten durchführten [1–3] und deren Ergebnisse rasch publizierten. Zu diesem Zeitpunkt gab es keine publizierten Ergebnisse systematisch aufgearbeiteter Obduktionsserien, nur einzelne Fälle und Operationspräparate von Lungen sowie bioptische Studien an Verstorbenen [4–6]. Auf Basis der Obduktionen entstanden außerdem innovative grundlagenorientierte wissenschaftliche Arbeiten [7–9], die wesentliche Erkenntnisse zur Pathophysiologie von COVID-19 erbracht haben, beispielsweise, dass ein diffuser alveolärer Schaden (DAD) beider Lungen im Vordergrund der Organschädigung steht, der offenbar unabhängig von der Durchführung einer invasiven Beatmung auftritt, und häufig mit thrombotischen Verschlüssen von Pulmonalarterienästen auf segmentaler und subsegmentaler Ebene [1, 2, 10] und einer Endotheliitis einhergeht [8]. Die Schädigung anderer Organe ist möglicherweise als Folge eines protrahierten Schockgeschehens mit nachfolgendem Multiorganversagen zu betrachten und kann mitunter auch nur in geringem Ausmaß vorhanden sein. Dazu zählen die ischämische Tubulusschädigung der Nieren [1, 11–13], fokale Pankreatitiden [1] und eine fokale ischämische Kolopathie [14]. Ergebnisse von Analysen des zentralen Nervensystems (ZNS) sind widersprüchlich und liefern bislang keine ausreichenden Beweise für eine direkte Schädigung des Gehirns durch SARS-CoV‑2 mit Ausnahme einer Einbeziehung in systemische Gerinnungsprozesse [15–19].
In Deutschland wurde früh anlässlich der ersten Infektionswelle das Deutsche Register für COVID-19-Obduktionen (DeRegCOVID, www.DeRegCOVID.ukaachen.de) in enger Zusammenarbeit der Deutschen Gesellschaft für Pathologie (DGP) und des Berufsverbandes der Deutschen Pathologen e. V. (BDP) ins Leben gerufen (offizieller Start am 15.04.2020) [20]. Im Rahmen des Registers wurde eine Verfahrensempfehlung ausgearbeitet, die das Vorgehen am Universitätsklinikum Aachen abbildet (Tab. 1) und mit höchster Priorität die Sicherheit der Mitarbeiter gewährleistet (Zusatzmaterial online, „Verfahrensanweisung COVID-19-Obduktionen der Uniklinik RWTH Aachen“). Diese wurde durch BDP und DGP als Beispiel bzw. Hilfestellung allen Mitgliedern zur Verfügung gestellt und ist insbesondere für Zentren gedacht, die keine ausgedehnte Erfahrung mit hochinfektiösen Obduktionen haben. Dabei sollten immer alle Prozesse an die lokalen Gegebenheiten angepasst und durch die entsprechenden Stellen geprüft werden, z. B. die hausinterne Krankenhaushygiene, institutsinterne QM-Richtlinien und zentrale Richtlinien für Biologische Sicherheit (nach gesetzlichen Vorgaben für biologische Sicherheit gemäß Biostoffverordnung und gemäß den geltenden Technischen Regeln für Biologische Arbeitsstoffe [TRBA 250 – Biologische Arbeitsstoffe im Gesundheitswesen und in der Wohlfahrtspflege]). Im Rahmen des DeRegCOVID hat die Registerzentrale in Aachen bislang gute Rückmeldungen zu dieser Empfehlung erhalten und konnte zusätzlich einige Zentren in Fragen der Arbeitssicherheit unterstützen (E-Mail: Covid.Pathologie@ukaachen.de). Im Rahmen des Deutschen Forschungsnetzwerks für Autopsien bei Pandemien (DEFEAT PANDEMIcs) werden aktuell die Verfahrensempfehlungen weiter ausgearbeitet und durch das DeRegCOVID zur Verfügung gestellt. Aktuell bereits veröffentliche Empfehlungen sind in Tab. 2 zusammengefasst.
| Empfehlung RKI | Empfehlung Aachen | Augsburg | Erlangen | TU München | Graz | Basel | |
|---|---|---|---|---|---|---|---|
| Anzahl der Mitarbeiter pro Obduktion (Ärzte [Ä]/Sekt.-Assistenten [PA]) | – | 1 A/2 PA | 4 Ä | 2 Ä/1 PA | 2 Ä/1 PA | 2 Ä/1 PA | 2 Ä/0–1 PA |
| Persönliche Schutzausrüstung und -Sektionsraumausstattung | |||||||
| Sektionssaal mit Unterdruckverhältnissen | – | X | X | X | X | X | X |
| Luftwechselraten (pro Stunde) | – | ≥12fach | 13fach | ≥12fach | ≥12fach | 20fach | 9fach |
| N95-Maske/FFP2/3-Maskea | X | X | X | X | X | X | X |
| Augenschutz | X | X | X | X | X | X | X |
| Kopfhaube | – | X | X | X | X | X | X |
| Mantel | X | X | X | X | X | X | Gefahrgutanzug |
| Handschuhe | X (mindestens ein Paar) | X (doppelt) | X (doppelt) | X (doppelt) | X (doppelt) | X (doppelt) | X (doppelt) |
| Schnittfeste Handschuhe aus synthetischem Netzgewebe/Kevlar | – | X | X | – | – | X | – |
| Wasserdichte Schürze | X | X | X | X | X | X | X |
| Gummischuhe/-stiefel | X | X | X | X | X | X | X |
| Unter PPE: OP-Hemden, Hosen | – | X | X | X | X | X | X |
| Obduktion im Bodybag | – | X | X | X | X | b | – |
| Gewebefixationszeiten in Formalin (in Stunden) | – | 336–504 | 96 | 48 | 72 | 24c/72c | 72 |
| Sonstiges | – | 2‑stufiges Verfahren, Organpräparation nach Formalinfixation (siehe Zusatzmaterial online, „Verfahrensanweisung COVID-19-Obduktionen der Uniklinik RWTH Aachen“) |
Knorpelzange für Thorax IQ-Air Healthpro 250 NE Raumluftreiniger (IQAir, Goldach, Schweiz) |
– | Handbohrer für Schädeltrepanation |
Säge mit Absaugung für Schädel, Knorpelzange für Thorax Lungenpräparation nach Formalinfixierung |
Handsäge für Schädel 2 h vor der Autopsie: 4 % phosphatgepuffertes Formalin, instilliert in Mund, Nase, Pharynx |
RKI Robert-Koch-Instiut, TUM Technische Universität München, FFP „filtering facepiece“, PPE „personal protective equipment“
aLt. RKI sind FFP2-Masken als Mindestausstattung definiert
bBodybag zum Transport des Leichnams
cFixierungzeiten in Abhängigkeit der Präparategröße
| Institution/Autor | Titel | Land | Link |
|---|---|---|---|
| Berufsverband der Deutschen Pathologen | Vorsichtsmaßnahmen zur Durchführung von Autopsien in SARS-, HIV-, Hepatitis-C- und Covid 19-Fällen | DE | https://www.pathologie.de/aktuelles/corona/corona-detailansicht/?tx_ttnews%5Btt_news%5D=1690&cHash=f7bb15ed3ab6d1ee006bcfbd87283316 |
| Boor et al., Aachen | Obduktion bei bestätigtem COVID-19-Todesfall | DE | Zusatzmaterial online, „Verfahrensanweisung COVID-19-Obduktionen der Uniklinik RWTH Aachen“ |
| Deutsche Gesellschaft für Neuropathologie und Neuroanatomie e. V. | Hinweise zur Prävention einer SARS-CoV-2-verursachten Coronavirus-Krankheit 2019 (COVID-19) in medizinischen Untersuchungsstellen und Laboren | DE | https://www.dgnn.de/images/documents/DGNN-Hinweise_zur_Praevention_COV19.pdf |
| Deutsche Gesellschaft für Neuropathologie und Neuroanatomie e. V. | CNS-COVID19: Deutschlandweite Phänotypisierungs-Plattform zur ZNS/PNS-Beteiligung von SARS-CoV‑2 | DE | https://jlubox.uni-giessen.de/dl/fiAS1d59XB9qD1B8PvdFYwJj/CNS-COVID19-Register_und_Asservierungsliste.pdf?inline |
| German Biobanking Node | Arbeiten mit SARS-CoV-2-Proben | DE | https://www.bbmri.de/covid-19/arbeiten-mit-sars-cov-2-proben/ |
| Österreichische Gesellschaft für Pathologie/IAP Austria | Obduktionen und COVID; Umgang mit an COVID-19 Verstorbenen | AT | https://oegpath.at/?s=COVID |
| Schweizerische Gesellschaft für Rechtsmedizin | Empfehlungen im Umgang mit SARS-CoV‑2 für die Untersuchung von Verstorbenen (Legalinspektion, postmortale Bildgebung und Autopsie) sowie für klinische Untersuchungen | CH | https://www.sgrm.ch/inhalte/Forensische-Medizin/Empfehlungen_SGRM_SARS-CoV_25maerz2020.pdf |
| Schweizerische Unfallversicherungsanstalt | Verhütung von Berufskrankheiten in pathologisch-anatomischen Instituten und histologischen Laboratorien | CH | http://www.sohf.ch/Themes/Labo/2869_25_D.pdf |
| Royal College of Pathologists | New briefing on COVID-19 – Autopsy practice relating to possible cases of COVID-19 | UK | https://www.rcpath.org/uploads/assets/d5e28baf-5789-4b0f-acecfe370eee6223/fe8fa85a-f004-4a0c-81ee4b2b9cd12cbf/Briefing-on-COVID-19-autopsy-Feb-2020.pdf |
| WHO | WHO (2020) Transmission of SARS-CoV-2: implications for infection prevention precautions | International | https://www.who.int/news-room/commentaries/detail/transmission-of-sars-cov-2-implications-for-infection-prevention-precautions |
Gesetzliche Grundlagen der Obduktion und Corona-Regelungen
Deutschland
In Deutschland ist die Regelung des Leichenschau- und Obduktionswesens Ländersache, sodass es keine bundesweite einheitliche Regelung gibt. Bundesrechtlich sind nur strafprozessuale, seuchengesetzliche und sozialversicherungsrechtliche Sektionen sowie in einem Teil der Länder Sektionen bei Feuerbestattung geregelt. COVID-19-Obduktionen waren bislang überwiegend klinische Sektionen, für die ein Einverständnis des Verstorbenen zu Lebzeiten oder der Angehörigen erforderlich ist. An einigen Orten – allen voran in Hamburg – wurden durch die Gesundheitsämter in Rahmen des Infektionsschutzgesetzes (IfSG) angeordnete Sektionen durchgeführt. Die gesetzlichen Grundlagen der Länder wurden und werden zumindest teilweise als unzureichend betrachtet [21, 22].
Zu Beginn der Pandemie in Deutschland erging vom Robert Koch-Institut die Empfehlung, Obduktionen von COVID-19-Fällen zu vermeiden. Mittlerweile wurde diese Empfehlung, offensichtlich nicht zuletzt aufgrund einer Intervention des Bundesverbandes Deutscher Pathologen und der Deutschen Gesellschaft für Pathologie, wieder zurückgenommen. Bei der äußeren Leichenschau von an COVID-19 Verstorbenen sollten laut Robert Koch-Institut mindestens die Regelungen der Schutzstufe 3 nach der Biostoffverordnung eingehalten werden, insbesondere falls postmortale Maßnahmen, wie beispielsweise Leicheneröffnungen, durchgeführt werden. Für den Transport von Leichen werden keine besonderen Maßnahmen empfohlen. Tatsächlich geregelt wird dies allerdings wieder auf Länderebene, beispielsweise muss laut dem Landesamt für Gesundheit und Lebensmittelsicherheit in Bayern davon ausgegangen werden, dass jeder Verstorbene Träger von Krankheitserregern ist und damit potenziell infektiös sein kann. Aus diesem Grund ist beim Umgang mit einem Verstorbenen stets die nach § 6 Bestattungsverordnung (BestV) vorgegebene Schutzkleidung erforderlich. Aus Vorsichtsgründen sollte in der Todesbescheinigung die Kennzeichnung als „infektiöse Leiche“ erfolgen. Dies zieht die nach § 7 BestV erforderlichen Maßnahmen nach sich. Letztere beinhalten den Transport der Leichen in sog. Bodybags. Der Leichentransport in einem von außen desinfizierten Bodybag, Tragen von Schutzkleidung und Angabe der möglichen, von dem oder der Verstorbenen ausgehenden Infektionsgefahr auf dem Totenschein sind in Nordrhein-Westfalen (NRW) gleichermaßen vorgeschrieben. Der Sarg ist mit der Angabe „infektiös“ oder „infektiöser Leichnam“ zu kennzeichnen. Das Aufbahren des Leichnams und Abschiednahme am offenen Sarg sind nicht gestattet (Tab. 2).
Mittlerweile liegt auch eine Empfehlung zur Durchführung von Autopsien in SARS-CoV‑2 verursachten Infektionsfällen vor [23].
Gemäß dem Zweiten Gesetz zum Schutz der Bevölkerung bei einer epidemischen Lage von nationaler Tragweite vom 19.05.2020 (Bundesgesetzblatt Jahrgang 2020 Teil I Nr. 23, ausgegeben zu Bonn am 22. Mai 2020) besteht für COVID-19 eine Arztmeldepflicht nach § 6 IfSG sowie für den direkten und indirekten Nachweis von SARS-CoV und SARS-CoV‑2 eine Labormeldepflicht nach § 7 IfSG, soweit die Nachweise auf eine akute Infektion hinweisen.
Österreich
In Österreich sind Leichenschau und Obduktionen auf Ebene der Bundesländer gesetzlich geregelt (Leichenbestattungs- bzw. Bestattungsgesetze), auf Bundesebene die klinische Obduktion (§ 25 Krankenanstalten- und Kuranstaltengesetz [KAKuG]: https://www.ris.bka.gv.at; Gesetzesnummer 10010285) sowie die Leichenbeschau und gerichtliche Obduktion im Rahmen der Strafprozessordnung. Im Gegensatz zu den anderen deutschsprachigen Ländern erfordert eine Obduktion in Österreich nur in Ausnahmefällen eine Zustimmung der Angehörigen. In öffentlichen Krankenhäusern besteht bei unklarer Todesursache zur Wahrung öffentlicher oder wissenschaftlicher Interessen, insbesondere wegen diagnostischer Unklarheit des Falles oder wegen eines vorgenommenen operativen Eingriffes, eine Obduktionspflicht. Außerdem müssen Obduktionen durchgeführt werden, wenn sie sanitätspolizeilich oder strafprozessual angeordnet wurden. Diese gesetzliche Bestimmung wird in die jeweilige Landesgesetzgebung übernommen (KAKuG der einzelnen Bundesländer), daher könnten grundsätzlich alle an COVID-19 Verstorbenen auf Basis der gesetzlichen Grundlagen ohne Zustimmung von Angehörigen obduziert werden. Für die Durchführung der Obduktionen sind in den Krankenanstalten Institute für Pathologie zuständig, außerhalb der Krankenanstalten ebenfalls Pathologieinstitute (sanitätspolizeiliche Obduktionen) sowie Institute für Gerichtsmedizin (zum Teil sanitätspolizeiliche Obduktionen sowie gerichtliche Obduktionen). Obduktionen sind ferner in den jeweiligen Landesgesetzen über das Bestattungswesen (Leichenbestattungs- bzw. Bestattungsgesetze) geregelt, wobei dies detaillierter ausformuliert ist als in den KAKuG. Für die Durchführung von Obduktionen sind laut Ärztegesetz Fachärztinnen/Fachärzte für Pathologie oder Gerichtsmedizin zuständig.
Zu Beginn der Coronapandemie gab es von Seiten des Bundesministeriums für Soziales und Gesundheit weder eine Empfehlung für die Durchführung von Obduktionen an COVID-19-Verstorbenen noch eine Ablehnung. Die Österreichische Gesellschaft für Pathologie (ÖGPath/IAP Austria) hat als zuständige Fachgesellschaft auf ihrer Homepage (https://oegpath.at) auf die gesetzlichen Grundlagen und damit auf die Möglichkeit zur Obduktion hingewiesen. Die ersten Obduktionen fanden Mitte März in Wien (sanitätspolizeiliche Obduktion einer Verstorbenen in Heimquarantäne) und am LKH Graz II statt. Die Obduktionsfrequenz war regional sehr unterschiedlich und reichte von weniger als 1 % bis zu 35 % (Steiermark).
Schweiz
In der Schweiz obliegt das Obduktionswesen der kantonalen Gesundheitsgesetzgebung, stützt sich allerdings auf die Bundesgerichtsentscheide 97 I 221, 118 IV 319, 127 I 115, 129 I 173 (siehe https://www.bger.ch/ext/eurospider/live/de/php/clir/http/index_atf.php?lang=de) über die Rechte der Toten. In Basel-Stadt wird die klinische Obduktion durch das Gesundheitsgesetz (GesG, 300.100) IV.6.§20 (siehe https://www.gesetzessammlung.bs.ch/app/de/texts_of_law/300.100/versions/5117) geregelt und sieht die aktive Zustimmung (zu Lebzeiten) der verstorbenen Person bzw. der nächsten Angehörigen vor. Im Einklang mit dem Bundesgesetz über die Bekämpfung übertragbarer Krankheiten des Menschen, dem Epidemiengesetz (EpG) (siehe https://www.admin.ch/opc/de/classified-compilation/20071012/index.html), Artikel 11 und Artikel 36 sieht das kantonale GesG § 20 im Punkt 3 vor, dass im Interesse der öffentlichen Gesundheit die Kantonsärztin oder der Kantonsarzt auch gegen den Willen der entscheidungsbefugten Personen eine Obduktion anordnen kann. Ferner regelt das EpG über Artikel 25 die Sorgfaltspflicht beim Umgang mit Krankheitserregern alle erforderlichen Maßnahmen zu treffen, damit keine Menschen zu Schaden kommen können. Die Forschung an Verstorbenen wird schließlich über das Bundesgesetz über die Forschung am Menschen/Humanforschungsgesetz (HFG) Kapitel 5 (siehe https://www.admin.ch/opc/de/classified-compilation/20061313/index.html#id-5) geregelt und sieht eine aktive Zustimmung (zu Lebzeiten) der verstorbenen Person bzw. der nächsten Angehörigen vor und erlaubt, dass geringfügige Körpersubstanzmengen auch ohne Einwilligung zu Forschungszwecken anonymisiert asserviert werden, sofern keine dokumentierte Ablehnung der verstorbenen Person vorliegt.
Im Rahmen der COVID-19-Pandemie kam es in der Schweiz zu keiner Anwendung der in den kantonalen GesG vorgesehenen Passus, auch gegen den Willen der entscheidungsbefugten Personen Obduktionen anzuordnen. Autopsien wurden nach den üblichen gesetzlichen Rahmenbedingungen durchgeführt. Kantone bzw. Spitäler, welche aufgrund der Ausstattung ihrer Autopsieeinrichtungen den Anforderungen der EpG Artikel 25 nicht entsprechen konnten, sahen von Autopsien voll ab. So wurden z. B. im Kanton Tessin, welcher die höchste Mortalitätsrate im Rahmen der ersten Welle aufwies, keine Autopsien durchgeführt, während sie im Kanton Basel-Stadt bei 25 % und im Kanton Basel-Landschaft bei 35 % liegen.
Obduktionstechnisches Vorgehen der verschiedenen Zentren
Augsburg
Die technischen Voraussetzungen für einen sicheren Sektionsbetrieb waren in Augsburg gegeben. Der Luftwechsel im Sektionsraum betrug 13/h. Zusätzlich wurde ein Luftreinigungsgerät mit Virenfilter betrieben (s. Tab. 1). Alle Obduktionen erfolgten durch ein Team von 4 Ärzten (2 Pathologen, 2 Internisten). Auf den Einsatz von Präparations- und Weiterbildungsassistenten wurde verzichtet, da es zunächst zwar theoretisch begründete Einschätzungen zur Infektionsgefahr im Sektionssaal gab, jedoch keine belastbaren Daten. Im Gegensatz zur allgemeinen Empfehlung, mit möglichst wenig Personal zu arbeiten, glauben wir hier einen Vorteil durch die Aufgabenteilung zu erreichen. Alle präparatorischen Aufgaben führten 2 Kollegen durch. Ein Kollege arbeitete als Dokumentar und Springer, der vierte kümmerte sich um die optimale Organ- und Gewebeasservierung. Die persönliche Schutzausstattung ist der Tab. 1 zu entnehmen. Die Sektionen erfolgten im Bodybag, in dem der Leichnam von der Station in die Prosektur verbracht wurde. Die Eröffnung des Thorax erfolgte mittels einer Knorpelschere, die des Schädels allerdings mit einer oszillierenden Säge. Der Einsatz einer oszillierenden Säge ohne Absaugeinrichtung blieb für die Obduzenten zwar folgenlos, wird jedoch nicht empfohlen. Ein besonderes Augenmerk richtete sich auf eine optimale Fixierung des entnommenen Gewebes mit ausreichendem Verhältnis von Gewebe zu Formalin (mind. 1:3). Die Fixierung des Lungengewebes wurde durch Injektion von ca. 300 ml Formalin pro Lungenflügel mittels 50-ml-Perfusorspritzen und dicklumiger Injektionsnadel ins Parenchym unterstützt. Diese Technik hat sich in Augsburg auch bereits bei Lungenoperationspräparaten bewährt und führt hier zu besseren Ergebnissen als die bronchiale Instillation. Die minimale Fixationszeit betrug mindestens 96 h. Die Gehirnobduktion erfolgte durch die neuropathologischen Kollegen der Technischen Universität München gemäß den Vorgaben der Deutschen Gesellschaft für Neuropathologie und Neuroanatomie (s. Tab. 2). Abstriche erfolgten aus dem Rachenraum, der Trachea und der Bronchien, in einzelnen Fällen auch der Bindehaut. Soweit möglich wurden auch Körperflüssigkeiten (Ergüsse, Liquor, Augenkammerwasser) asserviert. Im Verlauf wurden auch routinemäßig Gewebeproben kryoasserviert.
Nach Abschluss der Obduktion erfolgte ein Verschluss des Bodybags und eine Desinfektion der Hülle. Einmalschutzkleidung wurde in entsprechende Abwurfbehälter gegeben. Desinfektion und Abfallbeseitigung erfolgten durch geschultes Personal.
Alle 4 mit den Obduktionen betrauten Ärzte blieben gesund, was durch zweimalig durchgeführte Abstrichuntersuchungen und jeweils eine Antigenbestimmung bestätigt wurde.
Erlangen
Am Uniklinikum Erlangen wurde bislang (Stand 16.10.2020) bei 13 Verstorbenen eine COVID-19-Infektion nachgewiesen und in 4 Fällen eine Obduktion durchgeführt.
Alle Obduktionen wurden in einem separaten, für Risikosektionen vorgehaltenen Sektionsraum sowie mit adäquater persönlicher Schutzausrüstung der beteiligten Personen (s. Tab. 1) durchgeführt. Gemäß der zum Zeitpunkt der Obduktion geltenden Empfehlungen (die Obduktionen wurden zwischen April und Mai 2020 durchgeführt) wurde die Anzahl der beteiligten Personen so gering wie möglich gehalten. Die organpräparatorischen Arbeiten, die Asservierung und die initiale Dokumentation wurden durch einen erfahrenen Arzt in Weiterbildung, unterstützt durch einen medizinischen Präparator, durchgeführt. Die Dokumentation erfolgte dabei zunächst auf „kontaminierten“ Protokollbögen und wurde nach Abschluss der Obduktion auf neue, nicht kontaminierte Protokollbögen übertragen. Die Supervision oblag dem Prosektor (Facharzt). Die Obduktion erfolgte identisch wie in Augsburg.
Nach Abschluss der Obduktion erfolgte eine Desinfektion des Bodybags sowie anschließend die Verbringung in einen zweiten, frischen Bodybag, um einen maximalen Infektionsschutz zu erhalten. Die Einmalschutzkleidung wurde in entsprechende Abwurfbehälter gegeben. Reinigung und Desinfektion der wiederverwendbaren Schutzausrüstung, des Sektionssaales sowie Abfallentsorgung erfolgten durch geschultes Personal.
Die nativen Gewebeproben wurden kryoasserviert in, je nach Organgröße, großzügiger Menge in einem Kunststoffbehälter mit Schraubverschluss in einem gesonderten und gekennzeichneten Tiefkühlschrank (−80 °C). SARS-CoV‑2 wurde durch den Ausschuss für Biologische Arbeitsstoffe (ABAS) in die Risikogruppe 3 und in die Schutzstufe 2 eingeordnet. Unter Einhaltung der entsprechenden Sicherheitsvorkehrungen sind ungerichtete Tätigkeiten (u. a. Probenlagerung) als unkritisch anzusehen [24].
Die histologischen Proben wurden bei Raumtemperatur für mindestens 48 h in 4 %igem, gepuffertem Formalin fixiert.
TU München
Am Institut für Pathologie der Technischen Universität München (TUM) wurde zusammen mit der Ultraschallabteilung und Gewebebank (MTBIO) des Klinikums rechts der Isar ein durch postmortale Ultraschallbildgebung unterstütztes standardisiertes Verfahren für die Gewebegewinnung und -asservierung letaler COVID-19-Fälle etabliert, das „postmortal imaging and biopsy program“. Dieses berücksichtigt den Infektionsschutz für Mitarbeiter und die Qualitätssicherung postmortal entnommener Organproben und beantwortet diagnostische Fragen zur Pathobiologie und Gewebeschädigung von COVID-19. Das Verfahren und die Verwendung der Proben für die COVID-19-Forschung wurden von der Ethikkommission der TU München genehmigt.
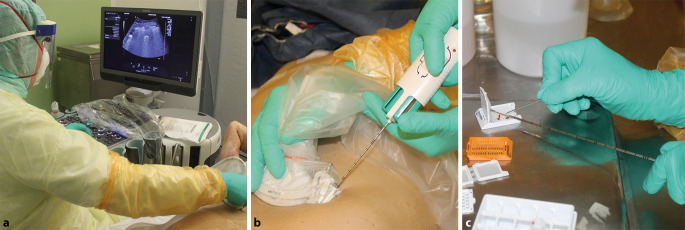
Im Rahmen der Gelbfieberepidemie 2018 in Brasilien wurde ein minimal-invasives Verfahren, die sog. Minimal-invasive Autopsie (MIA) in einer etwas einfacheren Technik bereits erfolgreich angewendet [25], wobei Todesursachen mittels MIA mit vergleichbarer hoher Sicherheit wie mittels konventioneller Autopsie ermittelt werden konnten. Über erste positive Erfahrungen der minimal-invasiven Autopsie im Rahmen der COVID-19-Pandemie wurde bereits berichtet [26, 27]. Einer der Vorteile der minimal-invasiven Verfahren ist die fehlende Aerosolbildung, sodass unter Einhaltung der spezifischen Sicherheitsvorkehrungen (siehe Tab. 1) bereits kurz nach Eintritt des Todes Gewebe für Untersuchungen auf zellulärer und subzellulärer Ebene sicher gewonnen werden kann. Um schnellstmöglich und treffsicher postmortales Gewebe zu asservieren, werden Organe bzw. Zielläsionen mit einem High-End-Ultraschallgerät identifiziert und mittels Punktionsaufsatz und Einmalbiopsiegerät unter Sichtkontrolle zielgenau punktiert (Abb. 1). Für die Durchführung des Verfahrens wurde am Institut für Pathologie ein Punktionsraum im Sektionsbereich eingerichtet und mit IT-Anbindung an das Klinikinformationssystem ausgerüstet. Das Team besteht aus einem fachärztlichen Internisten/einer fachärztlichen Internistin mit besonderer Ultraschallqualifikation (DEGUM III), einem Facharzt/einer Fachärztin für Pathologie und einem Mitarbeiter/einer Mitarbeiterin zur technischen Unterstützung des Probenmanagements. Bei Ableben eines COVID-19-Erkrankten am Klinikum rechts der Isar werden die Angehörigen des Verstorbenen informiert. Nach Einwilligung der Angehörigen wird unter Einhaltung der empfohlenen Infektionsschutzmaßnahmen (analog zur konventionellen Autopsie) das Verfahren im geöffneten Bodybag im Punktionsraum der Pathologie durchgeführt. Nach äußerer Leichenschau durch den Pathologen erfolgt nach standardisiertem Protokoll die Ultraschalluntersuchung der inneren Organe und die transkutane Punktion diverser Organe bzw. Zielläsionen (Trachea, Lunge, Herz, Leber, Pankreas, Nieren, Milz, Aorta, Lymphknoten u. a.). Mittels gezielter Schädeltrepanation wird weiterhin Hirngewebe und eine Knochenmarksprobe am vorderen Beckenkamm gewonnen. Die Ultraschalluntersuchung und die Punktionen werden in Rückenlage des Leichnams ohne Umlagerung durchgeführt, sodass eine mögliche umlagerungsbedingte Aerosolbildung verhindert wird. Je Organ bzw. Zielläsion werden mindestens 3 Proben gewonnen und in 4 % gepuffertem Formalin (optimale Morphologie) bzw. dem formalinfreien PAXgene Tissue FIX (Qiagen N.V., Venlo, Niederlande; optimale Erhaltung von Morphologie und Molekülen) für 72 h fixiert (Abb. 1). Zudem wird eine Probe je Organ/Zielläsion bei −80 °C eingefroren und in einer gesonderten und gekennzeichneten Tiefkühltruhe gelagert, sodass das gesamte Spektrum der Methoden der State-of-the-Art-Pathologie für die postmortale Diagnostik COVID-19-Verstorbener sowie zur funktionellen Infektionsforschung zur Anwendung kommen kann.
Nach Abschluss der Obduktion erfolgt ein Verschluss und Desinfektion des Bodybags. Einmalschutzkleidung wird in entsprechende Abwurfbehälter entsorgt. Die Desinfektion und Abfallbeseitigung erfolgten durch geschultes Personal.
Graz
Zum Zeitpunkt der ersten Obduktionen Mitte März gab es kaum verfügbare Standards, außer jene der CDC (Centers for Disease Control and Prevention) in den USA und des Royal College of Pathologists des Vereinigten Königreichs [28, 29]. Daher wurden rasch eigene Standards entwickelt und konsequent ausgeführt [30]. Bis zum 31.12.2020 wurden am Institut für Pathologie des LKH Graz II 104 COVID-19-Obduktionen nach identem Standard durchgeführt.
Im LKH Graz II besteht ein Obduktionsraum mit speziellem Belüftungssystem mit getrennter Abluft zur Verfügung (Zuluft von 2120 m3, Abluft von 2180 m3, Luftwechsel ca. 20fach/h), der als Airborne Infection Isolation Room (AIIR) klassifiziert ist. Alle Obduktionen wurden von einem 3‑köpfigen Team (2 Pathologen und ein Obduktionsassistent) durchgeführt, die ersten 30 Obduktionen von demselben Ärztetandem. Die Sicherheitsmaßnahmen wurden vorab mit dem verantwortlichen Krankenhaushygieniker abgestimmt. Die Schutzmaßnahmen, insbesondere die Schutzkleidung, entsprach den Maßnahmen auf den COVID-19-Stationen, wobei das Pathologieteam an der hausinternen Schulung teilnahm (siehe Tab. 1). Die Schutzkleidung bestand aus Funktionskleidung (Hose und Shirt), darüber ein OP-Mantel, eine Plastikschürze, 2 Paar Latexhandschuhe (bzw. ein schnittfester Handschuh im Bereich der nichtmesserführenden Hand), Plastikgamaschen für die Arme, eine OP-Haube sowie eine FFP3-Maske. Für den Schutz der Augen wurde anfangs eine Schutzbrille verwendet, im Laufe der Zeit auf einen Schutzschild gewechselt, welches den gesamten Gesichtsbereich abdeckt und lokal produziert wird. Der OP-Mantel ist flüssigkeitsabweisend und durch die Reinigung in der Krankenhauswäscherei gut zu recyceln. Außerdem ist das Entkleiden sicherer als bei Plastikoveralls.
Einer der beiden Pathologen verblieb im sauberen Bereich und führte die Dokumentation durch, entnahm Abstriche und überwachte das hygienekonforme Verhalten des Obduzenten und des Obduktionsassistenten. Unter den Schutzmaßnahmen wurde speziell darauf geachtet, die Entstehung von Aerosolen zu vermeiden, insbesondere durch die Vermeidung von Wasserdampf. Daher wurde trocken obduziert, das Spülen mit Wasser vermieden und zur Reinigung ausschließlich eine Desinfektionslösung aus dem Desinfektionsspender verwendet. Vor der Obduktion wurde ein Abstrich aus dem Oropharynx entnommen, während der Obduktion getrennte Abstriche aus dem rechts- und linksseitigen Bronchialsystem sowie zum Teil aus anderen Organen. Die Obduktionstechnik wurde vor der ersten Obduktion festgelegt und bei allen Obduktionen angewandt. Für die Eröffnung des Gehirnschädels wurde eine elektrische Säge mit Absaugvorrichtung herangezogen. Das Gehirn wurde in toto entnommen und in Formalin fixiert, zuvor Hirnstamm und Kleinhirn abgetrennt und das Großhirn durch einen Frontalschnitt durch die Corpora mamillaria in 2 Teile getrennt. Bei 10 Obduktionen in der ersten Serie wurde aus Sicherheitsgründen auf die Gehirnentnahme verzichtet, in der Folge aber konsequent durchgeführt. Der Thorax wurde mit einer Knorpelzange eröffnet, Halsorgane und Thoraxsitus wurden en bloc entnommen. Die Lungen wurde in toto in Formalin fixiert und in fixiertem Zustand vom Apex zur Basis zur Entnahme von Proben für die histologische Untersuchung lamelliert. Die Abdominalorgane wurden in situ seziert und nach Präparation abgesetzt und abgewogen. Die tiefen Beinvenen wurden von dorsal nach Umdrehen der wieder verschlossenen Leiche präpariert. Aus allen Organen wurden Proben zur histologischen Untersuchung entnommen und außerdem Proben aus mehreren Organen eingefroren. Nach der Obduktion wurden die Verstorbenen in einem verschlossenen Bodybag untergebracht. Ausrüstung und Obduktionsraum wurden gemäß Hygieneplan mit Desinfektionslösungen gereinigt und das Werkzeug in einer speziellen Spülmaschine gewaschen. Alle an den Obduktionen beteiligten Personen (insgesamt 6 Ärzte und 2 Obduktionsassistenten) blieben gesund.
Basel
In der Schweiz gibt es keine Empfehlungen für die Untersuchung von Verstorbenen mit SARS-CoV-2-Infektion bzw. COVID-19-Autopsien, weder von Seiten der Swiss National COVID-19 Science Task Force noch der Schweizerische Gesellschaft für Pathologie. Einzig die Schweizerische Gesellschaft für Rechtsmedizin empfiehlt eine FFP2-Maske für Autopsien, Schutzhandschuhe, ggf. schnittfeste Handschuhe, Schutzbrille oder Gesichtsschutz, wasserabweisende Überschürze (Abb. 2; Tab. 1), nach der Untersuchung gründliche Desinfektion aller Instrumente und Geräte sowie der Hände mit Standarddesinfektionsmittel und Entsorgung der Einwegmaterialien in einem separaten Sack [31].

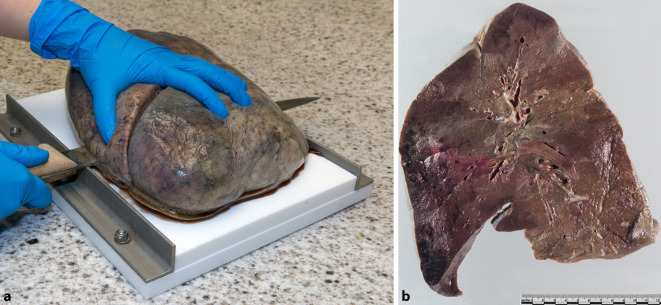
Abgesteckt durch die o. g. Rahmenbedingungen und bei Verfügbarkeit eines Autopsiebereiches mit adäquater technischer Lüftung mit einem – wie von der Schweizerischen Unfallversicherungsanstalt empfohlen [32] – mindestens 6fachem (im Fall Basel 9fachem) Luftwechsel pro Stunde und unter Einbezug der Erfahrung mit Autopsien bei HIV-, HCV- oder HBV-infizierten Individuen wurde im Basel am 16.03.2020 die erste Autopsie eines COVID-19-Verstorbenen mit zum Zeitpunkt des Todes vorhandener (hoher) Viruslast durgeführt. Zu dieser Zeit waren die Richtlinien des Royal College of Pathologists [33] noch nicht publiziert (Erscheinungsdatum 20.03.3020), sondern nur auf der Internetseite der Gesellschaft zu finden [28]. Aus allen diesen Gründen war eigenverantwortliche Konzeptarbeit erforderlich. Unter der begründeten Annahme einer Tröpfchen- bzw. Schmierinfektion durch SARS-CoV‑2 [34] und der potenziellen Infektiosität der nasalen und oralen Partie der Leichname, welche sich später als doch relevant erwiesen hat [14, 35, 36], haben wir in Basel beschlossen 1) ca. 2 h vor der Autopsie 4 %iges gepuffertes Formalin (100–200 ml) mittels Pipetten in die Nase und in dem Mund der Leichname zu instillieren, ferner – zur weiteren Reduktion der Infektiosität – 2) das Hantieren an der Leiche bzw. mit Organen in die Hände von 2 Fachärzten zu geben (MT und AT; beide während der ganzen Zeit der Pandemie bis zum heutigen Tag gesund), 3) bei Ausfall der Präparatoren (was auch eingetroffen ist) eine In-corpore-Autopsietechnik, analog derer, die in einigen Instituten für Rechtsmedizin benutzt wird, anzuwenden [2], 4) Hirnautopsien nur bei Patienten jünger als 75 oder mit neurologischer Symptomatik durchzuführen, 5) das Neurokranium ausschließlich mit der Handsäge zu eröffnen und 6) das Trachea-Lungen-Organpaket mit kaltem (bessere Penetration) 4 %igem gepuffertem Formalin (2–4 l) zu infundieren, anschließend mit der Kocherklemme zu blockieren und eingetaucht in Formalin für 72 h fixieren zu lassen. Die Trachea wurde anschließend gewöhnlich präpariert und untersucht, während die Lungen mithilfe des sog. Lungenbretts (Abb. 3a) in 10 mm dicken parasagittalen Schnitten (beste Ebene zur Erhaltung des Zusammenhangs der Lappen) aufgearbeitet wurden (Abb. 3b). Es wurde systematisch und reichlich (62 Standardkassetten) Gewebe zur Klärung der Todesursache und Virusausbreitung asserviert. Die Qualität der Asservate ermöglichte es uns und auch in Zusammenarbeit mit internationalen Partnern, wichtige und später unabhängig breit bestätigte Erkenntnisse über die Pathogenese von COVID-19 als generalisiertes, dennoch pulmozentrisches mikroangiopathisches/endotheliales Dysfunktionssyndrom mit schwerer thrombotischer Diathese zu gewinnen [2, 7, 18, 37, 38].
Zusammenfassung und Diskussion
Bereits anhand einer geringen Fallzahl konnten von unseren Teams hochkarätige wissenschaftliche Arbeiten veröffentlicht und somit wesentliche Beiträge zu einem besseren Verständnis der Erkrankung geliefert werden. Dies unterstreicht die Notwendigkeit von Obduktionen in der Situation einer neu aufgetretenen Krankheit, im speziellen Fall einer Infektionserkrankung. Anzahl und Umfang der Obduktionen sowie auch die Schutzmaßnahmen unterscheiden sich zwischen den Zentren, außerdem sind die gesetzlichen Grundlagen in den 3 Ländern unterschiedlich. Basel kann ein Modell der minimalen Personalexposition darstellen, während die TU München das Spektrum technischer Möglichkeiten autoptischer Verfahren erweitert, um mittels postmortaler Ultraschallbildgebung und Punktion sicher und standardisiert Gewebeproben für postmortale Diagnostik und Forschung zu gewinnen.
Von verschiedenen wissenschaftlichen Organisationen und Berufsverbänden liegen Empfehlungen für die Obduktionen bei COVID-19 vor, die maßgeblich die Handlungsfähigkeit der mit Autopsien betrauten Fächer unterstützten. Eine einheitliche, detaillierte und verbindliche Empfehlung fehlt allerdings bislang. Für Deutschland wird eine solche derzeit im Rahmen des vom Bundesministerium für Forschung und Bildung geförderten Deutschen Forschungsnetzwerks für Autopsien in Pandemien (DEFEAT PANDEMIcs; siehe Artikel in dieser Sonderausgabe) erarbeitet.
Die Frage nach der Infektionsgefahr im Rahmen der COVID-19-Obduktionen konnte bisher nicht umfassend beantwortet werden. Einzelne Untersuchungen haben gezeigt, dass Virus-RNA bei Verstorbenen zwar nachweisbar ist [11], die meist hohen Ct-Werte (über 30) eine Infektiosität jedoch infrage stellen. Am Institut in Augsburg wurde in 50 konstitutiven postmortalen Analysen aus Rachen und Atmungswegen im Mittel ein Ct-Wert von 23 ± 6 ermittelt (unpubl. Daten). Eine Anzüchtung von Viren aus Abstrichen von Verstorbenen ist in einzelnen Fällen gut dokumentiert [35, 39]. Es liegen hier allerdings keine gleichzeitigen quantitativen Informationen über die Virus-RNA in Form von Ct-Werten vor [36]. Ganz wesentlich ist die Vermeidung der Aerosolbildung durch eine möglichste trockene Obduktionstechnik sowie der Schutz durch adäquate Atemschutzmasken (idealerweise FFP3). In diesem Rahmen ist wichtig festzuhalten, dass es bisher keine Berichte von sicher im Obduktionssaal erworbenen Infektionen an SARS-CoV‑2 gibt. Unsere Mitarbeiter und Mitarbeiterinnen blieben gesund und frei von einer Infektion. Eine Zurückhaltung gegenüber Obduktionen basiert damit auf keiner rationalen Grundlage.
Fazit für die Praxis
Obduktionen stellen einen unverzichtbaren Teil der Erforschung von neuen Erkrankungen, wie z. B. COVID-19, dar.
Standards einschließlich SOPs wurden von mehreren Instituten unabhängig voneinander entwickelt, vielfach reproduziert und zum Teil publiziert. Darüber hinaus sollten Standards offiziell anerkannt werden. Die minimal-invasive, ultraschallgesteuerte Autopsie (MIA-US) stellt eine innovative Ergänzung zur kompletten Obduktion dar, mit dem Nachteil, makroskopische Veränderungen nur eingeschränkt erfassen zu können.
Dem Schutz des mit COVID-19-Obduktionen betrauten Personals durch technische Voraussetzungen (ausreichender Luftwechsel) und geeignete Schutzausrüstung gilt besonderes Augenmerk.
Unter Beachtung der erforderlichen Schutzmaßnahmen sind COVID-19-Obduktionen sicher durchführbar.
Supplementary Information
Acknowledgments
Danksagung
Diese Arbeit wurde unterstützt durch das Deutsche Register für COVID-19 Autopsien (DeRegCOVID, www.DeRegCOVID.ukaachen.de), finanziert durch das Bundesministerium für Gesundheit (ZMVI1-2520COR201) und das Bundesministerium für Bildung und Forschung im Rahmen des Netzwerkes Universitätsmedizin (DEFEAT PANDEMIcs, 01KX2021). Unser Dank gilt den Kollegen und Kolleginnen der einzelnen Pathologien und Neuropathologien sowie denen der klinischen Fächer, die uns in mannigfaltiger Form unterstützt haben. Aus München sei besonders PD Dr. med. vet. Katja Steiger und PD. Dr. med. Konrad Stock gedankt. Frau Dr. Jasmin Haslbauer, Herrn Ralph Schoch und Herrn Thomas Rost aus Basel sei herzlich für die unschätzbare und tatkräftige Unterstützung hinsichtlich COVID-19 Autopsien gedankt: amici certi in re incerta cernitur. Diese Arbeit ist den Teams aus Ärztinnen und Ärzten und Pflegekräften gewidmet, die täglich um das Leben der COVID-Patienten kämpfen. Daneben gilt unser besonderer Dank den Angehörigen der Verstorbenen, die in der Situation des Verlustes und der Trauer durch Ihre Einverständnisse einen unschätzbaren Beitrag zur Erforschung dieser in vieler Hinsicht bedrohlichen Erkrankung geleistet haben.
Einhaltung ethischer Richtlinien
Interessenkonflikt
P. Boor, P. Eichhorn, A. Hartmann, S. F. Lax, B. Märkl, T. Menter, K. Skok, J. Slotta-Huspenina, S. von Stillfried, A. Tzankov und G. Weirich geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes
Die Reihung der Autoren erfolgt in alphabetischer Reihenfolge.
Die Autoren P. Eichhorn, S. F. Lax, T. Menter, J. Slotta-Huspenina, S. von Stillfried und A. Tzankov haben federführend und in gleicher Weise zu diesem Artikel beigetragen.
Literatur
- 1.Lax SF, Skok K, Zechner P, Kessler HH, Kaufmann N, Koelblinger C, Vander K, Bargfrieder U, Trauner M. Pulmonary Arterial Thrombosis in COVID-19 With Fatal Outcome: Results From a Prospective, Single-Center, Clinicopathologic Case Series. Ann Intern Med. 2020;173(5):350–361. doi: 10.7326/M20-2566. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Menter T, Haslbauer JD, Nienhold R, Savic S, Hopfer H, Deigendesch N, Frank S, Turek D, Willi N, Pargger H, Bassetti S, Leuppi JD, Cathomas G, Tolnay M, Mertz KD, Tzankov A. Postmortem examination of COVID-19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings in lungs and other organs suggesting vascular dysfunction. Histopathology. 2020 doi: 10.1111/his.14134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Wichmann D, Sperhake JP, Lutgehetmann M, Steurer S, Edler C, Heinemann A, Heinrich F, Mushumba H, Kniep I, Schroder AS, Burdelski C, de Heer G, Nierhaus A, Frings D, Pfefferle S, Becker H, Bredereke-Wiedling H, de Weerth A, Paschen HR, Sheikhzadeh-Eggers S, Stang A, Schmiedel S, Bokemeyer C, Addo MM, Aepfelbacher M, Puschel K, Kluge S. Autopsy Findings and Venous Thromboembolism in Patients With COVID-19: A Prospective Cohort Study. Ann Intern Med. 2020;173(4):268–277. doi: 10.7326/M20-2003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Barton LM, Duval EJ, Stroberg E, Ghosh S, Mukhopadhyay S. COVID. Oklahoma: USA. Am J Clin Pathol; 2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Tian S, Hu W, Niu L, Liu H, Xu H, Xiao SY. Pulmonary Pathology of Early-Phase 2019 Novel Coronavirus (COVID-19) Pneumonia in Two Patients With Lung Cancer. J Thorac Oncol. 2020;15(5):700–704. doi: 10.1016/j.jtho.2020.02.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Tian S, Xiong Y, Liu H, Niu L, Guo J, Liao M, Xiao SY. Pathological study of the 2019 novel coronavirus disease (COVID-19) through postmortem core biopsies. Mod Pathol. 2020;33(6):1007–1014. doi: 10.1038/s41379-020-0536-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, Vanstapel A, Werlein C, Stark H, Tzankov A, Li WW, Li VW, Mentzer SJ, Jonigk D. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120–128. doi: 10.1056/NEJMoa2015432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, Mehra MR, Schuepbach RA, Ruschitzka F, Moch H. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417–1418. doi: 10.1016/S0140-6736. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Haslbauer JD, Perrina V, Matter M, Dellas A, Mihatsch MJ, Tzankov A. Retrospective Post-mortem SARS-CoV-2 RT-PCR of Autopsies with COVID-19-Suggestive Pathology Supports the Absence of Lethal Community Spread in Basel, Switzerland, before February 2020. Pathobiology. 2020 doi: 10.1159/000512563. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Lax SF, Skok K, Trauner M. Pulmonary arterial thrombosis as an important complication of COVID-19 pulmonary disease: letter to the editor. Virchows Arch. 2020;477(3):467–468. doi: 10.1007/s00428-020-02896-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Su H, Yang M, Wan C, Yi LX, Tang F, Zhu HY, Yi F, Yang HC, Fogo AB, Nie X, Zhang C. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China. Kidney Int. 2020;98(1):219–227. doi: 10.1016/j.kint.2020.04.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Puelles VG, Lutgehetmann M, Lindenmeyer MT, Sperhake JP, Wong MN, Allweiss L, Chilla S, Heinemann A, Wanner N, Liu S, Braun F, Lu S, Pfefferle S, Schroder AS, Edler C, Gross O, Glatzel M, Wichmann D, Wiech T, Kluge S, Pueschel K, Aepfelbacher M, Huber TB. Multiorgan and Renal Tropism of SARS-CoV-2. N Engl J Med. 2020;383(6):590–592. doi: 10.1056/NEJMc2011400. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Amann K, Boor P, Wiech T, et al. COVID-19-Auswirkungen auf die Niere. Pathologe. 2021 doi: 10.1007/s00292-020-00899-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Skok K, Stelzl E, Trauner M, Kessler HH, Lax SF. Post-mortem viral dynamics and tropism in COVID-19 patients in correlation with organ damage. Virchows Arch. 2020 doi: 10.1007/s00428-020-02903-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Meinhardt J, Radke J, Dittmayer C, Mothes R, Franz J, Laue M, Schneider J, Brünink S, Hassan O, Stenzel W, Windgassen M, Rößler L, Goebel H-H, Martin H, Nitsche A, Schulz-Schaeffer WJ, Hakroush S, Winkler MS, Tampe B, Elezkurtaj S, Horst D, Oesterhelweg L, Tsokos M, Heppner BI, Stadelmann C, Drosten C, Corman VM, Radbruch H, Heppner FL. Olfactory transmucosal SARS-CoV-2 invasion as port of Central Nervous System entry in COVID-19. Patients Prepr. 2020 doi: 10.1101/2020.06.04.135012. [DOI] [PubMed] [Google Scholar]
- 16.Matschke J, Lutgehetmann M, Hagel C, Sperhake JP, Schroder AS, Edler C, Mushumba H, Fitzek A, Allweiss L, Dandri M, Dottermusch M, Heinemann A, Pfefferle S, Schwabenland M, Sumner Magruder D, Bonn S, Prinz M, Gerloff C, Puschel K, Krasemann S, Aepfelbacher M, Glatzel M. Neuropathology of patients with COVID-19 in Germany: a post-mortem case series. Lancet Neurol. 2020;19(11):919–929. doi: 10.1016/S1474-4422. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Pezzini A, Padovani A. Lifting the mask on neurological manifestations of COVID-19. Nat Rev Neurol. 2020 doi: 10.1038/s41582-020-0398-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Deigendesch N, Sironi L, Kutza M, Wischnewski S, Fuchs V, Hench J, Frank A, Nienhold R, Mertz KD, Cathomas G, Matter MS, Siegemund M, Tolnay M, Schirmer L, Probstel AK, Tzankov A, Frank S. Correlates of critical illness-related encephalopathy predominate postmortem COVID-19 neuropathology. Acta Neuropathol. 2020 doi: 10.1007/s00401-020-02213-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Acker T. Covid-19-Auswirkungen auf das ZNS. Pathologe. 2021 doi: 10.1007/s00292-021-00924-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.von Stillfried S, Bulow RD, Rohrig R, Knuchel-Clarke R, Boor P. Autopsy registry can facilitate COVID-19 research. EMBO Mol Med. 2020;12(8):e12885. doi: 10.15252/emmm.202012885. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Dettmeyer R, Madea B. Obduktionen: Unsichere und uneinheitliche. Rechtslage Dtsch Arztebl Intern. 2002;99(36):2311–2314. [Google Scholar]
- 22.Edler C, Schröder AS, Aepfelbacher M, Fitzek A, Heinemann A, Heinrich F, Klein A, Langenwalder F, Lutgehetmann M, Meissner K, Püschel K, Schadler J, Steurer S, Mushumba H, Sperhake JP. Dying with SARS-CoV-2 infection-an autopsy study of the first consecutive 80 cases in Hamburg, Germany. Int J Legal Med. 2020;134(4):1275–1284. doi: 10.1007/s00414-020-02317-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Bundesverband-deutscher-Pathologen (2020) Vorsichtsmaßnahmen zur Durchführung von Autopsien in SARS-, HIV-, Hepatitis-C- und Covid 19-Fällen. https://www.pathologie.de/aktuelles/corona/corona-detailansicht/?tx_ttnews%5Btt_news%5D=1690&cHash=f7bb15ed3ab6d1ee006bcfbd87283316. Zugegriffen: 1. Nov. 2020
- 24.German-Biobank-Node (2020) Arbeiten mit SARS-CoV-2-Proben. https://www.bbmri.de/covid-19/arbeiten-mit-sars-cov-2-proben/. Zugegriffen: 28. Nov. 2020
- 25.Duarte-Neto AN, Monteiro RAA, Johnsson J, Cunha MDP, Pour SZ, Saraiva AC, Ho YL, da Silva LFF, Mauad T, Zanotto PMA, Saldiva PHN, de Oliveira IRS, Dolhnikoff M. Ultrasound-guided minimally invasive autopsy as a tool for rapid post-mortem diagnosis in the 2018 Sao Paulo yellow fever epidemic: Correlation with conventional autopsy. PLoS Negl Trop Dis. 2019;13(7):e0007625. doi: 10.1371/journal.pntd.0007625. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.D’Onofrio V, Donders E, Vanden Abeele ME, Dubois J, Cartuyvels R, Achten R, Lammens M, Dendooven A, Driessen A, Augsburg L, Vanrusselt J, Cox J. The clinical value of minimal invasive autopsy in COVID-19 patients. PLoS ONE. 2020;15(11):e0242300. doi: 10.1371/journal.pone.0242300. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Duarte-Neto AN, Monteiro RAA, da Silva LFF, Malheiros D, de Oliveira EP, Theodoro-Filho J, Pinho JRR, Gomes-Gouvêa MS, Salles APM, de Oliveira IRS, Mauad T, Saldiva PHN, Dolhnikoff M. Pulmonary and systemic involvement in COVID-19 patients assessed with ultrasound-guided minimally invasive autopsy. Histopathology. 2020;77(2):186–197. doi: 10.1111/his.14160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Osborn M, Lucas S, Stewart R, Swift B, Youd E (2020) Briefing on COVID-19: Autopsy practice relating to possible cases of COVID-19 (2019-nCov, novel coronavirus from China 2019/2020). https://www.rcpath.org/uploads/assets/d5e28baf-5789-4b0f-acecfe370eee6223/fe8fa85a-f004-4a0c-81ee4b2b9cd12cbf/Briefing-on-COVID-19-autopsy-Feb-2020.pdf. Zugegriffen: 1. Nov. 2020
- 29. Centers_for_Disease_Control_and_Prevention (2021) Collection and Submission of Postmortem Specimens from Deceased Persons with Confirmed or Suspected COVID-19. https://www.cdc.gov/coronavirus/2019-ncov/hcp/guidance-postmortem-specimens.html. Zugegriffen: 10. Jan. 2021
- 30.Skok K, Vander K, Setaffy L, Kessler HH, Aberle S, Bargfrieder U, Trauner M, Lax SF. COVID-19 autopsies: Procedure, technical aspects and cause of fatal course. Experiences from a. Single-center Pathol Pract. 2020 doi: 10.1016/j.prp.2020.153305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Medizin SGfR‑F (2020) Empfehlungen im Umgang mit SARS-CoV‑2 für die Untersuchung von Verstorbenen (Legalinspektion, postmortale Bildgebung und Autopsie) sowie für klinische Untersuchungen. https://www.sgrm.ch/inhalte/Forensische-Medizin/Empfehlungen_SGRM_SARS-CoV_25maerz2020.pdf. Accessed 1. Nov. 2020 2020
- 32.Jost M, Rüegger M, Gutzwiller A, Liechti B, Wolf R (2003) Verhütung von Berufskrankheiten in pathologisch-anatomischen Instituten und histologischen Laboratorien. www.sohf.ch/Themes/Labo/2869_25_D.pdf. Zugegriffen: 1. Nov. 2020
- 33.Hanley B, Lucas SB, Youd E, Swift B, Osborn M. Autopsy in suspected COVID-19 cases. J Clin Pathol. 2020;73(5):239–242. doi: 10.1136/jclinpath-2020-206522. [DOI] [PubMed] [Google Scholar]
- 34.WHO (2020) Transmission of SARS-CoV-2: implications for infection prevention precautions. https://www.who.int/news-room/commentaries/detail/transmission-of-sars-cov-2-implications-for-infection-prevention-precautions. Accessed 1. Nov. 2020 2020
- 35.Plenzig S, Held H, Gradhand E, Kettner M, Verhoff MA, Berger A. Infektiosität von COVID-19-Leichen. Rechtsmedizin. Berl. 2020;5:365. [Google Scholar]
- 36.Basso C, Calabrese F, Sbaraglia M, Del Vecchio C, Carretta G, Saieva A, Donato D, Flor L, Crisanti A, Dei Tos AP. Feasibility of postmortem examination in the era of COVID-19 pandemic: the experience of a Northeast Italy University Hospital. Virchows Arch. 2020;477(3):341–347. doi: 10.1007/s00428-020-02861-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Löffler KU, Reinhold A, Herwig-Carl MC, Tzankov A, Holz FG, Scholl HPN, Meyer P. Ocular post-mortem findings in patients having died from COVID-19. Ophthalmologe. 2020;117(7):648–651. doi: 10.1007/s00347-020-01149-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Eckermann M, Frohn J, Reichardt M, Osterhoff M, Sprung M, Westermeier F, Tzankov A, Werlein C, Kühnel M, Jonigk D, Salditt T. 3D virtual pathohistology of lung tissue from Covid-19 patients based on phase contrast X-ray tomography. Elife. 2020 doi: 10.7554/eLife.60408. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Borczuk AC, Salvatore SP, Seshan SV, Patel SS, Bussel JB, Mostyka M, Elsoukkary S, He B, Del Vecchio C, Fortarezza F, Pezzuto F, Navalesi P, Crisanti A, Fowkes ME, Bryce CH, Calabrese F, Beasley MB. COVID-19 pulmonary pathology: a multi-institutional autopsy cohort from Italy and New York City. Mod Pathol. 2020 doi: 10.1038/s41379-020-00661-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.