Abstract
-
•
La COVID-19 puede presentar síntomas prolongados no solo respiratorios, sino también extrapulmonares.
-
•
Las alteraciones hematológicas, cardiacas y neurológicas pueden llegar a ser las más graves, pero otras manifestaciones pueden también impactar sobre la calidad de vida.
-
•
El papel de atención primaria durante el seguimiento es fundamental, identificando problemas y orientando su tratamiento.
-
•
El trabajo multidisciplinar y en equipo es la base de una correcta atención a estos pacientes.
Palabras clave: Coronavirus, Atención primaria, Secuelas, COVID-19 postaguda
Apenas han pasado 11 meses desde que la enfermedad por coronavirus de 2019 (COVID-19) irrumpiese en el mundo1, y a pesar del gran esfuerzo internacional para estudiar todos los aspectos relacionados con la enfermedad, y muy especialmente todo lo relacionado con el virus SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2), es todavía mucho más lo que se ignora que lo que se conoce2.
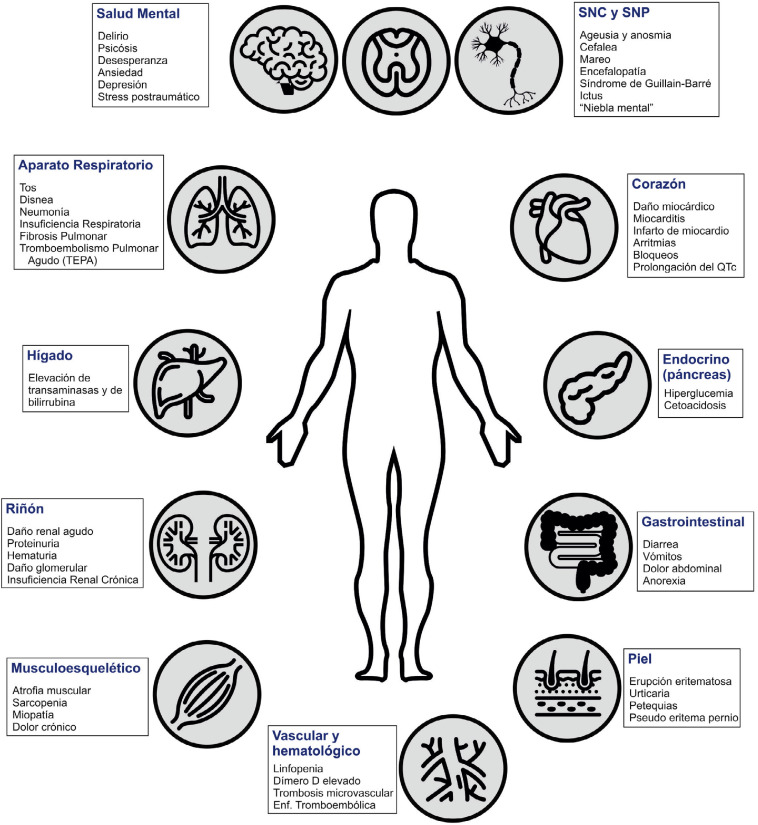
Se sabe que el SARS-CoV-2 provoca inicialmente una enfermedad pulmonar aguda, que puede manifestarse con neumonía y con síndrome de distrés respiratorio agudo (SDRA)3. Se han observado igualmente muchas manifestaciones extrapulmonares de la enfermedad4, que afectan a los sistemas hematológico, cardiovascular, renal, digestivo, endocrinológico, neurológico, oftalmológico y dermatológico (fig. 1 ). Sin embargo, se desconoce la historia natural de la enfermedad, la duración de los síntomas y la posible persistencia de secuelas en todos los sistemas reseñados.
Figura 1.
Afectación del SARS-CoV-2 sobre diferentes órganos y sistemas del cuerpo humano.
QTc: intervalo QT corregido; SNC: sistema nervioso central; SNP: sistema nervioso periférico.
Elaboración propia, basado en Gupta A et al.4. Dibujos realizados para el Noun Project, con licencia Creative Commons.
Fisiopatología del SARS-CoV-2
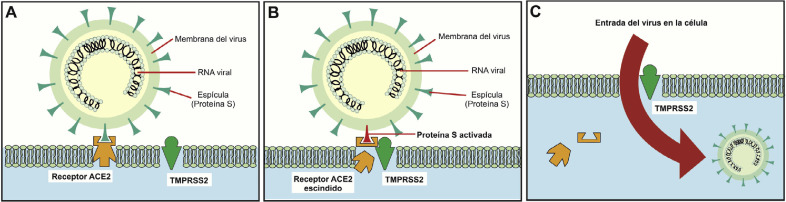
El virus SARS-CoV-2 es un virus de ARN que infecta inicialmente las vías respiratorias altas, bien a través de fómites, bien vehiculizado por gotículas de saliva o en aerosoles. Una vez entra en el organismo, infecta las células mediante la unión de su proteína de las espículas (proteína S) a los receptores de la enzima convertidora de la angiotensina 2 (ACE2), aunque requiere la presencia de una proteasa de membrana, la proteasa transmembrana de serina de tipo II (TMPRSS2) para que el ARN viral penetre en la célula infectada5 (fig. 2 ).
Figura 2.
A) La proteína S de la espícula del coronavirus se une a los receptores de la enzima convertidora de la angiotensina 2 (ACE2), en la superficie de la célula diana. B) La proteasa transmembrana de serina de tipo II (TMPRSS2) se une al receptor ACE2 y lo escinde. En el proceso, se activa la proteína S de la espícula. C) La parte de la ACE2 escindida y no unida a la proteína S y la proteína S activada facilitan la entrada viral.
Modificado y adaptado de Rabi et al.8.
La eficiencia con la que el virus se une a los receptores ACE2 es determinante para la transmisibilidad. Se ha demostrado una mayor afinidad por los receptores ACE2 del SARS-CoV-2 respecto al SARS-CoV (causante de la epidemia de SARS de 2003), lo que explica la mayor transmisibilidad de aquel6.
Esta alta afinidad por los receptores ACE2 justifica además la ubicuidad de los daños provocados por el SARS-CoV-2 en todo el organismo, ya que la expresión de los receptores ACE2 es prácticamente universal en las células de todos los órganos del cuerpo humano. Sin embargo, sigue siendo desconocido el mecanismo de extensión del virus en el organismo (hematógeno u otros).
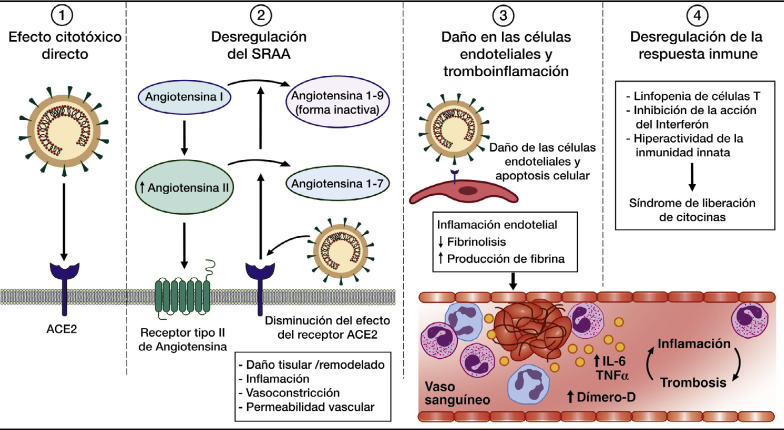
El daño provocado por la infección del SARS-CoV-2 se debe a cuatro mecanismos principales4: efecto citotóxico directo, desregulación del sistema renina-angiotensina-aldosterona (SRAA), daño endotelial y trombosis, y desregulación de la respuesta inmunitaria (fig. 3 ). Veamos brevemente cada uno de estos mecanismos.
Figura 3.
ACE2: receptor de la enzima convertidora de la angiotensina 2.
IL-6: interleucina-6; SRAA: sistema renina-angiotensina-aldosterona; TNFα: factor de necrosis tumoral alfa.
Esquema traducido y modificado de Gupta et al.4. Explicación en el texto.
Citotoxicidad viral directa
La citotoxicidad directa provoca el daño en los diferentes órganos afectados, alterando su normal funcionamiento.
Desregulación del SRAA
El ACE2 es un potente modulador del SRAA. Transforma la angiotensina I en su forma inactiva, y la angiotensina II en angiotensina 1-7, que es vasodilatadora y tiene propiedades antiproliferativas y antifibróticas. La infección por el SARS-CoV-2 altera todo este sistema y provoca algunas manifestaciones clínicas en determinados órganos7.
Daño endotelial y trombosis
Se ha demostrado la expresión de receptores ACE2 en el endotelio vascular de diferentes órganos4, 8. El SARS-CoV-2 daña por citotoxicidad directa el endotelio, provocando igualmente una endotelitis9. Estos fenómenos llevan a un aumento de la producción de fibrina, inhibición de la fibrinólisis y activación del complemento, lo que induce la formación de microtrombos y una disfunción microvascular.
Desregulación de la respuesta inmunitaria
El SARS-CoV-2 provoca una activación de los neutrófilos y de los macrófagos que actúan como mediadores de la hiperinflamación, con liberación anormal de citocinas, principalmente interleucina 6 (IL-6), cuya presencia en el suero del paciente se ha relacionado con un peor pronóstico10. Otros marcadores de hiperinflamación detectados en suero son linfopenia, proteína C reactiva, ferritina, dímero D, fibrinógeno y lactato deshidrogenasa (LDH). Niveles anormales de estos parámetros conllevan un peor pronóstico.
Todos estos mecanismos provocan, en mayor o menor grado, la afectación de los diferentes sistemas de nuestro organismo.
En un novedoso estudio11, realizado mediante búsqueda en redes sociales de los síntomas persistentes que con más frecuencia aparecen en pacientes recuperados de COVID-19, los síntomas más prevalentes eran malestar y fatiga, disnea, dolor torácico inespecífico, taquicardia, insomnio y tos. Como puede apreciarse, varios de ellos son manifestaciones extrapulmonares de la enfermedad. La persistencia prolongada de síntomas, tanto respiratorios como no respiratorios, en pacientes que han superado la fase aguda de la enfermedad se ha denominado COVID prolongada (“Long COVID”)12. Otros autores han señalado la afectación prolongada multiorgánica en pacientes jóvenes de bajo riesgo (66% de afectación en un órgano, 25% en varios)13.
A continuación, describiremos las alteraciones no pulmonares de la COVID-19 más importantes.
Manifestaciones hematológicas
Entre los hallazgos de laboratorio que podemos encontrar en pacientes de COVID-19 se encuentra principalmente una marcada linfopenia, presente entre el 67% y el 90% de los pacientes ingresados4. Dicha linfopenia afecta tanto a los linfocitos T CD4+ como a los CD8+, y su presencia se ha asociado a mayor gravedad de la enfermedad. También se ha asociado a peor pronóstico la leucocitosis, en especial la neutrofilia, aunque esta alteración se observa más raramente.
Puede existir trombocitopenia, lo que podría indicar una alteración por consumo, pero en ocasiones se detecta un aumento del recuento plaquetario, especulándose que podría deberse al aumento reactivo de la trombopoyetina tras la inflamación pulmonar.
Tanto la presencia de niveles elevados de dímero D en el momento del ingreso (que aparece en un 46% de los pacientes) como su incremento a lo largo de la estancia hospitalaria se han asociado a un aumento de la mortalidad14.
En cuanto a las manifestaciones clínicas, la más importante, y en ocasiones dramática, es la enfermedad tromboembólica. Además de por la ya comentada disfunción endotelial y la respuesta inflamatoria, el tromboembolismo venoso (TEV) se ve favorecido por factores como la inmovilidad en cama, en pacientes ingresados, o condiciones previas del paciente (hipertensión arterial, diabetes, enfermedad renal, factores genéticos, etc.). Por otra parte, no solo se da TEV, sino que pueden aparecer fenómenos trombóticos arteriales, principalmente por trombosis microvascular, y que se dan con frecuencia en el territorio pulmonar15.
La enfermedad tromboembólica y la trombosis microvascular en la COVID-19 condicionan la aparición de accidentes cerebrovasculares (ACV), tromboembolismo pulmonar agudo (TEPA), infarto de miocardio y otros eventos graves que pueden conducir a un empeoramiento importante e incluso a la muerte16.
Es necesario, pues, vigilar la posible aparición de fenómenos trombóticos, incluso semanas después del alta hospitalaria (se desconoce el tiempo durante el cual el paciente puede tener fenómenos tromboembólicos tras el alta). Ante la sospecha clínica de evento trombótico, debe remitirse al paciente a urgencias hospitalarias para determinación de dímero D y otras pruebas complementarias.
En el paciente dado de alta tras ingreso, Férnandez de Sanmamed et al.17 proponen diferenciar cuatro escenarios:
-
1.
Paciente sin anticoagulación previa a la infección y que durante la infección por la COVID-19 no presenta alteración de coagulación ni riesgo trombótico asociado: en este caso no se requiere tratamiento.
-
2.
Paciente que no recibe tratamiento anticoagulante previamente a la infección y que se considera paciente de riesgo trombótico por la infección de la COVID-19: en este caso se pauta heparina de bajo peso molecular (HBPM) durante el ingreso y se continua al alta por un tiempo que oscila entre 7-15 días y un mes (a tener en cuenta la situación individual de cada paciente con respecto a la inmovilización).
-
3.
Paciente con tratamiento anticoagulante oral previo (fibrilación auricular, valvulopatía, trombosis venosa profunda, etc.) y con infección por la COVID-19 sin alteración de la coagulación ni riesgo trombótico añadido: se debería tener en cuenta si se ha realizado tratamiento con fármacos que puedan interaccionar con el tratamiento anticoagulante. Recibirán tratamiento con HBPM a dosis terapéuticas continuando al alta como en el punto 2 o hasta fin de la interacción farmacológica, teniendo en cuenta la vida media de los fármacos administrados, antes de volver a instaurar el tratamiento anticoagulante que tomase previamente.
-
4.
Indicación de nueva anticoagulación por fibrilación auricular en período de pandemia en paciente sin infección por la COVID-19: comenzar el tratamiento anticoagulante, cuando esté indicado, con anticoagulantes antagonistas de la vitamina K (AVK) y, en situaciones especiales, valorar la utilización de anticoagulantes de acción directa (ACOD).
En los pacientes en tratamiento con anticoagulación que requieren control, como es el caso de los AVK, debe realizarse el seguimiento en atención primaria.
Manifestaciones cardiacas
Se ha informado de diversas manifestaciones cardiacas de la COVID-19, que pueden ser secuelas directas del virus, o indirectas, por las alteraciones inflamatorias y por los fenómenos tromboembólicos4.
El daño miocárdico con elevación de biomarcadores cardiacos se da hasta en el 30% de los pacientes hospitalizados (50% entre los que presentaban enfermedad cardiovascular previa). Se ha constatado que a mayor elevación de la troponina hay un peor pronóstico. Se desconoce hasta qué punto el daño miocárdico se debe a infarto de miocardio, a miocarditis o a la combinación de hipoxia, trombosis microvascular e inflamación sistémica que se da en los pacientes de COVID-19 grave.
La cardiomiopatía biventricular puede presentarse hasta en un tercio de los pacientes críticos. El fallo ventricular derecho aislado es más raro4.
Un 17% de los pacientes hospitalizados puede presentar diversas arritmias: fibrilación auricular de nueva aparición, bloqueos cardiacos y arritmias ventriculares. También puede apreciarse prolongación del intervalo QT corregido (QTc) en algunos pacientes en el momento del ingreso4.
En un pequeño estudio con 100 pacientes recuperados tras pasar la COVID-1918, de los cuales 67 no requirieron ingreso durante su enfermedad, y con prueba de reacción en cadena de la polimerasa (PCR) negativa en el momento del estudio, a los que se realizó una resonancia magnética cardiaca (RMC), mostraron crecimiento ventricular izquierdo y una menor fracción de eyección que los sujetos control. En 78 de los sujetos se apreciaba edema miocárdico e inflamación, y en 71 se encontraron niveles elevados de troponina T de alta sensibilidad. Estos hallazgos, de confirmarse en estudios más amplios, indicarían que aún en pacientes con enfermedad leve o moderada, aparentemente recuperados, se produce lesión miocárdica.
Una circunstancia alarmante que ha sido también señalada es la disminución, en todo el mundo, de los ingresos hospitalarios por infarto de miocardio con elevación del segmento ST y otros síndromes coronarios agudos, desde marzo de 202019. En paralelo a este hecho se ha descrito un aumento del número de paradas cardiacas fuera del hospital, en las mismas fechas. Esto significa que, bien por el temor del paciente a contagiarse del SARS-CoV-2, que le lleva a evitar acudir a centros sanitarios, o bien por la distorsión de la atención sanitaria producto de la focalización en la COVID-19, se están dejando de diagnosticar y de atender eventos cardiacos graves.
En el seguimiento de los pacientes dados de alta tras padecer COVID-19 es fundamental prevenir la aparición o persistencia de lesiones cardiacas. Ha de vigilarse la aparición de síntomas de dolor coronario, de fallo cardiaco o de alteraciones del ritmo cardiaco, haciendo una buena anamnesis y, al menos, un electrocardiograma (ECG) urgente en caso de sospecha de alguna de estas circunstancias. Debe mantenerse la atención ante cualquier cuadro sospechoso de infarto o síndrome coronario agudo, para prestar atención inmediata y activar, si es necesario, el “Código Corazón”.
Aunque no se ha establecido la periodicidad, debería realizarse un ECG de control tras el alta, y posiblemente otro al mes o a los 2 meses. En caso de que se requiera administrar cualquier medicación que pueda prolongar el QTc, debe realizarse también previamente un ECG4.
En pacientes que ya estuvieran tomando, previamente a la COVID-19, inhibidores de la enzima convertidora de la angiotensina (IECA), estos no deben ser retirados, ya que no se ha demostrado relación entre los IECA y la gravedad de la infección, e incluso algunos trabajos señalan que podrían disminuirla20.
Manifestaciones neurológicas
Se han descrito múltiples manifestaciones neurológicas relacionadas con la COVID-1921, desde problemas leves (mareos, mialgias, anosmia y ageusia, cefalea) a problemas de gravedad (alteración de la conciencia, ictus, convulsiones, meningoencefalitis, síndrome de Guillain-Barré, etc.). Sin embargo, la fisiopatología de estas manifestaciones no está bien establecida. Se cree que el SARS-CoV-2 puede actuar sobre el sistema nervioso central (SNC) y periférico (SNP) por tres mecanismos diferentes:
-
1.
Paso directo del virus desde el epitelio nasal al nervio olfatorio a través de la lámina cribosa del etmoides.
-
2.
Transporte axonal y transferencia transináptica del virus desde nervios periféricos hasta el SNC.
-
3.
Diseminación hematógena o linfática.
No obstante, se ha postulado que la principal causa de las alteraciones neurológicas en la COVID-19 no es la acción directa del virus, sino las alteraciones sistémicas producidas por el estado inflamatorio y la hipercoagulabilidad, afectando a la vasculatura cerebral y a la barrera hematoencefálica4, 22.
Uno de los cuadros más frecuentes y persistentes en pacientes que han pasado la COVID-19 es la denominada “niebla mental” o “niebla cerebral” (Brain Fog)12, más frecuente en personas que han superado un cuadro grave, y especialmente en aquellas de mayor edad; no obstante, puede aparecer también en pacientes que hayan sufrido una COVID-19 leve-moderada. Estos pacientes relatan fatiga, inatención, dificultad para concentrarse y problemas para poder trabajar durante muchas horas, les resulta difícil planificar acciones, etc.23.
El seguimiento de estos pacientes en atención primaria ha de hacerse controlando la posible aparición de síntomas neurológicos o la persistencia de estos, y dando tratamiento de soporte a las alteraciones que presenten. Ha de prestarse especial atención a la posible aparición de secuelas tempranas graves tras el alta (síndrome de Guillain-Barré, mielitis transversa, ictus) y a la persistencia de alteraciones más leves, pero que afectan a la calidad de vida, como la “niebla mental”.
Manifestaciones psicoemocionales
La COVID-19 puede determinar alteraciones psicológicas y psiquiátricas por diversos motivos24, desde afectación del SNC hasta repercusiones de la situación de temor y confinamiento padecidas. En la fase aguda, el cuadro psiquiátrico más común es el delirio, más frecuente en pacientes graves que requieren ingreso en la Unidad de Cuidados Intensivos (UCI), aunque también se han descrito en algunas personas cuadros de psicosis. A medio y largo plazo, se ha asociado la COVID-19 con bajo estado de ánimo, desesperanza, ansiedad, depresión y cuadros de estrés postraumático (especialmente en trabajadores sanitarios y otras profesiones esenciales)25.
Es importante, en el seguimiento de estos pacientes, no señalar como patológico lo que les sucede. Aunque algunas personas podrían beneficiarse de una interconsulta a salud mental, se debe hacer hincapié en el apoyo emocional, enseñanza de autocuidados (dieta, hidratación, actividad) y ocasionalmente, en el control de los síntomas. Sería ideal un abordaje multidisciplinar por parte de psicólogos, médicos de familia, enfermeras y trabajadores sociales12.
Manifestaciones endocrinológicas
Los pacientes COVID-19 pueden presentar en fase aguda alteraciones del metabolismo de la glucosa, con hiperglucemia y cetoacidosis de inicio, incluso en pacientes que previamente no tenían diagnóstico de diabetes26.
Está en discusión que la infección por SARS-CoV-2 desencadene un cuadro de diabetes a largo plazo. No obstante, en pacientes que hayan presentado hiperglucemia durante su enfermedad, sería conveniente la determinación periódica de la hemoglobina glicosilada para el seguimiento4.
Manifestaciones renales
En la fase aguda de la enfermedad se produce, en un número importante de pacientes graves, un daño renal agudo, con alteraciones electrolíticas, proteinuria, hematuria y acidosis metabólica, todo lo cual conlleva una alta mortalidad4.
A largo plazo, puede provocarse daño glomerular permanente, bien por acción directa del virus, bien por inmunocomplejos. También puede presentarse una intensa al- buminuria, secundaria a la disfunción endotelial. Estos acontecimientos pueden llevar a una insuficiencia renal cró- nica27.
Tras el alta, es conveniente controlar durante los primeros meses la función renal, incluyendo la posible presencia de albuminuria.
Manifestaciones musculoesqueléticas
Diversos factores conducen a que los pacientes con COVID-19, especialmente los que han sido ingresados de forma prolongada, presenten alteraciones en el sistema musculoesquelético28. En primer lugar, la propia acción del SARS-CoV-2, bien por su efecto directo sobre las células musculares y nerviosas, bien por las consecuencias de las alteraciones sistémicas desencadenadas (alteraciones inmunitarias, hipercoagulabilidad, daño mediado por citocinas). En segundo lugar, el ingreso prolongado provoca un importante desacondicionamiento muscular con atrofia (en algunos pacientes puede manifestarse una sarcopenia, con una afectación mucho más intensa de la esperable por la inmovilización prolongada). Y, por último, el uso de corticoides como tratamiento puede condicionar la aparición de una miopatía corticoidea. También las articulaciones se ven afectadas, ya sea por daño directo o indirecto por el virus, o por la inmovilidad prolongada.
La concurrencia de alteraciones musculares, articulares y de neuropatía periférica puede llegar a condicionar en estos pacientes la aparición de dolor crónico29.
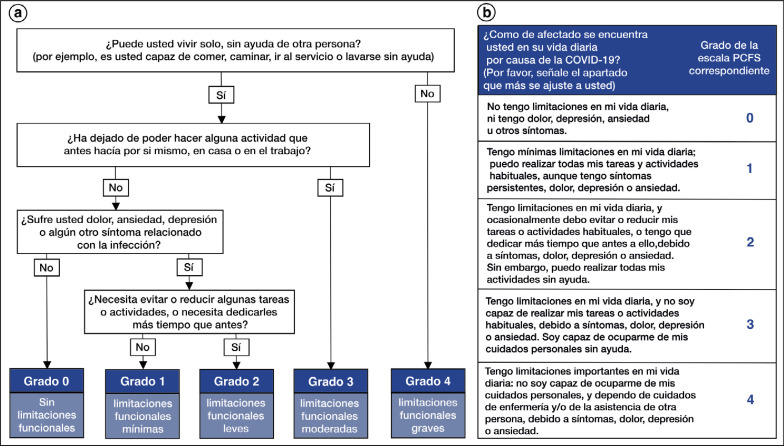
El seguimiento de estos pacientes debe incluir el apoyo emocional, la enseñanza de normas de higiene y autocuidados, y la remisión a rehabilitación lo más precozmente posible. Se han propuesto algunos métodos sencillos para la clasificación funcional de estos pacientes, como la escala para medir el estado funcional tras sufrir COVID-19 (PCFS: “Post-COVID-19 Functional Status”) (fig. 4 )30.
Figura 4.
Escala para medir el estado funcional tras sufrir COVID-19 (PCFS: “Post-COVID-19 Functional Status”): a) diagrama de flujo. b) Cuestionario para pacientes.
Instrucciones de uso: 1) para evaluar la recuperación después de la infección por SARS-CoV-2, esta escala PCFS cubre toda la gama de limitaciones funcionales, incluidos los cambios en el estilo de vida, el ejercicio físico y deportivo, y las actividades sociales; 2) la asignación de un grado de la escala PCFS se refiere a la situación promedio de la semana anterior (excepción: cuando se evalúa al alta, se refiere a la situación que existía el día del alta); 3) los síntomas incluyen (pero no se limitan a) disnea, dolor, fatiga, debilidad muscular, pérdida de memoria, depresión y ansiedad; 4) en caso de que dos grados parezcan ser apropiados para el paciente, elija siempre el grado más alto, con más limitaciones; 5) medir el estado funcional antes de la infección por SARS-CoV-2 es opcional; 6) como alternativa a este diagrama de flujo y cuestionario para pacientes, se encuentra disponible una entrevista estructurada extensa.
El manual completo para pacientes y médicos está disponible en https://osf.io/qgpdv/ [consultado el 9 de noviembre de 2020]. Traducido y modificado de Klok et al.30. [Licencia de atribución Creative Commons].
Conclusiones
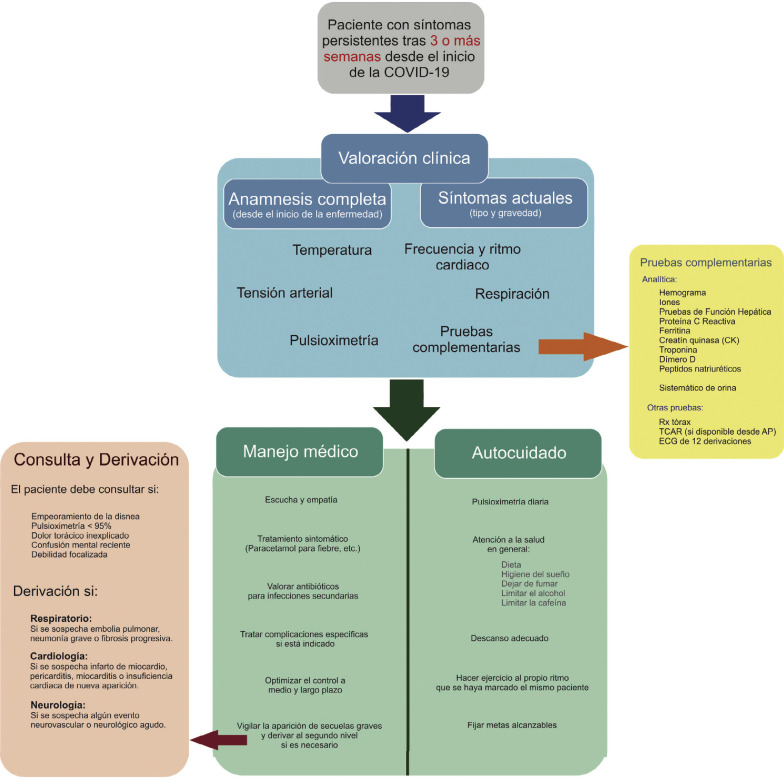
La COVID-19 tiene múltiples manifestaciones, no solo respiratorias, sino en todos los sistemas del cuerpo humano. Algunas de ellas van a persistir tras la superación de la fase aguda de la enfermedad, dando lugar a la denominada COVID prolongada. La figura 5 propone la actuación de atención primaria en estos pacientes12.
Figura 5.
Esquema de actuación y seguimiento en atención primaria de pacientes con COVID prolongada.
ECG: electrocardiograma; Rx tórax: radiografía de tórax; TCAR: tomografía computarizada de alta resolución.
Modificado y adaptado de Greenhalgh et al.12.
Para los profesionales de atención primaria supone un reto el identificar estas manifestaciones y manejarlas adecuadamente, tal como se resume en la tabla 1 . Para ello es necesario una buena coordinación con los servicios hospitalarios, pero sobre todo es un desafío para desarrollar de forma eficiente un trabajo en equipo que implique no solo a los profesionales sanitarios, sino también al propio paciente, a su familia y a su entorno social.
Tabla 1.
Síntomas persistentes más frecuentes tras sufrir COVID-19
| Sistema afectado | Alteraciones | Actuación en AP |
|---|---|---|
| Vascular y hematológico | Linfopenia Trombosis microvascular Enfermedad tromboembólica Dímero D elevado |
Vigilancia estrecha sobre la posible aparición de fenómenos tromboembólicos Mantenimiento de profilaxis con HBPM durante ¿semanas? |
| Corazón | Daño miocárdico Cardiomiopatía biventricular Arritmias y bloqueos Prolongación del QTc |
Atención a posibles signos de cardiopatía Realizar ECG tras el alta, al mes y a los 2 meses Realizar ECG si se va a pautar un medicamento que pueda alterar el intervalo QT No suspender IECA si ya lo tomaba |
| Sistema nervioso | Mareos, mialgias, anosmia… Ictus Convulsiones Meningoencefalitis Síndrome de Guillain-Barré “Niebla mental” |
Valorar la aparición o persistencia de síntomas neurológicos Vigilar la aparición de complicaciones graves (ictus, Guillain-Barré) incluso semanas después del alta Vigilar la persistencia de la “niebla mental” |
| Psicoemocional | Delirio, psicosis... Bajo estado de ánimo Depresión Estrés postraumático |
Evitar señalamiento Prestar apoyo emocional Enseñanza de autocuidados Abordaje pluridisciplinar |
| Endocrino | Hiperglucemia ¿Diabetes? |
Determinación periódica de la hemoglobina glicosilada (podría ser al alta y a los 3 meses) |
| Renal | Daño glomerular Albuminuria Insuficiencia renal crónica |
Monitorizar función renal durante los primeros meses |
| Musculoesquelético | Desacondicionamiento muscular Atrofia muscular Miopatía corticoidea Dolor crónico |
Apoyo emocional Tablas de ejercicios Remisión temprana a rehabilitación |
AP: atención primaria; ECG: electrocardiograma; HBPM: heparinas de bajo peso molecular; IECA: inhibidor de la enzima convertidora de la angiotensina; QTc: intervalo QT corregido.
Bibliografía
- 1.Zhu N., Zhang D.Y., Wang W.L., Li X.W., Yang B., Song J.D. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med [internet] 2020;382:727–733. doi: 10.1056/NEJMoa2001017. [consultado 29 de octubre de 2020]; Disponible en: https://www.nejm.org/doi/10.1056/NEJMoa2001017?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Smith G.D., Blastland M., Munafò M. Covid-19's known unknowns. BMJ [internet] 2020;371:m3979. doi: 10.1136/bmj.m3979. [consultado 29 de octubre de 2020]; Disponible en: https://www.bmj.com/content/371/bmj.m3979/rapid-responses. [DOI] [PubMed] [Google Scholar]
- 3.Rothan H.A., Byrareddy S.N. The epidemiology and pathogenesis of coronavirus disease (COVID-19) outbreak. J Autoimmun [internet]. 2020;109:102433. doi: 10.1016/j.jaut.2020.102433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Gupta A., Madhavan M.V., Sehgal K., Nair N., Mahajan S., Sehrawat T.S. Extrapulmonary manifestations of COVID-19. Nat Med [internet] 2020;26:1017–1032. doi: 10.1038/s41591-020-0968-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Rabi F.A., Al Zoubi M.S., Kasasbeh G.A., Salameh D.M., Al-Nasser A.D. SARS-CoV-2 and Coronavirus Disease 2019: What We Know So Far. Pathogens. 2020;9:231. doi: 10.3390/pathogens9030231. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Wang Q., Zhang Y., Wu L., Niu S., Song C., Zhang Z. Structural and functional basis of SARS-CoV-2 entry by using human ACE2. Cell. 2020;181:894–904. doi: 10.1016/j.cell.2020.03.045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Vaduganathan M., Vardeny O., Michel T., McMurray J.J.V., Pfeffer M.A., Solomon S.D. Renin-angiotensin-aldosterone system inhibitors in patients with Covid-19. N Engl J Med. 2020;382:1653–1659. doi: 10.1056/NEJMsr2005760. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ackermann M., Verleden S.E., Kuehnel M., Haverich A., Welte T., Laenger F. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020;383:120–128. doi: 10.1056/NEJMoa2015432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Varga Z., Flammer A.J., Steiger P., Haberecker M., Andermatt R., Zinkernagel A.S. Endothelial cell infection and endothelilitis in COVID-19. Lancet. 2020;395:1417–1418. doi: 10.1016/S0140-6736(20)30937-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Mehta P., McAuley D.F., Brown M., Sanchez E., Tattersall R.S., Manson J.J. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395:1033–1034. doi: 10.1016/S0140-6736(20)30628-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Banda J.M., Singh G.V., Alser O., Prieto-Alhambra D. Long-term patient-reported symptoms of COVID-19: an analysis of social media data. medRxiv. 2020 doi: 10.1101/2020.07.29.20164418. 2020.07.29.20164418. [DOI] [Google Scholar]
- 12.Greenhalgh T., Knight M., A’Court C., Buxton M., Husain L. Management of post- acute covid-19 in primary care. BMJ. 2020;370:m3026. doi: 10.1136/bmj.m3026. [DOI] [PubMed] [Google Scholar]
- 13.Dennis A., Wamil M., Kapur S., Alberts J., Badley A., Decker G.A. Multi-organ impairment in low-risk individuals with long COVID. medRxiv. 2020 doi: 10.1101/2020.10.14.20212555. 2020.10.14.20212555. [DOI] [Google Scholar]
- 14.Connors J.M., Levy J.H. COVID-19 and its implications for thrombosis and anticoagulation. Blood. 2020;135:2033–2040. doi: 10.1182/blood.2020006000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Spyropoulos J.H., Levy W., Ageno J.M., Connors B.J., Hunt T., Iba M. Scientific and standardization committee communication: clinical guidance on the diagnosis, prevention and treatment of venous thromboembolism in hospitalized patients with COVID-19. J Thromb Haemostasis. 2020;18:1859–1865. doi: 10.1111/jth.14929. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Shi W., Lv J., Lin L. Coagulopathy in COVID-19: Focus on vascular thrombotic events. J Mol Cell Cardiol. 2020;146:32–40. doi: 10.1016/j.yjmcc.2020.07.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Fernández de Sanmamed M.J., Riera L., Serrano E. ¿Y después de la fase aguda de la COVID-19 qué...?. 2.ª parte. AMF [internet]. 2020 [consultado el 29 de octubre de 2020]. Disponible en: https://amf-semfyc.com/web/article_ver.php?id=2643#R1. [Google Scholar]
- 18.Puntmann V.O., Carerj M.L., Wieters I., Fahim M., Arendt C., Hoffmann J. Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19) JAMA Cardiol. 2020 doi: 10.1001/jamacardio.2020.3557. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Baldi E., Sechi G.M., Mare C., Canevari F., Brancaglione A., Primi R. Out-of-Hospital Cardiac Arrest during the Covid-19 Outbreak in Italy. N Engl J Med. 2020;383:496–498. doi: 10.1056/NEJMc2010418. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Zhang P., Zhu L., Cai J., Lei F., Qin J., Xie J. Association of inpatient use of angiotensin converting enzyme inhibitors and angiotensin II receptor blockers with mortality among patients with hypertension hospitalized with COVID-19. Circ Res. 2020;126:1671–1681. doi: 10.1161/CIRCRESAHA.120.317134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Mao L., Jin H., Wang M., Hu Y., Chen S., He Q. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol. 2020;77:683–690. doi: 10.1001/jamaneurol.2020.1127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Chen X., Laurent S., Onur O.A., Kleineberg N.N., Fink G.R., Schweitzer F. A systematic review of neurological symptoms and complications of COVID-19. J Neurol. 2020:1–11. doi: 10.1007/s00415-020-10067-3. Jul 20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Nordvig A.S., Rimmer K.T., Willey J.Z., Thakur K.T., Boehme A.K., Vargas W.S. Potential neurological manifestations of COVID-19. Neurol Clin Pract. 2020 doi: 10.1212/CPJ.0000000000000897. 10.1212/CPJ.0000000000000897. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Troyer E.A., Kohn J.N., Hong S. Are we facing a crashing wave of neuropsychiatric sequelae of COVID-19? Neuropsychiatric symptoms and potential inmunologic mechanisms. Brain Behav Immun. 2020;88:957–958. doi: 10.1016/j.bbi.2020.04.027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Butler M., Pollak T.A., Rooney A.G., Michael B.D., Nicholson T.R. Neuropsychiatric complications of covid-19. BMJ. 2020;371:m3871. doi: 10.1136/bmj.m3871. [DOI] [PubMed] [Google Scholar]
- 26.Li J., Wang X., Chen J., Zuo X., Zhang H., Deng A. COVID-19 infection may cause ketosis and ketoacidosis. Diabetes Obes Metab. 2020 doi: 10.1111/dom.14057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Velez J.C.Q., Caza T., Larsen C.P. COVAN is the new HIVAN: the re-emergence of collapsing glomerulopathy with COVID-19. Nat Rev Nephrol. 2020;16:565–567. doi: 10.1038/s41581-020-0332-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Disser N.P., De Micheli A.J., Schonk M.M., Konnaris M.A., Piacentini A.N., Edon D.L. Musculoskeletal Consequences of COVID-19. J Bone Joint Surg Am. 2020;102:1197–1204. doi: 10.2106/JBJS.20.00847. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Kemp H.I., Corner E., Colvin L.A. Chronic pain after COVID-19: implications for rehabilitation. Br J Anaesth. 2020;125:436–440. doi: 10.1016/j.bja.2020.05.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Klok F.A., Boon G.J.A.M., Barco S., Endres M., Geelhoed J.J.M., Knauss S. The Post-COVID-19 Functional Status scale: a tool to measure functional status over time after COVID-19. Eur Respir J. 2020;56:2001494. doi: 10.1183/13993003.01494-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]