Resumo
Fundamento
A resistência vascular pulmonar elevada ainda é um grande problema na seleção de candidatos ao transplante cardíaco.
Objetivo
Nosso objetivo foi avaliar o efeito da administração de sildenafila pré-transplante cardíaco em pacientes com hipertensão pulmonar fixa.
Métodos
O estudo retrospectivo, de centro único, incluiu 300 candidatos a transplante cardíaco consecutivos tratados entre 2003 e 2013. Destes, 95 pacientes tinham hipertensão pulmonar fixa e, dentre eles, 30 pacientes foram tratados com sildenafila e acabaram passando pelo transplante, formando o Grupo A. O Grupo B incluiu 205 pacientes sem hipertensão pulmonar que passaram pelo transplante cardíaco. A hemodinâmica pulmonar foi avaliada antes do transplante, 1 semana e 1 ano após o transplante. A taxa de sobrevivência foi comparada entre os grupos. Neste estudo, um P valor < 0,05 foi considerado estatisticamente significativo.
Resultados
Após o tratamento com sildenafila, mas antes do TxC, a RVP (-39%) e a PAPs (-10%) diminuíram significativamente. A PAPs diminuiu após o TxC em ambos os grupos, mas permaneceu significativamente alta no grupo A em relação ao grupo B (40,3 ± 8,0 mmHg versus 36,5 ± 11,5 mmHg, P=0,022). Um ano após o TxC, a PAPs era 32,4 ± 6,3 mmHg no Grupo A versus 30,5 ± 8,2 mmHg no Grupo B (P=0,274). O índice de sobrevivência após o TxC 30 dias (97% no grupo A versus 96% no grupo B), 6 meses (87% versus 93%) e um ano (80% versus 91%) após o TxC não foi estatisticamente significativo (Log-rank P=0,063). Depois do primeiro ano, o índice de mortalidade era similar entre os dois grupos (sobrevivência condicional após 1 ano, Log-rank p=0,321).
Conclusão
Nos pacientes com HP pré-tratados com sildenafila, a hemodinâmica pós-operatória inicial e o prognóstico são numericamente piores em pacientes sem HP, mas depois de 1 ano, a mortalidade em médio e longo prazo são semelhantes. (Arq Bras Cardiol. 2021; 116(2):219-226)
Keywords: Resistência Vascular, Transplante de Coração, Hipertensão Pulmonar, Citrato de Sildenafila, Inibidores da Fosfodiesterase 5, Disfunção Ventricular Direita
Introdução
O transplante cardíaco (TxC) é o padrão ouro do cuidado da insuficiência cardíaca terminal.1 Estudos epidemiológicos mostraram que 60-70% dos pacientes com insuficiência cardíaca (IC) desenvolvem hipertensão pulmonar (HP).2,3 Em um estudo da Mayo Clinic,4 detectou-se uma forte associação graduada entre pressão arterial pulmonar sistólica (PAPs) e mortalidade e, por isso, a presença de HP grave é uma das maiores contraindicações ao TxC, devido à disfunção do coração direito pós-operatória.5
Pressões elevadas no lado direito em IC geralmente resultam de pressões de enchimento elevadas no ventrículo esquerdo (VE). Portanto, a pressão arterial pulmonar diastólica (PAPd) está firmemente correlacionada com a pressão capilar pulmonar (PCP).6,7 Por outro lado, o componente vasorreativo da HP se desenvolve com a HP duradoura. Ele é caracterizado por vasoespasmo, vasoconstrição e alterações morfológicas dos vasos.8,9Nesse caso, a HP persiste, independentemente da diminuição da PCP após o TxC. Refletindo os componentes “fixos” da HP, a resistência vascular pulmonar (RVP) e o gradiente transpulmonar (GTP) são elevados.6
A princípio, a HP é reversível por vasodilatadores sistêmicos, mas, posteriormente ela se torna relativamente estática ou “fixa”.6,9,10A RVP elevada aumenta a mortalidade no período inicial pós-TxC e continua sendo um grande problema para a seleção dos candidatos.11,12 A impossibilidade do coração transplantado de se adaptar a HP significativa pré-existente geralmente resulta em insuficiência do ventrículo direito (VD), que representa aproximadamente 50% de todas as complicações cardíacas e até 19% de todas as mortes precoces no pós-operatório.12,13Por isso, a avaliação correta que a reatividade do sistema vascular pulmonar exerce para a terapia vasodilatadora tem um papel crucial na seleção do candidato. As diretrizes da American Heart Association definem HP fixa como média da pressão arterial pulmonar (mPAP) ≥ 25 mmHg e RVP ≥ 2,5 unidades Wood (UW) e/ou GTP ≥ 12 mmHg, mesmo depois da testagem com vasodilatador farmacológico.14
A sildenafila é um inibidor de fosfodiestarase tipo 5 (PDE5) seletivo e potente que, especificamente, degrada a guanosina monofosfato cíclico, o segundo mensageiro do óxido nítrico nas células musculares lisas vasculares.8,15 A sildenafila tem um perfil favorável sem desnaturação do oxigênio ou alterações significativas da frequência cardíaca ou da pressão sanguínea.16 Vários estudos de centro único demonstraram efeito hemodinâmico favorável da administração da sildenafila pré-TxC em candidatos ao TxC com HP.12,17 Entretanto, há uma escassez de dados sobre os resultados iniciais e de longo prazo sobre esses pacientes de alto risco.
O objetivo deste estudo é comparar o efeito na hemodinâmica inicial do VD e mortalidade após o TxC da administração da sildenafila pré-TxC em pacientes com HP fixa que se qualificaram para o TxC e em pacientes sem HP. Nossa hipótese é de que os pacientes com HP que foram transplantados com o uso de sildenafila têm prognósticos comparáveis aos dos pacientes sem HP.
Métodos
População do Estudo
Este estudo de observação, de centro único e retrospectivo incluiu 300 pacientes consecutivos, candidatos a TxC, observados entre novembro de 2003 e dezembro de 2013. A população incluiu 95 pacientes com hipertensão pulmonar fixa. Dentre eles, 30 pacientes foram tratados com sildenafila e acabaram passando pelo transplante, formando o Grupo A. O Grupo B incluiu 205 pacientes sem HP fixa que passaram pelo TxC.
No grupo A, a sildenafila foi administrada via oral a 20 mg t.i.d., durante um período médio de 65 dias (faixa 4 - 81) antes do TxC. A sildenafila foi bem tolerada em todos os pacientes envolvidos, sem que eventos adversos sérios tivessem sido observados.
Coleta de Dados
Dados clínicos, laboratoriais e hemodinâmicos foram extraídos usando um software dedicado. Todos os pacientes passaram por um cateterismo do coração direito (CCD) com um cateter Swan-Ganz, pela veia femoral, antes do começarem a usar a sildenafila. O grupo de pacientes que foram expostos à sildenafila passaram por um segundo CCD para avaliar o efeito hemodinâmico da droga. Depois do TxC, as pressões sistólica do ventrículo direito e diastólica final foram registradas durante a primeira biópsia endomiocárdica, que foi realizada 1 semana após o TxC. Um acompanhamento hemodinâmico tardio foi coletado durante o CCD pré-definido 1 ano após o TxC em ambos os grupos.
O débito cardíaco (DC) foi medido pelo método de Fick, e o índice cardíaco (IC) foi calculado dividindo-se o DC pela área da superfície do corpo. A PCP, a PAPs, a PAPd e a mPAP foram medidas automaticamente. RVP e GTP foram calculados utilizando-se as seguintes fórmulas: GTP (mmHg) = mPAP - PCP; RVP (UW) = GTP/DC.18 Um acompanhamento foi realizado por um período médio de 6,9 anos (faixa 4,2 - 6,9 anos) por entrevista pessoal na clínica, análise de registros hospitalares e contato telefônico, e foi realizado para todos os pacientes incluídos. A confidencialidade foi sempre respeitada.
Endpoints
As medidas de resultados coprimários foram (1) Pressão sistólica de VD e pressão diastólica final (a última usada como substituta da função VD) 7 dias após o TxC e (2) a PAPs e RVP, 1 ano após o TxC. O resultado secundário foi a mortalidade global após o TxC. Os endpoints forma comparados entre grupos pré-definidos.
Análise Estatística
Variáveis contínuas foram distribuídas normalmente e avaliado usando-se o teste de Shapiro-Wilk, e expressas como média ± desvio padrão, e as com distribuição não normal foram expressas como média (faixa interquartil). Variáveis dicotômicas foram expressas como frequências (porcentagens). Para comparar dados entre os grupos, utilizamos o teste T de Student (teste T não pareado) para variáveis contínuas, teste Mann-Whitney para dados não contínuos, e teste qui-quadrado (Fisher, conforme apropriado) para dados dicotômicos. O teste de McNemar foi usado para análise de dados categóricos pareados. As curvas de sobrevivência de Kaplan-Meyer foram construídas e comparadas usando o teste Log-rank. A sobrevivência condicional foi avaliada limitando-se o grupo de pacientes analisado aos que sobreviveram pelo menos 1 ano. A análise total foi realizada utilizando-se o software STATA 12.0 (College Station, Texas, EUA). Os gráficos foram construídos com o software GraphPad 5.0 (La Jolla, California, EUA). Neste estudo, um P valor < 0,05 foi considerado estatisticamente significativo.
Resultados
Todos os 235 pacientes passaram por TxC com sucesso. As características da linha de base são apresentadas na Tabela 1. A maioria dos pacientes era do sexo masculino, e a média de idade do grupo A foi de 53,6 ± 10,9 anos, e do grupo B 52,9 ± 13,4 anos (p = 0,545). A hemodinâmica pré-TxC é apresentada na Tabela 2 e foi significativamente diferente entre os grupos. Os pacientes do grupo A apresentaram hemodinâmica pulmonar mais grave do que os pacientes do grupo B. Após o tratamento com sildenafila, mas antes do TxC, o RVP (-39%) e a PAPs (-10%) diminuíram significativamente (Tabela 3).
Tabela 1. – Características de pacientes com (Grupo A) e sem (Grupo B) pré-tratamento com sildenafila antes do transplante cardíaco.
| Característica a | Grupo A (n=30) | Grupo B (n = 205) | Valor de p b |
|---|---|---|---|
| Média de idade, anos | 53,6 ± 10,9 | 52,9 ± 13,4 | 0,545 |
| Sexo masculino, % | 86,7 | 76,2 | 0,247 |
| Etiologia | |||
| Isquêmica, % | 50,0 | 34,0 | 0,346 |
| Idiopática, % | 36,7 | 56,3 | |
| Hipertrófica, % | 3,3 | 4,4 | |
| Restritiva, % | 10,0 | 2,9 | |
| Congênita, % | 0,0 | 2,4 | |
| Classe NYHA | |||
| III, % | 33,3 | 36,4 | 0,968 |
| IV, % | 66,7 | 63,6 | |
| Parâmetros laboratoriais | |||
| Hemoglobina, g/dl | 12,3 ± 1,8 | 12,7 ± 1,7 | 0,815 |
| Creatinina, mg/dl | 1,4 ± 1,0 | 1,3 ± 0,5 | 0,060 |
| BNP, pg/ml | 524 [396 - 912] | 625 [306 - 1039] | 0,906 |
| Parâmetros cardíacos | |||
| FEVE, % | 19,6 ± 4,5 | 21,2 ± 8,4 | 0,021 |
| Regurgitação mitral | |||
| Leve, % | 16,0 | 12,5 | 0,703 |
| Moderada, % | 32,0 | 34,0 | |
| Moderada a Grave, % | 24,0 | 14,6 | |
| Grave, % | 24,0 | 31,2 | |
| Dispositivos cardíacos | |||
| CDI, % | 40,0 | 21,8 | 0,128 |
| CRT, % | 10,0 | 22,4 | |
| Sildenafila, pré-TxC | |||
| Duração, dias | 65 [4 – 181] |
BNP: peptídeo natriurético do tipo B; TRC: terapia de ressincronização cardíaca; TxC: transplante cardíaco; CDI: cardioversor desfibrilador implantável; FEVE: fração de ejeção do ventrículo esquerdo; NYHA: New York Heart Association. aOs dados são expressos como porcentagens, média ± desvio padrão ou média (faixa interquartil). bTeste T de Student para variáveis contínuas com distribuição normal, teste de Mann-Whitney para variáveis contínuas sem distribuição normal, e Teste qui-quadrado para variáveis categóricas.
Tabela 2. – Variáveis hemodinâmicas antes do transplante cardíaco em pacientes com (Grupo A) e sem (Grupo B) hipertensão grave.
| Variável | Grupo A Média ± DP | Grupo B Média ± DP | Valor de p a |
|---|---|---|---|
| RVP, UW | 5,4 ± 2,3 | 2,7 ± 1,8 | <0,001 |
| PAPs (mmHg) | |||
| Sistólica | 58,9 ± 16,4 | 44,5 ± 15,2 | <0,001 |
| Diastólica | 23,1 ± 8,2 | 19,4 ± 8,0 | 0,025 |
| Média | 36,4 ± 10,7 | 29,0 ± 10,3 | 0,001 |
| DC, litros/min | 3,7 ± 1,2 | 3,6 ± 1,0 | 0,645 |
| PS, mmHg | |||
| Sistólica | 75,0 ± 12,2 | 74,9 ± 10,8 | 0,980 |
| FC, ppm | 76 ± 18 | 76 ± 16 | 0,873 |
PS: pressão sanguínea; FC: frequência cardíaca; DC: débito cardíaco; PAP: pressão arterial pulmonar; RVP: resistência vascular pulmonar; DP: desvio padrão. aFoi usado o teste T de Student.
Tabela 3. – Variáveis hemodinâmicas antes e depois do Transplante cardíaco em pacientes com (Grupo A) e sem (Grupo B) pré-tratamento com sildenafila.
| Qualificação para CCD | CCD 3-meses após sildenafila | BEM 7 dias após o TxC | CCD de 1 ano | |||||
|---|---|---|---|---|---|---|---|---|
| PAPs (mmHg) | RVP (UW) | PAPs (mmHg) | RVP (UW) | VD sistólica pressão (mmHg) | VD diastólica final pressão (mmHg) | PAPs (mmHg) | RVP (UW) | |
| Sem sildenafila | 44,5 (15,2) | 2,7 (1,8) | -- | -- | 36,5 (11,5) | 7,0 (7,1) | 30,48 (8,23) | 1,8 (1,0) |
| Sildenafila | 58,9 (16,4) | 5,4 (2,3) | 52,8 (17,1)c | 3,3 (2,3)d | 40,3 (8,0) | 7,9 (5,8) | 32,43 (6,39) | 1,8 (0,8) |
| Valor de pa | < 0,001 | < 0,001 | -- | -- | 0,022b | 0,374b | 0,274 | 0,789 |
BEM: biópsia endomiocárdica; RVP: resistência vascular pulmonar; CCD: cateterismo do coração direito; UW: unidades Wood. a Teste t de Student comparando pacientes sem sildenafila pacientes a pacientes tratados com sildenafila. bTeste de McNemmar. cp = 0,845 versus pacientes sem sildenafila. dp = 0,806 versus pacientes sem sildenafila.
Dados Peri-TxC e Resultados Pós-TxC
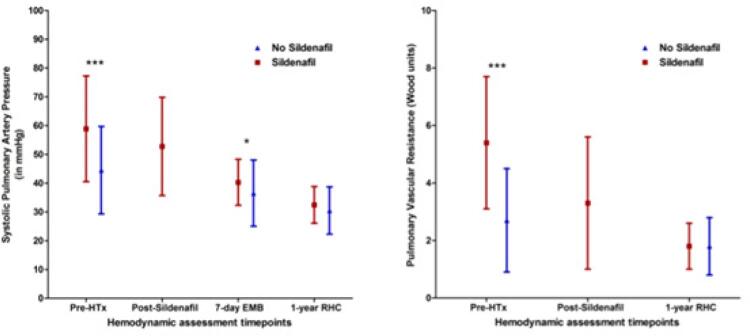
As medidas de endpoints coprimários, avaliadas 1 semana após o TxC, são apresentadas na Tabela 3. A evolução da PAPs durante o período de acompanhamento em ambos os grupos é apresentada na Figura 1. A PAPs diminuiu após o TxC em ambos os grupos, mas permaneceu significativamente alta no grupo A em relação ao grupo B (40,3 ± 8,0 mmHg versus 36,5 ± 11,5 mmHg, p=0,022). Não foram encontradas diferenças em relação à pressão diastólica final do VD uma semana após o TxC, usado como substituo da disfunção de VD inicial (Tabela 3). Um ano após o TxC, a PAPs era 32,4 ± 6,3 mmHg no Grupo A versus 30,5 ± 8,2 mmHg no Grupo B (P=0,274) (Tabela 3). A RVP também foi semelhante entre os dois grupos (1,8 ± 0,8 mmHg versus 1,8 ± 1,0 UW, p = 0,789).
Figura 1. – (Painel esquerdo) Pressão arterial pulmonar sistólica (PAPs, em mmHg) em quatro momentos diferentes: linha de base antes do transplante cardíaco (TxC) sem tratamento com sildenafila, antes do TxC com tratamento com sildenafila, logo após o TxC (7 dias) e muito tempo após o TxC (um ano). ***p < 0,001, * p = 0,022. (Painel direito) Resistência vascular pulmonar (RVP, em unidades Wood) em três pontos no tempo diferentes: linha de base antes do (TxC) sem tratamento com sildenafila, antes do TxC com tratamento com sildenafila, e mais tarde após o TxC (um ano). *** p < 0,001, * p = 0,789. BEM: biópsia endomiocárdica; TxC: transplante cardíaco; CCD: cateterismo do coração direito.
Análise dos Índices de Sobrevivência
A mortalidade global pós TxC é apresentada na Figura 2 (Log-rank p = 0,055). O índice de sobrevivência após o TxC do grupo A foi 97% após 30 dias, 87% após 6 meses, e 80% após um ano. No grupo B, a sobrevivência após os mesmos períodos foi de 96%, 93% e 91%, respectivamente. A diferença no ponto temporal de um ano não foi estatisticamente significativa (Log-rank p = 0,063). Depois do primeiro ano, o índice de mortalidade era similar entre os dois grupos, conforme mostrado na Figura 3 (sobrevivência condicional após 1 ano, Log-rank p = 0,321).
Figura 2. – Análise de Kaplan-Meier da mortalidade global após o transplante de acordo com o grupo de tratamento com sildenafila. Log-rank p = 0,063.
Figura 3. – Análise de Kaplan-Meier, análise de sobrevivência condicional após 1 ano. Log-rank p = 0,321.
Discussão
O tratamento de candidatos a TxC com HP fixa com sildenafila garantiu um período pós-operatório bem-sucedido para a maioria dos pacientes para os quais o TxC havia sido contraindicado inicialmente. Embora apresentassem hemodinâmica pior logo após o TxC, e mortalidade numericamente mais alta durante o primeiro ano, o prognóstico durante o acompanhamento de médio a longo prazo foi semelhante ao dos pacientes de TxC sem HP.
O limite entre HP fixa e reversível não é claro e não há concordância sobre o tempo necessário para se atingir o nível de irreversibilidade teórica ou sobre os melhores parâmetros para definir esse status.12 Em nosso centro, o CCD é utilizado rotineiramente com um teste vasodilatador, pois pose ser útil para estabelecer o risco de morte após o TxC.5 Uma das variáveis mais úteis para avaliar o risco é a RVP.13 Conforme demonstrado por Taylor et al.19 a RVP é um indicador independente de morte precoce após o TxC. Esse grupo relatou que o índice de sobrevivência em pacientes de TxC foi significativamente melhor quando o RVP ficava entre 1 e 3 UW, em comparação com pacientes com RVP entre 3 a 5 UW. Pacientes com RVP > 5 UW apresentaram os piores resultados. Em nosso estudo, utilizamos a sildenafila para diminuir a RVP (3,3 ± 2,3 UW), qualificando, dessa forma, os pacientes para o TxC. Na verdade, entre nossos pacientes que foram tratados com sildenafila, a RVP média era significativamente elevada e excluiria a possibilidade de TxC (5,4 ± 2,3 UW), se não fosse feita nenhuma intervenção. Se esses pacientes não fossem transplantados, seu prognóstico com tratamento médico teria sido ruim, a menos que um dispositivo de assistência ventricular (LVAD, do inglês left ventricular assist device) fosse implantado.
Curiosamente, dois estudos recentes sugeriram que o suporte do LVAD e a descarga mecânica não pulsante contínua do VE pode reverter uma hipertensão pulmonar que anteriormente não respondia a medicação, e tornar os pacientes aptos ao TxC.20,21 É interessante notar que a RVP pré-LVAD nesses estudos (4,3 ± 1,7 UW e 4,8 ± 1,8 UW) foi semelhante à do nosso estudo coorte (5,4 ± 2,3 UW). De acordo com Perez-Villa et al.22 uma estratégia de redução da RVP elevada usando terapia via oral (sildenafila ou bosentana) em pacientes considerados não aptos ao TxC devido à RVP elevada é viável e pode reduzir o risco de disfunção de VD pós-operatória, como também demonstramos em nosso estudo.
Os inibidores de PDE5 têm despertado o interesse no campo da doença do coração esquerdo.6,12Além da terapia padrão de IC, a intervenção com sildenafila pode melhorar os parâmetros hemodinâmicos pulmonares.6,12 Esses efeitos favoráveis surgem de sua inibição seletiva de guanosina monofosfato cíclico (GMPc) nos vasos pulmonares, que promove a vasodilatação e menos remodelagem, além de um efeito semelhante ao da milrinona no VD, devido a um processo de diafonia molecular que pode inibir o PDE3 e aumentar a contratilidade do VD.15,18Em uma meta-análise recente,2 identificou-se que o tratamento com sildenafila reduz a RVP em comparação com o uso de placebo (diferença de média ponderada -1,0 UW, p < 0,01).2 Nosso estudo também demonstrou que a administração de sildenafila pré-TxC em candidatos ao TxC com HP teve um efeito hemodinâmico positivo ao reduzir a RVP em aproximadamente 2 UW.
A insuficiência circulatória do lado direito é a morbidade a ela associada ainda são uma fonte importante de morte no perioperatório para pacientes de TxC. Pons et al.12 também avaliaram os efeito do uso continuado de sildenafila nos resultados clínicos de TxC (acompanhamento médio, 3,4 ± 2,1 anos). Neste estudo, o índice de sobrevivência após o TxC no grupo de pacientes pré-tratados com sildenafila (incluindo apenas 15 pacientes) foi de 87% após 30 dias. É importante observar que nenhum outro paciente morreu durante o período de acompanhamento de 5 anos após o TxC. Comparativamente, o índice de sobrevivência do grupo A foi 97% após 30 dias e 70% após cinco anos. Em conformidade com isso, no ISHLT - International Registry for Heart Transplantation, o índice de sobrevivência após 5 anos era de 72%, semelhante a nosso grupo de pacientes com HP fixa pré-tratada com sildenafila.23
Por todos esses motivos, uma estratégia usando a sildenafila para reduzir a RVP pode ser considerada uma “terapia de resgate” valiosa em um grupo de pacientes com IC terminal, que não estariam aptos ao TxC de outra forma. Nossos dados mostram que ela está associada a índices de mortalidade no perioperatório e em longo prazo semelhantes aos observados em pacientes sem HP.
Limitações
As limitações deste estudo incluem sua natureza retrospectiva e não controlada, o que pode condicionar uma seleção tendenciosa. Entretanto, incluímos todos os pacientes que foram transplantados consecutivamente em nosso centro, e nenhum paciente foi perdido durante o período de acompanhamento. Além disso, o tamanho de nossa amostra é relativamente pequeno, o que limita o poder estatístico. No entanto, relatamos o que acreditamos ser a maior série existentes de pacientes de TxC pré-tratados com sildenafila. Outra limitação é a ausência de medições diretas da função do VD imediatamente após o TxC. Tentamos compensar esse fato utilizando uma medição hemodinâmica da função do VD coletada 7 dias após o procedimento. Apesar de todas essas limitações, acreditamos que os resultados podem ter validade externa para outras populações com IC avançada, já que os dados demográficos, clínicos e hemodinâmicos estão alinhados com os relatados em outros estudos.
Conclusão
O uso de sildenafila em candidatos a TxC com HP fixa melhorou a hemodinâmica pulmonar, levando-a a um limiar em que o transplante seria possível. Nesse grupo de pacientes de alto risco, a hemodinâmica pós-operatória inicial e os resultados foram ligeiramente comprometidos, em comparação com pacientes sem HP. Entretanto, após 1 ano, os resultados de médio a longo prazo foram semelhantes entre os grupos. Nossos achados corroboram o conceito de que a sildenafila pode resgatar pacientes previamente inaptos para o TxC.
Vinculação Acadêmica
Não há vinculação deste estudo a programas de pós-graduação.
Aprovação Ética e Consentimento Informado
Este artigo não contém estudos com humanos ou animais realizados por nenhum dos autores.
Fontes de Financiamento.O presente estudo não teve fontes de financiamento externas.
Referências
- 1.. Ferreira AR, Mendes S, Leite L, Monteiro S, Pego M. Pulse pressure can predict mortality in advanced heart failure. Rev Port Cardiol. 2016;35(4):225-8. [DOI] [PubMed]; Ferreira AR, Mendes S, Leite L, Monteiro S, Pego M. Pulse pressure can predict mortality in advanced heart failure. Rev Port Cardiol. 2016;35(4):225–228. doi: 10.1016/j.repc.2015.11.012. [DOI] [PubMed] [Google Scholar]
- 2.. Wu X, Yang T, Zhou Q, Li S, Huang L. Additional use of a phosphodiesterase 5 inhibitor in patients with pulmonary hypertension secondary to chronic systolic heart failure: a meta-analysis. Eur J Heart Fail. 2014;16(4):444-53. [DOI] [PubMed]; Wu X, Yang T, Zhou Q, Li S, Huang L. Additional use of a phosphodiesterase 5 inhibitor in patients with pulmonary hypertension secondary to chronic systolic heart failure: a meta-analysis. Eur J Heart Fail. 2014;16(4):444–453. doi: 10.1002/ejhf.47. [DOI] [PubMed] [Google Scholar]
- 3.. Lam CSP, Roger VL, Rodeheffer RJ, Borlaug BA, Enders FT, Redfield MM. Pulmonary hypertension in heart failure with preserved ejection fraction: a community-based study. J Am Coll Cardiol. 2009;53(13):1119-26. [DOI] [PMC free article] [PubMed]; Lam CSP, Roger VL, Rodeheffer RJ, Borlaug BA, Enders FT, Redfield MM. Pulmonary hypertension in heart failure with preserved ejection fraction: a community-based study. J Am Coll Cardiol. 2009;53(13):1119–1126. doi: 10.1016/j.jacc.2008.11.051. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.. Bursi F, McNallan SM, Redfield MM, Nkomo VT, Lam CSP, Weston SA, et al. Pulmonary pressures and death in heart failure: a community study. J Am Coll Cardiol. 2012;59(3):222-31. [DOI] [PMC free article] [PubMed]; Bursi F, McNallan SM, Redfield MM, Nkomo VT, Lam CSP, Weston SA, et al. Pulmonary pressures and death in heart failure: a community study. J Am Coll Cardiol. 2012;59(3):222–231. doi: 10.1016/j.jacc.2011.06.076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.. Reichenbach A, Al-Hiti H, Malek I, Pirk J, Goncalvesova E, Kautzner J, et al. The effects of phosphodiesterase 5 inhibition on hemodynamics, functional status and survival in advanced heart failure and pulmonary hypertension: a case-control study. Int J Cardiol. 2013;168(1):60-5. [DOI] [PubMed]; Reichenbach A, Al-Hiti H, Malek I, Pirk J, Goncalvesova E, Kautzner J, et al. The effects of phosphodiesterase 5 inhibition on hemodynamics, functional status and survival in advanced heart failure and pulmonary hypertension: a case-control study. Int J Cardiol. 2013;168(1):60–65. doi: 10.1016/j.ijcard.2012.09.074. [DOI] [PubMed] [Google Scholar]
- 6.. Guglin M, Rajagopalan N, Anaya P, Charnigo R. Sildenafil in heart failure with reactive pulmonary hypertension (Sildenafil HF) clinical trial (rationale and design). Pulm Circ. 2016;6(2):161-7. [DOI] [PMC free article] [PubMed]; Guglin M, Rajagopalan N, Anaya P, Charnigo R. Sildenafil in heart failure with reactive pulmonary hypertension (Sildenafil HF) clinical trial (rationale and design) Pulm Circ. 2016;6(2):161–167. doi: 10.1086/685548. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.. Moreira N, Baptista R, Costa S, Franco F, Pêgo M, Antunes M. Lowering pulmonary wedge pressure after heart transplant: pulmonary compliance and resistance effect. Arq Bras Cardiol. 2015;105(3):292-300. [DOI] [PMC free article] [PubMed]; Moreira N, Baptista R, Costa S, Franco F, Pêgo M, Antunes M. Lowering pulmonary wedge pressure after heart transplant: pulmonary compliance and resistance effect. Arq Bras Cardiol. 2015;105(3):292–300. doi: 10.5935/abc.20150083. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.. Guglin M, Khan H. Pulmonary hypertension in heart failure. J Card Fail. 2010;16(6):461-74. [DOI] [PubMed]; Guglin M, Khan H. Pulmonary hypertension in heart failure. J Card Fail. 2010;16(6):461–474. doi: 10.1016/j.cardfail.2010.01.003. [DOI] [PubMed] [Google Scholar]
- 9.. Guazzi M. Pulmonary hypertension in heart failure preserved ejection fraction: prevalence, pathophysiology, and clinical perspectives. Circ Heart Fail. 2014;7(2):367-77. [DOI] [PubMed]; Guazzi M. Pulmonary hypertension in heart failure preserved ejection fraction: prevalence, pathophysiology, and clinical perspectives. Circ Heart Fail. 2014;7(2):367–377. doi: 10.1161/CIRCHEARTFAILURE.113.000823. [DOI] [PubMed] [Google Scholar]
- 10.. Hefke T, Zittermann A, Fuchs U, Schulte-Eistrup S, Gummert JF, Schulz U. Bosentan effects on hemodynamics and clinical outcome in heart failure patients with pulmonary hypertension awaiting cardiac transplantation. Thorac Cardiovasc Surg. 2012;60(1):26-34. [DOI] [PubMed]; Hefke T, Zittermann A, Fuchs U, Schulte-Eistrup S, Gummert JF, Schulz U. Bosentan effects on hemodynamics and clinical outcome in heart failure patients with pulmonary hypertension awaiting cardiac transplantation. Thorac Cardiovasc Surg. 2012;60(1):26–34. doi: 10.1055/s-0030-1250726. [DOI] [PubMed] [Google Scholar]
- 11.. Costard-Jäckle A, Fowler MB. Influence of preoperative pulmonary artery pressure on mortality after heart transplantation: testing of potential reversibility of pulmonary hypertension with nitroprusside is useful in defining a high risk group. J Am Coll Cardiol. 1992;19(1):48-54. [DOI] [PubMed]; Costard-Jäckle A, Fowler MB. Influence of preoperative pulmonary artery pressure on mortality after heart transplantation: testing of potential reversibility of pulmonary hypertension with nitroprusside is useful in defining a high risk group. J Am Coll Cardiol. 1992;19(1):48–54. doi: 10.1016/0735-1097(92)90050-w. [DOI] [PubMed] [Google Scholar]
- 12.. Pons J, Leblanc MH, Bernier M, Cantin B, Bourgault C, Bergeron S, et al. Effects of chronic sildenafil use on pulmonary hemodynamics and clinical outcomes in heart transplantation. J Heart Lung Transplant. 2012;31(12):1281-7. [DOI] [PubMed]; Pons J, Leblanc MH, Bernier M, Cantin B, Bourgault C, Bergeron S, et al. Effects of chronic sildenafil use on pulmonary hemodynamics and clinical outcomes in heart transplantation. J Heart Lung Transplant. 2012;31(12):1281–1287. doi: 10.1016/j.healun.2012.09.009. [DOI] [PubMed] [Google Scholar]
- 13.. Taylor DO, Stehlik J, Edwards LB, Aurora P, Christie JD, Dobbels F, et al. Registry of the International Society for Heart and lung transplantation: Twenty-sixth Official Adult Heart Transplant Report-2009. J Heart Lung Transplant. 2009;28(10):1007-22. [DOI] [PubMed]; Taylor DO, Stehlik J, Edwards LB, Aurora P, Christie JD, Dobbels F, et al. Registry of the International Society for Heart and lung transplantation: Twenty-sixth Official Adult Heart Transplant Report-2009. J Heart Lung Transplant. 2009;28(10):1007–1022. doi: 10.1016/j.healun.2009.08.014. [DOI] [PubMed] [Google Scholar]
- 14.. Costanzo MR, Augustine S, Bourge R, Bristow M, O’Connell JB, Driscoll D, et al. Selection and treatment of candidates for heart transplantation. A statement for health professionals from the Committee on Heart Failure and Cardiac Transplantation of the Council on Clinical Cardiology, American Heart Association. Circulation. 1995;92(12):3593-612. [DOI] [PubMed]; Costanzo MR, Augustine S, Bourge R, Bristow M, O’Connell JB, Driscoll D, et al. Selection and treatment of candidates for heart transplantation. A statement for health professionals from the Committee on Heart Failure and Cardiac Transplantation of the Council on Clinical Cardiology, American Heart Association. Circulation. 1995;92(12):3593–3612. doi: 10.1161/01.cir.92.12.3593. [DOI] [PubMed] [Google Scholar]
- 15.. Schwartz BG, Levine LA, Comstock G, Stecher VJ, Kloner RA. Cardiac uses of phosphodiesterase-5 inhibitors. J Am Coll Cardiol. 2012;59(1):9-15. [DOI] [PubMed]; Schwartz BG, Levine LA, Comstock G, Stecher VJ, Kloner RA. Cardiac uses of phosphodiesterase-5 inhibitors. J Am Coll Cardiol. 2012;59(1):9–15. doi: 10.1016/j.jacc.2011.07.051. [DOI] [PubMed] [Google Scholar]
- 16.. Lewis GD, Lachmann J, Camuso J, Lepore JJ, Shin J, Martinovic ME, et al. Sildenafil improves exercise hemodynamics and oxygen uptake in patients with systolic heart failure. Circulation. 2007;115(1):59-66. [DOI] [PubMed]; Lewis GD, Lachmann J, Camuso J, Lepore JJ, Shin J, Martinovic ME, et al. Sildenafil improves exercise hemodynamics and oxygen uptake in patients with systolic heart failure. Circulation. 2007;115(1):59–66. doi: 10.1161/CIRCULATIONAHA.106.626226. [DOI] [PubMed] [Google Scholar]
- 17.. Groote P, El Asri C, Fertin M, Goéminne C, Vincentelli A, Robin E, et al. Sildenafil in heart transplant candidates with pulmonary hypertension. Arch Cardiovasc Dis. 2015;108(6-7):375-84. [DOI] [PubMed]; Groote P, El Asri C, Fertin M, Goéminne C, Vincentelli A, Robin E, et al. Sildenafil in heart transplant candidates with pulmonary hypertension. Arch Cardiovasc Dis. 2015;108(6-7):375–384. doi: 10.1016/j.acvd.2015.01.013. [DOI] [PubMed] [Google Scholar]
- 18.. Galie N, Humbert M, Vachieryc JL, Gibbs S, Lang I, Torbicki A, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J. 2015;37(1):67-119. [DOI] [PubMed]; Galie N, Humbert M, Vachieryc JL, Gibbs S, Lang I, Torbicki A, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT) Eur Heart J. 2015;37(1):67–119. doi: 10.1093/eurheartj/ehv317. [DOI] [PubMed] [Google Scholar]
- 19.. Trulock EP, Edwards LB, Taylor DO, Boucek MM, Keck BM, Hertz MI. The Registry of the International Society for Heart and Lung Transplantation: twenty-first official adult lung and heart-lung transplant report--2004. J Heart Lung Transplant. 2004;23(7):804-15. [DOI] [PubMed]; Trulock EP, Edwards LB, Taylor DO, Boucek MM, Keck BM, Hertz MI. The Registry of the International Society for Heart and Lung Transplantation: twenty-first official adult lung and heart-lung transplant report--2004. J Heart Lung Transplant. 2004;23(7):804–815. doi: 10.1016/j.healun.2004.05.013. [DOI] [PubMed] [Google Scholar]
- 20.. Alba AC, Rao V, Ross HJ, Jensen AS, Sander K, Gustafsson F, et al. Impact of fixed pulmonary hypertension on post–heart transplant outcomes in bridge-to-transplant patients. J Heart Lung Transplant. 2010;29(11):1253-8. [DOI] [PubMed]; Alba AC, Rao V, Ross HJ, Jensen AS, Sander K, Gustafsson F, et al. Impact of fixed pulmonary hypertension on post–heart transplant outcomes in bridge-to-transplant patients. J Heart Lung Transplant. 2010;29(11):1253–1258. doi: 10.1016/j.healun.2010.06.002. [DOI] [PubMed] [Google Scholar]
- 21.. Etz CD, Welp HA, Tjan TDT, Hoffmeier A, Weigang E, Scheld HH, et al. Medically refractory pulmonary hypertension: treatment with nonpulsatile left ventricular assist devices. Ann Thorac Surg. 2007;83(5):1697-705. [DOI] [PubMed]; Etz CD, Welp HA, Tjan TDT, Hoffmeier A, Weigang E, Scheld HH, et al. Medically refractory pulmonary hypertension: treatment with nonpulsatile left ventricular assist devices. Ann Thorac Surg. 2007;83(5):1697–1705. doi: 10.1016/j.athoracsur.2007.01.019. [DOI] [PubMed] [Google Scholar]
- 22.. Perez-Villa F, Farrero M, Sionis A, Castel A, Roig E. Therapy with sildenafil or bosentan decreases pulmonary vascular resistance in patients ineligible for heart transplantation because of severe pulmonary hypertension. J Heart Lung Transplant. 2010;29(7):817-8. [DOI] [PubMed]; Perez-Villa F, Farrero M, Sionis A, Castel A, Roig E. Therapy with sildenafil or bosentan decreases pulmonary vascular resistance in patients ineligible for heart transplantation because of severe pulmonary hypertension. J Heart Lung Transplant. 2010;29(7):817–818. doi: 10.1016/j.healun.2010.02.004. [DOI] [PubMed] [Google Scholar]
- 23.. Yusen RD, Edwards LB, Dipchand AI, Goldfarb SB, Kucheryavaya AY, Levvey BJ, et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Lung and Heart–Lung Transplant Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant. J Heart Lung Transplant. 2016;35(10):1170-84. [DOI] [PubMed]; Yusen RD, Edwards LB, Dipchand AI, Goldfarb SB, Kucheryavaya AY, Levvey BJ, et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Lung and Heart–Lung Transplant Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant. J Heart Lung Transplant. 2016;35(10):1170–1184. doi: 10.1016/j.healun.2016.09.001. [DOI] [PubMed] [Google Scholar]