Abstract
Introducción y objetivos
La enfermedad por coronavirus de 2019 (COVID-19) está causada por el segundo coronavirus del síndrome respiratorio agudo y grave. La fibrilación auricular (FA) es común en situaciones agudas, en las que conlleva más complicaciones y mortalidad.
Métodos
Análisis del Registro internacional HOPE (NCT04334291); el objetivo es evaluar la información pronóstica de FA en pacientes con COVID-19. Se realizó un análisis multivariable y un emparejamiento por puntuación de propensión para evaluar la relación entre FA y mortalidad. Además, se evaluó en estos pacientes el impacto en la mortalidad y los eventos embólicos de la puntuación CHA2DS2-VASc.
Resultados
Entre los 6.217 pacientes inscritos en el registro HOPE, 250 tenían FA (4,5%). Los pacientes con FA tenían una mayor prevalencia de factores de riesgo cardiovascular y comorbilidades. Después del emparejamiento por puntuación de propensión, estas diferencias se atenuaron. A pesar de ello, los pacientes con FA tuvieron una mayor incidencia de complicaciones hospitalarias como insuficiencia cardiaca (el 19,3 frente al 11,6%; p = 0,021) e insuficiencia respiratoria (el 75,9 frente al 62,3%; p = 0,002), así como una mayor tasa de mortalidad a los 60 días (el 43,4 frente al 30,9%; p = 0,005). En el análisis multivariado, la FA se asoció de manera independiente con una mayor mortalidad a los 60 días (hazard ratio = 1,234; IC95%, 1,003-1,519). La puntuación CHA2DS2-VASC predice de manera aceptable la mortalidad a los 60 días de los pacientes con COVID-19 (área ROC = 0,748; IC95%, 0,733-0,764), pero no su riesgo embólico (área ROC = 0,411; IC95%, 0,147-0,675).
Conclusiones
La FA en pacientes con COVID-19 se asocia con más complicaciones y mayor mortalidad a los 60 días. La puntuación CHA2DS2-VASc puede ser un buen marcador de riesgo en pacientes con COVID-19, pero no predice su riesgo embólico.
Palabras clave: COVID-19, SARS-CoV-2, Mortalidad, Registro, Pronóstico, Fibrilación auricular, CHA2DS2-VASc, Hemorragia
Abreviaturas: AF, atrial fibrillation; PSM, propensity score matching
Abstract
Introduction and objectives
Coronavirus disease 2019 (COVID-19) is caused by severe acute respiratory syndrome coronavirus 2. Atrial fibrillation (AF) is common in acute situations, where it is associated with more complications and higher mortality.
Methods
Analysis of the international HOPE registry (NCT04334291). The objective was to assess the prognostic information of AF in COVID-19 patients. A multivariate analysis and propensity score matching were performed to assess the relationship between AF and mortality. We also evaluated the impact on mortality and embolic events of the CHA2DS2-VASc score in these patients.
Results
Among 6217 patients enrolled in the HOPE registry, 250 had AF (4.5%). AF patients had a higher prevalence of cardiovascular risk factors and comorbidities. After propensity score matching, these differences were attenuated. Despite this, patients with AF had a higher incidence of in-hospital complications such as heart failure (19.3% vs 11.6%, P = .021) and respiratory insufficiency (75.9% vs 62.3%, P = .002), as well as a higher 60-day mortality rate (43.4% vs 30.9%, P = .005). On multivariate analysis, AF was independently associated with higher 60-day mortality (hazard ratio, 1.234; 95%CI, 1.003-1.519). CHA2DS2-VASc score acceptably predicts 60-day mortality in COVID-19 patients (area ROC, 0.748; 95%CI, 0.733-0.764), but not its embolic risk (area ROC, 0.411; 95%CI, 0.147-0.675).
Conclusions
AF in COVID-19 patients is associated with a higher number of complications and 60-day mortality. The CHA2DS2-VASc score may be a good risk marker in COVID patients but does not predict their embolic risk.
Keywords: COVID-19, SARS-CoV-2, Mortality, Registry, Prognosis, Atrial fibrillation, CHA2DS2-VASc, Bleeding
INTRODUCCIÓN
En enero de 2020 se identificó un nuevo virus, conocido como coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2), como el único agente causal de un conglomerado de casos de neumonía detectados inicialmente en la ciudad china de Wuhan, en la provincia de Hubei1. El SARS-CoV-2, que provoca la enfermedad que ahora se denomina enfermedad por coronavirus de 2019 (COVID-19), se ha extendido desde China hacia el resto del mundo2, 3.
Actualmente se desconoce el porcentaje de portadores infectados asintomáticos, pero varios estudios indican que podría ser muy elevado4. En pacientes sintomáticos, al parecer, la variedad clínica de la infección por SARS-CoV-2 es amplia y abarca desde una enfermedad leve de las vías respiratorias altas hasta una neumonía viral grave con insuficiencia respiratoria e incluso la muerte5. La mayoría de los casos mortales son de pacientes de edad avanzada o con comorbilidades médicas subyacentes, como enfermedad cardiovascular, hipertensión, diabetes mellitus, enfermedad pulmonar crónica e insuficiencia renal crónica6, 7.
La fibrilación auricular (FA) es la arritmia más frecuente en el mundo y su prevalencia es mayor entre los pacientes con factores de riesgo cardiovascular y otras comorbilidades8. Esta arritmia es común en el contexto de situaciones agudas, como infarto de miocardio, cirugía cardiaca o infecciones, en las que se relaciona con mayor riesgo de complicaciones y mortalidad9. Sin embargo, no hay ningún trabajo que aborde específicamente el impacto de la FA en el pronóstico de la COVID-19. A continuación se presentan los detalles de un registro internacional de pacientes dados de alta de un hospital con infección por SARS-CoV-2 sospechada o confirmada por un laboratorio y resultados clínicos claros. Nuestro objetivo es describir las características clínicas y el pronóstico de los pacientes con COVID-19 y FA y evaluar las repercusiones de esta arritmia en el pronóstico de la enfermedad a corto plazo. Además, también se trata de investigar el impacto de la puntuación CHA2DS2-VASc y el tratamiento anticoagulante durante el ingreso en el pronóstico de esta población. La puntuación CHA2DS2-VASc es un esquema simple de estratificación del riesgo de accidente cerebrovascular, basado en un enfoque de factores de riesgo (insuficiencia cardiaca congestiva/disfunción ventricular izquierda, hipertensión, edad, diabetes mellitus, accidente cerebrovascular, enfermedad vascular y sexo), y ofrece un buen valor predictivo de eventos embólicos en pacientes con FA8, 10.
MÉTODOS
Diseño del estudio y población
Este es un subanálisis del registro de evaluación predictiva de resultados de salud HOPE (Health Outcome Predictive Evaluation) para la COVID-19 con una muestra de estudio general de 6.217 pacientes con un diagnóstico definitivo o alta sospecha de infección por SARS-CoV-211. En resumen, el registro HOPE es un registro de cohortes retrospectivo (es decir, del tipo de todos los pacientes en la «vida real»), con participación voluntaria y sin compensación económica. Todos los pacientes dados de alta (muertos o vivos) después de los ingresos hospitalarios por COVID-19 fueron adecuados para el estudio. No hubo criterios de exclusión, excepto por la negativa explícita de los pacientes a participar. Desde el 23 de marzo hasta el 1 de junio de 2020, se evaluó en el presente estudio a todos los pacientes que cumplían los criterios de inclusión de 24 centros de España. Se recopilaron datos clínicos y demográficos en el momento de la inclusión y durante la hospitalización. El estudio se realizó de acuerdo con los principios éticos de la Declaración de Helsinki y las guías de buena práctica clínica y fue aprobado por el Comité Ético de Investigación del Hospital Clínico San Carlos (Madrid, España) (20/241-E). Se renunció al consentimiento informado por escrito debido a las características del registro anónimo y la gravedad de la situación. Sin embargo, se exigió al menos la autorización verbal del paciente (o del familiar o cuidador cuando no se podía disponer de la de aquel). En el material adicional se adjunta la lista de hospitales participantes, investigadores, colaboradores y del protocolo.
Definiciones y resultados del estudio
Se dividió en 2 grupos a los pacientes incluidos según los antecedentes de FA. Las definiciones del estudio se presentan en el sitio web del registro12. El criterio de valoración principal fue la mortalidad por cualquier causa a los 60 días en cualquiera de las cohortes. Se valoró si la puntuación de riesgo CHA2DS2-VASc fue útil para evaluar el riesgo de muerte o embolia de los pacientes con COVID-19. La puntuación CHA2DS2-VASc no se registró en el conjunto de datos original, pero se obtuvo de manera retrospectiva para este estudio de investigación. Se dividió a los pacientes inscritos en 3 grupos según su puntuación CHA2DS2-VASc (grupo 1: CHA2DS2-VASc = 0 los varones y ≤ 1 las mujeres; grupo 2: CHA2DS2-VASc = 1 los varones o = 2 las mujeres, y grupo 3: CHA2DS2-VASc > 1 los varones o > 2 las mujeres). Otros eventos clínicamente relevantes se registraron como criterios de valoración secundarios: respiración mecánica invasiva, respiración mecánica no invasiva, insuficiencia respiratoria, insuficiencia cardiaca, insuficiencia renal, sepsis, síndrome de respuesta inflamatoria sistémica, hemorragia clínicamente relevante y eventos embólicos. Los eventos se clasificaron según los criterios de los investigadores locales de acuerdo con las definiciones del registro HOPE COVID-19. Mediante entrevista telefónica, se confirmó que los pacientes dados de alta siguieran con vida a los 60 días.
Análisis estadísticos
Los valores se presentan como media ± desviación estándar de las variables continuas con una distribución normal, mediana [intervalo intercuartílico] de las variables continuas con una distribución no normal y como frecuencia (%) de las variables cualitativas. Se utilizaron la prueba de la t de Student y la prueba de la U de Mann-Whitney para comparar variables continuas con distribuciones normales y no normales cuando procedía. Para comparar variables cualitativas, se utilizó la prueba de la χ2 o la prueba exacta de Fisher. Se realizó un análisis univariante para las variables cualitativas y se comunicó como odds ratio (OR) y su intervalo de confianza del 95% (IC95%). Dada la multiplicidad de variables, solo los factores asociados con la mortalidad por cualquier causa con p < 0,01 en el análisis univariante (edad, sexo, hipertensión, dislipemia, diabetes mellitus, tabaquismo, insuficiencia renal crónica, cardiopatía isquémica, insuficiencia cardiaca, neumopatía, enfermedad cerebrovascular, cáncer, tratamiento con inhibidores del sistema renina-angiotensina-aldosterona, FA, tratamiento con ácido acetilsalicílico, tratamiento anticoagulante, saturación de O2 < 92% en el momento del ingreso, elevación del dímero D, elevación de la proteína C reactiva o elevación de la lactato deshidrogenasa) se introdujeron en el análisis de regresión de Cox multivariante para definir los factores de riesgo independientes del criterio de valoración principal en la población emparejada. El supuesto de proporcionalidad en los riesgos se verificó con la prueba de residuos de Schoenfeld. Se calcularon el índice C y la prueba de Gronnesby y Borgan para determinar la discriminación y la calibración respectivamente. Se utilizaron curvas de Kaplan-Meier para estimar la función en la supervivencia y comparar subgrupos con la prueba del orden logarítmico. Se evaluaron las posibles colinealidades e interacciones con la introducción de términos multiplicativos para calcular la tolerancia y el factor de inflación de la varianza. Se estimó el emparejamiento por puntuación de propensión (EPP) con la FA como variable dependiente y los principales perfiles clínicos en el momento del ingreso (EPP 1:1; tolerancia de 0,01, sin reemplazo, con el método de emparejamiento nearest neighbor) para obtener equilibrio entre grupos. Se utilizó el paquete MatchIt (Ho, Imai, King y Stuart, 2007). Las variables incluidas en el EPP fueron edad, dislipemia, tabaquismo, enfermedad cerebrovascular y neumopatía, y se sumaron exactamente (sexo, hipertensión, diabetes, insuficiencia renal crónica y cualquier tipo de cáncer). El ajuste de calidad generado por el modelo de EPP se muestra en la figura 1 del material adicional. El área bajo la curva de características operativas del receptor (ROC) se utilizó para medir si los modelos discriminaban bien la puntuación CHA2DS2-VASc de la mortalidad por cualquier causa a 60 días y el riesgo de evento embólico hospitalario. Todas las pruebas fueron bilaterales. El análisis estadístico se realizó con el paquete de software IBM SPSS 24.0, el programa STATA versión 15 y el R Core Team (2020).
RESULTADOS
De los 6.217 pacientes consecutivos incluidos en el registro HOPE COVID-19, 250 tenían antecedentes de FA (4,2%) y 1.687 eran varones (60,3%). Después de comparar los principales factores de confusión iniciales, se seleccionó a 233 pacientes con FA y a otros 233 sin FA para el análisis definitivo.
Características basales
Los pacientes que dieron positivo a la infección por SARS-CoV-2 mediante PCR nasofaríngea fueron el 89%. Las características basales de los pacientes con COVID-19 se muestran en la tabla 1 . La media de edad fue 66 ± 17 años, el 57,6% de los pacientes eran varones y el intervalo medio desde el inicio de la enfermedad hasta el ingreso fue de 6 [5] días. Del total de pacientes notificados, 3.020 (50,3%) tenían hipertensión; 2.237 (37,5%), dislipemia; 1.237 (19,9%), diabetes mellitus; 1.243 (30,5%), neumopatía previa; 265 (4,2%), insuficiencia cardiaca y 416 (7,1%), insuficiencia renal crónica.
Tabla 1.
Características de los pacientes con COVID-19 y análisis comparativo según fibrilación auricular
| Antes del EPP |
Después del EPP |
|||||||
|---|---|---|---|---|---|---|---|---|
| Cohorte completa (n = 6.217) | FA (n = 250) |
Sin FA (n = 5.967) |
p | Cohorte completa (n = 466) |
FA (n = 233) |
Sin FA (n = 233) |
p | |
|
Características demográficas | ||||||||
| Varones (%) |
3.579 (57,6) |
171 (68,4) |
3.408 (57,1) |
< 0,001 |
268 (57,5) |
134 (57,5) |
134 (57,5) |
1 |
| Edad (años) |
65,7 ± 16,8 |
79,9 ± 9,9 |
65,1 ± 16,7 |
< 0,001 |
79,4 ± 10,7 |
79,7 ± 9,7 |
79,1 ± 11,5 |
0,538 |
| IMC (kg/m2) |
28,8 ± 5,2 |
28,8 ± 4,4 |
28,8 ± 5,2 |
0,229 |
28,5 ± 4,2 |
28,5 ± 4,2 |
28,6 ± 4,4 |
0,858 |
|
Comorbilidades | ||||||||
| Hipertensión |
3.020 (50,3) |
203 (81,2) |
2.817 (49,0) |
< 0,001 |
378 (81,1) |
189 (81,1) |
189 (81,1) |
1 |
| Diabetes mellitus |
1.237 (19,9) |
77 (30,8) |
1.160 (19,4) |
< 0,001 |
138 (29,6) |
69 (29,6) |
69 (29,6) |
1 |
| Hipercolesterolemia |
2.237 (37,5) |
140 (56,7) |
2.097 (36,7) |
< 0,001 |
262 (56,2) |
132 (56,7) |
130 (55,8) |
0,852 |
| Tabaquismo |
271 (5,1) |
10 (4,1) |
261 (5,1) |
0,478 |
23 (4,9) |
10 (4,3) |
13 (6,3) |
0,354 |
| Neumopatía |
1.243 (30,5) |
87 (47,3) |
1.156 (29,7) |
< 0,001 |
159 (34,1) |
81 (34,8) |
78 (33,5) |
0,769 |
| Enfermedad renal crónica |
416 (7,1) |
370 (88,9) |
46 (18,8) |
< 0,001 |
82 (17,6) |
41 (17,6) |
41 (17,6) |
1 |
| Obesidad |
1.174 (24,5) |
59 (27,7) |
1.115 (24,3) |
0,263 |
103 (27,2) |
56 (28,1) |
47 (26,1) |
0,657 |
| Insuficiencia cardiaca |
265 (4,2) |
15 (6,0) |
250 (4,2) |
0,234 |
176 (37,8) |
110 (47,2) |
66 (28,3) |
< 0,001 |
| Cardiopatía isquémica |
396 (6,4) |
9 (3,6) |
387 (6,5) |
0,067 |
35 (7,5) |
9 (3,9) |
26 (11,2) |
0,003 |
| Miocardiopatía |
127 (2,0) |
6 (2,4) |
121 (2,0) |
0,684 |
19 (4,1) |
6 (2,6) |
13 (5,6) |
0,101 |
| Enfermedad cerebrovascular |
479 (8,1) |
33 (13,4) |
446 (7,9) |
0,002 |
68 (14,6) |
31 (13,3) |
37 (15,9) |
0,431 |
| Cualquier cáncer |
861 (14,6) |
51 (20,7) |
810 (14,3) |
0,005 |
94 (20,2) |
47 (20,2) |
47 (20,2) |
1 |
|
Tratamiento concomitante | ||||||||
| Bloqueadores beta |
933 (15,7) |
123 (49,6) |
810 (14,2) |
< 0,001 |
179 (38,6) |
120 (51,7) |
59 (25,4) |
< 0,001 |
| IECA/ARA-II |
2.214 (37,1) |
2.090 (36,6) |
124 (49,8) |
< 0,001 |
261 (56,3) |
118 (50,9) |
143 (61,6) |
0,019 |
| Antiagregantes plaquetarios |
901 (15,2) |
23 (9,2) |
878 (15,4) |
0,008 |
85 (18,4) |
22 (9,5) |
63 (27,3) |
< 0,001 |
| Tratamiento anticoagulante oral |
651 (10,9) |
214 (85,6) |
437 (7,6) |
< 0,001 |
230 (49,3) |
198 (85,0) |
32 (13,8) |
< 0,001 |
| Antagonistas de la vitamina K |
535 (82,2) |
145 (67,8) |
390 (89,2) |
163 (70,9) |
137 (69,2) |
26 (81,3) |
||
| Anticoagulantes orales de acción directa |
116 (17,8) |
69 (32,2) |
47 (10,8) |
67 (29,1) |
61 (30,8) |
6 (18,7) |
||
|
Parámetros de laboratorio | ||||||||
| Creatinina (mg/dl) |
1,1 ± 1,7 |
1,5 ± 1,3 |
1,1 ± 1,6 |
0,035 |
1,4 ± 1,2 |
1,3 ± 1,0 |
1,5 ± 1,4 |
0,071 |
| Hemoglobina (g/dl) |
13,5 ± 1,9 |
12,7 ± 2,4 |
13,6 ± 1,9 |
< 0,001 |
12,9 ± 2,3 |
13,1 ± 2,2 |
12,8 ± 2,4 |
0,146 |
| Recuento plaquetario (×109/l) |
213 ± 95 |
192 ± 90 |
213 ± 85 |
0,513 |
203 ± 95 |
231 ± 99 |
192 ± 89 |
0,017 |
| Linfocitos (g/dl) |
1.229 ± 1.715 |
1.276 ± 3.279 |
1.228 ± 161 |
0,015 |
1.318 ± 3.063 |
1.330 ± 2.726 |
1.305 ± 3.377 |
0,930 |
| Aumento de dímero D |
3.633 (69,7) |
151 (71,2) |
3.482 (69,6) |
0,619 |
292 (75,1) |
140 (71,4) |
152 (78,8) |
0,095 |
| Aumentode laprocalcitonina |
832 (13,4) |
41 (30,1) |
791 (21,6) |
0,018 |
87 (30,5) |
40 (31,3) |
47 (29,9) |
0,811 |
| Aumento de la proteína C reactiva |
5.249 (90,0) |
217 (90,0) |
5.032 (90,0) |
0,990 |
408 (90,5) |
202 (90,2) |
206 (90,7) |
0,837 |
| Aumento de las troponinas |
382 (14,1) |
28 (31,5) |
354 (13,5) |
< 0,001 |
50 (25,8) |
26 (31,3) |
24 (21,6) |
0,126 |
| Aumentode las transaminasas |
2.304 (41,9) |
73 (31,1) |
2.231 (42,4) |
0,001 |
150 (34,6) |
69 (31,5) |
81 (37,9) |
0,165 |
| Aumento de la ferritina |
2.018 (64,0) |
70 (65,4) |
1.948 (63,9) |
0,753 |
140 (63,1) |
67 (67,0) |
73 (59,8) |
0,271 |
| Aumento de la actividad de la LDH | 4.155 (77,0) | 175 (77,4) | 3.980 (77,0) | 0,879 | 327 (78,2) | 164 (77,7) | 163 (78,7) | 0,801 |
ARA-II: antagonistas del receptor de la angiotensina II; EPP: emparejamiento por puntuación de propensión; FA: fibrilación auricular; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; LDH: lactato deshidrogenasa.
Los valores expresan n (%) o media ± desviación estándar.
Se clasificó a los pacientes en 2 grupos según los antecedentes de FA. Al comparar estos grupos, se observa que los pacientes con FA eran de más edad y tenían mayor número de comorbilidades. Además, este grupo había recibido con mayor frecuencia tratamiento previo con antiagregantes plaquetarios, anticoagulantes e inhibidores del sistema renina-angiotensina-aldosterona. Estas diferencias se controlaron después del emparejamiento estadístico (tabla 1).
Tratamiento y resultados durante el ingreso
El abordaje se describe en la tabla 2 . Los fármacos específicos para la COVID-19 más utilizados fueron la hidroxicloroquina (86,1%), los antibióticos (77,9%) y lopinavir/ritonavir (54,4%). Se recetaron corticoides al 31% de los pacientes aproximadamente. En cuanto a la asistencia respiratoria, se utilizó el decúbito prono en el 7% y la respiración mecánica no invasiva en el 10%. Se requirió un abordaje de respiración mecánica invasiva en más del 6%. Cuando se comparan estos grupos según la FA, los fármacos antivirales y el tocilizumab se habían utilizado con mayor frecuencia en pacientes sin FA; en cambio, los corticoides y los antibióticos se habían utilizado con mayor frecuencia en los pacientes con FA. Después del EPP, estas diferencias se atenuaron (tabla 2).
Tabla 2.
Eventos adversos durante la hospitalización de pacientes con COVID-19 y análisis comparativo según fibrilación auricular
| Antes del EPP |
Después del EPP |
|||||||
|---|---|---|---|---|---|---|---|---|
| Cohorte general (n = 6.217) |
FA (n = 250) |
Sin FA (n = 5.967) |
p | Cohorte general (n = 466) |
FA (n = 233) |
Sin FA (n = 233) |
p | |
|
Lesión renal aguda |
1.047 (17,8) |
95 (38,6) |
952 (16,8) |
< 0,001 |
156 (33,5) |
87 (37,3) |
69 (29,6) |
0,077 |
|
Insuficiencia cardiaca |
406 (6,9) |
49 (20,0) |
357 (6,3) |
< 0,001 |
72 (15,5) |
45 (19,3) |
27 (11,6) |
0,021 |
|
Sepsis |
1.351 (23,2) |
27 (10,9) |
589 (10,5) |
0,842 |
57 (12,4) |
27 (11,6) |
30 (13,2) |
0,608 |
|
Síndrome de respuesta inflamatoria sistémica |
1.351 (23,2) |
74 (30,1) |
1277 (22,9) |
0,009 |
126 (27,5) |
69 (29,7) |
57 (25,1) |
0,266 |
|
Hemorragia importante |
169 (2,9) |
24 (9,8) |
145 (2,6) |
< 0,001 |
27 (5,9) |
20 (8,7) |
7 (3,1) |
0,012 |
|
Evento embólico |
154 (2,6) |
5 (2,0) |
149 (2,7) |
0,544 |
8 (1,7) |
5 (2,2) |
3 (1,3) |
0,487 |
|
Insuficiencia respiratoria |
3.100 (52,3) |
190 (76,3) |
2.910 (51,2) |
< 0,001 |
320 (69,1) |
176 (75,9) |
144 (62,3) |
0,002 |
|
Cánula nasal de alto flujo |
994 (17,1) |
22 (9,1) |
972 (17,4) |
0,001 |
76 (16,8) |
18 (7,9) |
58 (25,7) |
< 0,001 |
|
Respiración mecánica no invasiva |
589 (10,0) |
10 (4,0) |
579 (10,3) |
0,001 |
34 (7,4) |
8 (3,4) |
26 (11,4) |
0,001 |
|
Respiración mecánica invasiva |
350 (6,0) |
7 (2,8) |
343 (6,1) |
0,033 |
13 (2,8) |
7 (3,0) |
6 (2,6) |
0,797 |
|
Corticoides |
1.819 (31,2) |
106 (42,6) |
1.713 (30,7) |
< 0,001 |
166 (36,5) |
98 (42,2) |
68 (30,5) |
0,009 |
|
Hidroxicloroquina |
5.094 (86,1) |
207 (83,1) |
4.887 (86,2) |
0,166 |
374 (81,1) |
191 (82,3) |
183 (79,9) |
0,508 |
|
Medicamentos antivirales |
3.204 (54,4) |
97 (39,3) |
3.107 (55,1) |
< 0,001 |
190 (41,8) |
91 (39,6) |
99 (44,0) |
0,038 |
|
Interferón o similar |
659 (11,4) |
21 (8,5) |
638 (11,5) |
0,142 |
46 (10,2) |
19 (8,2) |
27 (12,2) |
0,165 |
|
Tocilizumab o similar |
540 (9,3) |
8 (3,3) |
532 (9,5) |
0,001 |
19 (4,2) |
8 (3,5) |
11 (4,9) |
0,452 |
|
Antibióticos |
4.323 (77,9) |
199 (84,3) |
4.124 (77,6) |
0,015 |
345 (79,7) |
184 (83,3) |
161 (75,9) |
0,059 |
|
Anticoagulación |
< 0,001 |
< 0,001 |
||||||
| No |
990 (20,2) |
41 (17,3) |
949 (20,4) |
116 (25,3) |
38 (16,7) |
78 (33,9) |
||
| Dosis profiláctica |
3.068 (62,7) |
61 (25,7) |
3.007 (64,6) |
179 (39,1) |
58 (25,4) |
121 (52,6) |
||
| Dosis completa | 837 (17,1) | 135 (57,0) | 702 (15,0) | 163 (35,6) | 132 (57,9) | 31 (13,5) | ||
EPP: emparejamiento por puntuación de propensión; FA: fibrilación auricular.
Los valores expresan n (%).
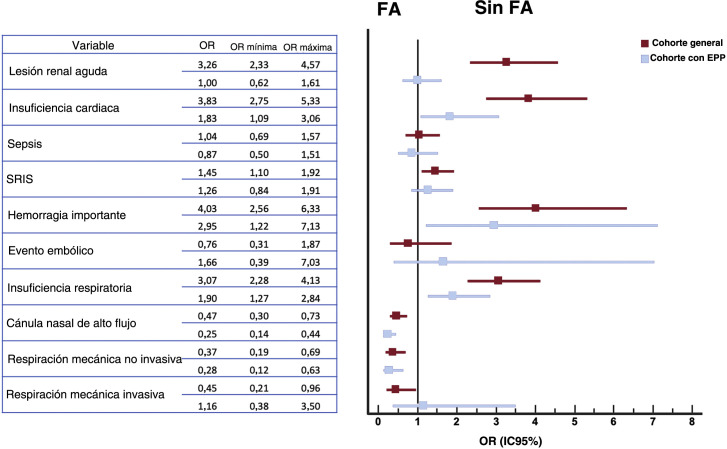
Los eventos hospitalarios se muestran en la figura 1 . El más frecuente fue la neumonía bilateral (75%), con insuficiencia respiratoria concomitante en el 52,3% de todos los pacientes. En la población general con COVID-19, se notificó lesión renal aguda, sepsis y síndrome de respuesta inflamatoria sistémica en aproximadamente un 20% de los pacientes. El síndrome de respuesta inflamatoria sistémica, la insuficiencia cardiaca y la insuficiencia respiratoria fueron más frecuentes en el grupo con FA. Paralelamente, se observa una mayor incidencia de complicaciones hemorrágicas en el grupo con FA (el 9,8 frente al 2,6%; OR = 4,03; IC95%, 2,56-6,33), pero con resultados en eventos embólicos comparables entre los 2 grupos. A pesar del emparejamiento estadístico, el grupo con FA continuó mostrando una mayor incidencia de todas estas complicaciones (tabla 2).
Figura 1.
Eventos adversos durante la hospitalización de pacientes con COVID-19 y análisis comparativo según FA. EPP: emparejamiento por puntuación de propensión; FA: fibrilación auricular; IC95%: intervalo de confianza del 95%; OR: odds ratio; SRIS: síndrome de respuesta inflamatoria sistémica.
Tratamiento anticoagulante hospitalario
Durante la hospitalización, cerca del 80% de todos los pacientes recibieron algún tipo de tratamiento anticoagulante; el 62,7% recibió una dosis profiláctica, mientras que el 17,1% recibió la dosis completa de anticoagulante. En concreto, en el grupo con FA, solo 135 pacientes (57%) recibieron anticoagulación a la dosis adecuada: 102 (75,6%) de ellos con anticoagulación intravenosa/subcutánea con heparina/enoxaparina, 18 (13,3%) con acenocumarol y 15 (11,1%) con un anticoagulante de acción directa; 61 (25,7%) recibieron una dosis profiláctica y 41 (17,3%) no recibieron tratamiento anticoagulante. No se observan diferencias en la edad (79,4 frente a 81,5 años; p = 0,248) o la puntuación CHA2DS2-VASc (3,8 frente a 3,8; p = 0,277) entre los pacientes que habían recibido alguna dosis de tratamiento anticoagulante y los que no. A pesar de este bajo porcentaje de pacientes tratados con dosis adecuadas de tratamiento anticoagulante, la incidencia de complicaciones hemorrágicas importantes durante el ingreso fue mayor en el grupo con FA (el 9,8 frente al 2,6%; OR = 4,03; IC95%, 2,56-6,33). Cuando se compara la cohorte completa de pacientes, se observa que quienes recibieron dosis completas de anticoagulante corrieron mayor riesgo de hemorragia que los que solo tomaron una dosis profiláctica o ninguna (dosis completa frente a dosis profiláctica, OR = 4,17; IC95%, 2,90-6,00; dosis completa frente a cualquier dosis, OR = 3,32; IC95%, 2,05-5,35). Sin embargo, estas diferencias no se observaron al analizar solo el grupo de pacientes con FA (dosis completa frente a dosis profiláctica, OR = 1,42; IC95%, 0,49-4,11; dosis completa frente a cualquier dosis, OR = 1,57; IC95%, 0,43-5,72). Cuando se analizan los eventos embólicos, no se observan diferencias entre los grupos en función del tipo de anticoagulante (2 [6,1%] en el grupo de anticoagulantes orales no antagonistas de la vitamina K frente a 4 [6,6%] en el grupo de antagonistas de la vitamina K frente a 33 [5,1%] en el grupo de heparina no fraccionada frente a 115 [3,9%] en el grupo de heparina de bajo peso molecular; p = 0,298) y de la dosis recibida (40 [4,7%] en el grupo de dosis completa de anticoagulación frente a 99 [3,2%] en el grupo de profilaxis frente a 15 [1,5%] en el grupo sin anticoagulación; p = 0,231).
Factores pronósticos de la fibrilación auricular en la COVID-19
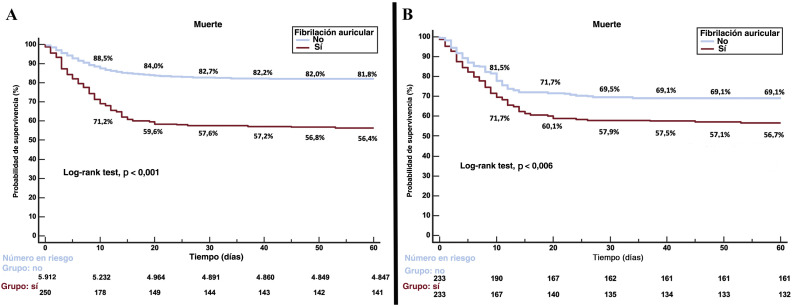
El análisis univariante de la mortalidad por cualquier causa a 60 días en la COVID-19 mostró una relación lineal entre la aparición de FA y la mortalidad (mortalidad de pacientes con FA frente a sin FA, el 43,6 frente al 18%; OR = 3,51; IC95%, 2,71-4,55). En el análisis multivariante (estadístico C = 0,750; IC95% Jackknife, 0,71-0,788; prueba de Gronnesby y Borgan, p = 0,782) (tabla 3 ), la existencia de FA se asoció de manera independiente con la mortalidad por cualquier causa a 60 días en estos pacientes (hazard ratio [HR] = 1,234; IC95%, 1,003-1,519) junto con otras variables, como la edad, valores de lactato deshidrogenasa elevados al ingreso, saturación < 92% al ingreso y enfermedad renal crónica. Además, se observa una elevada mortalidad entre los pacientes que estaban en tratamiento anticoagulante antes del ingreso (el 41,9 frente al 16,9%; OR = 3,55; IC95%, 2,99-4,28), concretamente el 43,9% dentro del grupo con FA. El análisis de supervivencia de Kaplan-Meier a 60 días después del EPP confirmó la mayor mortalidad entre los pacientes con FA (figura 2 ).
Tabla 3.
Análisis de regresión de Cox multivariante para evaluar el riesgo de mortalidad por cualquier causa a 60 días
| HR (IC95%) | p | |
|---|---|---|
| Edad (por año) | 1,04 (1,02-1,06) | < 0,001 |
| Saturación al ingreso < 92% | 3,84 (2,65-5,58) | < 0,001 |
| LDH elevada al ingreso | 1,65 (1,06-1,58) | 0,027 |
| Enfermedad renal crónica | 1,78 (1,29-2,58) | 0,002 |
| Fibrilación auricular | 1,57 (1,12-2,20) | 0,009 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; LDH: lactato deshidrogenasa.
Variables de ajuste incluidas en el modelo completo: edad, sexo, hipertensión, dislipemia, diabetes mellitus, tabaquismo, insuficiencia renal crónica, cardiopatía isquémica, insuficiencia cardiaca, enfermedad pulmonar, enfermedad cerebrovascular, cáncer, tratamiento con inhibidores del sistema renina-angiotensina-aldosterona, fibrilación auricular, tratamiento con ácido acetilsalicílico, tratamiento anticoagulante, saturación de O2 < 92% al ingreso, aumento del dímero D, aumento de la proteína C reactiva y aumento de LDH.
Figura 2.
Análisis de punto de referencia de Kaplan-Meier de la supervivencia según los antecedentes de fibrilación auricular. A: antes del emparejamiento por puntuación de propensión. B: después del emparejamiento por puntuación de propensión.
Un total de 1.185 pacientes murieron durante el seguimiento de 60 días. Las principales causas de mortalidad en nuestro registro fueron insuficiencia respiratoria (59,2%), causa combinada (19,9%), etiología infecciosa (6,2%) y respuesta inflamatoria sistémica (5,0%). La etiología cardiovascular fue la causa primaria de muerte en el 1,4% de los pacientes. Además, se registró un total de 154 eventos embólicos durante el ingreso hospitalario, sin diferencias entre los grupos (tabla 2).
Puntuación CHA2DS2-VASc y evaluación del riesgo de mortalidad
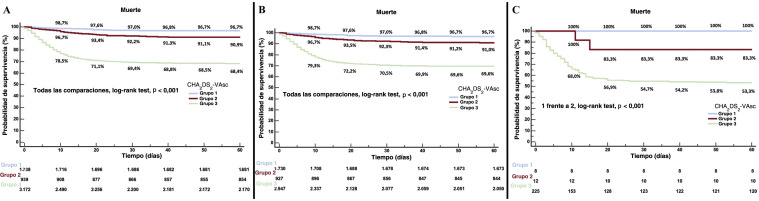
El análisis de supervivencia de Kaplan-Meier según la puntuación CHA2DS2-VASc se muestra en la figura 3 . La puntuación CHA2DS2-VASc mostró una discreta capacidad para predecir la mortalidad por cualquier causa a 60 días en toda la cohorte (área ROC, 0,748; IC95%, 0,733-0,764); sin embargo, tuvo un rendimiento escaso cuando se evaluó específicamente al grupo de pacientes con FA (área ROC, 0,618; IC95%, 0,546-0,689). Además, la puntuación CHA2DS2-VASc tampoco pudo predecir la incidencia de embolia durante el ingreso en la cohorte general (área ROC, 0,519; IC95%, 0,471-0,568) ni en el grupo con FA (área ROC, 0,411; IC95%, 0,147-0,675).
Figura 3.
Análisis de punto de referencia de Kaplan-Meier de la supervivencia según la puntuación CHA2DS2-VASc. Grupo 1: CHA2DS2-VASc = 0 los varones y ≤ 1 las mujeres; grupo 2: CHA2DS2-VASc = 1 los varones o 2 las mujeres, y grupo 3: CHA2DS2-VASc > 1 los varones o > 2 las mujeres. A: cohorte completa. B: pacientes sin fibrilación auricular. C: pacientes con fibrilación auricular.
DISCUSIÓN
Los pacientes con COVID-19 y enfermedad cardiovascular subyacente están en mayor riesgo de morbilidad y mortalidad por lesión miocárdica complicada, miocarditis, insuficiencia cardiaca congestiva, tromboembolia y arritmias13. Curiosamente, la FA es la arritmia observada con más frecuencia en la atención terciaria y pacientes críticos14. De hecho, las arritmias cardiacas se encuentran entre las comorbilidades más comunes de los pacientes con COVID-19 y se han identificado en casi todos los casos mortales15. Sin embargo, hasta la fecha no hay evidencia de que la FA contribuya de alguna manera al pronóstico de COVID-19, de modo que se presenta el primer trabajo que aborda específicamente la influencia y el papel pronóstico de la FA en la COVID-19. Los principales resultados son: a) el 4% de los pacientes con COVID-19 tenían antecedentes de FA antes de la hospitalización; b) los pacientes con COVID-19 y FA presentaron mayor mortalidad por cualquier causa a los 60 días; c) la FA es un factor pronóstico independiente de mortalidad; d) los pacientes con una puntuación CHA2DS2-VASc alta presentaron mayor mortalidad por cualquier causa a los 60 días; e) la puntuación CHA2DS2-VASc no es útil para predecir la incidencia de eventos embólicos durante la infección por SARS-CoV-2, y f) el tratamiento anticoagulante de dosis completa puede aumentar las complicaciones hemorrágicas.
La FA es la arritmia más común en todo el mundo y se sabe que su prevalencia es mayor entre los ancianos y pacientes con afecciones como hipertensión, diabetes mellitus, enfermedad renal crónica y cardiopatía16. Nuestros datos confirman una mayor carga de factores de riesgo cardiovascular en este grupo de pacientes, pero en el análisis multivariante, la existencia de FA mostró asociación independiente con el pronóstico de la COVID-19. Por lo tanto, surge la siguiente pregunta: ¿la FA en la COVID-19 es un simple espectador o un marcador de mayor riesgo? Se han propuesto varias teorías para tratar de explicar por qué los pacientes con FA pueden correr mayor riesgo de infección por SARS-CoV-2, pero probablemente se basan tanto en el estado inflamatorio como en los mecanismos de entrada celular del virus17. Se ha demostrado con anterioridad que una elevada carga de FA se asocia con niveles más altos de actividad de la enzima de conversión de la angiotensina 2 (ECA2), el péptido a través del cual el virus se une a las células humanas18. La regulación al alza de la ECA2 podría aumentar la susceptibilidad a la COVID-1918. Curiosamente, la concentración de ECA2 también se correlaciona con los remodelados estructural y funcional de la aurícula izquierda, que a su vez son sustratos para una mayor susceptibilidad a la FA19. Además, una de las vías clave de la COVID-19 está representada por la respuesta inflamatoria anómala del huésped. Es importante destacar que la inflamación sistémica precede y predice la FA en la comunidad. Desde esta perspectiva, la FA puede reflejar el aumento del sustrato inflamatorio que favorece peores resultados, amplificado cuando se combina con COVID-19. La existencia de la FA en sí misma es un factor de mal pronóstico en múltiples contextos clínicos; asimismo, la FA de nueva aparición empeora el pronóstico de los pacientes ingresados por enfermedades graves20. En el contexto de las infecciones, este peor pronóstico se acentúa y se prolonga durante el seguimiento a medio plazo21. Además, se sabe que la FA aumenta la mortalidad en pacientes con y sin enfermedad cardiovascular previa22, 23.
Es importante señalar que la mayoría de los pacientes con FA requieren anticoagulación para prevenir el riesgo de embolia, pero en algunos casos este tratamiento está relacionado con complicaciones hemorrágicas. Ambas complicaciones pueden acentuarse en pacientes con infección por SARS-CoV-2. La COVID-19 a menudo induce hipercoagulabilidad con inflamación, que causa un aumento de los factores de coagulación procoagulantes y la alteración de la homeostasis normal de las células endoteliales vasculares, lo que produce microangiopatía, formación de trombos locales y una falta de coagulación sistémica que lleva a trombosis de grandes vasos y, por lo tanto, a complicaciones tromboembólicas importantes24. Se desconoce si la anticoagulación por sí sola es suficiente para prevenir estos eventos trombóticos, especialmente los originados por disfunción endotelial, aunque se recomienda profilaxis de trombosis venosa profunda para todos los pacientes ingresados25. Sin embargo, se comunicó que la prevalencia de interacciones farmacológicas por anticoagulación alcanzaba al 26,3% de la población con FA. Estas interacciones aumentaron hasta 7 veces el riesgo de hemorragia y se espera que sea mayor en pacientes con COVID-19. Aunque los principios rectores de la anticoagulación de los pacientes con COVID-19 y FA son los mismos que para los pacientes sin la infección, se sabe poco sobre las posibles complicaciones con la COVID-19. Nuestros datos muestran que los pacientes que reciben anticoagulación a dosis completa presentan mayor incidencia de complicaciones hemorrágicas. En cambio, no tienen una mayor incidencia de complicaciones embólicas. Además, la puntuación CHA2DS2-VASc no es capaz de predecir el riesgo embólico hospitalario de esta población. Por lo tanto, la necesidad de anticoagulación hospitalaria no debería justificarse únicamente por esta escala y debería individualizarse. Se podría considerar que para los pacientes con FA que ingresan por COVID-19 podría bastar el tratamiento con anticoagulación profiláctica.
Limitaciones
El diseño de este estudio conlleva algunas limitaciones. Es posible que algunos nuevos eventos en los centros participantes no se hayan diagnosticado o comunicado. El cálculo de la incidencia de los eventos no es exacto, ya que la preselección se realizó en los centros participantes sin otros procedimientos de muestreo que los criterios amplios de inclusión (alta hospitalaria). En cuanto al tratamiento aplicado, en todo momento fue decidido por el equipo médico, también en el grupo de comparación.
Otras consideraciones que se debe tener en cuenta son: no se dispuso de información sobre el tipo de FA (paroxística/permanente), por lo que no se puede saber si esta clasificación influyó en el pronóstico o el tratamiento de estos pacientes; pese al EPP, algunas variables, como la insuficiencia cardiaca y la cardiopatía isquémica, no se equilibraron; aunque se intentó el ajuste por muchos factores de confusión, otros factores de confusión desconocidos o no medidos podrían haber influido; se intentó comunicar todos los tratamientos utilizados durante el ingreso, pero los protocolos eran diferentes en cada centro, lo que puede haber influido en los resultados. Además, no se pudo registrar posibles eventos de FA hospitalaria, ya que la situación sanitaria vivida en algunos hospitales incluidos en el registro no permitía realizar el seguimiento electrocardiográfico o los electrocardiogramas diarios a muchos pacientes. La variable «anticoagulación previa» no se incluyó en el proceso de emparejamiento; por lo tanto, no se puede descartar que esta variable pudiera haber modificado nuestros resultados. A pesar de ello, se incluyó esta variable en el análisis multivariante y no fue predictiva de peor pronóstico. Además, nuestro registro solo incluyó complicaciones hospitalarias (excepto mortalidad), de modo que no se puede excluir la posibilidad de que algunos pacientes hayan sufrido un evento embólico o hemorrágico tras el alta. El impacto exacto de la FA en la COVID-19 exige más estudios.
CONCLUSIONES
Nuestros resultados muestran que la FA en pacientes con COVID-19 se asocia con una elevada tasa de mortalidad por cualquier causa a 60 días. La puntuación CHA2DS2-VASc puede ser un buen marcador de riesgo en pacientes con COVID-19, pero no predice su riesgo embólico. Se necesitan más estudios para confirmar estos resultados.
FINANCIACIÓN
Beca incondicional (Fundación Interhospitalaria para la Investigación Cardiovascular [FIC], Madrid, España). Esta organización sin ánimo de lucro no participó en el diseño del estudio, la recopilación, el análisis y la interpretación de los datos, la redacción del informe o la decisión de enviar el artículo para su publicación.
CONFLICTO DE INTERESES
No hay conflicto de intereses que declarar.
¿QUÉ SE SABE DEL TEMA?
-
–
La COVID-19 varía desde formas asintomáticas hasta formas críticas y se han descrito varios factores pronósticos. Sin embargo, no hay ningún artículo que aborde el impacto específico de la fibrilación auricular.
¿QUÉ APORTA DE NUEVO?
-
–
La FA en pacientes con COVID-19 se asocia con mayor número de complicaciones y mortalidad a 60 días. La puntuación CHA2DS2-VASc puede ser un buen marcador de riesgo en pacientes con COVID-19, pero no predice su riesgo embólico. Los médicos deben evaluar sistemáticamente con la CHA2DS2-VASc a los pacientes con COVID-19 y fibrilación auricular en el momento del ingreso hospitalario para optimizar la estratificación del riesgo y mejorar la asignación de recursos. Sin embargo, la necesidad de anticoagulación hospitalaria no debe justificarse solo por esta escala y debe individualizarse.
Agradecimientos
A Cardiovascular Excellence SL, por su imprescindible apoyo con la base de datos y la página web de HOPE. A todos los investigadores de HOPE.
Footnotes
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2020.12.014
Appendix B. Material suplementario
Bibliografía
- 1.Word Health Organization. Novel coronavirus – China. 2020. Disponible en: http://www.who.int/csr/don/12-january-2020-novel-coronavirus-china/en/. Consultado 14 Dic 2020.
- 2.Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU). COVID-19 Dashboard. 2020. Disponible en: https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6. Consultado 12 Dic 2020.
- 3.Chan J.F., Yuan S., Kok K.H. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020;395:514–523. doi: 10.1016/S0140-6736(20)30154-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Pollán M., Pérez-Gómez B., Pastor-Barriuso R. Prevalence of SARS-CoV-2 in Spain (ENE-COVID): a nationwide, population-based seroepidemiological study. Lancet. 2020:396535–396544. doi: 10.1016/S0140-6736(20)31483-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Zhou F., Yu T., Du R. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395:1054–1062. doi: 10.1016/S0140-6736(20)30566-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Petrilli C.M., Jones S.A., Yang J. Factors associated with hospital admission and critical illness among 5279 people with coronavirus disease 2019 in New York City: prospective cohort study. BMJ. 2020;369:m1966. doi: 10.1136/bmj.m1966. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Uribarri A., Núñez Gil I.J., Aparisi A. Impact of renal function on admission in COVID-19 patients: an analysis of the international HOPE COVID-19 (Health Outcome Predictive Evaluation for COVID 19) Registry. J Nephrol. 2020;33:737–745. doi: 10.1007/s40620-020-00790-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Hindricks G., Potpara T., Dagres N., 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS) Eur Heart J. 2020 doi: 10.1093/eurheartj/ehaa612. [DOI] [Google Scholar]
- 9.Steinberg B.A., Zhao Y., He X. Management of postoperative atrial fibrillation and subsequent outcomes in contemporary patients undergoing cardiac surgery: insights from the Society of Thoracic Surgeons CAPS-Care Atrial Fibrillation Registry. Clin Cardiol. 2014;37:7–13. doi: 10.1002/clc.22230. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Lip G.Y.H., Nieuwlaat R., Pisters R., Lane D.A., Crijns H.J.G.M. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest. 2010;137:263–272. doi: 10.1378/chest.09-1584. [DOI] [PubMed] [Google Scholar]
- 11.ClinicalTrials.gov. International COVID19 Clinical Evaluation Registry, (HOPE COVID 19). Disponible en: https://clinicaltrials.gov/ct2/show/NCT04334291. Consultado 12 Dic 2020.
- 12.HOPE registry website. Disponible en: https://hopeprojectmd.com. Consultado 14 Dic 2020.
- 13.Driggin E., Madhavan M.V., Bikdeli B. Cardiovascular Considerations for Patients, Health Care Workers, and Health Systems During the COVID-19 Pandemic. J Am Coll Cardiol. 2020;75:2352–2371. doi: 10.1016/j.jacc.2020.03.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Bosch N.A., Cimini J., Walkey A.J. Atrial Fibrillation in the ICU. Chest. 2018;154:1424–1434. doi: 10.1016/j.chest.2018.03.040. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Sanchis-Gomar F., Perez-Quilis C., Lavie C.J. Should atrial fibrillation be considered a cardiovascular risk factor for a worse prognosis in COVID-19 patients? Eur Heart J. 2020;41:3092–3093. doi: 10.1093/eurheartj/ehaa509. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Chugh S.S., Havmoeller R., Narayanan K. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014;129:837–847. doi: 10.1161/CIRCULATIONAHA.113.005119. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Inciardi R.M., Adamo M., Lupi L., Metra M. Atrial fibrillation in the COVID-19 era: simple bystander or marker of increased risk? Eur Heart J. 2020;41:3094. doi: 10.1093/eurheartj/ehaa576. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Tomasoni D., Italia L., Adamo M. COVID-19 and heart failure: from infection to inflammation and angiotensin II stimulation. Searching for evidence from a new disease. Eur J Heart Fail. 2020;22:957–966. doi: 10.1002/ejhf.1871. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Walters T.E., Kalman J.M., Patel S.K., Mearns M., Velkoska E., Burrell L.M. Angiotensin converting enzyme 2 activity and human atrial fibrillation: increased plasma angiotensin converting enzyme 2 activity is associated with atrial fibrillation and more advanced left atrial structural remodelling. Europace. 2017;19:1280–1287. doi: 10.1093/europace/euw246. [DOI] [PubMed] [Google Scholar]
- 20.Moss T.J., Calland J.F., Enfield K.B. New-Onset Atrial Fibrillation in the Critically Ill. Crit Care Med. 2017;45:790–797. doi: 10.1097/CCM.0000000000002325. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Gundlund A., Olesen J.B., Butt J.H. One-year outcomes in atrial fibrillation presenting during infections: a nationwide registry-based study. Eur Heart J. 2020;41:1112–1119. doi: 10.1093/eurheartj/ehz873. [DOI] [PubMed] [Google Scholar]
- 22.Benjamin E.J., Wolf P.A., D’Agostino R.B., Silbershatz H., Kannel W.B., Levy D. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation. 1998;98:946–952. doi: 10.1161/01.cir.98.10.946. [DOI] [PubMed] [Google Scholar]
- 23.Pedersen O.D., Bagger H., Køber L., Torp-Pedersen C., The occurrence and prognostic significance of atrial fibrillation/-flutter following acute myocardial infarction. TRACE Study group. TRAndolapril Cardiac Evalution Eur Heart J. 1999;20:748–754. doi: 10.1053/euhj.1998.1352. [DOI] [PubMed] [Google Scholar]
- 24.Iba T., Levy J.H., Levi M., Connors J.M., Thachil J. Coagulopathy of Coronavirus Disease 2019. Crit Care Med. 2020;48:1358–1364. doi: 10.1097/CCM.0000000000004458. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Tang N., Bai H., Chen X., Gong J., Li D., Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020;18:1094–1099. doi: 10.1111/jth.14817. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.