SARS-CoV-2-Infektionen können mit einem breiten Spektrum unterschiedlicher Hautläsionen in Erscheinung treten. Ein eindrucksvolles Beispiel hierfür liefert der folgende Fallbericht.
Wir berichten über eine 54-jährige Patientin mit Asthma bronchiale, die sich aufgrund rezidivierenden Auftretens multipler kleiner Pseudolymphom-ähnlicher Läsionen Mitte November 2020 in unserer Sprechstunde vorstellte. Sechs Wochen zuvor (am 1. Oktober) hatte sie sich einer saisonalen Grippeimpfung unterzogen, mit nachfolgender Abgeschlagenheit, Gliederschmerzen und Schüttelfrost über eine Woche.
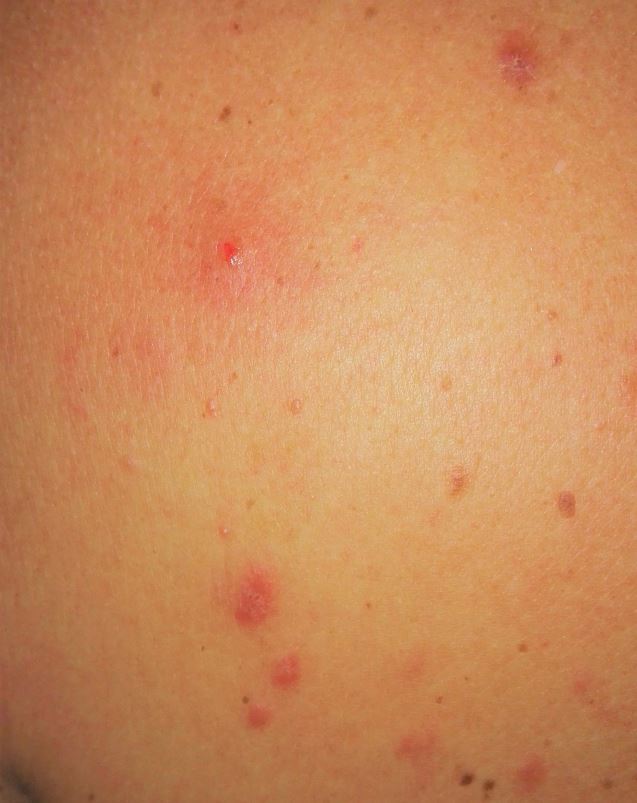
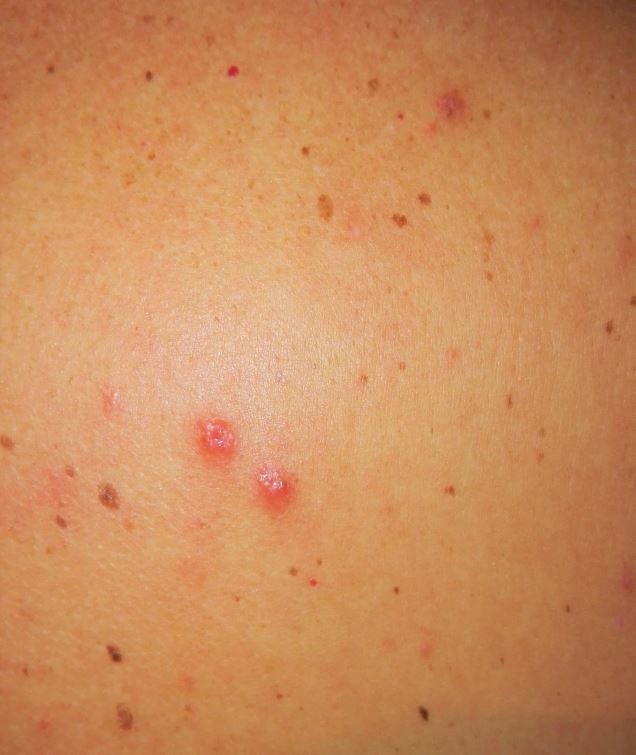
Bei der körperlichen Untersuchung fanden sich jetzt multiple, leicht juckende, bis zu 8 mm große, leicht elevierte erythematöse plaqueförmige Läsionen (Abb. 1), die klinisch Pseudolymphomen oder persistierenden Arthropodenreaktionen ähnelten (Abb. 2). Unauffällig waren das Routinelabor (BB, BSG, CRP, ANA Elektrophorese) und die palpablen Lymphknotenstationen. Eine Hautbiopsie wurde entnommen.
Histologie und Immunhistologie
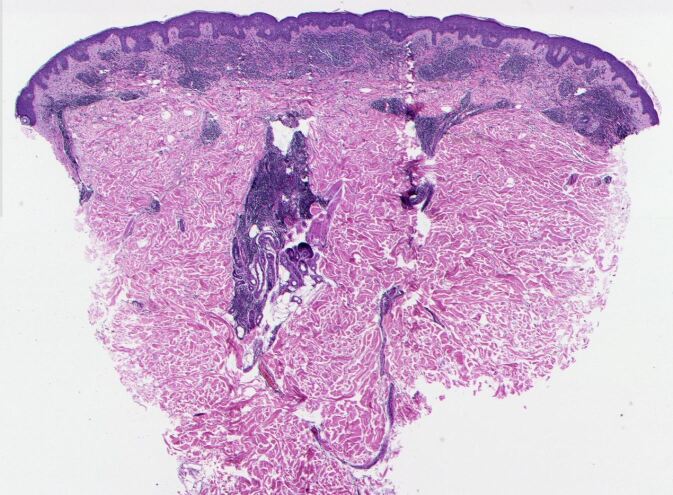
Das histopathologische Muster ähnelt einem Lymphocytic-Infiltration-artigen Pseudolymphom mit auffallender Ansammlung von Lymphozyten im Bereich der Schweißdrüsen und der Drüsenausführungsgänge. In Ergänzung dazu findet sich eine dichte bandförmige Rundzellinfiltration im oberen Korium mit nur geringgradiger Exo- zytose. Zeichen von Vaskulitis oder Vaskulopathie fehlen; insbesondere finden sich keine thrombotischen Phänomene (Abb. 3).
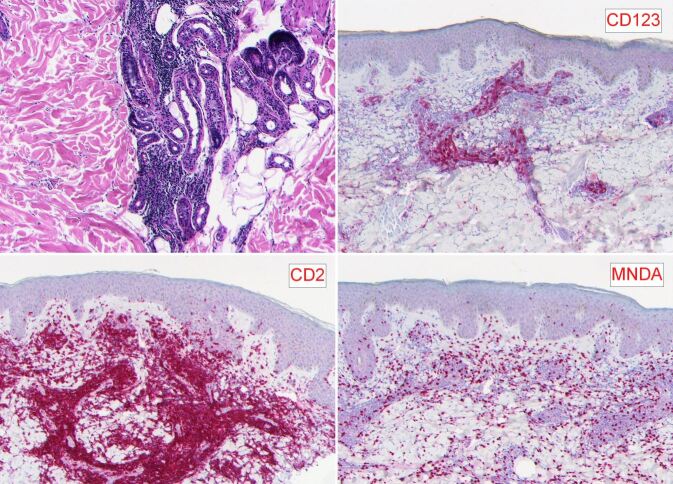
Immunphänotypisch dominieren CD2- positive T-Lymphozyten (CD4 > CD8) mit nur sehr wenigen beigemischten CD79a-positiven B-Lymphozyten (< 5 %). Das Infiltrat ist negativ für BCL6, MUM1 und MYC. CD30-positive aktivierte Lymphozyten fehlen. Auffallend sind zahlreiche Cluster aggregierter CD123-positiver plasmozytoider den- dritischer Zellen (PCDC) (Abb. 4). In diesem Zusammenhang ist erwähnenswert, dass virale Ribonukleinsäuren das Wachstum der PCDCs über deren Toll-like-Rezeptoren stimulieren können.
Eine weitere immunhistochemische Auffälligkeit ist die sternhimmelartige Verteilung zahlreicher MNDA-positiver Zellen (Granulozyten und deren Vorläuferzellen) inmitten des Rundzellinfiltrates. In der direkten Immunfluoreszenz (DIF mit anti-IgG, IgA, IgM, C3, C4, Fibrin/Fibrinogen) konnten keine spezifischen Antikörperablagerungen nachgewiesen werden. Molekularpathologisch fand sich weder eine T-Zell- noch eine B-Zell-Klonalität. Die Borrelien-PCR war negativ.
Therapie und Verlauf
Unter peroraler Prednisolontherapie ab Ende November 2020 (Startdosis 20-10-10-10-10 mg Prednisolon/d) besserten sich die Beschwerden nur geringgradig. Bei der zweiten Vorstellung Mitte Januar 2021 (8 Wochen später) - unter mittlerweile deutlich reduzierter Prednisolonmedikation (3 × 2,5 mg/d) - bestanden immer noch kutane Restinfiltrate. Zu diesem Zeitpunkt konnten im peripheren Blut spezifische SARS-CoV-2- Antikörper nachgewiesen werden mit ungewöhnlich hohem Titer (COVTO/SARS-CoV-2 Total AK 14004,00 [< bis 1,0 Index]).
Zwei Wochen später traten erneut Infektsymptome mit Gliederschmerzen und Lymphknotenschwellung auf. Pa- rallel hierzu rezidivierten die Pseudolym- phom-ähnlichen Plaques am Rücken. Zu diesem Zeitpunkt wurden im Rachenabstrich Influenza-A-Viren nachgewiesen (Influenza-A-RNA PCR positiv).
Ex juvantibus - basierend auf jünge- ren Literaturmitteilungen [1, 2] - reduzierten wir die Steroidtherapie und lei- teten eine perorale Colchicin-Therapie (1 × 0,5 mg/d) ein, die innerhalb von acht Tagen zu einer signifikanten Rückbildung von Hautveränderungen und Pruritus führte.
Diskussion
SARS-CoV-2 ist ein Virus, das dermatologisch mit einem ungewöhnlich breiten Spektrum unterschiedlichster Läsionen [3, 4] in Erscheinung treten kann, die von Perniosis-ähnlichen Manifestationen ("Covid toes") [5] über vaskulitische Phänomene [6] bis hin zu urtikariellen [7] und Erythema-multiforme-artigen Effloreszenzen [8] reichen. Es ist noch nicht eindeutig geklärt, ob alle COVID-19-assoziierten Hautläsionen tatsächlich kausal mit dem viralen Infekt verknüpft werden können oder ob es sich nicht doch in einigen Fällen um Paraphänomene, Arzneimittelexantheme oder andere virale Reaktivierungen handelt [9]. Spezifisch scheint jedoch das COVID-19-Enanthem [10] zu sein, das als wichtiges klinisches Zeichen gilt.
Wir stellen hier einen Fall von COVID-19-assoziierten Pseudolymphom-ähnlichen rezidivierenden Läsionen vor, die zeitlich mit den typischen systemischen Krankheitssymptomen und sig- nifikanter Erhöhung der spezifischen SARS-CoV-2-Antikörper korrelierten. Im Laufe der Erkrankung - offenbar um wenige Wochen zeitversetzt - trat zusätzlich eine Influenza-A-Infektion auf.
Koinfektionen mit SARS-CoV-2 und anderen viralen oder bakteriellen Erregern sind nicht ungewöhnlich - wenngleich selten [11, 12, 13, 14]. Der Anteil von SARS-CoV-2-Koinfektionen mit Influenza A wird auf circa 5 % geschätzt. Chinesische Arbeitsgruppen berichten über eine größere Kohorte von 530 chine- sischen Patienten, von denen 286 (54 %) mit SARS-CoV-2 und Influenza A ko- infiziert waren [11]. Es wird vermutet, dass eine Koinfektion mit Influenza A den klinischen Verlauf von COVID-19 wesentlich aggravieren kann [15]. Umso wichtiger ist die frühzeitige Erkennung einer Influenza-A-Infektion bei COVID-19-Patienten, um rechtzeitig mit einer antiviralen Therapie beginnen zu können.
Die hier beschriebenen plaqueförmigen, von T-Lymphozyten dominierten Pseudolymphom-ähnlichen Infiltrate wurden bisher bei COVID-19-Patien- ten kaum beobachtet. Im Wesentlichen dominieren bei COVID-19-Erkrankten makulopapulöse Exantheme (21 %), Perniosis-artige Läsionen ("Covid toes" - vor allem bei jugendlichen Patienten - meist mit günstigem klinischen Verlauf), Urtikaria und Angioödeme (11 %), vesikulöse Exantheme (13 %) und Livedovaskulitis mit Nekrosen, die gelegentlich dem Bild der Pityriasis lichenoides et varioliformis ähneln. Altmeyer hat die bestehende provisorische Klassifikation um eine weitere Effloreszenzen-Gruppe ergänzt, die Erythema multiforme, leukozytoklastische Vaskulitis, flexurale Exantheme und akrale Peeling-Skin-Syndrome umfasst [16, 17].
Wichtig ist, dass die vaskulitischen Phänomene - mit und ohne Throm- bosierung - fast immer ungünstigste COVID-19-Verläufe ankündigen. Die SARS-CoV-2-Infektion in ihrem Vollbild ist im Wesentlichen eine Sepsis, wobei die begleitende Vaskulitis deren schlimmste Manifestation darstellt. Perniosis-artige Infiltrate mit lymphozytärer Vaskulitis, Livedovaskulitis-ähnliche Infiltrate und Kryoglobulin-ähnliche Vaskulitis-/Vaskulopathie-Zeichen gehen fast immer mit einem schwereren COVID-19-Verlauf einher [18].
Bemerkenswert ist, dass im Gegensatz zu den meisten bekannten viralen In- fektionen das kutane Erscheinungsbild von COVID-19 selbst für den erfahrenen Kliniker sehr irreführend sein kann: Es findet sich eine verwirrende Vielfalt unterschiedlichster Läsionen [19, 20, 21]. Entfernt erinnert dieses bunte Bild an das camouflierende Verhalten der Syphilis in ihren verschiedenen Stadien.
Der hier vorgestellte Fall zeichnet sich durch eine weitere, histopathologische Besonderheit aus: die markante Ansammlung dicht gepackter Cluster von CD123-positiven plasmozytoiden den- dritischen Zellen (PCDC). Diese Zellen gelten auch als "natural interferon-producing cells". Ihr Wachstum lässt sich über die zelleigenen Toll-like-Rezeptoren stimulieren. Ein wichtiges stimulierendes Agens sind dabei Ribonukleinsäuren, zu denen vor allem die virale RNA und DNA zählen. Wir spekulieren, dass derartige CD123-positive Cluster ein histopathologischer Hinweis auf virale Infektionen sein können.
Fazit
Wir lernen langsam die häufigsten Hautveränderungen der SARS-CoV-2-Infektion kennen. Offenkundig gilt auch hier der ursprünglich auf die Lues und ihre vielen Gesichter gemünzte Leitspruch: Was man nicht sicher deuten kann, das sehe man als COVID an. Mit der Möglichkeit einer viralen oder bakteriellen Koinfektion bei bestehender SARS-CoV-2-Infektion sollte man immer rechnen.
Ein Dankeschön gilt der Patientin für die Freigabe der Bilder für diese Publikation.
Dr. med. Caterina Kostic.
MVZ Jung-Stillling, Dermatologie
Im Plan 4, 57223 Kreuztal
Dr. med. Andreas Jesper.
Praxis Dr. Soemantri
Hohfuhrstr. 42b, 58509 Lüdenscheid
Dr. med. Stefanie Christ Dr. med. Joachim Christ.
Talweg 16−16a, 53113 Bonn
PD Dr. med. Heinz Kutzner .
Dermatopathologie Friedrichshafen
Siemensstraße 6/1, 88006 Friedrichshafen
Literatur
- 1.Vitiello A, Ferrara F. Colchicine and SARS-CoV-2: Management of the hyperinflammatory state. Respir Med 2021; https://doi.org/10.1016/j.rmed.2021.106322 [DOI] [PMC free article] [PubMed]
- 2.Schlesinger N et al. Colchicine in COVID-19: an Old Drug, New Use. Curr Pharmacol Rep 2020; 18: 1−9 [DOI] [PMC free article] [PubMed]
- 3.Tomsitz D et al. Skin manifestations reported in association with COVID-19 infection. J Dtsch Dermatol Ges 2020; https://doi.org/10.1111/ddg.14353 [DOI] [PubMed]
- 4.Catala Gonzalo A, Galvan Casas. COVID-19 y piel. Actas Dermo-Sifiliogr 2020; 111: 447−9 [DOI] [PMC free article] [PubMed]
- 5.Hubiche T et al. Clinical, laboratory and interferon-alpha response characteristics of patients with chilblain-like lesions during the COVID-19 pandemic. JAMA 2020; https://doi.org/10.1001/jamadermatol.2020. 4324 [DOI] [PMC free article] [PubMed]
- 6.Daneshgaran G et al. Cutaneous Manifestations of COVID-19: An Evidence-Based Review. Am J Clin Dermatol 2020; 21: 627−39 [DOI] [PMC free article] [PubMed]
- 7.Najafzadeh M et al. Urticaria (angioedema) and COVID-19 infection. J Eur Acad Dermatol Venereol 2020; 34: e568-e570 [DOI] [PMC free article] [PubMed]
- 8.Marzano AV et al. Cutaneous manifestations in patients with COVID-19: a preliminary review of an emerging issue. Br J Dermatol 2020; 183: 431−42 [DOI] [PMC free article] [PubMed]
- 9.Gianotti R et al. Similarities in Cutaneous histopathological patterns between COVID-19-positive and COVID-19 high-risk patients with skin dermatosis. Acta Derm Venerol 2020: 100; 1−5 [DOI] [PMC free article] [PubMed]
- 10.Jimenez-Cauhe J et al. Enantema in patients with COVID-19 and skin rash. JAMA 2020: 156: 1135−6 [DOI] [PMC free article] [PubMed]
- 11.Cheng Y et al. Co-infection of influenza A virus and SARS-CoV-2: A retrospective cohort study. J Med Virol 2021; 21. doi: 10.1002/jmv.26817. Online ahead of print.J Med Virol 2021. https://doi.org/10.1002/jmv.26817 [DOI] [PMC free article] [PubMed]
- 12.Jing R et al. Co-infection of COVID-19 and influenza A in a hemodialysis patient: a case report. BMC Infect Dis 2021; 21: 68 [DOI] [PMC free article] [PubMed]
- 13.Munivenkatappa A et al. SARS-CoV-2 & influenza A virus co-infection in an elderly patient with pneumonia. Indian J Med Res 2021; https://doi.org/10.4103/ijmr.IJMR_2711_20 [DOI] [PMC free article] [PubMed]
- 14.Covin S, Rutherford GW. Co-infection, SARS-CoV-2 and influenza: an evolving puzzle. Clin Infect Dis 2020; https://doi.org/10.1093/cid/ciaa1810 [DOI] [PMC free article] [PubMed]
- 15.Zhang AJ et al. Co-infection by severe acute respiratory syndrome coronavirus 2 and influenza A (NH1N1)pdm09 virus enhances the severity of pneumonia in golden Syrian hamsters. Clin Infect Dis 2020; https://doi.org/10.1093/cid/ciaa1747 [DOI] [PMC free article] [PubMed]
- 16.Altmeyer P. COVID-19-Infektionen Hautveränderungen. https://www.altmeyers.org/de/dermatologie/covid-19-infektionen-hautveranderungen-153965 (abgerufen am 11.2.2021)
- 17.Galván Casas et al. Classification of the cutaneous manifestations of COVID-19: a rapid prospective nationwide consensus study in Spain with 375 cases. Br J Dermatol 2020, 183: 71−7 [DOI] [PMC free article] [PubMed]
- 18.Garrido Ruiz MC et al. Spectrum of Clinicopathologic Findings in COVID-19- induced Skin Lesions: Demonstration of Direct Viral Infection of the Endothelial Cells. Am J Surg Pathol 2021; 45: 293−303 [DOI] [PubMed]
- 19.Freeman E et al. The spectrum of COVID-19- associated dermatologic manifestations: An international registry of 716 patients from 31 countries. J Am Acad Dermatol 2020; 83: 1118−29 [DOI] [PMC free article] [PubMed]
- 20.Gupta A al. Extrapulmonary manifestations of COVID-19. Nat Med 2020; 26: 1017-32 [DOI] [PMC free article] [PubMed]
- 21.Kaya G et al. Clinical and histopathological features and potential pathological mechanisms of skin lesions in COVID-19: Review of literature. Dermatopathology 2020; 7: 3−16 [DOI] [PMC free article] [PubMed]