髓外浸润是影响急性白血病预后的重要因素,急性髓系白血病(AML)和急性淋巴细胞白血病(ALL)更容易发生髓外浸润[1]–[2],可导致白血病复发或治疗失败。白血病髓外浸润常表现为淋巴结、肝脾、睾丸肿大及中枢神经系统白血病等,以皮肤浸润为复发表现的报道少见。本研究中我们对72例急性白血病(AL)皮肤髓外浸润患者的改良的针吸细胞学(FNAC)检查结果及临床特点进行总结分析,以期更好地指导临床工作。
病例与方法
1.病例资料:回顾性分析2011年8月至2019年1月在哈尔滨医科大学附属第一医院经细胞形态学、免疫学、细胞遗传学、分子生物学检查确诊的72例AL患者资料,其中AML 49例,ALL 23例。患者在化疗骨髓达完全缓解(CR)后巩固治疗或随访中出现皮肤肿块,经FNAC检查证实为AL皮肤浸润。其中男46例,女36例,年龄23~67岁。
2.改良的FNAC方法:采用小空针持续负压法。选取皮损表面颜色变化或隆起最明显的部位,使用5 ml一次性注射器,抽吸负压为0.5~1 ml,可以变换角度、方向及深度,抽吸数次,拔出针头,迅速将针吸物打在玻片上,以针头轻轻将针吸物涂开,制备涂片2~3张,同时用无菌棉球按压皮肤穿刺点。涂片经瑞特-吉姆萨染色后镜检。
3.免疫组化和细胞化学染色:对部分细胞涂片进一步进行HLA-DR(购自福州迈新生物技术开发有限公司)免疫组化染色。AML(M5除外)患者标本进行过氧化物酶(POX)染色,ALL患者标本进行过碘酸雪夫(PAS)染色,AML-M5患者标本进行α-丁酸萘酚酯酶(α-NBE)染色(均购自上海太阳生物技术有限公司)。免疫组化及细胞化学染色试验方法参照试剂说明书。
4.治疗:ALL初始诱导治疗以VDCP(长春新碱、柔红霉素、环磷酰胺、甲泼尼龙)为基础方案,AML初始诱导治疗以DA(柔红霉素、阿糖胞苷)或IA(去甲氧柔红霉素、阿糖胞苷)为基础方案,其中两例第2次CR(CR2)的患者,在第1次复发后一例以FLAG为第二次诱导缓解方案,另一例进行了异基因造血干细胞移植。
5.统计学处理:采用SPSS 19.0统计软件进行统计学分析。采用Spearman相关系数对外周血WBC与原始细胞数进行相关性分析。P<0.05为差异有统计学意义。
结果
1.患者基线资料:72例AL患者化疗缓解后发生皮肤浸润,AML 49例,男23例,女26例,中位年龄43(24~66)岁;ALL 23例,男13例,女10例,中位年龄44(23~67)岁。AML组与ALL组的性别、年龄差异无统计学意义(P值均>0.05)。除2例AML患者为CR2外,其余患者均处于第1次CR(CR1)。白血病初诊时间距皮肤浸润中位时间为185 d。
2.不同的AL类型皮肤浸润部位、皮损特点:72例发生皮肤浸润的AL患者的浸润部位见表1。受累部位以躯干和四肢较为多见,ALL病灶多发生于躯干,AML常累及四肢。胸部、腹部及背部皮肤常大面积受累。AML-M2型为AML中发生皮肤浸润最多的类型。
表1. 急性白血病皮肤复发患者的白血病类型和浸润部位(例).
| 组别 | 例数 | 浸润部位 |
|||||||||
| 乳腺 | 头面部 | 颈部 | 胸部 | 腹部 | 上肢 | 下肢 | 臀部 | 背部 | |||
| AML | 49 | 3 | 4 | 2 | 7 | 8 | 10 | 10 | 3 | 2 | |
| M1 | 2 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| M2 | 25 | 1 | 3 | 1 | 3 | 4 | 7 | 6 | 0 | 0 | |
| M3 | 5 | 0 | 0 | 1 | 2 | 0 | 0 | 1 | 1 | 0 | |
| M4 | 6 | 0 | 1 | 0 | 0 | 1 | 0 | 2 | 0 | 2 | |
| M5 | 8 | 0 | 0 | 0 | 1 | 3 | 3 | 1 | 0 | 0 | |
| M6 | 2 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | |
| 未分类 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | |
| ALL | 23 | 0 | 3 | 0 | 8 | 5 | 2 | 3 | 0 | 2 | |
注:腹股沟计入腹部,肛周计入臀部,腋窝计入胸部。AML:急性髓系白血病;ALL:急性淋巴细胞白血病
皮损特点多表现为直径0.5~5 cm的无痛性丘疹或结节,部分患者伴轻微痒感。初发时常呈淡红色,随时间逐渐加深,转变为深红色、灰褐色等。进行穿刺活检后局部皮肤无明显变化。
3.AL皮肤FNAC形态学特征:各型AL皮肤浸润细胞的形态学特征与初诊时骨髓象原始细胞表现一致。为了进一步证实皮肤浸润细胞源性,对部分细胞涂片进行HLA-DR免疫组化染色,同时根据不同白血病类型分别进行POX、PAS或α-NBE染色,其结果与骨髓形态学中细胞化学染色结果一致(图1)。
图1. 急性白血病骨髓和皮肤浸润细胞特殊染色(×1000).
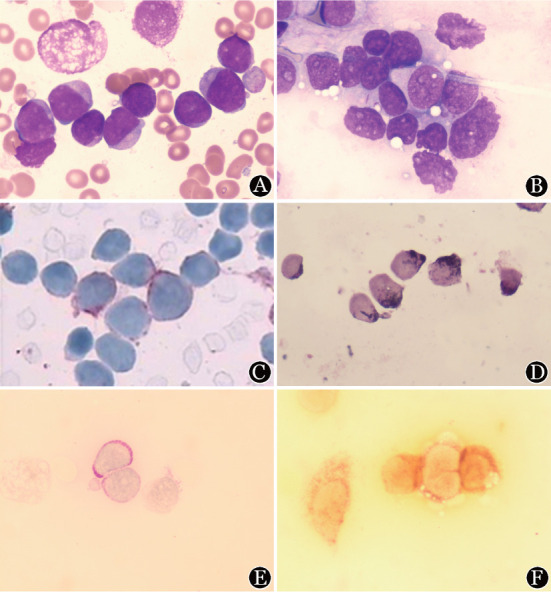
A:患者白血病初发时骨髓涂片;B:发生皮肤浸润时针吸细胞学(FNAC)检查细胞涂片,可见与骨髓涂片相似的白血病细胞;C:急性白血病皮肤浸润细胞HLA-DR免疫组化染色,证实原始细胞;D:急性髓系白血病(AML)(M5除外)皮肤浸润细胞过氧化物酶染色;E:急性淋巴细胞白血病皮肤浸润细胞过碘酸雪夫染色;F:AML-M5皮肤浸润细胞α-丁酸萘酚酯酶染色
4.患者骨髓、外周血情况及治疗效果:15例患者同时出现骨髓复发(13例为骨髓首次复发,占86.7%)。57例(79.2%)为单纯皮肤髓外浸润,骨髓仍处于CR状态,外周血无明显异常。我们给予皮肤复发的患者以阿糖胞苷为基础的治疗方案,但96.5%(55例)单纯皮肤浸润的患者仍于半年内出现骨髓复发。48例(66.7%)初诊时WBC高于正常,中位WBC为15.32(1.75~379.00)×109/L。51例(70.8%)患者初诊时外周血可见原始或幼稚白血病细胞。外周血WBC与原始细胞数呈正相关关系(r=0.942,P<0.001)。全部最终发生骨髓复发的患者中,伴有重现性遗传学异常的AML患者(M3、M2b、M4EO,占总例数约10%)经二线方案治疗后骨髓可持续性CR,不会因皮肤浸润影响预后。其余90%的患者应用二线方案(阿糖胞苷为基础,联合地西他滨、柔红霉素或米托蒽醌等药物)化疗达CR2后再次骨髓复发,2.9%(2例)患者骨髓处于持续复发状态。骨髓治疗缓解的患者皮损也在化疗后减小或消失。
5.免疫分型、基因学及染色体改变:全部23例ALL患者进行了免疫分型检查,其中有7例呈T细胞免疫表型(T-ALL),16例呈B细胞免疫表型(B-ALL)。B-ALL中,13例表达CD38,6例表达HLA-DR,3例表达TdT。4例T-ALL表达CD38。49例AML患者中有28例进行了免疫分型检查,其中19例表达CD38,18例表达HLA-DR,1例伴有T细胞免疫表型。所有AML-M3患者均不表达CD34。
47例患者进行了融合基因检查。ALL患者中,1例T-ALL SIL-TAL1融合基因阳性。B-ALL患者均未检出融合基因。AML患者中,1例M1型患者MIL-AF10阳性,2例M2b型患者AML-ETO阳性,1例M2a型患者(慢性髓性白血病急性变)BCR-ABL210阳性,M3型患者均PML-RARα阳性,1例M4EO型患者CBFβ-MYH11阳性,其余患者未见融合基因表达。
33例AML患者进行了基因突变或二代测序检测,WT1阳性者有12例,其中WT1和ABL1双突变者6例;FLT3-ITD突变者有10例,其中FLT3和WT1双突变者2例,FLT3、WT1和NPM1三突变者2例。NPM1和DNMT3A突变者2例,NPM1伴FLT3突变者2例,单纯NPM1突变阳性者4例。3例复杂基因突变者分别为TET2、U2AF1、ETV6、ASXL1、CBL突变,STAG2、IDH2、NRAS突变,T3-TKD、TET2突变。
46例患者进行了染色体检查。11例ALL患者为正常核型,1例T-ALL患者的核型为47,XX,+10[15]/46,XX[5]。34例AML患者中,23例为正常核型,1例核型表现为47,XX,+21[16]/46,XX[4],10例表现为复杂核型。
讨论
皮肤浸润是AL髓外复发的一种特殊表现,其发生可不伴有骨髓复发。对于皮肤浸润的诊断,本研究中79.2%的患者为单纯皮肤浸润,骨髓仍处于CR状态,外周血无明显异常,因此对骨髓或外周血进行免疫分型、基因检测并不适合。而从皮损中很难获取大量细胞进行PCR、流式细胞术等检测。因此,组织病理学检查至关重要[3]。皮肤活检取材行病理检查是皮肤浸润的主要诊断方式[4],但该方法为手术操作,皮肤创口大,免疫功能受损的AL患者很容易继发切口感染,而重度血小板减少或凝血功能障碍的患者不宜行皮肤活检,且组织块处理程序复杂,一般需用时3~7 d,延误患者治疗时机。FNAC十多年来被广泛用于乳腺癌术前诊断,其诊断准确性高(98.6%),同时具有很高的敏感性和特异性(92.6%和100%)[5]。有研究报道FNAC在AL髓外淋巴结浸润中也有很好的诊断效果[6]。
我们尝试应用改良的FNAC方法进行皮肤浸润的诊断。由经验丰富的技术人员选取皮损表面颜色变化或隆起最明显的部位进行穿刺,注意避开皮肤破溃的部位。如果患者同时存在不同部位皮损,可同时行多部位穿刺,确定皮损性质。穿刺取材成功率100%,明显高于传统FNAC方法。我们将穿刺涂片与初诊时骨髓涂片进行形态学对比,浸润皮肤的白血病细胞和初发时骨髓原始细胞形态学表现一致。为进一步确定皮肤浸润细胞源性,我们选取广泛表达于各型白血病原始细胞中的HLA-DR对穿刺涂片细胞进行免疫组化染色,可见此类细胞HLA-DR染色阳性,主要位于细胞膜,少部分位于细胞质。为更好地确定细胞源性,降低假阳性率,我们还针对不同类型白血病进行了POX、PAS或α-NBE细胞化学染色,其结果与骨髓形态学中细胞化学染色结果一致。此方法需要组织量少,具有创伤小、无切口、不易感染、对血小板和凝血功能要求不高、不影响治疗、耗时短(不用免疫组化验证时,最短仅需2 h)等特点。
我们对72例皮肤髓外浸润患者的临床特点进行分析。本研究中AML与ALL患者的男女比例及年龄差异无统计学意义。AL初诊至发生皮肤复发的中位时间为185 d,与文献报道的0~13个月相符[7]。
有研究表明AML皮肤浸润的发生率高于ALL,尤以M4及M5型为高[8]。本研究中发生皮肤复发的患者也以AML多见,占68%,类型以M2、M4、M5为主。AL皮肤浸润的皮损可以表现为斑疹、丘疹、结节、肿块或溃疡等,局灶性或弥散性分布[9]。本研究中AL皮肤复发的患者多表现为结节或丘疹,无皮肤破溃情况。有学者认为不同类型的AL有不同的皮损部位[10]。本组患者中皮肤复发浸润的部位以躯干和四肢较为多见。ALL病灶多发生于躯干,AML常累及四肢。
尽管有研究提示皮肤浸润常发生在血常规和骨髓象异常后[3],但是本研究中皮肤复发时79.2%的AL患者骨髓仍处于缓解状态,外周血WBC并不高。初诊时外周血WBC与AL缓解后皮肤髓外复发是否相关尚无文献报道。本研究结果显示66.7%的患者初诊WBC升高,且70.8%的AL患者初诊时外周血可见白血病细胞,且两者为正相关关系,提示发生皮肤复发可能与初诊外周血高白细胞数有关,推测原因可能是白血病细胞随血流至末梢循环导致皮肤定植。
AL可累及全身各系统,发生皮肤浸润者多预后不良[11]。本研究中96.5%单纯发生皮肤浸润的患者半年内会出现骨髓复发,且2.9%的患者骨髓处于持续复发状态,90%的患者再次化疗达CR后骨髓仍反复复发。但伴有重现性遗传学异常的AML-M3、M2b、M4EO患者经二线治疗后骨髓可持续性CR,并不会因发生皮肤浸润而影响预后。
本文中患者免疫分型检查进一步明确了白血病的分型和原始细胞的免疫原性,发生皮肤浸润的ALL患者以B-ALL为多,占69.6%。T细胞免疫表型的患者中表达CD38者占57.1%,而B细胞免疫表型的患者中表达CD38者占81.2%。60%以上的AML患者表达CD38和HLA-DR,有1例伴有T淋巴细胞表型。CD38高表达是否与皮肤浸润相关,需进一步扩大样本量分析。患者染色体分析以正常核型为主,AML中复杂核型所占的比例高于ALL。而复杂染色体核型提示预后不良,这可能是导致本研究中AML患者发生皮肤浸润多于ALL患者的原因。WT1基因突变和FLT3基因突变常提示预后不良,本研究中发生上述突变患者占所检测者一半以上,提示基因预后不良者更容易出现皮肤髓外复发。
References
- 1.Ge L, Ye F, Mao X, et al. Extramedullary relapse of acute leukemia after allogeneic hematopoietic stem cell transplantation: different characteristics between acute myelogenous leukemia and acute lymphoblastic leukemia[J] Biol Blood Marrow Transplant. 2014;20(7):1040–1047. doi: 10.1016/j.bbmt.2014.03.030. [DOI] [PubMed] [Google Scholar]
- 2.Nambu M, Shimizu K, Ito S, et al. A case of juvenile myelomonocytic leukemia with ocular infiltration[J] Ann Hematol. 1999;78(12):568–570. doi: 10.1007/s002770050561. [DOI] [PubMed] [Google Scholar]
- 3.Li L, Wang Y, Lian CG, et al. Clinical and pathological features of myeloid leukemia cutis[J] An Bras Dermatol. 2018;93(2):216–221. doi: 10.1590/abd1806-4841.20186327. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Longacre TA, Smoller BR. Leukemia cutis. Analysis of 50 biopsy-proven cases with an emphasis on occurrence in myelodysplastic syndromes[J] Am J Clin Pathol. 1993;100(3):276–284. doi: 10.1093/ajcp/100.3.276. [DOI] [PubMed] [Google Scholar]
- 5.柳 海军, 杨 浩鑫. 乳腺细针针吸细胞学检查在基层医院应用的可行性分析[J] 北京医学. 2016;38(5):452–454, 384. doi: 10.15932/j.0253-9713.2016.5.022. [DOI] [Google Scholar]
- 6.Kumar PV, Karimi M, Monabati A, et al. Cytology of leukemic lymphadenopathy[J] Acta Cytol. 2002;46(5):801–807. doi: 10.1159/000327050. [DOI] [PubMed] [Google Scholar]
- 7.Cronin DM, George TI, Sundram UN. An updated approach to the diagnosis of myeloid leukemia cutis[J] Am J Clin Pathol. 2009;132(1):101–110. doi: 10.1309/AJCP6GR8BDEXPKHR. [DOI] [PubMed] [Google Scholar]
- 8.Kang YS, Kim HS, Park HJ, et al. Clinical characteristics of 75 patients with leukemia cutis[J] J Korean Med Sci. 2013;28(4):614–619. doi: 10.3346/jkms.2013.28.4.614. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Watson KM, Mufti G, Salisbury JR, et al. Spectrum of clinical presentation, treatment and prognosis in a series of eight patients with leukaemia cutis[J] Clin Exp Dermatol. 2006;31(2):218–221. doi: 10.1111/j.1365-2230.2005.02022.x. [DOI] [PubMed] [Google Scholar]
- 10.Lee JI, Park HJ, Oh ST, et al. case of leukemia cutis at the site of a prior catheter insertion[J] Ann Dermatol. 2009;21(2):193–196. doi: 10.5021/ad.2009.21.2.193. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Markowski TR, Martin DB, Kao GF, et al. Leukemia cutis: a presenting sign in acute promyelocytic leukemia[J] Arch Dermatol. 2007;143(9):1220–1221. doi: 10.1001/archderm.143.9.1220. [DOI] [PubMed] [Google Scholar]


