Abstract
目的
探讨ETV6-RUNX1融合基因阳性儿童急性前体B淋巴细胞白血病(B-ALL)的临床特征及预后。
方法
回顾性分析2011年4月至2020年5月福建医科大学附属协和医院小儿血液科收治的927例初诊B-ALL患儿的临床资料。根据ETV6-RUNX1检测结果,分为ETV6-RUNX1+组及ETV6-RUNX1−组,对比两组的临床特征及预后;182例ETV6-RUNX1+患儿规范治疗,其中144例接受中国儿童白血病协作组(CCLG)-ALL 2008方案治疗(CCLG-ALL 2008方案组),38例接受中国儿童癌症协作组(CCCG)-ALL 2015方案治疗(CCCG-ALL 2015方案组),对比两种方案的疗效、严重不良反应(SAE)发生率及治疗相关死亡(TRM)率。
结果
927例B-ALL患儿中,189例(20.4%)ETV6-RUNX1阳性。ETV6-RUNX1+组初诊时有危险因素(年龄≥10岁或<1岁,WBC≥50×109/L)的患者比例均显著低于ETV6-RUNX1−组(P值分别为0.000和0.001),而泼尼松诱导试验反应良好、诱导化疗第15天或第19天微小残留病(MRD)<1%,以及诱导化疗第33天或第46天MRD<0.01%的患者比例显著高于ETV6-RUNX1−组(P值分别为0.001、0.028和0.004)。ETV6-RUNX1+组的5年无事件生存(EFS)及总生存(OS)率均显著高于ETV6-RUNX1−组(EFS:89.8%对83.2%,P=0.003;OS:90.2%对86.3%,P=0.030)。CCLG-ALL 2008组感染相关SAE发生率显著高于CCCG-ALL 2015组(27.1%对5.3%,P=0.004),TRM发生率也高于CCCG-ALL 2015组,但差异无统计学意义(4.9%对0,P=0.348)。
结论
ETV6-RUNX1+儿童B-ALL初诊危险因素较少,早期治疗反应较好,复发率低,总体预后良好;适当减低化疗强度,可降低感染相关SAE及TRM发生率,并进一步提高该亚型ALL患儿的OS率。
Abstract
Objective
To investigate the clinical features and prognosis of ETV6-RUNX1-positive childhood B-precursor acute lymphocyte leukemia (B-ALL).
Methods
The clinical data of 927 newly diagnosed children with B-ALL admitted to the Fujian Medical University Union Hospital from April 2011 to May 2020 were retrospectively analyzed. According to the results of ETV6-RUNX1 gene, the patients were divided into ETV6-RUNX1+ and ETV6-RUNX1− groups. The clinical features and prognosis between the two groups were compared. Among the 182 children with ETV6-RUNX1+, 144 patients received the Chinese Childhood Leukemia Collaborative Group (CCLG)-ALL 2008 protocol (CCLG-ALL 2008 group) and 38 received the China Childhood Cancer Collaborative Group (CCCG)-ALL2015 protocol (CCCG-ALL 2015 group). The efficacy, serious adverse effects (SAE) incidence, and treatment-related mortality (TRM) of the two groups were also compared.
Results
Of the 927 B-ALL patients, 189 (20.4%) were ETV6-RUNX1+. The proportion of patients with risk factors (age ≥10 years or <1 year, white blood cell count ≥50×109/L) in the ETV6-RUNX1+ group was significantly lower than that in the ETV6-RUNX1− group (P=0.000, 0.001, respectively), while the proportion of patients with good early response (good response to prednisone, d15 or d19 MRD <1%, and d33 or d46 MRD<0.01% in induction chemotherapy) in the ETV6-RUNX1+ group was significantly higher than that in the ETV6-RUNX1− group (P=0.028, 0.004, respectively). The 5-year EFS and OS of the ETV6-RUNX1+ group were significantly higher than those of the ETV6-RUNX1− group (EFS: 89.8% vs 83.2%, P=0.003; OS: 90.2% vs 86.3%, P=0.030). The incidence of infection-related SAE and TRM was significantly higher than that of CCCG-ALL 2015 group. A statistical difference was observed between the incidence of infection-related SAE of the two groups (27.1% vs 5.3%, P=0.004), but no difference in TRM (4.9% vs 0, P=0.348).
Conclusion
ETV6-RUNX1+B-ALL children have fewer risk factors at diagnosis, better early response, lower recurrence rate, and good prognosis than that of ETV6-RUNX1−B-ALL children. Reducing the intensity of chemotherapy appropriately can lower the infection-related SAE and TRM and improve the long-term survival in this subtype.
急性淋巴细胞白血病(ALL)是儿童最常见的恶性肿瘤,约占同时期儿童恶性肿瘤的30%。随着危险度分层的日趋精准、支持治疗的不断增强及对特殊融合基因亚型的靶向治疗,目前儿童ALL的5年无事件生存(EFS)率可达到85%[1]。ETV6-RUNX1(又称TEL-AML1)融合基因,是由12号染色体上的转录因子ETV6基因与21号染色体上的RUNX1序列断裂、重接形成,可影响造血干细胞的自我更新与分化,与白血病的发生、发展密切相关。ETV6-RUNX1融合基因在儿童急性前体B淋巴细胞白血病(precursor B acute lymphoblastic leukemia,B-ALL)中的阳性率为20%~25%[2]。国外研究发现,多数ETV6-RUNX1融合基因阳性儿童B-ALL预后良好,5年的EFS率达80%~97%,显著高于其他亚型[3]–[6],但仍有部分患儿发生治疗相关死亡或晚期复发死亡。目前国内对ETV6-RUNX1融合基因阳性儿童B-ALL的大样本研究仍较少,本研究通过回顾性分析该亚型患儿的临床特征及不同治疗方案的疗效,探讨更为合理的治疗方案以进一步改善该亚型ALL患儿的生存。
病例与方法
1.研究对象:2011年4月至2020年5月在福建医科大学附属协和医院初诊的B-ALL患儿作为研究对象,入选标准:①年龄≤14岁;②临床表现符合ALL,并经骨髓细胞形态学、免疫分型、细胞遗传学及分子生物学(ETV6-RUNX1、BCR-ABL1、MLL-AF4和E2A-PBX1等融合基因作为常规检测项目)检查明确诊断为B-ALL[7];③初发患儿(来院就诊前未经过任何ALL相关治疗)。所有患儿初诊时均通过定量PCR筛查相关的融合基因,筛查出ETV6-RUNX1阳性的患者后续采用荧光定量PCR及TaqMan探针定量法检测标本中ETV6-RUNX1基因的拷贝数。
2.治疗方案及危险度分层:2019年1月1日前收治的患儿其治疗方案、危险分组、疗效评价采用中国儿童白血病协作组(Chinese Children Leukemia Group,CCLG)-ALL 2008方案[7]。2019年1月1日后收治的患儿其治疗方案、危险分组、疗效评价采用中国儿童癌症协作组(Chinese Children Cancer Group,CCCG)-ALL 2015方案[8]。
两种方案的化疗药物种类及各个时间段化疗方案的组成基本相同,主要的区别在于化疗药物的剂量和次数存在差异。CCLG-2008方案诱导化疗中推荐低危组柔红霉素为2剂,中危组为3剂,高危组为4剂,培门冬酶均为2剂,而CCCG-ALL-2015方案的诱导化疗中,推荐低危组柔红霉素根据血常规情况可仅给予1剂或2剂,培门冬酶仅为1剂,中高危组柔红霉素及培门冬酶均为2剂,且柔红霉素的剂量由前者的30 mg/m2降至25 mg/m2,培门冬酶的剂量由前者2500 IU/m2降至2000 IU/m2。此外,后者诱导方案中,推荐中高危组若诱导化疗第19天微小残留病(MRD)<1%可仅给予1个疗程的CAT方案,而前者均推荐2个疗程CAM方案。
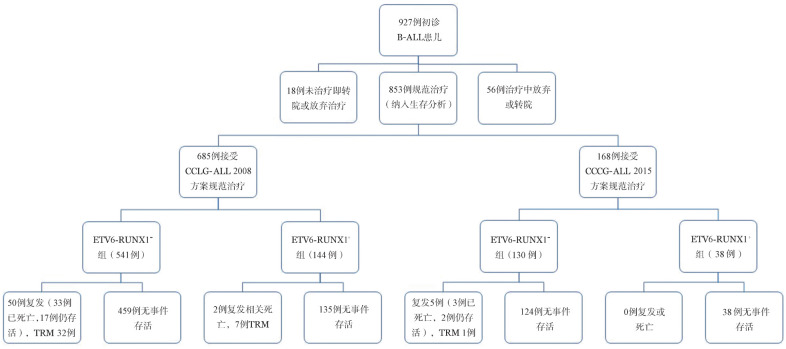
189例ETV6-RUNX1阳性患儿中,182例规范治疗者纳入生存分析;738例ETV6-RUNX1阴性患儿中,671例规范治疗者纳入生存分析。144例ETV6-RUNX1阳性和541例ETV6-RUNX1阴性患儿接受CCLG-ALL 2008方案化疗。38例ETV6-RUNX1阳性和130例ETV6-RUNX1阴性患儿接受CCCG-ALL 2015方案化疗。治疗分组见图1。
图1. 927例初诊急性前体B淋巴细胞白血病(B-ALL)患儿的治疗及转归.
TRM:治疗相关死亡;CCLG:中国儿童白血病协作组;CCCG:中国儿童癌症协作组
3.MRD的监测:本研究中患儿在诱导化疗期间监测MRD,其中接受CCLG-ALL 2008方案治疗的患儿在诱导化疗第15天及第33天评估骨髓MRD;而接受CCCG-ALL 2015方案的患儿在诱导化疗第19天及第46天评估骨髓MRD。MRD使用BC Navios流式细胞仪进行检测,抗体包括CD45、CD34、CD117、CD38、CD123、TdT、CD33、CD13、CD15、CD5、CD7、CD19、CD10,B-ALL组合还包括cCD79a、cIgM、CD22、CD20、CD58、HLA-DR、CXCR4,T-ALL组合包括cCD3、CD2、CD4、CD8、mCD3、CD57、CD1a、CD56和CD16。使用CD45/SSC设门法,区分正常细胞群和异常细胞群;以正常细胞群作为内对照,判定异常细胞抗原的表达(阳性率>0.01%为阳性);对异常细胞群进行免疫表型分析,最后得出诊断结论。
4.随访:所有病例通过门诊复查或电话进行随访,随访截至2020年7月31日。中位随访时间36.3(0.7~111.7)个月。总生存(OS)期为患者开始治疗至死亡或末次随访的时间;无事件生存(EFS)期为开始治疗至发生任何事件的时间,包括任何原因所致死亡、疾病进展、复发或失访。56例失访(治疗中放弃或转院)患者未纳入生存分析。观察患者一般情况、复发及干预措施、生存情况,监测骨髓象、MRD、ETV6-RUNX1基因水平等。
5.统计学处理:采用回顾性分析方法,用SPSS 21.0软件进行统计分析,非正态分布样本集中趋势用中位数表示,计量样本比较用秩和检验,两个样本率的比较用卡方检验或Fisher确切概率法,采用Kaplan-Meier方法分析患儿的OS和EFS,并行Log-rank检验。P<0.05为差异有统计学意义。
结果
1.一般资料:927例B-ALL患儿中,男540例,女387例,中位年龄为7.3(1~13)岁。ETV6-RUNX1+组与ETV6-RUNX1−组比较(表1),性别比例差异无统计学意义;但ETV6-RUNX1+组初诊有危险因素(年龄≥10岁或<1岁,WBC≥50×109/L)的患者比例显著低于ETV6-RUNX1−组(P值分别为0.000和0.001),而泼尼松诱导试验反应良好、诱导化疗第15天或第19天MRD<1%,及诱导化疗第33天或第46天MRD<0.01%的患者比例显著高于ETV6-RUNX1−组(P值分别为0.001、0.028、0.004)。
表1. ETV6-RUNX1+组和ETV6-RUNX1−组的临床特征及早期治疗反应比较[例(%)].
| 特征 | 例数 | ETV6-RUNX1+组(189例) | ETV6-RUNX1−组(738例) | χ2值 | P值 |
| 性别 | 0.262 | 0.609 | |||
| 男 | 540 | 107(56.6) | 433(58.7) | ||
| 女 | 387 | 82(43.4) | 305(41.3) | ||
| 年龄 | 17.699 | 0.000 | |||
| ≥10岁或<1岁 | 119 | 7(3.7) | 112(15.2) | ||
| 1~10岁 | 808 | 182(96.3) | 626(84.8) | ||
| 初诊WBC | 10.950 | 0.001 | |||
| ≥50×109/L | 211 | 26(13.8) | 185(25.1) | ||
| <50×109/L | 716 | 163(86.2) | 553(74.9) | ||
| BCR-ABL融合基因 | 6.580 | 0.010 | |||
| 阳性 | 25 | 0(0) | 25(3.4) | ||
| 阴性 | 902 | 189(100) | 713(96.6) | ||
| E2A-PBX1融合基因 | 13.249 | 0.000 | |||
| 阳性 | 49 | 0(0) | 49(6.6) | ||
| 阴性 | 878 | 189(100) | 689(93.4) | ||
| MLL基因重排 | 3.113 | 0.078 | |||
| 阳性 | 12 | 0(0) | 12(1.6) | ||
| 阴性 | 915 | 189(100) | 726(98.4) | ||
| 泼尼松诱导试验a | 11.378 | 0.001 | |||
| 反应不良 | 68 | 3(2.0) | 65(10.8) | ||
| 反应良好 | 686 | 148(98.0) | 538(89.2) | ||
| D15或D19 MRDb | 4.828 | 0.028 | |||
| ≥1% | 264 | 45(29.0) | 219(38.6) | ||
| <1% | 458 | 110(71.0) | 348(61.4) | ||
| D33或D46 MRDc | 8.163 | 0.004 | |||
| ≥0.01% | 113 | 12(6.8) | 101(15.0) | ||
| <0.01% | 739 | 165(93.2) | 574(85.0) |
注:MRD:微小残留病。a对比了754例接受中国儿童白血病协作组(CCLG)-ALL2008方案的患者。b接受CCLG-ALL 2008方案的患儿在诱导化疗第15天(D15)检查MRD;接受中国儿童癌症协作组(CCLG)-ALL 2015方案的患儿在诱导化疗第19天(D19)检查MRD;205例早期的患儿该检查点的MRD结果缺失。c接受CCLG-ALL 2008方案的患儿在诱导化疗第33天(D33)检查MRD;接受CCCG-ALL 2015方案的患儿在诱导化疗第46天(D46)检查MRD;75例患儿因未到该检查点或已死亡,导致结果缺失
2.早期治疗反应比较:对比ETV6-RUNX1+组和ETV6-RUNX1−组的早期治疗反应(表1),接受CCCG-ALL 2008方案的754例患儿中,泼尼松诱导试验反应不良(第8天外周血幼稚细胞计数≥1×109/L)68例(7.3%),ETV6-RUNX1+组比例显著低于ETV6-RUNX1−组(2.0%对10.8%,P=0.001)。本研究中共有722例患儿在化疗第15天或第19天检测MRD,其中≥1%者264例(36.6%),ETV6-RUNX1+组显著低于ETV6-RUNX1−组(29.0%对38.6%,P=0.028)。而监测第33天或第46天MRD者共有852例,≥0.01%者113例(13.3%),ETV6-RUNX1+组显著低于ETV6-RUNX1−组(6.8%对15.0%,P=0.004)。
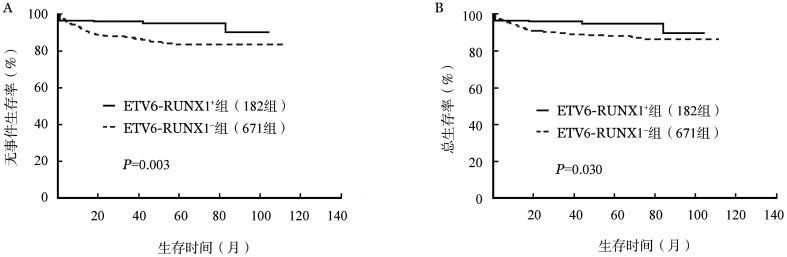
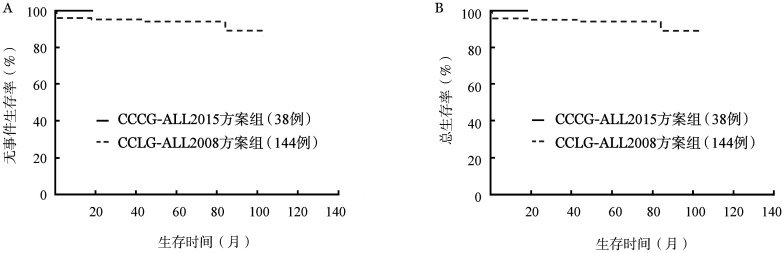
3.远期疗效比较:对比规范治疗的182例ETV6-RUNX1+组患儿和671例ETV6-RUNX1−组患儿的远期疗效。ETV6-RUNX1+组的5年EFS率及OS率均显著高于ETV6-RUNX1−组(EFS:89.8%对83.2%,P=0.003;OS:90.2%对86.3%,P=0.030)(图2)。ETV6-RUNX1+组患儿按治疗方案不同进一步行亚组分析,CCLG-ALL 2008方案组的144例患儿,中位随访49.0(0.7~104.8)个月,2例复发(均为晚期复发,复发时间分别为42.1、83.0个月),7例治疗相关死亡(均为重症感染相关死亡,其中6例在诱导化疗中死亡,1例在强化治疗中死亡)。CCCG-ALL 2015方案组的38例患儿中,中位随访9.0(2.0~18.5)个月,无复发和死亡病例。CCLG-ALL 2008方案组治疗相关死亡率高于CCCG-ALL 2015组,但差异无统计学意义(4.9%对0,P=0.348)。两组患者的生存曲线见图3。
图2. 在规范治疗的853例急性前体B淋巴细胞白血病患儿中ETV6-RUNX1+和ETV6-RUNX1−组无事件生存率(A)和总生存率(B)比较.
图3. 在182例ETV6-RUNX1+阳性急性前体B淋巴细胞白血病患儿中接受CCLG-ALL 2008方案和CCCG-ALL 2015方案组无事件生存率(A)和总生存率(B)比较.
4.CCLG-ALL 2008方案和CCCG-ALL 2015方案的不良反应比较:对ETV6-RUNX1+患者按不同治疗方案组分析,接受CCLG-ALL 2008方案的144例患儿中,共有39例(27.1%)发生感染相关严重不良反应(SAE)(诱导治疗中发生脓毒血症29例,深部真菌感染5例;强化治疗中发生脓毒血症3例,重症肺炎2例),13例(3.8%)发生非感染相关SAE(诱导治疗中发生门冬酰胺酶相关胰腺炎10例;强化治疗中发生门冬酰胺酶相关胰腺炎2例,高甲氨蝶呤血症1例,入住ICU进行连续肾脏替代治疗)。而接受CCCG-ALL 2015方案的38例患儿中,仅2例(5.3%)发生感染相关SAE(1例脓毒血症、1例深部真菌感染),2例(5.3%)发生非感染相关SAE(1例门冬酰胺酶相关胰腺炎,1例高甲氨蝶呤血症,后者入住ICU进行连续肾脏替代治疗),无治疗相关死亡及复发病例。CCLG-ALL 2008方案组感染相关SAE发生率显著高于CCCG-ALL 2015组(27.1%对5.3%,P=0.004)。
讨论
目前ETV6-RUNX1融合基因阳性ALL发病机制主要与“二次打击”模式有关:当ETV6基因中的HLH区域和几乎整个RUNX1基因拼接在一起时,两个原有基因结构破坏,从而引发DNA修复,随后形成ETV6-RUNX1融合基因,这些往往在胎儿前期就已发生,其功能是抑制转录活性,从而影响造血干细胞的自我更新和分化[9]–[11];当发生二次突变或遭受环境打击后,体内的多种途径被激活,最终发展为ALL[12]–[13]。
ETV6-RUNX1是ALL中最常见的融合基因,在B-ALL中的阳性率为20%~26%,阳性率与种族有一定的相关性[14]–[15]。在北欧、美国、韩国、日本、西班牙的调查中,B-ALL患者ETV6-RUNX1阳性率分别为25%、26%、17%、9.5%、3%[3]–[5],[14]。国内报道的比例为18%~24%[14],[16]–[17]。在本研究中,儿童B-ALL中ETV6-RUNX1融合基因阳性率为20.4%,与国内外报道相当。
国内外多个大样本量的研究显示,ETV6-RUNX1+儿童ALL的预后较好。Rubnitz等[18]分析了244例ETV6-RUNX1+和682例ETV6-RUNX1− B-ALL患儿的预后,结果显示前者的EFS率显著高于后者[(82±2)%对(72±2)%,P<0.001],且ETV6-RUNX1+为独立的预后因素。Bhojwani等[5]对比了168例ETV6-RUNX1+和494例ETV6-RUNX1− B-ALL患儿的预后,结果显示,前者的5年EFS和OS率均显著高于后者。一项前瞻性研究显示,ETV6-RUNX1+B-ALL患儿组的EFS和OS率均高于ETV6-RUNX1−组,但多因素分析显示,ETV6-RUNX1并非独立预后因素[3]。国内CCLG-ALL 2008方案最大样本的单中心和多中心研究均显示,在不同融合基因亚型中,ETV6-RUNX1+组预后最好[7],[19]。本研究结果显示,ETV6-RUNX1+组复发率明显低于ETV6-RUNX1−组,而ETV6-RUNX1+组5年EFS及OS均优于阴性组。因此,我们认为ETV6-RUNX1+为B-ALL预后良好的因素,这与以上国内外报道亦相符合[5],[7],[14],[18]–[21]。
ETV6-RUNX1融合基因对预后的影响可能与其独特的生物学特征相关。首先,基础研究显示,ETV6-RUNX1基因可通过转录抑制多药耐药-1基因的表达,从而克服化疗耐药性;与其他细胞遗传学亚型的白血病细胞相比,ETV6-RUNX1阳性白血病细胞对抗白血病药物的体外敏感性增加[22]–[24]。其次,临床研究显示,ETV6-RUNX1+相对于ETV6-RUNX1− B-ALL患儿,合并预后不良危险因素的患者比例较低,而早期治疗反应良好患者比例则较高[5],[18]。在本研究中,ETV6-RUNX1+组初诊危险因素更少,早期治疗反应更好,与报道相符合。
ETV6-RUNX1+组共有7例因重症感染死亡,均为CCLG-ALL 2008方案组,治疗相关死亡率高达3.8%(7/182)。本研究进一步对两种方案的治疗相关死亡率及不良反应发生情况进行分析,结果显示接受CCLG-ALL 2008方案化疗的患儿感染性或非感染性SAE的发生率明显高于接受CCCG-ALL 2015方案化疗的患儿,且差异有统计学意义,而两组之间的治疗相关死亡率、EFS及OS差异并无统计学意义,考虑SAE发生率高可能与化疗强度相关。在保证OS及EFS的情况下,减轻化疗强度可以降低SAE发生率,这也是本中心调整化疗方案的原因。但因本研究中纳入CCCG-ALL 2015方案化疗的患儿样本量较小,且随访时间较短,对于两组之间的EFS及OS比较有待扩大样本量来进一步验证。
既往研究显示,ETV6-RUNX1融合基因阳性复发者常为晚期复发[4]–[5]。本研究结果中,有2例患儿复发,复发时间分别为42.1个月和83.0个月,均为晚期复发。目前关于该组亚型复发的预后因素尚未明确。国内外研究认为这可能与初诊亚克隆如非等位的ETV6基因缺失[del(12p13))及del(9p21)][6],[25]、拷贝数变异[26]等方面有关。郑雪岭等[27]利用基因表达谱探索ETV6-RUNX1的异质性,发现WASF1、FRMD4B、STCH、CLIC5、GNG11基因低表达,而MARCKS、ICAM3、SH3BP5、NFE2、ACTN1、SNF1LK基因高表达的ETV6-RUNX1阳性ALL患儿预后可能相对不良。此外,在一些患者中,儿童期联合化疗可能无法消除胎儿白血病前ETV6-RUNX1基因的克隆,并且在治疗后该克隆发生二次转化导致白血病复发[28]。但即使复发后,ETV6-RUNX1+组的OS仍明显优于ETV6-RUNX1−组[29]。
综上所述,本研究结果显示ETV6-RUNX1融合基因阳性B-ALL患儿初诊危险因素较少,早期治疗反应较好,复发率低,总体预后良好。适当减低化疗强度的CCCG-ALL 2015方案较CCLG-ALL 2008方案有更低的感染相关SAE及治疗相关死亡发生率,可能进一步提高该亚型ALL患儿的OS率。
References
- 1.Teachey DT, Pui CH. Comparative features and outcomes between paediatric T-cell and B-cell acute lymphoblastic leukaemia[J] Lancet Oncol. 2019;20(3):e142–e154. doi: 10.1016/S1470-2045(19)30031-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Inaba H, Greaves M, Mullighan CG. Acute lymphoblastic leukaemia[J] Lancet. 2013;381(9881):1943–1955. doi: 10.1016/S0140-6736(12)62187-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Loh ML, Goldwasser MA, Silverman LB, et al. Prospective analysis of TEL/AML1-positive patients treated on Dana-Farber Cancer Institute Consortium Protocol 95-01[J] Blood. 2006;107(11):4508–4513. doi: 10.1182/blood-2005-08-3451. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Forestier E, Heyman M, Andersen MK, et al. Outcome of ETV6/RUNX1-positive childhood acute lymphoblastic leukaemia in the NOPHO-ALL-1992 protocol: frequent late relapses but good overall survival[J] Br J Haematol. 2008;140(6):665–672. doi: 10.1111/j.1365-2141.2008.06980.x. [DOI] [PubMed] [Google Scholar]
- 5.Bhojwani D, Pei D, Sandlund JT, et al. ETV6-RUNX1-positive childhood acute lymphoblastic leukemia: improved outcome with contemporary therapy[J] Leukemia. 2012;26(2):265–270. doi: 10.1038/leu.2011.227. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Lee JW, Kim SK, Jang PS, et al. Outcome and Prognostic Factors for ETV6/RUNX1 Positive Pediatric Acute Lymphoblastic Leukemia Treated at a Single Institution in Korea[J] Cancer Res Treat. 2017;49(2):446–453. doi: 10.4143/crt.2016.211. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cui L, Li ZG, Chai YH, et al. Outcome of children with newly diagnosed acute lymphoblastic leukemia treated with CCLG-ALL 2008: The first nation-wide prospective multicenter study in China[J] Am J Hematol. 2018;93(7):913–920. doi: 10.1002/ajh.25124. [DOI] [PubMed] [Google Scholar]
- 8.Cai J, Yu J, Zhu X, et al. Treatment abandonment in childhood acute lymphoblastic leukaemia in China: a retrospective cohort study of the Chinese Children's Cancer Group[J] Arch Dis Child. 2019;104(6):522–529. doi: 10.1136/archdischild-2018-316181. [DOI] [PubMed] [Google Scholar]
- 9.Schäfer D, Olsen M, Lähnemann D, et al. Five percent of healthy newborns have an ETV6-RUNX1 fusion as revealed by DNA-based GIPFEL screening[J] Blood. 2018;131(7):821–826. doi: 10.1182/blood-2017-09-808402. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Sun C, Chang L, Zhu X. Pathogenesis of ETV6/RUNX1-positive childhood acute lymphoblastic leukemia and mechanisms underlying its relapse[J] Oncotarget. 2017;8(21):35445–35459. doi: 10.18632/oncotarget.16367. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Zakaria Z, Othman N, Ismail A, et al. Whole-Exome Sequencing of ETV6/RUNX1 in Four Childhood Acute Lymphoblastic Leukaemia Cases[J] Asian Pac J Cancer Prev. 2017;18(4):1169–1175. doi: 10.22034/APJCP.2017.18.4.1169. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Alpar D, Wren D, Ermini L, et al. Clonal origins of ETV6-RUNX1+ acute lymphoblastic leukemia: studies in monozygotic twins[J] Leukemia. 2015;29(4):839–846. doi: 10.1038/leu.2014.322. [DOI] [PubMed] [Google Scholar]
- 13.Ford AM, Greaves M. ETV6-RUNX1 + Acute Lymphoblastic Leukaemia in Identical Twins[J] Adv Exp Med Biol. 2017;962:217–228. doi: 10.1007/978-981-10-3233-2_14. [DOI] [PubMed] [Google Scholar]
- 14.王 邢玮, 李 本尚, 沈 树红, et al. ETV6/RUNX1阳性儿童急性B系淋巴细胞白血病临床预后研究[J] 临床儿科杂志. 2016;34(5):321–325. doi: 10.3969/j.issn.1000-3606.2016.05.001. [DOI] [Google Scholar]
- 15.王 凯玲, 梅 妍妍, 崔 蕾, et al. 两种化疗方案对于TEL-AML1融合基因阳性儿童急性淋巴细胞白血病的疗效比较[J] 中国实验血液学杂志. 2014;22(2):285–290. doi: 10.7534/j.issn.1009-2137.2014.02.005. [DOI] [PubMed] [Google Scholar]
- 16.王 书春, 陈 晓娟, 宋 振, et al. 172例TEL/AML1阳性急性淋巴细胞白血病生物学特征分析[J] 中国小儿血液与肿瘤杂志. 2020;25(2):82–86. doi: 10.3969/j.issn.1673-5323.2020.02.006. [DOI] [Google Scholar]
- 17.高 静, 胡 绍燕, 卢 俊, et al. TEL/AML1基因阳性急性淋巴细胞白血病患儿CCLG-ALL-2008方案疗效分析[J] 临床儿科杂志. 2017;35(5):325–330. doi: 10.3969/j.issn.1000-3606.2017.05.002. [DOI] [Google Scholar]
- 18.Rubnitz JE, Wichlan D, Devidas M, et al. Prospective analysis of TEL gene rearrangements in childhood acute lymphoblastic leukemia: a Children's Oncology Group study[J] J Clin Oncol. 2008;26(13):2186–2191. doi: 10.1200/JCO.2007.14.3552. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Gao C, Zhao XX, Li WJ, et al. Clinical features, early treatment responses, and outcomes of pediatric acute lymphoblastic leukemia in China with or without specific fusion transcripts: a single institutional study of 1,004 patients[J] Am J Hematol. 2012;87(11):1022–1027. doi: 10.1002/ajh.23307. [DOI] [PubMed] [Google Scholar]
- 20.Piette C, Suciu S, Clappier E, et al. Differential impact of drugs on the outcome of ETV6-RUNX1 positive childhood B-cell precursor acute lymphoblastic leukaemia: results of the EORTC CLG 58881 and 58951 trials[J] Leukemia. 2018;32(1):244–248. doi: 10.1038/leu.2017.289. [DOI] [PubMed] [Google Scholar]
- 21.Wang Y, Zeng HM, Zhang LP. ETV6/RUNX1-positive childhood acute lymphoblastic leukemia in China: excellent prognosis with improved BFM protocol[J] Ital J Pediatr. 2018;44(1):94. doi: 10.1186/s13052-018-0541-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Ramakers-van WNL, Pieters R, Loonen AH, et al. TEL/AML1 gene fusion is related to in vitro drug sensitivity for L-asparaginase in childhood acute lymphoblastic leukemia[J] Blood. 2000;96(3):1094–1099. [PubMed] [Google Scholar]
- 23.Frost BM, Forestier E, Gustafsson G, et al. Translocation t(12;21) is related to in vitro cellular drug sensitivity to doxorubicin and etoposide in childhood acute lymphoblastic leukemia[J] Blood. 2004;104(8):2452–2457. doi: 10.1182/blood-2003-12-4426. [DOI] [PubMed] [Google Scholar]
- 24.Asakura K, Uchida H, Miyachi H, et al. TEL/AML1 overcomes drug resistance through transcriptional repression of multidrug resistance-1 gene expression[J] Mol Cancer Res. 2004;2(6):339–347. [PubMed] [Google Scholar]
- 25.Ampatzidou M, Papadhimitriou SI, Paterakis G, et al. ETV6/RUNX1-positive childhood acute lymphoblastic leukemia (ALL): The spectrum of clonal heterogeneity and its impact on prognosis[J] Cancer Genet. 2018;224-225:1–11. doi: 10.1016/j.cancergen.2018.03.001. [DOI] [PubMed] [Google Scholar]
- 26.邹 尧, 张 丽, 刘 晓明, et al. 儿童ETV6/RUNX1阳性急性淋巴细胞性白血病基因拷贝数变异的临床研究[J] 中华儿科杂志. 2016;54(3):209–213. doi: 10.3760/cma.j.issn.0578-1310.2016.03.011. [DOI] [Google Scholar]
- 27.郑 雪岭, 王 子阳, 孙 嫣然, et al. ETV6-RUNX1阳性儿童急性淋巴细胞白血病基因表达谱聚类的临床特征[J] 中华血液学杂志. 2020;41(5):405–411. doi: 10.3760/cma.j.issn.0253-2727.2020.05.008. [DOI] [Google Scholar]
- 28.Ford AM, Fasching K, Panzer-Grümayer ER, et al. Origins of “late” relapse in childhood acute lymphoblastic leukemia with TEL-AML1 fusion genes[J] Blood. 2001;98(3):558–564. doi: 10.1182/blood.v98.3.558. [DOI] [PubMed] [Google Scholar]
- 29.Gandemer V, Chevret S, Petit A, et al. Excellent prognosis of late relapses of ETV6/RUNX1-positive childhood acute lymphoblastic leukemia: lessons from the FRALLE 93 protocol[J] Haematologica. 2012;97(11):1743–1750. doi: 10.3324/haematol.2011.059584. [DOI] [PMC free article] [PubMed] [Google Scholar]