Abstract
Fieber während der Granulozytopenie („febrile neutropenia“) ist die häufigste potenzielle Notfallsituation in der Kinderonkologie. Aufgrund der therapiebedingten Immunsuppression fehlen dem Patienten wichtige Abwehrmechanismen, sodass v. a. bakterielle Infektionen und in bestimmten Risikogruppen auch Pilzinfektionen lebensbedrohlich verlaufen können. Die möglichst zeitnahe Einleitung einer angemessenen antibiotischen Therapie kann hier Leben retten. Der vorliegende Beitrag möchte für diese Notfallsituation sensibilisieren und einen Überblick über das Management dieser Patienten geben.
Schlüsselwörter: Immunsystem, Bakterielle Infektionen, Pilzinfektionen, Antibiotika, Notfälle
Abstract
Febrile neutropenia is the most common potential emergency situation in children and adolescents with cancer. The host response of these patients is severely compromised by treatment-induced immunosuppression resulting in a lack of important defence mechanisms, so that bacterial infections and in certain risk groups also fungal infections can be life threatening. As the clinical course of these infectious complications may be rapid and fatal, early antibiotic treatment can save lives. This article aims to raise awareness to this emergency situation and gives an overview of the management of pediatric cancer patients with febrile neutropenia.
Keywords: Immune system, Bacterial infections, Fungal infections, Antibiotics, Emergencies
Trotz signifikanter Verbesserungen der Supportivtherapie sowie der Verfügbarkeit neuer antibiotischer und antimykotischer Substanzen sind Infektionen noch immer eine wichtige Ursache für Morbidität und Mortalität bei krebskranken Kindern und Jugendlichen. So zeigten Untersuchungen bei pädiatrischen Patienten mit akuter myeloischer Leukämie, dass diese während der intensiven Therapie im Durchschnitt 3 infektiöse Komplikationen erlitten, und dass Infektionen für 60 % der therapieassoziierten Todesfälle verantwortlich waren [3, 5, 11]. Da bei fiebernden granulozytopenischen Patienten lokale Entzündungsreaktionen fehlen können, die Infektionen jedoch einen rasch fortschreitenden und lebensbedrohlichen Verlauf nehmen können, ist das adäquate Management betroffener Kinder für alle Kinderärzte/-ärztinnen1 in der Notfallversorgung von größter Bedeutung.
Geschwächte Immunabwehr durch Krebserkrankung und Therapie
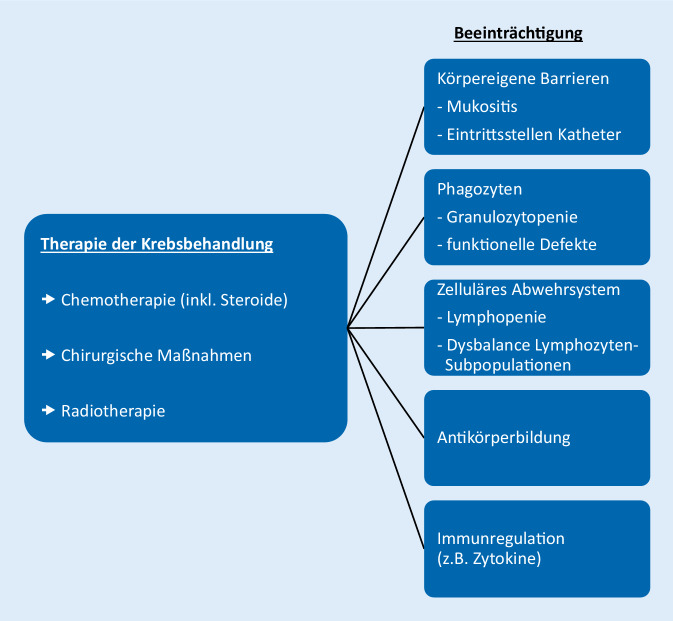
Eine der wichtigsten unerwünschten Nebenwirkungen einer Krebsbehandlung ist die temporäre Unterdrückung der Blutbildung. Hierdurch kommt es etwa 7 bis 10 Tage nach Beginn der Chemotherapie zu einer Unterdrückung der Myelopoese, die sich als klinisch als Anämie, Granulozytopenie und Thrombozytopenie zeigt. Die neutrophilen Granulozyten sind einer der wichtigsten primären Abwehrmechanismen von bakteriellen Erregern und Pilzen, weswegen das Risiko für infektiöse Komplikationen vom Schweregrad und von der Dauer der Granulozytopenie abhängt. Wichtig ist jedoch auch die Dynamik der Granulozytenzahlen im peripheren Blut: Fallende Werte mit einer in den nächsten Tagen erwarteten Granulozytopenie sind mit einem höheren, steigende Werte mit einem niedrigeren Risiko für kompliziert verlaufende Infektionen assoziiert [1]. Neben der Granulozytopenie wird das Risiko für Infektionen zusätzlich durch funktionelle Einschränkungen der Infektionsabwehr erhöht. Dies ist insbesondere bei längerdauernder und höherdosierter Glukokortikoidtherapie der Fall, z. B. bei Patienten unter Therapie einer akuten lymphoblastischen Leukämie (ALL). Reparaturmechanismen funktionieren verlangsamt, sodass physikalische Schutzbarrieren mit schnellem Zellumsatz wie z. B. die Schleimhäute Defekte und damit Eintrittspforten für Erreger aufweisen. Daneben werden durch die Chemotherapie auch das lymphozytäre Abwehrsystem sowie die humorale Immunität mit Antikörperbildung beeinträchtigt (Abb. 1).
Neben der Chemotherapie kann auch die Grunderkrankung Wochen oder sogar Monate vor der eigentlichen Diagnosestellung eine Granulozytopenie verursachen, da Tumorzellen im Knochenmark die normale Blutbildung verdrängen [18].
Fieber während der Granulozytopenie
Da bei granulozytopenischen Patienten lokale Entzündungsreaktionen nur schwach ausgeprägt sind oder ganz fehlen können, kann Fieber das erste und auch einzige Zeichen einer infektiösen Komplikation sein. Infektionen können bei granulozytopenischen Patienten fulminant sein und binnen weniger Stunden tödlich verlaufen, insbesondere solche durch gramnegative Erreger wie Pseudomonas-Spezies oder Klebsiellen. Deshalb ist Fieber während der Granulozytopenie (Tab. 1) als eine potenzielle Notfallsituation zu betrachten.
| Fieber | Oral, axillär oder aurikulär gemessene Temperatur ≥ 38,5 °C oder bei wiederholter Messung im Abstand von 1 h zwischen 38,0 und 38,5 °C. Rektale Messung nicht empfohlen (Schleimhautschäden) |
| Entfieberung | Körperkerntemperatur für 24 h anhaltend < 38 °C ohne die Gabe von Antipyretika |
| Fieber unbekannter Ursache („fever of unknown origin“, FUO) | Fieber ohne klinisch (auch ohne bildgebend) gesicherten Infektionsfokus (klinisch dokumentierte Infektion) oder ohne mikrobiologisch gesicherten Infektionsfokus (mikrobiologisch dokumentierte Infektion) |
| Granulozytopenie (Neutropenie) | Absolute Granulozytenzahl im peripheren Blut < 0,5 • 109/l oder Leukozytenzahl < 1,0 • 109/l (falls kein Differenzialblutbild verfügbar) |
| Protrahierte Granulozytopenie | Absolute Granulozytenzahl im peripheren Blut ≤ 0,5 • 109/l für ≥ 10 Tage |
| Mukositis | Durch zytostatische Therapie induzierte Entzündung der Schleimhäute des Gastrointestinaltrakts |
| Sepsis | Systemische inflammatorische Wirtsreaktion („systemic inflammatory response syndrome“, SIRS) mit Fieber oder Hypothermie, Tachykardie, Tachypnoe mit oder ohne Organkomplikationen im Zusammenhang mit einer Infektion |
| „Time to antibiotic treatment“ (TTA) | Zeitraum zwischen Ankunft des Patienten im Krankenhaus und Beginn einer i.v.-Antibiotika-Therapie |
| Empirische (kalkulierte) Therapie | Antibiotika bzw. Antimykotika werden aufgrund der Häufigkeit zu erwartender Erreger/Resistenzen ausgewählt |
| Gezielte Therapie | Therapie, die sich nach den Ergebnissen der Diagnostik gegen einen Infektionserreger richtet, dessen In-vitro-Empfindlichkeit bekannt ist |
Fieber während einer Granulozytopenie ist eine potenzielle Notfallsituation
Allerdings können Infektionen bei granulozytopenischen Patienten auch ohne Fieber verlaufen, gerade bei Patienten unter Glukokortikoid- oder Analgetikatherapie wie Paracetamol oder Metamizol. Jede deutliche Verschlechterung des Allgemeinzustands und unklare Schmerzsymptomatiken müssen eine sofortige ärztliche Untersuchung mit Überprüfung der Vitalzeichen und der Laborparameter nach sich ziehen.
Umgekehrt kann die Gabe von Blutprodukten, Humanalbumin oder Immunglobulinen sowie auch von Medikamenten („drug fever“, z. B. Cytarabin) Fieber auslösen. Die Entscheidung für oder gegen eine antibiotische Therapie muss in solchen Situationen immer mit einem erfahren Kinderonkologen getroffen werden; im Zweifel ist mit der unmittelbaren i.v.-Antibiotikagabe zu beginnen.
Epidemiologie
Trotz aller mikrobiologischen Untersuchungen bleibt bei etwa zwei Dritteln der Patienten mit Fieber während der Granulozytopenie dessen Ursache letztlich unklar und wird als „Fieber unbekannter Ursache“ bezeichnet („fever of unknown origin“, FUO; Tab. 1; [11]). Bei etwa 10 % aller Patienten mit Fieber während der Granulozytopenie lässt sich im Fall der klinisch diagnostizierten Infektion kein Erreger nachweisen („klinisch dokumentierte Infektion“), während sich bei etwa 30 % aller Patienten mit Fieber während der Granulozytopenie ein für das Infektionsgeschehen plausibler Erreger isolieren lässt, meist in der Blutkultur (positiv in 10–20 % aller Fälle, „mikrobiologisch dokumentierte Infektion“). Hier finden sich meist grampositive Erreger, wie es auch eine Studie bei Kindern mit akuter myeloischer Leukämie (AML) zeigt (Tab. 2; [11]). Pilze werden dahingegen sehr selten (< 5 %) in der Blutkultur nachgewiesen, in aller Regel dann Candida-Arten.
| Pathogen | Gesamt (n = 252; 100 %)a |
|---|---|
| Grampositive Erreger | |
| Gesamt, n (%) | 203 (80,6) |
| Staphylokokken, n (%) | 94 (37,3) |
| Streptokokken, n (%) | 80 (31,7) |
| Enterococcus-Spezies, n (%) | 7 (2,8) |
| Corynebakterien, n (%) | 6 (2,4) |
| Andere, n (%) | 16 (6,3) |
| Gramnegative Erreger | |
| Gesamt, n (%) | 49 (19,4) |
| Klebsiella-Spezies, n (%) | 8 (3,2) |
| Pseudomonas aeruginosa, n (%) | 10 (4,0) |
| Escherichia coli, n (%) | 13 (5,2) |
| Andere, n (%) | 18 (7,2) |
aIn 24 Fällen wurde mehr als ein Erreger in der Blutkultur nachgewiesen
Wichtig ist die regelmäßige Analyse der lokalen Erreger- und Resistenzstatistik
Zunehmend häufiger treten Infektionen durch multiresistente bakterielle Erreger auf, deren Nachweis bei inadäquater Initialtherapie die Prognose signifikant verschlechtern kann [13]. Deswegen ist es wichtig, ein indikationsbezogenes Screening durchzuführen und regelmäßig die lokale Erreger- und Resistenzstatistik (Blutstrominfektionen) zu analysieren. Dies kann ggf. sowohl bei individuellen Patienten als auch insgesamt zu einer Anpassung des empirischen Antibiotikaregimes genutzt werden.
Anamnese und Untersuchung
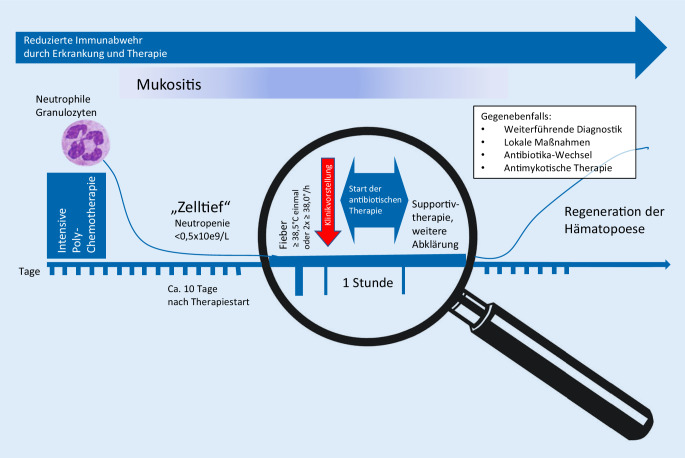
Kinder mit Krebserkrankungen, die eine intensive zytostatische Therapie erhalten, müssen bei Fieber unmittelbar in einem kinderonkologischen Zentrum vorgestellt werden, insbesondere in der Zeit des durch die Behandlung erwarteten Zelltiefs (Abb. 2). Bereits vor der ersten Entlassung nach der Diagnosestellung sind die Eltern hierüber ausführlich aufzuklären.
Wichtige anamnestische Informationen sind Art der Grunderkrankung, Zeitpunkt und Art der letzten Chemotherapie, derzeitige Medikation. einschließlich einer antimikrobiellen Prophylaxe, Angaben zu Besiedelungen bzw. vorherige Infektionen (einschließlich multiresistente Erreger und Clostridioides difficile).
Die körperliche Untersuchung umfasst sowohl den Allgemeinzustand und die Vitalparameter des Patienten als auch die Suche nach Eintrittspforten für Erreger oder Infektionszeichen (Abb. 3). Aufgrund der fehlenden lokalen Entzündungsreaktion können einige Infektionszeichen atypisch imponieren. Selbst schwere infektiöse Krankheitsbilder wie eine Pneumonie, eine Peritonitis oder tiefe Weichteilinfektionen können ohne typische Untersuchungsbefunde wie Abwehrspannung oder Rötung und Überwärmung ablaufen. Wichtig ist insbesondere, auf die klinischen Warnzeichen einer Sepsis zu achten (Abb. 3).
Weiterführende Untersuchungen
Entsprechend den klinischen Befunden können weiterführende Untersuchungen indiziert sein, wie z. B. eine Bildgebung mithilfe der Sonographie bei Verdacht auf einen Pleuraerguss oder ein Röntgen des Thorax, besser eine Computertomographie, bei Verdacht auf ein infektiöses Geschehen in der Lunge. Weiterführende Untersuchungen sollen erst nach Beginn der empirischen antibiotischen Therapie durchgeführt werden.
Laborchemische Untersuchungen und Blutkultur
Gemäß den aktuellen Leitlinien sollen bei kinderonkologischen Patienten mit Fieber und Granulozytopenie ein Blutbild erstellt und Blutproben zur Kultivierung entnommen werden sowie weitere laborchemische Untersuchungen wie zentralvenöse Blutgasanalyse, Bestimmungen der Elektrolyte, Leberwerte, Entzündungs- und Gerinnungsparameter erfolgen. Bisher wurde kein Entzündungsparameter (z. B. C‑reaktives Protein, Prokalzitonin, Interleukin[IL]-6, IL-8) identifiziert, der in der akuten Situation von eigenständiger klinischer Relevanz ist. Die erste Dosis der antibiotischen Therapie darf durch das Abwarten der Laborergebnisse nicht verzögert werden [4].
Probenentnahmen oder ausstehende Laborbefunde dürfen die Antibiotikabehandlung nicht verzögern
Die Blutkulturproben sind immer vor der ersten Antibiotikagabe zu entnehmen, wobei jedoch die Behandlung nicht verzögert werden darf. Bei Vorhandensein eines Zentralvenenkatheters (ZVK) erfolgt die Blutentnahme aus jedem einzelnen Schenkel getrennt, da jedes Katheterlumen Quelle der Bakteriämie sein kann [7]. Entscheidend hinsichtlich der Sensitivität einer Blutkultur ist, dass die Kulturflaschen ausreichend gefüllt werden, wobei die Angaben des Herstellers beachtet werden müssen [17]. Weiterführende mikrobielle Untersuchungen wie Rachenabstrich, Urin- oder Stuhluntersuchung richten sich nach der Symptomatik und werden nicht routinemäßig durchgeführt. Hiervon ausgenommen sind mikrobiologische Routineabstriche nach lokalem Standard (wie z. B. „severe acute respiratory syndrome coronavirus 2“, SARS-CoV-2).
Initiale empirische Therapie
Bei granulozytopenischen Patienten mit Fieber oder anderen Zeichen bzw. Symptomen, die auf eine Infektion hinweisen können, soll die initiale empirische antibiotische Therapie ohne das Abwarten der mikrobiologischen Ergebnisse innerhalb von 60 min nach Klinikvorstellung („time to antibiotic treatment“, TTA) erfolgen (Abb. 2; [16]). Dabei sollte der konkrete Ablauf von der ersten telefonischen Ankündigung des fiebernden Patienten bis zur ersten Gabe des Antibiotikums für jede Klinik in einem internen Standard definiert werden [17]. Bei der Wahl des Antibiotikaregimes muss neben patientenspezifischen Faktoren, wie z. B. der klinische Zustand, Komorbiditäten, Allergien oder vorangegangene Infektionen, auch die lokale Resistenzlage von invasiven Erregern beachtet werden [2, 10].
Die initiale empirische Antibiotikatherapie soll innerhalb von 60 min nach Klinikvorstellung erfolgen
Entsprechend den kürzlich erschienenen internationalen kinderspezifischen Leitlinien zur antibakteriellen Therapie bei Kindern mit Fieber während der Granulozytopenie sollte als empirische Initialtherapie für klinisch stabile Patienten mit einem geringen Risiko für eine Infektion durch multiresistente Erreger eine antibakterielle Monotherapie verabreicht werden [9]. Hierfür werden Piperacillin-Tazobactam, Ceftazidim oder Cefepim empfohlen. Carbapeneme sollen als Reservetherapeutika initial nicht eingesetzt werden, sie sind aber bei Patienten mit Zeichen einer Sepsis Mittel der ersten Wahl (Deeskalationstherapie bei Sepsis, z. B. Start mit Meropenem, Amikacin, Teicoplanin ± Caspofungin). Bei Patienten, die mit resistenten gramnegativen Bakterien besiedelt sind, durch diese Keime bereits eine Infektion erlitten haben oder in Zentren mit einer hohen Resistenzrate (z. B. von Escherichia coli gegen Piperacillin-Tazobactam oder von Pseudomonas aeruginosa gegen Ceftazidim) behandelt werden, sollte die initiale empirische Therapie entsprechend angepasst werden [9]. Hier kann es in der Praxis sehr hilfreich sein, dies vorab zu entscheiden und in der Patientenkurve zu hinterlegen.
Management im Verlauf
Der klinische Zustand von Patienten mit Fieber während der Granulozytopenie muss nach Beginn der empirischen Antibiotikatherapie kontinuierlich beobachtet und bei jeder Verschlechterung reevaluiert werden (Abb. 3). Eine Modifikation des initialen Antibiotikaregimes ist z. B. notwendig, wenn sich der klinische Zustand verschlechtert oder sich neue Symptome einer lokalen Infektion zeigen. Persistierendes Fieber ohne klinische Verschlechterung allein ist kein Grund, das antibiotische Regime zu modifizieren [10].
Strategien der antibiotischen Deeskalation
Bei Patienten in stabilem klinischen Zustand, bei denen keine Infektion mit einem gegen die empirische Therapie resistenten Erreger nachgewiesen wurde, sind folgende Szenarien denkbar:
Bei Patienten mit einer mikrobiologisch dokumentierten Infektion sollte erwogen werden, die initial breite empirische Therapie unter Berücksichtigung des Resistenzprofils des Erregers zu deeskalieren [15].
Wurde weder ein Erreger noch ein klinischer Infektionsfokus nachgewiesen, bestehen verschiedene Deeskalationsmöglichkeiten der antibiotischen Therapie, wie z. B. eine Weiterbehandlung im ambulanten Setting, ein Wechsel auf orale Antibiotika oder aber auch die Beendigung der antibiotischen Therapie nach einer Mindestbehandlungsdauer von 72 h.
Die Anwendung der jeweiligen Strategien wurde in prospektiven Studien bei Patienten mithilfe unterschiedlicher Risikovorhersagemodelle geprüft, von denen jedoch bisher keines universell anwendbar ist [12, 14]. Deshalb obliegt es bislang dem jeweiligen Zentrum, eigene Überlegungen zu einem risikoadaptierten Vorgehen zu entwickeln, in das auch die ambulante Infrastruktur eingeht (z. B. Entfernung zwischen Wohnort und Klinik, Vorhandensein eines spezialisierten ambulanten Pflegedienstes usw.; [9]). Bei Patienten, die initial in stabilem klinischen Zustand waren, 72 h nach Beginn der i.v.-Antibiotika-Therapie keine klinisch oder mikrobiologisch dokumentierte Infektion aufweisen und für mindestens 24 h fieberfrei waren, kann unabhängig von einer hämatologischen Regeneration eine Beendigung der antibiotischen Therapie in Betracht gezogen werden. Dies gilt insbesondere dann, wenn eine Erholung des Blutbilds in den nächsten Tagen zu erwarten ist und einer Entlassung keine anderen Aspekte (z. B. Mukositis) entgegenstehen [9]. Handelt es sich um Patienten, bei denen die Granulozytopenie voraussichtlich noch länger als 7 Tage andauern wird, ist eine individuelle ärztliche Risikoanalyse auch im Hinblick auf die Notwendigkeit einer weiteren stationären Überwachung zielführend.
Antibiotikarefraktäres Fieber oft erstes Zeichen einer Pizlinfektion
Patienten mit einer protrahierten Granulozytopenie (Granulozytenzahl < 0,5 · 109/l und Dauer der Granulozytopenie ≥ 10 Tage; Tab. 1) haben ein hohes Risiko für invasive Pilzinfektionen [6]. Hierzu gehören insbesondere Patienten mit einer AML, einem Rezidiv einer akuten Leukämie oder Patienten nach allogener hämatopoetischer Stammzelltransplantation [6]. Falls diese Patienten trotz einer adäquaten antibiotischen Therapie nach 96 h noch fiebern, muss an eine Pilzinfektion gedacht werden. Da weitere Symptome einer Pilzinfektion oft fehlen und auch die Bestimmung der Labormarker und die Bildgebung gerade in der Frühphase einer invasiven Pilzinfektion unauffällige Befunde ergeben, soll bei diesen Patienten zu diesem Zeitpunkt eine empirische antimykotische Therapie begonnen werden [8, 10]. Hierfür eignen sich liposomales Amphotericin oder Caspofungin, die beide für diese Indikation bei pädiatrischen Patienten aller Altersgruppen zugelassen sind. Trotz Beginn einer empirischen antimykotischen Therapie sollten insbesondere bei pulmonalen Symptomen eine weitere Diagnostik wie Computertomographie der Lunge, ggf. eine Bildgebung der Nasennebenhöhlen und die Bestimmung von Biomarkern (wie dem Galaktomannanantigentest im Serum oder, bei pulmonalen Infiltraten, in der bronchoalveolären Lavage) durchgeführt werden. Falls sich hier Hinweise auf einen ursächlichen Erreger zeigen, sollte eine Modifikation der antimykotischen Therapie überdacht werden. So ist z. B. bei Hinweisen auf eine pulmonale Aspergillose (typische Lungeninfiltrate und positiver Befund im Galaktomannanantigentest) Voriconazol (in Verbindung mit Spiegelkontrollen) Mittel der ersten Wahl [8]. Während die empirische antimykotische Therapie bei hämatopoetischer Regeneration und Entfieberung beendet werden kann, wird die Therapie einer invasiven Pilzinfektion bis zur Normalisierung aller klinischen Symptome und aller bildgebenden Hinweise auf eine aktive Infektion fortgeführt wird [8].
Fazit für die Praxis
Fieber während der Granulozytopenie ist ein häufiger Notfall im Rahmen der onkologischen Therapie.
Entsprechend aktuellen pädiatrischen Leitlinien soll die erste Antibiotikagabe mithilfe standardisierter Verfahren in der Notfallversorgung innerhalb von 60 min nach Klinikvorstellung verabreicht werden.
Anpassung und Deeskalation der Therapie erfolgen entsprechend den klinischen Zeichen und der Diagnostik.
Acknowledgments
Danksagung
Dieser Beitrag ist in freundschaftlicher Dankbarkeit Herrn Prof. Dr. Thomas Klingebiel zur Emeritierung gewidmet.
Einhaltung ethischer Richtlinien
Interessenkonflikt
K. Bochennek und A. Simon geben an, dass kein Interessenkonflikt besteht. T. Lehrnbecher erhielt Vortragshonorare von Astellas, Gilead Sciences, GSK, Merck/MSD und Pfizer, Honorare für Beratertätigkeiten von Astellas, Gilead Sciences, Merck/MSD, Mundipharma und Pfizer sowie Forschungsunterstützung von Gilead Sciences. H.-J. Laws erhielt Vortragshonorare und Reisekostenunterstützung von CSL Behring, Pfizer und Bayer sowie Honorare für Beratertätigkeiten von CSL Behring. A.H. Groll erhielt Vortragshonorare von Astellas, Basilea, F2G, Gilead Sciences, Merck/MSD und Pfizer, Honorare für Beratertätigkeiten von Amplyx, Astellas, Basilea, F2G, Gilead Sciences, Merck/MSD, Mundipharma und Pfizer sowie Forschungsunterstützung von Gilead Sciences, Merck/MSD und Pfizer.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes
Im Folgenden sind bei allen entsprechenden Bezeichnungen immer beide Geschlechter gemeint.
Literatur
- 1.Alali M, David MZ, Danziger-Isakov LA, Bartlett AH, Petty LA, Schwartz T, Pisano J. Association between depth of neutropenia and clinical outcomes in febrile pediatric cancer and/or patients undergoing hematopoietic stem-cell transplantation. Pediatr Infect Dis J. 2020;39:628–633. doi: 10.1097/INF.0000000000002641. [DOI] [PubMed] [Google Scholar]
- 2.Averbuch D, Orasch C, Cordonnier C, Livermore DM, Mikulska M, Viscoli C, Gyssens IC, Kern WV, Klyasova G, Marchetti O, Engelhard D, Akova M, ECIL4. EBMT. EORTC. ICHS. ESGICH/ESCMID. ELN European guidelines for empirical antibacterial therapy for febrile neutropenic patients in the era of growing resistance: summary of the 2011 4th European Conference on Infections in Leukemia. Haematologica. 2013;98:1826–1835. doi: 10.3324/haematol.2013.091025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Bochennek K, Hassler A, Perner C, Gilfert J, Schöning S, Klingebiel T, Reinhardt D, Creutzig U, Lehrnbecher T. Infectious complications in children with acute myeloid leukemia: decreased mortality in multicenter trial AML-BFM 2004. Blood Cancer J. 2016;6:e382. doi: 10.1038/bcj.2015.110. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cohen C, King A, Lin CP, Friedman GK, Monroe K, Kutny M. Protocol for reducing time to antibiotics in pediatric patients presenting to an emergency department with fever and neutropenia efficacy and barriers. Pediatr Emerg Care. 2016;32:739–745. doi: 10.1097/PEC.0000000000000362. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Creutzig U, Zimmermann M, Reinhardt D, Dworzak M, Stary J, Lehrnbecher T. Early deaths and treatment-related mortality in children undergoing therapy for acute myeloid leukemia: analysis of the multicenter clinical trials AML-BFM 93 and AML-BFM 98. J Clin Oncol. 2004;22:4384–4393. doi: 10.1200/JCO.2004.01.191. [DOI] [PubMed] [Google Scholar]
- 6.Fisher BT, Robinson PD, Lehrnbecher T, Steinbach WJ, Zaoutis TE, Phillips B, Sung L. Risk factors for invasive fungal disease in pediatric cancer and hematopoietic stem cell transplantation: a systematic review. J Pediatric Infect Dis Soc. 2018;7:191–198. doi: 10.1093/jpids/pix030. [DOI] [PubMed] [Google Scholar]
- 7.Gaur AH, Flynn PM, Heine DJ, Giannini MA, Shenep JL, Hayden RT. Diagnosis of catheter-related bloodstream infections among pediatric oncology patients lacking a peripheral culture, using differential time to detection. Pediatr Infect Dis J. 2005;24:445–449. doi: 10.1097/01.inf.0000160950.83583.7f. [DOI] [PubMed] [Google Scholar]
- 8.Groll AH, Pana D, Lanternier F, Mesini A, Ammann RA, Averbuch B, Castagnola E, Cesaro S, Engelhard D, Garcia-Vidal C, Kanerva J, Ritz N, Roilides E, Styczynski J, Warris A, Lehrnbecher T, Eighth European Conference on Infections in Leukaemia (ECIL-8) 2020 updated guidelines for diagnosis, prevention and treatment of invasive fungal diseases in paediatric patients with cancer or allogeneic haematopoietic cell transplantation. Lancet Oncol. Im Druck [DOI] [PubMed]
- 9.Lehrnbecher T, Averbuch D, Castagnola E, Cesaro S, Ammann RA, Garcia-Vidal C, Kanerva J, Lanternier F, Mesini A, Mikulska M, Pana Z, Ritz N, Slavin M, Styczynski J, Warris A, Groll AH, Eighth European Conference on Infections in Leukaemia (ECIL-8) 2020 Guidelines for the Use of Antibiotics in Paediatric Patients with Cancer or Haematopoietic Cell Transplantation. Lancet Oncol. Im Druck [DOI] [PubMed]
- 10.Lehrnbecher T, Robinson P, Fisher B, Alexander S, Ammann RA, Beauchemin M, Carlesse F, Groll AH, Haeusler GM, Santolaya M, Steinbach WJ, Castagnola E, Davis BL, Dupuis LL, Gaur AH, Tissing WJE, Zaoutis T, Phillips R, Sung L. Guideline for the management of fever and neutropenia in children with cancer and hematopoietic stem-cell transplantation recipients: 2017 update. J Clin Oncol. 2017;35:2082–2094. doi: 10.1200/JCO.2016.71.7017. [DOI] [PubMed] [Google Scholar]
- 11.Lehrnbecher T, Varwig D, Kaiser J, Reinhardt D, Klingebiel T, Creutzig U. Infectious complications in pediatric acute myeloid leukemia: analysis of the prospective multi-institutional clinical trial AML-BFM 93. Leukemia. 2004;18:72–77. doi: 10.1038/sj.leu.2403188. [DOI] [PubMed] [Google Scholar]
- 12.Miedema KG, de Bont ES, Oude Nijhuis CS, van Vliet D, Kamps WA, Tissing WJ. Validation of a new risk assessment model for predicting adverse events in children with fever and chemotherapy-induced neutropenia. J Clin Oncol. 2011;29:e182–184. doi: 10.1200/JCO.2010.32.7767. [DOI] [PubMed] [Google Scholar]
- 13.Mikulska M, Cordonnier C. Fluoroquinolone prophylaxis during neutropenia: what can we expect nowadays? Clin Microbiol Infect. 2018;24:678–679. doi: 10.1016/j.cmi.2018.02.031. [DOI] [PubMed] [Google Scholar]
- 14.Phillips RS, Bhuller K, Sung L, Ammann RA, Tissing WJ, Lehrnbecher T, Stewart LA, Collaboration P. Risk stratification in febrile neutropenic episodes in adolescent/young adult patients with cancer. Eur J Cancer. 2016;64:101–106. doi: 10.1016/j.ejca.2016.05.027. [DOI] [PubMed] [Google Scholar]
- 15.Reinecke J, Lowas S, Snowden J, Neemann K. Blood stream infections and antibiotic utilization in pediatric leukemia patients with febrile neutropenia. J Pediatr Hematol Oncol. 2019;41:251–255. doi: 10.1097/MPH.0000000000001279. [DOI] [PubMed] [Google Scholar]
- 16.Salstrom JL, Coughlin RL, Pool K, Bojan M, Mediavilla C, Schwent W, Rannie M, Law D, Finnerty M, Hilden J. Pediatric patients who receive antibiotics for fever and neutropenia in less than 60 min have decreased intensive care needs. Pediatr Blood Cancer. 2015;62:807–815. doi: 10.1002/pbc.25435. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Simon A, Agyeman P, Ammann R, Attarbaschi A, Behrends U, Berger C, Groll A, Hamprecht A, Hufnagel M, Laws H-J, Lehrnbecher T, Scheler M, Simon A, Temme C. Diagnostik und Therapie bei Kindern mit onkologischer Grunderkrankung, Fieber und Granulozytopenie (mit febriler Neutropenie) außerhalb der allogenen Stammzelltransplantation. 2016. [Google Scholar]
- 18.Yang TO, Liu YL, Huang WT, Chen MH, Chen PC. Specific and non-specific clinical presentations in the year before the diagnosis of childhood leukaemia. Pediatr Blood Cancer. 2016;63:1387–1393. doi: 10.1002/pbc.26029. [DOI] [PubMed] [Google Scholar]