Abstract
Vitamin D wird aus der Nahrung aufgenommen oder in der Haut unter Einwirkung von UV-Licht gebildet. In der Leber wird 25(OH)-Vitamin D gebildet und in der Niere 1,25(OH)2-Vitamin D, welches als Hormon den Knochen- und Mineralstoffwechsel reguliert.
Außerhalb der Niere besitzen viele Organe Enzyme, um 1,25(OH)2-Vitamin D zu bilden für autokrine und parakrine Wirkungen. Für diese pleiotropen Effekte erscheint eine gleichmäßige Vitamin-D-Versorgung (tägliche Vitamin-D-Supplementation) mit mäßiger Dosierung besser wirksam als hoch dosierte Bolusapplikationen. Neben der klassischen Wirkung von 1,25(OH)2-Vitamin D auf das muskuloskelettale System sind unter den extraskelettalen Wirkungen insbesondere die immunregulatorischen Effekte mittlerweile sehr gut belegt. So kann durch eine gute Vitamin-D-Versorgung das Risiko für respiratorische Infekte vermindert werden, was gerade im Hinblick auf die aktuelle COVID-19(Coronavirus-Erkrankung-19)-Pandemie von Bedeutung erscheint.
Schlüsselwörter: Muskuloskelettales System, Autoimmunerkrankungen, Atemwegsinfekte, Vitamin-D-Supplementation, Diabetes mellitus
Abstract
Vitamin D is provided by nutritional sources or by skin synthesis under the influence of UV light. In the liver, vitamin D is converted to 25(OH)-vitamin D and finally in the kidney to 1,25(OH)2-vitamin D, which is a hormone regulating bone and mineral metabolism.
Besides the kidneys, other organs are also capable of making 1,25(OH)2-vitamin D, which exerts autocrine and paracrine effects. For these pleiotropic effects, a continuous vitamin D supply (daily supplements) with moderate doses is more effective than high-dose bolus applications. Beside the classical effects of 1,25(OH)2-vitamin D on the musculoskeletal system, there is good evidence for extraskeletal effects on the immune system. A good vitamin D supply can reduce the risk of respiratory infections. At the present time, the preventive and therapeutic use of vitamin D regarding COVID-19 (coronavirus disease 19) is of great interest.
Keywords: Musculoskeletal system, Autoimmune disease, Respiratory infects, Vitamin D-supplementation, Diabetes mellitus
Vitamin D hat in den letzten 10 Jahren ein erhebliches wissenschaftliches und öffentliches Interesse gefunden, was durch die enorme Zahl von Publikationen in der Fachliteratur, aber gerade auch in der Laienpresse belegt wird. Die Ursache dafür ist, dass Vitamin D offensichtlich nicht nur an der Regulation des Mineralstoffwechsels beteiligt ist und für die Therapie spezieller Erkrankungen wie Osteomalazie eingesetzt wird, sondern auch Wirkungen in fast allen Organsystemen hat und somit ein präventiver oder sogar therapeutischer Effekt bei vielen Erkrankungen, die nicht das Skelettsystem betreffen, vermutet wird.
Die präventive Supplementation oder auch Therapie mit Vitamin D wird deshalb bei Autoimmunerkrankungen, kardiovaskulären Erkrankungen, Diabetes mellitus, Infertilität bis hin zu Krebserkrankungen empfohlen. Dabei werden teils sehr hohe Dosierungen von Vitamin D eingesetzt. In letzter Zeit hat allerdings eine gewisse Ernüchterung stattgefunden, nachdem größere kontrollierte Studien die postulierten klinischen Wirkungen von Vitamin D nicht belegen konnten. Auch zeigte sich, dass eine hoch dosierte Vitamin-D-Gabe, insbesondere in Form einer Bolus- oder Stoßtherapie, auch schädliche und unerwünschte Effekte haben kann. Aktuell erlebt das Thema Vitamin D wieder eine erhöhte Aufmerksamkeit, weil es Hinweise gibt, dass Vitamin D möglicherweise einen gewissen Schutzeffekt bei COVID-19-Erkrankungen bieten könnte. Dies ist Anlass, im Folgenden die pleiotropen Wirkungen von Vitamin D insbesondere aus klinischer Sicht zu betrachten.
Stoffwechsel von Vitamin D
Vitamin D wird entweder mit der Nahrung aufgenommen (fettige Fische, Eier, Pilze) oder in der Haut unter Einfluss von UV-Licht synthetisiert. Er gibt im Wesentlichen 2 Formen von Vitamin D: Vitamin D2 aus pflanzlichen Quellen (oder aus einigen Nahrungsergänzungsmitteln) und Vitamin D3, das aus tierischen Quellen oder der Eigensynthese stammt. Die biologische Wirkung ist sehr ähnlich, sodass im Folgenden diesbezüglich nicht differenziert wird. Über die Blutbahn gelangt Vitamin D in die Leber, wo es zu 25-OH-Vitamin D (25-Hydroxy-Vitamin D) umgewandelt wird. Die Bildung von 25-OH-Vitamin D ist substratgetrieben, sodass es sehr gut die Vitamin-D-Versorgung repräsentiert sowie die Speicherform von Vitamin D darstellt. Aus diesem Grund wird die Messung des 25-OH-Vitamin D für die Einschätzung der Vitamin-D-Versorgung eingesetzt. Über die Zirkulation gelangt 25-OH-Vitamin D in die Niere, wo es in einem streng kontrollierten Schritt zu 1,25-Dihydroxy-Vitamin D (1,25-[OH]2 D) umgewandelt wird. Das dafür verantwortliche Enzym, die 1α-Hydroxylase, steht unter Kontrolle der Serumkonzentration von Calcium und einer Reihe von Hormonen (Parathormon, Östradiol, FGF-23 [fibroblast growth factor 23] u. a.). Das 1,25-(OH)2 D ist ein klassisches Hormon und reguliert die Calciumhomöostase über die Stimulation der intestinalen Calciumabsorption und der renalen Calcium-Rückresorption sowie über die Regulation des Knochenstoffwechsels (Anbau und Abbau) und über die negative Rückkopplung auf die Nebenschilddrüsen (Hemmung der Parathormonsekretion) [1]. Neben dieser klassischen endokrinen Funktion gibt es jedoch auch noch die autokrinen und parakrinen Wirkungen von Vitamin D. Sehr viele Organe bzw. Zellen verfügen über eine eigene 1‑α-Hydroxylase und nukleäre Vitamin-D-Rezeptoren und können sich aus dem zirkulierenden 25-OH-Vitamin D selbst das aktive 1,25-(OH)2 D herstellen. Deshalb ist ein ausreichend hoher Spiegel von 25-OH-Vitamin D für die extraskelettalen Wirkungen von Vitamin D sehr wichtig. Dies kann die vielfach gefundenen statistischen Korrelationen zwischen der Serumkonzentration von 25-OH-Vitamin D und Organfunktionen bzw. Krankheitssymptomen erklären.
Neuere Untersuchungen weisen jedoch darauf hin, dass die Regulation der Serumkonzentrationen von Vitamin D, 25-OH-Vitamin D, und 1,25-(OH)2 D eine sehr komplexe Angelegenheit ist [2]. Für die Bioverfügbarkeit der Vitamin-D-Metaboliten ist das Vitamin-D-Bindungsprotein (VDBP) von großer Bedeutung. Die Affinität von 25-OH-Vitamin D zum VDBP ist erheblich größer als diejenige von Vitamin D und das 25-OH-Vitamin D steht nur zu einem sehr geringen Anteil als freie Form zur Verfügung. Die unterschiedliche Affinität zum VDBP bedingt auch die unterschiedlichen Halbwertszeiten in der Zirkulation: Die Halbwertszeit von 25-OH-Vitamin D beträgt Wochen, während diejenige von Vitamin D nur einen Tag beträgt. Ein bisher zu wenig beachteter Aspekt für die autokrine und parakrine Wirkung von Vitamin D betrifft die Verfügbarkeit von freiem Vitamin bzw. 25-OH-Vitamin D für die Diffusion von der Zirkulation in die Zellen. Während Niere, Nebenschilddrüse und Plazenta über einen Transportmechanismus verfügen (Endocytose mit Hilfe von Megalin und Cubilin) [3], um das 25-OH-Vitamin D aufzunehmen, sind andere Organe auf die einfache zelluläre Diffusion angewiesen. Wahrscheinlich ist für diese Zellen das verfügbare „Muttersubstrat“ Vitamin D von großer Bedeutung, da es weniger an VDBP gebunden ist als 25-OH-Vitamin D. Da viele Organe über eine eigene 25-Hydroxylase verfügen, kann die Verfügbarkeit (Serumkonzentration) von Vitamin D eine große Bedeutung für autokrine und parakrine Effekte haben. Unter Berücksichtigung der Wichtigkeit von Vitamin D als „Muttersubstrat“ und seiner kurzen Halbwertszeit von einem Tag erscheint es plausibel, dass die tägliche Einnahme kleinerer Mengen von Vitamin D wirksamer ist und andere Effekte hervorruft als die Verabreichung von größeren Mengen in Form eines Bolus in längeren Intervallen.
Wirkung von Vitamin D auf die Mineralhomöostase und den Knochen
1,25-Dihydroxy-Vitamin D (1,25-(OH)2D) hat in der Mineralhomöostase folgende Wirkungen:
Steigerung der intestinalen Calcium- und Phosphatabsorption,
Differenzierung von osteoblastären Zellen,
Stimulation der Knochenmatrixsynthese
Stimulation der Mineralisierung der Knochenmatrix.
Stimulation der FGF-23-Bildung in Osteozyten (Regulation Phosphatstoffwechsel).
Die Regulation des Knochenstoffwechsels ist ein aktiver, von 1,25-(OH)2 D gesteuerter Vorgang, der über die Bereitstellung von Mineralien hinausgeht. Durch das 1,25-(OH)2 D werden in den Knochenzellen (Osteozyten, Osteoblasten) eine Vielzahl von Genen reguliert, deren Produkte den Knochenstoffwechsel regulieren oder als systemische Hormone den Mineralstoffwechsel und andere endokrine Systeme beeinflussen [4]. Es stimuliert in Osteozyten die Freisetzung von FGF-23, das die renale Phosphatausscheidung steigert und im Sinne einer negativen Rückkopplung die renale 1α-Hydroxylase hemmt. In osteoblastären Zellen stimuliert 1,25-(OH)2 D die Expression der alkalischen Phosphatase und fördert somit die Mineralisierung mittels Spaltung des Pyrophosphats, welches ein Inhibitor der Mineralisierung ist.
Es steigert zudem die Bildung von Osteocalcin (Bestandteil der Knochenmatrix und Regulator der Mineralisierung), Osteopontin (Osteoblastenfunktion), LRP5 (low density lipoprotein receptor-related protein 5, welches die Stimulation des Wnt-Signalweges mit Steigerung der Osteoblastenproliferation bewirkt). Mittels Steigerung der Sekretion von IGF-Bindungsproteinen wird andererseits die Proliferation osteoblastärer Zellen vermindert und die Differenzierung gefördert [5].
Dosisabhängig hat 1,25-(OH)2 D aber auch katabole Effekte im Knochen. In hohen Dosierungen steigert 1,25-(OH)2 D die Knochenresorption. Diese Wirkung wird über die gesteigerte Bildung von RANKL vermittelt (RANK-Ligand ist ein Kopplungsfaktor, der von Osteoblasten gebildet wird und die Osteoklastenbildung und Knochenresorption steigert). Weiterhin unterdrückt 1,25-(OH)2 D die RUNX2-Expression und behindert somit die Osteoblastendifferenzierung ([4]; Abb. 1).
Wirkung von Vitamin D auf den Muskel
Das 1,25-(OH)2 D hat direkte Wirkung auf Muskelzellen. Ein Vitamin-D-Mangel, z. B. bei Osteomalazie oder Rachitis, führt zu einer ausgeprägten Muskelschwäche.
Muskelzellen besitzen den nukleären Vitamin-D-Rezeptor (VDR), daneben gibt es aber auch nichtgenomische Wirkungen über einen anzunehmenden Membranrezeptor, der über den MAP-Kinase- und PLC-Signalweg Effekte wie den raschen Eintritt von Calcium in die Zelle induziert. Über den klassischen VDR-vermittelten Weg wird eine Reihe von Genen reguliert, wie z. B. Calmodulin (Verbesserung der Kontraktion), „insulin-like growth factor 2“ (IGF‑2, Proliferation von Muskelfasern), Myogenin, Myostatin. Der therapeutische Einsatz von 1,25-(OH)2 D (= Calcitriol) führt zu einer Änderung der Muskelfaserzusammensetzung mit Zunahme der schnellen Typ-2-Fasern [6].
Wirkung von Vitamin D auf das Immunsystem
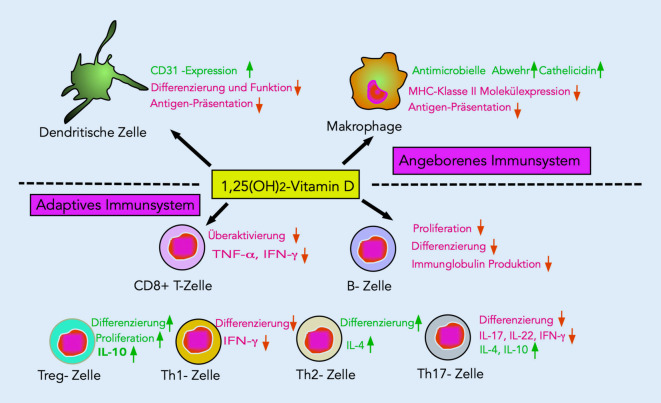
Immunkompetente Zellen (z. B. Makrophagen) verfügen über eine extrarenale 1α-Hydroxylase, sodass neben der Konzentration von 1,25-(OH)2 D auch die Verfügbarkeit von Vitamin D bzw. 25-OH-Vitamin D für die Immunkompetenz von Bedeutung ist. Im Sinne einer Rückkopplung hemmen Entzündungsmediatoren wie TNF‑α die Bildung des Hormons 1,25-(OH)2-D.
Vitamin D moduliert sowohl das angeborene, nichtadaptive, von dendritischen Zellen und Makrophagen bestimmte Immunsystem (Bildung von antimikrobiellen Peptiden, wie zum Beispiel Cathelicidin) als auch das adaptive, erworbene Immunsystem (T- und B‑Lymphozyten, Vermehrung von TH2-Zellen, Hemmung von proinflammatorischen TH17+-Zellen) ([7–9]; Abb. 2).
Die Interaktion von Vitamin D mit dem Immunsystem ist für die Rolle des Vitamin-D-Mangels als Risikofaktor für Infekte und Autoimmunerkrankungen von Bedeutung, worauf weiter unten eingegangen wird.
Vitamin D zur Therapie von muskuloskelettalen Erkrankungen
Der ausgeprägte Vitamin-D-Mangel führt bei Kindern zu Rachitis und bei Erwachsenen zu Osteomalazie. Beide Erkrankungen sind durch unzureichende Mineralisierung des Knochens, Knochenverbiegungen, Frakturen und Muskelschwäche charakterisiert. Labordiagnostisch fallen grenzgradig niedrige oder erniedrigte Konzentrationen von Calcium und Phosphat auf, eine erhöhte Aktivität der alkalischen Phosphatase und ein sekundärer Hyperparathyreoidismus. Das 25(OH)-Vitamin D ist erniedrigt, während das 1,25(OH)2 D oft noch normal ist (infolge der kompensatorisch erhöhten Aktivität der renalen 1α-Hydroxylase) [10].
Die Therapie mit Vitamin D führt zu einer raschen Heilung der Rachitis bzw. der Osteomalazie, wobei eine Kombination mit Calciumsupplementen zu empfehlen ist. Infolge der raschen Mineralisierung des Knochens und dortigen Ablagerung von Mineralien kann es ohne ausreichende Calciumzufuhr zu einer Hypocalciämie kommen (Hungry-bone-Phänomen) [11].
Im Gegensatz zur Osteomalazie ist die Studienlage für Vitamin D im Einsatz zum Erhalt der Skelettgesundheit insbesondere bei älteren Menschen oder als Begleittherapie bei Osteoporose nicht so eindeutig. Bevölkerungsbasierte Studien zeigten ein verbreitetes Vitamin-D-Defizit vor allem im Winter und eine Assoziation zwischen niedrigeren 25(OH)-Vitamin-D-Spiegeln und erhöhten Knochenabbaumarkern [12]. Grundlegende Studien hatten einen Effekt von Vitamin D auf die Verhinderung von peripheren Frakturen bei älteren Frauen [13] oder auf die Verminderung von Stürzen [14] gezeigt. Eine weitere bahnbrechende Studie zeigte für Vitamin D eine Verminderung der proximalen Femurfrakturen bei älteren Altersheimbewohnern [15], wobei ein relevanter Prozentsatz der Teilnehmer in dieser Studie auch eine Osteomalazie gehabt haben dürfte. Im Gefolge wurden eine Vielzahl von Interventionsstudien publiziert, die teils kontroverse Ergebnisse erbrachten [16]. Erst kürzlich wurde eine Studie zur Sturzrate bei älteren Menschen publiziert, die keinen Nutzen einer Dosierung von 1000 IE Vitamin D tgl. im Vergleich zu einer niedrigen Dosierung (200 IE) gesehen hat und für höhere Dosierungen sogar schädliche Effekte fand [17]. Die unterschiedlichen Studienergebnisse sind durch unterschiedliche Studienpopulationen, unterschiedliches Ausmaß eines vorbestehenden Vitamin-D-Mangels, unterschiedliche Versorgung mit Calcium und durch unterschiedliche Dosierungsschemata zu erklären. Insbesondere eine hoch dosierte Bolustherapie mit Vitamin D kann paradoxerweise zu vermehrten Stürzen und Frakturen führen [18–21]. Wenn man diese Studien mit Bolustherapie ausschließt, dann zeigt eine neuere Metaanalyse von Bischoff-Ferrari für eine Dosierung von 800 bis 1000 IE Vitamin D täglich eine Reduktion des Sturzrisikos um 12 % und des Frakturrisikos um 14 % [22]. Möglicherweise kann der Effekt von Vitamin D durch die zusätzliche Gabe von Calcium gesteigert werden ([23]; Tab. 1).
| 800 bis 2000 IE/Tag oral | Leichter bis mäßiger Vitamin-D-Mangel bei Osteoporose |
|
Für 4–6 Wochen 5000 bis 7000 IE/Tag oder 40.000 IE/Woche; nach 4–6 Wochen 20.000 IE/Woche im Weiteren Dosierung nach Laborparametern einstellen (Calcium, alkalische Phosphatase, Parathormon, 25-Hydroxy-Vitamin D) Erhaltungsdosis z. B.1000 bis 2000 IE/Tag |
Osteomalazie |
|
10.000 IE/alle 4 Wochen i.m. oder 100.000 IE alle 3 Monate i.m. |
Malabsorption |
| 0,5–1,0 µg 1,25-Dihydroxy-Vitamin D (Calcitriol)/Tag | Eingeschränkte Nierenfunktion |
Vitamin D und kardiovaskuläres System
Vitamin D kann das Gefäßsystem über Matrixproteine in der Gefäßwand und über immunologische Prozesse beeinflussen. Ein weiterer Faktor ist die Hemmung des Renin-Angiotensin-Systems und eine Senkung des Blutdrucks.
Zahlreiche epidemiologische Studien und Metaanalysen weisen auf eine Assoziation zwischen niedrigem Vitamin-D-Status und erhöhtem kardiovaskulärem Risiko hin [24, 25].
Interventionsstudien zeigten aber keinen Effekt einer Vitamin-D-Therapie auf klinische Endpunkte bei kardiovaskulären Patienten [26, 27].
Insbesondere eine groß angelegte Studie mit über 25.000 Teilnehmern (> 50 Jahre), die über 6 Jahre mit 2000 IE Vitamin D3 täglich (versus Placebo) behandelt wurden, fand keinen Unterschied hinsichtlich kardiovaskulärer Endpunkten [28].
Vitamin D und rheumatoide Arthritis
Zahlreiche, aber nicht alle Studien fanden bei Patienten mit rheumatoider Arthritis verringerte Spiegel von 25(OH)-Vitamin D. Auch scheinen niedrigere 25(OH)-Vitamin-D-Spiegel mit einer höheren Entzündungsaktivität einherzugehen [29]. Aufgrund der immunmodulatorischen Rolle von Vitamin D erscheint es plausibel, dass Vitamin-D-Mangel das Risiko für das Auftreten einer rheumatoiden Arthritis erhöht [30]. Dabei spielt die hemmende Wirkung von 1,25(OH)2 D auf die Bildung von Tumornekrosefaktor‑α (TNF-α) eine wichtige Rolle, da dieser für die Pathogenese der rheumatoiden Arthritis von großer Bedeutung ist. Darüber hinaus kann TNF‑α die Aktivität der 1α‑Hydroxylase vermindern, sodass bei hoher Entzündungsaktivität ein Mangel an 1,25(OH)2 D auftritt. In einer klinischen Untersuchung konnte für 1α-Hydroxy-Vitamin D (Alfacalcidol) bei Patienten mit rheumatoider Arthritis eine Absenkung der TNF-α-Konzentration im Serum, eine Verminderung der Gelenkschmerzen und eine Verbesserung der Muskelfunktion gezeigt werden [31].
Vitamin D und multiple Sklerose
Vitamin D konnte in hohen Dosierungen (im Rahmen einer pharmakologischen Behandlung) Symptome der multiplen Sklerose verbessern [32].
Eine Metaanalyse der Cochrane Collaboration fand jedoch eine schwache Evidenz dafür, dass Vitamin D keinen Effekt auf den Verlauf der multiplen Sklerose hat [33].
Die Auswertung von 2 großen klinischen Studien (SOLAR und CHOLINE) ergab keinen eindeutigen Nachweis für die Wirkung einer hoch dosierten Vitamin-D-Therapie (14.000 IE Vitamin D3 täglich in der SOLAR-Studie): Die primären klinischen Endpunkte wurden verfehlt. Allerdings zeigte sich ein moderater Effekt auf sekundäre Endpunkte, wie z. B. Progression von im MRT nachweisbaren Läsionen. Es wird empfohlen, dass ein Vitamin-D-Mangel bei Patienten mit multipler Sklerose vermieden werden sollte [34].
Vitamin D und Diabetes mellitus Typ 1
Da Patienten mit Diabetes mellitus Typ 1 häufig einen Vitamin-D-Mangel aufweisen, wurde wegen der immunregulatorischen Effekte von Vitamin D postuliert, dass Vitamin-D-Mangel an der Entstehung eines Diabetes mellitus Typ 1 beteiligt ist.
Im Tierexperiment konnte die Behandlung mit 1,25-Dihydroxy-Vitamin D die Entstehung einer Insulitis und die Entwicklung eines autoimmuninduzierten Diabetes mellitus verhindern [35, 36]. In höheren Dosierungen führt 1,25-Dihydroxy-Vitamin D jedoch zur Hypercalcämie. Deshalb wurde auch natives Vitamin D in Tierexperimenten verwendet und es wurde ein präventiver Effekt in NOD-Mäusen gefunden [37].
Auch beim Menschen gibt es eine Assoziation zwischen Vitamin-D-Mangel, Mangel an Sonnenlichtexposition (geografischer Breitengrad) und der Prävalenz von Diabetes mellitus Typ 1 [38, 39]. Niedrige Serumkonzentrationen von 25(OH)-Vitamin D sind in zahlreichen Beobachtungsstudien mit dem Auftreten von Diabetes mellitus Typ 1 assoziiert gewesen [7], was aber noch keine kausale Beziehung beweist. In einer Fallkontrollstudie war niedriges 25(OH)-Vitamin D bei amerikanischem Militärpersonal mit einer höheren Diabetesinzidenz assoziiert [40], aber andere Autoren fanden keinen Zusammenhang zwischen Vitamin-D-Status und dem Auftreten von Diabetes mellitus Typ 1 [41, 42].
Kontrollierte Interventionsstudien zeigten bei Kindern einen präventiven Effekt von Vitamin-D-Supplementation und/oder Nahrungsergänzung mit Fischöl hinsichtlich der Manifestation eines Diabetes Typ 1 [7]. Bei Patienten mit neu diagnostiziertem Diabetes mellitus Typ 1 hatte die tägliche Behandlung mit Vitamin D3 (2000 IE/Tag) einen nachweisbaren Effekt auf die regulatorischen T‑Zellen und konnte die Restfunktion der Inselzellen erhalten (evaluiert an der C‑Peptid-Sekretion) [43]. Effekte von Vitamin D auf T‑Zellen wurden auch durch andere Arbeiten bestätigt [44, 45]. In einer randomisierten placebokontrollierten Studie mit Cross-over-Design führte die Therapie mit 4000 IE Vitamin D3 täglich bei Männern zu einem Anstieg der regulatorischen T‑Zellen und bei allen Teilnehmern zu einer Abnahme des Insulinbedarfs und zu einer Verbesserung des HBA1c-Wertes [46], allerdings war die Beobachtung auf 3 Monate begrenzt. Ein positiver Effekt der täglichen Vitamin-D3-Therapie (Dosierungen zwischen 400 und 6000 IE/Tag) auf die residuale Betazellfunktion wurde vor allem bei Kindern mit neu entdecktem Diabetes mellitus Typ 1 (Krankheitsdauer bis 2 Jahre) gefunden [47–49]. Andere Studien mit Vitamin D in hoch dosierter Bolusform und bei Patienten, die schon länger an Diabetes mellitus Typ 1 erkrankt waren, fanden jedoch keine Wirkung [50–52].
Wegen hypercalcämischen Nebenwirkungen konnte 1,25-(OH)2 D (1,25-Dihydroxy-Vitamin D = Calcitriol) nur in geringer Dosierung eingesetzt werden und zeigte keine Effekte auf die Diabetesprävention [53–55].
Hingegen konnte bei Erwachsenen mit latentem autoimmuninduzierten Diabetes mellitus (LADA) für das Prohormon 1α-Hydroxy-Vitamin D (Alfacalcidol, 0,5 µg/Tag) ein protektiver Effekt gezeigt werden [56], ebenso bei Kindern [57].
Vitamin D und Diabetes mellitus Typ 2
Patienten mit Diabetes mellitus Typ 2 haben häufig einen Vitamin-D-Mangel [58]. Obgleich der Diabetes mellitus Typ 2 keine Autoimmunerkrankung darstellt, kann Vitamin D über eine Verbesserung der Insulinsekretion oder auch indirekt über die Steigerung der Osteocalcinspiegel den Stoffwechsel verbessern [59]. So wurde bei Diabetes mellitus Typ 2 in Assoziationsstudien ein Zusammenhang zwischen Vitamin-D-Mangel und Erkrankungsrisiko gefunden. Kleinere kontrollierte Interventionsstudien konnten für Vitamin D eine Verbesserung der Insulinresistenz zeigen. Die Effekte von Vitamin D auf den klinischen Verlauf sind jedoch gering. So konnte eine Metaanalyse aus dem Jahr 2018 bei der Auswertung von Interventionsstudien keinen Effekt von Vitamin D auf die Nüchtern-Glukosespiegel, Nüchtern-Insulinspiegel oder den HBA1c-Wert nachweisen. Allerdings konnte Vitamin D die Insulinresistenz verbessern [60].
Eine große Studie über 2 Jahre mit relativ hoher Vitamin-D-Dosis von 4000 IE/Tag konnte bei Patienten mit Prädiabetes für die Progression in einen manifesten Diabetes mellitus Typ 2 keinen protektiven Effekt von Vitamin D nachweisen (Hazard Ratio für Vitamin D 0,88 mit p = 0,12) [61].
Vitamin D und Autoimmunerkrankungen der Schilddrüse
Einige, aber nicht alle Studien fanden eine Assoziation zwischen Vitamin-D-Mangel und höherer Krankheitsaktivität bei Autoimmunthyreoiditis (M. Basedow und Hashimoto-Thyreoiditis). Kontrollierte Interventionsstudien konnten einen Effekt der Vitamin-D-Behandlung (1000 bis 4000 IE Vitamin D täglich) auf eine Absenkung der Autoantikörper nachweisen [62–64]. Die klinische Relevanz ist jedoch unklar.
Vitamin D und Krebs
Vitamin D hat antiproliferative Effekte. Die Wirkung von Vitamin D auf Krebserkrankungen ist komplex und die Studienergebnisse sind uneinheitlich [65]. Im Rahmen dieses Artikels kann auf die umfangreiche Studienlage nicht näher eingegangen werden.
Vitamin D in der Reproduktionsmedizin
Die Vitamin-D-Versorgung spielt in der reproduktiven Funktion (Ovar, Endometrium) eine wichtige Rolle. Allerdings sind die klinischen Daten zur Vitamin-D-Supplementation widersprüchlich und erlauben keine klare Empfehlung bei Kinderwunsch. Eine Supplementation mit ca. 1000 IE Vitamin D erscheint jedoch vernünftig [66].
Vitamin D und Atemwegsinfektionen
Vitamin D verbessert die angeborene Immunabwehr, wobei im Hinblick auf die Abwehr von bakteriellen Infektionen die Stimulation von Chemotaxis, Phagozytose, Bildung von Cathelicidin und Defensin in Makrophagen von Bedeutung sind [8]. Eine Supplementation mit Vitamin D wirkt auch bei der Behandlung der Tuberkulose unterstützend [67]. Ein systematischer Review von 11 placebokontrollierten Studien zeigte für Vitamin D einen protektiven Effekt gegen Atemwegsinfektion mit einer Odds Ratio von 0,64 (95-%-Intervall 0,49–0,84) [68]. Eine neuere Metaanalyse bestätigte den Schutzeffekt von Vitamin D, wobei der Effekt bei täglicher oder wöchentlicher Gabe besser war als bei Bolusapplikation. Auch war die Wirkung von Vitamin D besser, wenn die Studienpopulation niedrige Ausgangswerte von 25(OH)-Vitamin D (< 25 nmol/l) aufwies [69].
Eine kürzlich veröffentlichte australische Studie, die keinen Effekt von Vitamin D auf Atemwegsinfekte nachweisen konnte, stellt keine Widerlegung des Schutzeffektes dar, weil in dieser Studie monatliche Bolusdosen (60.000 IE Vitamin D) verwendet wurden und die Studienpopulation im Durchschnitt keinen Vitamin-D-Mangel aufwies [70].
Bei Patienten mit COPD konnte Vitamin D das Risiko von Exazerbationen vermindern [71].
Vitamin D und SARS-CoV-2 (COVID-19)
Ein Schutzeffekt von Vitamin D gegen respiratorische Virusinfekte wurde schon vor einigen Jahren nachgewiesen. So konnte in einer kontrollierten Studie für eine Dosierung von 1200 IE Vitamin D täglich eine Verminderung der Infekte mit Influenza A bei japanischen Schulkindern um ca. 40 % nachgewiesen werden [72]. Auch wurde früher schon beschrieben, dass Vitamin D die Immunantwort auf respiratorische Virusinfekte moduliert [73]. Im Hinblick auf COVID-19 erscheint insbesondere die Hemmung der Bildung von Interleukin 6 (Blockade des Zytokinsturms), die Neuroprotektion mit Stimulation der Bildung von Neurotrophin, „nerve growth factor“ (Verhinderung von Riechstörungen) und Interaktion mit ACE2 („angiotensin-converting enzyme 2“, beteiligt beim Viruseintritt) von Bedeutung zu sein ([74, 75]; Abb. 3).
In einer populationsbasierten Studie waren niedrige Plasma-25(OH)-Vitamin-D-Spiegel mit einem erhöhten Risiko für eine COVID-19-Infektion assoziiert [76]. Hospitalisierte Patienten mit SARS-CoV‑2 wiesen in einer spanischen Studie im Vergleich zu Kontrollpersonen häufig einen Vitamin-D-Mangel auf, ohne dass eine Beziehung zwischen Ausmaß des Vitamin-D-Mangels und der Schwere des Krankheitsverlaufes erkennbar war [77]. Die hohe Prävalenz eines Vitamin-D-Mangels bei stationär behandelten Patienten mit COVID-19 wurde durch weitere Studien bestätigt [78]. Panagiotou und Mitarbeiter fanden bei stationären Patienten mit COVID-19, dass niedrige Serumkonzentrationen von 25(OH)-Vitamin D mit einer höheren Krankheitsaktivität einhergingen [79]. In einer griechischen Studie waren niedrige 25(OH)-Vitamin-D-Spiegel zum Zeitpunkt der Aufnahme auf die Intensivstation bei Patienten mit COVID-19-Pneumonie mit einem höheren Mortalitätsrisiko assoziiert [80]. Damit in Übereinstimmung wurde auch in einer türkischen Beobachtungsstudie ein Einfluss von 25(OH)-Vitamin D auf die Mortalität von Patienten mit COVID-19 gesehen [81]. In einer iranischen retrospektiven Studie waren höhere 25(OH)-Vitamin-D-Spiegel mit einer niedrigeren Mortalität und einer geringeren Lungenbeteiligung assoziiert [82]. In einer englischen Studie wiesen Patienten mit COVID-19 auf der Intensivstation häufiger einen Vitamin-D-Mangel auf als Patienten auf Normalstation und Vitamin-D-Mangel war mit höherer Viruslast assoziiert. Es bestand jedoch kein Zusammenhang zwischen Vitamin-D-Status und klinischem Verlauf auf der Intensivstation [83]. In einer Datenbankanalyse aus dem Vereinigten Königreich wurde untersucht, ob die niedrigeren 25(OH)-Vitamin-D-Konzentrationen für die erhöhte Mortalität bei ethnischen Minderheiten („blacks“, „south asians“) verantwortlich sei. Nach Korrektur für Einflussfaktoren wie Ethnie, Geschlecht, Jahreszeit, Wohnquartiere, Haushaltseinkommen, Rauchen, BMI, Diabetes, Behinderung war der Einfluss von 25(OH)-Vitamin D auf COVID-19-Infektionen nicht mehr signifikant. Die Autoren folgerten, dass ihre Studienergebnisse keinen Einfluss von Vitamin D auf das Risiko für COVID-19 belegen konnten und dass die 25(OH)-Vitamin-D-Spiegel nicht die ethnischen Unterschiede bei COVID-19-Infektionen erklären können [84].
Dagegen war in einer deutschen Untersuchung ein niedriger 25(OH)-Vitamin-D-Spiegel (< 30 nmol/l) mit einem höheren Risiko für invasive Beatmung und Tod assoziiert, auch nach Adjustierung für Alter, Geschlecht und Begleiterkrankungen [85].
Um letztlich einen pathogenetischen Einfluss von Vitamin D auf COVID-19 beweisen zu können, wären kontrollierte Interventionsstudien notwendig. Aufgrund fehlender Finanzierung und aufgrund des erst kurz zurückliegenden erstmaligen Auftretens von COVID-19 sind solche Studien in größerem Umfang nicht zu erwarten.
Ohaegbulam und Mitarbeiter berichteten von 2 (!) Patienten, die von einer Vitamin-D-Gabe mit 50.000 IE/Tag über 5 Tage (im Vergleich zu 2 Patienten mit Standarddosis) klinisch profitiert hätten [86].
In einer quasi-experimentellen Studie mit 77 Teilnehmern hatte die Gruppe, die im Jahr vor der COVID-19-Diagnose eine Vitamin-D-Supplementation erhalten hatte, eine höhere Überlebenschance. Auch die Gruppe mit Vitamin-D-Supplementation nach Diagnosestellung hatte einen besseren Krankheitsverlauf [87]. In einer ähnlich angelegten quasi-experimentellen Studie zeigten Patienten (n = 57), die im Monat vor der COVID-19-Diagnose oder nach der Diagnose eine Bolussupplementation mit Vitamin D erhalten hatten, im Vergleich zur Kontrollgruppe ohne Supplementation (n = 9) eine höhere Überlebenswahrscheinlichkeit [88].
In einer kontrollierten Pilotstudie konnte hoch dosiertes 25(OH)-Vitamin D (Calcifediol) bei hospitalisierten Patienten (nachgewiesene Erkrankung mit PCR-Test und röntgenologisch nachgewiesener Pneumonie) das Risiko für eine intensivmedizinische Behandlung reduzieren. Die Dosierung betrug 0,532 mg (21.280 IE) orales 25(OH)-Vitamin D3 am Aufnahmetag und 0,266 mg (10.640 IE) an den Tagen 3 und 7 und dann wöchentlich. Alle Patienten erhielten die bestmögliche Behandlung. Nur einer von 50 Patienten unter 25(OH)-Vitamin-D-Therapie, aber 13 von 26 unbehandelten Patienten benötigten eine intensivmedizinische Behandlung [89]. In einer kontrollierten Studie bei 40 Patienten mit einer milden Verlaufsform von COVID-19 und prävalentem Vitamin-D-Mangel führte eine Behandlung mit 60.000 IE Vitamin D über 7 Tage (Ziel war ein Serum-25[OH]-Vitamin‑D von > 125 nmol/l) zu einer höheren Rate an Patienten, die SARS-CoV-2-RNA-negativ wurden. Außerdem wurde Fibrinogen abgesenkt [90]. Eine Studie in Sao Paulo (Brasilien) an 240 hospitalisierten Patienten mit schwerem Verlauf von COVID-19 (davon 116 mit Vitamin-D-Mangel) untersuchte den Effekt einer einzelnen oralen Bolusgabe von 200.000 IE Vitamin D3. Die Therapie war sicher und konnte den 25(OH)-Vitamin-D-Spiegel effektiv anheben, aber hatte im Vergleich zu Placebo keinen Einfluss auf die Aufenthaltsdauer im Krankenhaus oder andere klinisch bedeutsame Parameter [91]. Der fehlende Effekt von Vitamin D wurde mit der prävalenten Adipositas und dem späten Beginn der Vitamin-D-Intervention (im Durchschnitt 10 Tage nach Beginn der Symptome) erklärt. Auch kann die Art der Applikation (hoch dosierter einzelner Bolus) ungünstig sein.
Weitere kontrollierte Studien werden derzeit noch durchgeführt und lassen auf eine bessere Evidenzlage hoffen [92].
Zusammenfassend gibt es aber schon jetzt genügend Indizien, die für eine präventive Supplementation mit Vitamin D (möglichst in täglicher Dosierung) zur Vermeidung eines Vitamin-D-Mangels sprechen, um schweren Verläufen von COVID-19 vorzubeugen. Überdies ist diese Maßnahme preiswert und weitgehend nebenwirkungsfrei und hat auch im Hinblick auf das Skelett positive Wirkungen.
Einhaltung ethischer Richtlinien
Interessenkonflikt
S. H. Scharla gibt an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes
Hinweis des Verlags
Der Verlag bleibt in Hinblick auf geografische Zuordnungen und Gebietsbezeichnungen in veröffentlichten Karten und Institutsadressen neutral.
Literatur
- 1.Barger-Lux MJ, Heaney RP, Lanspa SJ, Healy JC, DeLuca HF. An investigation of sources of variation in calcium absorption efficiency. J Clin Endocrinol Metab. 1995;80:406–411. doi: 10.1210/jcem.80.2.7852497. [DOI] [PubMed] [Google Scholar]
- 2.Hollis BW, Wagner CL. The role of the parent compound vitamin D with respect to metabolism and function: why clinical dose intervals can affect clinical outcomes. J Clin Endocrinol Metab. 2013;98:4619–4628. doi: 10.1210/jc.2013-2653. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Nykjaer A, Dragun D, Walther D, et al. An endocytic pathway essential for renal uptake and activation of the steroid 25-(OH) vitamin D3. Cell. 1999;96:507–515. doi: 10.1016/S0092-8674(00)80655-8. [DOI] [PubMed] [Google Scholar]
- 4.Haussler MR, Whitfield GK, Kaneko I, Haussler CA, Hsieh D, Hsieh J, Jurutka PW. Molecular mechanisms of vitamin D action. Calcif Tissue Int. 2013;92:77–98. doi: 10.1007/s00223-012-9619-0. [DOI] [PubMed] [Google Scholar]
- 5.Scharla SH, Strong DD, Rosen C, Mohan S, Holick M, Baylink DJ, Linkhart TA. 1,25-dihydroxyvitamin D3 increases secretion of insulin-like growth factor binding protein-4 (IGFBP-4) by human osteoblast-like cells in vitro and elevates IGFBP-4 serum levels in vivo. J Clin Endocrinol Metab. 1993;77:1190–1197. doi: 10.1210/jcem.77.5.7521341. [DOI] [PubMed] [Google Scholar]
- 6.Scharla S. Einfluss von Vitamin D auf Knochen und Muskel. Diabetologe. 2016;12:261–268. doi: 10.1007/s11428-016-0101-x. [DOI] [Google Scholar]
- 7.Infante M, Ricordi C, Sanchez J, Clare-Salzler MJ, Padilla N, Fuenmayor V, Chavez C, Alvarez A, Baidal D, Alejandro R, Caprio M, Fabbri A. Influence of vitamin D on islet autoimmunity and beta-cell function in type 1 diabetes. Nutrients. 2019;11:2185. doi: 10.3390/nu11092185. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Mathieu C. Vitamin D and the immune system: getting it right. IBMS Bonekey. 2011;8:178–186. doi: 10.1138/20110505. [DOI] [Google Scholar]
- 9.Colin EM, Asmawidjaja PS, van Hamburg JP, Mus AM, van Driel M, Hazes JM, van Leeuwen JP, Lubberts E. 1,25-dihydroxyvitamin D3 modulates Th17 polarization and interleukin-22 expression by memory T cells from patients with early rheumatoid arthritis. Arthritis Rheum. 2010;62:132–142. doi: 10.1002/art.25043. [DOI] [PubMed] [Google Scholar]
- 10.Scharla S. Diagnosis of disorders of vitamin D-metabolism and osteomalacia. Clin Lab. 2008;54:451–459. [PubMed] [Google Scholar]
- 11.Scharla S. Osteomalazie. In: Lehnert H, editor. DGIM Innere Medizin. Berlin, Heidelberg: Springer; 2019. [Google Scholar]
- 12.Scharla SH, Scheidt-Nave C, Leidig G, Woitge H, Wüster C, Seibel MJ, Ziegler R. Lower serum 25-hydroxyvitamin D is associated with increased bone resorption markers and lower bone density at the proximal femur in normal females. A population-based study. Exp Clin Endocrinol Diabetes. 1996;104:289–292. doi: 10.1055/s-0029-1211456. [DOI] [PubMed] [Google Scholar]
- 13.Dawson-Hughes B, Harris SS, Krall EA, Dallal GE. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N Engl J Med. 1997;337:670–676. doi: 10.1056/NEJM199709043371003. [DOI] [PubMed] [Google Scholar]
- 14.Pfeifer M, Begerow B, Minne HW, Suppan K, Fahrleitner-Pammer A, Dobnig H. Effects of a long-term vitamin D and calcium supplementation on falls and parameters of muscle function in community-dwelling older individuals. Osteoporos Int. 2009;20:315–322. doi: 10.1007/s00198-008-0662-7. [DOI] [PubMed] [Google Scholar]
- 15.Chapuy MC, Arlot ME, Duboeuf F, et al. Vitamin D3 and calcium to prevent hip fractures in elderly women. N Engl J Med. 1992;327:1637–1642. doi: 10.1056/NEJM199212033272305. [DOI] [PubMed] [Google Scholar]
- 16.Bolland MJ, Grey A, Avenell A. Effects of vitamin D supplementation on musculoskeletal health: a systematic review, meta-analysis, and trial sequential analysis. Lancet Diabetes Endocrinol. 2018;6:847–858. doi: 10.1016/S2213-8587(18)30265-1. [DOI] [PubMed] [Google Scholar]
- 17.Appel LJ, Michos E, Mitchell CM, Blackford AL, Sternberg AL, Miller ER, Juraschek SP, Schrack JA, Szanton SL, Charleston J, Minotti M, Baksh SN, Christenson RH, Coresh J, Drye LT, Guralnik JM, Kalyani RR, Plante TB, Shade DM, Roth DL, Tonascia J. The effects of four doses of vitamin D supplements on falls in older adults: a response-adaptive, randomized clinical trial. Ann Intern Med. 2021;174:145–156. doi: 10.7326/M20-3812. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Sanders KM, Stuart AL, Williamson EJ, et al. Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. JAMA. 2010;303:1815–1822. doi: 10.1001/jama.2010.594. [DOI] [PubMed] [Google Scholar]
- 19.Bischoff-Ferrari HA, Dawson-Hughes B, Orav EJ, Staehelin HB, Meyer OW, Theiler R, Dick W, Willett WC, Egli A. Monthly high-dose vitamin D treatment for the prevention of functional decline: a randomized clinical trial. JAMA Intern Med. 2016;176:175–183. doi: 10.1001/jamainternmed2015.7148. [DOI] [PubMed] [Google Scholar]
- 20.Ginde AA, Blatchford P, Breese K, Zarrabi L, Linnebur SA, Wallace JI, Schwartz RS. High dose monthly vitamin D for prevention of acute respiratory infection in older long-term care residents: a randomized clinical trial. J Am Geriatr Soc. 2017;65:496–503. doi: 10.1111/jgs.14679. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Zheng YT, Cui QQ, Hong YM, Yao WG. A meta-analysis of high dose, intermittent vitamin D supplementation among older adults. PLoS ONE. 2015;10:e0115850. doi: 10.1371/journal.pone.0115850. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Bischoff-Ferrari HA, Orav EJ, Abderhalden L, Dawson-Hughes B, Willett WC. Vitamin D supplementation and musculoskeletal health. Lancet Diabetes Endocrinol. 2019;7:85. doi: 10.1016/S2213-8587(18)30347-4. [DOI] [PubMed] [Google Scholar]
- 23.Boonen S, Lips P, Bouillon R, Bischoff-Ferrari HA, Vanderschueren D, Haentjens P. Need for additional calcium to reduce the risk of hip fracture with vitamin D supplementation: evidence from a comparative metaanalysis of randomized controlled trials. J Clin Endocrinol Metab. 2007;92:1415–1423. doi: 10.1210/jc.2006-1404. [DOI] [PubMed] [Google Scholar]
- 24.Parker J, Hashmi O, Dutton D, Mavrodaris A, Stranges S, Kandala N-B, Clarke A, Franco OH. Levels of vitamin D and cardiometabolic disorders: Systematic review and meta-analysis. Maturitas. 2010;65:225–236. doi: 10.1016/j.maturitas.2009.12.013. [DOI] [PubMed] [Google Scholar]
- 25.Pilz S, März W, Wellnitz B, Seelhorst U, Fahrleitner-Pammer A, Dimai HP, Boehm BO, Dobnig H. Association of vitamin D deficiency with heart failure and sudden cardiac death in a large cross-sectional study of patients referred for coronary Angiography. J Clin Endocrinol Metab. 2008;93:3927–3935. doi: 10.1210/jc.2008-0784. [DOI] [PubMed] [Google Scholar]
- 26.Avenell A, MacLennan GS, Jenkinson DJ, McPherson GC, McDonald AM, Pant PR, Grant AM, Campbell MK, Anderson FH, Cooper C, Francis RM, Gillespie WJ, Robinson CM, Torgerson DJ, Wallace WA, RECORD Trial Group Long-term follow-up for mortality and cancer in a randomized placebo-controlled trial of vitamin D(3) and/or calcium (RECORD trail) J Clin Endocrinol Metab. 2012;97:614–622. doi: 10.1210/jc.2011-1309. [DOI] [PubMed] [Google Scholar]
- 27.Zittermann A. Effect of vitamin D on all-cause mortality in heart failure (EVITA): a 3-year randomized trial with 4000 IU vitamin D daily. Eur Heart J. 2017 doi: 10.1093/euheartj/ehx235. [DOI] [PubMed] [Google Scholar]
- 28.Manson JE, Cook NR, Lee I-M, et al. Vitamin D supplements and prevention of cancer and cardiovascular disease. N Engl J Med. 2019;380:33–44. doi: 10.1056/NEJMoa1809944. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Lee YH, Bae SC. Vitamin D level in rheumatoid arthritis and ist correlation with the disease activity: a meta-analysis. Clin Exp Rheumatol. 2016;34:827–833. [PubMed] [Google Scholar]
- 30.Aslam M, John P, Bhatti A, Jahangir S, Kamboh M. Vitamin D as a principal factor in mediating rheumatoid arthritis-derived immune response. Biomed Res Int. 2019;2019:3494937. doi: 10.1155/2019/3494937. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Scharla SH, Schacht E, Lempert UG. Alfacalcidol versus plain vitamin D in inflammation induced bone loss. J Rheumatol. 2005;32(Suppl 76):26–32. [PubMed] [Google Scholar]
- 32.Burton JM, Kimball S, Vieth R, Bar-Or A, Dosch HM, Cheung R, Gagne D, D’Souza C, Ursell M, O’Connor P. A phase 1/II dose-escalation trial of vitamin D3 and calcium in multiple sclerosis. Neurology. 2010;74:1852–1859. doi: 10.1212/WNL.0b013e3181e1cec2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Jagannath VA, Filippini G, Di Pietrantonj C, Asokan GV, Robak EW, Whamond L, Robinson SA. Vitamin D for the management of multiple sclerosis. Cochrane Database Syst Rev. 2018 doi: 10.1002/14651858.CD008422.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Smolders J, Torkildsen Ø, Camu W, Holmøy T. An update on vitamin D and disease activity in multiple sclerosis. CNS Drugs. 2019;33:1187–1199. doi: 10.1007/s40263-019-00674-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Mathieu C, Laureys J, Sobis H, Vandeputte M, Waer M, Bouillon R. 1,25-dihydroxyvitamin D 3 prevents insulitis in NOD Mice. Diabetes. 1992;41:1491–1495. doi: 10.2337/diab.41.11.1491. [DOI] [PubMed] [Google Scholar]
- 36.Mathieu C, Waer M, Laureys J, Rutgeerts O, Bouillon R. Prevention of autoimmune diabetes in NOD mice by 1,25-dihydroxyvitamin D. Diabetologia. 1994;37:552–558. doi: 10.1007/BF00403372. [DOI] [PubMed] [Google Scholar]
- 37.Takiishi T, Ding L, Baeke F, Spagnuolo I, Sebastiani G, Laureys J, Verstuyf A, Carmeliet G, Dotta F, Van Belle TL, Gysemans A, Mathieu C. Dietary supplementation with high doses of regular vitamin D3 safely reduces diabetes incidence in NOD mice when given early and long term. Diabetes. 2014;63:2026–2036. doi: 10.2337/db13-1559. [DOI] [PubMed] [Google Scholar]
- 38.EURODIAB ACE Study Group Variation and trends in incidence of childhood diabetes in Europe. Lancet. 2000;355:873–876. doi: 10.1016/S0140-6736(99)07125-1. [DOI] [PubMed] [Google Scholar]
- 39.Mohr SB, Garland CF, Gorham ED, Garland FC. The association between ultraviolet B irradiance, vitamin D status and incidence rates of type 1 diabetes in 51 regions worldwide. Diabetologia. 2008;51:1391–1398. doi: 10.1007/s00125-008-1061-5. [DOI] [PubMed] [Google Scholar]
- 40.Gorham ED, Garland CF, Burgi AA, Mohr SB, Zeng K, Hofflich H. Lower prediagnostic serum 25-hydroxyvitamin D concentration is associated with higher risk of insulin-requiring diabetes: a nestet case-control study. Diabetologia. 2012;55:3224–3227. doi: 10.1007/s00125-012-2709-8. [DOI] [PubMed] [Google Scholar]
- 41.Cadario F, Savastio S, Pagliardini V, Bagnati M, Vidali M, Cerutti F. Vitamin D levels at birth and risk of type 1 diabetes in childhood: A case-control study. Acta Diabetol. 2015;52:1077–1081. doi: 10.1007/s00592-015-0772-6. [DOI] [PubMed] [Google Scholar]
- 42.Mäkinen M, Mykkänen J, Koskinen M, Simell V, Veijola R, Hyöty H. Serum 25-Hydroxyvitamin D concentrations in children progressing to autoimmunity and clinical type 1 diabetes. J Clin Endocrinol Metab. 2016;101:723–729. doi: 10.1210/jc.2015-3504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Gabbay MAL, Sato MN, Finazzo C, Duarte AJS, Dib SA. Effect of cholecalciferol as adjungtive therapy with insulin on protective immunologic profile and decline of residual b-cell function in new-onset type 1 diabetes mellitus. Arch Pediatr Adolesc Med. 2012;166:601–607. doi: 10.1001/archpediatrics.2012.164. [DOI] [PubMed] [Google Scholar]
- 44.Treiber G, Prietl B, Fröhlich-Reiterer E, Lechner E, Ribitsch A, Fritsch M, Rami-Merhar B, Steigleder-Schweiger C, Graninger W, Borkenstein M, Pieber TR. Cholecalciferol supplementation improves suppressive capacity of regulatory T-cells in young patients with new-onset type 1 diabetes mellitus—A randomized clinical trial. Clin Immunol. 2015;161:217–224. doi: 10.1016/j.clim.2015.08.002. [DOI] [PubMed] [Google Scholar]
- 45.Penna-Martinez M, Hess H, Doering C, Nejatian N, Bogdanou D, Shoghi F, Hansmann ML, Badenhoop K. High dose vitamin D treatment regulates the gene expression pattern in T-Helper cells of type 1 diabetes patients; 2016. [Google Scholar]
- 46.Bogdanou D, Penna-Martinez M, Filmann N, Chung TL, Moran-Auth Y, Wehrle J, Cappel C, Huenecke S, Herrmann E, Koehl U, Badenhoop K. T-lymphocyte and glycemic status after vitamin D treatment in type 1 diabetes: a randomized controlled trial with sequential crossover. Diabetes Metab Res Rev. 2017 doi: 10.1002/dmrr.2865. [DOI] [PubMed] [Google Scholar]
- 47.Mishra A, Dayal D, Sachdeva N, Attri SV. Effect of 6-months’s vitamin D supplementation on residual beta cell function in children with type 1 diabetes: a case control interventional study. J Pediatr Endocrinol Metab. 2015;29:395–400. doi: 10.1515/jpem-2015-0088. [DOI] [PubMed] [Google Scholar]
- 48.Giri D, Pintus D, Burnside G, Ghatak A, Mehta F, Paul P, Senniappan S. Treating vitamin D deficiency in children with type I diabetes could improve their glycaemic control. BMC Res Notes. 2017;10:465. doi: 10.1186/s13104-017-2794-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Panjiyar RP, Dayal D, Attri SV, Sachdeva N, Sharma R, Bhalla AK. Sustained serum 25-hydroxyvitamin D concentrations for one year with cholecalciferol supplementation improves glycaemic control and slows the decline of resitual β-cell function in children with type 1 diabetes. Pediatr Endocrinol Diabetes Metab. 2018;24:111–117. doi: 10.5114/pedm.2018.80992. [DOI] [PubMed] [Google Scholar]
- 50.Shih EM, Mittelman S, Pitukcheewanont P, Azen CG, Monzavi R. Effects of vitamin D repletion on glycemic control and inflammatory cytokines in adolescents with type 1 diabetes. Pediatr Diabetes. 2016;17:36–43. doi: 10.1111/pedi.12238. [DOI] [PubMed] [Google Scholar]
- 51.Sharma S, Biswal N, Bethou A, Rajappa M, Kumar S, Vinayagam V. Does vitamin D supplementation improve glycaemic control in children with type 1 diabetes mellitus?—A randomized controlled trial. J Clin Diagnostic Res. 2017;11:SC15–SC17. doi: 10.7860/JCDR/2017/27321.10645. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Perchard R, Magee L, Whatmore A, Ivison F, Murray P, Stevens A, Mughal MZ, Ehtisham S, Campbell J, Ainsworth S, Marshall M, Bone M, Doughty I, Clayton PE. A pilot interventional study to evaluate the impact of cholecalciferol treatment on HBA1c in type 1 diabetes (T1D) Endocr Connect. 2017;6:225–231. doi: 10.1530/EC-17-0045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Pitocco D, Crinò A, Di Stasio E, Manfrini S, Guglielmi C, Spera S, Anguissola B, Visalli N, Suraci C, Matteoli MC, Patera IP, Cavallo MG, Bizzari C, Pozzilli P, IMDIAB group The effects of calcitriol and nicotinamide on residual pancreatic β-cell function in patients with recent onset type 1 diabetes (IMDIAB XI) Diabetic Med. 2006;23:920–923. doi: 10.1111/j.1464-5491.2006.01921.x. [DOI] [PubMed] [Google Scholar]
- 54.Walter M, Kaupper T, Adler K, Foersch J, Bonifacio E, Ziegler AG. No effect of the 1a,25-dihydroxyvitamin D3 on beta cell residual function and insulin requirement in adults with new-onset type 1 diabetes. Diabetes Care. 2010;33:1443–1448. doi: 10.2337/dc09-2297. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Bizzari C, Pitocco D, Napoli N, Di Stasio E, Maggi D, Manfrini S, Suraci C, Cavallo MG, Cappa M, Ghirlanda G, Pozzilli P, IMDIAB Group No protective effect of calcitriol on β-cell function in recent-onset type 1 diabetes. Diabetes Care. 2010;33:1962–1963. doi: 10.2337/dc10-0814. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Li X, Liao L, Yan X, Huang G, Lin J, Lei M, Wang X, Zhou Z. Protective effects of 1-alpha-hydroxyvitamin D3 on residual beta cell function in patients with adult-onset latent autoimmune diabetes (LADA) Diabetes Metab Res Rev. 2009;25:411–416. doi: 10.1002/dmrr.977. [DOI] [PubMed] [Google Scholar]
- 57.Ataie-Jafari A, Loke S-C, Rahmat AB, Larijani B, Abbasi F, Leow KS, Yassin Z. A randomized placebo-controlled trial of alphacalcidol on the preservation of beta cell function in children with recent onset type 1 diabetes. Clin Nutr. 2013;32:911–917. doi: 10.1016/j.clnu.2013.01.012. [DOI] [PubMed] [Google Scholar]
- 58.Lempert UG, Scharla SA, Scharla SHJ. Einfluss von Body-Mass-Index, 25-hydroxyvitamin D und HbA1c auf Myostatin. Osteologie. 2020;29:50. [Google Scholar]
- 59.Scharla SH. Knochen und Diabetes mellitus. Osteologie. 2020;29:7–12. doi: 10.1055/a-1076-1523. [DOI] [Google Scholar]
- 60.Li X, Liu Y, Zheng Y, Wang P, Zhang Y. The effect of vitamin D supplementation on glycemic control in type 2 diabetes patients: a systematic review and meta-analysis. Nutrients. 2018;10:375. doi: 10.3390/nu10030375. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Pittas AG, Dawson-Hughes B, Sheehan P, Ware JH, Knowler WC, Aroda VR, Brodsky I, Ceglia L, Chadha C, Chatterjee R, Desouza C, Dolor R, Foreyt J, Fuss P, Ghazi A, Hsia DS, Johnson KC, Kashyap SR, Kim S, LeBlanc ES, Leweis MR, Liao E, Neff LM, Nelson J, O’Neil P, Park J, Peters A, Phillips LS, Pratley R, Raskin P, Rasouli N, Robbins D, Rosen C, Vickery EM, Staten M, for the D2d Research Group Vitamin D supplementation and prevention of type 2 diabetes. N Engl J Med. 2019;381:520–530. doi: 10.1056/NEJMoa1900906. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Simsek Y, Cakir I, Yetmis M, Dizdar OS, Baspinar O, Gokay F. Effects of vitamin D treatment on thyroid autoimmunity. J Res Med Sci. 2016;21:85. doi: 10.4103/1735-1995.192501. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Mazokopakis EE, Papadomanolaki MG, Tsekouras KC, Evangelopoulos AD, Kotsiris DA, Tzortzinis AA. Is vitamin D related to pathogenesis and treatment of Hashimotos’s thyroiditis? Hell J Nucl Med. 2015;18:222–227. [PubMed] [Google Scholar]
- 64.Chaudhary S, Dutta D, Kumar M, Saha S, Mondal SA, Kumar A, Mukhopadhyay S. Vitamin D supplementation reduces thyroid peroxidase antibody levels in patients with autoimmune thyroid disease: an open-labeled randomized controlled trial. Indian J Endocrinol Metab. 2016;20:391–398. doi: 10.4103/2230-8210.179997. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Lappe J, Watson P, Travers-Gustafson D, Recker R, Garland C, Gorham E, Baggerly K, McDonnel SL. Effect of vitamin D and calcium supplementation on cancer incidence in older women: a randomized clinical trial. JAMA. 2017;317:1234–1243. doi: 10.1001/jama.2017.2115. [DOI] [PubMed] [Google Scholar]
- 66.Scharla SH. Vitamin D in der Reproduktionsmedizin. Gynäkologische Endokrinologie. 2019;17:16–19. doi: 10.1007/s10304-018-0235-6. [DOI] [Google Scholar]
- 67.Coussens AK, Wilkinson RJ, Hanifa Y, Nikolayevskyy V, Elkington PT, Islam K, Timms PM, Venton TR, Bothamley GH, Packe GE, Darmalingam M, Davidson RN, Milburn HJ, Baker LV, Barker RD, Meim CA, Bhaw-Rosun L, Nuamah R, Young DB, Drobniewski FA, Griffiths CJ, Martineau AR. Vitamin D accelerates resolution of inflammatory responses during tuberculosis treatment. Proc Natl Acad Sci U S A. 2012;109:15449–15454. doi: 10.1073/pnas.1200072109. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Bergmann P, Lindh AU, Björkhem-Bergman L, Lindh JD. Vitamin D and respiratory tract infections: a systematic review and meta-analysis of randomized controlled trials. Plos One. 2013;8:e65835. doi: 10.1371/journal.pone.0065835. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Martineau AR, Jolliffe DA, Greenberg L, Aloia JF, Bergman P, Dubnov-Raz G, Esposito S, Ganmaa D, Ginde AA, Goodall EC, Grant CC, Janssens W, Jensen ME, Kerley CP, Laaksi I, Manaseki-Holland S, Mauger D, Murdoch DR, Neale R, Rees JR, Simpson S, Stelmach I, Kumar GT, Uraschima M, Camargo CA, Griffiths CJ, Hooper RL. Vitamin D supplementation to prevent acute respiratory infections: individual participant data meta-analysis. Health Technol Assess. 2019;23:1–44. doi: 10.3310/hta23020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Pham H, Waterhouse M, Baxter C, Romero BD, McLeod DSA, Armstrong BK, et al. The effect of vitamin D supplementation on acute respiratory tract infection in older Australian adults: an analysis of data from the D-Health Trial. Lancet Diabetes Endocrinol. 2021;9:69–81. doi: 10.1016/S2213-8587(20)30380-6. [DOI] [PubMed] [Google Scholar]
- 71.Martineau AR, James WY, Hooper RL, Barnes NC, Jolliffe DA, Greiller CL, Islam K, McLaughlin D, Bhowmik A, Timms PM, Rajajulasingam RK, Rowe M, Venton TR, Choudhury AB, Simcock DE, Wilks M, Degun A, Sadique Z, Monteiro WR, Corrigan CJ, Hawrylowicz CM, Griffiths CJ. Vitamin D supplementation in patients with chronic obstructive pulmonary disease (ViDiCo): a multicentre, double-blind, randomised controlled trial. Lancet Respir Med. 2015;3:120–130. doi: 10.1016/S2213-2600(14)70255-3. [DOI] [PubMed] [Google Scholar]
- 72.Urashima M, Segawa T, Okazaki M, Kurihara M, Wada Y, Ida H. Randomized trial of vitamin D supplementation to prevent seasonal influenza A in schoolchildren. Am J Clin Nutr. 2010;91:1255–1260. doi: 10.3945/ajcn.2009.29094. [DOI] [PubMed] [Google Scholar]
- 73.Greiller CL, Martineau AR. Modulation of the immune response to respiratory viruses by Viamin D. Nutrients. 2015;7:4240–4270. doi: 10.3390/nu7064240. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Xu Yi, Baylink DJ, Chen CS, Reeves ME, Xiao J, Lacy C, Lau E, Cao H. The importance of vitamin d metabolism as a potential prophylactic, immunoregulatory and neuroprotective treatment for COVID-19. J Transl Med. 2020;18:322. doi: 10.1186/s12967-020-02488-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Mahdavi AM. A brief review of interplay between vitamin D and angiotensin-converting enzyme 2: Implications for a potential treatment for COVID-19. Rev Med Virol. 2020;30:e2119. doi: 10.1002/rmv.2119. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Merzon E, Tworowski D, Gorohovski A, Vinker S, Cohen AG, Green I, Frenkel-Morgenstern Low plasma 25(OH)vitamin D level is associated with increased risk of COVID-19 infection: an Israeli population-based study. FEBS J. 2020;287:3693–3702. doi: 10.1111/febs.15495. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Hernandez JL, Nan D, Fernandez-Ayala M, Garcia-Unzueta M, Hernandez-Hernandez MA, Lopez-Hoyos M, Munoz-Ccho P, Omos JM, Gutierrez-Cuadra M, Ruiz-Cubillan JJ, Crespo J, Marinez-Taboada VM. Vitamin D status in hospitalized patients with SARS-coV-2 infection. J Clin Endocrinol Metab. 2020 doi: 10.1210/clinem/dgaa733. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Hutchings N, Babalyan V, Baghdasaryan S, Qefoyan M, Sargsyants N, Aghajanova E, Martirosyan A, Harutyunyan R, Lesnyak O, Formenti AM, Giustina A, Bilezikian JP. Patients hospitalized with COVID-19 have low levels of 25-hydroxyvitamin D. Endocrine. 2021;16:1–3. doi: 10.1007/s12020-020-02597-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Panagiotou G, Tee SA, Ihsan Y, Athar W, Marchitelli G, Kelly D, Boot CS, Stock N, Macfarlane J, Martineau AR, Burns G, Quinton R. Low serum 25-hydroxyvitamin D (25[OH]D) levels in patients hospitalized with COVID-19 are associated with greater disease severity. Clin Endocrinol. 2020;93:508–511. doi: 10.1111/cen.14276. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Vassiliou AG, Jahaj E, Pratikaki M, Orfanos SE, Dimopoulou I, Kotanidou A. Low 25-Hydroxyvitamin D levels on admission to the intensive care unit may predispose COVID-19 pneumonia patients to a higher 28-day mortality risk: a pilot study on a greek ICU cohort. Nutrients. 2020;12:3773. doi: 10.3390/nu12123773. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Karahan S, Katkat F. Impact of serum 25(OH)Vitamin D level on mortality in patients with COVID-19 in Turkey. J Nutr Health Aging. 2021;25:189–196. doi: 10.1007/s12603-020-1479-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Abrishami A, Dalili N, Torbati PM, Asgari R, Arab-Ahmadi M, Behnam B, Sanei-Taheri M. Possible association of vitamin D status with lung involvement and outcome in patients with COVID-19: a retrospective study. Z Ernahrungswiss. 2020 doi: 10.1007/s00394-020-02411-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Orchard L, Baldry M, Nasim-Mohi M, Monck C, Saeed K, Grocott MPW, Ahilanandan D, University Hospital Southampton Critical Care Team and the REACT COVID Investigators Vitamin D levels and intensive care unit outcomes of a cohort of critically ill COVID-19 patients. Clin Chem Lab Med. 2021 doi: 10.1515/cclm-2020-1567. [DOI] [PubMed] [Google Scholar]
- 84.Hastie CE, Mackay DF, Ho F, Celis-Morales CA, Katikireddi SV, Niedzwiedz C, Jani BD, Welsh P, Mair FS, Gray SR, O’Donnell CA, Gill JMR, Sattar N, Pell JP. Vitamin D concentrations and COVID-19 infection in UK Biobank. Diabetes Metab Syndr. 2020;14:561–565. doi: 10.1016/j.dsx.2020.04.050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Radujkovic A, Hippchen T, Tiwari-Heckler S, Dreher S, Boxberger M, Merle U. Vitamin D deficiency and outcome of COVID-19 Patients. Nutrients. 2020;12:2757. doi: 10.3390/nu12092757. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Ohaegbulam KC, Swalih M, Patel P, Smith MA, Perrin R. Vitamin D supplementation in COVID-19 patients: a clinical case series. Am J Ther. 2020;27:e485–e490. doi: 10.1097/MJT.0000000000001222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Annweiler G, Corvaisier M, Gautier J, Dubee V, Legrand E, Sacco G, Annweiler C. Vitamin D supplementation associated to better survival in hospitalized frail elderly COVID-19 patients. The GERIA-COVID Quasi-Experimental Study. Nutrients. 2020;12:3377. doi: 10.3390/nu12113377.. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Annweiler C, Hanotte B, de lÉprevier C, Sabatier JM, Lafaie L, Célarier T. Vitamin D and survival in COVID-19 patients: a quasi-experimental study. J Steroid Biochem Mol Biol. 2020;204:105771. doi: 10.1016/j.jsbmb.2020.105771. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Castillo ME, Costa LME, Barrios JMV, Diaz JFA, Miranda JL, Bouillon R, Gomez JMQ. Effect of calcifediol treatment and best available therapy versus best available therapy on intensive care unit admission and mortality among patients hospitalized for COVID-19: A pilot randomized clinical study. J Steroid Biochem Mol Biol. 2020;203:105751. doi: 10.1016/j.jsbmb.2020.105751. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Rastogi A, Bhansali A, Khare N, Suri V, Yaddanapudi N, Sachdeva N, Puri GD, Malhotra P. Short term, high-dose vitamin D-supplementation for COVID-19 disease: a randomized, placebo-controlled study (SHADE study) Postgrade Med J. 2020 doi: 10.1136/postgradmedj-2020-1390651. [DOI] [PubMed] [Google Scholar]
- 91.Murai ICH, Fernandes AL, Sales LP, et al. Effect of vitamin D3 supplementation vs placebo on hospital length of stay in patients with severe COVID-19: a multicenter, double-blind, randomized controlled trial. 2020. [Google Scholar]
- 92.Brenner H. Vitamin D supplementation to prevent COVID-19 infections and deaths—accumulating evidence from epidemiological and intervention studies calls for immediate action. Nutrients. 2021;13:411. doi: 10.3390/nu13020411. [DOI] [PMC free article] [PubMed] [Google Scholar]