Abstract
Die Myelitis ist ein entzündliches Syndrom des Rückenmarks, das zumeist akut oder subakut auftritt. Oft synonym wird der Begriff Myelopathie verwendet, die häufig mit ähnlichen Symptomen auffällt, aber durch eine Vielzahl von nicht primär inflammatorischen Ursachen ausgelöst werden und sich auch chronisch entwickeln kann. In der letzten Dekade hat sich das Spektrum autoimmuner Myelitiden, aber auch das diagnostische Methodenspektrum, stark erweitert. Neben der Multiplen Sklerose als typischer kurzstreckiger Myelitis und den Neuromyelitis-optica-Spektrum-Erkrankungen mit typischer langstreckiger Myelitis sind viele seltenere, aber wichtige Differenzialdiagnosen zu beachten. Die Magnetresonanztomographie sowie die Antikörper- und Liquordiagnostik sind die entscheidenden differenzialdiagnostischen Methoden und legen den Grundstein für eine schnellstmögliche Therapie und bessere Prognose. Dieser Artikel bietet einen Überblick zum Spektrum autoimmuner Rückenmarkserkrankungen und deren Differenzialdiagnostik.
Schlüsselwörter: Autoimmune Systemerkrankungen, Symptomatik, Myelitis, Multiple Sklerose, Neuromyelitis optica
Abstract
Myelitis is an acute or subacute inflammatory syndrome of the spinal cord. Myelopathy, often used as a synonym and presenting with similar symptoms in clinical practice, can be caused by numerous, not primarily inflammatory etiologies and might also show a progressive disease course. Within the last decade the spectrum of autoimmune myelitis was significantly broadened as was the spectrum of diagnostic methods. Apart from the characteristic example of multiple sclerosis with short-length myelitis and neuromyelitis optica spectrum disorders with longitudinally extensive transverse myelitis, multiple rare but important differential diagnoses should also be considered. Magnetic resonance imaging and laboratory analyses of serum antibodies and cerebrospinal fluid are the most important diagnostic methods and are fundamental for rapid treatment decisions, subsequently with better prognosis. This article reviews representative diseases within the spectrum of autoimmune spinal cord diseases and their differential diagnoses.
Keywords: Autoimmune systemic diseases, Symptoms, Myelitis, Multiple sclerosis, Neuromyelitis optica
Hintergrund
Die Myelitis ist eine Entzündung des Rückenmarks, die zumeist akut oder subakut auftritt. Der Oberbegriff Myelopathie wird oft synonym verwendet. Diese manifestiert sich häufig mit ähnlichen Symptomen, kann aber eine Vielzahl nicht primär inflammatorischer Ursachen haben. Sowohl Myelitis als auch Myelopathien können autoimmunvermittelt sein [108]. Eine rasche Diagnostik autoimmuner Ursachen ist zur schnellen Behandlung und Vorbeugung von Behinderung dringend geboten [37].
Myelitiden können als Schubereignis demyelinisierender neurologischer Erkrankungen wie z. B. bei Multipler Sklerose (MS; [93]) oder diversen antikörpervermittelten Erkrankungen auftreten – z. B. bei Aquaporin-4-Antikörper(AQP4-IgG)-seropositiven Neuromyelitis-optica-Spektrum-Erkrankungen („neuromyelitis optica spectrum disorders“, NMOSD; [105]), Myelinoligodendrozytenglykoprotein-Antikörper(MOG-IgG)-assoziierter Erkrankung (MOGAD; [50]) oder Glial-fibrillary-acidic-protein-Antikörper(GFAP-IgG)-assoziierter Erkrankung [48]. Andere immunvermittelte Rückenmarksbeteiligungen treten u. a. para-/postinfektiös/postvakzinal (z. B. auch akute disseminierende Enzephalomyelitis, ADEM; [1]), verursacht durch paraneoplastische Antikörper [60] oder bei Sarkoidose auf [65]. Auch im Rahmen systemischer, insbesondere rheumatologischer Autoimmunerkrankungen mit neurologischen Manifestationen wie z. B. systemischer Lupus erythematodes [12] und Behçet-Syndrom [46] können Myelitiden auftreten (Tab. 1).
| Differenzialdiagnose | Beispiele |
|---|---|
| Atopische Myelitis [91] | |
| Demyelinisierende Erkrankungen | Akut disseminierende Enzephalomyelitis (ADEM) |
| Glial-fibrillary-acidic-protein-Antikörper(GFAP)-IgG-assoziierte Erkrankung (seltener auch paraneoplastisch) | |
| Multiple Sklerose | |
| Myelinoligodendrozytenglykoprotein-Antikörper(MOG-IgG)-assoziierte Erkrankungen (MOGAD) | |
| Neuromyelitis Optica-Spektrum-Erkrankung (NMOSD, seltener auch paraneoplastisch) | |
| Idiopathische Myelitis [94] | |
| Parainfektiöse Myelitis (Erreger häufig nicht identifizierbar; [9]) |
– Bakteriell z. B. Acinebacter baumanii, Bartonella henselae, Borrelia burgdorferi, Brucella melitensis, Campylobacter jejuni, Chlamydia pneumoniae/psittaci, Coxiella burnetii, Legionella pneumonia, Leptospira, Mycobacterium tuberculosis, Mycoplasma pneumoniae, Orientia tsutsugamushi, Salmonella paratyphi B, Streptococcus A/B, Treponema pallidum |
|
– Fungal z. B. Actinomyceten, Aspergillus, Mastomyceten, Cladophialophora bantiana, Coccidioides, Cryptococcus | |
|
– Parasitär z. B. Acanthamoeba, Echinococcus granulosus, Gnathostoma spinigerum, Paragonimus westermani, Schistosoma, Taenia solium, Toxocara, Toxoplasma gondii, Trypanosoma brucei | |
|
– Viral Chikungunya, Coronaviren, Coxsackie-Virus A/B, Zytomegalievirus, Dengue-Virus, Echo-Virus, Epstein-Barr-Virus, Enteroviren, Frühsommermeningoenzephalitis, Hanta-Viren, Hepatitis A/B/C/E, humanes Immundefizienzvirus, Masern, Herpes simplex, humanes Herpesvirus 6, Influenza A/B, Japanische B‑Enzephalitis, lymphozytisches Choriomeningitisvirus, Mumps, Murray-Valley-Enzephalitis, Parvovirus B19, Rocky-Mountain-Fleckfieber, Rubella, St.-Louis-Enzephalitis, Vacciniavirus, Varizella zoster, West-Nil-Virus | |
| Paraneoplastische Syndrome | Antikörper gegen z. B. ANNA‑3 [17], Antiamphiphysin [75], Anti-Hu [88], Anti-GAD65 [76], Anti-Ma [43], Anti-Ri [59], Anti-Ta [43], Anti-Yo/PCA‑1 [61], Aquaporin‑4 [89], CRMP‑5 [107], Glycin-Rezeptor [62], N‑Methyl-D-Aspartat--Rezeptor [97], PCA‑2 [96] |
| Postvakzinale Myelitis [47] | z. B. Cholera, Diptherie, Gelbfieber, Hepatitis B, Influenza, Japanische B‑Enzephalitis, Mumps, Masern, Pertussis, Pocken, orale Poliovakzine, Rabies, Röteln |
| Sarkoidose/Neurosarkoidose | |
| Substanz- und medikamenteninduzierte Myelitis [9, 32] | z. B. Benzol, Cisplatin, Cytarabin, Gemcitabin, Heroin, Immuncheckpoint-Inhibitoren, Tumornekrosefaktor-α-Inhibitoren, Sulfasalazin |
| Systemische autoimmun-entzündliche Erkrankungen | Antiphospholipid-Syndrom [84] |
| Behçet-Syndrom [46] | |
| IgG4-Syndrom | |
| Sjögren-Syndrom [23] | |
| Systemischer Lupus erythematodes [12] | |
| Systemische Sklerose [6] | |
| Weitere seltenere Ätiologien | Graft-vs.-Host-Erkrankung [80] |
| ANCA-assoziierte Vaskulititis [67] | |
| Psoriasis-Arthritis [77] | |
| Spondylitis ankylosans [29] | |
| Urtikariavaskulitis [13] | |
| Mischkollagenose [102] | |
| Colitis ulcerosa [78] | |
| Zöliakie [16] | |
Diese Übersichtsarbeit erläutert das diagnostische Vorgehen bei verschiedenen immunvermittelten Myelitisätiologien mit Fokus auf demyelinisierende Erkrankungen sowie deren Abgrenzung von nichtautoimmunen Ätiologien.
Anamnese und klinische Untersuchung
Die demographische Verteilung immunvermittelter Myelitiden orientiert sich an der zugrunde liegenden Erkrankung. Wie meist bei Autoimmunerkrankungen sind Frauen häufiger betroffen als Männer; die Ausnahme bilden MOGAD sowie das Behçet-Syndrom [2, 11]. MS betrifft v. a. kaukasische Patienten [45], während Sarkoidose insbesondere dunkelhäutige Menschen [71] und das Behçet-Syndrom Patienten mit Herkunft aus dem mediterranen Raum oder Mittleren Osten betrifft [2]. Ein genereller Altersgipfel besteht nicht; ADEM tritt jedoch zumeist bei Kindern auf, während paraneoplastische Syndrome sich im höheren Lebensalter häufen [92, 111]. Im Rahmen der gründlichen Anamnese sollten Infektionen (parainfektiös; [9]), Impfungen (postvakzinal; [47]) und potenzielle Symptombeschreibungen einer neurologischen oder systemischen Autoimmunerkrankung oder eines onkologischen Geschehens besondere Beachtung finden.
Die Symptomatik akuter Myelitiden entwickelt sich innerhalb von Tagen und erreicht ihr Maximum innerhalb von 3 Wochen [94]. Neben Schubereignissen bzw. Erstmanifestationen bei MS, NMOSD, MOGAD, GFAP-IgG-assoziierter Erkrankung und ADEM sollte für ein akutes Geschehen eine postvakzinale (z. B. bei Impfungen gegen Diptherie, Pertussis, Mumps, Masern, Röteln, Influenza, Hepatitis B) oder paraneoplastische Genese in Betracht gezogen werden [9]. Auch verschiedene autoimmune Systemerkrankungen (z. B. Sjögren-Syndrom, systemischer Lupus erythematodes) können eine akute Myelitis verursachen [12, 23].
Immunvermittelte chronische Myelopathien, die sich über Wochen bis Monate hinweg entwickeln, sind seltener, können aber z. B. bei paraneoplastischen Syndromen, bei progressiver MS oder bei rheumatologischen Erkrankungen auftreten. Hier sollte der diagnostische Fokus jedoch auch auf nichtimmunvermittelte Ursachen abzielen (Tab. 2). Weitere Argumente gegen eine immunvermittelte Genese sind ein apoplektiformer Beginn (< 4 h), kürzliche Traumata oder chirurgische Eingriffe, ein vaskuläres Risikoprofil, eine bestehende Immunsuppression und Symptome einer Infektion des Zentralnervensystems (ZNS; z. B. Fieber, Meningismus).
| Nichtautoimmune Differenzialdiagnosen | |
|---|---|
| Akute Myelitiden | |
| Infektiös |
– Bakteriell Actinomyceten, Borrelia burgdorferi, Mycoplasma pneumoniae, spinale Abzesse einer systemischen Infektion |
|
– Fungal Aspergillus, Blastomyces, Coccidioides, Cryptococcus | |
|
– Parasitär Angiostrongylus, Gnathostoma, Neurozystizerkose, Schistosoma mansoni (Bilharzien), Toxocara | |
|
– Viral Coronaviren (SARS-CoV‑2 [„severe acute respiratory syndrome coronavirus type 2“]), Flaviviren (Dengue-Virus, Japanische B‑Enzephalitis, St.-Louis-Enzephalitis, West-Nil-Virus), Herpesviren (Zytomegalievirus, Epstein-Barr-Virus, Herpes-simplex-Virus, humane Herpesviren 6/7, Varizella-Zoster-Virus), Orthomyxoviren (Influenza-A-Virus), Paramyxoviren (Masernvirus, Mumpsvirus), Picornaviren (Coxsackie-Viren A/B, Echoviren, Enteroviren 70/71, Hepatitis A/C), Polioviren (Typ 1/2/3) | |
| Neoplastisch | Intramedulläre Metastasen |
| Primär intramedulläre Tumoren (Astrozytom, Ependymom, Hämangioblastom, Lymphom) | |
| Vaskulär | Arteria-spinalis-anterior/posterior-Infarkt |
| Arteriovenöse Fistel | |
| Hämatomyelie | |
| Nucleus-pulposus-Embolus | |
| Chronische Myelopathien | |
| Hereditär-degenerativ | Amyotrophe Lateralsklerose |
| Adrenomyeloneuropathie | |
| Friedreich-Ataxie | |
| Hereditäre spastische Paraparese | |
| Spinozerebelläre Ataxien | |
| Kompression | Spondylose |
| Syrinx | |
| Tumor | |
| Zervikale Myelopathie | |
| Mangelsyndrome | Kupfer (auch metabolisch induziert durch einen Zinküberschuss) |
| Vitamin B12 | |
| Vitamin E | |
| Infektiös | Borrelia burgdorferi |
| Brucellosis | |
| Humanes Immundefizienzvirus (HIV) | |
| Humanes T‑lymphotropes Virus 1 (HTLV 1) | |
| Mycobacterium tuberculosis (seltener akut) | |
| Treponema pallidum (seltener akut) | |
| Schistosomiasis | |
| Vaskulär | Superfizielle Siderose [58] |
| Zerebrale autosomal-dominante Arteriopathie mit subkortikalen Infarkten und Leukenzephalopathie (CADASIL) | |
Die meisten immunvermittelten Myelitiden folgen einem schubhaften Verlauf und können nach dem Initialereignis je nach Schwere der Erkrankung und Therapieerfolg erneut auftreten [94]. Eine Ausnahme bildet die ADEM, die zumeist monophasisch verläuft [92]. Die Sarkoidose verläuft nach dem initialen Ereignis meist progressiv und flammt beim Ausschleichen der immunsuppressiven Therapie häufig wieder auf [98]. Auch paraneoplastische Myelopathien verlaufen meist progressiv, einzelne schubartige Verläufe sind jedoch beschrieben [34]. Zunächst schubförmige Myelitiden bei demyelinisierenden Erkrankungen oder eine chronische immunvermittelte Myelopathie können langfristig eine progressive Atrophie des Rückenmarks mit folgender schwerer Behinderung auslösen – eine effektive krankheitsstabilisierende Therapie nicht nur zur Schubprophylaxe – ist daher entscheidend [18, 95].
Die Symptomatik variiert in Abhängigkeit von der Lokalisation der Rückenmarksläsion
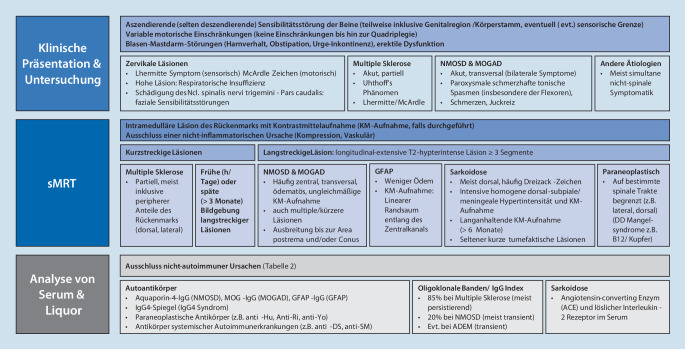
Die klinische Präsentation ist stark von der Lokalisation der Rückenmarksläsion abhängig. Die Patienten beschreiben meist eine aszendierende, seltener eine deszendierende Sensibilitätsstörung der Beine, die den Körperstamm oder die Genitalregion einschließen kann. Bei der Untersuchung lässt sich unter Umständen ein sensibles Niveau am Körperstamm nachweisen. Auch die motorischen Einschränkungen variieren je nach Lokalisation und können von Symptomfreiheit bis hin zur Quadriplegie reichen. Während die meist kleineren MS-Läsionen häufiger einseitige oder asymmetrische Sensibilitäts- und Krafteinschränkungen verursachen (eventuell als Brown-Séquard-Syndrom), induzieren transverse Läsionen wie z. B. bei NMOSD, MOGAD oder Sarkoidose häufig bilaterale Symptome [36].
Zervikale Läsionen, oft als Charakteristikum der MS betrachtet, können bei passiver Nackenbeugung eine unangenehme elektrisierende Sensation entlang der Wirbelsäule (Lhermitte-Zeichen; [55]) und eine verminderte Kraft der Fingerextensoren (McArdle-Zeichen; [87]) verursachen. Sehr hohe Läsionen führen zu einer Sensibilitätsstörung im Gesicht (bei Schädigung des Ncl. spinalis nervi trigemini), zu Übelkeit und Erbrechen (bei Schädigung der Area postrema) oder unter Umständen sogar zu einer respiratorischen Insuffizienz [36]. Im Gegensatz dazu induzieren insbesondere – aber nicht ausschließlich – kaudal gelegene Läsionen Blasen-Mastdarm-Störungen, Harnverhalt, Obstipation oder Urge-Inkontinenz sowie erektile Dysfunktion [36].
Infolge der Demyelinisierung kommt es häufig zu einer für die MS typischen hitzeinduzierten Verschlechterung der Symptome (Uhthoff-Phänomen; [21]). Paroxysmale schmerzhafte tonische Spasmen, Schmerzen (zentral, tief oder radikulär) oder Juckreiz sind eher ein Hinweis auf NMOSD (Abb. 1; [5]).
Die Symptomatik von Myelopathien ist auch von der Symptomdauer abhängig. Bei akuter schwerer Myelopathie (spinaler Schock) können Muskeleigenreflexe erlöschen, doch im Verlauf entwickeln sich zumeist Zeichen des 1. Motoneurons mit Hyperreflexie und erhöhtem Tonus. Bei Beteiligung der spinalen grauen Substanz können die Reflexe abgeschwächt oder abwesend sein. Bei thorakalen Läsionen erlischt der Abdominalreflex (oberhalb T6 [thorakales Segment 6]: vollständig erloschen, bei T10 oder niedriger: Erhalt des oberen und mittleren Segments, unterhalb T12: alle Reflexe erhalten; [15]). Der Cremaster-Reflex erlischt bei Läsionen auf Höhe L2 (lumbales Segment 2) oder höher; der Bulbokavernosusreflex bei Läsionen oberhalb S2 (sakrales Segment 2; [36]).
Eine zusätzliche Symptomatik außerhalb des Rückenmarks kann die Differenzialdiagnostik deutlich erleichtern. Das gleichzeitige Auftreten von Sehnervenentzündungen oder Area-postrema-Syndrom spricht z. B. für eine AQP4-IgG-seropositive NMOSD oder MOGAD [105]. Bei Patienten mit MOGAD können zusätzlich eine Enzephalopathie oder epileptische Anfälle auftreten [41, 70]. Auch paraneoplastische Syndrome zeigen oft ein polytopes klinisches Bild, das als primär-progressive MS fehldiagnostiziert werden kann [34]. Insbesondere für Erkrankungen des rheumatologischen Formenkreises ist die Evaluation anderer Organsysteme, wie z. B. der Nieren oder der Lunge, sowie extraspinaler neurologischer Manifestationen unumgänglich (Tab. 3). Während das periphere Nervensystem bei rheumatologischen oder paraneoplastischen Erkrankungen häufig betroffen ist, ist dessen ausgeprägte Affektion bei MS und NMOSD nur durch eine Komorbidität zu erklären [44]. Patienten mit rheumatologischen Erkrankungen beschreiben außerdem häufig bereits früh eine ausgeprägte Fatigue [7]. Neuere Studien lassen jedoch vermuten, dass auch MS- und MOGAD-Patienten – wenn auch in deutlich geringerem Maße – von peripheren oder kranialen Neuropathien und früher Fatigue betroffen sein können [19, 53, 66, 81].
| Diagnose | Klinische Hinweise | Ergänzende Diagnostik |
|---|---|---|
|
Antiphospholipidsyndrom Thorakale Myelitis mit Sphinkterdysfunktion [84] |
Thrombosen, Thromboembolien, Livedo reticularis, Schwangerschaftkomplikationen | Serologischer Nachweis von Antiphospholipidantikörpern: Lupus-Antikoagulans, Anti-Cardiolipin-Antikörper, Anti-β2-Glykoprotein 1-Antikörper, verlängerte aPTT |
|
Behçet-Erkrankung Multifokale longitudinale transverse Myelitis [64] |
Geographische Häufung (mediterraner Raum/Mittlerer Osten), orale Aphthen, genitale Ulzerationen, Uveitis/Retinitis, Hautläsionen | Pathergie-Test, ophthalmologische und gynäkologische Untersuchung |
|
Sjögren-Syndrom Akute oder progressive transverse Myelopathie [23] |
Verminderte Drüsensekretion (Tränen‑, Speicheldrüsen), Fatigue, periphere Neuropathie, Purpura/Urtikaria, Pseudolymphom, Pneumonie | Serologischer Nachweis von Antikörpern: SS‑B (La) und SS‑A (Ro), erhöhte Blutsenkung, Schirmer-Test, Histologie/Sonographie |
|
Systemischer Lupus erythematodes Myelitis der grauen oder weißen Substanz [12] |
Fieber, Fatigue, Gewichtsverlust, Arthralgien/Myalgien, Photosensitivität, Schmetterlingsödem, Serositis, Nephritis, Delir/Psychose/Epilepsie | Antinukleäre Antikörper, Anti-dsDNA-Antikörper, Anämie, Thrombozytopenie, Lymphozytopenie, reduzierte Komplementfaktoren, erhöhte Blutsenkungsgeschwindigkeit, Haut‑/Nierenbiopsie |
|
Systemische Sklerose Subakute oder progressive Myelopathie [6] |
Progrediente Hautfibrose, Calcinosis cutis, Fingerkuppennekrose, Teleangiektasien, Sicca-Symptomatik, Beteiligung von Gastrointestinaltrakt/Lunge/Gelenk/Niere | Serologischer Nachweis von Antikörpern: antinukleäre Antikörper (ANA), Anti-Scl-70, Antizentromerantikörper (ACA), Anti-RNA-Polymerase II, III, Kapillarmikroskopie der Nagelfalz |
aPTT aktivierte partielle Thromboplastinzeit
Bildgebung
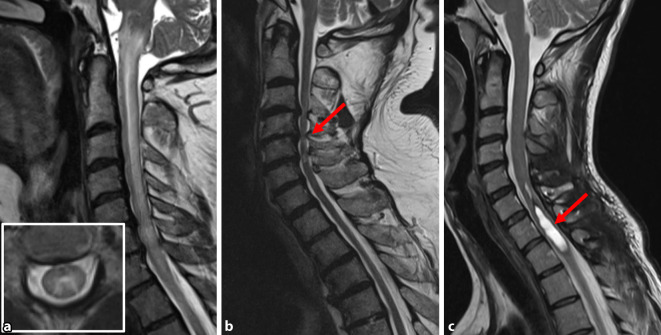
Bei jedem Patienten mit Verdacht auf Myelitis oder Myelopathie sollte eine Magnetresonanztomographie (MRT inkl. Kontrastmittel [KM]) schnellstmöglich durchgeführt werden, um Invalidität und falsche therapeutische Entscheidungen zu vermeiden. Primäres Ziel ist dabei die Abgrenzung einer nichtinflammatorischen Ursache (z. B. einer kompressiven Myelopathie, Abb. 2) von einer entzündlichen Ursache (z. B. einer intramedullären, kontrastmittelaufnehmenden Läsion). Bildgebend wird zwischen kurzstreckigen (< 3 Segmente) und langstreckigen Myelonläsionen (≥ 3 Segmente) unterschieden [9].
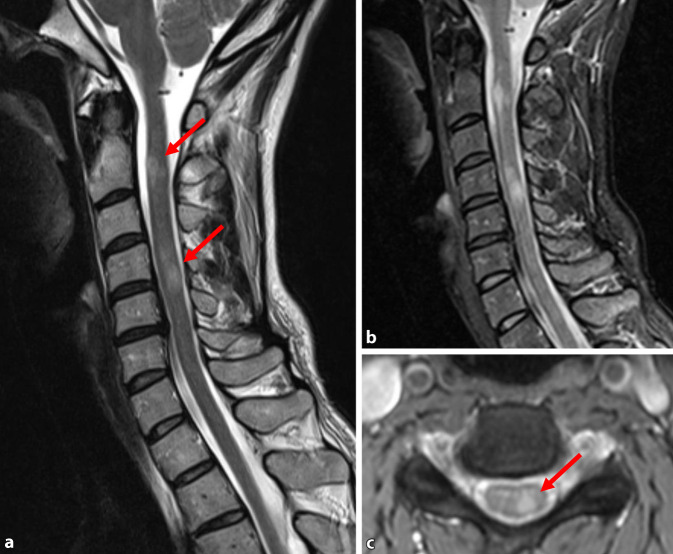
Multiple Sklerose ist die häufigste Ursache für kurzstreckige Rückenmarksläsionen [31]. MS-Läsionen des Rückenmarks sind häufig peripher, d. h. nicht zentral im Myelon lokalisiert (Abb. 3). Im Vergleich zu Hirnläsionen sind Rückenmarksläsionen bei MS laut aktueller Studienlage mit einer schlechteren Prognose assoziiert [54]. Seiten- und Hinterstränge sind am häufigsten betroffen; spinale MS-Läsionen sind häufig multifokal und meist zervikal lokalisiert [14]. Das Fehlen einer meningealen Beteiligung sowie axialer Ausbreitung bei MS erleichtert die Abgrenzung gegen andere demyelinisierende Erkrankungen [14]. Kurzstreckige T2w-Läsionen können allerdings auch bei anderen immunvermittelten Erkrankungen auftreten – entweder zusätzlich zu langstreckigen Läsionen, z. B. als Residuum einer stattgehabten langstreckigen Myelitis oder bei zu früher (Stunden bis Tage) oder zu später (> 3 Monate) MRT-Aufnahme derselben [4, 35]. Hier kann die Kontrastmittelaufnahme Aufschluss über den Zeitpunkt der Bildgebung im Krankheitsgeschehen geben. Bei ADEM sind die spinalen Läsionen eher unspezifisch; kurz- und langstreckige Läsionen mit Ödem können auftreten [92].
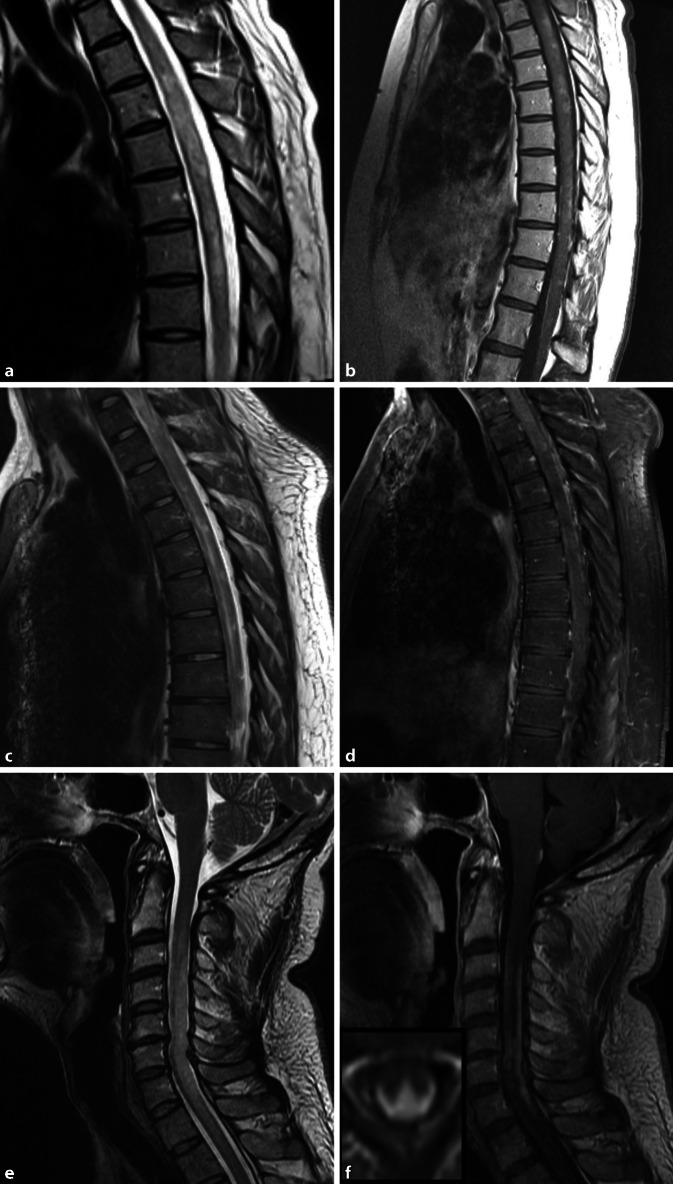
Die longitudinale extensive transverse Myelitis (LETM) wird häufig als Kerncharakteristikum der NMOSD genannt [105]. Und in der Tat treten diese – häufig bis zur Area postrema oder zum Konus ausgedehnten – Läsionen besonders häufig bei AQP4-IgG-seropositiver NMOSD und MOGAD auf (Abb. 4a, b; [105]). Auf der axialen Aufnahme sind die Läsionen häufig zentral lokalisiert und transversal (> 50 % der Querschnittsfläche; Abb. 3b, c Bild-in-Bild; [18]). Die schwere Inflammation verursacht ein ausgedehntes Ödem sowie eine inhomogene Kontrastmittelaufnahme [73]. Bildgebende Unterschiede zwischen AQP4-IgG- und MOG-IgG-seropositiven Patienten werden diskutiert: AQP4-IgG-seropositive NMOSD scheinen häufiger mit intramedullären kleinen Läsionen aufzufallen, die in T2-gewichteten Sequenzen heller als Liquor erscheinen („bright spotty lesions“) und zeigen im Gegensatz zur MOGAD (aber nicht MS) häufig eine ringförmige Kontrastmittelaufnahme [106, 110]. MOG-IgG-seropositive Myelitiden indes betreffen häufiger den Konus und zeigen in ca. einem Drittel der Fälle eine Kombination aus linearer T2-Hyperintensität mit einem umgebendem diffusen T2-hyperintensen Signal in der sagittalen Aufnahme und einer H‑förmigen Hyperintensität mit Beteiligung der grauen Substanz in der axialen Aufnahme [24, 27].
Paraneoplastische Myelonläsionen sind häufig KM-aufnehmend und symmetrisch
Longitudinale extensive transverse Rückenmarksläsionen treten nicht nur bei NMOSD auf: Bis zu 20 % der GFAP-IgG-seropositiven Patienten zeigen ausgedehnte longitudinal-transversale Läsionen, die jedoch meist deutlich weniger ödematös sind und häufig eine leptomeningeale Kontrastmittelaufnahme sowie in ca. 20 % eine lineare Kontrastmittelaufnahme entlang des Zentralkanals aufweisen (Abb. 4c, d; [26]). Häufig fehldiagnostiziert werden auch längerstreckige Läsionen bei Patienten mit Neurosarkoidose [65]. Die Läsionen zeigen eine intensive subpiale und leptomeningeale Kontrastmittelaufnahme (Abb. 4e, f; [65]). Die Kontrastmittelaufnahme bleibt bei einer Neurosarkoidose im Vergleich relativ lange (> 6 Monate) erhalten [65]. Das typische MRT-Charakteristikum der spinalen Sarkoidose, das sog. Dreizack-Zeichen („trident sign“), kann differenzialdiagnostisch hilfreich sein, insbesondere bei der Abgrenzung der Neurosarkoidose von einer NMOSD [109].
Longitudinale Läsionen, die sich auf bestimmte Trakte (insbesondere lateral) beschränken, sind ein Charakteristikum paraneoplastischer Rückenmarkserkrankungen, sollten jedoch – insbesondere in der Differenzialdiagnostik chronisch-progressiver Symptome – gegen diverse nichtimmunvermittelte Ätiologien abgegrenzt werden, u. a. Mangelerkrankungen (z. B. Vitamin B12), toxische (z. B. Heroin, Methotrexat, Cytarabin) und infektiöse Ursachen (z. B. humanes Immundefizienzvirus [HIV]) sowie mitochondriale Erkrankungen (z. B. Leber’s) und hereditäre Syndrome (z. B. spinozerebelläre Ataxien; [34, 57]). Paraneoplastische Myelonläsionen sind häufig kontrastmittelaufnehmend und symmetrisch (Eulenaugen), die Abgrenzung gegenüber einer ischämischen Ätiologie ist dann ebenfalls wichtig [34].
Ein ergänzendes kraniales MRT kann je nach Verdachtsdiagnostik sinnvoll sein. So kann es u. a. die Differenzialdiagnostik zwischen MS, AQP4-IgG-seropositiver NMOSD und MOGAD (kleine und/oder unspezifische Läsionen) und ADEM (schlecht abgrenzbare und ausgedehnte Läsionen überwiegend der juxtakortikalen weißen und tiefen grauen Substanz, vergleichsweise nur wenige periventrikuläre Läsionen) erleichtern [38, 86]. Bei GFAP-IgG-seropositiven Patienten zeigt sich oft eine charakteristische linear radiäre periventrikuläre Kontrastmittelaufnahme – ähnlich zum spinalen MRT. Eine basale leptomeningeale Kontrastmittelaufnahme ist hinweisend auf eine Neurosarkoidose, kann aber seltener auch bei NMOSD auftreten [3].
Untersuchung von Serum und Liquor
Die Serum- und Liquoranalysen variieren stark je nach bestehenden Verdachts- und Differenzialdiagnosen und sollten sich zunächst auf den Ausschluss infektiöser Ursachen (z. B. je nach Differenzialdiagnose starke Pleozytose, niedrige Glukose oder hohes Laktat), Mangelsyndrome (insbesondere Vitamin B12, Vitamin E, Kupfer) und vaskulärer Risikofaktoren fokussieren, um die potenziell immunvermittelte Genese weiter abzusichern [40]. Auch der Ausschluss eines Lymphoms (z. B. Differenzialblutbild, Blutsenkungsgeschwindigkeit, Laktat-Dehydrogenase) sollte erfolgen [36]. Im Serum sind Neurofilamentleichtketten oft ebenfalls unspezifisch erhöht; im Schub deutet ein deutlicher Anstieg von GFAP eher auf AQP4-IgG-seropositive NMOSD und von Tau eher auf MOGAD hin [42, 56, 100]. Beim Verdacht auf die eher seltene atopische Myelitis wäre der Nachweis eines erhöhten IgE-Spiegels und einer Hypereosinophilie zu erwarten [72].
Im Liquor sind eine lymphozytäre Pleozytose und ein leicht erhöhtes Gesamtprotein typisch für eine immunvermittelte Myelitis, aber nicht für eine spezifische Genese wegweisend. Während sich bei Multipler Sklerose typischerweise eine milde Lymphozytose findet (< 50/μl), weisen höhere Leukozytenzahlen auf atypische MS-Varianten und andere Ätiologien hin [63]. Eine deutliche Lymphozytose und erhöhtes Gesamtprotein mit reduzierter Glukose und ein erhöhter löslicher Interleukin-2(IL2)-Rezeptor-Spiegel können auf eine Sarkoidose hindeuten [28, 30]. Oligoklonale Banden (OKB) im Liquor sind bei ca. 85 % der MS-Patienten zu finden und meist persistierend [22]. Im Gegensatz dazu sind nur bei ca. jedem 5. NMOSD-Patienten OKB nachweisbar, bei ADEM-Patienten sind OKB meist nur transient nachweisbar [49].
Der Antikörpernachweis ist oft der entscheidende Schritt zur Diagnose
Zum Nachweis antikörpervermittelter Myelitiden und ZNS-Erkrankungen ist der Antikörpernachweis oft der entscheidende Schritt zur Diagnose. Hier kann bei initial negativem Testergebnis eine erneute Antikörpertestung im Verlauf sinnvoll sein [52]. AQP4-IgG sind ein sensitiver und hochspezifischer Marker für NMOSD, die zellbasierten Assays sind der Immunohistochemie oder Durchflusszytometrie für die Testung vorzuziehen und haben eine Spezifität bis zu 100 % [101]. MOG-IgG weisen auf die seit Kurzem als eigenständiges Krankheitsbild definierte MOGAD hin. Auch für MOG-IgG sind zellbasierte Assays anderen Methoden vorzuziehen und erreichen eine gute Reproduzierbarkeit; idealerweise sollte dennoch sofern möglich aufgrund variabler Ergebnisse eine Validierung in einem unabhängigen Test erfolgen [79].
Das Manifestationsspektrum der MOG-IgG-assoziierten Erkrankung ist noch nicht vollständig geklärt und umfasst u. a. vormals als NMOSD oder ADEM, seltener jedoch als MS charakterisierte Patientengruppen [20]. Im Gegensatz zu AQP4-IgG-seropositiver NMOSD ist das Geschlechterverhältnis der MOG-IgG-seropositiven Patienten ausgeglichen [39, 51]. Die weitere klinische Abgrenzung der Erkrankung von AQP4-IgG-seropositiver NMOSD, aber auch insbesondere von MS sowie evidenzbasierte Therapieentscheidungen erfordern weitere, v. a. longitudinale Studien [68, 90]. Von GFAP-assoziierten autoimmun-inflammatorischen ZNS-Syndromen sind insbesondere Patienten um das 40. Lebensjahr betroffen – die Geschlechterverteilung ist ausgeglichen [48]. Der Antikörper richtet sich zumeist gegen das intrazelluläre αGFAP und ist daher höchstwahrscheinlich nicht direkt pathogen [103]. GFAP-IgG selbst lassen sich im Serum bei ca. 45 % der Patienten und im Liquor bei ca. 92 % der Patienten nachweisen; der Antikörpernachweis im Liquor ist außerdem spezifischer [26, 48]. Bis zu 50 % der Patienten sind jedoch zusätzlich seropositiv für AQP4- oder N‑Methyl-D-Aspartat-Rezeptor-IgG und ca. 30 % der Patienten leiden unter einer Tumorerkrankung – am häufigsten sind Ovarialteratome [26, 48].
Auch für paraneoplastische Rückenmarksbeteiligung ist der Ak-Nachweis entscheidend
Neben AQP4-IgG, MOG-IgG und GFAP-IgG ist der Nachweis von Antikörpern insbesondere für paraneoplastische Rückenmarksbeteiligung entscheidend. Häufig sind insbesondere Antikörper gegen Amphiphysin (z. B. assoziiert mit kleinzelligem Bronchialkarzinom oder Mammakarzinom; [75]), „collapsin response-mediator protein 5“ (z. B. assoziiert mit kleinzelligem Bronchialkarzinom oder Thymom; [107]) und Anti-Hu (z. B. assoziiert mit kleinzelligem Bronchialkarzinom; [88]), doch auch NMOSD kann paraneoplastisch auftreten [89] und andere Antikörper sind beschrieben (Tab. 1). Weiterhin sollte beim Verdacht auf eine rheumatologische Grunderkrankung (Tab. 2) ein erweitertes Antikörperscreening erfolgen, z. B. beim Verdacht auf Antiphospholipidsyndrom (Lupus-Antikoagulans, Anti-Cardiolipin-Antikörper, Anti-β2-Glykoprotein 1-Antikörper; [84]), Sjögren (SS‑A, SS‑B; [23]), systemischer Lupus erythematodes (antinukleäre Antikörper, Anti-dsDNA-Antikörper; [12]) oder systemische Sklerose (antinukleäre Antikörper [ANA], Anti-Scl-70, Antizentromerantikörper [ACA], Anti-RNA-Polymerase II, III; [6]). Interessanterweise können beim Auftreten von SLE- oder Sjögren-Syndrom-assoziierten Myelitiden häufig zusätzlich AQP4-IgG nachgewiesen werden [99].
Gewebebiopsien und weiterführende Diagnostik
Rückenmarksbiopsien sollten aufgrund des relativ hohen prozeduralen Risikos wenn möglich vermieden werden. So beschränkt sich die Indikation zur Biopsie heute meist auf Patienten mit schweren Myelitiden unklarer Genese – nach vollständiger bildgebender und paraklinischer (inklusive Antikörper‑)Diagnostik – und beim Verdacht auf ein intraspinales Lymphom [10, 83].
Eine seltene, aber wichtige immunvermittelte Differenzialdiagnose der spinalen Raumforderung ist das IgG4-Syndrom, eine fibrös-entzündliche Erkrankung, die meist tumefaktische Läsionen an multiplen Lokalisationen bildet [104]. Im spinalen MRT geht diese Raumforderung häufig mit einer Duraverdickung und Pachymeningitis einher: Ein erhöhter IgG4- und IgE-Spiegel im Serum ist häufig, aber nicht zwingend vorhanden. Die Histologie zeigt ein dichtes lymphoplasmatisches Infiltrat, eine irreguläre Fibrose und obliterierende Phlebitis [25]. Meist geht die neurologische Symptomatik mit allergieähnlichen Zusatzsymptomen und Gewichtsverlust einher. Durch den multifokalen Befall kann die Biopsie meist extraspinal erfolgen. Extraspinale Biopsien sind bei erschwerter Diagnosefindung auch für andere Erkrankungen des rheumatologischen Formenkreises üblich, z. B. bei Sjögren-Syndrom [33]. Auch hier sollte die nichtinvasive Diagnostik anderer nicht-neurologischer Organsysteme priorisiert werden.
Bei paraneoplastischer Myelitis steht die Diagnostik und Therapie der Tumorerkrankung im Vordergrund. Insbesondere bei MS, NMOSD und MOGAD und auch beim Verdacht auf eine Uveitis im Rahmen rheumatologischer Ätiologien ist zur weiteren Differenzierung eine neuroophthalmologische Untersuchung sinnvoll [8, 85]. Diese kann z. B. visuell-evozierte Potenziale und optische Kohärenztomographie einschließen, die Aufschluss über frühere Sehnervenentzündungen oder einen chronischen demyelinisierenden und/oder neurodegenerativen Prozess geben können [69, 74, 82].
Fazit für die Praxis
In der letzten Dekade hat sich das Spektrum immunvermittelter Myelitiden, aber auch das diagnostische Methodenspektrum stark erweitert.
Neben der Multiplen Sklerose als typische kurzstreckige Myelitis und Neuromyelitis-optica-Spektrum-Erkrankungen (NMOSD) als typische langstreckige Myelitis sind eher seltene, aber wichtige Differenzialdiagnosen zu beachten.
Die magnetresonanztomographische Bildgebung sowie die Antikörper- und Liquordiagnostik sind hierbei die entscheidenden differenzialdiagnostischen Methoden und legen den Grundstein für eine schnellstmögliche Therapie und damit ein besseres Patientenoutcome.
Einhaltung ethischer Richtlinien
Interessenkonflikt
F. C. Oertel: Forschungsgelder von der American Academy of Neurology (AAN) und National Multiple Sclerosis Society (NMSS) (nicht im Zusammenhang mit diesem Artikel). M. Scheel: keine externe Finanzierung. C. Chien: Forschungsgelder von Novartis (nicht im Zusammenhang mit diesem Artikel). A. Bischof: keine externe Finanzierung. C. Finke: keine externe Finanzierung. F. Paul: wissenschaftlicher Beirat für Novartis; Vortragshonorar/Reisekosten von Bayer, Novartis, Biogen Idec, Teva, Sanofi-Aventis/Genzyme, Merck Serono, Alexion, Chugai, MedImmune, und Shire; akademischer Editor für PLoS ONE; Associate Editor für Neurology® Neuroimmunology & Neuroinflammation; wissenschaftliche Konsultation for SanofiGenzyme, Biogen Idec, MedImmune, Shire, und Alexion; Forschungsgelder von Bayer, Novartis, Biogen Idec, Teva, Sanofi-Aventis/Genzyme, Alexion, Merck Serono, Viela Bio, Deutsche Forschungsgemeinschaft, Werth Stiftung der Stadt Köln, Deutsches Ministerium für Bildung und Forschung, Arthur Arnstein Stiftung Berlin, EU FP7 Framework Program, Arthur Arnstein Stiftung Berlin, Guthy Jackson Charitable Foundation, und National Multiple Sclerosis (USA) (nicht im Zusammenhang mit diesem Artikel).
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Agmon-Levin N, Kivity S, Szyper-Kravitz M, Shoenfeld Y. Transverse myelitis and vaccines: a multi-analysis. Lupus. 2009;18:1198–1204. doi: 10.1177/0961203309345730. [DOI] [PubMed] [Google Scholar]
- 2.Al-Araji A, Kidd DP. Neuro-Behçet’s disease: epidemiology, clinical characteristics, and management. Lancet Neurol. 2009;8:192–204. doi: 10.1016/S1474-4422(09)70015-8. [DOI] [PubMed] [Google Scholar]
- 3.Asgari N, Flanagan EP, Fujihara K, et al. Disruption of the leptomeningeal blood barrier in neuromyelitis optica spectrum disorder. Neurol Neuroimmunol Neuroinflammation. 2017;4:e343. doi: 10.1212/NXI.0000000000000343. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Asgari N, Skejoe HPB, Lillevang ST, et al. Modifications of longitudinally extensive transverse myelitis and brainstem lesions in the course of neuromyelitis optica (NMO): a population-based, descriptive study. BMC Neurol. 2013;13:33. doi: 10.1186/1471-2377-13-33. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Asseyer S, Schmidt F, Chien C, et al. Pain in AQP4-IgG-positive and MOG-IgG-positive neuromyelitis optica spectrum disorders. Mult Scler J Exp Transl Clin. 2018 doi: 10.1177/2055217318796684. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Averbuch-Heller L, Steiner I, Abramsky O. Neurologic manifestations of progressive systemic sclerosis. Arch Neurol. 1992;49:1292–1295. doi: 10.1001/archneur.1992.00530360094024. [DOI] [PubMed] [Google Scholar]
- 7.Bakshi J, Segura BT, Wincup C, Rahman A. Unmet needs in the pathogenesis and treatment of systemic lupus erythematosus. Clin Rev Allergy Immunol. 2018;55:352–367. doi: 10.1007/s12016-017-8640-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Balcer LJ, Balk LJ, Brandt AU, et al. The international multiple sclerosis visual system consortium: advancing visual system research in multiple sclerosis. J Neuroophthalmol. 2018;38:494–501. doi: 10.1097/WNO.0000000000000732. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Beh SC, Greenberg BM, Frohman T, Frohman EM. Transverse myelitis. Neurol Clin. 2013;31:79. doi: 10.1016/j.ncl.2012.09.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Beume L-A, Wolf K, Urbach H, et al. Primary intraspinal non-Hodgkin’s lymphoma: case report and review of literature. J Clin Neurosci. 2019;61:262–264. doi: 10.1016/j.jocn.2018.11.046. [DOI] [PubMed] [Google Scholar]
- 11.Billi AC, Kahlenberg JM, Gudjonsson JE. Sex bias in autoimmunity. Curr Opin Rheumatol. 2019;31:53–61. doi: 10.1097/BOR.0000000000000564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Birnbaum J, Petri M, Thompson R, et al. Distinct subtypes of myelitis in systemic lupus erythematosus. Arthritis Rheum. 2009;60:3378–3387. doi: 10.1002/art.24937. [DOI] [PubMed] [Google Scholar]
- 13.Bolla G, Disdier P, Verrot D, et al. Acute transverse myelitis and primary urticarial vasculitis. Clin Rheumatol. 1998;17:250–252. doi: 10.1007/BF01451059. [DOI] [PubMed] [Google Scholar]
- 14.Bot JCJ, Barkhof F, Polman CH, et al. Spinal cord abnormalities in recently diagnosed MS patients: added value of spinal MRI examination. Neurology. 2004;62:226–233. doi: 10.1212/wnl.62.2.226. [DOI] [PubMed] [Google Scholar]
- 15.Brazis PW, Masdeu JC, Biller J. Localization in clinical neurology. 2012. [Google Scholar]
- 16.Bürk K, Farecki M-L, Lamprecht G, et al. Neurological symptoms in patients with biopsy proven celiac disease. Mov Disord. 2009;24:2358–2362. doi: 10.1002/mds.22821. [DOI] [PubMed] [Google Scholar]
- 17.Chan KH, Vernino S, Lennon VA. ANNA-3 anti-neuronal nuclear antibody: marker of lung cancer-related autoimmunity. Ann Neurol. 2001;50:301–311. doi: 10.1002/ana.1127. [DOI] [PubMed] [Google Scholar]
- 18.Chien C, Scheel M, Schmitz-Hübsch T, et al. Spinal cord lesions and atrophy in NMOSD with AQP4-IgG and MOG-IgG associated autoimmunity. Mult Scler. 2018 doi: 10.1177/1352458518815596. [DOI] [PubMed] [Google Scholar]
- 19.Cobo-Calvo A, Ayrignac X, Kerschen P, et al. Cranial nerve involvement in patients with MOG antibody-associated disease. Neurol Neuroimmunol Neuroinflammation. 2019;6:e543. doi: 10.1212/NXI.0000000000000543. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cobo-Calvo Á, d’Indy H, Ruiz A, et al. Frequency of myelin oligodendrocyte glycoprotein antibody in multiple sclerosis: a multicenter cross-sectional study. Neurol Neuroimmunol Neuroinflammation. 2020 doi: 10.1212/NXI.0000000000000649. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Davis SL, Wilson TE, White AT, Frohman EM. Thermoregulation in multiple sclerosis. J Appl Physiol. 2010;109:1531–1537. doi: 10.1152/japplphysiol.00460.2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Deisenhammer F, Zetterberg H, Fitzner B, Zettl UK. The cerebrospinal fluid in multiple sclerosis. Front Immunol. 2019;10:726. doi: 10.3389/fimmu.2019.00726. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Delalande S, de Seze J, Fauchais A-L, et al. Neurologic manifestations in primary Sjögren syndrome: a study of 82 patients. Medicine. 2004;83:280–291. doi: 10.1097/01.md.0000141099.53742.16. [DOI] [PubMed] [Google Scholar]
- 24.Denève M, Biotti D, Patsoura S, et al. MRI features of demyelinating disease associated with anti-MOG antibodies in adults. J Neuroradiol. 2019;46:312–318. doi: 10.1016/j.neurad.2019.06.001. [DOI] [PubMed] [Google Scholar]
- 25.Deshpande V, Zen Y, Chan JK, et al. Consensus statement on the pathology of IgG4-related disease. Mod Pathol. 2012;25:1181–1192. doi: 10.1038/modpathol.2012.72. [DOI] [PubMed] [Google Scholar]
- 26.Dubey D, Hinson SR, Jolliffe EA, et al. Autoimmune GFAP astrocytopathy: prospective evaluation of 90 patients in 1 year. J Neuroimmunol. 2018;321:157–163. doi: 10.1016/j.jneuroim.2018.04.016. [DOI] [PubMed] [Google Scholar]
- 27.Dubey D, Pittock SJ, Krecke KN, et al. Clinical, radiologic, and prognostic features of myelitis associated with myelin oligodendrocyte glycoprotein autoantibody. JAMA Neurol. 2019;76:301. doi: 10.1001/jamaneurol.2018.4053. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Durel C-A, Marignier R, Maucort-Boulch D, et al. Clinical features and prognostic factors of spinal cord sarcoidosis: a multicenter observational study of 20 BIOPSY-PROVEN patients. J Neurol. 2016;263:981–990. doi: 10.1007/s00415-016-8092-5. [DOI] [PubMed] [Google Scholar]
- 29.Edgar MA. Letter: nervous system involvement in ankylosing spondylitis. Br Med J. 1974;1:394. doi: 10.1136/bmj.1.5904.394-b. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Eurelings LEM, Miedema JR, Dalm VASH, et al. Sensitivity and specificity of serum soluble interleukin-2 receptor for diagnosing sarcoidosis in a population of patients suspected of sarcoidosis. PLoS ONE. 2019;14:e0223897. doi: 10.1371/journal.pone.0223897. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Filippi M, Rocca MA, Ciccarelli O, et al. MRI criteria for the diagnosis of multiple sclerosis: magnims consensus guidelines. Lancet Neurol. 2016;15:292–303. doi: 10.1016/S1474-4422(15)00393-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Finke C, Schmidt W, Siebert E, Ostendorf F. Etanercept-associated myelitis. Oxf Med Case Rep. 2015;2015:220–221. doi: 10.1093/omcr/omv015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Fischer A, Swigris JJ, du Bois RM, et al. Minor salivary gland biopsy to detect primary Sjögren syndrome in patients with interstitial lung disease. Chest. 2009;136:1072–1078. doi: 10.1378/chest.08-2839. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Flanagan EP, Keegan BM. Paraneoplastic myelopathy. Neurol Clin. 2013;31:307–318. doi: 10.1016/j.ncl.2012.09.001. [DOI] [PubMed] [Google Scholar]
- 35.Flanagan EP, Weinshenker BG, Krecke KN, et al. Short myelitis lesions in aquaporin-4-IgG-positive neuromyelitis optica spectrum disorders. JAMA Neurol. 2015;72:81–87. doi: 10.1001/jamaneurol.2014.2137. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Frohman EM, Wingerchuk DM. Clinical practice. Transverse myelitis. N Engl J Med. 2010;363:564–572. doi: 10.1056/NEJMcp1001112. [DOI] [PubMed] [Google Scholar]
- 37.Gastaldi M, Marchioni E, Banfi P, et al. Predictors of outcome in a large retrospective cohort of patients with transverse myelitis. Mult Scler. 2018;24:1743–1752. doi: 10.1177/1352458517731911. [DOI] [PubMed] [Google Scholar]
- 38.Geraldes R, Ciccarelli O, Barkhof F, et al. The current role of MRI in differentiating multiple sclerosis from its imaging mimics. Nat Rev Neurol. 2018;14:199–213. doi: 10.1038/nrneurol.2018.14. [DOI] [PubMed] [Google Scholar]
- 39.Gold SM, Willing A, Leypoldt F, et al. Sex differences in autoimmune disorders of the central nervous system. Semin Immunopathol. 2019;41:177–188. doi: 10.1007/s00281-018-0723-8. [DOI] [PubMed] [Google Scholar]
- 40.Goodman BP. Metabolic and toxic causes of myelopathy. Contin Minneap Minn. 2015;21:84–99. doi: 10.1212/01.CON.0000461086.79241.3b. [DOI] [PubMed] [Google Scholar]
- 41.Hamid SHM, Whittam D, Saviour M, et al. Seizures and encephalitis in myelin oligodendrocyte glycoprotein IgG disease vs aquaporin 4 IgG disease. JAMA Neurol. 2018;75:65–71. doi: 10.1001/jamaneurol.2017.3196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Häring DA, Kropshofer H, Kappos L, et al. Long-term prognostic value of longitudinal measurements of blood neurofilament levels. Neurol Neuroimmunol Neuroinflammation. 2020 doi: 10.1212/NXI.0000000000000856. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Hoffmann LA, Jarius S, Pellkofer HL, et al. Anti-Ma and anti-Ta associated paraneoplastic neurological syndromes: 22 newly diagnosed patients and review of previous cases. J Neurol Neurosurg Psychiatry. 2008;79:767–773. doi: 10.1136/jnnp.2007.118588. [DOI] [PubMed] [Google Scholar]
- 44.Höftberger R, Rosenfeld MR, Dalmau J. Update on neurological paraneoplastic syndromes. Curr Opin Oncol. 2015;27:489–495. doi: 10.1097/CCO.0000000000000222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Howard J, Trevick S, Younger DS. Epidemiology of multiple sclerosis. Neurol Clin. 2016;34:919–939. doi: 10.1016/j.ncl.2016.06.016. [DOI] [PubMed] [Google Scholar]
- 46.Hyung Seok L, Do Young K, Ha Young S, Young-Chul C, Seung Min K. Spinal cord involvement in Behçet’s disease. Mult Scler. 2016 doi: 10.1177/1352458515613642. [DOI] [PubMed] [Google Scholar]
- 47.Huynh W, Cordato DJ, Kehdi E, et al. Post-vaccination encephalomyelitis: literature review and illustrative case. J Clin Neurosci. 2008;15:1315–1322. doi: 10.1016/j.jocn.2008.05.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Iorio R, Damato V, Evoli A, et al. Clinical and immunological characteristics of the spectrum of GFAP autoimmunity: a case series of 22 patients. J Neurol Neurosurg Psychiatry. 2018;89:138–146. doi: 10.1136/jnnp-2017-316583. [DOI] [PubMed] [Google Scholar]
- 49.Jarius S, Paul F, Franciotta D, et al. Cerebrospinal fluid findings in aquaporin-4 antibody positive neuromyelitis optica: results from 211 lumbar punctures. J Neurol Sci. 2011;306:82–90. doi: 10.1016/j.jns.2011.03.038. [DOI] [PubMed] [Google Scholar]
- 50.Jarius S, Ruprecht K, Kleiter I, et al. MOG-IgG in NMO and related disorders: a multicenter study of 50 patients. Part 2: epidemiology, clinical presentation, radiological and laboratory features, treatment responses, and long-term outcome. J Neuroinflammation. 2016 doi: 10.1186/s12974-016-0718-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Jarius S, Ruprecht K, Kleiter I, et al. MOG-IgG in NMO and related disorders: a multicenter study of 50 patients. Part 1: frequency, syndrome specificity, influence of disease activity, long-term course, association with AQP4-IgG, and origin. J Neuroinflammation. 2016;13:279. doi: 10.1186/s12974-016-0717-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Jarius S, Wildemann B, Paul F. Neuromyelitis optica: clinical features, immunopathogenesis and treatment. Clin Exp Immunol. 2014;176:149–164. doi: 10.1111/cei.12271. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Jende JME, Hauck GH, Diem R, et al. Peripheral nerve involvement in multiple sclerosis: demonstration by magnetic resonance neurography. Ann Neurol. 2017;82:676–685. doi: 10.1002/ana.25068. [DOI] [PubMed] [Google Scholar]
- 54.Kearney H, Miller DH, Ciccarelli O. Spinal cord MRI in multiple sclerosis—diagnostic, prognostic and clinical value. Nat Rev Neurol. 2015;11:327–338. doi: 10.1038/nrneurol.2015.80. [DOI] [PubMed] [Google Scholar]
- 55.Kempster PA, Rollinson RD. The Lhermitte phenomenon: variant forms and their significance. J Clin Neurosci. 2008;15:379–381. doi: 10.1016/j.jocn.2007.05.002. [DOI] [PubMed] [Google Scholar]
- 56.Kim H, Lee E-J, Kim S, et al. Serum biomarkers in myelin oligodendrocyte glycoprotein antibody-associated disease. Neurol Neuroimmunol Neuroinflammation. 2020 doi: 10.1212/NXI.0000000000000708. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Kumar N. Nutritional neuropathies. Neurol Clin. 2007;25:209–255. doi: 10.1016/j.ncl.2006.11.001. [DOI] [PubMed] [Google Scholar]
- 58.Kumar N, Cohen-Gadol AA, Wright RA, et al. Superficial siderosis. Neurology. 2006;66:1144–1152. doi: 10.1212/01.wnl.0000208510.76323.5b. [DOI] [PubMed] [Google Scholar]
- 59.Leypoldt F, Eichhorn P, Saager C, et al. Successful immunosuppressive treatment and long-term follow-up of anti-Ri-associated paraneoplastic myelitis. J Neurol Neurosurg Psychiatry. 2006;77:1199–1200. doi: 10.1136/jnnp.2005.086140. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Liu Z, Jiao L, Qiu Z, et al. Clinical characteristics of patients with paraneoplastic myelopathy. J Neuroimmunol. 2019;330:136–142. doi: 10.1016/j.jneuroim.2019.03.001. [DOI] [PubMed] [Google Scholar]
- 61.McKeon A. Purkinje cell cytoplasmic autoantibody type 1 accompaniments: the cerebellum and beyond. Arch Neurol. 2011;68:1282. doi: 10.1001/archneurol.2011.128. [DOI] [PubMed] [Google Scholar]
- 62.McKeon A, Pittock SJ. Paraneoplastic encephalomyelopathies: pathology and mechanisms. Acta Neuropathol. 2011;122:381–400. doi: 10.1007/s00401-011-0876-1. [DOI] [PubMed] [Google Scholar]
- 63.Mehling M, Kuhle J, Regeniter A. 10 most commonly asked questions about cerebrospinal fluid characteristics in demyelinating disorders of the central nervous system. Neurologist. 2008;14:60–65. doi: 10.1097/NRL.0b013e31815ac523. [DOI] [PubMed] [Google Scholar]
- 64.Moskau S, Urbach H, Hartmann A, Schmidt S. Multifocal myelitis in Behçet’s disease. Neurology. 2003;60:517. doi: 10.1212/wnl.60.3.517. [DOI] [PubMed] [Google Scholar]
- 65.Murphy OC, Salazar-Camelo A, Jimenez JA, et al. Clinical and MRI phenotypes of sarcoidosis-associated myelopathy. Neurol Neuroimmunol Neuroinflammation. 2020;7:e722. doi: 10.1212/NXI.0000000000000722. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Nakamura T, Kaneko K, Watanabe G, et al. Myelin oligodendrocyte glycoprotein-IgG-positive, steroid-responsive combined central and peripheral demyelination with recurrent peripheral neuropathy. Neurol Sci. 2020 doi: 10.1007/s10072-020-04822-7. [DOI] [PubMed] [Google Scholar]
- 67.Nakashima I, Fujihara K, Endo M, et al. Clinical and laboratory features of myelitis patients with anti-neutrophil cytoplasmic antibodies. J Neurol Sci. 1998;157:60–66. doi: 10.1016/s0022-510x(98)00073-2. [DOI] [PubMed] [Google Scholar]
- 68.Narayan R, Simpson A, Fritsche K, et al. MOG antibody disease: a review of MOG antibody seropositive neuromyelitis optica spectrum disorder. Mult Scler Relat Disord. 2018;25:66–72. doi: 10.1016/j.msard.2018.07.025. [DOI] [PubMed] [Google Scholar]
- 69.Oertel FC, Zimmermann H, Paul F, Brandt AU. Optical coherence tomography in neuromyelitis optica spectrum disorders: Potential advantages for individualized monitoring of progression and therapy. EPMA J. 2018;9:21–33. doi: 10.1007/s13167-017-0123-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Ogawa R, Nakashima I, Takahashi T, et al. MOG antibody-positive, benign, unilateral, cerebral cortical encephalitis with epilepsy. Neurol Neuroimmunol Neuroinflammation. 2017;4:e322. doi: 10.1212/NXI.0000000000000322. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.O’Regan A, Berman JS, Cotton D, et al. Sarcoidosis. Ann Intern Med. 2012;156:ITC5-1. doi: 10.7326/0003-4819-156-9-201205010-01005. [DOI] [PubMed] [Google Scholar]
- 72.Osoegawa M, Ochi H, Kikuchi H, et al. Eosinophilic myelitis associated with atopic diathesis: a combined neuroimaging and histopathological study. Acta Neuropathol. 2003;105:289–295. doi: 10.1007/s00401-002-0645-2. [DOI] [PubMed] [Google Scholar]
- 73.Pekcevik Y, Mitchell CH, Mealy MA, et al. Differentiating neuromyelitis optica from other causes of longitudinally extensive transverse myelitis on spinal magnetic resonance imaging. Mult Scler J. 2015 doi: 10.1177/1352458515591069. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Petzold A, Balcer LJ, Calabresi PA, et al. Retinal layer segmentation in multiple sclerosis: a systematic review and meta-analysis. Lancet Neurol. 2017;16:797–812. doi: 10.1016/S1474-4422(17)30278-8. [DOI] [PubMed] [Google Scholar]
- 75.Pittock SJ, Lucchinetti CF, Parisi JE, et al. Amphiphysin autoimmunity: paraneoplastic accompaniments. Ann Neurol. 2005;58:96–107. doi: 10.1002/ana.20529. [DOI] [PubMed] [Google Scholar]
- 76.Pittock SJ, Yoshikawa H, Ahlskog JE, et al. Glutamic acid decarboxylase autoimmunity with brainstem, extrapyramidal, and spinal cord dysfunction. Mayo Clin Proc. 2006;81:1207–1214. doi: 10.4065/81.9.1207. [DOI] [PubMed] [Google Scholar]
- 77.Rath JJG, Ronday HK, Wirtz PW. Acute transverse myelitis in psoriatic arthritis. J Neurol. 2010;257:457–458. doi: 10.1007/s00415-009-5361-6. [DOI] [PubMed] [Google Scholar]
- 78.Ray DW, Bridger J, Hawnaur J, et al. Transverse myelitis as the presentation of Jo-1 antibody syndrome (myositis and fibrosing alveolitis) in long-standing ulcerative colitis. Br J Rheumatol. 1993;32:1105–1108. doi: 10.1093/rheumatology/32.12.1105. [DOI] [PubMed] [Google Scholar]
- 79.Reindl M, Schanda K, Woodhall M, et al. International multicenter examination of MOG antibody assays. Neurol Neuroimmunol Neuroinflammation. 2020 doi: 10.1212/NXI.0000000000000674. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 80.Richard S, Fruchtman S, Scigliano E, et al. An immunological syndrome featuring transverse myelitis, Evans syndrome and pulmonary infiltrates after unrelated bone marrow transplant in a patient with severe aplastic anemia. Bone Marrow Transplant. 2000;26:1225–1228. doi: 10.1038/sj.bmt.1702677. [DOI] [PubMed] [Google Scholar]
- 81.Rinaldi S, Davies A, Fehmi J, et al. Overlapping central and peripheral nervous system syndromes in MOG antibody-associated disorders. Neurol Neuroimmunol Neuroinflammation. 2021 doi: 10.1212/NXI.0000000000000924. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Ringelstein M, Kleiter I, Ayzenberg I, et al. Visual evoked potentials in neuromyelitis optica and its spectrum disorders. Mult Scler. 2014;20:617–620. doi: 10.1177/1352458513503053. [DOI] [PubMed] [Google Scholar]
- 83.Ringelstein M, Metz I, Ruprecht K, et al. Contribution of spinal cord biopsy to diagnosis of aquaporin-4 antibody positive neuromyelitis optica spectrum disorder. Mult Scler. 2014;20:882–888. doi: 10.1177/1352458513510981. [DOI] [PubMed] [Google Scholar]
- 84.Rodrigues CEM, de Carvalho JF. Clinical, radiologic, and therapeutic analysis of 14 patients with transverse myelitis associated with antiphospholipid syndrome: report of 4 cases and review of the literature. Semin Arthritis Rheum. 2011;40:349–357. doi: 10.1016/j.semarthrit.2010.05.004. [DOI] [PubMed] [Google Scholar]
- 85.Rodriguez A, Calonge M, Pedroza-Seres M, et al. Referral patterns of uveitis in a tertiary eye care center. Arch Ophthalmol. 1996;114:593–599. doi: 10.1001/archopht.1996.01100130585016. [DOI] [PubMed] [Google Scholar]
- 86.Salama S, Khan M, Shanechi A, et al. MRI differences between MOG antibody disease and AQP4 NMOSD. Mult Scler. 2020 doi: 10.1177/1352458519893093. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Savoldi F, Nasr Z, Hu W, et al. McArdle sign: a specific sign of multiple sclerosis. Mayo Clin Proc. 2019;94:1427–1435. doi: 10.1016/j.mayocp.2019.01.047. [DOI] [PubMed] [Google Scholar]
- 88.Sillevis Smitt P, Grefkens J, de Leeuw B, et al. Survival and outcome in 73 anti-Hu positive patients with paraneoplastic encephalomyelitis/sensory neuronopathy. J Neurol. 2002;249:745–753. doi: 10.1007/s00415-002-0706-4. [DOI] [PubMed] [Google Scholar]
- 89.Soelberg K, Larsen SR, Moerch MT, et al. Aquaporin-4 IgG autoimmune syndrome and immunoreactivity associated with thyroid cancer. Neurol Neuroimmunol Neuroinflammation. 2016;3:e252. doi: 10.1212/NXI.0000000000000252. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Spadaro M, Gerdes LA, Krumbholz M, et al. Autoantibodies to MOG in a distinct subgroup of adult multiple sclerosis. Neurol Neuroimmunol Neuroinflammation. 2016;3:e257. doi: 10.1212/NXI.0000000000000257. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Tanaka M, Matsushita T, Tateishi T, et al. Distinct CSF cytokine/chemokine profiles in atopic myelitis and other causes of myelitis. Neurology. 2008;71:974–981. doi: 10.1212/01.wnl.0000326589.57128.c3. [DOI] [PubMed] [Google Scholar]
- 92.Tenembaum S, Chitnis T, Ness J, et al. Acute disseminated encephalomyelitis. Neurology. 2007;68:S23–S36. doi: 10.1212/01.wnl.0000259404.51352.7f. [DOI] [PubMed] [Google Scholar]
- 93.Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol. 2018;17:162–173. doi: 10.1016/S1474-4422(17)30470-2. [DOI] [PubMed] [Google Scholar]
- 94.Transverse Myelitis Consortium Working Group Proposed diagnostic criteria and nosology of acute transverse myelitis. Neurology. 2002;59:499–505. doi: 10.1212/wnl.59.4.499. [DOI] [PubMed] [Google Scholar]
- 95.Tsagkas C, Magon S, Gaetano L, et al. Spinal cord volume loss: a marker of disease progression in multiple sclerosis. Neurology. 2018;91:e349–e358. doi: 10.1212/WNL.0000000000005853. [DOI] [PubMed] [Google Scholar]
- 96.Vernino S, Lennon VA. New Purkinje cell antibody (PCA-2): Marker of lung cancer–related neurological autoimmunity. Ann Neurol. 2000;47:297–305. doi: 10.1002/1531-8249(200003)47:3<297::AID-ANA4>3.0.CO;2-4. [DOI] [PubMed] [Google Scholar]
- 97.Vitaliani R, Mason W, Ances B, et al. Paraneoplastic encephalitis, psychiatric symptoms, and hypoventilation in ovarian teratoma. Ann Neurol. 2005;58:594–604. doi: 10.1002/ana.20614. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.Voortman M, Drent M, Baughman RP. Management of neurosarcoidosis: a clinical challenge. Curr Opin Neurol. 2019;32:475–483. doi: 10.1097/WCO.0000000000000684. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 99.Wandinger K-P, Stangel M, Witte T, et al. Autoantibodies against aquaporin-4 in patients with neuropsychiatric systemic lupus erythematosus and primary Sjögren’s syndrome. Arthritis Rheum. 2010;62:1198–1200. doi: 10.1002/art.27337. [DOI] [PubMed] [Google Scholar]
- 100.Watanabe M, Nakamura Y, Michalak Z, et al. Serum GFAP and neurofilament light as biomarkers of disease activity and disability in NMOSD. Neurology. 2019;93:e1299–e1311. doi: 10.1212/WNL.0000000000008160. [DOI] [PubMed] [Google Scholar]
- 101.Waters P, Reindl M, Saiz A, et al. Multicentre comparison of a diagnostic assay: aquaporin-4 antibodies in neuromyelitis optica. J Neurol Neurosurg Psychiatry. 2016;87:1005–1015. doi: 10.1136/jnnp-2015-312601. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 102.Weatherby SJ, Davies MB, Hawkins CP, et al. Transverse myelopathy, a rare complication of mixed connective tissue disease: comparison with SLE related transverse myelopathy. J Neurol Neurosurg Psychiatry. 2000;68:532–533. doi: 10.1136/jnnp.68.4.532a. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 103.Wickel J, Chung H-Y, Kirchhof K, et al. Encephalitis with radial perivascular emphasis: not necessarily associated with GFAP antibodies. Neurol Neuroimmunol Neuroinflammation. 2020 doi: 10.1212/NXI.0000000000000670. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 104.Williams MM, Mashaly H, Puduvalli VK, et al. Immunoglobulin G4–related disease mimicking an epidural spinal cord tumor: case report. J Neurosurg Spine. 2017;26:76–80. doi: 10.3171/2016.5.SPINE16119. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 105.Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology. 2015;85:177–189. doi: 10.1212/WNL.0000000000001729. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 106.Yonezu T, Ito S, Mori M, et al. “Bright spotty lesions” on spinal magnetic resonance imaging differentiate neuromyelitis optica from multiple sclerosis. Mult Scler. 2014;20:331–337. doi: 10.1177/1352458513495581. [DOI] [PubMed] [Google Scholar]
- 107.Yu Z, Kryzer TJ, Griesmann GE, et al. CRMP-5 neuronal autoantibody: marker of lung cancer and thymoma-related autoimmunity. Ann Neurol. 2001;49:146–154. doi: 10.1002/1531-8249(20010201)49:2<146::AID-ANA34>3.0.CO;2-E. [DOI] [PubMed] [Google Scholar]
- 108.Zalewski NL, Flanagan EP. Autoimmune and paraneoplastic myelopathies. Semin Neurol. 2018;38:278–289. doi: 10.1055/s-0038-1660856. [DOI] [PubMed] [Google Scholar]
- 109.Zalewski NL, Krecke KN, Weinshenker BG, et al. Central canal enhancement and the trident sign in spinal cord sarcoidosis. Neurology. 2016;87:743–744. doi: 10.1212/WNL.0000000000002992. [DOI] [PubMed] [Google Scholar]
- 110.Zalewski NL, Morris PP, Weinshenker BG, et al. Ring-enhancing spinal cord lesions in neuromyelitis optica spectrum disorders. J Neurol Neurosurg Psychiatry. 2017;88:218–225. doi: 10.1136/jnnp-2016-314738. [DOI] [PubMed] [Google Scholar]
- 111.Zekeridou A, Majed M, Heliopoulos I, Lennon VA. Paraneoplastic autoimmunity and small-cell lung cancer: neurological and serological accompaniments. Thorac Cancer. 2019;10:1001–1004. doi: 10.1111/1759-7714.13009. [DOI] [PMC free article] [PubMed] [Google Scholar]