Estimado Editor: en la infección osteoarticular (IOA) no siempre es posible la curación microbiológica y, en ocasiones, se debe anteponer preservar la funcionalidad de la estructura afecta a la curación, pues ésta puede requerir un tratamiento quirúrgico tan agresivo que podría incapacitar severamente al paciente. En estos casos el paciente recibe un tratamiento antibiótico de manera indefinida para mantener controlada la infección de tal manera que pueda mantener la función, sin dolor, denominado terapia antibiótica supresora (TAS) [1].
Dalbavancina es un antibiótico lipopéptido de administración parenteral con una gran actividad contra los cocos Gram positivos, indicado en las infecciones de piel y partes blandas. Una de sus características es su larga vida media, por lo que se administra en únicamente 1 o 2 dosis para el tratamiento de estas infecciones, lo cual permite que el paciente no precise de estar hospitalizado para poder recibir este tratamiento [2]. Esta característica tan particular hace que sea muy atractivo para tratar infecciones que requieren largos ciclos antibióticos, como la endocarditis infecciosa o la IOA, donde varios estudios han demostrado que es eficaz y segura [3-6]. Presentamos el caso de un paciente con una infección compleja de prótesis articular de cadera, en el que se optó por utilizar dalbavancina como TAS.
Se trata de un paciente de 27 años que en 2011 es diagnosticado de osteosarcoma de alto grado en fémur que se trata con resección del 1/3 proximal y medio del fémur con implantación de prótesis tumoral. En el postoperatorio desarrolla infección de la herida quirúrgica que se trata con curas locales y antibioterapia empírica. Se inicia quimioterapia que continua hasta diciembre de 2012. La evolución de la herida no es buena con aparición de fístula sobre la misma, realizándose tras finalizar la quimioterapia desbridamiento quirúrgico con retención del implante (DAIR) en donde se aísla S. epidermidis resistente a meticilina, quinolonas, cotrimoxazol, clindamicina y rifampicina. Tras antibioterapia prolongada continua con drenaje persistente por la herida, pero el paciente rechaza recambio de la prótesis en ese momento y se pauta TAS con minociclina. En 2014 es diagnosticado de carcinoma suprarrenal localizado que se trata con suprarrenolectomía y quimioterapia. Persiste fístula en la cadera y tras finalizar la quimioterapia se decide recambio de la prótesis en 2 tiempos. En los cultivos de la cirugía del primer tiempo se aísla de nuevo S. epidermidis, mientras que los del segundo tiempo son estériles. En 2016 se detectan varios implantes peritoneales que se extirpan (compatibles con metástasis de carcinoma suprarrenal) y posterior-mente se tratan con quimioterapia.
En julio de 2018 ingresa en otro centro por sepsis, identificándose absceso periprotésico. Se desestima tratamiento quirúrgico y se inicia antibioterapia empírica. En cultivo del absceso y en 1 hemocultivo se aísla otra vez S. epidermidis sensible a glucopéptidos y linezolid, pero resistente a otros antibióticos antiestafilocóccicos orales (no se testó la minociclina en esta ocasión). El paciente persiste con fiebre y es trasladado a nuestro hospital donde se procede a DAIR, continuando con anti-bioterapia parenteral. Los cultivos intraoperatorios son estériles. El paciente evoluciona de forma favorable de la infección protésica y la sepsis, aunque desarrolla anemia hemolítica autoinmune que se resuelve con esteroides. Una vez estabilizado se decide iniciar, previa solicitud como uso compasivo, TAS con dalbavancina en dosis de 1.500 mg cada 4 semanas que continua a día de hoy. Tras 2 años de TAS el paciente se mantiene sin dolor, fístula, fiebre, signos inflamatorios locales ni radio-lógicos de aflojamiento de la prótesis, es capaz de deambular sin ayudas y no ha presentado efectos adversos atribuidos al tratamiento, incluido sobreinfecciones. Actualmente mantiene también tratamiento con inmunoterapia.
En resumen, se trata de un paciente varios tumores malignos, con una infección crónica de una prótesis tumoral de revisión (figuras 1 y 2) por un microorganismo multirresistente. Dada la complejidad técnica de un nuevo recambio, la estabilidad de la prótesis, con buena funcionalidad de la misma, y el control (que no curación) del proceso infeccioso con antibioterapia se decidió optar por TAS, aunque en este caso ésta estaba limitada por las escasas opciones existentes. Se ha empleado teicoplanina en tratamientos prolongados y también como TAS, con una posología de administración entre 1 y 3 veces por semana [7]. Linezolid era un antibiótico activo, pero su uso a largo plazo está limitado por sus efectos secundarios, entre ellos hematológicos, y este paciente estaba además condicionado por la existencia de una anemia hemolítica. No se disponía de la sensibilidad de minociclina en el último ingreso y además el tratamiento con ésta ya había fracaso.
Figura 1.
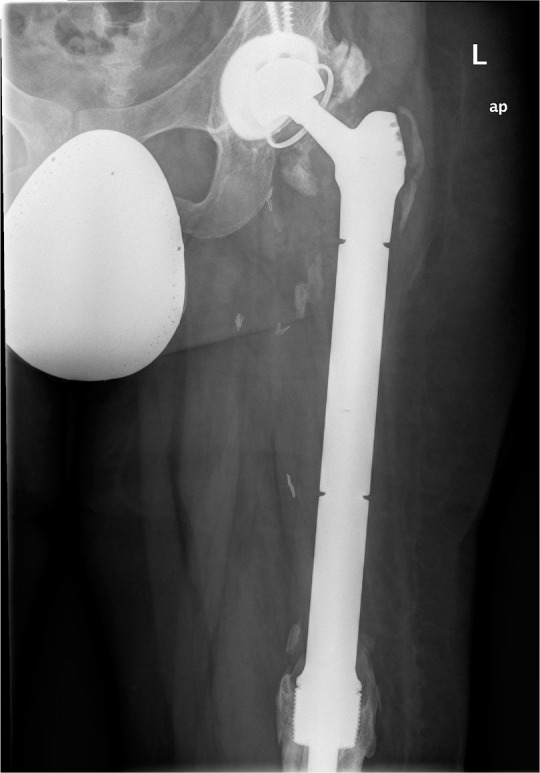
Radiografía simple ampliada: prótesis tumoral de cadera izquierda.
Figura 2.
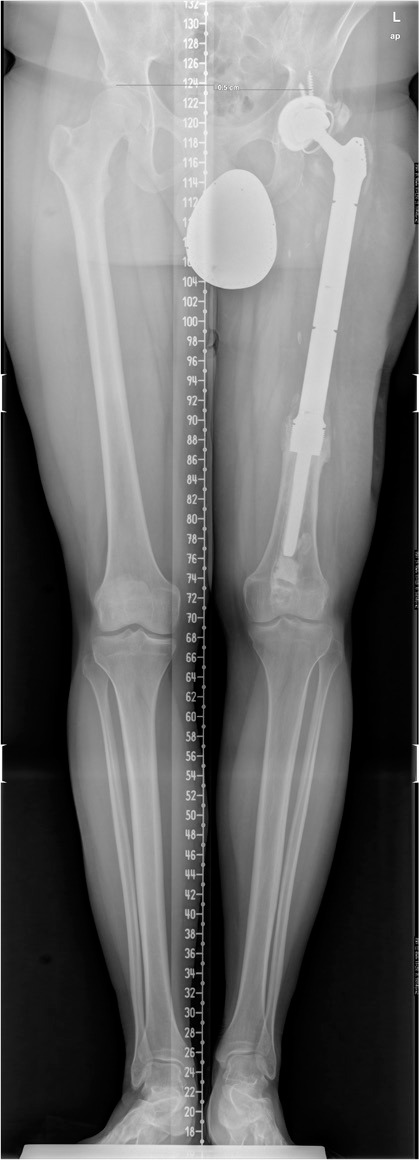
Radiografía simple: prótesis tumoral de cadera izquierda.
Dalbavancina tiene entre sus características, además de su gran actividad contra los cocos grampositivos y su larga vida media, muy buena penetración ósea. En un estudio de simulación farmacocinética, tras dos dosis de 1.500 mg se concluía que mantiene concentraciones en hueso por encima de CMI durante hasta 4 semanas [8]. Estas propiedades han hecho que se generalice su uso, de tal forma que en la vida real se utiliza más fuera de indicación que la que tiene reconocida [5]. En la IOA, aun no estando aprobada para su uso, existe ya bastante experiencia en cuanto su efectividad y seguridad [4,5]. Así, una pauta de dos dosis de 1.500 mg separadas 1 semana ha demostrado eficacia en el tratamiento de las osteomielitis [6].
De igual forma, también se ha empleado en endocarditis infecciosa, fundamentalmente como tratamiento de continuación para que el paciente no tenga que permanecer hospitalizado para completar todo el ciclo [3], pero también hay experiencias como TAS en pacientes no subsidiarios de tratamiento quirúrgico, con buenos resultados [9].
Por todos esos motivos se decidió emplear en este paciente dalbavancina en dosis mensual de 1.500 mg, con lo que se ha conseguido que durante estos 2 años el paciente se mantenga libre de sintomatología infecciosa y preserve la funcionalidad de la extremidad, sin dolor, sin haberse producido hasta el momento ningún efecto adverso.
FINANCIACIÓN
Los autores declaran que no han recibido financiación para la realización de este estudio.
CONFLICTO DE INTERESES
JMB declara haber recibido honorarios por conferencias de los laboratorios Menarini, Amgen, Boehringer Ingelheim y Angelini. El resto de autores declaran no tener ningún conflicto de interés.
References
- 1.Escudero-Sanchez R, Senneville E, Digumber M, Soriano A, Del Toro MD, Bahamonde Aet al. Suppressive antibiotic therapy in prosthetic joint infections: a multicentre cohort study. Clin Microbiol Infect 2020;26(4):499-505. doi: 10.1016/j.cmi.2019.09.007 [DOI] [PubMed] [Google Scholar]
- 2.Boucher HW, Wilcox M, Talbot GH, Puttagunta S, Das AF, Dunne MW. Once-weekly dalbavancin versus daily conventional therapy for skin infection. N Engl J Med 2014;370(23):2169-2179. doi: 10.1056/NEJMoa1310480 [DOI] [PubMed] [Google Scholar]
- 3.Tobudic S, Forstner C, Burgmann H, Lagler H, Ramharter M, Steininger Cet al. Dalbavancin as Primary and Sequential Treatment for Gram-Positive Infective Endocarditis: 2-Year Experience at the General Hospital of Vienna. Clin Infect Dis 2018;67(5):795-798. doi: 10.1093/cid/ciy279 [DOI] [PubMed] [Google Scholar]
- 4.Morata L, Cobo J, Fernández-Sampedro M, Guisado P, Ruano E, Lora-Tamayo Jet al. Safety and Efficacy of Prolonged Use of Dalbavancin in Bone and Joint Infections. Antimicrob Agents Chemother 2019;63(5):e02280-18. doi: 10.1128/AAC.02280-18 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Dinh A, Duran C, Pavese P, Khatchatourian L, Monnin B, Bleibtreu A, et al. ; Dalbavancin French Study Group . French national cohort of first use of dalbavancin: A high proportion of off-label use. Int J Antimicrob Agents 2019;54(5):668-672. doi: 10.1016/j.ijantimicag.2019.08.006. [DOI] [PubMed] [Google Scholar]
- 6.Rappo U, Puttagunta S, Shevchenko V, Shevchenko A, Jandourek A, Gonzalez PL, et al. Dalbavancin for the Treatment of Osteomyelitis in Adult Patients: A Randomized Clinical Trial of Efficacy and Safety. Open Forum Infect Dis 2018;6(1):ofy331. doi: 10.1093/ofid/ofy331 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Allen J, Adams K, Thompson F, Cullen L, Barlow G. Long-term, once-weekly outpatient teicoplanin use for suppression of chronic prosthetic joint infection. Int J Antimicrob Agents 2013;41(2):200-1. doi: 10.1016/j.ijantimicag.2012.10.006. [DOI] [PubMed] [Google Scholar]
- 8.Dunne MW, Puttagunta S, Sprenger CR, Rubino C, Van Wart S, Baldassarre J. Extended-duration dosing and distribution of dalbavancin into bone and articular tissue. Antimicrob Agents Chemother 2015; 59:1849–55. doi: 10.1128/AAC.04550-14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Spaziante M, Franchi C, Taliani G, D’Avolio A, Pietropaolo V, Biliotti E, et al. Serum Bactericidal Activity Levels Monitor to Guide Intravenous Dalbavancin Chronic Suppressive Therapy of Inoperable Staphylococcal Prosthetic Valve Endocarditis: A Case Report. Open Forum Infect Dis. 2019;6(11):ofz427. doi: 10.1093/ofid/ofz427. [DOI] [PMC free article] [PubMed] [Google Scholar]


