Abstract
Objetivos
La COVID-19 fue declarada pandemia en marzo del 2020. Han sido comunicados los hallazgos clínicos, analíticos y radiológicos. Sin embargo, la diversa evolución de pacientes del mismo brote local lo ha sido escasamente. Comunicamos en este trabajo 6 casos seleccionados de tal evolución.
Casos clínicos
Se expone la evolución clínica, radiológica y analítica de 6 pacientes. Estos fueron seleccionados ya que fueron epidemiológicamente contactos estrechos y mostraron una evolución clínica particularmente diferente.
Resultados
El curso clínico al inicio de la infección (primera semana) fue similar entre los pacientes. En relación con la evolución clínica, un curso moderado a severo se relacionó evolutivamente con marcadores elevados de inflamación (dímero D, IL-6, ferritina, linfopenia, etc.). Fueron observadas alteraciones pulmonares típicas, pero fueron comunes también hallazgos neurológicos y neuropsiquiátricos. En la evolución 2 pacientes mostraron síntomas moderados, pero los 2 más gravemente afectados murieron.
Conclusiones
Está por elucidar las diferentes vías evolutivas y resultados finales de los pacientes con COVID-19. En nuestros 6 pacientes del mismo brote local, las características clínicas, de laboratorio y radiológicas fueron diferentes. Discutimos aspectos de la fisiopatología de la enfermedad distintos de los ampliamente descritos del sistema respiratorio.
Palabras clave: Coronavirus, COVID-19, Brote epidémico, Complicaciones, UCI
Abstract
Objectives
COVID-19 was declared pandemic by March 2020. Clinical, analytical, and radiological findings have been reported. Detailed different evolution of patients of the same local outbreak has been scarcely reported. We report 6 selected cases of such an evolution.
Clinical cases
The clinical, radiological, analytical evolution of 6 patients is reported. Patients were selected as it were epidemiological close contacts, and showed particular different clinical evolution.
Results
The clinical course at the start of infection (first week) was similar among patients. In relationship with clinical evolution, middle to severe course were related with inflammation markers levels evolution (D-dimer, IL-6, ferritin, lymphocytes count, etc.). Specially lung alterations were observed, but neurological/neuropsychiatric findings are still common. In evolution, 2 patients showed middle symptoms, but the 2 most severely affected died.
Conclusions
It remains to be elucidated the different evolutive pathways and outcomes of COVD-19. In our 6 patients of the same local outbreak, clinical, laboratory and radiological features were different. We discuss some aspects of the pathophysiology of the disease, other than the widely described of the respiratory system.
Keywords: Coronavirus, COVID-19, Outbreak, Complications, ICU
Introducción
La Organización Mundial de la Salud declaró pandemia de COVID-19 el 11 de marzo del 2020. España sigue siendo uno de los países más afectados del mundo, tanto en casos totales, casos totales por millón de habitantes, fallecidos y exceso de muertes. Marzo fue el mes con mayor incremento de casos de COVID-19, con la ocupación de unidades de Cuidados Intensivos (UCI) y camas de hospitalización al límite. Como en otros países, desde un punto de vista clínico, la gama de síntomas de los pacientes varió, la proporción de pacientes que necesitaron tratamiento en UCI fue del 14-30% y la mortalidad fue de alrededor del 3-10%1.
En esta comunicación, exponemos una serie de casos seleccionados. Intentamos subrayar los diferentes aspectos de la enfermedad en los casos de contacto cercano y enfatizar la diferente evolución de los pacientes, en adición al ampliamente descrito deterioro respiratorio.
Métodos
Presentamos una serie de casos seleccionados de pacientes con COVID-19 del mismo brote local. El Comité de Ética local consideró innecesario el consentimiento informado para la publicación.
Los pacientes iniciaron los síntomas hacia la tercera semana de marzo del 2020. Se sospechó clínicamente COVID-19 y se diagnosticó mediante reacción en cadena de la polimerasa-transcriptasa inversa (RT-PCR) al SARS-CoV-2. Las características de los pacientes, las características clínicas, la cronología del proceso diagnóstico y los resultados se muestran en la tabla 1 .
Tabla 1.
Características demográficas, síntomas y detección de la RT-PCR frente a SARS-CoV-2 y resultado final
| Demografía, antecedentes, tratamiento previo | Síntomas de inicio | Primer síntoma hasta RT-PCR+a | Primer síntoma hasta RT-PCR–a | T. desde primer síntoma hasta ingreso en hospital/UCIa | Estancia en UCIa | Estancia en hospitala | Resultado final físico/psicológico | |
|---|---|---|---|---|---|---|---|---|
| Paciente 1 | 64 años, varón, 82 kg, 176 cm, hipertensión arterial, dislipidemia, amlodipino, telmisartán, omeprazol | Fiebre, malestar, dolores musculares, cefalea, diarrea, disnea, vómitos, astenia, mareos, vértigo | 9 | 30 | 10/10 | 11 | 44 | Microtrombos en arterias pulmonares que precisaron dosis terapéuticas de HBPM, pérdida de peso, fatiga/sensación de estar muy mal, SDPTb |
| Paciente 2 | 63 años, varón, 65 kg, 172 cm, hipertensión arterial, dislipidemia, asma, amlodipino, atorvastatina, prednisona, budesonida, formoterol | Fiebre, tos seca, astenia, fatiga, disnea, palpitaciones, mareos, vértigo | 7 | 23 | 9/11 | 17 | 30 | Pérdida de peso, palpitaciones, fatiga, insomnio/sensación de estar muy mal, SDPTb Quetiapina |
| Paciente 3 | 61 años, mujer, 65 kg, 158 cm, osteoporosis, vitamina D | Fiebre, malestar, cefalea, diarrea, náuseas, mareo discreto (todos de corta duración), anosmia, ageusia | 5 | 20 | NA | 23 | NA | Sin secuelas |
| Paciente 4 | 57 años, mujer, 70 kg, 160 cm, fumadora moderada, hipotiroidismo, levotiroxina | Fiebre, anosmia, ageusia | NA | NA | NA | 36 | NA | Sin secuelas |
| Paciente 5 | 63 años, varón, 90 kg, 160 cm, hipertensión arterial, losartán, atorvastatina | Tos, fiebre, malestar | 10 | 23 | 10/10 | 61 | NA | Traqueostomía, neumotórax bilateral, toracotomía, fallecimiento |
| Paciente 6 | 74 años, varón, hipertensión arterial, tromboembolia pulmonar, dislipidemia, candesartán, hidroclorotiazida, alopurinol | Tos, fiebre, mareos, mialgias | 7 | NAc | 7/10 | 60 | NA | Traqueostomía, fallecimiento |
Los pacientes 1 y 3 y los pacientes 2 y 4 eran pareja, los pacientes 5 y 6 fallecieron en la UCI.
NA: no aplicable; HBPM: heparina de bajo peso molecular; RT-PCR: transcriptasa inversa-reacción en cadena de la polimerasa; SDPT: síndrome de distrés postraumático.
En días.
Véase el texto para explicaciones adicionales.
Permaneció positivo hasta el deceso.
Los pacientes 1 y 3, y 2 y 4, respectivamente, eran pareja. El paciente 6 era un amigo cercano del paciente 1, con el que estuvo en contacto los días previos al inicio de los síntomas. El curso clínico y los hallazgos del paciente 5 se aportan debido a la especial gravedad y porque compartió una celebración con varias personas, algunas de las cuales presentaban formas leves o moderadas de COVID-19.
Resultados
En la tabla 2 se muestran las características evolutivas de los 4 pacientes que ingresaron en la UCI. La tabla 3 muestra algunos de los procedimientos y el curso clínico en la UCI y la tabla 4 muestra una descripción parcial de los procedimientos diagnósticos de imagen (con detalles en las Figura 1, Figura 2, Figura 3, Figura 4, Figura 5, Figura 6, Figura 7 ).
Tabla 2.
Datos de los análisis de los 4 pacientes ingresados en UCI. Los pacientes 1 y 2 fueron los que sobrevivieron, los pacientes 5 y 6 fallecieron en la UCI
| Paciente 1 | Paciente 2 | Paciente 5 | Paciente 6 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemoglobina (g/dl) | 12,9 | 9,7 | <* a | 15 | 12,2 | = | 14,3 | 6,5 | < | 12,6 | 7,6 | < |
| Leucocitos (× 109/l) | 2,3 | 20,4 | > | 6,6 | 10,2 | > | 6,2 | 23,5 | > | 9,8 | 14,1 | = |
| Neutrófilos (× 109/l) | 1,9 | 18 | > < | 4,8 | 1,8 | > | 4,3 | 10,5 | > | 9,2 | 13 | = |
| Linfocitos (× *109/l) | 0,29 | 0,52 | < > | 1,3 | 0,2 | < | 1,4 | 0,2 | < | 1,4 | 0,1 | < |
| Plaquetas (× 109/l) | 128 | 84 | = | 129 | 147 | = | 212 | 67 | = | 209 | 77 | <a |
| Índice Quick (%) | – | 81 | = | 93 | 65 | = | 73 | 69 | = | 90 | 55 | = |
| INR | – | 1,15 | = | 1,06 | – | = | 1,22 | 1,23 | = | 1 | 1,46 | = |
| Fibrinógeno (mg/dl) | – | 354 | = | 700 | 147 | = | 568 | 734 | > | 400 | 93 | < > |
| Dímero D (ng/ml) | 643 | 15331 | > | 284 | 912 | > | 200 | 8548 | > | 258 | 6100 | > |
| Glucosa (mg/dl) | 117 | 117 | = | 117 | 140 | = | 186 | 325 | > | 148 | 270 | > |
| Na (mEq/l) | 136 | 145 | = | 130 | 140 | = | 136 | 149 | = | 140 | 162 | > |
| K (mEq/l) | 3,7 | 4 | = | 4,1 | 3,8 | = | 3,3 | 3,1 | < | 3,9 | 5,1 | = |
| Bilirrubina (mg/dl) | – | 0,67 | = | 0,49 | 1 | = | 0,63 | 1,11 | = | 0,59 | 0,98 | = |
| AST (U/l) | 32 | 28 | = | 22 | 150 | = | 41 | 2587 | >b | 82 | 111 | >a |
| ALT (U/l) | 99 | 160 | >a | – | 81 | = | 39 | 2679 | >b | 100 | 100 | > < |
| GGT (U/l) | – | – | – | – | – | – | 231 | 438 | > | 67 | 300 | > |
| Urea (mg/dl) | 46 | 66 | = | 29 | 86 | = | 16 | 58 | >a | 119 | 164 | = |
| Creatinina (mg/dl) | 1,22 | 0,86 | = | 0,94 | 0,7 | = | 0,71 | 1,67 | >a | 1,3 | 1,37 | = |
| Ferritina (μg/l) | 675 | 207 | – | 721 | 683 | > | 200 | 16775 | > | 394 | 2000 | > |
| LDH (U/l) | 584 | 505 | > | 532 | 618 | >a | 488 | 1135 | > | 737 | 208 | > |
| Albúmina (g/dl) | 3,6 | 3 | <a | – | 3 | <a | 4,2 | 2 | < | 2,8 | 2 | < |
| Lactato (mEq/l) | 1 | 1,1 | = | 0,8 | 0,7 | = | 0,8 | 2 | = | 2 | 2,8 | = |
| Procalcitonina (ng/ml) | 0,16 | 0,11 | = | 0,54 | 0,51 | = | 0 | > | >b | 0,33 | 1,77 | >b |
| Troponina I US (mg/dl) | 6,6 | 9,78 | > | 7 | 60 | >a | 20 | 1251 | = | 12 | 121 | > |
| Proteína C reactiva (mg/dl) | 2,1 | 5,1 | = | 7,4 | 1,7 | >a | 9 | 45,2 | = | 28,3 | 38 | > |
| Interleucina 6 (ng/ml) | 9,8 | 20,8 | > | – | – | – | – | 9c | – | – | 7c | – |
Los pacientes 3 y 4 no ingresaron en el hospital y en ellos no se realizó análisis de sangre ni radiología.
Los datos mostrados son al ingreso en el hospital, peor resultado (nadir) y tendencia general del dato (si esta se mantenía más de 5 días consecutivos). INR: cociente internacional normalizado (international normalized ratio). Na: sodio. K: potasio. AST: aspartatot aminotransferasa. ALT: alaninaaminotransferasa. GGT: Gamma-glutariltranspeptidasa. LDH: lactatodeshidrogenasa. Troponina I US: troponina I ultrasensible.
=: en rango normal; >: predominantemente mayor que el rango normal; <: predominantemente inferior al rango normal.
Significa «moderada».
Significa incremento diferido en el tiempo (sepsis concurrente habitualmente debida a una coinfección bacteriana).
Determinación aislada.
Tabla 3.
Detalles de estancia en UCI
| Fecha de ingreso | PaFi 1 | Fecha intubación | PaFi 2 | Prono | PaFi 3 | Fecha extubación | PaFi 4 | Fechas de alta UCI (alta del hospital)/fallecimientoa | |
|---|---|---|---|---|---|---|---|---|---|
| Paciente 1 | 14/04/20 | 60 | 28/03/20 | 169 | 0 | 274 | 07/04/20 | 459 | 22/04/20 (29/04/20) |
| Paciente 2 | 23/03/20 | 86 | 23/03/20 | 97 | 4 | 368 | 01/04/20 | 442 | 08/04/20 (20/04/20) |
| Paciente 5 | 23/03/20 | 132 | 23/03/20 | 328 | 9 | NA | NA | 66b | 14/05/20a |
| Paciente 6 | 14/03/20 | 79 | 15/03/20 | 260 | 1 | NA | NA | 56b | 18/05/20a |
NA: no aplicable; PaFi: PaO2/FiO2 (1: preintubación traqueal; 2: inmediata postintubación traqueal; 3: preextubación traqueal; 4: inmediata postextubación traqueal o prefallecimiento); Prono: número de veces que el paciente fue pronado para ventilación en dicha posición (la pronación habitualmente duraba 12-16 h y se indicaba cuando la oxigenación no mejoraba con las maniobras habituales de ventilación, p. ej., PaO2/FiO2 < 150-200).
En caso de deceso del paciente, peor PaFi.
Tabla 4.
Descripción del ECG y hallazgos radiológicos en los pacientes ingresados en UCI
| ECG | Rx 1 (fecha) | Rx 2 (fecha) | Otras exploraciones de imagen | |
|---|---|---|---|---|
| Paciente 1 | Ritmo sinusal, 82 lpm, QRS estrecho, QTc 491 ms. Sin cambios en la estancia en UCI | Opacidades parenquimatosas bilaterales (25/03/20) | Opacidades parenquimatosas en ambos pulmones, derrame pleural bilateral (30/03/20) | TC: tromboembolismo pulmonar en el lóbulo superior derecho y varias arterias segmentarias, así como de arterias segmentarias del lóbulo superior izquierdo; opacificaciones difusas bilaterales “en vidrio deslustrado” (16/04/20) |
| Paciente 2 | Ritmo sinusal, 85 lpm, QRS estrecho, QT 393 ms. Sin cambios en la estancia en UCI | Opacidades bilaterales (23/03/20) | No opacidades (03/04/20) Atelectasias laminares (17/04/20) |
ND |
| Paciente 5 | Ritmo sinusal, 90 lpm, QRS estrecho, QT 500 ms | Opacificaciones reticulares intersticiales en lóbulo medio (25/03/20) | Patrón reticular intersticial, opacidades subpleurales bilaterales, discreto patrón alveolointersticial (10/04/20) Neumotórax bilateral (no simultáneo) y enfisema subcutáneo (22/04/20) |
US: sin hallazgos de tromboembolia pulmonar (10/04/20) |
| Paciente 6 | Ritmo sinusal, 40 lpm, QRS estrecho, QTc 357 ms. Desarrolló fibrilación auricular durante la estancia en UCIa | Opacificación reticular intersticial, condensación del lóbulo superior del pulmón izquierdo (14/03/20) | Condensaciones alveolares progresivas, colección pleural en hemitórax derecho (hemotórax) (16/05/20) Inserción de drenajes torácicos y toracotomía izquierda |
TC: opacificaciones bilaterales en vidrio deslustrado, opacidades periféricas en ambos lóbulos superiores, lóbulo medio y língula. Consolidación del lóbulo inferior derecho. Derrame pleural bilateral. No hallazgos de tromboembolia pulmonar (19/04/20) |
ECG: hallazgos electrocardiográficos; ND: no disponible; QRS: tipo de complejo QRS; QT y QTc: duración del intervalo QT (rango normal 400-440 ms); Rx 1: radiografía de tórax al ingreso en UCI; Rx 2: peores hallazgos en la radiografía de tórax (ambos con fecha de realización), TC: tomografía computarizada; US: exploración pulmonar con ultrasonidos.
Este paciente había sido diagnosticado con anterioridad de fibrilación auricular y estaba en tratamiento con acenocumarol a su ingreso.
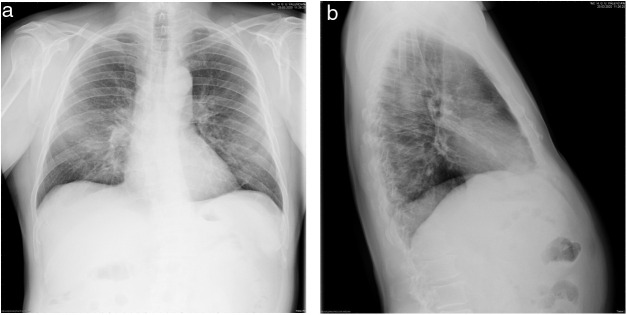
Figura 1.
Radiografía simple de tórax (paciente 5). Infiltrados intersticiales bilaterales (proyecciones posteroanterior y lateral).
Figura 2.
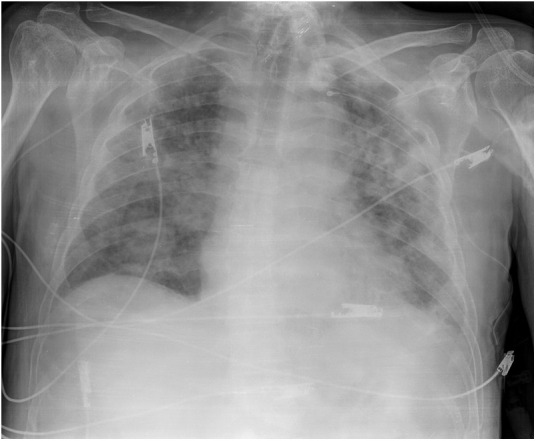
Radiografía simple de tórax (paciente 5). Opacidades pulmonares bilaterales. Tubo de traqueostomía. Catéter venoso central insertado periféricamente.
Figura 3.
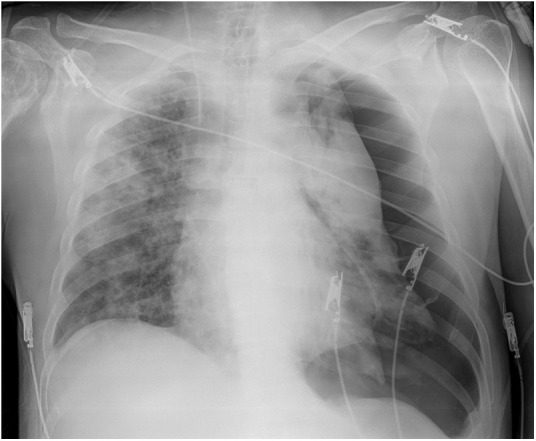
Radiografía de tórax (paciente 5). Opacidades en el pulmón derecho, neumotórax izquierdo masivo (previo a la inserción de drenaje), catéter en la vena yugular interna derecha.
Figura 4.
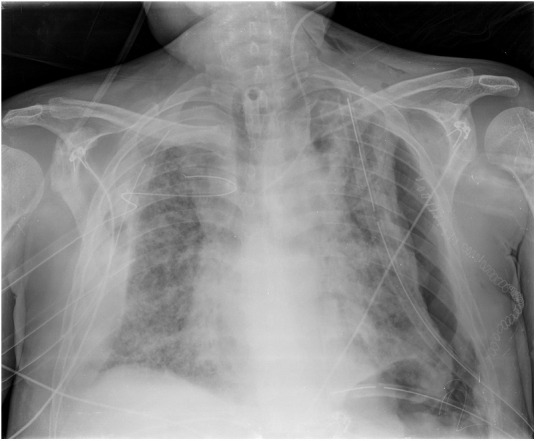
Radiografía simple de tórax (paciente 5). Consolidación severa bilateral, neumotórax bilateral, ensanchamiento mediastínico, catéter venoso yugular izquierdo, drenajes torácicos (ambos lados), enfisema subcutáneo, grapas en hemitórax izquierdo (por toracotomía, ver texto para mayor explicación).
Figura 5.
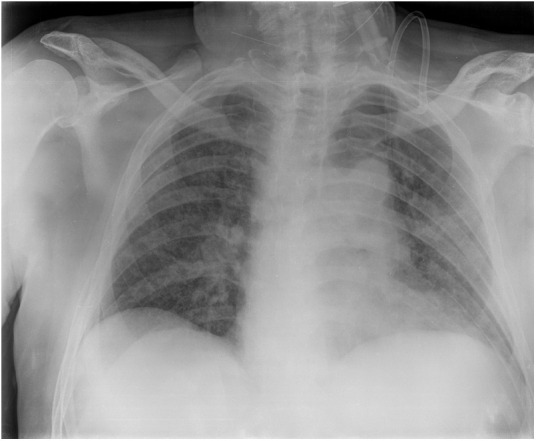
Radiografía simple de tórax (paciente 6). Opacidades pulmonares reticulares bilaterales.
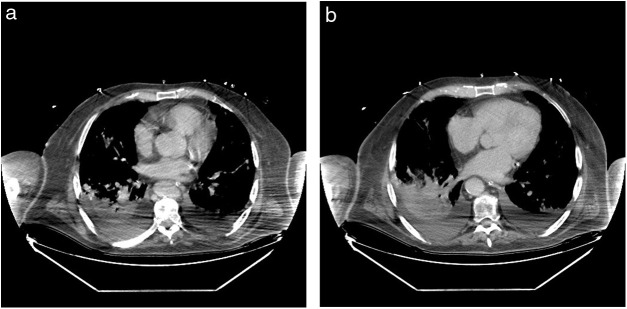
Figura 6.
Tomografía computada (paciente 6). a) Condensaciones pulmonares bilaterales y cierta infiltración intersticial. b) Condensaciones pulmonares bilaterales y derrame pleural, especialmente en hemitórax izquierdo.
Figura 7.
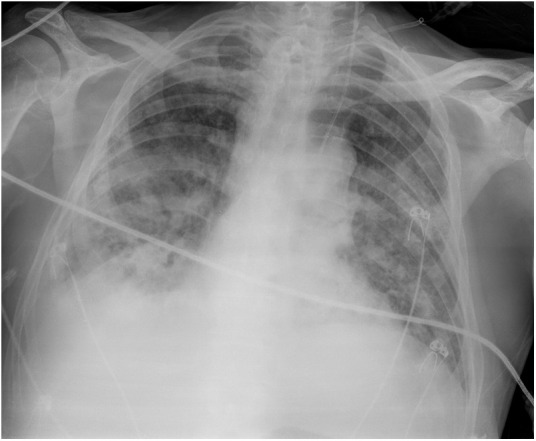
Radiografía simple de tórax (paciente 6). Opacidades y consolidación bilaterales. Derrame pleural derecho. catéter en vena yugular interna izquierda.
Paciente 1
Paciente varón de 64 años con fiebre moderada durante 7 días antes del ingreso, seguido de los síntomas resumidos en la tabla 1. Se decidió ingreso en UCI tras el diagnóstico de COVID-19 con neumonía y empeoramiento clínico. La intubación traqueal y la ventilación mecánica se iniciaron en el 2.° día de ingreso en la UCI. Los tratamientos específicos de COVID-19 y los protocolos locales de ese momento se resumen en la tabla 5 (anexo, material adicional online). La mejoría clínica y analítica llevó a la extubación 10 días después. Presentó episodios de agitación, somnolencia, desorientación de tiempo, lugar y persona, y habla incoherente en la UCI después de la extubación, y en la sala de Neumología (en la que permaneció en aislamiento respiratorio y de contacto, acompañado de su esposa, que también fue diagnosticada previamente de SARS-CoV-2, paciente 3). Una tomografía computarizada tardía mostró tromboembolia pulmonar (tabla 4). Fue dado de alta con enoxaparina. La RT-PCR para SARS-CoV-2 fue positiva antes de su ingreso en el hospital y se negativizó 21 días después.
Paciente 2
Paciente varón de 63 años que refirió fiebre de 5 días de evolución y tos productiva. Su curso clínico se muestra en la tabla 4. Después de 7 días en la unidad de Neumología, requirió terapia en la UCI, con intubación traqueal y ventilación mecánica. La extubación fue posible 8 días después.
Desarrolló agitación, desorientación que requirió infusión de propofol en dosis bajas, infusión de dexmedetomidina y lorazepam, seguido de risperidona. En la sala de Neumología, donde permaneció en aislamiento, presentó delirio, confusión, agitación moderada y euforia, que mejoraron progresivamente. Fue dado de alta a su domicilio (donde vivía con su esposa, paciente 4) en autoaislamiento adicional durante 14 días, y con tratamiento con quetiapina. La RT-PCR para SARS-CoV-2 fue positiva al ingreso y se volvió negativa 21 días después.
Pacientes 3 y 4
Estas pacientes estuvieron conviviendo con sus respectivas parejas (pacientes 1 y 2) durante al menos 7 días mientras que ambos tenían síntomas de COVID-19 y antes de la hospitalización. Sus síntomas fueron anosmia y disgeusia/ageusia, duraron más de 10 días. La paciente 3 refirió además fiebre leve durante 3 días. Por otra parte, estuvieron en aislamiento domiciliario durante 2 semanas después del diagnóstico.
Paciente 5
Paciente varón aquejado de fiebre (37,9 °C), taquipnea (40 rpm), cianosis y SaO2 77% respirando aire ambiente; presión arterial 140/70 mmHg y frecuencia cardíaca 110 latidos por minuto. Se diagnosticó neumonía intersticial bilateral (figura 1). Al sufrir deterioro neurológico ingresó en la UCI, donde se inició ventilación mecánica tras intubación traqueal.
El tratamiento se realizó según protocolo (anexo, tabla 5, material adicional online). Se realizó traqueotomía precoz. Los parámetros analíticos mostraron niveles elevados de dímero D, ferritina y LDH, que se mantuvieron elevados en el tiempo (tabla 2). La radiología de tórax mostró deterioro (figura 2).
Se inició tratamiento con óxido nítrico inhalado por hipoxemia refractaria. Debido al proceso inflamatorio persistente, se introdujo anakinra (antagonista del receptor de IL-1). A pesar de esto, la oxigenación no mejoró. Le siguió infección por Pseudomonas aeruginosa, estreptococos y coinfecciones fúngicas, tratadas según antibiograma y protocolo local. Finalmente, desarrolló inestabilidad hemodinámica tratada con dosis bajas de noradrenalina y dobutamina. Se añadió anticoagulación con heparina de bajo peso molecular (HBPM) a dosis completa y posteriormente fondaparinux.
Complicaciones desarrolladas a partir de la cuarta semana en la UCI: neumotórax izquierdo (figura 3), insuficiencia renal, aumento de marcadores de lesión miocárdica (con ecocardiografías normales), neumotórax derecho (que precisó toracotomía por hemotórax, figura 4), hemocultivos positivos a Candida auris e insuficiencia hepática.
En los últimos días antes de fallecer, se introdujo ruxolitinib (inhibidor de las cinasas JAK1 y JAK2), con indicación de uso compasivo.
La RT-PCR para el SARS-CoV-2 dio positivo en la primera admisión y se volvió negativa 25 días después.
Paciente 6
Varón de 74 años ingresado en Urgencias por fiebre de 39 °C, tos y mareos. Había asistido a una reunión con amigos que habían sido diagnosticados de SARS-CoV-2 mediante RT-PCR varios días después (incluida su esposa).
La SaO2 fue del 84% respirando aire ambiente, mejorando al 99% con mascarilla, pero tenía hipotensión arterial (80/50 mmHg, 65 latidos por minuto), taquipnea y cianosis. Se indicó ingreso en la UCI e intubación traqueal 6 días después. Se inició la infusión de noradrenalina a dosis bajas. Se diagnosticó neumonía atípica bilateral (figura 5). El tratamiento fue protocolizado (tabla 5, material adicional online). La administración profiláctica de enoxaparina fue seguida de dosis terapéuticas (luego cambiadas a fondaparinux) debido a trastornos de los parámetros de coagulación. Se realizó traqueotomía el día 17 de estancia en la UCI. Una tomografía computarizada mostró consolidaciones bilaterales y derrame pleural (figura 6 a y b).
En los últimos días presentó polineuropatía, miopatía e insuficiencia renal. Varias ecocardiografías transtorácicas y transesofágica no mostraron alteraciones. La radiología de tórax mostró permitió sospechar coinfección (figura 7).
Aparecieron sucesivamente bacteriemias debidas a coinfecciones o colonización (Staphylococcus aureus sensible a meticilina, Acinetobacter baumanii, Enterobacter cloacae, Enterococcus faecium y Candida auris) que fueron tratadas según antibiograma.
Un intento de destete de la ventilación mecánica no tuvo éxito. El fallo multiorgánico condujo al fallecimiento a los 44 días de ingreso en la UCI.
Discusión
En nuestro hospital (anexo, tablas 6 y 7 material adicional online), 1.226 pacientes fueron diagnosticados de infección con SARS-CoV-2, 371 (30,26%) fueron hospitalizados y 66 (5,38%, 43 varones) ingresaron en la UCI. La mortalidad en la UCI fue del 44% (29 pacientes fallecieron) en esa primera oleada de la pandemia.
En este artículo describimos los hallazgos clínicos, de laboratorio y radiológicos en 6 pacientes seleccionados diagnosticados de COVID-19 en un hospital de tercer nivel del sistema público de salud en Valencia, España. Los pacientes ingresaron durante la 2.ª y la 3ª semanas de la pandemia en este país.
Se desconocen las causas de la diferente evolución clínica de los pacientes infectados simultánea o posteriormente a los casos índice. El período medio de incubación antes del inicio de los síntomas es de aproximadamente 4 a 5 días y casi todos los pacientes sintomáticos desarrollan síntomas en 11,5 días2. Se señalan la carga viral, las características propias del paciente (edad avanzada, varones, factores genéticos) y las enfermedades (hipertensión arterial, diabetes, etc.)3.
En nuestros casos, al ingreso, los síntomas fueron similares ya fueran los pacientes leves o graves, pero los últimos empeoraron en los 5 días siguientes. Esto coincide con otras publicaciones4.
Se ha comunicado a partir de contactos cercanos de pacientes con COVID-19 confirmados en Wuhan5 que los asintomáticos, en comparación con los sintomáticos, eran más jóvenes, mujeres en mayor proporción, mostraban cifras más altas de linfocitos T CD4+ en la recuperación, una mejoría radiológica más rápida y menor duración de la diseminación viral (muestras a partir de hisopos nasofaríngeos; duración media [rango intercuartílico], 8 [3-12] días frente a 19 [16-24] días; p = 0,001). A partir de estos resultados, se puede sugerir que los pacientes con infecciones más leves podrían tener menos alteraciones del sistema inmunológico.
Cabe destacar que los 4 pacientes gravemente afectados habían sido tratados con antihipertensivos y 3 de ellos con antagonistas del receptor de angiotensina-ii o inhibidores de la enzima conversora de angiotensina. Existe controversia sobre el curso clínico de la enfermedad en pacientes que fueron tratados con ambos fármacos.
Además, varios parámetros analíticos se han relacionado con peores resultados, incluida una mayor mortalidad4, 6. Llama la atención que los pacientes que desarrollaron trastornos graves de la coagulación, principalmente en la circulación pulmonar (pacientes 1 y 5), mostraron los resultados más elevados de dímero D (tabla 2), hecho que ha sido notificado4. Recientemente, se ha evidenciado que se trataba de un estado de hipercoagulabilidad en la mayoría de los pacientes y en más del 60% existía evidencia clínica de eventos trombóticos, especialmente en los enfermos críticos. Esta circunstancia puede explicar las embolias pulmonares, que se suman a la vasculitis pulmonar y la endotelialitis. Los trombos de la arteria pulmonar del paciente 1 fueron diagnosticados con retraso relativo (cercano al alta hospitalaria) debido a hipoxemia persistente.
Conseguimos escasas determinaciones de laboratorio de IL-6, pero este marcador inflamatorio también pareció aumentado. También se ha descrito como un marcador independiente de mortalidad intrahospitalaria4.
Por tanto, las concentraciones de dímero D e IL-6 al ingreso parecieron predictores de mortalidad. En nuestros pacientes, ambas, además de la ferritina, se incrementaron desde los primeros estadios de la enfermedad como expresión del síndrome hiperinflamatorio que se ha sugerido como causa de afectación multiorgánica en la COVID-19.
La linfopenia es otro hallazgo repetido en pacientes con COVID-192 y también puede ser de valor pronóstico. Recientemente, ha sido revisado el papel de las células del sistema inmunológico en la inmunopatogenicidad del daño pulmonar y la hiperinflamación general7.
Ninguno de nuestros pacientes desarrolló un deterioro orgánico relevante en los primeros días/semanas salvo afectación pulmonar y signos de inflamación generalizada (tabla 3). Respecto a esto, la ferritina, como marcador (o mediador) de la inflamación8, se incrementó y se mantuvo elevada en los casos de mayor estancia en UCI (pacientes 2, 5 y 6) y evolución más grave (pacientes 5 y 6). A pesar del aumento de troponina i ultrasensible, no se encontraron hallazgos de cardiopatía en exploraciones de imagen repetidas en todos los pacientes durante su estancia en la UCI. En nuestros pacientes, contrariamente a algunas publicaciones, solo se observaron algunos cambios en el electrocardiograma, como bradicardia, discreta prolongación de QT o QTc, y fibrilación auricular en algunos casos.
Los pacientes con peor evolución presentaban varias coinfecciones, poco frecuentes en el momento de presentación, por lo que las alteraciones de los parámetros analíticos tardíos coincidían con un aumento de lactato, procalcitonina, proteína C reactiva, etc. (tabla 2), similar a un síndrome de dificultad respiratoria aguda típico, agravado por coinfecciones concurrentes. Se ha publicado que las infecciones virales sistémicas suelen ir acompañadas o seguidas de inmediato de infecciones bacterianas y fúngicas y que estas influyen en el resultado final6.
Además de la anosmia y la disgeusia, recientemente se ha revisado el tema de la afectación del sistema nervioso central (SNC)9. Nos gustaría reseñar las alteraciones neurológicas que hemos observado constantemente en estos pacientes. Aunque no está especialmente definido en los primeros grandes estudios de China, EE. UU. e Italia, desde que ingresaron los primeros casos en nuestro hospital y en la UCI, los pacientes presentaban problemas neurológicos y psiquiátricos. Los pacientes en la UCI presentaban confusión, mareos, somnolencia y aparecían desorientados y bradipsíquicos al ingreso (con SaO2 normal a moderadamente baja y normocapnia), y los mismos síntomas más agitación, delirio, euforia, confusión, etc. cuando ya se detenía la sedación y estaban extubados, así como también en la sala de hospitalización10. La afectación del SNC podría explicarse por hipoxia o efectos secundarios de fármacos (sedantes, relajantes musculares), pero algunos pacientes también presentaron estos síntomas a pesar de una corta estancia en la UCI. Podemos especular sobre varios mecanismos de afectación del SNC porque otros coronavirus también son neurotrópicos y debido a que inicialmente se comunicó escasamente la afectación neurológica, a pesar de que la incidencia era entre el 36,411 y el 67%12. Sin embargo, aún se desconoce si esto es una consecuencia de la invasión viral o la reacción inflamatoria general.
La rotura de la integridad de la barrera hematoencefálica, un paso teórico esencial para el ataque al SNC, es producida por varios mecanismos y factores que incluyen, entre otras, la edad avanzada, la inflamación y las viriasis13. Además, podríamos teorizar que puede prevalecer una alteración funcional y no es necesaria la invasión viral directa, por ejemplo, mediante alteración de la vía antiinflamatoria colinérgica14. Además, la neuroinvasión que afecta a algunos núcleos del SNC podría explicar, al menos en parte, el origen de la insuficiencia respiratoria de algunos pacientes con COVID-1915 y podría tener implicaciones terapéuticas. Queda por dilucidar si este daño persiste en el tiempo.
Los pacientes críticos fueron tratados según los protocolos institucionales. Sin embargo, estos iban cambiando día a día (según recomendaciones del Ministerio de Sanidad y de la administración local), por lo que el momento preciso en el que se incluían algunos fármacos no era el mismo para todos los pacientes. Por ejemplo, los antiinflamatorios se iniciaron más de una semana después de la aparición de los síntomas en todos los casos, dependiendo de la respuesta clínica y los hallazgos analíticos. Además, hemos tenido escasez de fármacos, como anakinra o sedantes. Esto impidió, en parte, un enfoque por etapas (ventana terapéutica).
Esta serie de casos tiene varias limitaciones. El número de casos es escaso, pero nuestro objetivo es mostrar las características de casos típicos de la enfermedad seleccionados. Por supuesto, no se buscó una relación causal, pero la información descriptiva podría ser interesante para el lector, porque esta es la forma en que la mayoría de los pacientes se presentaron durante la pandemia.
En conclusión, presentamos las diferentes vías evolutivas y los resultados de 6 pacientes diagnosticados de COVID-19 con estrecha relación entre ellos, y discutimos sobre los hallazgos típicos, las características clínicas, de laboratorio y radiológicas, y la fisiopatología de la enfermedad, además de los ampliamente descritos del sistema respiratorio.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Footnotes
Se puede consultar material adicional a este artículo en su versión electrónica disponible en doi:10.1016/j.redar.2021.03.009
Anexo A. Material adicional
Bibliografía
- 1.Wang D., Hu B., Hu C., Zhu F., Liu X., Zhang J., et al. Clinical characteristics of 138 hospitalized patients with 2019 novel Coronavirus-infected pneumonia in Wuhan, China. JAMA. 2020;323:1061–1069. doi: 10.1001/jama.2020.1585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y., et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Grasselli G., Zanella A. Critically ill patients with COVID-19 in New York City. Lancet. 2020;395 doi: 10.1016/S0140-6736(20)31190-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cummings M.J., Baldwin M.R., Abrams D., Jacobson S.D., Meyer B.J., Balough E.M., et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: A prospective cohort study. Lancet. 2020;20:363–374. doi: 10.1016/S0140-6736(20)31189-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Yang R., Gui X., Xiong Y. Comparison of clinical characteristics of patients with asymptomatic vs symptomatic Coronavirus disease 2019 in Wuhan, China. JAMA Netw Open. 2020;3:e2010182. doi: 10.1001/jamanetworkopen.2020.10182. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z., et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: A retrospective cohort study. Lancet. 2020;395:1054–1062. doi: 10.1016/S0140-6736(20)30566-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tay M.Z., Poh C.M., Renia L., MacAry P.A., Ng L.F.P. The trinity of COVID-19: Immunity, inflammation and intervention. Nat Rev Immunol. 2020;20:363–374. doi: 10.1038/s41577-020-0311-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Rosario C., Zandman-Goddard G., Meyron-Holtz E.G., d’Cruz D.P., Shoenfeld Y. The hyperferritinemic syndrome: Macrophage activation syndrome, Still's disease, septic shock and catastrophic antiphospholipid syndrome. BMC Med. 2013;11:185. doi: 10.1186/1741-7015-11-185. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Zubair A.S., McAlpine L.S., Gardin T., Farhadian S., Kuruvilla D.E., Spudich S. Neuropathogenesis and neurologic manifestations of the coronaviruses in the age of Coronavirus disease 2019: A review. JAMA Neurol. 2020;77:1018–1027. doi: 10.1001/jamaneurol.2020.2065. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Steardo L., Steardo L., Jr., Zorec R., Verkhratsky A. Neuroinfection may contribute to pathophysiology and clinical manifestations of COVID-19. Acta Physiol (Oxf). 2020:e13473. doi: 10.1111/apha.13473. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Mao L., Wang M., Chen S., He Q., Chang J., Hong C., et al. Neurological manifestations of hospitalized patients with COVID-19 in Wuhan, China: A retrospective case series study. JAMA Neurol. 2020;77:683–690. doi: 10.1001/jamaneurol.2020.1127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Helms J., Kremer S., Merdji H., Clere-Jehl R., Schenck M., Kummerlen C., et al. Neurologic features in severe SARS-CoV-2 infection. N Engl J Med. 2020;382:2268–2270. doi: 10.1056/NEJMc2008597. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Abbott N.J. Inflammatory mediators and modulation of blood-brain barrier permeability. Cell Mol Neurobiol. 2000;20:131–147. doi: 10.1023/a:1007074420772. [DOI] [PubMed] [Google Scholar]
- 14.Cuoco J.A., Fennie C.N., Cheriyan G.K. The cholinergic anti-inflammatory pathway: A novel paradigm for translational research in neuroimmunology. J Neurol Neurosci. 2016;7:86. doi: 10.21767/2171-6625.100086. [DOI] [Google Scholar]
- 15.Li Y.C., Bai W.Z., Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J Med Virol. 2020 doi: 10.1002/jmv.25728. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.