Abstract
Objetivo
Analizar si la presencia de anemia incrementa el riesgo de mortalidad a largo plazo asociado al estado de fragilidad y discapacidad en adultos mayores.
Diseño
Subestudio de la cohorte concurrente de base poblacional FRADEA (Fragilidad y Dependencia en Albacete), con 10 años de seguimiento (2007-2017), en mayores de 69 años.
Emplazamiento
Albacete capital, España.
Participantes
De los 993 participantes incluidos en la primera oleada se seleccionaron 790 sujetos con datos válidos de función (fragilidad y discapacidad), anemia y estado vital a los 10 años.
Mediciones principales
La anemia se definió según los criterios de la Organización Mundial de la Salud (hemoglobina < 13 g/dl en hombres y < 12 g/dl en mujeres). Se creó la variable «clasificación funcional» incluyendo fragilidad y discapacidad, e identificando cuatro niveles progresivos: robusto, prefrágil, frágil y con discapacidad en actividades básicas de la vida diaria, empleando el fenotipo de fragilidad e índice de Barthel, respectivamente. Se construyó una nueva variable de ocho categorías combinando las cuatro funcionales con la presencia o ausencia de anemia. La asociación con mortalidad se determinó mediante Kaplan-Meier y análisis de riesgos proporcionales de Cox ajustado por edad, sexo, comorbilidad, polifarmacia, institucionalización y creatinina.
Resultados
Edad media 79 años, siendo el 59,6% mujeres. Un total de 393 participantes (49,7%) fallecieron durante el periodo de seguimiento. La mediana de supervivencia fue de 98,4 meses (rango intercuartil 61). El riesgo de mortalidad aumentó desde los niveles con mejor clasificación funcional hasta aquellos con peor, y para cada subgrupo fue mayor en los participantes con anemia. Prefrágiles sin anemia hazard ratio (HR): 1,59, IC 95%: 1,07-2,36, y con anemia HR: 2,37, IC 95%: 1,38-4,05. Frágiles sin anemia HR: 3,18, IC 95%: 1,68-6,02, y con anemia HR: 4,42, IC 95%: 1,99-9,84. Discapacitados sin anemia HR: 3,81, IC 95%: 2,45-5,84, y con anemia HR: 5,48, IC 95%: 3,43-8,76.
Conclusión
La anemia incrementa el riesgo de mortalidad asociado a la fragilidad y discapacidad en adultos mayores.
Palabras clave: Anemia, Fragilidad, Discapacidad, Mortalidad, Hemoglobina, Anciano
Abstract
Objective
To analyze if anemia increases 10-year mortality risk associated to frailty and disability in older adults.
Design
Substudy of the FRADEA population-based concurrent cohort study (Frailty and dependence in Albacete), with a 10-year follow-up (2007-2017) in people older than 69 years.
Setting
Albacete city, Spain.
Participants
Of the 993 participants included in the first wave, 790 were selected with valid data on function (frailty and disability), anemia and vital status at 10 years.
Main measurements
Anemia was defined according to the criteria of the World Health Organization (hemoglobin < 13 g/dL in men and < 12 g/dL in women). A functional classification variable was created, including frailty and disability, identifying four progressive functional levels: robust, prefrail, frail and disabled in basic activities of daily life, using frailty phenotype and Barthel index respectively. A new eight categories variable was constructed combining the four functional groups with the presence or absence of anemia. The association with mortality was determined by Kaplan-Meier and Cox proportional hazards analysis adjusted for age, sex, comorbidity, polypharmacy, institutionalization and creatinine.
Results
Mean age was 79 years and 59.6% were women. 393 participants (49.7%) died during the follow-up period. The median survival was 98.4 months (interquartile range 61). The risk of mortality increased from the levels with better functionality to those with worse functionality, and for each subgroup it was higher in the participants with anemia. Prefrail without anemia HR [hazard ratio] 1.59 (95% CI 1.07-2.36) and with anemia HR 2.37 (95% CI 1.38-4.05). Frail without anemia HR 3.18 (95% CI 1.68-6.02) and with anemia HR 4.42 (95% CI 1.99-9.84). Disabled without anemia HR 3.81 (95% CI 2.45-5.84) and with anemia HR 5.48 (95% CI 3.43-8.76).
Conclusion
Anemia increases the risk of mortality associated with frailty and disability in older adults.
Keywords: Anemia, Frailty, Disability, Mortality, Hemoglobin, Elderly
Introducción
La anemia se ha convertido en una entidad de gran importancia en los mayores por su elevada prevalencia y por las consecuencias clínicas negativas en términos de mortalidad, funcionalidad y calidad de vida1, 2, 3, 4, 5, 6, 7. La definición de anemia en el anciano más utilizada y aceptada a nivel internacional por la sociedad científica es la establecida por la Organización Mundial de la Salud (OMS)8. La anemia por sí misma es capaz de interferir en el funcionamiento de órganos y sistemas vitales favoreciendo una situación de vulnerabilidad en el adulto mayor9, y al mismo tiempo podría interaccionar con comorbilidades comunes aumentando de forma sinérgica el riesgo de resultados graves como discapacidad o muerte10. Sin embargo, los mecanismos específicos que justifican la asociación de la anemia con eventos adversos de salud en esta población son todavía desconocidos11.
Se define fragilidad como un estado caracterizado por un declinar progresivo de los sistemas fisiológicos relacionado con el envejecimiento, que resulta en una reducción de la capacidad intrínseca y que confiere una extrema vulnerabilidad a estresores, aumentando el riesgo de presentar diversos eventos adversos de salud12, 13. La fragilidad es un estado prediscapacidad que, dentro del continuum funcional en ancianos —el que va desde la máxima capacidad intrínseca o situación de robustez hasta la menor capacidad intrínseca posible o discapacidad máxima—, se sitúa en un estado intermedio entre la robustez y la discapacidad leve13, 14. Con una prevalencia cercana al 10% en mayores de 65 años independientes de la comunidad, la fragilidad se describe actualmente como uno de los principales factores independientes asociados a eventos adversos de salud en esta población15, 16. Aunque se conocen algunos mecanismos patogénicos asociados con este síndrome17, la anemia no ha sido claramente identificada como elemento causal.
La asociación entre anemia y fragilidad parece estar bien descrita en estudios transversales18, 19 y se han propuesto diferentes hipótesis biológicamente plausibles para relacionar ambos problemas de salud, incluyendo la inflamación crónica de bajo grado20, 21, la hipoxia11 o la sarcopenia7, 22, 23, 24, aunque son necesarios estudios longitudinales para analizar esta posible causalidad. Así mismo y a nivel de causalidad, tampoco es bien conocido si la anemia se asocia a eventos adversos de salud a través de la producción de fragilidad o discapacidad. Por todo ello, el objetivo del presente trabajo fue analizar si la existencia de anemia aumenta la mortalidad a largo plazo como evento adverso grave asociado a la fragilidad y discapacidad en adultos mayores.
Material y métodos
Diseño
Nuestro trabajo presenta datos del último corte tras seguimiento de 10 años (2007-2017) de la cohorte del estudio FRADEA, un estudio de cohortes concurrente de base poblacional. El razonamiento, diseño, metodología, selección y características basales han sido publicados previamente25.
Sujetos y ámbito de estudio
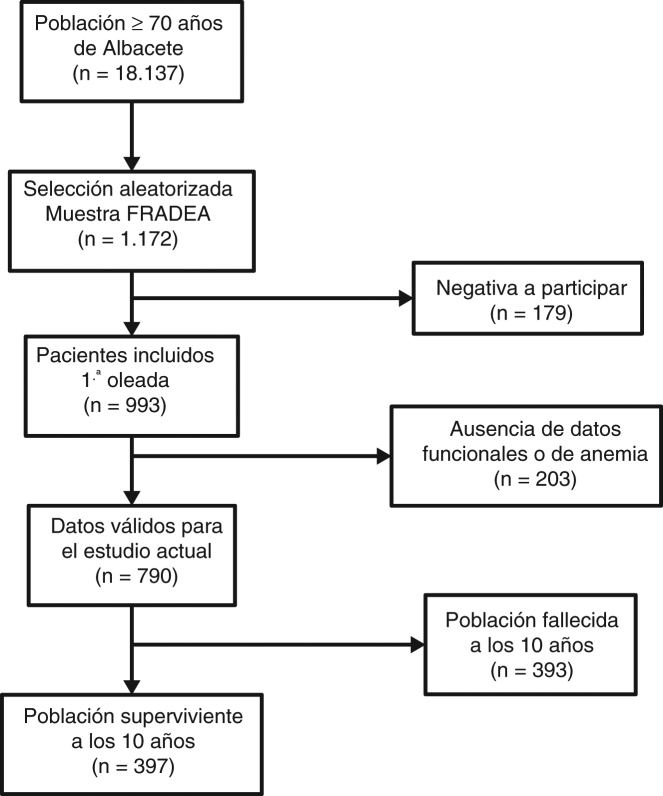
Se seleccionó mediante un muestreo aleatorio estratificado por edad y sexo a partir de la base de datos de tarjeta sanitaria (n = 18.137), una muestra representativa de personas de 70 o más años (n = 1.172) residentes en la ciudad de Albacete durante al menos 3 meses al año. Se obtuvo así una muestra aleatoria de personas mayores en cada uno de los siguientes cuatro estratos: hombres y mujeres con edades inferiores o superiores a 80 años, a partir de 70, manteniendo las proporciones de la población de referencia. De ellos, aceptaron participar 993 (84,7%) y rechazaron hacerlo 179 (15,3%). El único criterio de exclusión fue la negativa a participar en el estudio o no firmar el consentimiento informado por escrito. De los 993 participantes incluidos en la primera oleada se seleccionaron 790 sujetos con datos válidos de función (fragilidad y discapacidad), anemia y estado vital a los 10 años. El esquema general del estudio se muestra en la figura 1.
Figura 1.
Diagrama de flujo del estudio.
Variables del estudio
Anemia
Se definió anemia como una concentración de Hb inferior a 13 g/dl en los hombres y a 12 g/dl en mujeres, siendo los puntos de corte de Hb reconocidos por la OMS8, y se analizó como variable cualitativa. Los valores de Hb (g/dl) se midieron mediante un analizador hematológico ADVIA automatizado 2120i (Siemens).
Clasificación funcional
Para la clasificación funcional de los participantes se empleó el constructo de continuum funcional, que comprende todo el espectro de la función de las personas desde la máxima capacidad intrínseca o situación de robustez hasta la menor capacidad intrínseca posible o discapacidad máxima12, 13, 14. El continuum funcional incluye la fragilidad, un estado prediscapacidad en un lugar intermedio entre la robustez y la discapacidad leve y a la discapacidad en las fases avanzadas, categorías continuas pero excluyentes, ya que su caracterización diagnóstica y su manejo son diferentes26. Se clasificó a los participantes según metodología previamente descrita y validada14 en cuatro niveles funcionales progresivos: robustos, prefrágiles, frágiles y con discapacidad para actividades básicas de la vida diaria (ABVD).
El estado de fragilidad se evaluó según los criterios propuestos por Fried27, aunque con algunas modificaciones. Estos son:
-
1.
Pérdida de peso no intencionada igual o superior a 4,6 kg o igual o superior al 5% del peso corporal en el último año.
-
2.
Cansancio autorreferido en base a la respuesta a dos preguntas de la escala CES-D, según original de Fried.
-
3.
Nivel de actividad física bajo, utilizando como instrumento Calcumed® en lugar del Minnesota Leisure Time Physical Activity Questionnaire (MLTAQ) utilizado por Fried, pero también utilizando los mismos puntos de corte originales.
-
4.
Lentitud, mediante velocidad para caminar 4 m, inferior al percentil 20 y ajustado para sexo y altura, según los valores originales de Fried.
-
5.
Debilidad, según medición de la fuerza prensora de mano dominante con dinamómetro de JAMAR, por debajo del percentil 20 ajustado por sexo e índice de masa corporal, según valores originales de Fried.
Se consideró que los sujetos eran frágiles cuando presentaban 3 o más de los 5 criterios referidos, prefrágiles si presentaban 1 o 2 criterios y robustos si no presentaban ninguno.
La discapacidad para ABVD se evaluó mediante el índice de Barthel28. Este instrumento evalúa 10 ABVD (alimentación, baño, vestido, aseo, continencia fecal, continencia urinaria, uso del retrete, transferencias, deambulación y escalones) y puntúa la dependencia o independencia total o parcial desde 0 a 5, 10 o 15 puntos en cada una según la actividad; el rango de puntuación total se encuentra entre 0-100 puntos, de forma que a menor puntuación, mayor dependencia. En este trabajo se consideró discapacidad para ABVD cuando los sujetos puntuaron por debajo del máximo en alguno de los siguientes 5 ítems: baño, aseo, alimentación, uso del retrete o vestido.
Clasificación funcional con/sin anemia
Para alcanzar el objetivo principal y conocer la influencia de la anemia sobre la asociación entre cada uno de los subgrupos de población establecidos y mortalidad como evento adverso grave se definieron ocho categorías combinando las cuatro de función con la presencia o ausencia de anemia:
-
1.
Robusto sin anemia.
-
2.
Prefrágil sin anemia.
-
3.
Frágil sin anemia.
-
4.
Discapacidad ABVD sin anemia.
-
5.
Robusto con anemia.
-
6.
Prefrágil con anemia.
-
7.
Frágil con anemia.
-
8.
Discapacidad ABVD con anemia.
Variable resultado: mortalidad
Se identificó la mortalidad a través de la información del estado del sujeto en la fecha de última observación, confirmándose la fecha exacta con la historia clínica de atención primaria y del hospital del paciente. Cuando existió discordancia o los datos eran desconocidos se consultó el registro municipal de la ciudad de Albacete. Por ello se consiguió la fecha exacta de mortalidad de todos los participantes incluidos en este subestudio.
Covariables
Se recogieron la edad, el sexo y la institucionalización. La discapacidad para actividades instrumentales de la vida diaria (AIVD) se registró utilizando el índice de Lawton, que evalúa 8 ítems: cocinar, comprar, lavar, limpiar, uso del teléfono, manejo de la medicación, uso de transporte y manejo de finanza, y se consideró sujeto dependiente para AIVD el que presentaba discapacidad en al menos uno de los 8 ítems referidos.
Las enfermedades crónicas de los sujetos se obtuvieron de sus informes médicos y fueron codificadas a través del CIE-10 y posteriormente clasificadas en grandes grupos homogéneos para su posterior análisis. Se analizó la comorbilidad a través del índice de comorbilidad de Charlson, definiendo como alta comorbilidad una puntuación igual o superior a 3.
Se registró el número de fármacos prescritos y se construyó la variable polifarmacia definida como el consumo de 5 o más fármacos, siendo el punto de corte encontrado en la literatura para definir este concepto29.
Los niveles de creatinina (mg/dl) en suero se midieron por ensayo cinético colorimétrico usando el equipo Cobas 8000 (Roche Diagnostic).
Se incluyeron otros parámetros analíticos tales como el recuento total de leucocitos, que se realizó mediante un analizador hematológico ADVIA automatizado 2120i (Siemens), y la concentración de glucosa (mg/dl), que se medió mediante el analizador Hitachi de Roche Diagnostic®.
La metodología de aplicación de los diferentes test utilizados y las referencias bibliográficas de los mismos para este trabajo se han descrito en el estudio original25.
Fuentes de información
La entrevista basal se llevó a cabo entre 2007 y 2009 de forma presencial en las consultas externas del Servicio de Geriatría del Complejo Hospitalario Universitario de Albacete por 4 enfermeras entrenadas. Cuando el sujeto participante no podía trasladarse al hospital, se acudía al domicilio o institución para la obtención de los datos. El seguimiento posterior se realizó durante 10 años mediante visitas periódicas presenciales o telefónicas, recogiendo el estado vital del participante. La información fue facilitada por el propio participante o por el cuidador principal cuando el primero no podía. El proceso de la entrevista fue estandarizado para aumentar su fiabilidad. La información clínica de las enfermedades crónicas se obtuvo del historial médico de los sujetos. A todos los participantes que dieron su consentimiento se les realizó una extracción sanguínea para la realización de una analítica que incluía hemograma y perfil bioquímico. Las muestras de sangre se obtuvieron por punción venosa después de un ayuno durante la noche y se determinaron en el laboratorio del Hospital General Universitario de Albacete.
Aspectos éticos
La investigación realizada ha cumplido con la normativa de Helsinki referente al estudio con humanos. El proyecto FRADEA fue aprobado por el comité de investigación clínica del Área Sanitaria de Albacete y la comisión de investigación clínica del Complejo Hospitalario Universitario de Albacete. Todos los participantes firmaron consentimiento informado previo a su inclusión en el estudio.
Análisis estadístico
Se realizó un análisis descriptivo de las características basales de los sujetos de la muestra mediante frecuencias, medidas de tendencia central y medidas de dispersión según la naturaleza de las variables, y un análisis bivariante entre anemia y la situación funcional, las diferentes covariables y mortalidad como evento adverso mediante pruebas de chi cuadrado y t de Student o ANOVA, según la naturaleza de las mismas.
La asociación entre el estado de anemia y la situación funcional con la mortalidad a 10 años, en función de los 8 subgrupos establecidos de manera conjunta y por grupos de categorías funcionales, se analizó mediante el análisis de riesgos proporcionales de Cox ajustado a edad, sexo, comorbilidad, polifarmacia, institucionalización y creatinina. Estos resultados se presentan como hazard ratio (HR) con su intervalo de confianza del 95% (IC 95%). De igual manera, se realizó un análisis de supervivencia Kaplan Meier con comparaciones bivariantes utilizando el test estadístico Log Rank (Mantel-Cox), expresando las medianas de supervivencia con su rango intercuartil (RI). La supervivencia se determinó en meses.
Por otra parte, se procedió a realizar un análisis factorial por componentes para la identificación del porcentaje de variabilidad explicada por la mortalidad como evento adverso y relativo a las variables y covariables incluidas en el modelo. Se aplicó la prueba de contraste de Kaiser Meyer y Olkin (KMO), así como la prueba de esfericidad de Bartlett. Igualmente se procedió a valorar la bondad de ajuste del modelo mediante el método Varimax.
Todos los datos se analizaron utilizando el paquete de software estadístico SPSS Statistics 22.0 para Windows.
Resultados
Se incluyeron un total de 790 sujetos de 70 o más años. Las características de la muestra basal analizada y de los diferentes grupos quedan recogidas en la tabla 1. La edad media fue de 79 años, siendo la mayoría mujeres (59,6%); el 19,1% de la muestra estaba institucionalizada. Los participantes que fallecieron presentaron una edad más elevada, mayor tasa de institucionalización, peor estado funcional, mayor comorbilidad y polifarmacia, así como cifras más bajas de Hb, valores más elevados de glucemia plasmática y de leucocitos totales que los que permanecieron vivos tras 10 años de seguimiento (tabla 2).
Tabla 1.
Características basales de la muestra
| Total (n = 790) | G1 (n = 172) |
G2 (n = 272) |
G3 (n = 27) |
G4 (n = 159) |
G5 (n = 9) |
G6 (n = 45) |
G7 (n = 11) |
G8 (n = 95) |
|
|---|---|---|---|---|---|---|---|---|---|
| Edad (años) | 79,0 (6,3) | 75,1 (3,9)‡ | 77,0 (3,8)‡ | 77,4 (3,8)‡ | 83,0 (6,6)‡ | 80,7 (4,1)‡ | 79,1 (4,9)‡ | 81,3 (5,9)‡ | 85,2 (6,6)‡ |
| Hombre | 319 (40,4) | 105 (32,9)‡ | 104 (32,6)‡ | 3 (0,9)‡ | 38 (11,9)‡ | 6 (1,9)‡ | 23 (7,2)‡ | 2 (0,6)‡ | 38 (11,9)‡ |
| Mujer | 471 (59,6) | 67 (14,2)‡ | 168 (35,6)‡ | 24 (5,1)‡ | 121 (25,7)‡ | 3 (0,6)‡ | 22 (4,2)‡ | 9 (1,8)‡ | 57 (60,0)‡ |
| Institucionalización | 151 (19,1) | 3 (1,7)‡ | 12 (4,4)‡ | 2 (7,4)‡ | 71 (44,7)‡ | 1 (11,1)‡ | 4 (8,9)‡ | 4 (36,4)‡ | 54 (56,8)‡ |
| Índice de Barthel | 83,3 (27,0) | 98,3 (3,1)‡ | 97,5 (3,6)‡ | 95,6 (4,2)‡ | 58,2 (28,3)‡ | 97,8 (3,6)‡ | 96,4 (4,1)‡ | 93,6 (5,0)‡ | 44,9 (31,1)‡ |
| Índice de Lawton | 5,3 (2,8) | 6,8 (1,2)‡ | 6,9 (1,4)‡ | 6,3 (2,1)‡ | 2,3 (2,2)‡ | 5,7 (1,9)‡ | 6,1 (2,0)‡ | 4,9 (2,8)‡ | 1,6 (2,8)‡ |
| Índice de Charlson | 1,1 (1,4) | 0,8 (1,1)‡ | 0,9 (1,1)‡ | 1,3 (1,7)‡ | 1,8 (1,6)‡ | 1,4 (1,0)‡ | 1,6 (1,9)‡ | 1,7 (1,6)‡ | 2,4 (1,9)‡ |
| Alta comorbilidad | 141 (17,8) | 17 (9,9)‡ | 26 (9,6)‡ | 4 (14,8)‡ | 40 (25,2)‡ | 2 (22,2)‡ | 10 (22,2)‡ | 3 (27,3)‡ | 39 (41,1)‡ |
| N.° de fármacos | 6,1 (3,5) | 4,2 (3,0)‡ | 5,6 (3,1)‡ | 7,5 (3,1)‡ | 7,8 (3,5)‡ | 5,0 (2,9)‡ | 5,7 (3,2)‡ | 8,4 (3,6)‡ | 8,2 (3,2)‡ |
| Polifarmacia | 509 (64,4) | 66 (38,4)‡ | 166 (61,0)‡ | 22 (81,5)‡ | 131 (55,6)‡ | 5 (55,6)‡ | 26 (57,8)‡ | 10 (90,9)‡ | 83 (87,4)‡ |
| Glucosa (mg/dl) | 106,7 (46,1) | 105,1 (29,1) | 104,6 (34,4) | 111,7 (35,8) | 110,9 (71,1) | 116,0 (32,8) | 101,7 (27,9) | 104,7 (28,2) | 108,6 (58,9) |
| Leucocitos (× 109/l) | 7,2 (4,0) | 6,6 (2,7)* | 7,5 (5,8)* | 7,6 (2,6)* | 7,8 (2,6)* | 7,4 (2,1)* | 5,9 (2,0)* | 6,6 (1,6)* | 7,7 (2,9)* |
| Creatinina (mg/dl) | 1,06 (1,44) | 0,92 (0,19)‡ | 0,93 (0,23)‡ | 1,00 (0,33)‡ | 0,96 (0,30)‡ | 1,03 (0,21)‡ | 1,31 (0,90)‡ | 1,10 (0,45)‡ | 1,31 (1,06)‡ |
| Hemoglobina (g/dl) | 13,5 (2,1) | 14,5 (1,2)‡ | 14,0 (1,1)‡ | 13,8 (0,9)‡ | 13,7 (1,0)‡ | 11,8 (0,6)‡ | 11,5 (1,0)‡ | 11,2 (1,2)‡ | 10,9 (1,4)‡ |
| Mortalidad | 393 (49,7) | 36 (20,9)‡ | 93 (34,2)‡ | 14 (51,9)‡ | 125 (78,6)‡ | 4 (44,4)‡ | 23 (51,1)‡ | 8 (72,7)‡ | 90 (94,7)‡ |
| Días de seguimiento | 2.381 (1.118) | 3.094 (605)‡ | 2.833 (744)‡ | 2.489 (822)‡ | 1.676 (1.142)‡ | 2.392 (1.118)‡ | 2.381 (1.025)‡ | 1.743 (1.015)‡ | 1.020 (921)‡ |
G1: Robustos sin anemia. G2: Prefrágiles sin anemia. G3: Frágiles sin anemia. G4: Discapacidad para actividades básicas de la vida diaria sin anemia. G5: Robustos con anemia. G6: Prefrágiles con anemia. G7: Frágiles con anemia. G8: Discapacidad para actividades básicas de la vida diaria con anemia.
Todos los datos son medias, con la desviación estándar o número de sujetos con los porcentajes entre paréntesis.
p < 0,001.
p < 0,05.
Tabla 2.
Características de los participantes según supervivencia a los 10 años
| Mortalidad a los 10 años |
||
|---|---|---|
| No (n = 397) | Sí (n = 393) | |
| Edad (años) | 76,1 (4,4)‡ | 81,9 (6,6)‡ |
| Hombre | 157 (39,5) | 162 (41,2) |
| Mujer | 240 (60,5) | 231 (58,8) |
| Institucionalización | 16 (4,0)‡ | 135 (34,4)‡ |
| Índice de Barthel | 95,3 (9,5)‡ | 71,1 (32,8)‡ |
| Índice de Lawton | 6,8 (1,6)‡ | 3,7 (2,9)‡ |
| Índice de Charlson | 0,8 (1,1)‡ | 1,9 (1,7)‡ |
| Alta comorbilidad | 33 (8,3)‡ | 108 (27,5)‡ |
| N.° de fármacos | 5,1 (3,2)‡ | 7,2 (3,5)‡ |
| Polifarmacia | 202 (50,9)‡ | 307 (78,1)‡ |
| Glucosa (mg/dl) | 102,4 (28,3)* | 111,0 (58,7)* |
| Leucocitos (× 109/l) | 6,7 (3,7)‡ | 7,8 (4,3)‡ |
| Creatinina (mg/dl) | 1,0 (1,9) | 1,1 (0,6) |
| Hemoglobina (g/dl) | 13,9 (1,8)‡ | 13,0 (2,3)‡ |
| Clasificación funcional | ‡ | ‡ |
| Robustos | 141 (35,5) | 40 (10,2) |
| Prefrágiles | 201 (50,6) | 116 (29,5) |
| Frágiles | 16 (4,0) | 22 (5,6) |
| Discapacidad ABVD | 39 (9,8) | 215 (54,7) |
| Días de seguimiento | 3.251 (210)‡ | 1.503 (964)‡ |
ABVD: actividades básicas de la vida diaria.
Todos los datos son medias, con la desviación estándar o número de sujetos con los porcentajes entre paréntesis.
p < 0,001.
p < 0,05.
Un total de 393 (49,7%) participantes fallecieron durante el periodo de seguimiento. La media y la mediana de supervivencia fueron 78,8 meses (DE: 1,2) y 98,4 meses (RI: 61), respectivamente. Las tasas de mortalidad aumentaron a medida que aumentó el deterioro funcional, y dentro de estos grupos fue mayor en participantes con anemia que en aquellos sin anemia (tabla 2). Mediante análisis de la supervivencia de Kaplan Meier, las medianas de supervivencia de los ocho grupos fueron las siguientes: robustos sin anemia 107,1 meses (RI: 14); prefrágiles sin anemia 102,8 meses (RI: 22); frágiles sin anemia 95,9 meses (RI: 47); discapacidad en ABVD sin anemia 48,6 meses (RI: 76); robustos con anemia 98,0 meses (RI: 68); prefrágiles con anemia 97,5 meses (RI: 59); frágiles con anemia 52,0 meses (RI: 62); discapacidad ABVD con anemia 24,2 meses (RI: 118). Log Rank (Mantel-Cox) 437,549 (p < 0,001). El análisis factorial demostró que cuatro variables explicaron el 75,2% de la varianza de la mortalidad. La variable situación funcional incluyendo el estado de anemia explicó el 28,7%, la comorbilidad el 20,0%, la polifarmacia el 14,9% y la función renal el 11,6% (test de esfericidad de Bartlett p < 0,001).
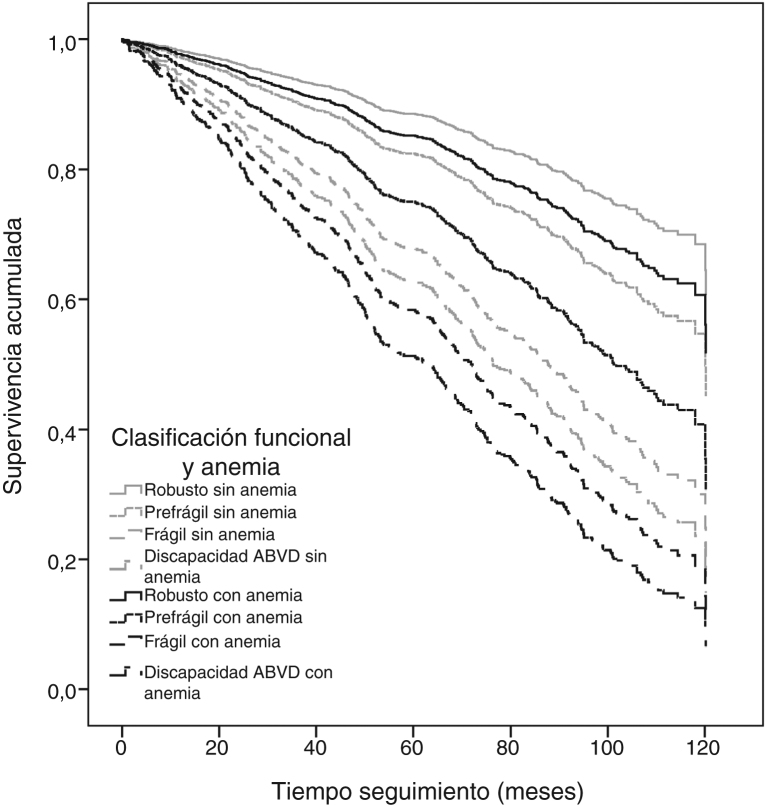
El análisis de riesgos proporcionales de Cox con todas las categorías mostró que a medida que aumenta el deterioro funcional de los pacientes aumenta la mortalidad a los 10 años, y que la adición de la anemia a las categorías funcionales casi multiplica por dos el riesgo de mortalidad (tabla 3). Los participantes prefrágiles sin anemia presentaron un HR de 1,59 (IC 95%: 1,07-2,36) de mortalidad, mientras que en aquellos con anemia el HR fue de 2,37 (IC 95%: 1,38-4,05). Los participantes frágiles sin anemia presentaron un HR de 3,18 (IC 95%: 1,68-6,02) de mortalidad, mientras que en aquellos con anemia el HR fue de 4,42 (IC 95%: 1,99-9,84). Por último, los participantes con discapacidad en ABVD sin anemia presentaron un HR de 3,81 (IC 95%: 2,45-5,84) de mortalidad, mientras que en aquellos con anemia el HR fue de 5,48 (IC 95%: 3,43-8,76) (modelo 2 en la tabla 2). Las curvas de supervivencia acumulada de la figura 2 muestran esta asociación, ajustada por edad, sexo, comorbilidad, polifarmacia, institucionalización y creatinina sérica.
Tabla 3.
Análisis de riesgos proporcionales de Cox para mortalidad a 10 años
| Clasificación funcional con/sin anemia | N categoría | Mortalidad a 10 años | Modelo 1a |
Modelo 2b |
||
|---|---|---|---|---|---|---|
| n (%) | HR (IC 95%) | p | HR (IC 95%) | p | ||
| 1. Robusto sin anemia | 172 | 36 (20,9) | 1,0 (referencia) | – | 1,0 (referencia) | – |
| 2. Prefrágil sin anemia | 272 | 93 (34,2) | 1,77 (1,21-2,61) | 0,004 | 1,59 (1,07-2,36) | 0,021 |
| 3. Frágil sin anemia | 27 | 14 (51,9) | 4,27 (2,31-7,91) | < 0,001 | 3,18 (1,68-6,02) | < 0,001 |
| 4. Discapacidad ABVD sin anemia | 159 | 125 (78,6) | 5,82 (3,90-8,69) | < 0,001 | 3,81 (2,45-5,84) | < 0,001 |
| 5. Robusto con anemia | 9 | 4 (44,4) | 1,84 (0,65-5,19) | 0,237 | 1,32 (0,46-3,76) | 0,605 |
| 6. Prefrágil con anemia | 45 | 23 (51,1) | 2,71 (1,60-4,59) | < 0,001 | 2,37 (1,38-4,05) | 0,002 |
| 7. Frágil con anemia | 11 | 8 (72,7) | 6,63 (3,02-14,56) | < 0,001 | 4,42 (1,99-9,84) | < 0,001 |
| 8. Discapacidad ABVD con anemia | 95 | 90 (94,7) | 9,57 (6,22-14,71) | < 0,001 | 5,48 (3,43-8,76) | < 0,001 |
| Edad | 790 | – | 1,09 (1,07-1,11) | < 0,001 | 1,09 (1,07-1,11) | < 0,001 |
| Sexo femenino | 790 | – | 0,55 (0,44-0,68) | < 0,001 | 0,62 (0,49-0,76) | < 0,001 |
| Índice de Charlson | 790 | – | – | – | 1,23 (1,15-1,31) | < 0,001 |
| Creatinina sérica | 790 | – | – | – | 0,99 (0,92-1,07) | 0,799 |
| Institucionalización | 790 | – | – | – | 1,29 (0,99-1,68) | 0,059 |
| Polifarmacia | 790 | – | – | – | 1,30 (0,99-1,69) | 0,058 |
ABVD: actividades básicas de la vida diaria; HR: hazard ratio; IC: intervalo de confianza.
Modelo 1: Ajustado por edad y sexo. Prueba ómnibus de coeficientes de modelo: -2log verosimilitud 4542,306 (p < 0,001).
Modelo 2: Ajustado por edad, sexo, índice de Charlson, creatinina sérica (mg/dl), institucionalización y polifarmacia (≥ 5 fármacos). Prueba ómnibus de coeficientes de modelo: -2log verosimilitud 4491,012 (p < 0,001).
Figura 2.
Supervivencia a los 10 años según categorías de funcionalidad y anemia.
Modelo 2: Ajustado por edad, sexo, índice de Charlson, creatinina sérica (mg/dl), institucionalización y polifarmacia (≥ 5 fármacos).
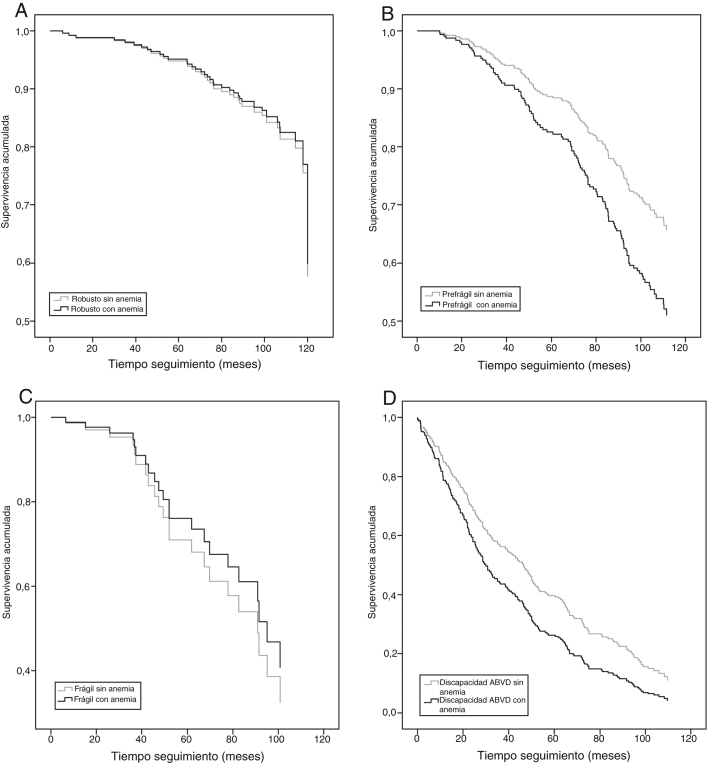
Por último, y en un análisis por categorías funcionales separadas, aquellos con anemia presentaron una menor mediana de supervivencia en todos los grupos con anemia, aunque solo con significación estadística en el grupo de prefrágiles y de discapacitados (fig. 3). Las medianas de supervivencia para los cuatro grupos funcionales según tuvieran o no anemia fueron respectivamente: robustos 98,0 y 107,1 meses (HR: 0,93; IC 95%: 0,28-3,11); prefrágiles 97,5 y 102,8 meses (HR: 1,60; IC 95%: 1,00-2,57); frágiles 52,0 y 95,9 meses (HR: 0,80; IC 95%: 0,22-2,89); con discapacidad en ABVD 24,2 y 48,6 meses (HR: 1,45; IC 95%: 1,08-1,94).
Figura 3.
Supervivencia a los 10 años según categorías de funcionalidad y anemia.
A: Participantes robustos. Ómnibus de coeficientes de modelo: -2log verosimilitud 363,759 (p < 0,001). B: Participantes prefrágiles. Ómnibus de coeficientes de modelo: -2log verosimilitud 1202,853 (p < 0,001). C: Participantes frágiles. Ómnibus de coeficientes de modelo: -2log verosimilitud 118,929 (p < 0,001). D: Participantes con discapacidad en actividades básicas de la vida diaria. Ómnibus de coeficientes de modelo: -2log verosimilitud 2012,473 (p < 0,001).
Discusión
La principal conclusión del presente trabajo es que la anemia en el adulto mayor, definida por los criterios de la OMS, incrementa el riesgo de mortalidad a 10 años en una población de sujetos con edad igual o mayor de 70 años de Albacete capital asociado a fragilidad y discapacidad para ABVD.
En los últimos años, numerosos trabajos han constatado que la anemia en la población anciana se relaciona con un mayor riesgo de mortalidad1, 2, 3, 4, al igual que existe evidencia de que tanto la fragilidad como la discapacidad por sí mismas son predictores de mortalidad15, 16, 30, 31. Sin embargo, no existen estudios que hayan abordado directamente el impacto de la anemia en la supervivencia ajustada al nivel de función de manera semejante a como se ha llevado a cabo el presente estudio. Solo el estudio Women's Health and Aging Study I detectó una asociación entre anemia y mortalidad a 5 años en mujeres mayores con discapacidad moderada-severa, pero sin analizar el efecto sobre la fragilidad2.
Por otra parte, diferentes estudios han documentado claras asociaciones entre anemia y resultados adversos relacionados con la función tales como fragilidad18, 19 o discapacidad4, 7, 11. Sin embargo, si estas asociaciones son verdaderamente causales o no es un hecho que todavía no se ha establecido, siendo uno de los principales motivos la escasez de trabajos longitudinales y de estudios de intervención al respecto. En apoyo a la hipótesis de que la anemia fuera un elemento causal capaz por sí misma de contribuir a estos resultados funcionales adversos se han propuestos diferentes mecanismos biológicamente plausibles. Uno de estos mecanismos estaría vinculado principalmente a la condición de hipoxia tisular resultante. Así, en el músculo esta situación podría limitar la capacidad aeróbica máxima y submáxima provocando síntomas de mala tolerancia a la actividad física que se traducirían en la aparición de fatiga11, 32 y debilidad muscular7. Además, estos síntomas, también limitarían la actividad física diaria y las ABVD favoreciendo el desuso. El resultado final sería la sarcopenia, entrando de esta forma en el ciclo de la fragilidad hacia la cascada de la discapacidad. Otros autores han planteado la hipótesis de que la propia inflamación crónica de bajo grado contribuiría al desarrollo de la anemia en el anciano, que a su vez favorecería la fragilidad20, 21. Sin embargo, hasta el momento no se ha podido establecer una relación de causa y efecto entre anemia, fragilidad e inflamación crónica21.
Nuestros hallazgos tienen varias implicaciones. La anemia en el anciano es un problema de salud potencialmente reversible y susceptible de tratamiento, añadiendo a esta consideración su fácil detección mediante la medición de la concentración plasmática de Hb como parámetro de laboratorio sencillo, barato y accesible a cualquier ámbito asistencial, y en especial en atención primaria. Así, el hecho de que la anemia se asocie con un mayor riesgo de mortalidad en sujetos mayores con prefragilidad, fragilidad y discapacidad para ABVD, pero no en robustos, identifica a un subgrupo importante de ancianos de alto riesgo en donde la detección, el diagnóstico y el abordaje de la anemia pudieran ayudar a aumentar su supervivencia. Sin embargo, los riesgos y los beneficios de la intervención de la anemia entre los adultos mayores, y en especial en este subgrupo, siguen siendo desconocidos en la actualidad.
La principal fortaleza del presente trabajo es que la cohorte analizada es de base poblacional, seleccionada mediante muestreo aleatorio estratificado, incluyendo tanto a sujetos de la comunidad como institucionalizados, lo que dota de mayor validez a los resultados obtenidos. Otra fortaleza relevante fue la alta tasa de participación, del 84,7%, probablemente debido al medio urbano en que nos encontramos, una capital de provincia mediana con mayoritaria afiliación a la seguridad social y fácil acceso a los dispositivos asistenciales sanitarios, además de un alto grado de conocimiento del Servicio de Geriatría del Complejo Hospitalario. Otro posible factor adicional pudo ser el método de reclutamiento (carta informativa y posterior llamada telefónica personalizada). En último lugar, resaltar que el equipo investigador y los entrevistadores se mantuvieron estables a lo largo de todo el estudio, lo que garantiza exactitud y rigor en todo el proceso. En cuanto a las posibles debilidades, nuestro estudio no incluye un análisis real de la etiología de la anemia en los sujetos participantes, ni datos sobre marcadores inflamatorios, por lo que no podemos especular sobre la magnitud de este efecto.
En conclusión, nuestros resultados podrían sugerir que la identificación de la anemia, su estudio y su corrección en ancianos con alto riesgo pudiera ser un elemento pronóstico para tener en cuenta como parte de las intervenciones actuales para revertir fragilidad, por su relación con la supervivencia. La posibilidad de que la corrección de anemia pudiera ser una de las pocas causas potencialmente reversibles de fragilidad es una idea particularmente atractiva. Por todo ello, sería de interés poder disponer de un mayor número de estudios que permitiesen esclarecer la relación tan compleja que existe entre anemia y fragilidad, y de estudios de intervención para evaluar la seguridad y la eficacia de los diferentes tratamientos según la etiología de la anemia en la población anciana y, en concreto, en sujetos frágiles, en términos de calidad de vida, funcionalidad y mortalidad.
Lo conocido sobre el tema
-
•
La anemia en el adulto mayor se relaciona con un mayor riesgo de mortalidad, y de igual manera, tanto la fragilidad como la discapacidad por sí mismas son predictores de mortalidad.
Qué aporta este estudio
-
•
La anemia incrementa el riesgo de mortalidad a largo plazo asociado a la fragilidad y discapacidad en adultos mayores, actuando como factor modulador en esta asociación.
-
•
Los resultados del presente trabajo sugieren que la identificación de la anemia, su estudio y su corrección en ancianos con alto riesgo podría ser un elemento pronóstico para tener en cuenta como parte de las intervenciones actuales para revertir fragilidad, por su relación con supervivencia.
Financiación
Este trabajo ha sido financiado por CIBERFES (CB16/10/00408), Instituto de Salud Carlos III, Ministerio de Economía y Competitividad, España. Ayuda cofinanciada por el Fondo Europeo de Desarrollo Regional FEDER Una Manera de hacer Europa.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
A todos los participantes en el estudio FRADEA.
Bibliografía
- 1.Izaks G.J., Westendorp R.G., Knook D.L. The definition of anemia in older persons. JAMA. 1999;281:1714–1717. doi: 10.1001/jama.281.18.1714. [DOI] [PubMed] [Google Scholar]
- 2.Chaves P.H., Xue Q.L., Guralnik J.M., Ferruci L., Volpato S., Fried L.P. What constitutes normal hemoglobin concentration in community-dwelling disabled older women? J Am Geriatr Soc. 2004;52:1811–1816. doi: 10.1111/j.1532-5415.2004.52502.x. [DOI] [PubMed] [Google Scholar]
- 3.Zakai N.A., Katz R., Hirsch C., Shlipak M.G., Chaves P.H., Newman A.B. A prospective study of anemia status, haemoglobin concentration, and mortality in an elderly cohort. Arch Intern Med. 2005;165:2214–2220. doi: 10.1001/archinte.165.19.2214. [DOI] [PubMed] [Google Scholar]
- 4.Contreras M.M., Formiga F., Ferrer A., Chivite D., Padrós G., Montero A. Profile and prognosis of patients over 85 years old with anemia living in the community. Octabaix Study. Rev Esp Geriatr Gerontol. 2015;50:211–215. doi: 10.1016/j.regg.2014.11.004. [DOI] [PubMed] [Google Scholar]
- 5.Thein M., Ershler W.B., Artz A.S., Tecson J., Robinson B.E., Rothstein G. Diminished quality of life and physical function in community-dwelling elderly with anemia. Medicine. 2009;88:107–114. doi: 10.1097/MD.0b013e31819d89d5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Agnihotri P., Telfer M., Butt Z., Zella A., Cella D., Kozma C.M. Chronic anemia and fatigue in elderly patients: Results of a randomized, double-blind, placebo-controlled, crossover exploratory study with epoetin alfa. J Am Geriatr Soc. 2007;55:1557–1565. doi: 10.1111/j.1532-5415.2007.01357.x. [DOI] [PubMed] [Google Scholar]
- 7.Penninx B.W., Pahor M., Cesari M., Corsi A.M., Woodman R.C., Bandinelli S. Anemia is associated with disability and decreased physical performance an muscle strength in the elderly. J Am Geriatr Soc. 2004;52:719–724. doi: 10.1111/j.1532-5415.2004.52208.x. [DOI] [PubMed] [Google Scholar]
- 8.Blanc B., Finch C.A., Hallberg L., Herbert V., Lawkowicz W., Layrisse M. Nutritional anaemias. Report of a WHO Scientific Group. WHO Tech Rep Ser. 1968;405:1–40. [PubMed] [Google Scholar]
- 9.Espinoza S., Walston J.D. Frailty in older adults: Insights and interventions. Cleve Clin J Med. 2005;72:1105–1112. doi: 10.3949/ccjm.72.12.1105. [DOI] [PubMed] [Google Scholar]
- 10.Artz A.S. Anemia and the frail elderly. Semin Hematol. 2008;45:261–266. doi: 10.1053/j.seminhematol.2008.06.002. [DOI] [PubMed] [Google Scholar]
- 11.Chaves P.H. Functional outcome of anemia in older adults. Semin Hematol. 2008;45:255–260. doi: 10.1053/j.seminhematol.2008.06.005. [DOI] [PubMed] [Google Scholar]
- 12.World Health Organization (WHO): Informe mundial sobre el envejecimiento y la salud 2015 [consultado 28 Dic 2018]. Disponible en: https://www.who.int/ageing/events/world-report-2015-launch/en/
- 13.Rodríguez-Laso A, Caballero Mora MA, García Sánchez I, et al. State of the art report on the prevention and management of frailty. Joint Action ‘724099/ADVANTAGE’. Disponible en: http://www.advantageja.eu/images/State-of-the-Art-ADVANTAGE-JA.pdf
- 14.Hoogendijk E.O., Romero L., Sánchez-Jurado P.M., Flores Ruano T., Viña J., Rodriguez Mañas L. A new functional classification base on frailty and disability stratifies the risk for mortality among older adults: The FRADEA study. J Am Med Dir Assoc. 2019 doi: 10.1016/j.jamda.2019.01.129. [Epub ahead of print] [DOI] [PubMed] [Google Scholar]
- 15.Abizanda P., Romero L., Sánchez-Jurado P.M., Martínez-Reig M., Alfonso-Silguero S.A., Rodríguez-Mañas L. Age, frailty, disability, institutionalization, multimorbidity or comorbidity Which are the main targets in older adults? J Nutr Health Aging. 2014;18:622–627. doi: 10.1007/s12603-014-0033-3. [DOI] [PubMed] [Google Scholar]
- 16.Kojima G., Iliffe S., Walters K. Frailty index as a predictor of mortality: A systematic review and meta-analysis. Age Ageing. 2017;13:1–8. doi: 10.1093/ageing/afx162. [DOI] [PubMed] [Google Scholar]
- 17.Angulo J., el Assar M., Rodriguez-Mañas L. Frailty and sarcopenia as the basis for the phenotypic manifestation of chronic diseases in older adults. Mol Aspects Med. 2016;50:1–32. doi: 10.1016/j.mam.2016.06.001. [DOI] [PubMed] [Google Scholar]
- 18.Palmer K., Vetrano D.L., Marengoni A., Tummolo A.M., Villani E.R., Acampora N. The relationship between anaemia and frailty: A systematic review and meta-analysis of observational Studies. J Nutr Health Aging. 2018;22:965–974. doi: 10.1007/s12603-018-1049-x. [DOI] [PubMed] [Google Scholar]
- 19.Hirani V., Naganathan V., Blyth F., le Couteur D.G., Kelly P., Handelsman D.J. Cross-sectional and longitudinal associations between anemia and frailty in older Australian men: The Concord Health and Aging in Men Project. J Am Med Dir Assoc. 2015;16:614–620. doi: 10.1016/j.jamda.2015.02.014. [DOI] [PubMed] [Google Scholar]
- 20.Leng S., Chaves P., Koening K., Walston J. Serum interleukin-6 and hemoglobin as physiological correlates in the geriatric syndrome of frailty: A pilot study. J Am Geriatr Soc. 2002;50:1268–1271. doi: 10.1046/j.1532-5415.2002.50315.x. [DOI] [PubMed] [Google Scholar]
- 21.Röhrig G. Anemia in the frail, elderly patient. Clin Interv Aging. 2016;11:319–326. doi: 10.2147/CIA.S90727. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Caballero B., Rubio-González A., Potes Y., Martínez-Reig M., Sánchez-Jurado P.M., Romero L. Associations of the antioxidant capacity and hemoglobin levels with functional physical performance of the upper and lower body limbs. Age (Dordr). 2014;36:851–867. doi: 10.1007/s11357-013-9607-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Hirani V., Naganathan V., Blyth F., le Couteur D.G., Seibel M.J., Waite L.M. Low hemoglobin concentrations are associated with sarcopenia, physical performance, and disability in older Australian men in cross-sectional and longitudinal analysis: The Concord Health and Ageing in Men Project. J Gerontol A Biol Sci Med Sci. 2016;71:1667–1675. doi: 10.1093/gerona/glw055. [DOI] [PubMed] [Google Scholar]
- 24.Coto Montes A., Boga J., Bermejo Millo C., Rubio González A., Potes Ochoa Y., Vega Naredo. Potential early biomarkers of sarcopenia among independent older adults. Maturitas. 2017;104:117–122. doi: 10.1016/j.maturitas.2017.08.009. [DOI] [PubMed] [Google Scholar]
- 25.Abizanda Soler P., López-Torres Hidalgo J., Romero Rizos L., López Jiménez M., Sánchez Jurado P.M., Atienzar Núñez P. Frailty and dependence in Albacete (FRADEA Study): Reasoning, design and methodology. Rev Esp Geriatr Gerontol. 2011;46:81–88. doi: 10.1016/j.regg.2010.10.004. [DOI] [PubMed] [Google Scholar]
- 26.Ministerio de Sanidad, Servicios Sociales e Igualdad (MSSSI). Documento de consenso sobre prevención de fragilidad y caídas en la persona mayor. Estrategia de Promoción de la Salud y Prevención en el SNS. 2014. Disponible en: http://www.msssi.gob.es/profesionales/saludPublica/prevPromocion/Estrategia/docs/FragilidadyCaidas_personamayor.pdf
- 27.Fried L.P., Tangen C.M., Walston J., Newman A.B., Hirsch C., Gottdiener J. Frailty in older adults: Evidence for a phenotype. J Gerontol A Biol Sci Med Sci. 2001;56:M146–M156. doi: 10.1093/gerona/56.3.m146. [DOI] [PubMed] [Google Scholar]
- 28.Mahoney F.I., Barthel D.W. Functional evaluation: The Barthel Index. Md State Med J. 1965;14:61–65. [PubMed] [Google Scholar]
- 29.Gnjidic D., Hilmer S.N., Blyth F.M., Naganathan V., Waite L., Seibel M.J. Polypharmacy cutoff and outcomes: five o more medicines were used to identify community-dwelling older men at risk of different adverse outcomes. J Clin Epidemiol. 2012;65:989–1065. doi: 10.1016/j.jclinepi.2012.02.018. [DOI] [PubMed] [Google Scholar]
- 30.Pongiglione B., de Stavola B.L., Kuper H., Ploubidis G.B. Disability and all-cause mortality in the older population: Evidence from the English Longitudinal Study of Ageing. Eur J Epidemiol. 2016;31:735–746. doi: 10.1007/s10654-016-0160-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Martínez-Reig M., Flores Ruano T., Fernández Sánchez M., Noguerón García A., Romero Rizos L., Abizanda Soler P. Frailty and long term mortality, disability and hospitalization in Spanish older adults. The FRADEA study. Rev Esp Geriatr Gerontol. 2016;51:254–259. doi: 10.1016/j.regg.2016.01.006. [DOI] [PubMed] [Google Scholar]
- 32.Evans W.J., Lambert C.P. Physiological basis of fatigue. Am J Phys Med Rehabil. 2007;86(Suppl 1):S29–S46. doi: 10.1097/phm.0b013e31802ba53c. [DOI] [PubMed] [Google Scholar]