Abstract
目的
明确西格列汀对牙龈卟啉单胞菌脂多糖(LPS)诱导的人牙龈成纤维细胞(HGF)炎症反应的影响,并探讨其发挥作用的分子学机制,为未来西格列汀在牙周炎治疗中的应用提供初步的实验依据。
方法
收集临床患者健康牙龈组织标本,利用酶消化法分离培养HGF并进行细胞来源鉴定;采用细胞增殖-毒性检测试剂盒检测LPS和西格列汀与HGF共培养24、48 h细胞增殖变化;通过实时荧光定量聚合酶链式反应(qRT-PCR)检测炎性细胞因子白细胞介素(IL)-6、IL-8、趋化因子配体2(CCL2)、超氧化物歧化酶2(SOD2)的基因表达水平;酶联免疫吸附实验检测细胞培养上清液中IL-6、IL-8和CCL2的蛋白表达水平;应用蛋白免疫印迹法检测核因子-κB(NF-κB)信号通路的激活情况,通过qRT-PCR验证NF-κB通路抑制剂BAY11-7082对LPS诱导的HGF炎症细胞因子基因表达水平的影响。
结果
低浓度的西格列汀(0.1、0.25、0.5 µmol·L−1)作用24、48 h对HGF的生长无影响,而高浓度西格列汀(5~1 000 µmol·L−1)明显抑制了细胞增殖。西格列汀浓度依赖性抑制5 µg·mL−1 LPS诱导的HGF中IL-6、IL-8、CCL2和SOD2的基因表达水平。此外,西格列汀显著抑制LPS诱导的IL-6、IL-8和CCL2蛋白表达水平。蛋白免疫印迹结果表明:0.5 µmol·L−1西格列汀显著性抑制了LPS诱导的NF-κB信号通路激活,qRT-PCR结果表明0.5 µmol·L−1西格列汀与5 µmol·L−1BAY11-7082均显著抑制了LPS诱导的IL-6、IL-8、CCL2和SOD2的基因表达水平。
结论
西格列汀通过阻断NF-κB信号通路的激活来抑制LPS诱导的HGF炎症反应。
Keywords: 西格列汀, 脂多糖, 核因子-κB, 炎症, 人牙龈成纤维细胞
Abstract
Objective
This study was performed to clarify the effects of sitagliptin on Porphyromonas gingivalis-lipopolysaccharide (LPS)-induced inflammatory response in human gingival fibroblasts (HGFs), explore the molecular mechanism of its roles, and provide a foundation for clinical therapeutics in periodontitis.
Methods
Healthy gingival samples were collected from the donors. HGFs were isolated with enzymic digestion method and identified. The effects of LPS and sitagliptin on cell viability were detected by cell-counting kit-8 (CCK8). The mRNA levels of inflammatory cytokines, namely, interleukin (IL)-6, IL-8, C-C motif ligand 2 (CCL2), and superoxide dismutase 2 (SOD2), were evaluated by quantity real-time polymerase chain reaction (qRT-PCR) and enzyme-linked immune sorbent assay (ELISA) was used to measure the secretion protein levels of IL-6, IL-8, and CCL2. Western blot analysis was used to further investigate the activation of nuclear factor (NF)-κB signaling pathway. The effect of NF-κB pathway inhibitor BAY11-7082 on LPS-induced HGF inflammatory cytokines at the gene level was verified by qRT-PCR.
Results
Low concentrations of sitagliptin (0.1, 0.25, and 0.5 µmol·L−1) did not affect HGF growth in 24 and 48 h, whereas high concentrations of sitagliptin (5-1 000 µmol·L−1) significantly inhibited cell proliferation. Sitagliptin suppressed 5 µg·mL−1 of LPS-induced IL-6, IL-8, CCL2, and SOD2 gene expression levels in HGF in a concentration-dependent manner. Furthermore, sitagliptin significantly decreased the elevated secretion of IL-6, IL-8, and CCL2 protein induced by LPS. Western blot analysis showed that 0.5 µmol·L−1 of sitagliptin significantly inhibited LPS-induced NF-κB signaling pathway activation. Results of qRT-PCR analysis indicated that 0.5 µmol·L−1 of sitagliptin and 5 µmol·L−1 of BAY11-7082 significantly inhibited LPS-induced IL-6, IL-8, CCL2, and SOD2 gene expressions.
Conclusion
Sitagliptin could significantly inhibit LPS-induced HGF inflammatory response by blocking the NF-κB signaling pathway activation.
Keywords: Sitagliptin, lipopolysaccharide, nuclear factor-κB, inflammation, human gingival fibroblasts
牙周炎是一种由微生物、宿主免疫反应、环境和遗传危险因素等多因素共同作用引起的慢性炎症性破坏性疾病[1],造成宿主牙周附着丧失、牙槽骨吸收,最终导致牙齿松动脱落[2]。目前的研究表明,菌斑生物膜是牙周炎的始动因素,但生物膜与宿主炎症免疫反应之间的相互作用是牙周组织破坏的主要原因[3],牙周致病菌攻击宿主并激活免疫系统,诱发宿主慢性炎症反应,进而损伤牙周组织[4]。牙龈卟啉单胞菌是一种重要的牙周致病菌,作为经典的红色复合体成员与慢性牙周炎的发生发展密切相关[5],脂多糖(lipopolysaccharide,LPS)是牙龈卟啉单胞菌细胞壁的主要构成成分,是一种重要的微生物毒力因子,可以引起宿主免疫反应,促使牙周组织破坏[6]。
牙龈炎症反应是牙周炎的最初表现[7],人牙龈成纤维细胞(human gingival fibroblast,HGF)是牙龈结缔组织中最丰富的细胞,可直接与细菌和细菌产物相互作用,在牙周炎进展中起重要作用[8]。尽管HGF不属于天然的炎性细胞范畴,但它们可以提供信号来吸引和调节炎症细胞的浸润并清除必要部位的感染,还可以确保在初始炎症解决后继续清除浸润的炎症细胞,成纤维细胞功能失调可能会导致炎症反应的时间延长,因此,HGF在保护牙周组织免受外源性刺激方面发挥极其重要的作用[9]–[12]。LPS刺激可诱导HGF免疫反应并激活与炎症基因的调节密切相关的核因子(nuclear factor,NF)-κB信号转导途径,在牙周结缔组织中诱导促炎细胞因子如白细胞介素(interleukin,IL)-1、IL-6、IL-8等的产生[8],[13]。此外,在牙周炎反应过程中还观察到超氧化物歧化酶2(superoxide dismutase 2,SOD2)和趋化因子配体2(C-C motif ligand 2,CCL2)的上调[14]–[15],从而形成牙周组织破坏的微环境。
西格列汀是一种新型的降糖药物,于2006年获得美国食品药品监督管理局的批准而上市,可单独使用或与其他药物联合使用来治疗2型糖尿病[16]。西格列汀除了具有显著的降糖作用,还具有抗炎[17]、抗肿瘤[18]、肾脏保护[19]、心血管保护[20]和促组织再生[21]等多种生物活性和药理作用。西格列汀的抗炎作用已有相关报道,可显著降低2型糖尿病患者的促炎细胞因子如C反应蛋白和肿瘤坏死因子(tumor necrosis factor,TNF)-α,同时增加抗炎细胞因子IL-10的表达[17]。此外,西格列汀也可通过抑制NF-κB的活性,在RINm细胞系中发挥抗炎作用[22]。然而,西格列汀对HGF的免疫炎症反应未见相关报道。因此,本研究的主要目的是初步探讨西格列汀对LPS诱导的HGF炎症反应的影响,并进一步阐明其潜在的分子学作用机制,为临床应用西格列汀防治牙周炎提供基础性理论依据。
1. 材料和方法
1.1. 试剂与材料
改良伊格尔培养基(Dulbecco's modified Eagle medium,DMEM)、磷酸盐缓冲液(phosphate-buffered saline,PBS)(Hyclone公司,美国);胎牛血清(fetal bovine serum,FBS,BioInd公司,以色列);青-链霉素混合液(100 U·mL−1青霉素,100 mg·mL−1链霉素),Ⅰ型胶原酶、分散酶Ⅱ、西格列汀(Sigma Aldrich公司,美国);0.25%胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)溶液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、含吐温的三羟甲基氨基甲烷缓冲液(tris-buffered saline Tween,TBST)缓冲液、放射免疫沉淀测定(radio immunoprecipitation assay,RIPA)细胞裂解液、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)蛋白酶抑制剂(北京市索莱宝生物科技有限公司);磷酸酶抑制剂(武汉市博士德生物工程有限公司);TRIzol、逆转录试剂盒和实时荧光定量聚合酶链式反应(quantity real-time polymerase chain reaction,qRT-PCR)试剂盒(Takara公司,日本);IL-6、IL-8、CCL2酶联免疫吸附实验检测试剂盒(Biolegend公司,美国);细胞计数试剂盒(cell-counting kit,CCK)-8细胞活性检测试剂盒(Dojindo公司,日本);牙龈卟啉单胞菌LPS(InvivoGen公司,美国);NF-κB抑制剂BAY11-7082(Abcam公司,英国);兔抗人3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、兔抗人波形丝蛋白抗体、兔抗人角蛋白17抗体、荧光标记山羊抗兔二抗、山羊抗兔二抗、山羊抗鼠二抗(Proteintech公司,美国);兔抗人NF-κB p65、p-p65、p-IκBα,鼠抗人IκBα一抗(Cell Signaling Technology公司,美国);增强化学发光(enhanced chemiluminescence,ECL)液、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(Millipore公司,美国)。
1.2. 主要仪器
二氧化碳恒温培养箱(Thermo公司,美国),倒置相差显微镜及照相系统(OLYMPUS公司,日本),罗氏480Ⅱ型qRT-PCR仪(Roche公司,瑞士),SPECTRO star Nano酶标仪(BMG Labtech公司,德国),Amersham Imager 600凝胶成像系统(GE Healthcare Life Sciences公司,美国)。
1.3. 方法
1.3.1. 分离与培养HGF
从2018年12月至2019年4月在山东大学口腔医院颌面外科招募6名需拔除埋伏阻生齿的健康志愿者(16~20岁,3名男性和3名女性;平均年龄18岁),收集其术中切除的少量牙龈组织。该项目根据2013年修订的1975年赫尔辛基宣言的指导原则,将研究项目告知所有志愿者,并签署知情同意书。本研究方案已获得山东大学口腔医学院医学伦理委员会批准(协议编号:GR201801)。
将分离出的牙龈组织直接浸入含有5%抗生素(100 U·mL−1青霉素、100 mg·mL−1链霉素)的预冷DMEM培养液中,迅速转移到实验室。在超净工作台内,将牙龈组织转移到无菌培养皿中,用含5%抗生素的PBS冲洗4次,去除上皮后将结缔组织剪成约1~3 mm2的碎片,将剪碎的牙龈组织转移到含3 mg·mL−1Ⅰ型胶原酶和4 mg·mL−1分散酶Ⅱ的无菌EP管内,将EP管置于37 °C水浴锅中消化组织2 h,每隔10 min进行摇晃,促使其消化完全。消化完成后,加入含10%FBS的DMEM培养液中和消化液,1 000 r·min−1离心5 min后,弃上清,利用含20%FBS的DMEM重悬细胞,将单细胞接种到T25培养瓶中,在37 °C、5%CO2的培养箱中孵育,当HGF达到80%~90%融合时,用0.25%胰蛋白酶-EDTA传代,传代的HGF以1∶3的稀释比在不含抗生素的10%FBS DMEM培养基中培养。选取第3~5代的HGF用于后续实验。
1.3.2. HGF的鉴定
将培养的第3代HGF以每孔4×104个的密度均匀接种于24孔板内,于37 °C,5%CO2培养箱里孵育24 h使细胞完全贴壁。用4%多聚甲醛液固定细胞30 min后预冷PBS冲洗3遍,0.1%Triton X-100室温下破膜15 min,加入含1%BSA的PBS液体封闭30 min。弃去封闭液,分别孵育稀释的波形丝蛋白一抗(1∶300)和角蛋白17一抗(1∶300)4 °C孵育过夜。弃染液,滴入含荧光的二抗(1∶500)孵育1 h,利用DAPI染核5 min,在暗室中的荧光显微镜下观察,拍照。
1.3.3. CCK8检测细胞活性
将HGF以每孔5 000个的密度接种于96孔板中,将培养板置于37 °C、5%CO2的恒温培养箱中孵育过夜。将细胞培养基更换为含0、0.1、0.25、0.5、5、10、100、200、500和1 000 µmol·L−1西格列汀的新鲜培养基,与HGF作用 24、48 h后,进行CCK-8检测。同时检测西格列汀(0.1、0.25、0.5 µmol·L−1)与LPS(5 µg·mL−1)[23]共同作用24 h、48 h对HGF活性的影响。各组培养结束后,弃去原有培养基,PBS冲洗2次,每孔加入含10% CCK8的100 µL DMEM培养基。将培养板置于37 °C恒温孵育箱内孵育2.5 h,使用酶标仪检测各孔在450 nm波长处的吸光度值。
1.3.4. 实时荧光定量PCR
将HGF以每孔2.5×105个的密度接种于6孔板中,实验分为5组检测不同浓度西格列汀对炎症因子的影响,即空白对照组、LPS组、LPS+0.1 µmol·L−1西格列汀(LPS+0.1)组、LPS+0.25 µmol·L−1西格列汀(LPS+0.25)组、LPS+0.5 µmol·L−1西格列汀(LPS+0.5)组,同时分别于12和24 h后收集培养上清液用于后续检测。为了进一步证实西格列汀通过NF-κB通路抑制炎症因子的表达,加入5 µmol·L−1 NF-κB通路抑制剂BAY11-7082验证通路,分为4组:1)对照组:常规培养,不做处理;2)LPS组:加入5 µg·mL−1 LPS;3)LPS+西格列汀组:加入0.5 µmol·L−1西格列汀和5 µg·mL−1 LPS;4)LPS+NF-κB抑制剂BAY11-7082组:加入5 µmol·L−1 BAY11-7082和5 µg·mL−1 LPS,加药培养24 h。使用TRIzol法提取细胞总RNA,Nanodrop超微量分光光度计检测RNA含量后,按逆转录试剂盒说明书以1 000 ng总RNA逆转录成cDNA,使用qRT-PCR试剂盒和罗氏480Ⅱ型qRT-PCR仪检测IL-6、IL-8、SOD2和CCL2的mRNA水平。以GAPDH为管家基因,通过计算ΔCt(目的基因Ct-管家基因平均Ct),目标基因的表达水平表示为2−(ΔCt)。引物序列见表1。反应条件为95 °C持续30 s激活热启动酶,然后将cDNA扩增45个循环,包括在95 °C变性5 s和60 °C延伸30 s。
表 1. qRT-PCR引物序列.
Tab 1 Primer sequences for qRT-PCR
| 引物 | 序列(5′-3′) |
| GAPDH | 上游:ACCACAGTCCATGCCATCAC |
| 下游:ACCACCCTGTTGCTGTA | |
| IL-6 | 上游:ATAACCACCCCTGACCCAAC |
| 下游:CCCATGCTACATTTGCCGAA | |
| IL-8 | 上游:TCAGAGACAGCAGAGCACAC |
| 下游:GGCAAAACTGCACCTTCACA | |
| CCL2 | 上游:CAGCCAGATGCAATCAATGCC |
| 下游:TGGAATCCTGAACCCACTTCT | |
| SOD2 | 上游:GGGATTGATGTGTGGGAGCA |
| 下游:CATAAAGAGCTTAACATACTCAGCA |
1.3.5. 酶联免疫吸附试验
1.3.4所述的培养上清液用于检测IL-6、IL-8和CCL2的蛋白浓度。将收集的培养上清液于4 °C、12 000 r·min−1高速离心机内离心5 min去除细菌和死细胞沉淀后收集上清液,根据酶联免疫吸附试验试剂盒说明书进行操作,使用酶标仪测量450 nm波长的吸光度值,计算细胞培养上清液中IL-6、IL-8和CCL2的蛋白含量。
1.3.6. 蛋白提取及蛋白免疫印迹实验
将HGF以每孔2.5×105个的密度接种于6孔板中,于37 °C培养箱内孵育过夜,待细胞贴壁后根据实验分组进行实验。本研究利用NF-κB信号通路抑制剂BAY11-7082作为阳性对照,研究0.5 µmol·L−1西格列汀对LPS诱导的HGF中NF-κB信号通路变化的影响。本实验分为4组。1)对照组:常规培养,不做处理;2)LPS组:加入5 µg·mL−1 LPS;3)LPS+西格列汀组:加入0.5 µmol·L−1西格列汀和5 µg·mL−1 LPS;4)LPS+NF-κB抑制剂BAY11-7082组:加入5 µmol·L−1 BAY11-7082和5 µg·mL−1 LPS。37 °C条件下LPS诱导2 h,待各组处理结束后弃掉原培养基,用预冷的PBS洗涤3次,向各孔内加入含有1%蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,将培养板置于冰上裂解30 min。使用细胞刮刀收集蛋白于离心管内,超声裂解后于4 °C、12 000 r·min−1离心5 min,收集上清液并转移到新的离心管。使用BCA蛋白测定试剂盒测定各组蛋白浓度,向每组加入蛋白上样缓冲液后,于100 °C条件下煮沸5 min进行蛋白变性。经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳后,将蛋白转至PVDF膜。室温下将膜用5%脱脂奶粉封闭1 h,然后与以下一抗在4 °C下孵育过夜:NF-κB p65,p-p65,IκBα,p-IκBα(1∶1 000);GAPDH(1∶10 000)。次日,用TBST洗涤3次,辣根过氧化物酶结合的抗兔和抗小鼠二抗(1∶10 000)在室温下孵育1 h,TBST洗涤3次。ECL发光液显影,并使用超灵敏成像仪进行扫描。使用Image J 1.44软件来定量蛋白质表达。
1.4. 统计学分析
采用Graphpad Prism 6软件对实验数据进行统计学分析,所有计量资料统计结果以Mean±SD表示,用单因素方差分析进行数据统计分析,P<0.05被认为差异有统计学意义。
2. 结果
2.1. HGF的分离和培养
原代培养的HGF生长7 d后,倒置显微镜下观察可见细胞呈集落样生长,呈旋涡状、放射状排列(图1A),细胞传代到第4代后,贴壁良好,生长旺盛,形态均一,细胞呈星形或长梭形,胞核呈圆形或卵圆形(图1B、C)。
图 1. 分离和培养HGF.
Fig 1 Isolation and culture of HGFs
A:原代培养HGF × 40;B:第4代HGF × 40;C:第4代HGF × 100。
2.2. HGF的鉴定
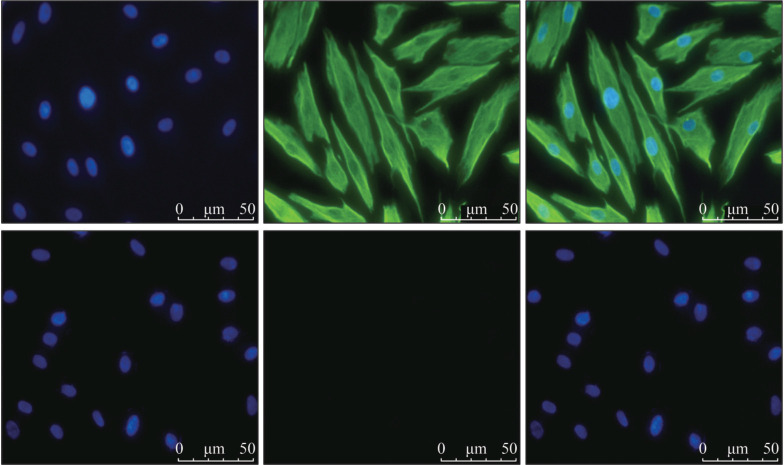
细胞免疫荧光检测的结果显示:在体外培养的HGF中,细胞波形丝蛋白染色呈阳性(图2中上),绿色荧光均匀分布在细胞浆内,细胞核呈蓝色荧光;细胞角蛋白17染色呈阴性(图2中下),仅见细胞核呈蓝色荧光,说明细胞来源于中胚层组织,无上皮组织来源细胞混杂。
图 2. HGF的鉴定 荧光显微镜 × 400.
Fig 2 Identification of HGFs fluorescence microscope × 400
上:波形丝蛋白染色阳性;下:角蛋白17染色阴性;左:DAPI;中上:波形丝蛋白;中下:角蛋白;右:图层合并。
2.3. 西格列汀和LPS对HGF活性的影响
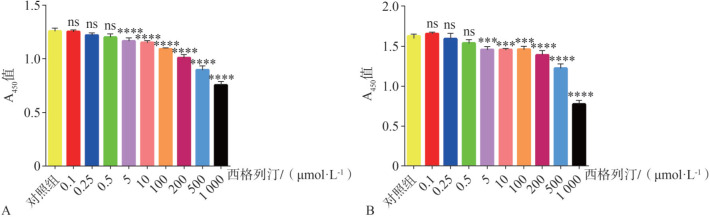
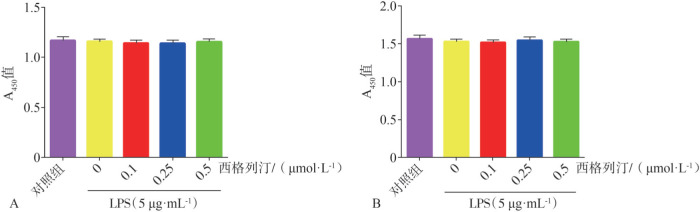
CCK8结果表明,低浓度的西格列汀(0.1、0.25和0.5 µmol·L−1)作用于HGF 24、48 h,对HGF的增殖没有明显影响(P>0.05,图3A、B)。与对照组相比,高浓度西格列汀(5~1 000 µmol·L−1)显著地抑制细胞增殖(P<0.001,图3A、B)。结果表明:5 µg·mL−1 LPS单独作用或与0.1、0.25和0.5 µmol·L−1西格列汀共同作用于HGF 24、48 h,对细胞增殖无明显影响(P>0.05,图4A、B)。基于本部分实验结果,本研究选取对HGF无明显毒性作用的低浓度西格列汀(0.1、0.25和0.5 µmol·L−1)与5 µg·mL−1 LPS进行后续实验。
图 3. 不同浓度西格列汀对HGF活性的影响.
Fig 3 Effects of sitagliptin at different concentrations on HGFs viability
A:24 h;B:48 h。与对照组相比,***P<0.001,****P<0.000; ns: 差异无统计学意义。
图 4. 不同浓度西格列汀和5 µg·mL−1 LPS共同作用对HGF活性的影响.
Fig 4 Effects of sitagliptin at different concentrations and 5 µg·mL−1 LPS on the viability of HGFs
A:24 h;B:48 h。
2.4. 西格列汀对LPS诱导的炎性细胞因子基因表达的影响
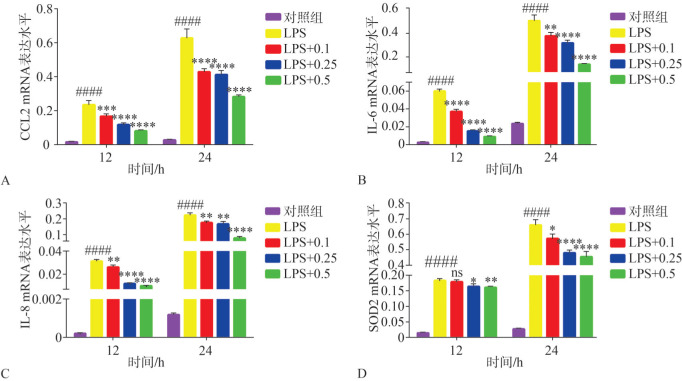
为了研究西格列汀对LPS诱导的HGF炎症反应的影响,本研究通过qRT-PCR检测了西格列汀与LPS共同作用12 h、24 h后细胞内CCL2、IL-6、IL-8和SOD2的基因表达水平。结果表明,相比于对照组,LPS显著上调了HGF中CCL2、IL-6、IL-8、SOD2的基因表达水平(P<0.000 1,图5),且24 h较12 h上调更为明显。西格列汀剂量依赖性地抑制LPS上调的CCL2(P<0.001,图5A)、IL-6(P<0.01,图5B)、IL-8(P<0.01,图5C)和SOD2(P<0.05,图5D)的表达。西格列汀对CCL2、IL-6与IL-8的基因表达水平的影响在12 h和24 h呈现一致变化,而西格列汀抑制SOD2的作用效果在24 h较12 h更为明显,0.1 µmol·L−1西格列汀作用于HGF 12 h对SOD2的基因表达水平无明显影响(P>0.05,图5D)。
图 5. 西格列汀对LPS诱导的HGF炎症细胞因子mRNA表达水平的影响.
Fig 5 Effects of sitagliptin on the mRNA expression levels of LPS-induced HGFs inflammatory cytokines
A:CCL2 mRNA表达水平;B:IL-6 mRNA表达水平;C:IL-8 mRNA表达水平;D:SOD2 mRNA表达水平。与对照组相比,####P<0.000 1;与LPS组相比,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1; ns:差异无统计学意义。
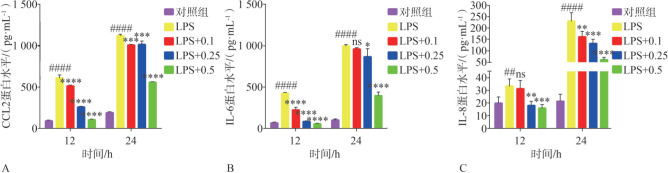
2.5. 西格列汀对LPS诱导的炎性细胞因子蛋白表达水平的影响
与对照组相比,HGF经LPS刺激12 h和24 h,培养上清液中的CCL2、IL-6、IL-8蛋白表达量呈不同程度升高,且24 h较12 h升高更为明显。西格列汀与LPS共同作用于HGFs 12 h和24 h后,与单独使用LPS组相比,0.1、0.25和0.5 µmol·L−1的西格列汀均显著性地降低了炎性细胞因子CCL2的蛋白表达水平(P<0.001,图 6A);对于IL-6,西格列汀与LPS共同作用于HGF 12 h,0.1、0.25和0.5 µmol·L−1的西格列汀可明显降低其表达(P<0.000 1),而在作用24 h时,低浓度的西格列汀(0.1 µmol·L−1)对LPS诱导的IL-6蛋白表达没有明显的抑制作用(P>0.05),而高浓度的西格列汀(0.25 µmol·L−1和0.5 µmol·L−1)则显著性地抑制了LPS诱导的IL-6分泌(P<0.05,图6B);对于IL-8的表达,西格列汀与LPS共同作用于HGF 12 h与24 h,0.25、0.5 µmol·L−1西格列汀均可显著性地降低LPS诱导的IL-8表达(P<0.01),而0.1 µmol·L−1的西格列汀作用24 h可以显著降低LPS诱导的IL-8表达(P<0.01),作用12 h则对IL-8蛋白的分泌无明显影响(P>0.05,图6C)。
图 6. 西格列汀对LPS诱导的HGF炎症细胞因子蛋白表达水平的影响.
Fig 6 Effects of sitagliptin on the protein expression levels of LPS-induced HGFs inflammatory cytokines
A:CCL2蛋白表达水平;B:IL-6蛋白表达水平;C:IL-8蛋白表达水平。与对照组相比,##P<0.01,####P<0.000 1;与LPS组相比,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;ns: 差异无统计学意义。
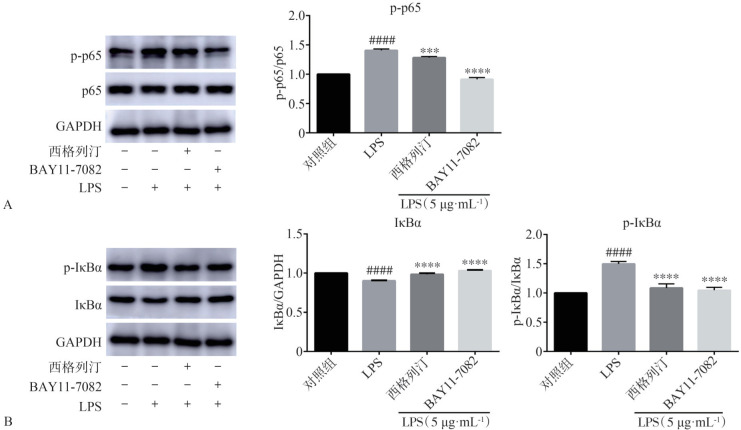
2.6. 西格列汀对LPS诱导的HGF中NF-κB信号通路的影响
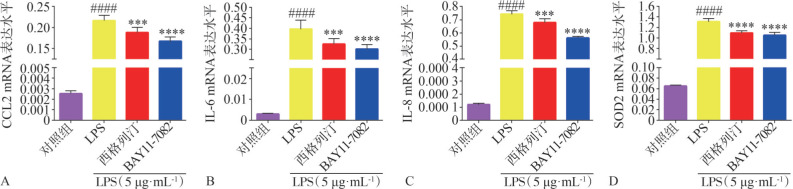
蛋白免疫印迹检测结果表明,LPS刺激HGF 2 h可通过促进IκBα降解(P<0.000 1)以及增加p-p65和p-IκBα蛋白表达水平(P<0.000 1),来激活NF-κB信号通路,而在0.5 µmol·L−1西格列汀和5 µmol·L−1 BAY11-7082处理组,LPS的作用则明显减弱(图7)。qRT-PCR分析结果表明,同正常对照组比较,LPS组的CCL2、IL-6、IL-8、SOD2的基因表达含量明显增加(P<0.000 1,图8),而同LPS组相比,0.5 µmol·L−1西格列汀抑制LPS上调的CCL2(P<0.001,图8A)、IL-6(P<0.001,图8B)、IL-8(P<0.001,图8C)和SOD2(P<0.000 1,图8D)的表达,5 µmol·L−1 BAY11-7082组CCL2、IL-6、IL-8和SOD2含量明显减少,差异有统计学意义(P<0.000 1,图8)。
图 7. 西格列汀和BAY11-7082对LPS诱导的NF-κB通路活化的影响.
Fig 7 Effects of sitagliptin and BAY11-7082 on LPS-induced activation of NF-κB pathway
A:西格列汀和BAY11-7082对HGF中p-p65蛋白的表达影响及灰度分析p-p65/p65相对表达量;B:西格列汀和BAY11-7082对HGF中IκBα和p-IκBα蛋白的表达影响及灰度分析IκBα/GAPDH和p-IκBα/IκBα相对表达量。与对照组相比,####P<0.000 1;与LPS组相比,***P<0.001,****P<0.000 1。
图 8. 西格列汀和BAY11-7082对LPS诱导的炎症因子表达的影响.
Fig 8 Effects of sitagliptin and BAY11-7082 on LPS-induced inflammatory cytokines
A:CCL2 mRNA表达水平;B:IL-6 mRNA表达水平;C:IL-8 mRNA表达水平;D:SOD2 mRNA表达水平。与对照组相比,####P<0.000 1;与LPS组相比,***P<0.001,****P<0.000 1。
3. 讨论
牙周炎是一种炎性免疫破坏性疾病,主要表现为起初的牙龈组织慢性炎症,随后伴发牙周袋形成、牙槽骨骨破坏及牙齿松动脱落,慢性牙周炎已经成为成年人牙齿缺失的主要原因[7]。牙龈卟啉单胞菌、伴放线聚集杆菌等牙周致病菌能通过产生多种致病物质及代谢产物如LPS、丁酸、牙龈素等作用于牙周支持组织并诱发宿主免疫反应,进而产生过多的促炎细胞因子和趋化因子如IL-1、IL-6、TNF-α等,形成炎症微环境,最终破坏牙周组织[9],[11],[24]–[25]。先前的研究[26]证实,控制过量炎症介质的产生是治疗牙周病的有效方法之一。
西格列汀作为一种新型的降糖药物,已被广泛应用于临床,除了具有显著的降糖作用外,还具有抗炎、抗肿瘤、抗动脉粥样硬化等多向作用,具有广泛的应用前景[18],[27]–[28]。以往研究[29]–[30]表明,西格列汀通过介导抗炎和抗纤维化作用,在治疗心血管疾病中发挥重要作用。在2型糖尿病的临床试验[27]中,西格列汀已被证实能明显降低单核细胞中Toll样受体(Toll-like receptor,TLR)-4、TLR2、趋化因子受体-2等的表达,进而抑制炎性细胞因子TNF-α、IL-6的表达。牙周炎是一种炎症性疾病,牙周炎发生时炎症细胞因子如IL-6、IL-8、TNF-α等表达量显著增加,炎症因子的浓度与牙周炎的严重程度密切相关[31]。关于西格列汀对牙周炎的影响在以往研究中报道极少,有学者[32]通过动物实验表明,每天10 mg·kg−1的西格列汀管饲可降低牙周炎大鼠IL-1β、基质金属蛋白酶-9和一氧化氮合酶-2的基因表达水平,但在该模型中未观察到对牙槽骨和胶原组织的显著保护作用,可能是因为在所用剂量中,这种基因表达的改变并不能促进胶原的增加或减少牙槽骨的吸收,说明西格列汀可能对牙周炎具有一定的抑制作用。本研究旨在通过明确西格列汀对LPS诱导的HGF炎症反应的影响来初步探讨西格列汀对牙周炎的治疗是否会有作用。
本课题目前的研究发现,LPS能显著促进HGF中炎性细胞因子CCL2、IL-6、IL-8、SOD2的基因表达,而西格列汀(0.1、0.25、0.5 µmol·L−1)能显著抑制LPS诱导的这些炎性细胞因子的上调。此外,在LPS诱导的HGF中,西格列汀处理可明显抑制LPS诱导的IL-6和IL-8蛋白的分泌。据报道[9],炎性细胞因子的升高与牙周炎的骨吸收有关。IL-6在破骨细胞生成和牙周疾病的发病机制中起促进作用[33]。IL-6和IL-8在所有牙周炎患者的牙龈组织中表达增高[34]。本实验以5 µg·mL−1牙龈卟啉单胞菌的LPS为刺激源,以HGF为实验对象成功建立炎症模型,结果表明:西格列汀能不同程度地下调IL-6、IL-8的基因表达及蛋白分泌水平,这些结果表明西格列汀在牙周炎的发病过程中,可能通过抑制LPS导致的炎症微环境来发挥其抗炎作用。
除促炎细胞因子,已经证实SOD2的上调与牙周炎的严重程度呈正相关,SOD2是一种重要的抗氧化酶,可导致分子氧或过氧化氢的产生[15],而氧化应激相关的炎症介质与牙周炎密切相关[35]。本研究表明,LPS可上调HGF中SOD2的表达,而西格列汀可抑制其上调。该结果表明西格列汀可通过抑制LPS诱导的SOD2过表达,从而维持活性氧稳态,进而发挥其保护牙周组织的作用。CCL2也被称为单核细胞趋化蛋白-1,作为一种促炎趋化因子,可吸引单核细胞和中性粒细胞到牙周炎的炎症部位发挥相应的作用,从而加速牙周炎的发展进程[14],[36]。本研究中,LPS诱导HGF中CCL2的表达升高,而西格列汀从基因和蛋白水平抑制了CCL2的升高,提示西格列汀可以减轻牙周炎症。
转录和翻译过程本身受许多因素影响,蛋白质和mRNA表达之间的差异很可能是基因表达的生物学结果。蛋白质调控是多层次、多时间和多类型的,仅RNA不能决定蛋白质表达,诸如转录后调控、蛋白质半衰期、合成速度之类的其他因素也影响蛋白质表达水平[37]–[39]。这可能是低浓度的西格列汀(0.1 µmol·L−1)对HGF中IL-6和IL-8的mRNA和蛋白的表达作用不一致的原因。
NF-κB通路是参与激活促炎细胞因子表达的关键核转录因子,长期以来一直被认为是典型的促炎信号通路[40]。在正常情况下,NF-κB以其非活性形式存在于细胞质中,p50/p65与其抑制物IκB结合成三聚体,使其不能核易位。一旦受到NF-κB激活剂(如LPS)的刺激,细胞信号就会启动并导致IκB蛋白的磷酸化和降解。随后,NF-κB p65从细胞质转移到细胞核,以调节炎症细胞因子[41]。先前的研究[41]–[43]表明,NF-κB在HGF中表达,且慢性牙周炎患者的牙龈组织中NF-κB(p50/p65)激活率远高于正常组织,该信号通路的激活在牙周疾病的发展中发挥着至关重要的作用。本实验证明了西格列汀能够下调NF-κB p65和IκBα的磷酸化水平以及IκBα的降解,进而阻断LPS诱导NF-κB信号通路激活,抑制炎性细胞因子IL-6、IL-8、CCL2和SOD2的表达,这与先前的研究[44]结果一致。同时,本研究将NF-κB通路抑制剂BAY11-7082作为阳性对照,并探究其对HGF中炎症因子CCL2、IL-6、IL-8、SOD2 mRNA和NF-κB通路的影响,结果表明:BAY11-7082对CCL2、IL-6、IL-8、SOD2 mRNA 的表达以及LPS诱导的NF-κB活化有抑制作用,说明阻断NF-κB通路可有效抑制LPS引起的HGF炎症反应,这同西格列汀的效果相同,据此本研究推测,西格列汀对HGF的抗炎作用很可能是通过阻断NF-κB活化,进而抑制炎症因子的释放,其可能的作用机制见图9。
图 9. 西格列汀在LPS诱导的NF-κB信号通路中的作用机制.
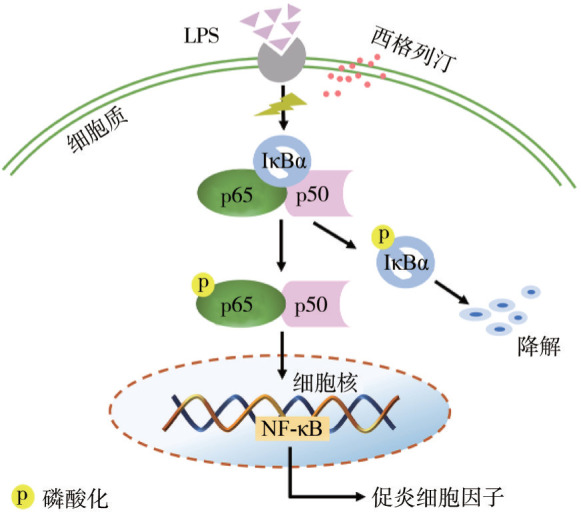
Fig 9 Putative mechanism for the role of sitagliptin in LPS-induced NF-κB signaling pathway
本研究从体外实验证明了西格列汀通过阻断NF-κB信号通路激活来抑制LPS诱导的HGF中炎症反应,在未来的研究中,将进一步增加体内实验及临床研究来验证西格列汀在抗炎方面的作用,为未来研发西格列汀应用于牙周炎治疗提供理论依据。
Funding Statement
[基金项目] 国家自然科学基金(81670993,81873716)
Supported by: Foundation:The National Natural Science Foundation of China (81670993, 81873716).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Ji S, Choi YS, Choi Y. Bacterial invasion and persistence: critical events in the pathogenesis of periodontitis[J] J Periodontal Res. 2015;50(5):570–585. doi: 10.1111/jre.12248. [DOI] [PubMed] [Google Scholar]
- 2.Chapple IL, Matthews JB. The role of reactive oxygen and antioxidant species in periodontal tissue destruction[J] Periodontol 2000. 2007;43:160–232. doi: 10.1111/j.1600-0757.2006.00178.x. [DOI] [PubMed] [Google Scholar]
- 3.Meyle J, Chapple I. Molecular aspects of the pathogenesis of periodontitis[J] Periodontol 2000. 2015;69(1):7–17. doi: 10.1111/prd.12104. [DOI] [PubMed] [Google Scholar]
- 4.Laine ML, Crielaard W, Loos BG. Genetic susceptibility to periodontitis[J] Periodontol 2000. 2012;58(1):37–68. doi: 10.1111/j.1600-0757.2011.00415.x. [DOI] [PubMed] [Google Scholar]
- 5.Bostanci N, Belibasakis GN. Porphyromonas gingivalis: an invasive and evasive opportunistic oral pathogen[J] FEMS Microbiol Lett. 2012;333(1):1–9. doi: 10.1111/j.1574-6968.2012.02579.x. [DOI] [PubMed] [Google Scholar]
- 6.Gölz L, Memmert S, Rath-Deschner B, et al. LPS from P. gingivalis and hypoxia increases oxidative stress in periodontal ligament fibroblasts and contributes to periodontitis[J] Mediators Inflamm. 2014;2014:986264. doi: 10.1155/2014/986264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kinane DF. Causation and pathogenesis of periodontal disease[J] Periodontol 2000. 2001;25:8–20. doi: 10.1034/j.1600-0757.2001.22250102.x. [DOI] [PubMed] [Google Scholar]
- 8.Wang PL, Azuma Y, Shinohara M, et al. Toll-like receptor 4-mediated signal pathway induced by Porphyromonas gingivalis lipopolysaccharide in human gingival fibroblasts[J] Biochem Biophys Res Commun. 2000;273(3):1161–1167. doi: 10.1006/bbrc.2000.3060. [DOI] [PubMed] [Google Scholar]
- 9.Trindade F, Oppenheim FG, Helmerhorst EJ, et al. Uncovering the molecular networks in periodontitis[J] Proteomics Clin Appl. 2014;8(9/10):748–761. doi: 10.1002/prca.201400028. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Buckley CD, Pilling D, Lord JM, et al. Fibroblasts regulate the switch from acute resolving to chronic persistent inflammation[J] Trends Immunol. 2001;22(4):199–204. doi: 10.1016/s1471-4906(01)01863-4. [DOI] [PubMed] [Google Scholar]
- 11.Ara T, Kurata K, Hirai K, et al. Human gingival fibroblasts are critical in sustaining inflammation in periodontal disease[J] J Periodontal Res. 2009;44(1):21–27. doi: 10.1111/j.1600-0765.2007.01041.x. [DOI] [PubMed] [Google Scholar]
- 12.Buckley CD. Why does chronic inflammation persist: an unexpected role for fibroblasts[J] Immunol Lett. 2011;138(1):12–14. doi: 10.1016/j.imlet.2011.02.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Wang Q, Zhang B, Yu JL. Farrerol inhibits IL-6 and IL-8 production in LPS-stimulated human gingival fibroblasts by suppressing PI3K/AKT/NF-κB signaling pathway[J] Arch Oral Biol. 2016;62:28–32. doi: 10.1016/j.archoralbio.2015.11.007. [DOI] [PubMed] [Google Scholar]
- 14.Damgaard C, Kantarci A, Holmstrup P, et al. Porphyromonas gingivalis-induced production of reactive oxygen species, tumor necrosis factor-α, interleukin-6, CXCL8 and CCL2 by neutrophils from localized aggressive periodontitis and healthy donors: modulating actions of red blood cells and resolvin E1[J] J Periodontal Res. 2017;52(2):246–254. doi: 10.1111/jre.12388. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Yoon Y, Kim TJ, Lee JM, et al. SOD2 is upregulated in periodontitis to reduce further inflammation progression[J] Oral Dis. 2018;24(8):1572–1580. doi: 10.1111/odi.12933. [DOI] [PubMed] [Google Scholar]
- 16.Zerilli T, Pyon EY. Sitagliptin phosphate: a DPP-4 inhibitor for the treatment of type 2 diabetes mellitus[J] Clin Ther. 2007;29(12):2614–2634. doi: 10.1016/j.clinthera.2007.12.034. [DOI] [PubMed] [Google Scholar]
- 17.Satoh-Asahara N, Sasaki Y, Wada H, et al. A dipeptidyl peptidase-4 inhibitor, sitagliptin, exerts anti-inflammatory effects in type 2 diabetic patients[J] Metabolism. 2013;62(3):347–351. doi: 10.1016/j.metabol.2012.09.004. [DOI] [PubMed] [Google Scholar]
- 18.Jiang W, Wen D, Cheng Z, et al. Effect of sitagliptin, a DPP-4 inhibitor, against DENA-induced liver cancer in rats mediated via NF-κB activation and inflammatory cytokines[J] J Biochem Mol Toxicol. 2018;32(12):e22220. doi: 10.1002/jbt.22220. [DOI] [PubMed] [Google Scholar]
- 19.Vaghasiya J, Sheth N, Bhalodia Y, et al. Sitagliptin protects renal ischemia reperfusion induced renal damage in diabetes[J] Regul Pept. 2011;166(1/2/3):48–54. doi: 10.1016/j.regpep.2010.08.007. [DOI] [PubMed] [Google Scholar]
- 20.Omoto S, Taniura T, Nishizawa T, et al. Anti-atherosclerotic effects of sitagliptin in patients with type 2 diabetes mellitus[J] Diabetes Metab Syndr Obes. 2015;8:339–345. doi: 10.2147/DMSO.S84545. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Huang CY, Shih CM, Tsao NW, et al. Dipeptidyl peptidase-4 inhibitor improves neovascularization by increasing circulating endothelial progenitor cells[J] Br J Pharmacol. 2012;167(7):1506–1519. doi: 10.1111/j.1476-5381.2012.02102.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Hu X, Liu S, Liu X, et al. DPP-4 (CD26) inhibitor sitagliptin exerts anti-inflammatory effects on rat insulinoma (RINm) cells via suppressing NF-κB activation[J] Endocrine. 2017;55(3):754–763. doi: 10.1007/s12020-016-1073-8. [DOI] [PubMed] [Google Scholar]
- 23.Kang W, Hu Z, Ge S. Healthy and inflamed gingival fibroblasts differ in their inflammatory response to Porphyromonas gingivalis lipopolysaccharide[J] Inflammation. 2016;39(5):1842–1852. doi: 10.1007/s10753-016-0421-4. [DOI] [PubMed] [Google Scholar]
- 24.Imamura T. The role of gingipains in the pathogenesis of periodontal disease[J] J Periodontol. 2003;74(1):111–118. doi: 10.1902/jop.2003.74.1.111. [DOI] [PubMed] [Google Scholar]
- 25.Jeng JH, Chan CP, Ho YS, et al. Effects of butyrate and propionate on the adhesion, growth, cell cycle kinetics, and protein synthesis of cultured human gingival fibroblasts[J] J Periodontol. 1999;70(12):1435–1442. doi: 10.1902/jop.1999.70.12.1435. [DOI] [PubMed] [Google Scholar]
- 26.Van Dyke TE, Serhan CN. Resolution of inflammation: a new paradigm for the pathogenesis of periodontal diseases[J] J Dent Res. 2003;82(2):82–90. doi: 10.1177/154405910308200202. [DOI] [PubMed] [Google Scholar]
- 27.Makdissi A, Ghanim H, Vora M, et al. Sitagliptin exerts an antinflammatory action[J] J Clin Endocrinol Metab. 2012;97(9):3333–3341. doi: 10.1210/jc.2012-1544. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Matsubara J, Sugiyama S, Sugamura K, et al. A dipeptidyl peptidase-4 inhibitor, des-fluoro-sitagliptin, improves endothelial function and reduces atherosclerotic lesion formation in apolipoprotein E-deficient mice[J] J Am Coll Cardiol. 2012;59(3):265–276. doi: 10.1016/j.jacc.2011.07.053. [DOI] [PubMed] [Google Scholar]
- 29.Esposito G, Cappetta D, Russo R, et al. Sitagliptin reduces inflammation, fibrosis and preserves diastolic function in a rat model of heart failure with preserved ejection fraction[J] Br J Pharmacol. 2017;174(22):4070–4086. doi: 10.1111/bph.13686. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Nauck MA, Meier JJ, Cavender MA, et al. Cardiovascular actions and clinical outcomes with glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors[J] Circulation. 2017;136(9):849–870. doi: 10.1161/CIRCULATIONAHA.117.028136. [DOI] [PubMed] [Google Scholar]
- 31.D'Aiuto F, Parkar M, Brett PM, et al. Gene polymorphisms in pro-inflammatory cytokines are associated with systemic inflammation in patients with severe periodontal infections[J] Cytokine. 2004;28(1):29–34. doi: 10.1016/j.cyto.2004.06.005. [DOI] [PubMed] [Google Scholar]
- 32.Moraes RM, Lima GM, Oliveira FE, et al. Exenatide and sitagliptin decrease interleukin 1β, matrix metalloproteinase 9, and nitric oxide synthase 2 gene expression but does not reduce alveolar bone loss in rats with periodontitis[J] J Periodontol. 2015;86(11):1287–1295. doi: 10.1902/jop.2015.150278. [DOI] [PubMed] [Google Scholar]
- 33.Bakker AD, Kulkarni RN, Klein-Nulend J, et al. IL-6 alters osteocyte signaling toward osteoblasts but not osteoclasts[J] J Dent Res. 2014;93(4):394–399. doi: 10.1177/0022034514522485. [DOI] [PubMed] [Google Scholar]
- 34.Noh MK, Jung M, Kim SH, et al. Assessment of IL-6, IL-8 and TNF-α levels in the gingival tissue of patients with periodontitis[J] Exp Ther Med. 2013;6(3):847–851. doi: 10.3892/etm.2013.1222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Wang Y, Andrukhov O, Rausch-Fan X. Oxidative stress and antioxidant system in periodontitis[J] Front Physiol. 2017;8:910. doi: 10.3389/fphys.2017.00910. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Aidoukovitch A, Anders E, Dahl S, et al. The host defense peptide LL-37 is internalized by human periodontal ligament cells and prevents LPS-induced MCP-1 production[J] J Periodontal Res. 2019;54(6):662–670. doi: 10.1111/jre.12667. [DOI] [PubMed] [Google Scholar]
- 37.Tian Q, Stepaniants SB, Mao M, et al. Integrated genomic and proteomic analyses of gene expression in Mammalian cells[J] Mol Cell Proteomics. 2004;3(10):960–969. doi: 10.1074/mcp.M400055-MCP200. [DOI] [PubMed] [Google Scholar]
- 38.de Sousa Abreu R, Penalva LO, Marcotte EM, et al. Global signatures of protein and mRNA expression levels[J] Mol Biosyst. 2009;5(12):1512–1526. doi: 10.1039/b908315d. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.de Klerk E, 't Hoen PA. Alternative mRNA transcription, processing, and translation: insights from RNA sequencing[J] Trends Genet. 2015;31(3):128–139. doi: 10.1016/j.tig.2015.01.001. [DOI] [PubMed] [Google Scholar]
- 40.Lawrence T. The nuclear factor NF-kappaB pathway in inflammation[J] Cold Spring Harb Perspect Biol. 2009;1(6):a001651. doi: 10.1101/cshperspect.a001651. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Nichols TC, Fischer TH, Deliargyris EN, et al. Role of nuclear factor-kappa B (NF-kappa B) in inflammation, periodontitis, and atherogenesis[J] Ann Periodontol. 2001;6(1):20–29. doi: 10.1902/annals.2001.6.1.20. [DOI] [PubMed] [Google Scholar]
- 42.Hao C, Wu B, Hou Z, et al. Asiatic acid inhibits LPS-induced inflammatory response in human gingival fibroblasts[J] Int Immunopharmacol. 2017;50:313–318. doi: 10.1016/j.intimp.2017.07.005. [DOI] [PubMed] [Google Scholar]
- 43.Ambili R, Santhi WS, Janam P, et al. Expression of activated transcription factor nuclear factor-kappaB in periodontally diseased tissues[J] J Periodontol. 2005;76(7):1148–1153. doi: 10.1902/jop.2005.76.7.1148. [DOI] [PubMed] [Google Scholar]
- 44.Lin CH, Lin CC. Sitagliptin attenuates inflammatory responses in lipopolysaccharide-stimulated cardiomyocy-tes via nuclear factor-κB pathway inhibition[J] Exp Ther Med. 2016;11(6):2609–2615. doi: 10.3892/etm.2016.3255. [DOI] [PMC free article] [PubMed] [Google Scholar]