Abstract
目的
探讨弥漫大B细胞淋巴瘤(DLBCL)患者的临床特征和预后因素,评估合并糖尿病(DM)及治疗过程中发生血糖升高对DLBCL预后的影响。
方法
回顾性收集2009年1月1日至2019年12月31日天津医科大学肿瘤医院及中山大学肿瘤防治中心收治的481例初诊DLBCL患者的临床资料,重点关注其治疗前及治疗中的血糖水平,采用Cox回归风险模型进行单因素分析评估预后影响因素,采用Kaplan-Meier法绘制生存曲线分析血糖异常对DLBCL患者总生存(OS)、无进展生存(PFS)的影响。
结果
82例(17.0%)患者在诊断DLBCL前患DM,88例(18.3%)患者在DLBCL治疗过程中至少发生一次血糖升高。单因素分析显示,年龄、Ann-Arbor分期、IPI评分、是否合并DM与OS、PFS相关(P值均<0.05)。组间比较显示,合并DM组与治疗过程中血糖升高组的OS和PFS均较无血糖异常组差(OS:P值分别为0.001、0.003,PFS:P值均<0.001),合并DM组与治疗过程中血糖升高组相比OS和PFS的差异均无统计学意义(P值分别为0.557、0.463)。化疗期间血糖控制良好组的OS和PFS优于血糖控制差组(OS:P=0.037,PFS:P=0.007)。
结论
合并DM是影响DLBCL患者预后的重要因素,治疗过程中血糖升高与DLBCL患者的不良预后相关。
Keywords: 淋巴瘤,大B细胞,弥漫型, 糖尿病, 高血糖, 预后
Abstract
Objective
This study aims to investigate the clinical features and prognostic factors of patients with diffuse large B-cell lymphoma(DLBCL)and assess the prognostic value of diabetes mellitus(DM)and hyperglycemia during DLBCL treatment in DLBCL.
Methods
The clinical data of 481 newly diagnosed DLBCL patients from January 1, 2009 to December 31, 2019 at Tianjin Medical University Cancer Institute and Hospital and Sun Yat-sen University Cancer Center were retrospectively collected, focusing on their blood glucose levels before and during treatment. Cox regression method was used for univariate analysis to assess prognostic factors, and the Kaplan-Meier method was used to draw survival curves to assess the prognostic value of DM and hyperglycemia during DLBCL treatment in patients with DLBCL.
Results
Eighty-two(17.0%)patients had DM before DLBCL diagnosis and treatment, and 88(18.3%)patients had at least one blood glucose increase during DLBCL treatment. Cox univariate analysis showed that age, Ann Arbor stage, international prognostic index, and DM were associated with overall survival(OS)and progression-free survival(PFS)(all P<0.05). The pairwise comparison between the two groups showed that the OS(P=0.001)and PFS(P<0.001)of patients with pre-existing DM were significantly worse than those of patients without abnormal blood glucose. Moreover, the OS(P=0.003)and PFS(P<0.001)of patients with hyperglycemia during DLBCL treatment were significantly worse than those of patients without abnormal blood glucose. No significant difference exists between patients with DM and patients with hyperglycemia during DLBCL treatment(OS, P=0.557; PFS, P=0.463). Additionally, patients with adequate glycemic control during chemotherapy had a better prognosis compared with patients with poor glycemic control(OS, P=0.037; PFS, P=0.007).
Conclusion
DM is an important factor affecting the prognosis of patients with DLBCL. Moreover, hyperglycemia during treatment is related to the poor prognosis of patients with DLBCL.
Keywords: Lymphoma, large B-cell, diffuse; Diabetes mellitus; Hyperglycemia; Prognosis
弥漫大B细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤(NHL)中最常见的类型,年发病率约占NHL的24%[1],发病率随年龄的升高而增加[2]。自利妥昔单抗广泛应用以来,尽管多数患者可通过R-CHOP(利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松)方案治愈,但仍有10%~15%的患者难治,20%~30%的患者复发[3]。IPI评分系统作为沿用已久的预后评估方式,对于高危患者的预后评估略显不足[4],因此,探索更多有价值的临床和分子预后指标一直是DLBCL领域的研究重点。
糖尿病(DM)及其并发症是严重威胁人类健康的世界性公共问题,1990-2010年DM患者数量增加了2倍,发病率增加了1倍,到2030年,全球约4.4%人口将受DM困扰[5]。大量研究表明,DM与NHL发病风险增加相关[6]–[7],但DM对DLBCL患者预后的影响仍不确切。由于糖皮质激素的广泛使用,DLBCL患者在治疗过程中发生血糖升高也越来越常见。为明确DM及治疗过程中发生血糖升高对DLBCL患者预后的影响,我们对481例DLBCL患者的临床资料进行了回顾性分析。
病例与方法
1. 病例:回顾性收集2009年1月1日至2019年12月31日于天津医科大学肿瘤医院血液科及中山大学肿瘤防治中心初次诊断为DLBCL的患者481例,均符合DLBCL的诊断标准[8]。排除诊断明确但放弃治疗者。
2. 临床资料:采集的临床资料包括年龄,性别,病理诊断,Ann-Arbor分期,有无B症状,IPI评分,LDH,是否有吸烟、饮酒史,是否有DM、高血压、冠心病、乙型肝炎、肺结核、脑血管意外、其他恶性肿瘤等合并症。其中,病理诊断根据Hans分类系统分为生发中心B细胞来源(GCB型)和非GCB(Non-GCB)型[9];根据PET-CT或CT结果按照Ann-Arbor分期系统对DLBCL患者进行分期[10];B症状定义为不明原因的发热(体温38 °C以上)、盗汗、体重减轻(6个月内不明原因体重减轻10%以上);根据IPI评分系统的不良因素(年龄>60岁、病变为Ⅲ/Ⅳ期、LDH高于正常值、ECOG体能状态评分≥2分、结外累及部位数目>1个)对DLBCL患者进行评分[11]。
3. 治疗及疗效评估:患者以化疗为主要治疗方式,以手术和放疗为辅助治疗方式。化疗方案主要为CHOP或R-CHOP方案,疗效评价参照国际工作组制定标准[12],分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。CHOP方案:环磷酰胺750 mg/m2,第1天;多柔比星50 mg/m2,第1天;长春新碱1.4 mg/m2(最大剂量2 mg/m2),第1天;泼尼松60 mg/m2,第1~5天。R-CHOP方案:利妥昔单抗375 mg/m2,第1天;环磷酰胺750 mg/m2,第1天;多柔比星50 mg/m2,第1天;长春新碱1.4 mg/m2(最大剂量2 mg/m2),第1天;泼尼松60 mg/m2,第1~5天。
4. 关于血糖异常的定义及相关治疗:血糖异常主要包括合并DM及治疗过程中发生血糖升高。合并DM是指在进行DLBCL治疗前存在DM,其标准为:①根据既往门诊或住院的医疗记录诊断为DM;②在DLBCL治疗前评估时空腹血糖(FPG)≥7.0 mmol/L(126 mg/dl)[13]。治疗过程中发生血糖升高指DLBCL治疗过程中出现一次及以上血糖升高,其标准为:①无DM既往史;②在进行DLBCL治疗前评估时FPG<6.0 mmol/L(108 mg/dl);③在DLBCL治疗过程中FPG≥6.0 mmol/L(108 mg/dl)[14]。FPG的采集:首次入院当天空腹过夜,于第二天上午8:00前收集静脉血样。血液样本采集后2 h内,在严格的质量控制下送至检验科检测血样血浆葡萄糖水平。
在接受DLBCL治疗期间,对于合并DM的患者,继续按照其入院前方案(口服药物或胰岛素)控制血糖;对于治疗过程中发生血糖升高的患者,按照其血糖水平给予相应药物治疗。对于血糖异常患者,根据DLBCL治疗期间的血糖控制情况分为血糖控制良好组和血糖控制差组,治疗期间FPG持续控制在≥3.9 mmol/L(70 mg/dl)且≤7.8 mmol/L(140 mg/dl)定义为血糖控制良好[15],余定义为血糖控制差。
5. 随访:采用电话、门诊复查和住院复查的方式进行随访,随访截止日期为2019年12月31日。主要观察终点:总生存(OS)期定义为自初次诊断至因任何原因引起死亡、末次随访或失访的时间;无进展生存(PFS)期定义为从初次诊断到肿瘤复发、进展或末次随访的时间。
6. 统计学处理:所有数据均采用SPSS 25.0、Graphpad Prism 8.0软件进行统计学分析。采用卡方检验对患者的基线临床特征进行分析,采用Cox回归风险模型进行单因素分析,采用Kaplan-Meier法绘制生存曲线,采用Log-rank检验比较组间差异。P<0.05为差异有统计学意义。
结果
1. 不同血糖情况DLBCL患者的基线临床特征:本研究共纳入481例DLBCL患者,患者中位年龄60(18~84)岁,其中>60岁患者209例(43.5%);男264例(54.9%),女217例(45.1%);233例(48.4%)病理诊断为GCB型,248例(51.6%)病理诊断为non-GCB型;283例(58.8%)在起病时伴B症状;192例(39.9%)有LDH水平升高;Ann-Arbor分期Ⅰ~Ⅱ期患者227例(47.2%),Ⅲ~Ⅳ期患者254例(52.8%);IPI评分低危(0~1分)206例(42.8%),中低危(2分)123例(25.6%),中高危(3分)76例(15.8%),高危(4~5分)76例(15.8%);91例(18.9%)有吸烟史,37例(7.7%)有饮酒史;149例(31.0%)患者存在除DM外的基础疾病,其中高血压102例(21.1%),冠心病34例(7.1%),乙型肝炎21例(4.4%),肺结核13例(2.7%),曾发生脑血管意外者10例(2.1%),除DLBCL以外的其他恶性肿瘤11例(2.3%)。352例(73.2%)使用R-CHOP方案治疗,129例(26.8%)使用CHOP方案治疗。
82例(17.0%)在诊断DLBCL前患DM,88例(18.3%)在DLBCL治疗中发生血糖升高,311例(64.7%)未发现血糖异常,年龄>60岁的DLBCL患者较年龄≤60岁者更易出现血糖异常(P<0.001)。血糖异常患者更倾向于具有较高的Ann-Arbor分期、IPI评分、LDH水平和其他合并症(P值分别为0.032、0.003、0.002和<0.001)(表1)。
表1. 伴或不伴血糖异常的481例弥漫大B细胞淋巴瘤患者的基线临床特征[例(%)].
| 临床特征 | 伴血糖异常(170例) | 不伴血糖异常(311例) | χ2值 | P值 |
| 年龄 | 13.554 | <0.001 | ||
| ≤60岁 | 77(45.3) | 195(62.7) | ||
| >60岁 | 93(54.7) | 116(37.3) | ||
| 性别 | 0.018 | 0.894 | ||
| 男 | 94(55.3) | 170(54.7) | ||
| 女 | 76(44.7) | 141(45.3) | ||
| 病理诊断 | 1.042 | 0.307 | ||
| GCB | 77(45.3) | 156(50.2) | ||
| Non-GCB | 93(54.7) | 155(49.8) | ||
| Ann-Arbor分期 | 4.603 | 0.032 | ||
| Ⅰ~Ⅱ | 69(40.6) | 158(50.8) | ||
| Ⅲ~Ⅳ | 101(59.4) | 153(49.2) | ||
| B症状 | <0.001 | 0.997 | ||
| 有 | 100(58.8) | 183(58.8) | ||
| 无 | 70(41.2) | 128(41.2) | ||
| IPI评分 | 8.581 | 0.003 | ||
| 0~2分 | 102(60.0) | 227(73.0) | ||
| 3~5分 | 68(40.0) | 84(27.0) | ||
| 吸烟 | 0.874 | 0.350 | ||
| 是 | 36(21.2) | 55(17.7) | ||
| 否 | 134(78.8) | 256(82.3) | ||
| 饮酒 | 0.001 | 0.978 | ||
| 是 | 13(7.6) | 24(7.7) | ||
| 否 | 157(92.4) | 287(92.3) | ||
| LDH | 9.883 | 0.002 | ||
| ≤250U/L | 86(50.6) | 203(65.3) | ||
| >250U/L | 84(49.4) | 108(34.7) | ||
| 治疗方案 | 0.008 | 0.930 | ||
| CHOP | 46(27.1) | 83(26.7) | ||
| R-CHOP | 124(72.9) | 228(73.3) | ||
| 有无其他合并症 | 21.234 | <0.001 | ||
| 有 | 75(44.1) | 74(23.8) | ||
| 无 | 95(55.9) | 237(76.2) |
注:GCB:生发中心来源;Non-GCB:非生发中心来源;B症状:不明原因的发热(体温38 °C以上)、盗汗、体重减轻(6个月内不明原因体重减轻10%以上);IPI:国际预后指数;CHOP:环磷酰胺+多柔比星+长春新碱+泼尼松;R-CHOP:利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松
2. 预后影响因素分析:Cox单因素分析结果显示,年龄、Ann-Arbor分期、IPI评分、合并DM与OS、PFS均相关(P值均<0.05)(表2)。
表2. 影响481例弥漫大B细胞淋巴瘤患者总生存(OS)和无进展生存(PFS)的单因素分析.
| 因素 | OS |
PFS |
||
| HR(95% CI) | P值 | HR(95% CI) | P值 | |
| 年龄(> 60岁,≤60岁) | 1.512(1.130~2.023) | 0.005 | 1.476(1.123~1.941) | 0.005 |
| 性别(女,男) | 1.071(0.800~1.434) | 0.645 | 1.109(0.844~1.459) | 0.458 |
| 病理诊断(Non-GCB,GCB) | 1.182(0.882~1.584) | 0.262 | 1.075(0.817~1.415) | 0.605 |
| Ann-Arbor分期(Ⅲ~Ⅳ,Ⅰ~Ⅱ) | 1.432(1.065~1.926) | 0.017 | 1.444(1.092~1.910) | 0.010 |
| B症状(有,无) | 1.121(0.832~1.511) | 0.452 | 1.113(0.842~1.473) | 0.452 |
| IPI评分(3~5分,0~2分) | 1.576(1.173~2.118) | 0.003 | 1.648(1.249~2.176) | <0.001 |
| 吸烟(是,否) | 1.078(0.751~1.547) | 0.683 | 1.061(0.756~1.490) | 0.732 |
| 饮酒(是,否) | 1.092(0.653~1.825) | 0.737 | 1.075(0.662~1.744) | 0.770 |
| LDH(> 250U/L,≤250U/L) | 1.264(0.944~1.694) | 0.116 | 1.190(0.904~1.567) | 0.216 |
| 治疗方案(R-CHOP,CHOP) | 0.761(0.558~1.037) | 0.084 | 0.768(0.572~1.031) | 0.079 |
| 合并糖尿病(是,否) | 1.559(1.104~2.202) | 0.012 | 1.425(1.023~1.983) | 0.036 |
| 其他合并症(是,否) | 1.278(0.944~1.729) | 0.112 | 1.305(0.982~1.734) | 0.066 |
注:Non-GCB:非生发中心来源;GCB:生发中心来源;B症状:不明原因的发热(体温38 °C以上)、盗汗、体重减轻(6个月内不明原因体重减轻10%以上);IPI:国际预后指数;R-CHOP:利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松;CHOP:环磷酰胺+多柔比星+长春新碱+泼尼松
3. 生存情况分析:截至随访结束,481例DLBCL患者的中位随访时间36(1~122)个月,其中182例(37.8%)患者死亡,206例(42.8%)患者发生疾病进展。5年OS率为54.3%,5年PFS率为48.8%,中位生存时间为76个月。
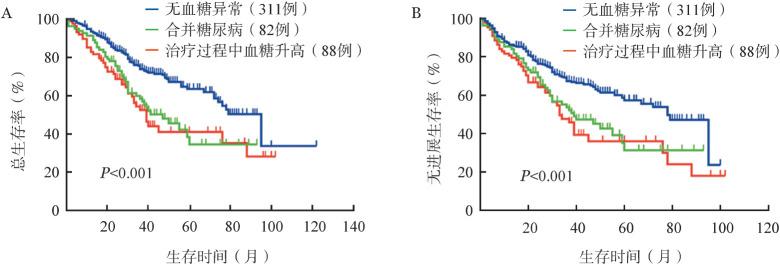
非DM和合并DM患者OS和PFS的差异均有统计学意义(P值分别为0.010、0.034)(图1),非DM患者包括无血糖异常患者(311例)和治疗过程中血糖升高患者(88例),DM组5年OS率为34.4%,5年PFS率为31.2%;非DM组5年OS率为59.0%,5年PFS率为53.1%。无血糖异常组、合并DM组和治疗过程中血糖升高组OS、PFS的差异均有统计学意义(P值均<0.001)(图2)。组间比较显示,合并DM组及治疗过程中血糖升高组的OS和PFS较无血糖异常组差,差异均有统计学意义(OS:P值分别为0.001、0.003,PFS:P值均<0.001);合并DM组与治疗过程中血糖升高组相比,OS和PFS的差异无统计学意义(P值分别为0.557、0.463)。血糖控制良好组与血糖控制差组相比,OS和PFS的差异均有统计学意义(P值分别为0.037、0.007)(图3)。
图1. 非糖尿病组及合并糖尿病组患者的总生存(A)和无进展生存(B)曲线.
图2. 无血糖异常组、合并糖尿病组及治疗过程中血糖升高组患者的总生存(A)和无进展生存(B)曲线.
图3. 血糖控制良好组及血糖控制差组患者的总生存(A)和无进展生存(B)曲线.
讨论
随着DLBCL在老年人群中发病率增高,其合并症对预后的影响引起广泛重视,本研究回顾性分析了血糖异常与DLBCL预后的相关性。
我们的研究结果显示,DLBCL合并DM的患病率为17.0%。既往研究显示,DM与NHL发病风险增高相关。Gao等[13]的研究显示,DLBCL患者中DM的患病率为19.71%,较中国DM年龄标准化患病率(9.7%)高,与本研究结果相似。一份基于SEER的数据显示,66岁以上人群中,有21.9%的NHL患者患DM,表明老年NHL患者合并DM更为常见[16]。Yang等[17]发现,中国大陆2型DM(T2DM)患者发生NHL的风险更高(HR=2.00,95% CI 1.32~3.03)。中国台湾的数据也表明了相似的结果(OR=1.51,95%CI 1.33~1.71)[18]。但是欧洲的多中心研究未发现DM与NHL发病风险增加相关[19]。此外,我们的研究表明,18.3%的DLBCL患者在治疗过程中至少发生了一次血糖升高,Lamar等[14]曾探讨过NHL患者接受化疗带来血糖升高问题,其数据表明NHL患者在接受R-CHOP或剂量调整的R-EPOCH方案治疗过程中,47%的患者发生了一次及以上血糖升高,可能与应用大剂量糖皮质激素相关。
合并DM是影响DLBCL患者OS和PFS的重要预后因素。一项来自波兰淋巴瘤研究小组(PLRG)的研究显示,合并T2DM与DLBCL患者预后不良相关,T2DM组的5年OS率、PFS率分别为64%、50.6%,而非T2DM组的5年OS率、PFS率分别为79%、62.5%[20]。Gao等[13]也证明DM与DLBCL患者PFS、肿瘤特异性生存率(CSS)较差相关,且是PFS和CSS的独立危险因素。此外,一些报道使用CCI指数量化合并症并分析其对DLBCL患者预后的影响,表明高CCI指数与老年DLBCL患者预后不良相关[21]–[23]。
值得注意的是,我们在探讨合并DM对预后影响的同时,也关注了治疗过程中发生血糖升高对DLBCL患者预后的影响,与无血糖异常患者相比,治疗过程中发生血糖升高患者的OS和PFS也较差。日本的一项研究表明,无论之前是否合并DM,高血糖都会影响原发中枢神经系统淋巴瘤患者的生存[24]。还有研究表明,治疗期间高血糖与胶质母细胞瘤预后不良相关[25],但Lamar等[14]发现,NHL患者化疗期间高血糖对缓解率或OS率无影响。因此,治疗过程中发生血糖升高是否影响预后尚无明确结论,需进一步探索。此外,我们的数据表明,血糖控制良好组预后更好,国内的其他研究得到了相似结论[13],提示化疗期间监测血糖的必要性。
本研究中,病理分型、LDH是否升高、是否使用利妥昔单抗对OS、PFS的影响无统计学意义。病理分型的影响无统计学意义可能与纳入局限期患者数较多有关,多项研究表明,GCB和Non-GCB表型在局限期患者中不是重要的预后因素[26]–[28]。另外,由于本文为回顾性分析,许多相关的分子学指标如Ki-67增殖指数或细胞遗传学异常(如MYC、BCL2基因重排)未纳入分析中,有待之后的研究进一步探索。LDH是否升高对预后的影响无统计学意义的原因可能是LDH水平与多个其他因素相关,本研究纳入的患者年龄较大,中位年龄60岁,合并基础疾病(如高血压、冠心病、乙型肝炎)的概率高,可能无法排除混杂因素以预测DLBCL患者预后。是否使用利妥昔单抗预后差异无统计学意义的原因可能是纳入研究的病例时间跨度大,早期利妥昔单抗未纳入医保,部分患者由于经济等因素未能规范足疗程应用利妥昔单抗,影响疗效。
虽然有大量报道显示DM与NHL发病率升高相关,但目前针对DM与DLBCL预后相关性的研究较少,我们的研究关注了治疗期间血糖升高及血糖控制情况,提示了治疗期间重视血糖监测与血糖控制的必要性。但本研究也存在一些局限性:①血糖监测方式单一,未能对糖化血红蛋白进行监测以更好地了解血糖控制情况;②DM患者用药情况对预后的影响未进行深入探讨。
综上所述,DM与DLBCL发病风险增高密切相关,血糖异常显著影响DLBCL患者的预后,临床需重视初治DLBCL合并DM患者,治疗过程中要注意血糖的监测与控制。虽然本研究从一定程度上阐明了血糖异常和DLBCL预后的关系,但DM在DLBCL发生中的潜在作用尚不明确[29],DLBCL治疗过程中高血糖所导致的内环境变化及对激素使用的影响也尚不清楚,期待今后的研究为DM与DLBCL的相关性提供更多依据。
References
- 1.Liu Y, Barta SK. Diffuse large B-cell lymphoma: 2019 update on diagnosis, risk stratification, and treatment[J] Am J Hematol. 2019;94(5):604–616. doi: 10.1002/ajh.25460. [DOI] [PubMed] [Google Scholar]
- 2.刘 鹏, 姜 时雨, 何 小慧, et al. 老年弥漫大B细胞淋巴瘤患者一线治疗方案疗效比较和预后分析[J] 中华肿瘤杂志. 2020;42(3):234–241. doi: 10.3760/cma.j.cn112152-20190705-00413. [DOI] [Google Scholar]
- 3.Kubuschok B, Held G, Pfreundschuh M. Management of diffuse large B-cell lymphoma (DLBCL)[J] Cancer Treat Res. 2015;165:271–288. doi: 10.1007/978-3-319-13150-4_11. [DOI] [PubMed] [Google Scholar]
- 4.Zhou Z, Sehn LH, Rademaker AW, et al. An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era[J] Blood. 2014;123(6):837–842. doi: 10.1182/blood-2013-09-524108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Rowley WR, Bezold C, Arikan Y, et al. Diabetes 2030: Insights from Yesterday, Today, and Future Trends[J] Popul Health Manag. 2017;20(1):6–12. doi: 10.1089/pop.2015.0181. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Wang Y, Liu X, Yan P, et al. Association between type 1 and type 2 diabetes and risk of non-Hodgkin's lymphoma: A meta-analysis of cohort studies[J] Diabetes Metab. 2020;46(1):8–19. doi: 10.1016/j.diabet.2019.04.006. [DOI] [PubMed] [Google Scholar]
- 7.Xu J, Wang T. Association of diabetes mellitus with non-Hodgkin lymphoma risk: a meta-analysis of cohort studies[J] Hematology. 2019;24(1):527–532. doi: 10.1080/16078454.2019.1636485. [DOI] [PubMed] [Google Scholar]
- 8.中华医学会血液学分会, 中国抗癌协会淋巴瘤专业委员会. 中国弥漫大B细胞淋巴瘤诊断与治疗指南(2013年版)[J] 中华血液学杂志. 2013;34(9):816–819. doi: 10.3760/cma.j.issn.0253-2727.2013.09.019. [DOI] [Google Scholar]
- 9.Hans CP, Weisenburger DD, Greiner TC, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray[J] Blood. 2004;103(1):275–282. doi: 10.1182/blood-2003-05-1545. [DOI] [PubMed] [Google Scholar]
- 10.Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification[J] J Clin Oncol. 2014;32(27):3059–3068. doi: 10.1200/JCO.2013.54.8800. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.International Non-Hodgkin's Lymphoma Prognostic Factors Project. A predictive model for aggressive non-Hodgkin's lymphoma[J] N Engl J Med. 1993;329(14):987–994. doi: 10.1056/NEJM199309303291402. [DOI] [PubMed] [Google Scholar]
- 12.Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma[J] J Clin Oncol. 2007;25(5):579–586. doi: 10.1200/JCO.2006.09.2403. [DOI] [PubMed] [Google Scholar]
- 13.Gao R, Liang JH, Man TS, et al. Diabetes mellitus predicts inferior survival in diffuse large B-cell lymphoma: a propensity score-matched analysis[J] Cancer Manag Res. 2019;11:2849–2870. doi: 10.2147/CMAR.S185319. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Lamar ZS, Dothard A, Kennedy L, et al. Hyperglycemia during first-line R-CHOP or dose adjusted R-EPOCH chemotherapy for non-Hodgkin lymphoma is prevalent and associated with chemotherapy alteration - a retrospective study[J] Leuk Lymphoma. 2018;59(8):1871–1877. doi: 10.1080/10428194.2017.1410889. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.中国医师协会内分泌代谢科医师分会; 中国住院患者血糖管理专家组. 中国住院患者血糖管理专家共识[J] 中华内分泌代谢杂志. 2017;33(1):1–10. doi: 10.3760/cma.j.issn.1000-6699.2017.01.001. [DOI] [Google Scholar]
- 16.Lam C, Cronin K, Ballard R, et al. Differences in cancer survival among white and black cancer patients by presence of diabetes mellitus: Estimations based on SEER-Medicare-linked data resource[J] Cancer Med. 2018;7(7):3434–3444. doi: 10.1002/cam4.1554. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Yang WS, Li HL, Xu HL, et al. Type 2 diabetes and the risk of non-Hodgkin's lymphoma: a report from two population-based cohort studies in China[J] Eur J Cancer Prev. 2016;25(2):149–154. doi: 10.1097/cej.0000000000000150. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Tseng CH. Diabetes and non-Hodgkin's lymphoma: analyses of prevalence and annual incidence in 2005 using the National Health Insurance database in Taiwan[J] Ann Oncol. 2012;23(1):153–158. doi: 10.1093/annonc/mdr334. [DOI] [PubMed] [Google Scholar]
- 19.Khan AE, Gallo V, Linseisen J, et al. Diabetes and the risk of non-Hodgkin's lymphoma and multiple myeloma in the European Prospective Investigation into Cancer and Nutrition[J] Haematologica. 2008;93(6):842–850. doi: 10.3324/haematol.12297. [DOI] [PubMed] [Google Scholar]
- 20.Drozd-Sokolowska J, Zaucha JM, Biecek P, et al. Type 2 diabetes mellitus compromises the survival of diffuse large B-cell lymphoma patients treated with (R)-CHOP - the PLRG report[J] Sci Rep. 2020;10(1):3517. doi: 10.1038/s41598-020-60565-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Wieringa A, Boslooper K, Hoogendoorn M, et al. Comorbidity is an independent prognostic factor in patients with advanced-stage diffuse large B-cell lymphoma treated with R-CHOP: a population-based cohort study[J] Br J Haematol. 2014;165(4):489–496. doi: 10.1111/bjh.12765. [DOI] [PubMed] [Google Scholar]
- 22.Saygin C, Jia X, Hill B, et al. Impact of comorbidities on outcomes of elderly patients with diffuse large B-cell lymphoma[J] Am J Hematol. 2017;92(10):989–996. doi: 10.1002/ajh.24819. [DOI] [PubMed] [Google Scholar]
- 23.Trebouet A, Marchand T, Lemal R, et al. Lymphoma occurring in patients over 90 years of age: characteristics, outcomes, and prognostic factors. A retrospective analysis of 234 cases from the LYSA[J] Ann Oncol. 2013;24(10):2612–2618. doi: 10.1093/annonc/mdt282. [DOI] [PubMed] [Google Scholar]
- 24.Debata A, Yoshida K, Ujifuku K, et al. Hyperglycemia is associated with poor survival in primary central nervous system lymphoma patients[J] Tumori. 2017;103(3):272–278. doi: 10.5301/tj.5000590. [DOI] [PubMed] [Google Scholar]
- 25.Derr RL, Ye X, Islas MU, et al. Association between hyperglycemia and survival in patients with newly diagnosed glioblastoma[J] J Clin Oncol. 2009;27(7):1082–1086. doi: 10.1200/JCO.2008.19.1098. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Barraclough A, Alzahrani M, Ettrup MS, et al. COO and MYC/BCL2 status do not predict outcome among patients with stage I/II DLBCL: a retrospective multicenter study[J] Blood Adv. 2019;3(13):2013–2021. doi: 10.1182/bloodadvances.2019000251. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Kumar A, Lunning MA, Zhang Z, et al. Excellent outcomes and lack of prognostic impact of cell of origin for localized diffuse large B-cell lymphoma in the rituximab era[J] Br J Haematol. 2015;171(5):776–783. doi: 10.1111/bjh.13766. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Castillo JJ, Beltran BE, Song MK, et al. The Hans algorithm is not prognostic in patients with diffuse large B-cell lymphoma treated with R-CHOP[J] Leuk Res. 2012;36(4):413–417. doi: 10.1016/j.leukres.2011.12.012. [DOI] [PubMed] [Google Scholar]
- 29.Lehmann MH, Schreiber S, Vogelsang H, et al. Constitutive expression of MCP-1 and RANTES in the human histiocytic lymphoma cell line U-937[J] Immunol Lett. 2001;76(2):111–113. doi: 10.1016/s0165-2478(01)00178-x. [DOI] [PubMed] [Google Scholar]