Abstract
目的
探讨穗花杉双黄酮调节体外诱导的M1型巨噬细胞极化的相关机制。
方法
设实验组、溶媒对照组和无药对照组,实验组:不同浓度的(5、10 μmol/L)穗花杉双黄酮干预用联合脂多糖及重组人干扰素-γ诱导的M1型巨噬细胞;溶媒对照组:溶媒3‰DMSO;无药对照组:不加穗花杉双黄酮处理。显微镜下观察细胞形态学;通过ELISA检测干预后细胞上清液L-6、IL-10、TNF-α、TGF-β各自的表达水平;通过CCK-8法检测计算出穗花杉双黄酮对细胞的安全浓度;通过分子对接建模确定穗花杉双黄酮的靶蛋白,利用RT-qPCR、Western blot检测L-6、IL-10、TNF-α、TGF-β、PPAR-α/γ、Arg-1、Fizz1基因和蛋白表达。
结果
穗花杉双黄酮干预后可以阻止被诱导引起的THP-1细胞向M1极化;穗花杉双黄酮可下调M1极化时高表达的IL-6、TNF-α的mRNA,上调M2型主要标志细胞因子IL-8和TGF-β的mRNA表达(P < 0.05),同时上调M1极化状态下的细胞内Arg1和Fizz1蛋白的表达(P < 0.05)。随着穗花杉双黄酮浓度的增加和作用时间的延长,其抑制细胞的增殖效果增强(P < 0.05),且高浓度具有杀伤作用。穗花杉双黄酮可与PPAR-α/γ关键靶点蛋白活性位点非共价结合并激活该蛋白。
结论
穗花杉双黄酮可通激活PPAR-α/γ,恢复Arg-1、Fizz1基因表达,抑制巨噬细胞向M1型分化。
Keywords: 穗花杉双黄酮, 巨噬细胞极化, 动脉粥样硬化, PPAR-α/γ, THP-1
Abstract
Objective
To investigate the mechanism by which amentoflavone inhibits polarization of THP-1-derived foam cells to M1 phenotype.
Methods
Human monocyte cell line THP-1 was stimulated to differentiate into M1-type macrophages using phorbol 12-myrislate13-acetate (PMA) combined with lipopolysaccharide (LPS) and recombinant human interferon-γ (rhlFN-γ). M1 polarization of THP-1-derived macrophages was confirmed by observing morphological changes of the cells and detecting the mRNA expression of L-6 and TNF-α with RT-qPCR. THP-1-derived foam cells treated with 5 or 10 μmol/L amentoflavone for 24 h were examined for cytokines using ELISA. The mRNA and protein expressions of IL-6, IL-10, TNF-α, TGF-β, PPAR-α/γ, Arg-1 and Fizz1 in the cells were detected using RT-qPCR and Western blotting.
Results
Amentoflavone prevented induced M1 polarization of THP-1 cells. Amentoflavone down-regulated the mRNA expressions of IL-6 and TNF-α, up-regulated mRNA expressions of IL-8 and TGF-β mRNA (P < 0.05), and increased the protein expressions of PPAR-α/γ, Arg-1 and Fizz1. Molecular docking simulation showed that amentoflavone could bind to the surface of PPARα/γ.
Conclusion
Amentoflavone can inhibit the differentiation of macrophages into M1 type by activating PPAR-α/γ and restoring the expressions of the gene Arg-1 and Fizz1.
Keywords: amentoflavone, macrophage polarization, atherosclerosis, PPAR-α/γ, THP-1
动脉粥样硬化(AS)是目前对人类健康影响最严重、最常见的慢性病之一,其发病机制有多种假说[1-2]。其中,AS发病的炎症机制是相对新的一种学说,而巨噬细胞是一种炎症细胞,在AS的炎症反应过程中发挥重要作用[3]。研究表明,巨噬细胞浸润病变并参与斑块的进展,不同极化类型的巨噬细胞在动脉粥样硬化的炎症反应过程中起重要作用,巨噬细胞贯穿于AS发展的全过程,其数量、表型、迁移等与AS斑块的命运息息相关,其亚型的极化被认为是AS发展的“关键动力”,并影响斑块稳定和AS结局[4]。过氧化物酶体增殖物激活受体(PPARs)是一类配体激活的转录因子,在巨噬细胞极化过程中发挥重要的作用,表现调节巨噬细胞代谢、抑制促炎基因和促进M2表型的转化[5-6]。中医药可通过调控巨噬细胞极化改善动脉粥样硬化斑块稳定性,在防治动脉粥样硬化易损斑块中展现良好的应用前景[7]。
我们前期筛选结果发现,穗花杉双黄酮可靶向结合PPAR-α/γ,但能否通过激动PPAR-α/γ对巨噬细胞的极化产生调节作用,既往未见研究报道。本研究拟采用不同浓度的穗花杉双黄酮干预用联合脂多糖(LPS)及重组人干扰素-γ(rhIFN-γ)诱导的M1型巨噬细胞,鉴定穗花杉双黄酮是否能够抑制THP-1源性巨噬细胞向M1型极化,随后检测相关细胞因子、基因、蛋白表达情况,结合穗花杉双黄酮(AF)的分子对接结果检测靶蛋白表达水平。旨在初步探索穗花杉双黄酮对巨噬细胞极化的分子调控作用,为动脉粥样硬化提供新的治疗靶点和理论依据。
1. 材料和方法
1.1. 实验材料、试剂
THP-1细胞(中国科学院细胞库),RPMI 1640培养基、双抗(青霉素-链霉素)、胰蛋白酶、胎牛血清[赛默飞世尔生物化学制品(北京)有限公司],AF、佛波酯(PMA)、联合LPS、重组人IFN-γ、GW9662、GW6471(Sigma),CCK8检测试剂(东仁化学科技上海有限公司),L-6、IL-10、TNF-α、TGF-β ELISA试剂盒(Biolegend),抗体PPAR-α/γ、Arg-1、Fizz1、GAPDH(CST)。
1.2. 细胞培养
THP-1单核细胞用含有10% 热灭活胎牛血清和10 U/mL青霉素、10 μg/mL链霉素的RPMI 1640培养液,在37 ℃、5%CO2培养箱中静置培养,维持细胞数1× 108/培养瓶左右。将传代培养的THP-1细胞稀释成1× 106/mL,接种于35 mm培养皿中,于含100 ng/mL佛波酯(PMA)、0.3% BSA的无血清RPMI 1640培养液中培养72 h诱导分化为M0状态。M0状态的巨噬细胞细胞稀释成1×106/mL用接种到6孔板中,加入1 μg/mL的LPS和20 ng/mL的rhIFN-γ极化成M1型细胞。
1.3. CCK-8测定
在96孔板中每孔加入M0状态的巨噬细胞细胞(1× 105/mL)100 μL的细胞悬液。用上述方法对THP-1细胞作M1型极化诱导24、48、72 h,并同步在每组中加入穗花杉双黄酮0.0、5.0、10.0、20.0、40.0、80.0、100.0 μmol/L。作用规定时间后,按照CCK-8说明书进行检测确定试验的安全浓度。
1.4. 分子对接建模
根据pubchem网站上中药单体的名称和CAS编号,下载小分子3D结构的SDF文件。然后针对PDB(mol2)获得的chem3D软件优化SDF。使用Chemidraw 11.0获得小分子结构,保存为mo12格式,Mgtools1.5.6获得PDBQT文件。蛋白质晶体结构从蛋白质数据库(<a href="http://www.rcsb.org/structure/3VI8" target="_blank">http://www.rcsb.org/structure/3VI8</a>,<a href="http://www.rcsb.org/structure/3ADS" target="_blank">http://www.rcsb.org/structure/3ADS</a>,<a href="http://www.rcsb" target="_blank">http://www.rcsb</a>)下载。经Mgtools1.5.6蛋白质结构处理,通过氢化、电荷计算,合并非极性氢后另存为PDBQT文件。使用AutoDock 4.2程序进行分子对接。选择最多的簇中具有最低结合能的构象用于进一步分析。通过Lamarck遗传算法打开分子PDBQT文件,并以灵活的方式对小分子结构操作100次,并通过autodock4保存到DPF文件中。
1.5. ELISA法检测细胞上清液中相关细胞因子含量
将建模成功的M0型细胞以1×106/孔接种于24孔板中,每孔加入含2 μg/mL的LPS和20 ng/mL的rhIFN- γ的培养基向M1型极化诱导24 h;同时用不同浓度药物处理24 h,设实验组(加药物培养)及对照组[溶媒对照组(3‰DMSO)和无药对照组]。按照ELISA试剂盒说明书操作,检测细胞上清中L-6、IL-10、TNF-α、TGF-β各自的表达。
1.6. RT-qPCR检测mRNA的表达水平
取2 mL M0型细胞以5×105/mL密度接种于12孔板中,M1型极化诱导方法同前,同步用不同浓度药物处理24 h,设实验组(加药物培养)及正常对照组[溶媒对照组(3‰DMSO)和无药对照组]。胰酶消化后,1200 r/min离心5 min收集细胞,冰冷PBS洗涤,应用TRIzol试剂(Takara)提取总RNA,离心样品加入氯仿,转移上清并加入预冷异丙醇。16 000 r/min离心10 min,弃上清加入冰冷乙醇清洗2次,离心后小心吸弃上清,产物以焦碳酸二乙酯水溶解。RNA定量采用NanoDrop微量分光光度计。取1 μg RNA用于合成cDNA,qPCR按照SYBR Green qPCR Master Mix(Thermo)操作说明进行,所用引物见表 1。上、下游引物各1 μL,无核酶水7 μL,总体系20 μL。以GADPH作为内参照,采用2-ΔΔCt法计算,对特异性扩增目的基因进行相对定量。
1.
qRT-PCR引物序列
qRT-PCR primers
| Gene | Forward primer (5'-3') | Reverse primer (5'-3') |
| GAPDH | TCTGGCACCACACCTTCTA | AGGCATACAGGGACAGCAC |
| IL-6 | TTCGGCAAATGTAGCATG | AATAGTGTCCTAACGCTCATAC |
| IL-10 | AGGGCACCCAGTCTGAGAACA, | CGGCCTTGCTCTTGTTTTCAC |
| TNF-α | ATTGCCCTGTGAGGAGGAC | TGAGCCAGAAGAGGTTGAGG |
| TGF-β | AACATGATCGTGCGCTCTGCAAGTGCAGC | AAGGAATAGTGCAGACAGGCAGGA |
1.7. Western blot法检测蛋白表达水平
取4 mL M0型细胞以2.5×104/mL密度接种于6孔板中,M1型极化诱导方法同前,同步用不同浓度药物处理24 h,实验分组同上。收集细胞,冰上裂解30 min,12 000 r/min离心30 min,吸取上清液,用BCA蛋白浓度测定试剂盒(碧云天生物)检测总蛋白浓度,将裂解液蛋白(50~100 μg)进行8%~15%SDS-PAGE,电泳转移至聚偏二氟乙烯膜(Amersham Bioscience)上。印迹后,将膜与特异性一抗在4 ℃孵育过夜。与HRP连接的二抗杂交后,通过增强的化学发光检测试剂(Amersham Biosciences)显可视化蛋白质条带。
1.8. 统计分析方法
实验数据采用SPSS25.0统计软件进行统计分析,实验数据定量资料均以均数±标准差表示,多组比较采用单因素方差分析及两因素方差分析,组间两两比较采用LSDt检验,P < 0.05认为差异具有统计学意义。
2. 结果
2.1. THP-1细胞向M1型极化的模型诱导
THP-1细胞100 ng/mL PMA、0.3% BSA的无血清RPMI1640培养液中培养72 h诱导分化为M0状态,倒置显微镜下观察到细胞形态以圆形为主且贴壁。加入LPS(2 μg/mL)和rhIFN-γ(20 ng/mL)诱导24 h极化成M1型细胞,镜下观察细胞形态变化较明显,多成梭形有伪足出现(图 1C)。RT-qPCR检测结果显示,经诱导极化为M1状态后的细胞,TNF-α、IL-6mRNA表达水平高于正常THP-1细胞和M0状态的细胞(P < 0.01,图 2)。
1.

不同状态下THP-1细胞形态
Morphology of THP-1 cells with or without induction. A: THP-1 cells without treatment. B: Cells stimulated with PMA for 72 h (M0). C: Cells induced by LPS and IFN-γ for 24 h after PMA stimulation (M1) (Original magnification: ×200).
2.

诱导成M1型细胞TNF-α、IL-6mRNA表达水平
Expressions of TNF-α and IL-6 mRNA in the cells after LPS and IFN-γ induction for 24 h.
2.2. 穗花杉双黄酮与PPAR-α/γ蛋白分子对接建模
通过分析对接100次的结果,选取能量最优构象(图 3)。穗花杉双黄酮主要通过疏水、范德华力进入PPAR-α/γ靶点蛋白活性位点非共价结合,其中与PPAR-α蛋白活性位点处的AL332、MET330、LEU331、LEU321、ILE317、THR279、SER280、HIS440、CYS276、CYS275、ILE272、GLU251、LEU247等氨基酸残基发生相互作用,配体能够与LEU331、GLU251氨基酸形成氢键。穗花杉双黄酮与PPAR-γ蛋白活性位点处的ARG280、ILE281、LYS265、HIS448、TYR327、SER239、ARG288、LYS265、ILE341、PHE264、LEU333、GLY284等氨基酸残基发生相互作用,配体能够与LYS265、TYR327、ILE281、LYS367、PHE264五个氨基酸形成氢键。氢键的形成增强了穗花杉双黄酮靶向PPAR-α/γ蛋白能力,其中与PPAR-γ结合能力更强,更好的抑制或者激活该蛋白。
3.

分子对接结果示意图
Molecular docking simulation. A: Molecular docking simulation between amentoflavone and PPARα/γ. B, C: Protein accumulation diagram and enlarged view of PPARα/γ binding withAmentoflavone.
2.3. 穗花杉双黄酮对M1型极化的THP-1细胞毒性影响
CCK-8检测结果显示,随着穗花杉双黄酮浓度的增加和作用时间的延长,其抑制细胞的增殖效果增强,且高浓度具有杀伤作用(图 4)。穗花杉双黄酮对M1型极化的THP-1细胞24、48、72 h的IC50值分别为56.55± 5.28、16.97±3.13和8.55±0.87 μmol/L。根据实验结果,选择5、10 μmol/L浓度进行后续实验。
4.

穗花杉双黄酮对M1型极化的THP-1细胞毒性影响
Toxic effect of amentoflavone on M1 polarized THP-1 cells.
2.4. 穗花杉双黄酮对THP-1源性M1型极化细胞的干预作用
THP-1细胞先用佛波酯诱导分化为M0状态后,加入LP、rhIFN-γ和AF诱导24 h后,进行相关实验检测。ELISA法检测结果显示:与正常组相比,诱导成M1型极化细胞的模型组的TNF-α、IL-6表达水平升高(P < 0.05),TGF-β、IL-10表达水平下降(P < 0.05,图 5)。与模型组比较,穗花杉双黄酮干预后使TGF-β、IL-10表达水平上调,而TNF-α、IL-6表达水平下调。RT-qPCR的结果也显示穗花杉双黄酮上调THP-1源性M1型极化细胞的TGF-β、IL-10 mRNA(图 6)。
5.

穗花杉双黄酮对THP-1源性M1型极化细胞因子的影响
Contents of IL-6, TNF-α, IL-10 and TGF-β in supernatant of M1 type polarized THP-1 cells treated with amentoflavone. A, B: Amentoflavone down-regulated the expression of IL-6 and TNF-α. C, D: Amentoflavone up-regulated the expression of IL-10 and TGF-β. *P < 0.05 vs BLANK group, **P < 0.01 vs BLANK group.
6.

穗花杉双黄酮对THP-1源性M1型极化细胞因子的mRNA表达影响
mRNA expressions of IL-6, TNF-α, IL-10 and TGF-β in M1 polarized THP-1 cells treated with amentoflavone. A, B: Amentoflavone down-regulated the expression of mRNA-IL-6 and mRNA-TNF-α. C, D: Amentoflavone upregulated the expression of mRNA-IL-10 and mRNA-TGF-β. *P < 0.05 vs M1-24 h group, **P < 0.01 vs M1-24 h.
2.5. 穗花杉双黄酮对THP-1源性M1型极化细胞蛋白表达的影响
在上述分子对接的理论基础上,我们推测穗花杉双黄酮可能通过激活PPAR-α/γ抑制THP-1源性M0型细胞向M1型极化。Western blot检测结果显示,M1型极化诱导的细胞中,药物同步处理24 h后,PPAR-α/γ、Arg-1、Fizz1蛋白表达上调(P < 0.05,图 7)。
7.
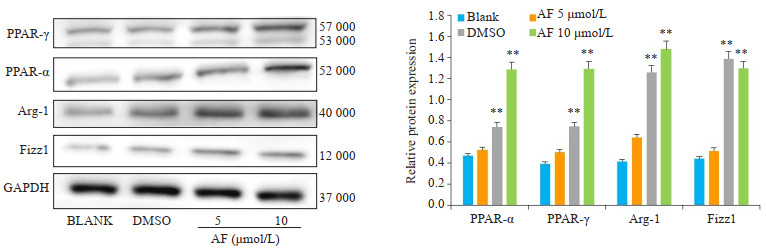
穗花杉双黄酮对THP-1源性M1型极化细胞的相关蛋白影响
Protein expressions of PPAR-α/γ, Arg-1 and Fizz1 in M1 polarized THP-1 cells treated with amentoflavone (AF). *P < 0.05, **P < 0.01 vs BLANK group.
2.6. PPAR-α/γ的拮抗剂GW9662,GW6471对穗花杉双黄酮作用的THP-1源性M1型极化细胞的影响
使用PPAR-γ的选择性拮抗剂GW9662(2 nmol/L)和PPAR-α的有效拮抗剂GW6471(100 μmol/L)与穗花杉双黄酮(10 μmol/L)共同孵育THP-1源性M1型极化细胞。ELISA法检测结果显示:与正常组相比,GW9662可以逆转穗花杉双黄酮对THP-1源性M1型极化细胞因子的影响,模型组的TNF-α、IL-6表达水平升高(P < 0.05),TGF-β,IL-10表达水平下降(P < 0.05,图 8)。而PPAR-α的有效拮抗剂GW6471对穗花杉双黄酮对THP-1源性M1型极化细胞因子的影响无统计学意义。另外,使用Western blot检测GW9662和GW6471对穗花杉双黄酮共同孵育THP-1源性M1型极化细胞分泌的蛋白发现,GW9662下调PPAR-γ、Arg-1、Fizz1蛋白的表达,但GW6471仅下调PPAR-α的表达,对Arg-1、Fizz1无影响(图 9)。
8.

PPAR-γ的拮抗剂GW9662对THP-1源性M1型极化细胞因子的影响
Contents of IL-6, TNF-α, IL-10 and TGF-β in supernatant of M1 polarized THP-1 cells treated with GW9662 and amentoflavone (AF). *P < 0.05, **P < 0.01.
9.
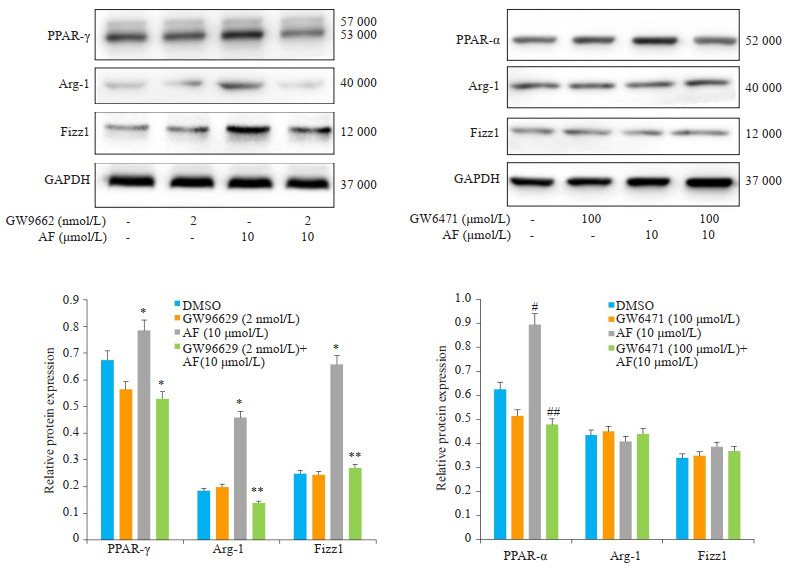
PPAR-α/γ的拮抗剂GW9662,GW6471对THP-1源性M1型极化细胞的相关蛋白影响
Protein expressions of PPAR-α/γ, Arg-1, and Fizz1 in M1 polarized THP-1 cells treated with GW9662 and GW6471. *P < 0.05 vs GW9662 group, **P < 0.01 vs AF group, #P < 0.05 vs GW6471 group, ##P < 0.01 vs AF group.
3. 讨论
炎性细胞与血管内皮细胞、平滑肌细胞、细胞外基质之间相互作用调控着AS的发生、发展及消退,尤其是单核-巨噬细胞,在动脉粥样硬化的炎症反应过程中发挥不可缺少的作用[8-10]。巨噬细胞的极化类型与AS的斑块密切相关,其中,M1主要存在于早期斑块中,与斑块形成相关;M2主要与斑块的进展相关,且能发挥抗炎效应,促进AS炎症的修复。随着AS损伤的进展,M1型和M2型巨噬细胞表型会发生转化,在斑块的不同部位可同时存在不同极化类型的巨噬细胞[11-12]。穗花杉双黄酮是一种黄酮类中药单体,既往的研究显示它有抗炎、抗氧化等作用[13]。由于巨噬细胞具有高度可塑性,针对巨噬细胞极化的扭转可能是炎症过程修复的策略之一[14]。但穗花杉双黄酮能否对巨噬细胞的极化产生调节作用,既往少有文献报道。
研究显示,巨噬细胞可以在不同环境中主要向两个极端极化:M1型巨噬细胞称为经典活化型,可由LPS单独或与其他细胞因子如IFN-γ、TNF-α等协同诱导活化,其表面特异性标志物以大量的促炎细胞因子如IL-1β、IL-6、IL-12、IL-23、TNF-α为特征,亦高表达诱导型一氧化氮合酶;M2型巨噬细胞称为替代活化型,可由IL-4、IL-13、IL-10、TGF-β、糖皮质激素、免疫复合物等诱导活化,以IL-10高表达、IL-12低表达为特征,高表达甘露糖受体、CD163,并表达高水平的Arg-1[8, 12, 15-17]。本研究中,加入LPS和rhIFN-γ诱导THP-1细胞24 h后,镜下观察细胞形态变化较明显,多成梭形有伪足出现,TNF-α、IL-6mRNA表达水平显著高于正常THP-1细胞和M0状态的细胞,说明诱导THP-1细胞至M1型是成功的。穗花杉双黄酮在安全同浓度干预LPS+rhIFN-γ联合诱导的THP-1源M1型细胞后,能使TGF-β,IL-10表达水平上调,而使TNF-α、IL-6表达水平下调,RT-qPCR的结果也显示穗花杉双黄酮能上调THP-1源性M1型极化细胞的TGF-β,IL-10 mRNA,说明穗花杉双黄酮可抑制巨噬细胞向M1型分化。
利用药物靶标相似性算法在靶标数据库、疾病基因组数据库挖掘与某个疾病相关的靶标,再在分子对接软件进行靶标预测, 是研究药物作用机制的手段之一[18]。分子对接显示,穗花杉双黄酮主要通过疏水、范德化力进入PPAR-α/γ靶点蛋白活性位点非共价结合,并可以形成氢键,穗花杉双黄酮与PPAR-γ结合能力更强,从而更好的抑制或者激活该蛋白。既往研究显示中药活性单体与PPARs靶向结合主要执行脂质和炎性反应调控作用。例如,丹参酮ⅡA、小檗碱和橙皮素1等靶向作用PPAR-γ调控经过一系列蛋白,促进胆固醇流出,减少细胞内脂质的沉积[19-21]。黄芪、当归、党参等活性成分通过作用PPAR-β可降低促炎因子MCP-1、TNF-α的水平,升高抗炎因子IL-10的水平,进而调控炎性反应[22]。而未见PPARs在调控巨噬细胞极化上发挥作用。有研究显示,PPARγ通过与其他转录因子与Arg1、Fizz1和Ym1基因启动子区域结合,进而促进Arg1和Fizz1基因表达并调控巨噬细胞M2极化水平,敲除PPARγ的巨噬细胞,Arg1的表达显著下调[23-25]。PPARγ1可通过去SUMO化促进下游Arg1基因的表达从而参与调控巨噬细胞M2型极化[26]。PPARγ还可通过与LPL基因启动子区域的PPARγ反应元件相互作用,从而增强LPL的表达[27],同时抑制炎性因子如TNF-α的表达,通过调控NF-κB、信号转导子和转录激活子等表达来抑制细胞因子和炎性因子IL-6、IL-1β的表达及分泌从而发挥重要的抗炎作用[28]。这说明PPARγ可驱动巨噬细胞向抗炎状态转变。本研究结果显示,M1型极化诱导的细胞中,穗花杉双黄酮同步处理24 h后,PPAR-α/γ、Arg-1、Fizz1蛋白表达上调,穗花杉双黄酮可能通过激活PPAR-α/γ抑制THP-1源性M0型细胞向M1型极化。
综上所述,中药单体穗花杉双黄酮能激活PPAR-α/ γ抑制巨噬细胞向M1型分化的作用,并可能逆转M1型巨噬细胞向M2型转化,发挥抗炎作用。有关穗花杉双黄酮促使M1型巨噬细胞向M2型巨噬细胞的具体转化机制还需进一步研究。
Biography
邱峰,博士,主任技师,硕士生导师,E-mail: QFSFL@126.com
Funding Statement
广东省佛山市医学类科技攻关项目(2018AB001112);佛山市中医药领域科技攻关专项(2020001005585);佛山市“新型冠状病毒感染的肺炎”应急科技攻关专项(2020001000376);广东省医学科研基金项目(B2020144)
Contributor Information
邱 峰 (Feng QIU), Email: QFSFL@126.com.
邓 屹琪 (Yiqi DENG), Email: dy_7dy_7@163.com.
References
- 1.Virani SS, Alonso A, Benjamin EJ, et al. Heart disease and stroke statistics—2020 update: a report from the American Heart Association. Circulation. 2020;141(9):230–6. doi: 10.1161/CIR.0000000000000757. [Virani SS, Alonso A, Benjamin EJ, et al. Heart disease and stroke statistics—2020 update: a report from the American Heart Association[J]. Circulation, 2020, 141(9): 230-6.] [DOI] [PubMed] [Google Scholar]
- 2.国家心血管病中心 . 中国心血管健康与疾病报告2019. 北京: 科学出版社; 2020. [国家心血管病中心. 中国心血管健康与疾病报告2019[M]. 北京: 科学出版社, 2020.] [Google Scholar]
- 3.孙 小淋, 鲁 敏, 楚 英杰. 巨噬细胞的异质性与动脉粥样硬化. 中华心血管病杂志. 2019;47(8):660–3. doi: 10.3760/cma.j.issn.0253-3758.2019.08.014. [孙小淋, 鲁敏, 楚英杰. 巨噬细胞的异质性与动脉粥样硬化[J]. 中华心血管病杂志, 2019, 47(8): 660-3.] [DOI] [PubMed] [Google Scholar]
- 4.Vergallo R, Crea F. Atherosclerotic plaque healing. N Engl J Med. 2020;383(9):846–57. doi: 10.1056/NEJMra2000317. [Vergallo R, Crea F. Atherosclerotic plaque healing[J]. N Engl J Med, 2020, 383(9): 846-57.] [DOI] [PubMed] [Google Scholar]
- 5.Tian Y, Yang C, Yao Q, et al. Procyanidin B2 Activates PPARγ to induce M2 polarization in mouse macrophages. Front Immunol. 2019;10:1895–903. doi: 10.3389/fimmu.2019.01895. [Tian Y, Yang C, Yao Q, et al. Procyanidin B2 Activates PPARγ to induce M2 polarization in mouse macrophages[J]. Front Immunol, 2019, 10: 1895-903.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med. 2017;377(12):1119–31. doi: 10.1056/NEJMoa1707914. [Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease[J]. N Engl J Med, 2017, 377(12): 1119-31.] [DOI] [PubMed] [Google Scholar]
- 7.Zhang M, Liu Y, Xu M, et al. Carotid artery plaque intervention with Tongxinluo capsule (CAPITAL): a multicenter randomized doubleblind parallel-group placebo-controlled study. Sci Rep. 2019;9(1):4545–52. doi: 10.1038/s41598-019-41118-z. [Zhang M, Liu Y, Xu M, et al. Carotid artery plaque intervention with Tongxinluo capsule (CAPITAL): a multicenter randomized doubleblind parallel-group placebo-controlled study[J]. Sci Rep, 2019, 9 (1): 4545-52.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Shapouri-Moghaddam A, Mohammadian S, Vazini H, et al. Macrophage plasticity, polarization, and function in health and disease. J Cell Physiol. 2018;233(9):6425–40. doi: 10.1002/jcp.26429. [Shapouri-Moghaddam A, Mohammadian S, Vazini H, et al. Macrophage plasticity, polarization, and function in health and disease[J]. J Cell Physiol, 2018, 233(9): 6425-40.] [DOI] [PubMed] [Google Scholar]
- 9.Tabas I, Bornfeldt KE. Macrophage phenotype and function in different stages of atherosclerosis. Circ Res. 2016;118(4):653–67. doi: 10.1161/CIRCRESAHA.115.306256. [Tabas I, Bornfeldt KE. Macrophage phenotype and function in different stages of atherosclerosis[J]. Circ Res, 2016, 118(4): 653-67.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Yla-Herttuala S, Bentzon JF, Daemen M., et al. Stabilization of atherosclerotic plaques: an update. Eur Heart J. 2013;34(42):3251–8. doi: 10.1093/eurheartj/eht301. [Yla-Herttuala S, Bentzon JF, Daemen M. et al. Stabilization of atherosclerotic plaques: an update[J]. Eur Heart J, 2013, 34(42): 3251-8.] [DOI] [PubMed] [Google Scholar]
- 11.Costantini A, Viola N, Berretta A, et al. Age-related M1/M2 phenotype changes in circulating monocytes from healthy/unhealthy individuals. http://europepmc.org/abstract/MED/29885276. Aging: Albany NY. 2018;10(6):1268–80. doi: 10.18632/aging.101465. [Costantini A, Viola N, Berretta A, et al. Age-related M1/M2 phenotype changes in circulating monocytes from healthy/unhealthy individuals[J]. Aging: Albany NY, 2018, 10(6): 1268-80.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Sica A, Erreni M, Allavena P, et al. Macrophage polarization in pathology. Cell Mol Life Sci. 2015;72(21):4111–26. doi: 10.1007/s00018-015-1995-y. [Sica A, Erreni M, Allavena P, et al. Macrophage polarization in pathology[J]. Cell Mol Life Sci, 2015, 72(21): 4111-26.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zhang Z, Sun T, Niu JG, et al. Amentoflavone protects hippocampal neurons: anti-inflammatory, antioxidative, and antiapoptotic effects. Neural Regen Res. 2015;10(7):1125–33. doi: 10.4103/1673-5374.160109. [Zhang Z, Sun T, Niu JG, et al. Amentoflavone protects hippocampal neurons: anti-inflammatory, antioxidative, and antiapoptotic effects [J]. Neural Regen Res, 2015, 10(7): 1125-33.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Finn AV, Nakano M, Polavarapu R, et al. Hemoglobin directs macrophage differentiation and prevents foam cell formation in human atherosclerotic plaques. J Am Coll Cardiol. 2012;59(2):166–77. doi: 10.1016/j.jacc.2011.10.852. [Finn AV, Nakano M, Polavarapu R, et al. Hemoglobin directs macrophage differentiation and prevents foam cell formation in human atherosclerotic plaques[J]. J Am Coll Cardiol, 2012, 59(2): 166-77.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chu KA, Wang SY, Yeh CC, et al. Reversal of bleomycin-induced rat pulmonary fibrosis by a xenograft of human umbilical mesenchymal stem cells from Wharton's jelly. Theranostics. 2019;9(22):6646–64. doi: 10.7150/thno.33741. [Chu KA, Wang SY, Yeh CC, et al. Reversal of bleomycin-induced rat pulmonary fibrosis by a xenograft of human umbilical mesenchymal stem cells from Wharton's jelly[J]. Theranostics, 2019, 9(22): 6646-64.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Labonte AC, Tosello-Trampont AC, Hahn YS. The role of macrophage polarization in infectious and inflammatory diseases. Mol Cells. 2014;37(4):275–85. doi: 10.14348/molcells.2014.2374. [Labonte AC, Tosello-Trampont AC, Hahn YS. The role of macrophage polarization in infectious and inflammatory diseases[J]. Mol Cells, 2014, 37(4): 275-85.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Arora S, Dev K, Agarwal B, et al. Macrophages: Their role, activation and polarization in pulmonary diseases. Immunobiology. 2018;223(4/5):383–96. doi: 10.1016/j.imbio.2017.11.001. [Arora S, Dev K, Agarwal B, et al. Macrophages: Their role, activation and polarization in pulmonary diseases[J]. Immunobiology, 2018, 223(4/5): 383-96.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.刘 志强, 王 博龙. 中药网络药理学药效成分筛选与靶标预测的研究进展. https://www.cnki.com.cn/Article/CJFDTOTAL-ZCYA201901033.htm. 中成药. 2019;41(1):171–8. [刘志强, 王博龙. 中药网络药理学药效成分筛选与靶标预测的研究进展[J]. 中成药, 2019, 41(1): 171-8.] [Google Scholar]
- 19.lio A, Ohguchi K, linuma M, et al. Hesperetin upregulates ABCA 1 expression and promotes cholesterol eflux from THP-1macrophages. J Natural Product. 2012;75(4):563–6. doi: 10.1021/np200696r. [lio A, Ohguchi K, linuma M, et al. Hesperetin upregulates ABCA 1 expression and promotes cholesterol eflux from THP-1macrophages [J]. J Natural Product, 2012, 75(4): 563-6.] [DOI] [PubMed] [Google Scholar]
- 20.Tang FT, Cao Y, Wang TQ, et al. Tanshinone ⅡA attenuates atherosclerosis in ApoE(-/-) mice through down-regulation of scavenger receptor expression. Eur J Pharmacol. 2011;650(1):275–84. doi: 10.1016/j.ejphar.2010.07.038. [Tang FT, Cao Y, Wang TQ, et al. Tanshinone ⅡA attenuates atherosclerosis in ApoE(-/-) mice through down-regulation of scavenger receptor expression[J]. Eur J Pharmacol, 2011, 650(1): 275-84.] [DOI] [PubMed] [Google Scholar]
- 21.张 倩, 张 怡, 卢 令慧, et al. PPARs在冠心病脂质代谢和炎性反应中分子调控机制及中医药研究进展. https://www.cnki.com.cn/Article/CJFDTOTAL-BXYY201708080.htm. 中华中医药杂志. 2017;32(8):3623–5. [张倩, 张怡, 卢令慧, 等. PPARs在冠心病脂质代谢和炎性反应中分子调控机制及中医药研究进展[J]. 中华中医药杂志, 2017, 32(8): 3623-5.] [Google Scholar]
- 22.丁 萍萍, 张 陆勇. 过氧化物酶体增殖物激活受体α在脂质代谢中的作用研究进展. https://www.cnki.com.cn/Article/CJFDTOTAL-PLHY201904106.htm. 临床合理用药杂志. 2019;12(4):177–9. [丁萍萍, 张陆勇. 过氧化物酶体增殖物激活受体α在脂质代谢中的作用研究进展[J]. 临床合理用药杂志, 2019, 12(4): 177-9.] [Google Scholar]
- 23.Chandra M, Miriyala S, Panchatcharam M. Panchatcharam, PPARγ and its role in cardiovascular diseases. http://www.ncbi.nlm.nih.gov/pubmed/28243251. PPAR Res. 2017;85(12):6404638–49. doi: 10.1155/2017/6404638. [Chandra M, Miriyala S, Panchatcharam M. Panchatcharam, PPARγ and its role in cardiovascular diseases[J]. PPAR Res, 2017, 85(12): 6404638-49.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Odegaard JI, Ricardo-Gonzalez RR, Goforth MH, et al. Macrophagespecific PPARgamma controls alternative activation and improves insulin resistance. Nature. 2007;447(7148):1116–20. doi: 10.1038/nature05894. [Odegaard JI, Ricardo-Gonzalez RR, Goforth MH, et al. Macrophagespecific PPARgamma controls alternative activation and improves insulin resistance[J]. Nature, 2007, 447(7148): 1116-20.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.L i, Q, Peng H, Fan H, et al. The LIM protein Ajuba promotes adipogenesis by enhancing PPARγ and p300/CBP interaction. Cell Death Different. 2016;23(1):158–68. doi: 10.1038/cdd.2015.83. [Li, Q, Peng H, Fan H, et al. The LIM protein Ajuba promotes adipogenesis by enhancing PPARγ and p300/CBP interaction[J]. Cell Death Different, 2016, 23(1): 158-68.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.王 秀芝, 左 勇. PPARγ1的SUMO化修饰对巨噬细胞M2极化的抑制作用. https://www.cnki.com.cn/Article/CJFDTOTAL-SHEY201912016.htm. 上海交通大学学报: 医学版. 2019;39(12):1402–8. [王秀芝, 左勇. PPARγ1的SUMO化修饰对巨噬细胞M2极化的抑制作用[J]. 上海交通大学学报: 医学版, 2019, 39(12): 1402-8.] [Google Scholar]
- 27.Bai L, Li Z, Li QW, et al. Mediator 1 is atherosclerosis protective by regulating macrophage polarization. http://www.ncbi.nlm.nih.gov/pubmed/28642237. Arterioscler Thromb Vasc Biol. 2017;37(8):1470–81. doi: 10.1161/ATVBAHA.117.309672. [Bai L, Li Z, Li QW, et al. Mediator 1 is atherosclerosis protective by regulating macrophage polarization[J]. Arterioscler Thromb Vasc Biol, 2017, 37(8): 1470-81.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Zhang X, Liu MH, Qiao L, et al. Ginsenoside Rb1 enhances atherosclerotic plaque stability by skewing macrophages to the M2 phenotype. http://onlinelibrary.wiley.com/doi/10.1111/jcmm.13329. J Cell Mol Med. 2018;22(1):409–16. doi: 10.1111/jcmm.13329. [Zhang X, Liu MH, Qiao L, et al. Ginsenoside Rb1 enhances atherosclerotic plaque stability by skewing macrophages to the M2 phenotype[J]. J Cell Mol Med, 2018, 22(1): 409-16.] [DOI] [PMC free article] [PubMed] [Google Scholar]


