Abstract
Die Aufarbeitung von Lymphonodektomiepräparaten gynäkologischer Malignome orientiert sich an den nationalen AWMF-Leitlinien und internationalen Empfehlungen. Die Definition von Mikrometastasen und isolierten Tumorzellen entspricht den Festlegungen der UICC(Union Internationale Contre le Cancer)/TNM(TNM-Klassifikation maligner Tumoren). Deren Nachweis soll im Befundbericht erwähnt werden sowie in die Tumorklassifikation einfließen. Alle übersandten Lymphknoten (LK) sollen untersucht werden mit vollständiger Einbettung aller LK bis 0,3 cm und Lamellierung aller größeren Lymphknoten parallel zu ihrer kurzen Achse in ca. 0,2 cm dicken Scheiben. Bestandteile des histologischen Befundberichtes sind: Zahl der befallenen LK im Verhältnis zur Zahl der entfernten/untersuchten LK entsprechend der Entnahmelokalisationen, metrische Ausdehnung der größten LK-Metastase, Fehlen/Nachweis einer extrakapsulären Ausbreitung. Zuschnitt und Einbettung von Sentinel-LK mit oder ohne Schnellschnittuntersuchung erfolgt in Analogie zu Nicht-Sentinel-LK mit Anfertigung von ca. 3 HE-gefärbten Stufenschnitten in einem Abstand von ca. 200 µm sowohl vom Gefrier- als auch Paraffinblock. Stellen sich die Sentinel-LK in der HE-Färbung negativ dar, soll ein immunhistochemisches Ultrastaging erfolgen.
Schlüsselwörter: Lymphknoten, Aufarbeitung, Mikrometastasen, Isolierte Tumorzellen, Ultrastaging
Abstract
The handling and reporting of resected lymph nodes in gynecologic cancer follows the recommendations of the German national guidelines and the recommendations of the International Collaboration of Cancer Reporting (ICCR) and the International Society of Gynecologic Pathologists (ISGyP). The definitions of micrometastases and isolated tumor cells are in accordance with the definition of the UICC (Union Internationale Contre le Cancer) and TNM system. Both findings must be reported as part of the pathology report and final tumor classification. It is mandatory to examine all excised lymph nodes with complete processing of all nodes up to 0.3 cm and slicing of all larger nodes in 0.2-cm wide intervals with complete processing of all lamellae. The amount of the resected lymph nodes in correlation to positive nodes, the metric dimension of the largest lymph node metastasis per lymph node region, and the presence of extracapsular extension of the lymph node deposits must be part of the pathology report. The handling and cutting of sentinel lymph nodes are similar to nonsentinel nodes. Within frozen section analyses and final processing from paraffin-embedded sentinel nodes, all nodes should be examined by three-step sections with an interval of about 200 µm. In cases of negative sentinel nodes on H&E staining, immunohistochemical ultrastaging should be performed.
Keywords: Lymph node, Cutting, Reporting, Micrometastases, Isolated tumor cells, Ultrastaging
Die Aufarbeitung von Lymphonodektomiepräparaten gynäkologischer Malignome orientiert sich an den jeweiligen AWMF-Leitlinien [3–6] sowie an Empfehlungen der International Collaboration of Cancer Reporting (ICCR), des Royal College of Pathologists und der International Society of Gynecologic Pathologists (ISGyP;[30, 32, 46]).
Allgemeine Definitionen
Entsprechend der UICC- und TNM-Klassifikation sind Mikrometastasen definiert als der histologische Nachweis von Tumorzellen im Lymphknoten von ≥0,2 mm, aber nicht größer als 0,2 cm. Tumorzellen von <0,2 mm Gesamtausdehnung werden als isolierte Tumorzellen im Lymphknoten definiert [41, 51].
Ungeachtet der Tatsache, dass die prognostische Bedeutung isolierter Tumorzellen bzw. von Mikrometastasen unklar ist [11, 25, 28, 31, 42, 48], sollen diese, den allgemeinen Empfehlungen der TNM-Klassifikation folgend [51], im Befundbericht enthalten sein und in die Tumorklassifikationen einfließen.
Infobox 1 Dokumentation von isolierten Tumorzellen und von Mikrometastasen
Der Nachweis von isolierten Tumorzellen bzw. von Mikrometastasen soll im histologischen Befundbericht erwähnt werden und in die TNM-Klassifikation einfließen.
Die extrakapsuläre Ausbreitung von Lymphknotenmetastasen ist beim Vulvakarzinom prognose- und stagingrelevant [45, 51]. Beim Zervixkarzinom gibt es Hinweise auf eine prognostische Bedeutung [20]. Beim Vaginal- und Endometriumkarzinom liegen dazu keine Daten vor. Dennoch wird in allen AWMF-Leitlinien empfohlen, die extrakapsuläre Ausbreitung standardmäßig im Befundbericht zu erwähnen [3–6].
Parametrane (mesometrane) Lymphknoten gehören beim Endometrium‑, Zervix- und proximalen Vaginalkarzinom zu den regionären Lymphknoten [51] und sollen unter den pelvinen Lymphknoten subsumiert werden. Intraomentale Lymphknoten gehören beim Ovarialkarzinom zu den regionären Lymphknoten [22].
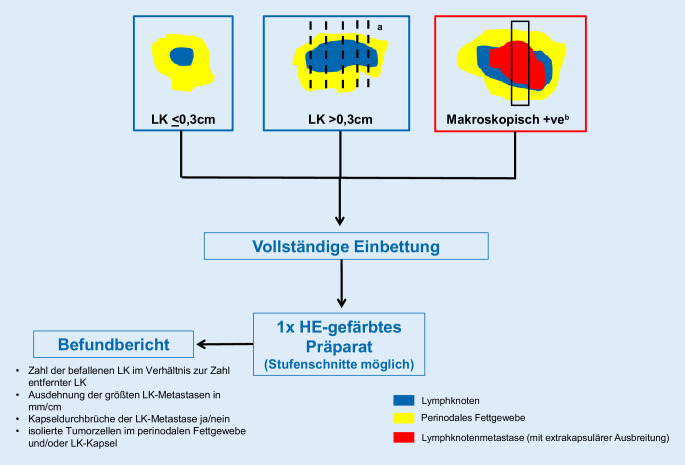
Aufarbeitung und Befundung von Lymphonodektomiepräparaten (Abb. 1 und 2; Tab. 1 und 2)
| Vulva | Vagina | Zervix | Endometrium | Ovar |
|---|---|---|---|---|
| – Dreidimensionale Messung des pro Lymphknotenstation resezierten Fettgewebesa | ||||
| – Lamellieren und Palpieren des resezierten Fettgewebes zur Identifizierung von Lymphknoten | ||||
| – Untersuchung ALLER resezierten/identifizierten Lymphknoten | ||||
| – Einbettung aller Lymphknoten <0,3 cm in toto | ||||
| – Lymphknoten >0,3 cm Lamellierung parallel zur kurzen Achse in 0,2 cm Abständen, komplette Einbettung | ||||
| – Belassen eines schmalen perinodalen Fettgewebes zur Beurteilung der Lymphknotenkapselb | ||||
| – Bei makroskopisch eindeutig befallenen Lymphknoten Einbettung einer repräsentativen Probe des Lymphknotens | ||||
| – Anfertigung eines HE-gefärbten Schnittpräparates pro Block | ||||
| – Bei makroskopisch fehlendem Lymphknotennachweis, (ausgedehnte, ggf. komplette) Einbettung des übersandten Fettgewebesc | ||||
HE Hämatoxylin-Eosin
aEinsatz sog. Clearingtechniken nicht empfohlen
bWichtig für die Beurteilung, ob eine extrakapsuläre Ausbreitung der Lymphknotenmetastase(n) vorliegt
cGgf. Einbettung von 2–3 zusätzlichen Kapseln mit Fettgewebe, wenn pro übersandter Lymphknotenstation weniger als 3 Lymphknoten makroskopisch nachweisbar sind
| Vulva | Vagina | Zervix | Endometrium | Ovar |
|---|---|---|---|---|
| – Angabe der Zahl der befallenen Lymphknoten im Verhältnis zur Zahl der entfernten/untersuchten Lymphknoten in Zuordnung zur Entnahmelokalisation (z. B. 4/13 inguinal links oder 0/15 inguinal links bzw. 7/22 iliakal extern rechts oder 0/17 paraaortal) | ||||
| – Angabe der größten Ausdehnung der größten Lymphknotenmetastase in mm/cm | ||||
| – Angabe des Fehlens/Nachweises eines Kapseldurchbruches der Lymphknotenmetastase(n) | ||||
| – Angabe des Nachweises isolierter Tumorzellen im Lymphknoten sowie des Nachweises von Lymphgefäßeinbrüchen im perinodalen Fettgewebe und/oder der Lymphknotenkapsel | ||||
Das entsprechend der klinisch determinierten Entnahmelokalisation entfernte Fettgewebe soll dreidimensional gemessen werden. Es empfiehlt sich das sorgfältige Lamellieren und Palpieren zur Identifikation aller resezierten Lymphknoten. Sogenannte Clearingtechniken werden in den Leitlinien nicht empfohlen [4–7, 46].
Alle makroskopisch identifizierten Lymphknoten sollen histologisch untersucht werden. Dabei sollten Lymphknoten bis ca. 0,3 cm Größe komplett eingebettet und größere Lymphknoten parallel zu ihrer kurzen Achse in ca. 0,2 cm dicke Scheiben lamelliert und ebenfalls komplett eingebettet werden [13, 18, 27, 30]. Bei makroskopisch befallenen Lymphknoten ist die Einbettung einer repräsentativen Probe ausreichend. Zur Beurteilung einer extrakapsulären Ausbreitung empfiehlt es sich, einen schmalen Fettgewebssaum an den Lymphknoten zu belassen [23, 30]. Lassen sich im übersandten Fettgewebe makroskopisch keine Lymphknoten nachweisen, empfiehlt sich eine ausgedehnte, ggf. komplette Einbettung und Aufarbeitung. Beim Nachweis von <3 Lymphknoten im lokalisationsbezogenen Fettgewebe empfiehlt es sich, 1–3 zusätzliche Kapseln zum Nachweis mikroskopisch kleiner Lymphknoten einzubetten.
Infobox 2 Aufarbeitung von Lymphonodektomiepräparaten
Bei Lymphonodektomiepräparaten bei gynäkologischen Malignomen sollen alle entfernten Lymphknoten histologisch untersucht werden.
Lymphknoten bis ca. 0,3 cm Größe sollten komplett eingebettet und größere Lymphknoten parallel zu ihrer kurzen Achse in ca. 0,2 cm dicke Scheiben lamelliert und ebenfalls komplett eingebettet werden.
Außerhalb von Studien genügt die Anfertigung eines HE-gefärbten Schnittes pro Block [3–6, 32]. Bei allen gynäkologischen Malignomen haben Studien ergeben, dass die Anfertigung von Stufenschnitten (mit einem Abstand von ca. 200 µm) die Chance der Detektion kleiner Metastasen bzw. von Mikrometastasen sowie isolierter Tumorzellen erhöht [8, 14, 21, 35, 36].
Die metrische Größenausdehnung von Lymphknotenmetastasen ist beim Vulva- und Ovarialkarzinom stagingrelevant [51]. Beim Zervixkarzinom gibt es Hinweise auf die prognostische Bedeutung der Unterscheidung zwischen Mikro- und Makrometastasen [19, 43].
Eine extrakapsuläre Ausbreitung von Lymphknotenmetastasen ist beim Vulvakarzinom bedeutsam für das Staging [51]. Für das Ovarial- und Zervixkarzinom scheint die extrakapsuläre Ausbreitung prognoserelevant zu sein [16, 19, 34].
Anforderungen an den histologischen Befundbericht bei Lymphonodektomiepräparaten sind ([9, 12, 18, 26, 27], Abb. 1; Tab. 2):
Angabe der Zahl der befallenen Lymphknoten im Verhältnis zur Zahl der entfernten/untersuchten Lymphknoten in Zuordnung zur Entnahmelokalisation (z. B. 4/13 inguinal links oder 0/15 inguinal links bzw. 7/22 iliacal extern rechts oder 0/17 paraaortal),
Angabe der größten Ausdehnung der größten Lymphknotenmetastase in mm/cm,
Angabe des Fehlens/Nachweises eines Kapseldurchbruches der Lymphknotenmetastase,
Angabe des Nachweises isolierter Tumorzellen im Lymphknoten.
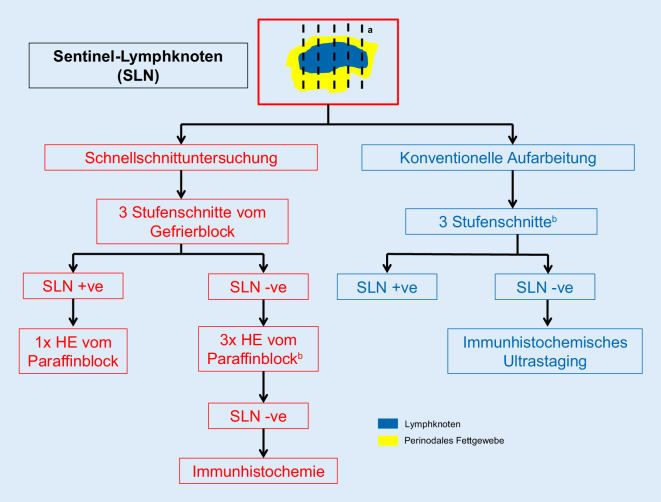
Aufarbeitung und Befundung von Sentinel-Lymphknoten (Abb. 3 und 4; Tab. 3)
| Vulva | Vagina | Zervix | Endometrium | Ovar | |
|---|---|---|---|---|---|
| 1) Einbettung | – Dreidimensionale Messung des resezierten Fettgewebes | ||||
| – Lamellieren und Palpieren des resezierten Fettgewebes zur Identifizierung von Lymphknoten | |||||
| – Untersuchung ALLER resezierten/identifizierten Lymphknoten | |||||
| – Lamellieren in 0,2-cm-Intervallen | |||||
| – Vollständige Einbettung dieser Lamellen (mehrere Lamellen in einem Block möglich) | |||||
| 2) Konventionelle Aufarbeitung | – Anfertigung von (mindestens) 3 HE-gefärbten Stufenschnitten vom Paraffinblock | ||||
| – Intervall zwischen den Schnittstufen ca. 200 µm | |||||
| 3) Intraoperative Schnellschnittuntersuchung | – Anfertigung von (mindestens) 3 HE-gefärbten Stufenschnitten vom Gefrierblock | ||||
| – weitere Aufarbeitung wie unter 2) beschrieben | |||||
| 4) Immunhistochemisches Ultrastaging (von in der HE-Färbung negativen Sentinel-Lymphknoten) | – 1 oder 2 Panzytokeratinantikörper (Zytokeratincocktails) | ||||
| – Ggf. Einsatz organspezifischerer Antikörper wie p16a, CK7b, HMB-45c, Melan Ac | |||||
HE Hämatoxylin-Eosin
aZu beachten ist, dass es p16-negative Karzinome gibt
bCK7 kann bei einem Teil der Endometriumkarzinome negativ sein
cEinsatz beim malignen Melanom der Vulva, ggf. auch bei vaginalen Schleimhautmelanomen
Konventionelle Aufarbeitung
Zur histopathologischen Untersuchung von Sentinel-Lymphknoten gynäkologischer Malignome gibt es derzeit kein einheitliches Protokoll [8, 9, 13, 17, 30]. Konsens besteht dahingehend, dass in jedem Fall ein Ultrastaging erfolgen soll [13, 17, 30]. Der Einsatz der Sentinel-Lymphknotentechnik beim Ovarialkarzinom steht derzeit am Anfang [10].
Aufgrund der Ergebnisse großer Studien sollen der/die klinisch identifizierten Lymphknoten vollständig eingebettet werden. Dabei ist es sinnvoll, diese in ca. 0,2 cm starke Scheiben zu lamellieren und komplett einzubetten [9, 13, 15, 32, 37, 46, 46, 50]. Dabei können mehrere Lamellen in einem Paraffinblock eingebettet werden. Von den Paraffinblöckchen sollen (mindestens) 3 HE-gefärbte Stufenschnitte jeweils in einem Abstand von ca. 200 µm angefertigt werden [9, 13, 14, 23, 26, 29, 32, 35, 36].
Infobox 3 Aufarbeitung von Sentinel-Lymphknoten gynäkologischer Malignome
Sentinel-Lymphknoten gynäkologischer Malignome sollen vollständig eingebettet und in Stufenschnitten untersucht werden. Zusätzlich sollen bei in der HE-Färbung karzinomfreien Sentinel-Lymphknoten immunhistochemische Untersuchungen durchgeführt werden (sog. Ultrastaging).
Lassen sich in den HE-gefärbten Schnittpräparaten keine Tumorzellen nachweisen, ist eine immunhistochemische Untersuchung mit einem (oder mehreren) Panzytokeratinantikörper(n) sinnvoll [13, 15, 26, 33, 35, 39, 48, 50]. Für Vulvakarzinome wird dieses Vorgehen bereits von der Leitlinie gefordert.
Die alleinige Verwendung eines Antikörpers gegen p16 beim Vulva‑, Vaginal- und Zervixkarzinom ist nicht sinnvoll, da aufgrund der unterschiedlichen Pathogenesewege nicht alle Karzinome dieser Lokalisationen HPV-positiv sind [1, 2, 38, 40, 44].
Der immunhistochemische Nachweis zytokeratinpositiver Strukturen ohne Kern innerhalb eines Sentinel-Lymphknotens beim Vulvakarzinom scheint keine biologische Relevanz zu besitzen [47], ist jedoch häufig mit einer lymphogenen Metastasierung assoziiert, sodass die entsprechenden Lymphknoten weiter mittels Stufenschnitten bzw. immunhistochemisch aufgearbeitet werden sollten.
Beim malignen Melanom erfolgt die immunhistochemische Untersuchung mit melanomspezifischen Markern [13].
Schnellschnittuntersuchung
Für die intraoperative Schnellschnittuntersuchung von Sentinel-Lymphknoten bei gynäkologischen Malignomen gibt es keine allgemeingültigen Richtlinien [24, 32, 48–50].
Die ESGO-Leitlinie zum Zervixkarzinom [9, 12] sowie die überarbeitete Version der S3-Leitlinie zum Zervixkarzinom, die auf die anderen Malignome extrapoliert werden kann, empfehlen (Tab. 3):
Makroskopische Aufarbeitung wie oben beschrieben.
Untersuchung aller Sentinel-Lymphknoten im Schnellschnitt.
Bei makroskopisch sichtbarem Tumor ist die intraoperative Untersuchung einer Probe des befallenen Lymphknotens ausreichend.
Makroskopisch unauffällige Lymphknoten sollen vollständig intraoperativ untersucht werden.
Von den Gefrierblöckchen sollen (3) Stufenschnitte angefertigt werden.
Die histologische Gefrierschnittuntersuchung kann durch eine intraoperative Imprintzytologie ergänzt werden.
Untersuchungen zum Sentinel-Lymphknoten bei gynäkologischen Malignomen geben verschiedene Aufarbeitungstechniken, einschließlich der Zahl und Anfertigung von Stufenschnitten an [9, 15, 23, 26, 32, 35, 36, 50]. In Analogie zur Aufarbeitung der Sentinel-Lymphknoten im Paraffinblock erscheint die Anfertigung von 3 Stufenschnitten vom Gefrierblock sinnvoll.
Bei im Schnellschnitt und in der anschließenden Paraffinaufarbeitung tumorfreien (Sentinel‑)Lymphknoten sollen die Aufarbeitung und das Ultrastaging wie oben beschrieben erfolgen.
Fazit für die Praxis
Die Definition von Mikrometastasen und isolierten Tumorzellen gynäkologischer Malignome ist von der UICC/TNM festgelegt.
Der Nachweis von Mikrometastasen und isolierten Tumorzellen soll im Befundbericht erwähnt werden und in die TNM-Klassifikation einfließen.
Alle übersandten Lymphknoten (LK) sollen untersucht werden mit vollständiger Einbettung aller LK bis 0,3 cm und Lamellierung aller größeren LK parallel zu ihrer kurzen Achse in ca. 0,2 cm dicken Scheiben.
Bestandteile des histologischen Befundberichtes sind: Zahl der befallenen LK im Verhältnis zur Zahl der entfernten/untersuchten LK, metrische Ausdehnung der größten LK-Metastase, Fehlen/Nachweis einer extrakapsulären Ausdehnung.
Zuschnitt und Einbettung aller Sentinel-LK wie beschrieben mit Anfertigung von (mindestens) 3 Stufenschnitten in einem Abstand von ca. 200 µm.
Bei in der HE-Färbung negativen Sentinel-LK erfolgt ein immunhistochemisches Ultrastaging.
Schnellschnittuntersuchung von Sentinel-LK: Zuschnitt und Einbettung wie beschrieben, Anfertigung von 3 Stufenschnitten vom Gefrierblock.
Funding
Open Access funding provided by Projekt DEAL.
Einhaltung ethischer Richtlinien
Interessenkonflikt
A.K. Höhn, C.E. Brambs, R. Erber, G.G.R. Hiller, D. Mayr, D. Schmidt, E. Schmoeckel und L.‑C. Horn geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Alemany L, Saunier M, Tinoco L, et al. Large contribution of human papillomavirus in vaginal neoplastic lesions: a worldwide study in 597 samples. Eur J Cancer. 2014;50(16):2846–2854. doi: 10.1016/j.ejca. [DOI] [PubMed] [Google Scholar]
- 2.Alonso I, Fusté V, del Pino M, Castillo P, Torné A, Fusté P, Rios J, Pahisa J, Balasch J, Ordi J. Does human papillomavirus infection imply a different prognosis in vulvar squamous cell carcinoma? Gynecol Oncol. 2011;122(3):509–514. doi: 10.1016/j.ygyno.2011.05.016. [DOI] [PubMed] [Google Scholar]
- 3.AWMF . S3-Leitlinie Diagnostik und Therapie des Zervixkarzinom. 2014. [Google Scholar]
- 4.AWMF (2015) S2k-Leitlinie Diagnostik, Therapie und Nachsorge des Vulvakarzinoms und seiner Vorstufen. https://www.awmf.org/uploads/tx_szleitlinien/015-059l_S2k_Vulvakarzinom_und_Vorstufen_Diagnostik_Therapie_2016-10.pdf. Zugegriffen: 3. Apr. 2020
- 5.AWMF (2018) Diagnostik, Therapie und Nachsorge des Vaginalkarzinoms und seiner Vorstufen. https://www.awmf.org/uploads/tx_szleitlinien/032-042l_S2k_Vaginalkarzinom-Vorstufen-Diagnostik-Therapie-Nachsorge_2018-11.pdf. Zugegriffen: 3. Apr. 2020
- 6.AWMF (2018) S3-Leitlinie Diagnostik, Therapie und Nachsorge der Patientinnen mit Endometriumkarzinom. https://www.awmf.org/uploads/tx_szleitlinien/032-034OLl_S3_Endometriumkarzinom-Diagnostik-Therpie-Nachsorge_2018-04.pdf. Zugegriffen: 3. Apr. 2020
- 7.AWMF (2019) S3-Leitlinie Diagnostik, Therapie und Nachsorge maligner Ovarialtumoren. S3-Leitlinie Diagnostik, Therapie und Nachsorge maligner Ovarialtumoren. https://www.awmf.org/leitlinien/detail/ll/032-035OL.html. Zugegriffen: 3. Apr. 2020
- 8.Cibula D, Oonk MHM, Abu-Rustum NR. Sentinel lymph node biopsy in the management of gynecologic cancer. Curr Opin Obstet Gynecol. 2015;27(1):66–72. doi: 10.1097/GCO.0000000000000133. [DOI] [PubMed] [Google Scholar]
- 9.Cibula D, Pötter R, Planchamp F, Avall-Lundqvist E, Fischerova D, Haie Meder C, Köhler C, Landoni F, Lax S, Lindegaard JC, Mahantshetty U, Mathevet P, McCluggage WG, McCormack M, Naik R, Nout R, Pignata S, Ponce J, Querleu D, Raspagliesi F, Rodolakis A, Tamussino K, Wimberger P, Raspollini MR. The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology Guidelines for the Management of Patients With Cervical Cancer. Int J Gynecol Cancer. 2018;28(4):641–655. doi: 10.1097/IGC.0000000000001216. [DOI] [PubMed] [Google Scholar]
- 10.Dell’Orto F, Laven P, Delle Marchette M, Lambrechts S, Kruitwagen R, Buda A. Feasibility of sentinel lymph node mapping of the ovary: a systematic review. Int J Gynecol Cancer. 2019;29(7):1209–1215. doi: 10.1136/ijgc-2019-000606. [DOI] [PubMed] [Google Scholar]
- 11.Dostalek L, Åvall-Lundqvist E, Creutzberg CL, Kurdiani D, Ponce J, Dostalkova I, Cibula D. ESGO survey on current practice in the management of cervical cancer. Int J Gynecol Cancer. 2018;28(6):1226–1231. doi: 10.1097/IGC.0000000000001314. [DOI] [PubMed] [Google Scholar]
- 12.ESGO (2018) Cervical cancer guidelines. https://guidelines.esgo.org/media/2018/04/Cervical-cancer-Guidelines-Complete-report.pdf. Zugegriffen: 3. Apr. 2020
- 13.Euscher ED, Malpica A. Gynaecological malignancies and sentinel lymph node mapping: an update. Histopathology. 2020;76(1):139–150. doi: 10.1111/his.14017. [DOI] [PubMed] [Google Scholar]
- 14.Hakam A, Nasir A, Raghuwanshi R, Smith PV, Crawley S, Kaiser HE, Grendys E, Fiorica JF. Value of multilevel sectioning for improved detection of micrometastases in sentinel lymph nodes in invasive squamous cell carcinoma of the vulva. Anticancer Res. 2004;24(2C):1281–1286. [PubMed] [Google Scholar]
- 15.Hauspy J, Beiner M, Harley I, Ehrlich L, Rasty G, Covens A. Sentinel lymph node in vulvar cancer. Cancer. 2007;110(5):1015–1023. doi: 10.1002/cncr.22874. [DOI] [PubMed] [Google Scholar]
- 16.Heublein S, Schulz H, Marmé F, Angele M, Czogalla B, Burges A, Mahner S, Mayr D, Jeschke U, Schmoeckel E. Extracapsular lymph node involvement in ovarian carcinoma. Cancers (Basel) 2019 doi: 10.3390/cancers11070924. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Holloway RW, Abu-Rustum NR, Backes FJ, Boggess JF, Gotlieb WH, Jeffrey Lowery W, Rossi EC, Tanner EJ, Wolsky RJ. Sentinel lymph node mapping and staging in endometrial cancer: a Society of Gynecologic Oncology literature review with consensus recommendations. Gynecol Oncol. 2017;146(2):405–415. doi: 10.1016/j.ygyno.2017.05.027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Horn L-C, Einenkel J, Höckel M, Kölbl H, Kommoss F, Lax SF, Riethdorf L, Schnürch H-G, Schmidt D. Pathologisch-anatomische Aufarbeitung und Befundung von Lymphknoten bei gynäkologischen Malignomen. Pathologe. 2005;26(4):266–272. doi: 10.1007/s00292-005-0764-3. [DOI] [PubMed] [Google Scholar]
- 19.Horn L-C, Hentschel B, Fischer U, Peter D, Bilek K. Detection of micrometastases in pelvic lymph nodes in patients with carcinoma of the cervix uteri using step sectioning: frequency, topographic distribution and prognostic impact. Gynecol Oncol. 2008;111(2):276–281. doi: 10.1016/j.ygyno.2008.07.017. [DOI] [PubMed] [Google Scholar]
- 20.Horn L-C, Hentschel B, Galle D, Bilek K. Extracapsular extension of pelvic lymph node metastases is of prognostic value in carcinoma of the cervix uteri. Gynecol Oncol. 2008;108(1):63–67. doi: 10.1016/j.ygyno.2007.08.086. [DOI] [PubMed] [Google Scholar]
- 21.Horn L-C, Kellner C, Scherling R, Höckel M, Einenkel J. Ultrastaging for micrometastases in para-aortic lymph nodes in patients with carcinoma of the uterine cervix. Gynecol Oncol. 2012;124(2):374–375. doi: 10.1016/j.ygyno.2011.10.004. [DOI] [PubMed] [Google Scholar]
- 22.Horn L-C, Brambs CE, Opitz S, Einenkel J, Mayr D. TNM-Klassifikation gynäkologischer Tumoren: Was bleibt über 2017 hinaus zu tun? Pathologe. 2019;40(1):73–79. doi: 10.1007/s00292-018-0559-y. [DOI] [PubMed] [Google Scholar]
- 23.Horn LC, Höhn AK. Processing and histopathological workup of hysterectomy specimens. In: Alkatout I, Mettler L, editors. Hysterectomy. A comprehensive surgical approach. Cham: Springer; 2018. pp. 259–295. [Google Scholar]
- 24.Kim CH, Soslow RA, Park KJ, Barber EL, Khoury-Collado F, Barlin JN, Sonoda Y, Hensley ML, Barakat RR, Abu-Rustum NR. Pathologic ultrastaging improves micrometastasis detection in sentinel lymph nodes during endometrial cancer staging. Int J Gynecol Cancer. 2013;23(5):964–970. doi: 10.1097/IGC.0b013e3182954da8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Knopp S, Nesland JM, Tropé C. SLNB and the importance of micrometastases in vulvar squamous cell carcinoma. Surg Oncol. 2008;17(3):219–225. doi: 10.1016/j.suronc.2008.05.001. [DOI] [PubMed] [Google Scholar]
- 26.Kurman RJ, Amin MB. Protocol for the examination of specimens from patients with carcinomas of the cervix: a basis for checklists. Cancer Committee, College of American Pathologists. Arch Pathol Lab Med. 1999;123(1):55–61. doi: 10.1043/0003-9985(1999)123. [DOI] [PubMed] [Google Scholar]
- 27.Lawrence WD. ADASP recommendations for processing and reporting of lymph node specimens submitted for evaluation of metastatic disease. Virchows Arch. 2001;439(5):601–603. doi: 10.1007/s004280100412. [DOI] [PubMed] [Google Scholar]
- 28.Lee YS, Rhim CC, Lee HN, Lee KH, Park JS, Namkoong SE. HPV status in sentinel nodes might be a prognostic factor in cervical cancer. Gynecol Oncol. 2007;105(2):351–357. doi: 10.1016/j.ygyno.2006.12.016. [DOI] [PubMed] [Google Scholar]
- 29.Leys CM, Hartenbach EM, Hafez GR, Mahvi DM. Screening for occult nodal metastasis in squamous cell carcinoma of the vulva. Int J Gynecol Pathol. 2000;19(3):243–247. doi: 10.1097/00004347-200007000-00008. [DOI] [PubMed] [Google Scholar]
- 30.Malpica A, Euscher ED, Hecht JL, Ali-Fehmi R, Quick CM, Singh N, Horn L-C, Alvarado-Cabrero I, Matias-Guiu X, Hirschowitz L, Duggan M, Ordi J, Parkash V, Mikami Y, Ruhul Quddus M, Zaino R, Staebler A, Zaloudek C, McCluggage WG, Oliva E. Endometrial carcinoma, grossing and processing issues: recommendations of the International Society of Gynecologic Pathologists. Int J Gynecol Pathol. 2019;38(Suppl 1):S9–S24. doi: 10.1097/PGP.0000000000000552. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Martínez A, Mery E, Ferron G, Querleu D. Incidence of micrometastases in histologically negative para-aortic lymph nodes in advanced cervical cancer patients. Gynecol Oncol. 2010;119(1):76–80. doi: 10.1016/j.ygyno.2010.06.016. [DOI] [PubMed] [Google Scholar]
- 32.McCluggage WG, Judge MJ, Alvarado-Cabrero I, Duggan MA, Horn L-C, Hui P, Ordi J, Otis CN, Park KJ, Plante M, Stewart CJR, Wiredu EK, Rous B, Hirschowitz L. Data set for the reporting of carcinomas of the cervix: recommendations from the International Collaboration on Cancer Reporting (ICCR) Int J Gynecol Pathol. 2018;37(3):205–228. doi: 10.1097/PGP.0000000000000412. [DOI] [PubMed] [Google Scholar]
- 33.Meads C, Sutton AJ, Rosenthal AN, Małysiak S, Kowalska M, Zapalska A, Rogozińska E, Baldwin P, Ganesan R, Borowiack E, Barton P, Roberts T, Khan K, Sundar S. Sentinel lymph node biopsy in vulval cancer: systematic review and meta-analysis. Br J Cancer. 2014;110(12):2837–2846. doi: 10.1038/bjc.2014.205. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Metindir J, Bilir Dilek G. Evaluation of prognostic significance in extracapsular spread of pelvic lymph node metastasis in patients with cervical cancer. Eur J Gynaecol Oncol. 2008;29(5):476–478. [PubMed] [Google Scholar]
- 35.Moore RG, Granai CO, Gajewski W, Gordinier M, Steinhoff MM. Pathologic evaluation of inguinal sentinel lymph nodes in vulvar cancer patients: a comparison of immunohistochemical staining versus ultrastaging with hematoxylin and eosin staining. Gynecol Oncol. 2003;91(2):378–382. doi: 10.1016/j.ygyno.2003.07.006. [DOI] [PubMed] [Google Scholar]
- 36.Oonk MH, van Hemel BM, Hollema H, de Hullu JA, Ansink AC, Vergote I, Verheijen RH, Maggioni A, Gaarenstroom KN, Baldwin PJ, van Dorst EB, van der Velden J, Hermans RH, van der Putten HW, Drouin P, Runnebaum IB, Sluiter WJ, van der Zee AG. Size of sentinel-node metastasis and chances of non-sentinel-node involvement and survival in early stage vulvar cancer: results from GROINSS-V, a multicentre observational study. Lancet Oncol. 2010;11(7):646–652. doi: 10.1016/S1470-2045(10)70104-2. [DOI] [PubMed] [Google Scholar]
- 37.Rasty G, Hauspy J, Bandarchi B. Assessment of sentinel lymph node in cervical cancer: review of literature. J Clin Pathol. 2009;62(12):1062–1065. doi: 10.1136/jcp.2007.054031. [DOI] [PubMed] [Google Scholar]
- 38.Reuschenbach M, Roos J, Panayotopoulos D, Baldus SE, Schnürch H-G, Berger A, Petry KU, Dürst M, Seiz M, von Knebel Doeberitz M, Hampl M. Characterization of squamous cell cancers of the vulvar anterior fourchette by human papillomavirus, p16INK4a, and p53. J Low Genit Tract Dis. 2013;17(3):289–297. doi: 10.1097/LGT.0b013e31826f2b2b. [DOI] [PubMed] [Google Scholar]
- 39.Roy M, Bouchard-Fortier G, Popa I, Grégoire J, Renaud M-C, Têtu B, Plante M. Value of sentinel node mapping in cancer of the cervix. Gynecol Oncol. 2011;122(2):269–274. doi: 10.1016/j.ygyno.2011.04.002. [DOI] [PubMed] [Google Scholar]
- 40.Singh N, Gilks CB. The changing landscape of gynaecological cancer diagnosis: implications for histopathological practice in the 21st century. Histopathology. 2017;70(1):56–69. doi: 10.1111/his.13080. [DOI] [PubMed] [Google Scholar]
- 41.Singletary SE, Greene FL, Sobin LH. Classification of isolated tumor cells: clarification of the 6th edition of the American Joint Committee on Cancer Staging Manual. Cancer. 2003;98(12):2740–2741. doi: 10.1002/cncr.11865. [DOI] [PubMed] [Google Scholar]
- 42.St Clair CM, Eriksson AGZ, Ducie JA, Jewell EL, Alektiar KM, Hensley ML, Soslow RA, Abu-Rustum NR, Leitao MM. Low-volume lymph node metastasis discovered during sentinel lymph node mapping for endometrial carcinoma. Ann Surg Oncol. 2016;23(5):1653–1659. doi: 10.1245/s10434-015-5040-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Stany MP, Stone PJB, Felix JC, Amezcua CA, Groshen S, Ye W, Kyser KL, Howard RS, Zahn CM, Muderspach LI, Lentz SE, Chernofsky MR. Lymph node micrometastases in early-stage cervical cancer are not predictive of survival. Int J Gynecol Pathol. 2015;34(4):379–384. doi: 10.1097/PGP.0000000000000188. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Stolnicu S, Barsan I, Hoang L, Patel P, Terinte C, Pesci A, Aviel-Ronen S, Kiyokawa T, Alvarado-Cabrero I, Oliva E, Park KJ, Abu-Rustum NR, Pike MC, Soslow RA. Stromal invasion pattern identifies patients at lowest risk of lymph node metastasis in HPV-associated endocervical adenocarcinomas, but is irrelevant in adenocarcinomas unassociated with HPV. Gynecol Oncol. 2018;150(1):56–60. doi: 10.1016/j.ygyno.2018.04.570. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Tan J, Chetty N, Kondalsamy-Chennakesavan S, Crandon A, Garrett A, Land R, Nascimento M, Nicklin J, Perrin L, Obermair A. Validation of the FIGO 2009 staging system for carcinoma of the vulva. Int J Gynecol Cancer. 2012;22(3):498–502. doi: 10.1097/IGC.0b013e318241d994. [DOI] [PubMed] [Google Scholar]
- 46.Hirschowitz et al. The Royal College of Pathologists (2015) Tissue pathways for gynaecological pathology. https://www.rcpath.org/uploads/assets/94763195-0982-40ed-bbc79ca92370e9ac/Tissue-pathways-for-gynaecological-pathology-January-2015.pdf. Zugegriffen: 3. Apr. 2020
- 47.Tjin Asjoe FM, van Bekkum E, Ewing P, Burger CW, Ansink AC. Sentinel node procedure in vulvar squamous cell carcinoma: a histomorphologic review of 32 cases. The significance of anucleate structures on immunohistochemistry. Int J Gynecol Cancer. 2008;18(5):1032–1036. doi: 10.1111/j.1525-1438.2007.01152.x. [DOI] [PubMed] [Google Scholar]
- 48.Todo Y, Kato H, Okamoto K, Minobe S, Yamashiro K, Sakuragi N. Isolated tumor cells and micrometastases in regional lymph nodes in stage I to II endometrial cancer. J Gynecol Oncol. 2016;27(1):e1. doi: 10.3802/jgo.2016.27.e1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Touboul C, Bentivegna E, Uzan C, Gouy S, Pautier P, Lhommé C, Duvillard P, Haie-Meder C, Morice P. Sentinel lymph node in endometrial cancer: a review. Curr Oncol Rep. 2013;15(6):559–565. doi: 10.1007/s11912-013-0345-1. [DOI] [PubMed] [Google Scholar]
- 50.Vercellino GF, Erdemoglu E, Lichtenberg P, Muallem MZ, Richter R, Abu-Rustum NR, Plante M, Lécuru F, Greggi S, Monk BJ, Sagae S, Denkert C, Keller M, Alhakeem M, Hellriegel M, Dückelmann AM, Chiantera V, Sehouli J. A GCIG international survey: clinical practice patterns of sentinel lymph node biopsies in cervical cancer. Arch Gynecol Obstet. 2019;300(1):191–199. doi: 10.1007/s00404-019-05164-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Wittekind C, editor. TNM – Klassifikation maligner Tumoren. Weinheim: Wiley-VCH; 2017. [Google Scholar]