Abstract
La tuberculosis (TB) era la primera causa de mortalidad infecciosa mundial hasta la pandemia de COVID-19. Afecta sobre todo a los países en vías de desarrollo (PVD), mientras que la diabetes mellitus (DM) es una de las enfermedades crónicas más prevalentes.
En esta revisión se objetiva que la DM constituye actualmente un importante factor de riesgo para desarrollar TB, presentando además TB más complicadas, más recaídas y mayor letalidad. Los PVD y el cuarto mundo de las grandes ciudades son los que presentan mayor incidencia de TB y un incremento de la DM, lo que dificultará el control de la enfermedad tuberculosa. Paralelamente, la pandemia por COVID-19 está complicando el manejo de ambas enfermedades por la dificultad de acceso al control y tratamiento y por el empeoramiento de desigualdades socioeconómicas. Es necesario establecer un cribado bidireccional de TB y DM e impulsar recomendaciones para el manejo conjunto de ambas enfermedades.
Palabras clave: Tuberculosis, Diabetes, Incidencia, Factores de riesgo, Progresión
Abstract
Tuberculosis (TB) is the leading cause of infectious mortality in the world, affecting mainly developing countries (DC), while diabetes (DM) is one of the most prevalent chronic diseases.
This review analyzes the fact that diabetes is currently an important risk factor for developing TB, also presenting more complicated TB, more relapses and higher mortality. The DCs and the fourth world of the large cities are those with the highest incidence of TB and an increase in DM, which will make it difficult to control tuberculosis disease. At the same time, the COVID-19 pandemic is complicating the management of both diseases due to the difficulty of access to control and treatment and the worsening of socioeconomic inequalities. It is necessary to establish a bidirectional screening for TB and DM and promote recommendations for the joint management of both diseases.
Keywords: Tuberculosis, Diabetes, Incidence, Risk factors, Progression
Introducción
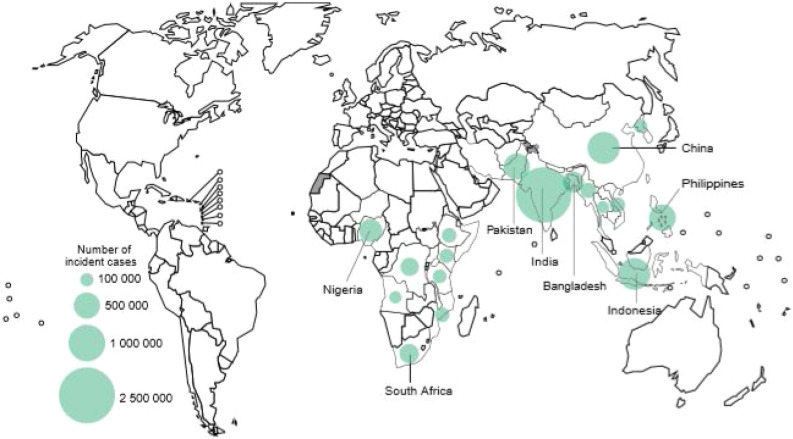
La tuberculosis (TB) es una enfermedad presente en el mundo desde el paleolítico, hace 75 mil años1. Constituye la primera causa de mortalidad por enfermedad infecciosa en el mundo, por encima del VIH, aunque en el 2020 puede ser superada por la COVID-192. Afecta especialmente a los países más pobres y a las zonas más desfavorecidas de los países desarrollados. La OMS estima que en 2018 un total de 10 millones de personas desarrollaron esta enfermedad, que causó 1.200.000 muertes, más otras 250.000 en personas VIH positivas3. Se calcula que dos tercios de los casos de TB a nivel mundial se concentran en ocho países: India (28%), China (9%), Indonesia (8%), Filipinas (6%), Pakistán (6%), Nigeria (4%), Bangladesh (4%) y Sudáfrica (3%) (fig. 1 ). En España, la tasa de incidencia de casos notificados en España en el año 2019 fue de solo 9,4 casos por 100.000 habitantes3, aunque existe un subregistro importante4, 5.
Figura 1.
Incidencia estimada de TB en 2018, para países con al menos 100.000 casos incidentes. Fuente: Global Tuberculosis Report 2019. Geneva: World Health Organization; 2019. Licence: CC BY-NC-SA 3.0 IGO. Disponible en: https://www.who.int/tb/publications/global_report/en/.
En un primer momento, Mycobacterium tuberculosis, el agente etiológico de la TB, produce infección tuberculosa latente (ITL) y solo una pequeña proporción de estos pacientes (5-10%) desarrollarán la enfermedad a lo largo de su vida. La OMS considera que los principales factores de riesgo para ello son la malnutrición, la infección por VIH, el alcoholismo, el tabaquismo y la diabetes3. También podrían influir otras enfermedades o tratamientos inmunodepresores y la edad avanzada.
A lo largo de los últimos años, los movimientos migratorios desde países con bajos ingresos y altas cargas de TB hacia países desarrollados han cambiado el patrón epidemiológico de la enfermedad en los países receptores, principalmente en áreas urbanas desfavorecidas de las grandes ciudades, donde el flujo migratorio es más intenso6.
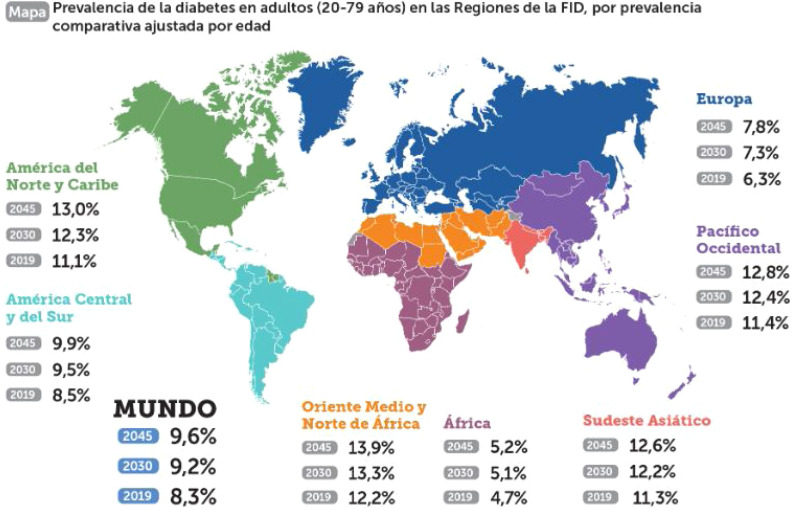
En cuanto a la diabetes mellitus (DM), se trata de una de las enfermedades crónicas más prevalentes también en nuestro entorno. En un estudio poblacional (di@bet.es) realizado en España en 2012, se observó que la prevalencia registrada de DM se situaba en torno al 13,8% de la población mayor de 18 años, con un 43,5% de casos no conocidos (prevalencia DM ignorada del 6%)7. Actualmente se estima en España una incidencia anual de 11,6 casos por cada 1.000 personas-año8. Gracias al uso de grandes bases de datos obtenidas de la práctica médica habitual, cada vez es más preciso el estudio epidemiológico de esta enfermedad metabólica9. Según el Atlas de la Federación Internacional de Diabetes (2019)10, unos 463 millones de personas en el mundo padecen esta enfermedad. La prevalencia mundial se calcula en un 9,3% en adultos entre 20 y 79 años (fig. 2 ). El impacto de la DM es muy variable en el mundo y depende de factores como la capacidad diagnóstica, la herencia genética, los estilos de vida y la calidad de la atención sanitaria que reciben las personas afectadas, siempre inferior en los países de bajos ingresos.
Figura 2.
Prevalencia de la diabetes en adultos (20-79 años) en las regiones de la Federación Internacional de la Diabetes, por prevalencia comparativa ajustada por edad. International Diabetes Federation. IDF Diabetes Atlas, 9th ed. Brussels, Belgium: International Diabetes Federation, 2019. Disponible en http://www.diabetesatlas.org.
Son los países con ingresos medios y bajos los que asumen un 80% de la carga global de DM (infradiagnóstico, menor acceso a tratamientos, mayor número de complicaciones y mortalidad). De hecho, es en estos países ubicados sobre todo en Oriente Medio, Este del Pacífico, Sudeste Asiático y África, donde se prevé un mayor aumento de los casos de DM en los próximos años. Las zonas de América del Norte, México y Caribe presentan una prevalencia del 11,1%, dos puntos por encima de la media mundial, y se prevé que aumente hasta el 13% en 204510. Este aumento sería consecuencia de los progresivos cambios en el estilo de vida y la globalización, que estarían comportando un mayor consumo de dietas poco adecuadas en estas poblaciones. También podría influir un progresivo mayor acceso al diagnóstico de DM y al aumento de la esperanza de vida. En consecuencia, se estima que la incidencia global de DM seguirá aumentando, siendo la previsión para 2030 de 578 millones de afectados (un 10,2% de la población mundial), incidiendo directamente en el aumento de la morbimortalidad de esta población10.
En esta revisión, se consideran las relaciones entre la TB y la DM, asumiendo que ambas enfermedades constituyen una sindemia, la cual está siendo complicada por la pandemia de COVID-19. También se aportan algunas recomendaciones para un mejor control clínico-epidemiológico.
Mecanismos inmunológicos en la infección por Mycobacterium tuberculosis y su alteración en el caso de la diabetes mellitus
Ante la evidencia de que la DM es un factor de riesgo para TB, se ha estudiado en modelos animales cómo la hiperglicemia podría influir en la respuesta inmunitaria frente a M. tuberculosis, aunque a día de hoy no existe una explicación definitiva.
En ratones en los que se había inducido hiperglicemia, se observó un retraso en la respuesta innata a nivel de los macrófagos alveolares, los cuales, además, tendrían unas funciones fagocíticas y antimicrobianas deficitarias contra las micobacterias11. Además, habría un retraso en el reclutamiento de células mieloides al lugar de la infección, ya que la hiperglicemia conllevaría un defecto en la expresión de receptores relacionados con la presentación antigénica y la activación de linfocitos T. La micobacteria tardaría más en ser presentada en los ganglios linfáticos, se demoraría también la activación de los linfocitos T antígeno-específicos, su proliferación y su migración al lugar de infección, pues la quimiotaxis también se vería alterada. Se alteraría, también, la función de los neutrófilos, tanto su migración al lugar donde deberían actuar, como su actividad bactericida y su función de ataque. También habría una menor producción inicial de citoquinas y de INF-?. Este retraso generalizado permitiría que los bacilos puedan replicarse durante más días11.
En resumen, en los pacientes diabéticos, la hiperglicemia alteraría la activación celular, la capacidad fagocítica y los mecanismos microbicidas, la transmigración de los leucocitos y la quimiotaxis, y habría un retraso en la presentación antigénica. Paralelamente, habría una multiplicación constante de bacilos12. En estos modelos animales se ha podido ver que, una vez esta respuesta inmune adaptativa se desarrolla, lo hace en un ambiente más proinflamatorio, donde se han generado un gran número de citoquinas inflamatorias y donde existe ya una elevada carga bacteriana, más difícil de contener11.
La diabetes como factor de riesgo para la infección tuberculosa
En dos ciudades con programas de control de la TB que recogen desde hace años los factores de riesgo asociados con esta infección, se ha observado que la DM tiene una importancia creciente a medida que algunos de los otros factores de riesgo están más controlados (VIH, drogadicción). Así, en Barcelona en 2017, con una incidencia de 16,5/100.000, el 8,6% de los 265 pacientes detectados tenían DM, mientras que la infección por VIH solo alcanzaba el 7,9%. En New York, el impacto de la DM en la TB es aún más importante, ya que en 2019, con una incidencia de TB de 6,9/100.000, presentaban DM el 23% de los 566 pacientes detectados, mientras que la infección por VIH ya solo la presentaban el 6%13, 14.
Las personas con DM tienen un mayor riesgo de presentar distintos tipos de infecciones, destacando las urinarias, las mucocutáneas y las del tracto respiratorio inferior15, incluida la TB16. De hecho, la OMS considera a la DM como uno de los principales factores de riesgo para TB3, ya que múltiples estudios han mostrado que, entre un 5 y un 30% de los pacientes con TB presentan concomitantemente una DM desarrollada años antes17. En cuanto a la incidencia de TB, se triplicaría en los diabéticos en relación con los que no lo son18. En un estudio de cohortes realizado en el distrito más deprimido de Barcelona, se objetivó un riesgo superior de presentar TB en los pacientes diabéticos frente a los no diabéticos (HR 1,77; IC: 1,09-2,86) y especialmente en los pacientes de origen indostaní19.
Se considera que la prevalencia de ITL es aproximadamente el doble en los pacientes con DM respecto de los no la tienen20, 21. Un estudio reciente estima una prevalencia algo inferior, 1,59 veces mayor en diabéticos de áreas de alta incidencia de TB22. En un metaanálisis, se objetivó asociación entre DM e ITL, aunque con una asociación epidemiológica débil (OR = 1,18; 1,06-1,30)23. La prevalencia de ITL en pacientes diabéticos era mayor en aquellos que presentaban un peor control glicémico, con hemoglobinas glucosiladas superiores al 7%24.
Por otra parte, los pacientes con DM tendrían una presentación clínica más grave25. Se ha objetivado que los pacientes diagnosticados de TB y con antecedente de DM presentaban más formas cavitadas en las radiografías de tórax, más efectos adversos a los fármacos antituberculosos y mayor necesidad de ingreso al momento del diagnóstico26. Las pautas de tratamiento indicadas en los pacientes que presentan ambas patologías no difieren de las indicadas en pacientes no diabéticos27, a pesar de la dificultad para el correcto manejo de esta situación.
Así mismo, los pacientes con DM tendrían un mayor riesgo de recaída tras el tratamiento antituberculoso, un metaanálisis realizado en 2011 habla de una probabilidad hasta cuatro veces mayor28, mientras que otro estudio más reciente estimaría este riesgo en 1,6429. Parece que en pacientes diabéticos, el riesgo de que los cultivos de esputo permanezcan positivos a los dos o tres meses del inicio del tratamiento sería aproximadamente el doble. Probablemente, un mayor fracaso en el tratamiento antituberculoso, el retraso en la negativización del cultivo y una mayor tasa de recaída se traducirían en una mayor infecciosidad: un aumento de la transmisión secundaria y una mayor incidencia de TB28, 29.
Se ha objetivado también un riesgo dos veces superior de TB multirresistente entre los pacientes diabéticos29, 30 y de presentar reacciones adversas graves al complicado tratamiento de la TB multirresistente31.
Tal y como sucede con las complicaciones crónicas de la enfermedad, muy probablemente el control glicémico de los pacientes diabéticos con TB influye directamente en el pronóstico de esta infección. Se ha visto que los pacientes con DM y TB tienen un peor control glicémico32, en cambio, un buen control metabólico mejoraría el funcionamiento de su sistema inmunitario y contribuiría a una mejor respuesta al tratamiento administrado33. De hecho, un estudio reciente define que una hemoglobina glucosilada igual o superior a 7% sería factor de riesgo para el desarrollo de resistencia a isoniacida y multidrogorresistencia en pacientes con DM y TB34.
En un estudio sobre la mortalidad a largo plazo de los pacientes que habían presentado TB, se asoció la DM a una menor supervivencia a cinco años35. En otro estudio se ha objetivado que los pacientes que presentan simultáneamente DM y TB tendrían un riesgo 1,88 veces mayor de mortalidad29.
La tuberculosis como factor de riesgo para la diabetes
Se ha descrito una hiperglicemia transitoria al inicio del diagnóstico de una TB que se relacionaría con un mayor riesgo de progresión a DM en algunos individuos. Probablemente se explicaría por la inflamación inducida por la propia infección (respuesta fisiológica de estrés ante una infección27 y también por el efecto hiperglicemiante de algunos fármacos antituberculosos como la isoniacida36, sobre todo en caso de intoxicación37, o por la interacción de estos con los antidiabéticos orales, como el caso de la rifampicina con las sulfonilureas y biguanidas, reduciendo sus niveles plasmáticos y dificultando el control glicémico27). Por ello, en pacientes con TB algunos autores plantean un tratamiento de la hiperglicemia preferiblemente con insulina para evitar interacciones farmacológicas27.
Algunos artículos hablan de que incluso la propia TB podría ser un factor que permitiría identificar a pacientes con mayor propensión a alteraciones metabólicas futuras38. Por otra parte, la propia TB puede causar pancreatitis tuberculosa, siendo la hipofunción endocrina del páncreas la causante de la hiperglicemia27.
En otro estudio realizado en Taiwán, se objetivó una incidencia mayor a la esperada de DM, ictus e infarto de miocardio en pacientes con antecedente de TB, sobre todo en los que habían realizado un tratamiento más prolongado39. En un metaanálisis reciente, la prevalencia media de DM entre las personas que habían presentado TB era del 15,3%, cuando la prevalencia en población general se situaba en el 8,8%. Así, se vio que la prevalencia de DM en los pacientes con TB en cada región estudiada era aproximadamente el doble respecto de la prevalencia local, exceptuando Centroamérica y Europa, donde la diferencia no era tan acusada40. En consecuencia, sería conveniente confirmar los nuevos diagnósticos de DM en este contexto, una vez resuelta la TB41, ya que la TB se configura como un posible factor de riesgo para la DM.
El impacto de la pandemia de COVID-19 en la diabetes y en la tuberculosis
El sistema sanitario se ha visto ampliamente superado por la pandemia de COVID-19 en todo el mundo. Según un comunicado de la OMS realizado a partir de encuestas a 163 países, se estima que la atención a enfermedades no transmisibles se ha visto especialmente afectada, y en el caso de la DM, un 49% de los países encuestados ha visto reducido el acceso al tratamiento de esta enfermedad y aumentadas las complicaciones secundarias a esta. Por otra parte, la pandemia está agravando las situaciones de desigualdad socioeconómica, hecho que afecta directamente a la evolución de enfermedades crónicas como la DM42.
En el caso de la COVID-19, en algunos estudios ya se ha descrito la DM como una de las comorbilidades más frecuentes en los pacientes infectados y atendidos en hospitales43, 44, aunque no parece que la prevalencia de esta enfermedad entre los pacientes con COVID-19 sea superior a la de la población general. Sin embargo, sí que presentarían una peor evolución, con más complicaciones y hasta triplicando la letalidad de los no diabéticos45. Según un estudio realizado en Wuhan (China), un mayor riesgo de coagulopatía en los pacientes con DM se asociaría a esta mayor letalidad46. Por lo tanto, la DM sería un predictor de morbimortalidad en pacientes con COVID-1947.
También la TB ha sido señalada como posible factor de riesgo de severidad para la COVID-1948. De hecho, asumiendo la mayor probabilidad de mala evolución en el caso de desarrollarse ambas infecciones de forma concomitante, en países de elevada incidencia de TB, como sería India, y dado que los síntomas iniciales pueden coincidir (si bien en el caso de la COVID-19 se desarrollarían con más rapidez), se propone testar a los pacientes con COVID-19 para descartar TB, y viceversa, sobre todo en caso de mala respuesta al tratamiento, deterioro importante o síntomas atípicos49.
Debido a la extraordinaria pandemia de COVID-19, se calcula que a escala mundial la detección de nuevos casos de TB se habría reducido en un 25% si se compara con el nivel de detección previo a la pandemia. Como consecuencia, se estiman unas 190.000 muertes por TB adicionales, es decir, un incremento del 13%. Si esta predicción se cumple supondría un atraso en la lucha contra la TB, situándonos en valores similares al año 2015. La OMS considera que los centros de vigilancia y tratamiento de TB tendrían que ser considerados como esenciales y mantenerse activos de forma prioritaria durante la pandemia50.
Cribados y controles en los pacientes con diabetes y/o tuberculosis
Tal como se ha descrito en esta revisión, DM y TB se comportan como una sindemia, es decir, una confluencia de dos enfermedades de alta prevalencia que actúan de forma sinérgica51. Por lo tanto, su prevención y control no deben realizarse de forma aislada. Es necesario un cribado bidireccional de ambas enfermedades, de acuerdo con diversos estudios y también con la iniciativa de la OMS «Collaborative framework for care and control of tuberculosis and diabetes» 52. Se considera que un mejor manejo de la DM ayudaría a controlar la carga de TB, especialmente en regiones con alta incidencia de esta infección, y viceversa, por lo que se debería valorar también llevar a cabo un abordaje en estas zonas de un factor clave como es la dieta.
Lee et al.23, al detectar mayor incidencia de ITL en pacientes diabéticos, sugirieron que estos datos serán útiles para futuros estudios de coste-efectividad, para analizar el impacto del cribado de ITL en los pacientes diabéticos. No obstante, el cribado de ITL en paciente con DM se basaría en pruebas de QuantiFERON o de tuberculina y RX al menos en los positivos a una de las dos pruebas citadas. Ello tiene un coste asumible, implicaría prescribir tratamientos de ITL, lo que evitaría casos de TB, o detectaría directamente algunos casos de TB que se beneficiarían de un diagnóstico y tratamientos tempranos. Esta estrategia también permitiría avanzar el estudio de contactos de los casos de TB, lo que también sería positivo.
Para los pacientes que presenten ambas enfermedades, se recomienda mantener un buen control glicémico, reduciendo así las posibilidades de una mala evolución tanto de la TB como de la DM. El abordaje conjunto de ambas patologías representa un desafío clínico. Es prioritaria la instauración de un tratamiento antituberculoso correcto y asegurar su cumplimiento. También, y especialmente cuando ambas enfermedades se presentan a la vez, deben controlarse los factores de riesgo cardiovascular53. Este control se fundamenta en que las principales causas de mortalidad en pacientes diabéticos son las enfermedades cardiovasculares y en que los pacientes con TB presentan también un mayor riesgo de presentar un síndrome coronario agudo54, 55.
Son necesarios más estudios que, desde un punto de vista clínico y epidemiológico, nos ayuden a conocer mejor el impacto de la DM y de sus factores asociados en la evolución de la TB, y que permitan determinar también las intervenciones más coste-efectivas en el abordaje de las dos patologías29, y del tipo Real World Data, que ayuden a esclarecer la interacción potencial entre ambas entidades, e implementar así, su prevención y control37.
Conclusiones: DM y TB, una relación bidireccional
Ya hay fuerte evidencia de que la DM es un factor de riesgo para TB, a pesar de que los mecanismos fisiopatológicos están todavía por clarificar. Se plantea también que la TB puede favorecer la presentación de DM en algunos pacientes. Además, numerosos estudios objetivan que en los pacientes que presentan ambas enfermedades, la evolución de la TB es más tórpida27.
Tanto la DM como la TB son dos de los principales objetivos de control de la OMS. La TB ocasiona todavía la mayor mortalidad por un agente infeccioso a escala mundial, al menos hasta la aparición de la pandemia por COVID-19, y la DM presenta elevada prevalencia y un mayor crecimiento en los países donde la carga de TB es mayor. En consecuencia, la prevención y el control de ambas enfermedades es una cuestión prioritaria a nivel de salud pública global.
La pandemia de COVID-19 está complicando enormemente la atención sanitaria a escala mundial. Todos los pacientes, tengan la patología que tengan, están sufriendo importantes retrasos en la atención sanitaria, hecho ya perfectamente objetivado en la TB56, 57 y en la DM58, lo que complica la historia natural de ambas enfermedades.
Recomendaciones para la prevención y el control de la DM y la TB en la era COVID-19
En los pacientes con TB conviene llevar a cabo un control estricto de la glicemia, aprovechando los controles analíticos (en el momento del diagnóstico y en los meses 1, 2, 4 y 6 de tratamiento en los pacientes con pauta de tratamiento de seis meses59), con el objetivo de descartar hiperglicemias o un debut de DM, y alargando este seguimiento a posteriori, para diagnosticar de forma precoz una posible incidencia de DM en los pacientes que presenten hiperglicemia mantenida.
En pacientes con DM debe cribarse la ITL y la TB, ya que son pacientes que se podrían beneficiar de un tratamiento temprano de la ITL o de la TB.
En los pacientes con TB y/o DM debe descartarse la infección por SARS-CoV-2, ya que esta infección complicaría la evolución de estas enfermedades. Por este motivo, estos pacientes deberían constituir un grupo prioritario para la vacunación frente a COVID-19.
Financiación
El presente trabajo ha sido financiado parcialmente por una beca FIS del Instituto de Salud Carlos III (fondos Feder, ISCIII, expediente número PI16/01751), y por una beca otorgada por el IDIAP Jordi Gol i Gurina (Institut Català de la Salut, PREDOC_ECO-19/2).
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Al grupo de trabajo del proyecto de investigación en DM y TB, formado por profesionales del IDIAP (Institut Universitari per a la Recerca a l’Atenció Primària de Salut) Jordi Gol i Gurina, BASIQ y al Servicio de Epidemiología de la Agència de Salut Pública de Barcelona.
Footnotes
En representación del grupo de trabajo del proyecto FIS PI16/01751. Este grupo está integrado por: Joan A. Caylà, Jose Luis del Val, Antonio Moreno, Àngels Orcau, Susana García, Josep Franch y Manel Mata.
Bibliografía
- 1.Cardona P.J., Català M., Prats C. Origin of tuberculosis in the Paleolithic predicts unprecedented population growth and female resistance. Sci Rep. 2020;10:1–20. doi: 10.1038/s41598-019-56769-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Johns Hopkins University & Medicine [Internet]. Coronavirus Resource Center. [consultado 13 Ene 2021] Disponible en: https://coronavirus.jhu.edu/
- 3.WHO Global Tuberculosis Report 2019. 2019 [consultado 15 Dic 2020]. Disponible en: https://www.who.int/teams/global-tuberculosis-programme/tb-reports. [Google Scholar]
- 4.Gimenez-Duran J., Galmes-Truyols A., Gonzalez-Cortijo T., Portell-Arbona M., Bosch-Isabel C., Vanrell-Berga J.M., et al. Capture-recapture and anti-tuberculosis drug prescriptions, Balearic Islands Spain, 2010-2012. Int J Tuberc Lung Dis. 2018;22:754–759. doi: 10.5588/ijtld.17.0303. [DOI] [PubMed] [Google Scholar]
- 5.Morales-García C., Rodrigo T., García-Clemente M.M., Muñoz A., Bermúdez P., Casas F., et al. Factors associated with unreported tuberculosis cases in Spanish hospitals. BMC Infect Dis. 2015;15:4–11. doi: 10.1186/s12879-015-1047-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Khan K., Hirji M., Miniota J., Hu W., Wang J., Gardam M., et al. Domestic impact of tuberculosis screening among new immigrants to Ontario Canada. CMAJ. 2018;187:473–481. doi: 10.1503/cmaj.150011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Soriguer F., Goday A., Bosch-Comas, Bordiú E., Calle-Pascual A., Carmena R., et al. Prevalence of diabetes mellitus and impaired glucose regulation in Spain: the Di@bet.es Study. Diabetologia. 2011;55:88–93. doi: 10.1157/13126836. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Rojo-Martínez G., Valdés S., Soriguer F., Vendrell J., Urrutia I., Pérez V., et al. Incidence of diabetes mellitus in Spain as results of the nation-wide cohort di@bet.es study. Sci Rep. 2020;10:1–9. doi: 10.1038/s41598-020-59643-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Franch Nadal J., Mata Cases M., Mauricio Puente D. Epidemiología y control clínico de la diabetes mellitus tipo 2 y sus comorbilidades en España (estudio e-Control) Med Clin (Barc). 2016;147(Supl 1):1–7. doi: 10.1016/S0025-7753(17)30618-8. [DOI] [PubMed] [Google Scholar]
- 10.Internationational Diabetes Federation . 9 th edn. International Diabetes Federation; Brussels, Belgium: 2019. IDF Diabetes Atlas. http://www.diabetesatlas.org. [Google Scholar]
- 11.Martinez N., Kornfeld H. Tuberculosis and diabetes: From bench to bedside and back. Int J Tuberc Lung Dis. 2019;23:669–677. doi: 10.5588/ijtld.18.0805. [DOI] [PubMed] [Google Scholar]
- 12.Ayelign B., Negash M., Genetu M., Wondmagegn T., Shibabaw T. Immunological Impacts of Diabetes on the Susceptibility of Mycobacterium tuberculosis. J Immunol Res. 2019;2019:1–8. doi: 10.1155/2019/6196532. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Orcau i Palau À., Gallego Cortés C., Caylà i Buqueras J.A., Rius i Gibert C. La tuberculosi a Barcelona. Informe 2017. 2017 [consultado 10 Ene 2021]. Disponible en: https://www.aspb.cat/wp-content/uploads/2020/10/tuberculosi-barcelona-2017.pdf. [Google Scholar]
- 14.New York City Health Department. Annual Tuberculosis Summary, 2019 [consultado 10 Ene 2021]. Disponible en: https://www1.nyc.gov/assets/doh/downloads/pdf/tb/tb2019.pdf
- 15.Muller L.M.A.J., Gorter K.J., Hak E., Goudzwaard W.L., Schellevis F.G., Hoepelman A.I.M., et al. Increased Risk of Common Infections in Patients with Type 1 and Type 2 Diabetes Mellitus. Clin Infect Dis. 2005;41:281–288. doi: 10.1086/431587. [DOI] [PubMed] [Google Scholar]
- 16.American Diabetes Association Standards of Medical Care in Diabetes - 2018. Diabetes Care. 2018;41 [Google Scholar]
- 17.Ruslami R., Aarnoutse R.E., Alisjahbana B., Van Der Ven A.J.A.M., Van Crevel R. Implications of the global increase of diabetes for tuberculosis control and patient care. Trop Med Int Heal. 2010;15:1289–1299. doi: 10.1111/j.1365-3156.2010.02625.x. [DOI] [PubMed] [Google Scholar]
- 18.Jeon C.Y., Murray M.B. Diabetes mellitus increases the risk of active tuberculosis: A systematic review of 13 observational studies. PLoS Med. 2008;5:1091–1101. doi: 10.1371/journal.pmed.0050152. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Antonio-Arques V., Caylà J.A., Franch-Nadal J., Orcau À., Moreno A., Real J., et al. El papel de la diabetes en la incidencia de nuevos casos de tuberculosis en Ciutat Vella. Rev Enf Emerg. 2020;19:183–185. Disponible en: http://enfermedadesemergentes.com/articulos/a758/taller_TBC2020_mesa_1.pdf. [Google Scholar]
- 20.Barron M.M., Shaw K.M., Bullard K.M.K., Ali M.K., Magee M.J. Diabetes is associated with increased prevalence of latent tuberculosis infection: Findings from the National Health and Nutrition Examination Survey, 2011-2012. Diabetes Res Clin Pract. 2018;139:366–379. doi: 10.1016/j.diabres.2018.03.022. [DOI] [PubMed] [Google Scholar]
- 21.Hensel R.L., Kempker R.R., Tapia J., Oladele A., Blumberg H.M., Magee M.J., et al. Increased risk of latent tuberculous infection among persons with pre-diabetes and diabetes mellitus HHS Public Access. Int J Tuberc Lung Dis. 2016;20:71–78. doi: 10.5588/ijtld.15.0457. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Lin C.H., Kuo S.C., Hsieh M.C., Ho S.Y., Su I.J., Lin S.H., et al. Effect of diabetes mellitus on risk of latent TB infection in a high TB incidence area: A community-based study in Taiwan. BMJ Open. 2019;9:1–8. doi: 10.1136/bmjopen-2019-029948. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Lee M.R., Huang Y.P., Kuo Y.T., Luo C.H., Shih Y.J., Shu C.C., et al. Diabetes Mellitus and Latent Tuberculosis Infection: A Systemic Review and Metaanalysis. Clin Infect Dis. 2017;64:719–727. doi: 10.1093/cid/ciw836. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Martínez-Aguilar G., Serrano C.J., Castañeda-Delgado J.E., Macías-Segura N., Hernández-Delgadillo N., Enciso-Moreno L., et al. Associated Risk Factors for Latent Tuberculosis Infection in Subjects with Diabetes. Arch Med Res. 2015;46:221–227. doi: 10.1016/j.arcmed.2015.03.009. [DOI] [PubMed] [Google Scholar]
- 25.Ugarte-Gil C., Alisjahbana B., Ronacher K., Riza A.L., Koesoemadinata R.C., Malherbe S.T., et al. Diabetes mellitus among pulmonary tuberculosis patients from 4 tuberculosis-endemic countries: The tandem study. Clin Infect Dis. 2020;70:780–788. doi: 10.1093/cid/ciz284. [DOI] [PubMed] [Google Scholar]
- 26.Moreno-Martínez A., Casals M., Orcau À., Gorrindo P., Masdeu E., Caylà J.A. Factors associated with diabetes mellitus among adults with tuberculosis in a large European city, 2000-2013. Int J Tuberc Lung Dis. 2015;19:1507–1512. doi: 10.5588/ijtld.15.0102. [DOI] [PubMed] [Google Scholar]
- 27.Yorke E., Atiase Y., Akpalu J., Sarfo-Kantanka O., Boima V., Dey I.D. The Bidirectional Relationship between Tuberculosis and Diabetes. Tuberc Res Treat. 2017;2017:1–6. doi: 10.1155/2017/1702578. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Baker M.A., Harries A.D., Jeon C.Y., Hart J.E., Kapur A., Lönnroth K., et al. The impact of diabetes on tuberculosis treatment outcomes: A systematic review. BMC Med. 2011;9:81. doi: 10.1186/1741-7015-9-81. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Huangfu P., Ugarte C., Pearson F., Golub J., Critchley J. OP93 The effects of diabetes on tuberculosis treatment outcomes: an updated systematic review and meta-analysis. J Epidemiol Community Health. 2016;70:A50–A51. doi: 10.1136/jech-2016-208064.93. [DOI] [PubMed] [Google Scholar]
- 30.Salindri A.D., Kipiani M., Kempker R.R., Gandhi N.R., Darchia L., Tukvadze N., et al. Diabetes reduces the rate of sputum culture conversion in patients with newly diagnosed multidrug-resistant tuberculosis. Open Forum Infect Dis. 2016;3:1–10. doi: 10.1093/ofid/ofw126. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Muñoz-Torrico M., Caminero-Luna J., Migliori G.B., D’Ambrosio L., Carrillo-Alduenda J.L., Villareal-Velarde H., et al. La diabetes se asocia con reacciones adversas graves en la tuberculosis multirresistente. Arch Bronconeumol. 2017;53:245–250. doi: 10.1016/j.arbres.2016.10.021. [DOI] [PubMed] [Google Scholar]
- 32.Kumpatla S., Sekar A., Achanta S., Sharath B.N., Kumar A.M.V., Harries A.D., et al. Characteristics of patients with diabetes screened for tuberculosis in a tertiary care hospital in South India. Public Heal Action. 2013;3:23–28. doi: 10.5588/pha.13.0035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Song C., Xie W., Gong L., Ren M., Pan P., Luo B. The relationship between HbA1c control levels and antituberculosis treatment effects: A meta-analysis. J Chinese Med Assoc. 2019;82:915–921. doi: 10.1097/JCMA.0000000000000205. [DOI] [PubMed] [Google Scholar]
- 34.Lyu M., Wang D., Zhao J., Yang Z., Chong W., Zhao Z., et al. A novel risk factor for predicting anti-tuberculosis drug resistance in patients with tuberculosis complicated with type 2 diabetes mellitus. Int J Infect Dis. 2020;97:69–77. doi: 10.1016/j.ijid.2020.05.080. Disponible en: 10.1016/j.ijid.2020.05.080. [DOI] [PubMed] [Google Scholar]
- 35.Ranzani O.T., Rodrigues L.C., Bombarda S., Minto C.M., Waldman E.A., Carvalho C.R.R. Long-term survival and cause-specific mortality of patients newly diagnosed with tuberculosis in São Paulo state Brazil, 2010-15: a population-based, longitudinal study. Lancet Infect Dis. 2020;20:123–132. doi: 10.1016/S1473-3099(19)30518-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Izzedine H., Launay-vacher V., Deybach C., Bourry E., Barrou B., Deray G. Drug-induced diabetes mellitus. Expert Opin Drug Saf. 2005;4:1097–1109. doi: 10.1517/14740338.4.6.1097. [DOI] [PubMed] [Google Scholar]
- 37.Topcu I., Yentur E.A., Kefi A., Ekici N.Z., Sakarya M. Seizures, metabolic acidosis and coma resulting from acute isoniazid intoxication. Anaesth Intensive Care. 2005;33:518–520. doi: 10.1177/0310057x0503300416. [DOI] [PubMed] [Google Scholar]
- 38.Pearson F., Huangfu P., McNally R., Pearce M., Unwin N., Critchley J.A. Tuberculosis and diabetes: Bidirectional association in a UK primary care data set. J Epidemiol Community Health. 2019;73:142–147. doi: 10.1136/jech-2018-211231. [DOI] [PubMed] [Google Scholar]
- 39.Salindri A.D., Wang J.Y., Lin H.H., Magee M. Post-tuberculosis incidence of diabetes, myocardial infarction, and stroke: Retrospective cohort analysis of patients formerly treated for tuberculosis in Taiwan, 2002-2013. Int J Infect Dis. 2019;84:127–130. doi: 10.1016/j.ijid.2019.05.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Noubiap J.J., Nansseu J.R., Nyaga U.F., Nkeck J.R., Endomba F.T., Kaze A.D., et al. Global prevalence of diabetes in active tuberculosis: a systematic review and meta-analysis of data from 2·3 million patients with tuberculosis. Lancet Glob Health. 2019;7:e448–e460. doi: 10.1016/S2214-109X(18)7-X3048. [DOI] [PubMed] [Google Scholar]
- 41.Boillat-Blanco N., Ramaiya K.L., Mganga M., Minja L.T., Bovet P., Schindler C., et al. Transient hyperglycemia in patients with tuberculosis in Tanzania: Implications for diabetes screening algorithms. J Infect Dis. 2016;213:1163–1172. doi: 10.1093/infdis/jiv568. [DOI] [PubMed] [Google Scholar]
- 42.UN INTERAGENCY TASK FORCE ON NCDs, OMS, PNUD. Hacer frente a las enfermedades no transmisibles durante la pandemia de COVID-19 y después de ella [consultado 10 Ene 2021]. Disponible en: https://apps.who.int/iris/bitstream/handle/10665/335827/WHO-2019-nCoV-Non-communicable_diseases-Policy_brief-2020.1-spa.pdf
- 43.Yang J., Zheng Y., Gou X., Pu K., Chen Z., Guo Q., et al. Prevalence of comorbidities and its effects in patients infected with SARS-CoV-2: a systematic review and meta-analysis. Lancet. 2020;94:91–95. doi: 10.1016/j.ijid.2020.03.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z., et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395:1054–1062. doi: 10.1016/S0140-6736(20)30566-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Katulanda P., Dissanayake H.A., Ranathunga I., Ratnasamy V., Wijewickrama P., Yogendranathan N., et al. Prevention and management of COVID-19 among patients with diabetes: an appraisal of the literature. Diabetologia. 2020;63:1440–1452. doi: 10.1007/s00125-020-05164-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Chen X., Chen Y., Wu C., Wei M., Xu J., Chao Y.C., et al. Coagulopathy is a major extrapulmonary risk factor for mortality in hospitalized patients with COVID-19 with type 2 diabetes. BMJ Open Diabetes Res Care. 2020;8:1–9. doi: 10.1136/bmjdrc-2020-001851. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Hussain A., Bhowmik B., do Vale Moreira N.C. COVID-19 and diabetes: Knowledge in progress. Diabetes Res Clin Pract. 2020;162:1–9. doi: 10.1016/j.diabres.2020.108142. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Wolff D., Nee S., Hickey N.S., Marschollek M. Risk factors for Covid-19 severity and fatality: a structured literature review. Infection. 2020;49:15–28. doi: 10.1007/s15010-020-01509-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Jain V.K., Iyengar K.P., Samy D.A., Vaishya R. Tuberculosis in the era of COVID-19 in India. Diabetes Metab Syndr Clin Res Rev. 2020;14:1439–1443. doi: 10.1016/j.dsx.2020.07.034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Glaziou P. Predicted impact of the COVID-19 pandemic on global tuberculosis deaths in 2020. medRxiv. 2020 doi: 10.1101/2020.04.28.20079582. [DOI] [Google Scholar]
- 51.Singer M. John Willey & Sons; Hoboken, New Jersey, EE. UU.: 2009. Introduction to Syndemics: A Critical Systems Approach to Public and Community Health EDN 1 st ed. [Google Scholar]
- 52.World Health Organization/International Union Against Tuberculosis and Lung Disease Collaborative framework for care and control of Tuberculosis and Diabetes. 2011 [consultado 28 Nov 2020]. Disponible en: http://apps.who.int/iris/bitstream/handle/10665/44698/9789241502252_eng.pdf?sequence=1. [PubMed] [Google Scholar]
- 53.Van Crevel R., Koesoemadinata R., Hill P.C., Harries A.D. Clinical management of combined tuberculosis and diabetes. Int J Tuberc Lung Dis. 2018;22:1404–1410. doi: 10.1101/2020.04.28.20079582. [DOI] [PubMed] [Google Scholar]
- 54.Chung W.S., Lin C.L., Hung C.T., Chu Y.H., Sung F.C., Kao C.H., et al. Tuberculosis increases the subsequent risk of acute coronary syndrome: A nationwide population-based cohort study. Int J Tuberc Lung Dis. 2014;18:79–83. doi: 10.5588/ijtld.13.0288. [DOI] [PubMed] [Google Scholar]
- 55.Huaman M.A., Kryscio R.J., Fichtenbaum C.J., Henson D., Salt E., Sterling T.R., et al. Tuberculosis and risk of acute myocardial infarction: a propensity score-matched analysis. Epidemiol Infect. 2017;145:1363–1367. doi: 10.1017/S0950268817000279. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Millet J.P., Orcau À. COVID y TB en Barcelona. Enf Emerg. 2021;20:27–45. Disponible en: http://enfermedadesemergentes.com/articulos/a772/Jornada_TBC_2021_MESA2.pdf. [Google Scholar]
- 57.Wingfield T., Karmadwala F., MacPherson P., Millington K.A., Walker N.F., Cuevas L.E., et al. Challenges and opportunities to end tuberculosis in the COVID-19 era. Lancet Respir Med. 2021 doi: 10.1016/S2213-2600(21)00161-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Holland D., Heald A.H., Stedman M., Green L., Scargill J., Duff C.J., et al. Impact of the UK COVID-19 pandemic on HbA1c testing and its implications for diabetes diagnosis and management. Int J Clin Pract. 2021;75 doi: 10.1111/ijcp.13980. [DOI] [PubMed] [Google Scholar]
- 59.Ruiz-Manzano J., Blanquer R., Calpe J.L., Caminero J.A., Caylà J., Domínguez J.A., et al. Diagnóstico y tratamiento de la tuberculosis. Arch Bronconeumol. 2008;44:551–566. doi: 10.1157/13126836. [DOI] [PubMed] [Google Scholar]