Abstract
Die Etablierung der unterstützten Spontanatmung gilt allgemein als eine vorteilhafte und wenig gefährdende Phase der Beatmungstherapie. Allerdings geben neuere Erkenntnisse Hinweise auf eine potenzielle Schädigung durch exzessive Spontanatembemühungen vor allem bei akuter Lungenschädigung. Das Syndrom wird unter dem Begriff „patient self-inflicted lung injury“ zusammengefasst. Ärzte, Pflegepersonen und Atmungstherapeuten sollten für diese Thematik sensibilisiert werden. Parameter, die mittels Ösophagusdruckmessung oder einfacher Manöver am Respirator bestimmt werden können, sind bei der Entscheidung zur Durchführung und zur Überwachung von Spontanatmung auch in den akuten Phasen der Lungenschädigung hilfreich. Weiterhin gibt es im Umgang mit hohem Atemantrieb oder erhöhter Atemanstrengung therapeutische Möglichkeiten, diesen zu begegnen.
Schlüsselwörter: Atemanstrengung, Lungenstress, Unterstützte Spontanatmung, Beatmungsinduzierte Lungenschädigung, Selbst zugefügte Lungenschädigung
Abstract
The establishment of assisted spontaneous breathing is a phase of ventilation therapy that is generally considered to be beneficial and not dangerous. However, recent findings regarding potential damage from vigorous spontaneous breathing effort should be noticed in patients with acute injured lungs. This syndrome is called patient self-inflicted lung injury. Physicians, nurses and respiratory therapists should be aware of this issue. Parameters that can be determined using esophageal pressure measurement or simple maneuvers on the respirator are helpful when deciding to implement and to monitor assisted spontaneous breathing, even in the acute phases of lung damage. In addition to monitoring, there are therapeutic options for dealing with high respiratory drive or increased breathing effort.
Keywords: Breathing effort, Lung stress, Assisted spontaneous breathing, Ventilator-induced lung injury, Respiratory effort
Durch Beatmung induzierte Lungenschädigungen („ventilator-induced lung injury“ [VILI]) sowie die Entwicklung von Strategien, um diesen vorzubeugen, standen in den letzten Jahrzehnten vielfach im Mittelpunkt der intensivmedizinischen Beatmungsmedizin und -forschung. Ursachen für diese Schädigung sind die Ruptur von Lungengewebe (Barotrauma), die Überdehnung von Lungengewebe (Volutrauma) oder das repetitive Öffnen und Kollabieren von Alveolen (Atelektrauma). Sie führen entweder direkt zur Parenchymschädigung oder indirekt zur Freisetzung proinflammatorischer Mediatoren, welche die immunologischen und entzündlichen Prozesse weiter unterhalten (Biotrauma; [1]). Allen Komponenten liegt entweder global oder regional erhöhter Lungenstress zugrunde. Belegt sind diese Zusammenhänge unter kontrollierter Beatmung. Die frühe Spontanatmung hat zahlreiche positive Effekte wie ein dorsobasales Recruitment, verbesserten Gasaustausch, augmentierten venösen Rückstrom mit erhöhtem Herzzeitvolumen, das Vermeiden einer Inaktivitätsatrophie des Zwerchfells und einen geringeren Analgosedierungsbedarf [2, 3]. Dem gegenüber spielt es aber keine Rolle, ob schädlicher Lungenstress durch Beatmung oder durch die Atemanstrengung des Patienten selbst generiert wird. Diese selbst zugefügte Lungenschädigung wird unter dem Akronym P‑SILI („patient self-inflicted lung injury“) beschrieben. In den vergangenen Jahren ist das P‑SILI zunehmend zum Forschungsgegenstand geworden. Weiter in den Fokus rückte dieses Phänomen während der COVID-19-Pandemie. COVID-19-Patienten zeigen häufig einen beeindruckenden Atemantrieb, dem die ARDS-geschädigte Lunge oft nicht gewachsen ist. Ein substanzieller Beitrag von P‑SILI zur Progression des „COVID-19 acute respiratory distress syndrome“ (CARDS) erscheint möglich [4]. In den vergangenen Jahren wurden Strategien entwickelt, welche die Lungenprotektion auch unter unterstützter Spontanatmung gewährleisten sollen [5, 6]. Der vorliegende Beitrag behandelt lungenprotektive Beatmungsstrategien unter unterstützter Spontanatmung bei Patienten mit akuter Lungenschädigung. Hierbei werden die Pathophysiologie des P‑SILI, Monitoringmöglichkeiten von Atemantrieb, Atemanstrengung und Lungenstress dargestellt sowie diagnostische und therapeutische Herangehensweisen aufgezeigt.
Pathophysiologie des P-SILI
Starke Pleuradruckerniedrigungen, ausgelöst durch hohen Atemantrieb, führen zu erhöhtem Lungenstress, gesteigertem pulmonalem Blutfluss und Patient-Ventilator-Asynchronien (PVA). Diese drei Faktoren werden für die Entstehung des P‑SILI verantwortlich gemacht [7].
Atemantrieb
Die Intensität der Atemanstrengung ergibt sich aus dem Atemantrieb und der Kapazität aktiver Atemmuskulatur. Bei akuter Lungenschädigung unterliegt der Atemantrieb einigen pathologischen Einflüssen. Hyperkapnie steigert den Atemantrieb enorm. Weiter bewirken Azidose und Hypoxämie eine zusätzliche Steigerung des Atemantriebs. Intrapulmonale C‑Faser-Rezeptoren werden durch inflammatorische Mediatoren aktiviert und stimulieren ebenfalls das Atemzentrum. Die fehlende Rückkopplung von Dehnungsrezeptoren in atelektatischen Bereichen der geschädigten Lunge verhindert die physiologische Hemmung des Atemantriebs [8]. Durch die starke Reduktion pulmonaler und ggf. auch thorakaler Dehnbarkeit kann die durch das Atemzentrum ausgelöste Atemanstrengung nicht in entsprechende Tidalvolumina (VT) umgesetzt werden (neuromechanische Entkopplung). Dies wird zentral mit höherem Atemantrieb und Dyspnoe beantwortet [8]. Stress, Schmerzen und Angst führen ebenfalls zu einer Steigerung des Atemantriebs [8]. Die Steigerung des Atemantriebs bewirkt eine Zunahme der Kontraktionsstärke der Inspirationsmuskulatur und den Einsatz von Hilfsmuskulatur. Die Folge ist eine erhöhte Atemanstrengung mit Steigerung des Atemmuskeldrucks (Pmus) und konsekutiv gesteigerter Pleuradruckerniedrigung.
Globaler Lungenstress in der „baby lung“ und regionaler Lungenstress in der abhängigen Lunge
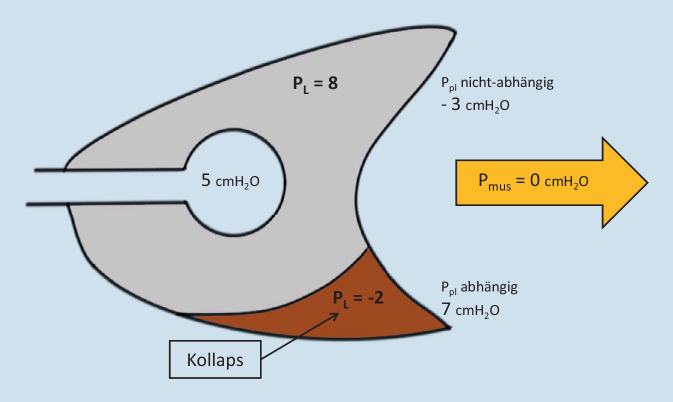
Während der Spontanatmung oder unter Beatmung wird das Lungengewebe inspiratorisch gedehnt. Das elastische Lungengewebe setzt dieser Dehnung eine mechanische Spannung entgegen, welche die passive Exspiration ermöglicht. Diese Spannung wird Lungenstress genannt. Klinisch kann Lungenstress mit der Differenz von Alveolardruck (Palv) und Pleuradruck (Ppl), also dem transpulmonalen Druck PL (PL = Palv − Ppl) gleichgesetzt und über die Messung des Ösophagusdrucks (Peso) bestimmt werden. Hierbei dient der Peso als Surrogatparameter des Ppl. Übersteigt der Lungenstress ein kritisches Maß, entsteht ein Volutrauma mit erhöhter alveolokapillärer Permeabilität und alveolärer Inflammation [6]. Volutraumagefahr besteht vorwiegend in den nichtabhängigen Lungenbezirken (= „baby lung“), da in diesen Bezirken der Ppl am geringsten und der PL am höchsten ist (Abb. 1 und 3). Gegenüber einer gesunden Lunge besteht beim „acute respiratory distress syndrome“ (ARDS) ein erhöhter Pleuradruckgradient von ventral nach dorsal bzw. von nichtabhängigen zu abhängigen Bereichen (Abb. 1). Dadurch ist in den abhängigen Bezirken der Ppl höher und der PL exspiratorisch negativ. Dies führt zu einem Kollaps der abhängigen Bereiche (Abb. 1). Werden diese kollaptischen Bereiche inspiratorisch wieder belüftet, führt dies zu repetitivem Öffnen und Kollabieren und ein Atelektrauma entsteht.
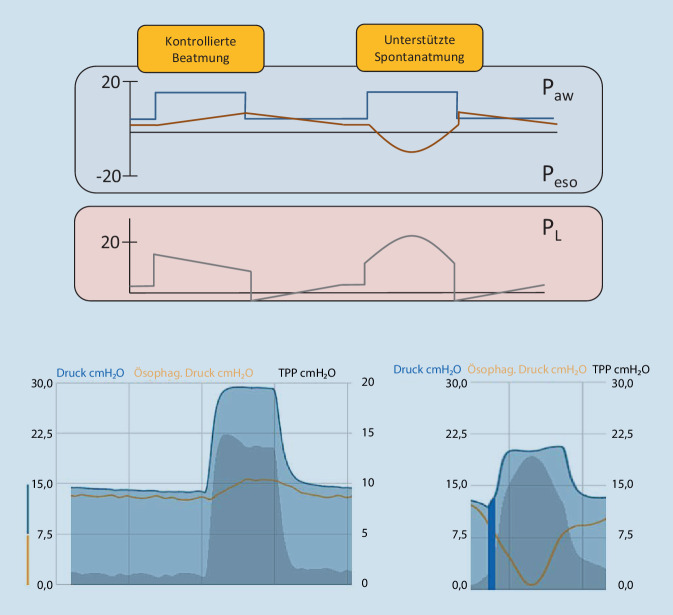
Im Gegensatz zu rein kontrollierter Beatmung wird unter Spontanatmung der Ppl reduziert (Abb. 2). In druckgesteuerten Beatmungsmodi wirken Beatmungsdruck und Atemmuskeldruck (Pmus) des Patienten synergistisch (Abb. 2). Durch die Druckkonstanz der Beatmung bei zeitgleicher Pleuradruckerniedrigung kann der PL stark ansteigen und die Gefahr von kritischem Lungenstress in der nichtabhängigen Lunge steigt (Abb. 2 und 3; [9]).
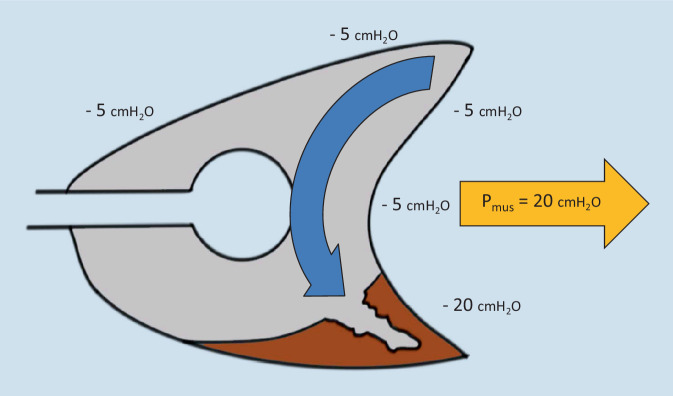
Bei akuter Lungenschädigung wird die Pleuradruckerniedrigung aufgrund des dorsalen Lungenkollapses nicht vollständig nach ventral übertragen. Daraus resultiert eine dorsal deutlich ausgeprägtere Ppl-Erniedrigung als ventral und konsekutiv eine dorsal stärkere Paw-Erniedrigung als ventral. Folge dieses intrapulmonalen Druckgradienten ist eine frühinspiratorische, ventrodorsale Atemgasumverteilung, die schon vor Beginn des Atemgasflusses durch den Respirator einsetzen kann. Dieses Phänomen wird Pendelluft genannt und führt zu repetitivem Öffnen und Kollabieren dorsaler Lungenabschnitte (Atelektrauma) sowie zu pathologisch hohem regionalem Lungenstress (Volutrauma) in den abhängigen Bereichen (Abb. 4; [10]). Es tritt sowohl unter druck- als auch unter volumengesteuerter Beatmung auf und verhält sich proportional zur Atemanstrengung [11, 12].
Gesteigerter pulmonaler Blutfluss
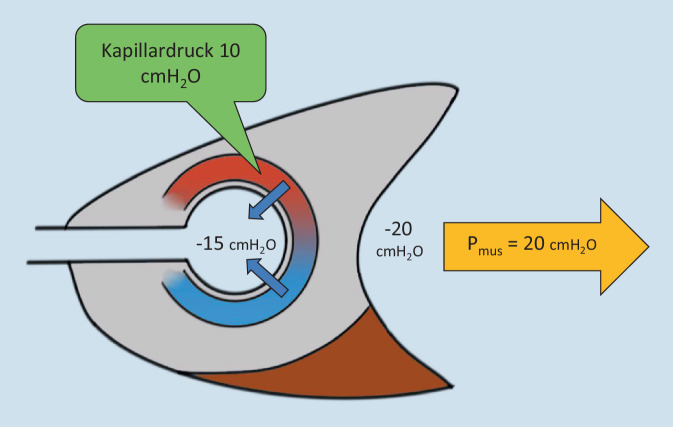
Durch starke Pleuradruckerniedrigung sinkt frühinspiratorisch der alveoläre Druck (Palv) und der venöse Rückstrom zum rechten Herzen wird augmentiert (vgl. Abb. 5). Da hierbei der Blutdruck in den perialveolären Kapillaren (Pcap) annähernd gleich bleibt, wird der Druckgradient (transvaskulärer Druck = Pcap − Palv) zwischen Gefäßen und Alveolen erhöht [13]. Dieser Gradient kann über Extravasation von Transsudat bis hin zum „stress failure“ pulmonaler Kapillaren mit Lungenödem und pulmonaler Hämorrhagie führen [14, 15].
P-SILI-Patient-Ventilator-Asynchronie (PVA)
Eine fehlende Übereinstimmung von Atemmuster des Patienten und Beatmungsmuster wird als PVA bezeichnet [16, 17]. PVA können ein P‑SILI begünstigen. Starke Inspirationen können zu Doppeltriggerungen führen, wenn die Einatemzeit des Patienten über die des Respirators hinausgeht und direkt postinspiratorisch ein weiterer Atemzug getriggert wird. Dabei addieren sich die Tidalvolumina von direkt aufeinander folgenden Atemhüben („breath stacking“; [18, 19]). Dies führt zu erhöhtem Lungenstress in den nichtabhängigen Bezirken. Über ein Drittel der Doppeltriggerungen während kontrollierter Beatmung sind auf sogenanntes „reverse triggering“ zurückzuführen [17]. Beim „reverse triggering“ löst ein kontrollierter Beatmungshub eine Zwerchfellkontraktion aus. Ist diese Kontraktion kräftig genug, führt dies zu „breath stacking“. Weiter kann das „reverse triggering“ das Pendelluftphänomen zur Folge haben und auch so die abhängigen Lungenbereiche schädigen [12, 20].
Parameter zur Diagnose und zum Monitoring des P-SILI
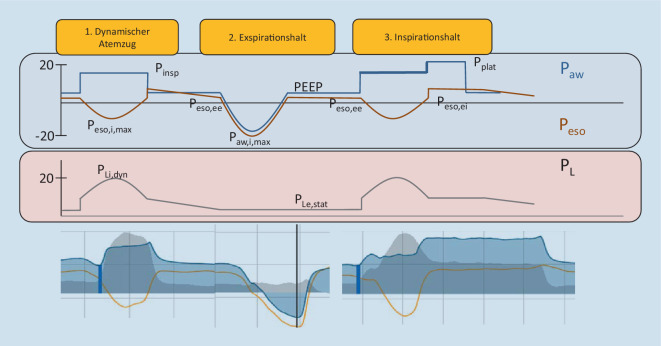
Um lungenprotektive unterstützte Spontanatmung zu ermöglichen, benötigt es durch Messmanöver ermittelte Monitoringparameter, welche die Beurteilung von Atemantrieb, Atemanstrengung und Lungenstress zulassen (Abb. 6 und 7). Da derzeit keine einheitliche Nomenklatur unter den inzwischen zahlreichen beschriebenen Parametern existiert, gibt die Tab. 1 einen Überblick über zugrunde liegende Definitionen. Es existieren Parameter, deren Bestimmung nur durch Ösophagusdruckmessung gelingt (∆PLi,stat, PLi,stat, ∆Peso, PLi,dyn, ∆PLi,dyn). In den vergangenen Jahren wurden aber auch Parameter validiert, deren Erhebung nicht die Ableitung des Ösophagusdrucks voraussetzt (∆Pstat, Pplat, Pmus pred, ∆PLi,dyn pred). Sie können verwendet werden, um Schädigungspotenzial mit hohem prädiktivem Wert auszuschließen, oder Anlass geben, die Ösophagusdruckmessung zur differenzierten Bestimmung der Atemmechanik einzusetzen (Abb. 6; [21, 22]).
| Name | Abkürzung | Definition |
|---|---|---|
| Atemwegsdruck | Paw | Beatmungsdruck |
| Inspirationsdruck | Pinsp | Inspiratorischer Paw (Inspirationsdruck oder PEEP + Druckunterstützung) |
| Maximale inspiratorische Erniedrigung der Paw-Kurve | Paw,i,max | Niedrigster Paw während spontaner Inspiration gegen auf PEEP-Niveau geschlossener Ventile (Exspirationshalt) |
| Plateaudruck | Pplat | Paw unter statischen Bedingungen (Abwesenheit von Flow) während eines Okklusionsmanövers auf Pinsp-Niveau (Inspirationshalt); entspricht dem endinspiratorischen Alveolardruck (Palv) |
| Positiver endexspiratorischer Druck | PEEP | Endexspiratorischer Paw. Unter statischen Bedingungen entspricht er dem endexspiratorischen Palv |
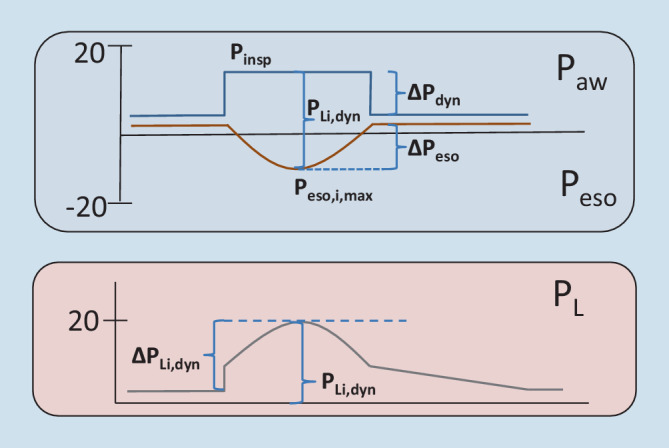
| Dynamischer „driving pressure“ | ∆Pdyn | Pinsp − PEEP |
| Statischer „driving pressure“ | ∆Pstat | Pplat − PEEP; alternativ VT/Compliance des respiratorischen Systems (CRS) |
| Endexspiratorischer Ösophagusdruck | Peso,ee | Exspiratorischer Ösophagusdruck unter statischen Bedingungen und bei inaktiver Atemmuskulatur |
| Maximale inspiratorische Erniedrigung der Peso-Kurve | Peso,i,max | Niedrigster Peso während spontaner Inspiration unter dynamischen Bedingungen |
| Inspiratorische ösophageale Auslenkung | ∆Peso | Maximale Auslenkung des Peso während spontaner Inspiration unter dynamischen Bedingungen (Peso,ee − Peso,i,max) |
| Endinspiratorischer Ösophagusdruck | Peso,ei | Endinspiratorischer Peso unter statischen Bedingungen bei inaktiver Atemmuskulatur während eines Okklusionsmanövers auf Pinsp-Niveau |
| Statischer exspiratorischer transpulmonaler Druck | PLe,stat | PEEP − Peso,ee (Absolutwertmethode) |
| Regionaler inspiratorischer Lungenstress (= dynamischer inspiratorischer transpulmonaler Druck) | PLi,dyn | Pinsp − Peso,i,max (Absolutwertmethode) |
| Regionaler tidaler Lungenstress (= dynamischer tidaler transpulmonaler Druck) | ∆PLi,dyn | PLi,dyn − PLe,stat; alternativ: ∆Pdyn + ∆Peso (Absolutwertmethode) |
| Globaler endinspiratorischer Lungenstress (= statischer endinspiratorischer transpulmonaler Druck) | PLi,stat | Pplat * EL/ERS (Elastance-basierte Methode) |
| Globaler tidaler Lungenstress (= statischer tidaler transpulmonaler Druck) | ∆PLi,stat | ∆Pstat * EL/ERS (Elastance-basierte Methode) |
Messmanöver
Für die Ermittlung der dargestellten Parameter wird der Atemzug unter dynamischen Bedingungen (während ungehinderter Atmung in Anwesenheit von Atemgasfluss) und unter statischen Bedingungen (während Okklusionsmanövern in Abwesenheit von Atemgasfluss) bewertet (vgl. Abb. 7). Die Monitoringparameter für Lungenstress und Atemanstrengung lassen sich mit den folgenden drei Manövern ermitteln.
Unter dynamischen Bedingungen wird während ungehinderter unterstützter Spontanatmung mit Peso-Messung der Beatmungskurvenbildschirm eingefroren. Mit dem Cursor werden der Peso,i,max und der Peso,ee abgelesen.
Durch einen Exspirationshalt, während der Patient einatmet (endexspiratorische Okklusion), erhält man eine Darstellung der Peso-Erniedrigung in der Atemwegsdruckkurve. Von Interesse ist die maximale inspiratorische Erniedrigung der Paw-Kurve (Paw,i,max). Dieses Manöver wird benötigt, wenn kein Peso-Katheter einliegt. Bei einliegendem Peso-Katheter ist dies nicht vonnöten und dient in Abb. 7 lediglich der Veranschaulichung der kongruenten Auslenkung von Peso und Paw.
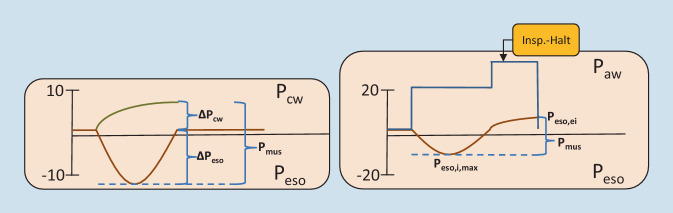
Durch einen während der Inspiration ausgelösten Inspirationshalt addieren sich postinspiratorisch der Pmus des Patienten und der Pinsp zum Plateaudruck (Pplat). Dieser Druck entspricht dem tatsächlichen endinspiratorischen Palv. Voraussetzung für die Validität dieses Manövers ist die Ausbildung eines stabilen Plateaus [23]. Steigt der Druck kontinuierlich an oder fällt er kontinuierlich ab, ist dies ein Hinweis auf exspiratorisches Pressen oder Leckagen und die Messung ist nicht verwertbar.
Monitoringparameter
Die abzuleitenden Parameter lassen sich in drei Gruppen zusammenfassen (Abb. 6):
- Parameter, welche den globalen Lungenstress in der „baby lung“ quantifizieren
- Tidaler und endinspiratorischer Lungenstress (∆PLi,stat, PLi,stat)
- Statischer „driving pressure“ und Plateaudruck (∆Pstat, Pplat)
- Parameter, welche den Atemantrieb und die Atemanstrengung widerspiegeln
- Okklusionsdruck (P0,1)
- Atemmuskeldruck (Pmus)
- Inspiratorische ösophageale Auslenkung (∆Peso)
- Atemwegsdruckerniedrigung während endexspiratorischer Okklusion (∆Poccl)
- Prognostizierter Atemmuskeldruck (Pmus pred)
- Parameter, welche auf regional erhöhten Lungenstress und repetitives Öffnen und Kollabieren in den abhängigen Bereichen schließen lassen
- Dynamischer inspiratorischer Lungenstress (PLi,dyn)
- Dynamischer tidaler Lungenstress (∆PLi,dyn)
- Prognostizierter dynamischer tidaler Lungenstress (∆PLi,dyn pred)
Parameter, welche den globalen Lungenstress in der „baby lung“ quantifizieren (Elastance-basierte Methode)
Der globale endinspiratorische (PLi,stat) und tidale (∆PLi,stat) Lungenstress in der „baby lung“ werden mithilfe der Elastance-basierten Methode der Ösophagusdruckinterpretation ermittelt [16, 24]. Dieser Methode liegt die Prämisse zugrunde, dass der Ppl bei einem Paw von 0 cmH2O ebenfalls 0 cmH2O beträgt. Sie spiegelt damit die Verhältnisse in den nichtabhängigen Bereichen wider [25]. Daher ist diese Methode geeignet, den globalen Lungenstress in der „baby lung“ abzuschätzen (Abb. 8). Bei dieser Methode dienen tidale Ösophagusdruck- und Atemwegsdruckdifferenzen als Interpretationsgrundlage. Zunächst wird das Verhältnis von Steifigkeit der Lunge („elastance of the lung“ [EL]) und Steifigkeit des respiratorischen Systems („elastance of the respiratory system“ [ERS]) ermittelt.
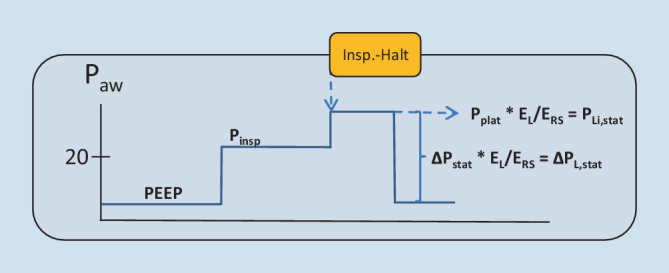
Der Quotient EL/ERS entspricht der Fraktion des Beatmungsdrucks, welcher auf das Lungenparenchym wirkt. Der globale endinspiratorische Lungenstress wird durch Multiplikation des in Manöver 3 ermittelten Pplat mit dem EL/ERS berechnet:
Um den globalen tidalen Lungenstress zu berechnen, subtrahiert man vom PPlat den PEEP und erhält den „driving pressure“ (∆Pstat). Eine Multiplikation des ∆Pstat mit dem EL/ERS ergibt den globalen tidalen Lungenstress (Abb. 8).
Ohne Ösophagusdruckmessung bedient man sich der unter kontrollierter Beatmung etablierten Grenzwerte für den Pplat und den ∆Pstat. Der unter Spontanatmung gemessene Pplat sollte auf 30 cmH2O limitiert werden [23]. Der ∆Pstat sollte auf 15 cmH2O begrenzt werden [26]. Der ∆Pstat korreliert gut mit dem Lungenstress [27] und auch bei unterstützter Spontanatmung mit der Mortalität von ARDS-Patienten [28].
Parameter, welcher den Atemantrieb widerspiegelt
Okklusionsdruck – P0,1
Zur Atemantriebsbestimmung kann der P0,1 herangezogen werden. Entsprechende Atemwegsverschlussmanöver sind in den meisten Intensivrespiratoren implementiert. Der P0,1 ist unbeeinflusst von atemmechanischen Indizes wie Compliance und Resistance. Ebenso gilt der Wert auch bei Atemmuskelschwäche als zuverlässig [29, 30]. Für reliable Werte sollten stets Messreihen mit 3–4 randomisierten Messungen durchgeführt und der Mittelwert bestimmt werden [31]. Werte über 3,5–5 cmH2O deuten auf einen gesteigerten Atemantrieb mit konsekutiv erhöhter Atemanstrengung hin [6, 32].
Parameter, welche die Atemanstrengung widerspiegeln
Atemmuskeldruck (Pmus)
Der Atemmuskeldruck (Pmus) ist der Druck, der inspiratorisch durch die Atemmuskulatur erzeugt und in Pleuradruckerniedrigung übersetzt wird [16]. Der Pmus wird aus der inspiratorischen ösophagealen Auslenkung (∆Peso) und dem zusätzlichen Muskeldruck berechnet, der nötig ist, um die Steifigkeit der Thoraxwand („elastance of the chestwall“ [Ecw]) zu überwinden (∆Pcw; Abb. 9; [33]). Die Ecw kann abgeschätzt oder mittels Ösophagusdruckmessung berechnet werden [34]. Alternativ wird der Peso,i,max vom Peso,ei subtrahiert (Abb. 9; [35]).
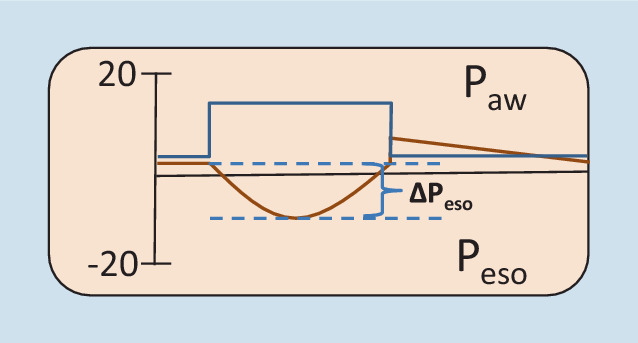
Inspiratorische ösophageale Auslenkung (∆Peso)
Da die Ermittlung der Ecw in der Praxis aufwendig ist, kann alternativ die ∆Peso allein zur Beurteilung der Atemanstrengung herangezogen werden. Unter der Annahme, dass die Ecw normal ist, betragen die Zielwerte 3–8 cmH2O (Abb. 10; [33]).
Atemwegsdruckerniedrigung während endexspiratorischer Okklusion (∆Poccl)
Ein kurzes unangekündigtes endexspiratorisches Okklusionsmanöver kann unter Spontanatmung dazu verwendet werden, die Atemanstrengung auch ohne Ösophagusdruckmessung abzuschätzen. Atmet der Patient während des Okklusionsmanövers gegen die geschlossenen Ventile ein, wird seine Pleuradruckerniedrigung exakt in der Atemwegsdruckkurve dargestellt. Mit dem Cursor wird die niedrigste Atemwegsdruckerniedrigung (Paw,i,max) ermittelt. Die ∆Poccl errechnet sich aus dem PEEP − Paw,i,max (Abb. 11).
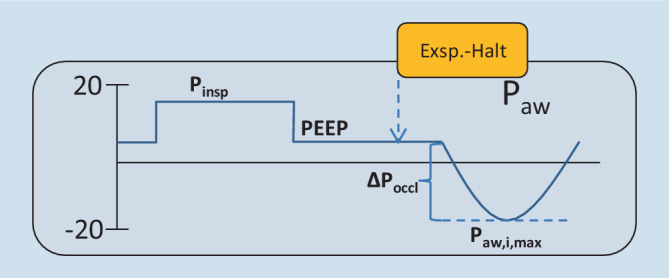
Prognostizierter Atemmuskeldruck (Pmus pred)
Die ∆Poccl überschätzt die ∆Peso unter dynamischen Bedingungen, sodass Korrekturfaktoren nötig sind, um mit ∆Poccl den Pmus abzuschätzen. Durch Multiplikation von ∆Poccl mit 0,75 erhält man den prognostizierten Pmus (Pmus pred). Der Pmus pred korreliert allerdings nur mäßig mit dem Pmus. Werte über 13–15 cmH2O diagnostizieren jedoch zuverlässig hohe Atemanstrengung [22, 36].
Parameter welche auf erhöhten regionalen Lungenstress und repetitives Öffnen und Kollabieren in den atelektatischen Bereichen schließen lassen
Mit Parametern, die unter unterstützter Spontanatmung mit der Absolutwertmethode der Ösophagusdruckinterpretation erhoben werden, kann die P‑SILI-Gefahr in den abhängigen Bereichen abgeschätzt werden [37]. Bei der Absolutwertmethode wird der direkt gemessene Ösophagusdruck dem Pleuradruck gleichgesetzt [38]. Ihr liegt die Annahme zugrunde, dass der Ösophagusdruck exakt dem Pleuradruck entspricht. Aufgrund des Pleuradruckgradienten ist dies nur in den abhängigen Bereichen der Fall, sodass der Absolutwert des Ösophagusdrucks etwa dem Pleuradruck in den abhängigen Lungenbezirken entspricht [25]. Somit spiegelt die Berechnung des transpulmonalen Drucks mit der Absolutwertmethode (vgl. Tab. 1) die regionalen transpulmonalen Drücke in den abhängigen Bereichen wider. Der transpulmonale Druck errechnet sich mit der Absolutwertmethode aus der Differenz von Atemwegsdruck und Ösophagusdruck (PL = Paw − Peso).
Abgeleitete Parameter sind der regionale inspiratorische Lungenstress (PLi,dyn) und der regionale tidale Lungenstress (∆PLi,dyn) (Abb. 12). Beide korrelieren mit dem Auftreten von Pendelluft und dem assoziierten Atelek- und Volutrauma [37, 39, 40]. Der PLi,dyn errechnet sich aus dem Inspirationsdruck minus Peso,i,max (Abb. 12). Der ∆PLi,dyn aus dem PLi,dyn minus PLe, stat oder alternativ aus ∆Pdyn plus ∆Peso (Abb. 12). In der Literatur wird vorgeschlagen, den PLi,dyn auf maximal 20 cmH2O zu limitieren [33]. Für den ∆PL,dyn wird eine Limitierung auf <15–20 cmH2O angegeben, um Schädigungen zu vermeiden [5, 33, 41].
Ohne Ösophagusdruckmessung kann mit dem ∆Poccl ein prognostizierter ∆PLi,dyn (∆PLi,dyn pred) errechnet werden. Der ∆PLi,dyn pred errechnet sich aus der Addition von ∆Pdyn und ∆Poccl * 0,66. Aus physiologischen Erwägungen heraus wurde eine Limitation des ∆PL,dyn pred auf Werte <16–17 cmH2O vorgeschlagen, um lungenprotektive unterstützte Spontanatmung zu gewährleisten [22].
Diagnose von drohendem und manifestem P-SILI
Die Diagnose eines P‑SILI zu stellen, ist schwierig. Klare diagnostische Kriterien gibt es bisher nicht. Dementsprechend sind die oben vorgestellten Parameter nur Puzzleteile eines Gesamtbilds, das im klinischen Kontext betrachtet werden muss. Grundsätzlich scheint mit steigendem Schweregrad der Lungenschädigung die Prädisposition für eine zusätzliche Lungenschädigung zu steigen. Dieser Circulus vitiosus aus hohem Lungenstress, progredienter Schädigung der Lunge und daraus gesteigerter Atemanstrengung mit konsekutiv noch höherem Lungenstress führt zu immer ausgeprägterem P‑SILI und geringerem Baby-lung-Volumen [42]. Daher sollte bei allen unterstützt beatmeten Patienten mit akuter Lungenschädigung täglich eine Quantifizierung von Atemantrieb, Atemanstrengung und Lungenstress über P0,1, ∆P, Pplat, Pmus pred und ∆PLi,dyn pred erfolgen. Ein Überschreiten der Grenzwerte sollte als potenziell schädliches Atemmuster interpretiert und ggf. über Ösophagusdruckmessung verifiziert werden. Das Baby-lung-Volumen korreliert mit der Compliance des respiratorischen Systems (CRS). Eine progrediente Lungenschädigung geht mit einer Verminderung derselben einher. Die tägliche Messung der CRS erlaubt dadurch im Verlauf eine Aussage über die Progression der Lungenschädigung. Da die CRS unter unterstützter Spontanatmung bei hoher Atemanstrengung von Beatmungsgeräten falsch hoch gemessen wird [43], sollte sie über folgende Formel errechnet werden:
Weitere Hinweise auf eine progrediente Lungenschädigung ergeben sich auch aus neuen konsolidierten bzw. verdichteten Lungenarealen in der Bildgebung (Röntgen, Computertomographie oder Lungenultraschall [44]) und einer zunehmenden Gasaustauschstörung (Horovitz-Index). Mit der Kombination aus potenziell schädlichem Atemmuster und progredienter Lungenschädigung sollte eine so hohe Wahrscheinlichkeit für ein P‑SILI abzuleiten sein, dass eine therapeutische Intervention indiziert ist. Prospektive Daten hierzu existieren bisher aber nicht. Auch können laborchemische und mikrobiologische Befunde bei der differenzialdiagnostischen Abgrenzung zum Progress der Grunderkrankung oder einer neuen nosokomialen Pneumonie hilfreich sein.
Therapeutische Interventionen bei drohendem oder manifestem P-SILI
Die zur Verfügung stehenden therapeutischen Möglichkeiten umfassen nebenwirkungsarme Maßnahmen wie die aktive Atemgasklimatisierung, die Modifikation des Unterstützungsdrucks oder die Synchronisation mit dem Respirator, welche schon bei potenziell schädlichem Atemmuster zur Anwendung kommen sollten. Nebenwirkungsbehaftete Maßnahmen wie bspw. die neuromuskuläre Blockade oder tiefe Analgosedierung sollten nur angewendet werden, wenn ein P‑SILI sehr wahrscheinlich ist. Die Beatmung mit aktiver Atemgasbefeuchtung gewährleistet durch Totraumreduktion eine effizientere Decarboxylierung, als es mit herkömmlichen Heat-and-moisture-exchanger(HME)-Filtern zu erreichen ist. Dies mildert einen wichtigen zentralen Stimulus für hohen Atemantrieb ab. Durch den geringeren Atemwegswiderstand reduziert sich zusätzlich die Atemanstrengung [45]. Entscheidend für die Regulation des Atemantriebs unter assistierter und unterstützter Beatmung ist die Wahl eines individuell angepassten Unterstützungsdrucks (Pinsp − PEEP). Dieser gewährleistet, dass sowohl eine Überlastung als auch eine Überassistenz der Atemmuskulatur vermieden wird. Erhöht man den Unterstützungsdruck, sinkt konsekutiv die zu erbringende Atemanstrengung des Patienten. Die korrekt justierte Unterstützung kann den Atemantrieb und die Atemarbeit auf ein normales Maß reduzieren [46, 47]. Nach erfolgreicher Anpassung sollten die Atemanstrengung normalisiert und der Lungenstress reduziert sein. Ein hoher PEEP hat das Potenzial, Pendelluft zu reduzieren. Ein dorsales Recruitment mit konsekutiver Homogenisierung des Pleuradruckgradienten und ein durch ein höheres endexspiratorisches Lungenvolumen reduziertes diaphragmales Kraft-Längen-Verhältnis werden hierfür als ursächlich betrachtet [40]. Allerdings ist der Erfolg dieser Maßnahme an ein vorhandenes Recruitmentpotenzial des Patienten gekoppelt, welches nicht bei jedem Patienten gegeben ist [23]. PVA können visuell anhand von Druck- und Flusskurven identifiziert [18] und Doppeltriggerungen durch Verlängerung der Inspirationszeit verhindert werden [17, 19]. Die Erhöhung der Druckanstiegsgeschwindigkeit kann den Lufthunger reduzieren und die Atemmuskulatur entlasten und somit zur Reduktion des Atemantriebs beitragen [48]. Medikamentös kann die Atemanstrengung durch Gabe atemantriebssenkender Medikamente reduziert werden. Hierfür sind Opiate und Propofol die Mittel der Wahl [5]. Die neuropsychiatrische Komponente des Atemantriebs (Delir, Angst) sollte durch entsprechende etablierte medikamentöse oder nichtmedikamentöse Konzepte adressiert werden. In einer Proof-of-concept-Studie zeigten Doorduin et al., dass eine partielle neuromuskuläre Blockade effektiv den Lungenstress senken kann [49]. Es existiert jedoch bisher nur ein Fallbericht, in welchem dieses Konzept erfolgreich angewendet wurde [50]. Unter extrakorporaler Membranoxygenierung kann der Atemantrieb durch Erhöhung des Sweep-Gasflusses reduziert werden [51]. Da im schweren ARDS der Atemantrieb durch verschiedene pathologische Reflexe moduliert wird, gelingt dies allerdings nicht immer [52]. Zeigt sich trotz Ausschöpfung genannter Maßnahmen ein drohendes oder manifestes P‑SILI, so sollte durch starke Vertiefung der Analgosedierung und ggf. vollständige neuromuskuläre Blockade die Spontanatmung ausgesetzt werden. Diese Maßnahme muss täglich neu evaluiert werden, um den frühestmöglichen Zeitpunkt für die Wiederaufnahme der Spontanatmung zu erkennen.
Fazit für die Praxis
Eine exzessive Atemanstrengung des Patienten mit akuter Lungenschädigung kann dieselben pathologischen Mechanismen auslösen, die unter kontrollierter Beatmung zum VILI führen. Die daraus resultierende Lungenschädigung wird P‑SILI genannt.
Zur Diagnose bzw. zur Vermeidung des P‑SILI unter unterstützter Spontanatmung eignen sich Parameter für Lungenstress, Atemantrieb und Atemanstrengung.
Die Diagnose des P‑SILI ist aufgrund bisher fehlender Diagnosekriterien und Überlappung zum fortschreitenden ARDS oder zu pulmonalen Infektionen schwierig und immer in den klinischen Kontext zu stellen.
Als therapeutische Möglichkeiten stehen mehrere Interventionen zur Verfügung, welche aufgrund ihres Nebenwirkungsprofils in hierarchischer Reihenfolge zur Anwendung kommen sollten.
Lediglich nach Ausschöpfen beschriebener Maßnahmen sollten bei einem schädlichen Atemmuster die tiefe Analgosedierung und ggf. neuromuskuläre Blockade eingeleitet werden.
Einhaltung ethischer Richtlinien
Interessenkonflikt
B. Neetz, T. Flohr, F.J.F. Herth und M.M. Müller geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Slutsky AS, Ranieri VM. Ventilator-induced lung injury. N Engl J Med. 2013;369(22):2126–2136. doi: 10.1056/NEJMra1208707. [DOI] [PubMed] [Google Scholar]
- 2.Putensen C, et al. The impact of spontaneous breathing during mechanical ventilation. Curr Opin Crit Care. 2006;12(1):13–18. doi: 10.1097/01.ccx.0000198994.37319.60. [DOI] [PubMed] [Google Scholar]
- 3.Levine S, et al. Rapid disuse atrophy of diaphragm fibers in mechanically ventilated humans. N Engl J Med. 2008;358(13):1327–1335. doi: 10.1056/NEJMoa070447. [DOI] [PubMed] [Google Scholar]
- 4.Gattinoni L, et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med. 2020;46(6):1099–1102. doi: 10.1007/s00134-020-06033-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Goligher EC, et al. Clinical strategies for implementing lung and diaphragm-protective ventilation: avoiding insufficient and excessive effort. Intensive Care Med. 2020;46(12):2314–2326. doi: 10.1007/s00134-020-06288-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Goligher EC, et al. Lung and diaphragm-protective ventilation. Am J Respir Crit Care Med. 2020;202(7):950–961. doi: 10.1164/rccm.202003-0655CP. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Yoshida T, et al. Impact of spontaneous breathing during mechanical ventilation in acute respiratory distress syndrome. Curr Opin Crit Care. 2019;25(2):192–198. doi: 10.1097/MCC.0000000000000597. [DOI] [PubMed] [Google Scholar]
- 8.Spinelli E, et al. Respiratory drive in the acute respiratory distress syndrome: pathophysiology, monitoring, and therapeutic interventions. Intensive Care Med. 2020;46(4):606–618. doi: 10.1007/s00134-020-05942-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Mauri T, et al. Extremely high transpulmonary pressure in a spontaneously breathing patient with early severe ARDS on ECMO. Intensive Care Med. 2016;42(12):2101–2103. doi: 10.1007/s00134-016-4470-9. [DOI] [PubMed] [Google Scholar]
- 10.Yoshida T, et al. Spontaneous effort causes occult pendelluft during mechanical ventilation. Am J Respir Crit Care Med. 2013;188(12):1420–1427. doi: 10.1164/rccm.201303-0539OC. [DOI] [PubMed] [Google Scholar]
- 11.Yoshida T, et al. Volume-controlled ventilation does not prevent injurious inflation during spontaneous effort. Am J Respir Crit Care Med. 2017;196(5):590–601. doi: 10.1164/rccm.201610-1972OC. [DOI] [PubMed] [Google Scholar]
- 12.Yoshida T, et al. Reverse triggering causes an injurious inflation pattern during mechanical ventilation. Am J Respir Crit Care Med. 2018;198(8):1096–1099. doi: 10.1164/rccm.201804-0649LE. [DOI] [PubMed] [Google Scholar]
- 13.Loyd JE, et al. Effects of inspiratory resistance loading on lung fluid balance in awake sheep. J Appl Physiol. 1986;60(1):198–203. doi: 10.1152/jappl.1986.60.1.198. [DOI] [PubMed] [Google Scholar]
- 14.West JB, Mathieu-Costello O. Stress failure of pulmonary capillaries: role in lung and heart disease. Lancet. 1992;340(8822):762–767. doi: 10.1016/0140-6736(92)92301-U. [DOI] [PubMed] [Google Scholar]
- 15.Kallet RH, et al. Exacerbation of acute pulmonary edema during assisted mechanical ventilation using a low-tidal volume, lung-protective ventilator strategy. Chest. 1999;116(6):1826–1832. doi: 10.1378/chest.116.6.1826. [DOI] [PubMed] [Google Scholar]
- 16.Mauri T, et al. Esophageal and transpulmonary pressure in the clinical setting: meaning, usefulness and perspectives. Intensive Care Med. 2016;42(9):1360–1373. doi: 10.1007/s00134-016-4400-x. [DOI] [PubMed] [Google Scholar]
- 17.de Haro C, et al. Double cycling during mechanical ventilation: frequency, mechanisms, and physiologic implications. Crit Care Med. 2018;46(9):1385–1392. doi: 10.1097/CCM.0000000000003256. [DOI] [PubMed] [Google Scholar]
- 18.Beitler JR, et al. Quantifying unintended exposure to high tidal volumes from breath stacking dyssynchrony in ARDS: the BREATHE criteria. Intensive Care Med. 2016;42(9):1427–1436. doi: 10.1007/s00134-016-4423-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Pohlman MC, et al. Excessive tidal volume from breath stacking during lung-protective ventilation for acute lung injury. Crit Care Med. 2008;36(11):3019–3023. doi: 10.1097/CCM.0b013e31818b308b. [DOI] [PubMed] [Google Scholar]
- 20.Baedorf Kassis E, et al. Reverse trigger phenotypes in acute respiratory distress syndrome. Am J Respir Crit Care Med. 2021;203(1):67–77. doi: 10.1164/rccm.201907-1427OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Soundoulounaki S, et al. Airway pressure morphology and respiratory muscle activity during end-inspiratory occlusions in pressure support ventilation. Crit Care. 2020;24(1):467. doi: 10.1186/s13054-020-03169-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Bertoni M, et al. A novel non-invasive method to detect excessively high respiratory effort and dynamic transpulmonary driving pressure during mechanical ventilation. Crit Care. 2019;23(1):346. doi: 10.1186/s13054-019-2617-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Neetz B, Herth FJF, Muller MM. Treatment recommendations for mechanical ventilation of COVID19 patients. Gefässchirurgie. 2020;25:408–416. doi: 10.1007/s00772-020-00702-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Gattinoni L, et al. Bench-to-bedside review: chest wall elastance in acute lung injury/acute respiratory distress syndrome patients. Crit Care. 2004;8(5):350–355. doi: 10.1186/cc2854. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Yoshida T, et al. Esophageal manometry and regional transpulmonary pressure in lung injury. Am J Respir Crit Care Med. 2018;197(8):1018–1026. doi: 10.1164/rccm.201709-1806OC. [DOI] [PubMed] [Google Scholar]
- 26.Amato MB, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med. 2015;372(8):747–755. doi: 10.1056/NEJMsa1410639. [DOI] [PubMed] [Google Scholar]
- 27.Chiumello D, et al. Airway driving pressure and lung stress in ARDS patients. Crit Care. 2016;20:276. doi: 10.1186/s13054-016-1446-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Bellani G, et al. Driving pressure is associated with outcome during assisted ventilation in acute respiratory distress syndrome. Anesthesiology. 2019;131(3):594–604. doi: 10.1097/ALN.0000000000002846. [DOI] [PubMed] [Google Scholar]
- 29.Vaporidi K, et al. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 2020;201(1):20–32. doi: 10.1164/rccm.201903-0596SO. [DOI] [PubMed] [Google Scholar]
- 30.Holle RH, Schoene RB, Pavlin EJ. Effect of respiratory muscle weakness on P0.1 induced by partial curarization. J Appl Physiol Respir Environ Exerc Physiol. 1984;57(4):1150–1157. doi: 10.1152/jappl.1984.57.4.1150. [DOI] [PubMed] [Google Scholar]
- 31.Kera T, Aihara A, Inomata T. Reliability of airway occlusion pressure as an index of respiratory motor output. respir care. 2013;58(5):845–849. doi: 10.4187/respcare.01717. [DOI] [PubMed] [Google Scholar]
- 32.Rittayamai N, et al. Effect of inspiratory synchronization during pressure-controlled ventilation on lung distension and inspiratory effort. Ann Intensive Care. 2017;7(1):100. doi: 10.1186/s13613-017-0324-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Bertoni M, Spadaro S, Goligher EC. Monitoring patient respiratory effort during mechanical ventilation: lung and diaphragm-protective ventilation. Crit Care. 2020;24(1):106. doi: 10.1186/s13054-020-2777-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.de Vries H, et al. Assessing breathing effort in mechanical ventilation: physiology and clinical implications. Ann Transl Med. 2018;6(19):387. doi: 10.21037/atm.2018.05.53. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Mezidi M, Guerin C. Complete assessment of respiratory mechanics during pressure support ventilation. Intensive Care Med. 2019;45(4):557–558. doi: 10.1007/s00134-018-5490-4. [DOI] [PubMed] [Google Scholar]
- 36.Roesthuis L, van den Berg M, van der Hoeven H. Non-invasive method to detect high respiratory effort and transpulmonary driving pressures in COVID-19 patients during mechanical ventilation. Ann Intensive Care. 2021;11(1):26. doi: 10.1186/s13613-021-00821-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Yoshida T, Amato MBP, Kavanagh BP. Understanding spontaneous vs. ventilator breaths: impact and monitoring. Intensive Care Med. 2018;44(12):2235–2238. doi: 10.1007/s00134-018-5145-5. [DOI] [PubMed] [Google Scholar]
- 38.Grieco DL, Chen L, Brochard L. Transpulmonary pressure: importance and limits. Ann Transl Med. 2017;5(14):285. doi: 10.21037/atm.2017.07.22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Mauri T, et al. Spontaneous breathing: a double-edged sword to handle with care. Ann Transl Med. 2017;5(14):292. doi: 10.21037/atm.2017.06.55. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Morais CCA, et al. High positive end-expiratory pressure renders spontaneous effort noninjurious. Am J Respir Crit Care Med. 2018;197(10):1285–1296. doi: 10.1164/rccm.201706-1244OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Dianti J, Bertoni M, Goligher EC. Monitoring patient-ventilator interaction by an end-expiratory occlusion maneuver. Intensive Care Med. 2020;46(12):2338–2341. doi: 10.1007/s00134-020-06167-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Marini JJ, Gattinoni L. Time course of evolving ventilator-induced lung injury: the “shrinking baby lung”. Crit Care Med. 2020;48(8):1203–1209. doi: 10.1097/CCM.0000000000004416. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Iotti GA, et al. Respiratory mechanics by least squares fitting in mechanically ventilated patients: applications during paralysis and during pressure support ventilation. Intensive Care Med. 1995;21(5):406–413. doi: 10.1007/BF01707409. [DOI] [PubMed] [Google Scholar]
- 44.Cereda M, et al. Imaging the injured lung: mechanisms of action and clinical use. Anesthesiology. 2019;131(3):716–749. doi: 10.1097/ALN.0000000000002583. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Gillies D, et al. Heat and moisture exchangers versus heated humidifiers for mechanically ventilated adults and children. Cochrane Database Syst Rev. 2017 doi: 10.1002/14651858.CD004711.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Van de Graaff WB, et al. Pressure support. Changes in ventilatory pattern and components of the work of breathing. Chest. 1991;100(4):1082–1089. doi: 10.1378/chest.100.4.1082. [DOI] [PubMed] [Google Scholar]
- 47.Alberti A, et al. P0.1 is a useful parameter in setting the level of pressure support ventilation. Intensive Care Med. 1995;21(7):547–553. doi: 10.1007/BF01700158. [DOI] [PubMed] [Google Scholar]
- 48.Chiumello D, et al. Effect of different inspiratory rise time and cycling off criteria during pressure support ventilation in patients recovering from acute lung injury. Crit Care Med. 2003;31(11):2604–2610. doi: 10.1097/01.CCM.0000089939.11032.36. [DOI] [PubMed] [Google Scholar]
- 49.Doorduin J, et al. Partial neuromuscular blockade during partial ventilatory support in sedated patients with high tidal volumes. Am J Respir Crit Care Med. 2017;195(8):1033–1042. doi: 10.1164/rccm.201605-1016OC. [DOI] [PubMed] [Google Scholar]
- 50.Somhorst P, Groot MW, Gommers D. Partial neuromuscular blockage to promote weaning from mechanical ventilation in severe ARDS: a case report. Respir Med Case Rep. 2018;25:225–227. doi: 10.1016/j.rmcr.2018.09.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Mauri T, et al. Control of respiratory drive and effort in extracorporeal membrane oxygenation patients recovering from severe acute respiratory distress syndrome. Anesthesiology. 2016;125(1):159–167. doi: 10.1097/ALN.0000000000001103. [DOI] [PubMed] [Google Scholar]
- 52.Crotti S, et al. Spontaneous breathing during extracorporeal membrane oxygenation in acute respiratory failure. Anesthesiology. 2017;126(4):678–687. doi: 10.1097/ALN.0000000000001546. [DOI] [PubMed] [Google Scholar]