Summary
Le plasma riche en plaquettes (PRP) possède des fonctions trophiques du fait d’une concentration importante en facteurs de croissance et cytokines. Ces propriétés peuvent avoir un intérêt thérapeutique dans la prise en charge des lésions de brûlures. En préparation d’une étude clinique au centre de traitement des brûlés de Lyon sur le PRP comme inducteur de la cicatrisation chez le brûlé, nous avons réalisé une revue de la littérature s’intéressant aux résultats de l’utilisation de cette thérapeutique. Elle a été réalisée en interrogeant la base de données PUBMED à l’aide des mots clés [platelet rich plasma] AND [burns]. Les études contrôlées, cliniques ou pré-cliniques, en langue anglaise ou française, ont été incluses. Onze articles ont été inclus, dont huit études pré- cliniques sur modèle animal et trois études cliniques. Les effets du PRP sur la cicatrisation des zones brûlées, qu’elles soient greffées ou non, sur l’amélioration des douleurs neuropathiques, sur la trophicité cutanée à distance y sont traitées. Les résultats des études pré- cliniques récentes montrent des durées d’épithélialisation plus courtes grâce au PRP. Chez l’homme, une étude d’effectif significatif (201 patients) valide son utilisation en association avec des greffes de peaux minces et une autre montre des bénéfices sur la trophicité cutanée à distance. En conclusion, l’utilisation de PRP en application topique ou en injection sous cutanée présente un intérêt potentiel dans la prise en charge en aigu des brûlures. Une série de grande ampleur valide son utilisation en pratique clinique.
Keywords: plasma riche en plaquettes, brûlés, réparation tissulaire, greffes cutanées, revue de littérature
Abstract
Platelet rich plasma (PRP) has trophic functions due to a high concentration of growth factors and cytokines. These properties may be of therapeutic interest in the management of burn injuries. In preparation for a clinical study at the Lyon Burn Centre on PRP as an inducer of healing in burns, we carried out a review of the literature looking at the results of the use of this therapy. A review of the literature on the use of PRP for the treatment of burn injuries was performed by querying the PUBMED database using the keywords [platelet rich plasma] AND [burns]. Controlled clinical or pre-clinical studies in English or French were included. Eleven articles were identified, consisting of eight preclinical animal model studies and three clinical studies. These looked at the effects of PRP on the healing of burned areas whether they were grafted or not, on the improvement of neuropathic pain, and on distant skin trophicity. The results of recent preclinical studies show shorter epithelialization times thanks to PRP. In humans, a significant study (201 patients) validates its use in combination with thin skin grafts, and another shows benefits on distant cutaneous trophicity. In conclusion, the use of PRP topically or by injection under the skin has a potential benefit in the management of acute burns. A large-scale series validates its use in clinical practice.
Introduction
Le plasma riche en plaquettes (PRP) ou concentré plaquettaire autologue est obtenu par centrifugation d’un volume sanguin anticoagulé permettant d’extraire une fraction de ce volume comportant principalement des plaquettes et du sérum. Il est généralement admis que sa concentration plaquettaire est trois à cinq fois plus élevée que le sang total soit entre 800 000 et 1 000 000 de plaquettes/mm3.1 Ses propriétés utilisables en pratique clinique sont principalement liées : à sa viscosité, permettant un effet de colle biologique ; à son action hémostatique et aux nombreux facteurs de croissance contenus dans les granules des plaquettes, relarguées dans le milieux environnant lors de l’agrégation plaquettaire.2 Les plaquettes sont fortement impliquées dans la promotion de la cicatrisation à sa phase très précoce. Dans les suites immédiates d’une effraction cutanée, les plaquettes vont s’agréger et s’activer, assurant l’hémostase conjointement en formant avec les réseaux de fibrine le clou plaquettaire. Les granules alpha des plaquettes relarguent alors les médiateurs (platelet-derived growth factor- PDGF ; fibroblast growth factor- FGF ; transforming growth factor-TGF ; platelet factor interleukin- IL ; plateletderived angiogenesis factor – PDAF ; vascular endothelial growth factor- VEGF ; epidermal growth factor- EGF ; insulin-like growth factor - IGF et fibronectine) permettant le recrutement de macrophages, la prolifération des fibroblastes, des cellules endothéliales et des cellules mésenchymateuses, par chimiotactisme.3-6 Leur action permet donc d’une part la coagulation, mais module également la réponse immunitaire, l’angiogenèse et les processus de cicatrisation.7,8 La première utilisation thérapeutique du PRP est rapporté en 1987. Il s’agissait d’un cas de chirurgie cardiaque en Italie.9 Depuis le PRP a été utilisé dans le traitement des fractures, des défects osseux, des plaies réfractaires ou en chirurgie orale, parodontale, maxillo-faciale avec notamment la stimulation de l’ostéogenèse après résection de kystes maxillomandibulaires. 10-14 Les possibilités thérapeutiques semblent également prometteuses en ophtalmologie (dans le traitement de la rétinopathie diabétique) et en médecine esthétique.15-17 Chez le patient brûlé, la première utilisation est rapportée par Stuart en 1988.10 Il est alors utilisé à visée hémostatique sous les greffes de peau, pour limiter les pertes sanguines et les risques d’échec des prises de greffes liés à un hématome. Une utilisation en topique sous des greffes de peau de mains brûlées a rapidement suivi.18 Au cours de ces premières études, un effet bénéfique sur l’adhérence mais également la cicatrisation des zones greffées est rapporté.
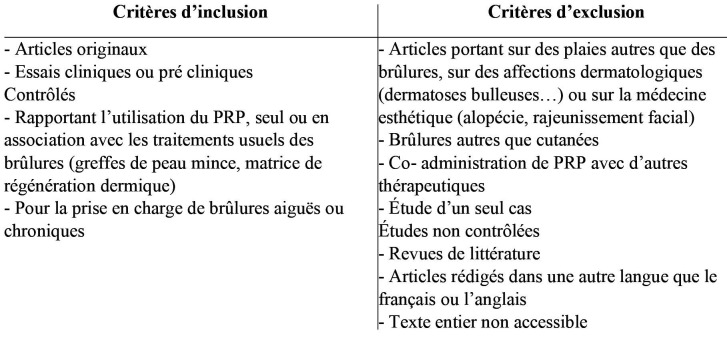
Matériel et méthodes
Une revue systématique de la littérature a été conduite en juillet 2020, à partir de la base de données PubMed. Les termes recherchés étaient les mots clés MeSH [platelet rich plasma] AND [burns]. Le but était de réaliser un résumé critique des résultats observés dans les études les plus pertinentes utilisant le PRP comme facteur de promotion de la cicatrisation dans le traitement des lésions de brûlure. Les articles repérés étaient lus intégralement et les bibliographies étaient examinées pour inclure d’éventuelles études additionnelles. Les critères d’inclusion et d’exclusion des articles sélectionnés dans la revue sont listés dans le Tableau I. Toutes les études cliniques et pré- cliniques comparatives et contrôlées s’intéressant à l’utilisation du PRP dans la brûlure ont été incluses. Les études portant sur les plaies non issues de brûlures ou sur les brûlures associées à d’autres plaies ont été exclues. Les plaies par abrasion mécanique n’étaient pas considérées comme des brûlures. Les études portant sur des brûlures autres que cutanées (oculaires notamment) n’ont pas été retenues. Le PRP devait être utilisé seul, en application topique ou en injection sous cutanée. Les seules associations autorisées pour notre revue étaient celle du PRP avec une greffe de peau mince ou une matrice de régénération dermique.
Tableau I. Critères d'inclusion et d'exclusion.
Résultats
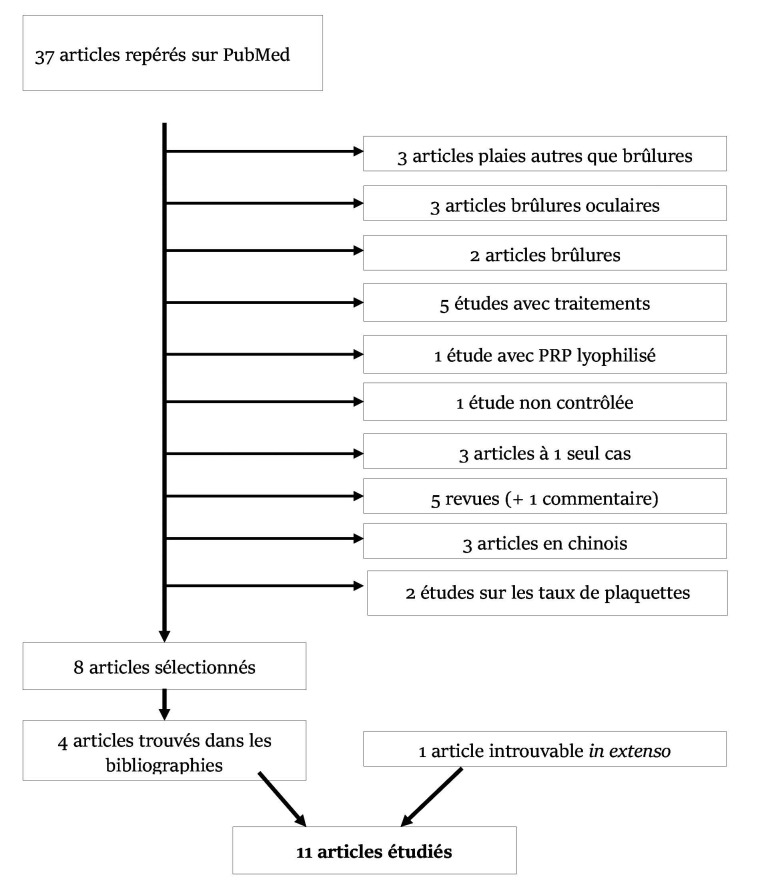
L’interrogation de la base de données PubMed a permis de sélectionner 37 articles (Fig. 1). Parmi ces articles, trois études portant sur des plaies non issues de brûlures, trois études portant sur des brûlures oculaires et deux sur des brûlures oesophagiennes ont été exclues.19-26 Les études utilisant de la colle de fibrine (fibrin glue, fibrin sealant), des facteurs de croissance isolés ou le PRP associé à des cellules mésenchymateuses graisseuses ou des cellules souches amniotiques n’ont pas été incluses du fait de la différence de composition avec le PRP.27-31 Une étude utilisant du PRP lyophilisé a été écartée, le protocole d’obtention du PRP par cultures itératives de fibroblastes étant trop éloigné du protocole d’obtention des autres études.32 De même les études portant sur un seul cas (trois études), les études non contrôlées (une étude), les revues de littérature (cinq études) et les articles en langue étrangère (trois études) autre que l’anglais n’ont pas retenu notre attention.,5,19,33-42 Enfin, une étude s’avérait être un commentaire sur une des revues de littérature et deux dernières s’intéressaient à la composition et à l’évolution du taux de plaquettes chez le brûlé.4,43,44 Après exclusion des études précédemment citées, huit articles ont été sélectionnés. La lecture de leur bibliographie a permis d’en inclure trois de plus soit 11: huit études pré- cliniques et trois études cliniques (Tableaux II et III). La diversité des protocoles et des indications au sein de ces différents articles est trop variable pour permettre la réalisation d’une méta analyse des résultats, mais un résumé critique de ces différentes études a été réalisé. La majorité de ces études s’intéresse à la promotion de la cicatrisation par utilisation du PRP, une seule s’intéresse à la diminution des douleurs neuropathiques. Toutes les brûlures sont au moins du 2ème degré profond soit avec un potentiel de guérison spontanée limité.
Fig. 1. Processus de sélection.
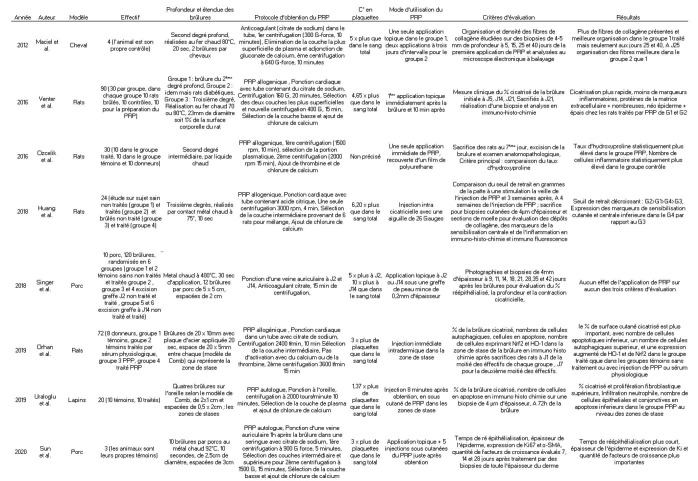
Tableau II. Listes des études pré- cliniques.
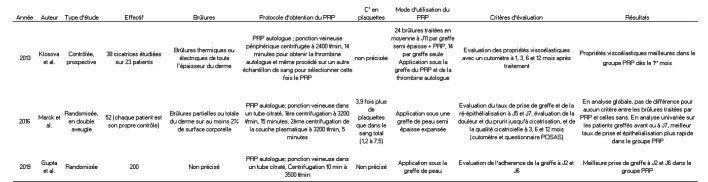
Tableau III. Liste des études cliniques.
Études précliniques
PRP et cicatrisation des zones brûlées. Dans son étude de 2012, Maciel appliquait une ou deux fois du PRP sur des brûlures chez quatre chevaux.45 Chaque cheval possédait sa brûlure contrôle, celle- ci étant couverte d’une gaze de sérum physiologique. Les biopsies des 5ème et 15ème jours ne montraient pas de différence du nombre de fibres de collagène ni de leur organisation. En revanche, les fibres de collagène étaient mieux organisées et plus nombreuses sur les biopsies des 25ème et 40ème jours sans influence du nombre d’applications de PRP. Ozcelik retrouvait, en 2016, un taux tissulaire d’hydroxyproline (acide aminé présent quasi exclusivement dans le collagène) plus élevé (résultat statistiquement significatif) chez les rats sur les brûlures desquels on avait appliqué du PRP par rapport aux rats dont la brûlure avait juste reçue du sérum physiologique.46 Autre effet positif, l’infiltration de cellules inflammatoires était significativement moins importante dans le groupe PRP. Au niveau macroscopique, il n’était pas observé de différence significative d’épithélialisation. Venter a quant à lui montré une augmentation significative du pourcentage de brûlures macroscopiquement cicatrisées sur des rats, diabétiques ou non, traités par deux applications de PRP.47 Chez les rats traités par PRP qu’ils soient diabétiques ou non, il retrouvait un néo- épiderme plus épais, un tissu de granulation et des dépôts de collagène plus développés et une diminution significative des marqueurs d’inflammation par rapport aux groupes contrôles. Cette étude ne montrait cependant aucun bénéfice du PRP sur les brûlures du 3ème degré. Dans l’étude prospective de Singer, réalisée sur des porcs, l’application de PRP n’a pas montré d’effet sur la ré-épithélialisation de brûlures profondes, qu’elles aient été excisées et greffées (PRP appliqué sous la greffe en adjonction à un topique antibiotique) ou non, comparativement à l’application de topique antibiotique seul et ce que l’excision greffe ait été réalisée précocement (J2) ou plus tardivement (J14).48 De même, la rétraction cicatricielle au 42ème jour était la même et il n’y avait aucune différence de profondeur de la cicatrice aux 28ème, 35ème et 42ème jours. En 2019, Orhan a mené une étude contrôlée sur les zones de stase des brûlures de 64 rats répartis en 4 groupes (degré des brûlures non précisé). Dans le premier groupe la brûlure était laissée en évolution spontanée, dans les 2ème, 3ème et 4ème groupes, on injectait du sérum physiologique, du plasma pauvre en plaquettes (PPP) et du PRP en intra dermique, dans la zone de stase de la brûlure. La surface de tissu vivant à sept jours était significativement supérieure (69,6%) dans le groupe 4, que dans le groupe 3 (27%), le groupe 1 (21,5%), et le groupe 2 (20,8%). Le nombre de cellules en apoptose décroissait et le nombre de cellules autophagiques croissait du groupe 1 au groupe 4.49 La même année, une étude portant sur les zones de stase de vingt lapins brûlés à l’oreille a été publiée par Uraloğlu. Dix lapins recevaient une injection sous cutanée de PRP autologue dans la brûlure, les dix autres une injection de sérum physiologique.50
À 72 heures de la brûlure, la ré-épithélialisation et le nombre de fibroblastes étaient significativement supérieurs dans le groupe PRP que dans le groupe contrôle. En outre, le nombre de cellules épithéliales et conjonctives en apoptose ainsi que l’infiltration neutrophile étaient significativement inferieurs dans le groupe PRP. Enfin, la surface de tissu viable dans les zones de stase était significativement plus élevée dans le groupe PRP. Enfin, une étude chinoise récente (publiée en 2020) de Sun, a réussi à mettre en évidence des résultats positifs et significatifs en terme de vitesse de cicatrisation et d’épaisseur de l’épiderme.51 En effet, il a montré que le temps de ré épithélialisation d’une brûlures profonde (brûlure partielle du derme) chez des cochons est inférieur (16,67 versus 19,33 jours) et que l’épaisseur de cet épiderme est plus importante (100.47 ± 19.03 μm versus 82.10 ± 16.09 μm) au 28ème jour, grâce à des injections sous cutanées superficielles, dans le lit de la brûlure, de PRP autologue faites en une fois, en comparaison de brûlures laissées en cicatrisation dirigée avec des pansements au sérum physiologique.
PRP et douleurs neuropathiques. Huang a montré que le PRP en injection sous cutanée dans des cicatrices de brûlures permet une réduction des douleurs neuropathiques (seuil de retrait à la douleur significativement plus élevé) chez des rats brûlés cicatrisés.52 De plus, chez les rats brûlés traités par PRP, Huang observait une réduction de l’expression des marqueurs de la sensibilisation centrale et de l’inflammation au niveau cutané et de la moelle épinière par rapport aux rats brûlés non traités par PRP.
Études cliniques
PRP et cicatrisation des brûlures greffées. Klosová et al. ont montré en 2013 que les propriétés viscoélastiques des cicatrices de brûlures profondes traitées avec la combinaison d’une greffe de peau semi épaisse et d’une application de concentré de plaquettes et de thrombine autologue sont meilleures que celles des zones traitées par greffe seule, à un, trois, six et douze mois des brûlures.53 Dans son essai contrôlé randomisé en double aveugle, Marck n’a pas réussi à mettre en évidence de différence significative d’épithélialisation ou de taux de greffes cicatrisées entre J5 et J7, ni de qualité cicatricielle à 3, 6 et 12 mois entre le groupe ayant reçu une application de PRP sous la greffe expansée et le groupe avec greffe seule.54 Même l’analyse en sous-groupes (délai avant la chirurgie, taille de la brûlure traitée, pourcentage de surface corporelle brûlée, nombre de plaquettes dans le PRP, âge, taille de l’expansion) n’a montré aucun bénéfice significatif du PRP. Néanmoins l’auteure retrouvait en analyse univariée une épithélialisation plus rapide (18 jours dans le groupe PRP versus 20 jours soit une différence de 12,7% ; p 0,036) et un meilleur taux de prise des greffes à l’évaluation de J5-J7 pour les patients ayant été opérés avant 8 jours (effectif de 11 patients). Dans une étude indienne de Gupta, contrôlée, randomisée, menée de 2017 à 2019 incluant 200 patients brûlés prêts à être greffés et répartis en deux groupes, le taux de prise de greffe était significativement supérieur dans le groupe PRP au 2ème (85 versus 70%) et au 6ème jour (89 versus 76%).55
Discussion
Chez l’animal, on retrouve des résultats plutôt positifs. Les études les plus anciennes présentent des résultats microscopiques positifs et significatifs en terme d’organisation des fibres de collagène, de réparation de la matrice extracellulaire, d’épaisseur du néo épiderme et d’infiltration de cellules inflammatoire.45-47 Seules les études récentes retrouvent des résultats macroscopiques significatifs avec une surface de tissu vivant supérieure et une réépithélialisation plus rapide grâce au PRP.49,50
Les brûlures sont pourvoyeuses de douleurs neuropathiques. Et une étude s’y est intéressée : chez le rat, l’injection intra cicatricielle de PRP permet de réduire l’expression des marqueurs de douleur neuropathique.52 Chez l’homme, Marck n’a pas réussi à mettre en évidence de différence significative concernant l’épithélialisation et le taux de greffes cicatrisées à J5 et J7.54 Ces deux derniers critères sont toutefois significativement meilleurs en analyse univariée chez les patients opérés précocement. Gupta a montré qu’avec une application de PRP sous la greffe de peau, le taux de prise de cette greffe est significativement plus grand à J2 et à J6 de la greffe. Cependant cette étude semble avoir de grandes lacunes méthodologiques : aucune précision sur la composition du PRP n’est apportée, l’auteur ne précise pas la profondeur des brûlures, les surfaces brûlées ni le délai entre la brûlure et la greffe de peau.55 Les résultats de Klosová sont également positifs ; elle a montré que les propriétés viscoélastiques des cicatrices de brûlures greffées étaient meilleures avec adjonction de PRP.53 L’étude des articles non inclus apporte également des éléments encourageant le développement de cette thérapeutique dans notre centre, pour obtenir une cicatrisation plus rapide. Kakudo a montré, chez un patient brûlé au 3ème degré, que l’épithélialisation du site donneur (peau prélevée au dermatome électrique d’une épaisseur de 0,5mm) progresse plus rapidement (11 versus 13 jours) avec l’application locale répétée (J1, 2, 3, 5, 7, 9, 11 et 13) de PRP par rapport à l’application de sérum physiologique.5 Dans une étude incluant 30 patients divisés en deux groupes, les sites de prélèvements cicatrisaient en un temps statistiquement inferieur dans le groupe ayant reçu une application de PRP (13,89 jours contre 17,73) et le score de Vancouver était significativement inferieur dans ce même groupe, à 4, 12 et 52 semaines après la brûlures.56 Signalons tout de même que, sur l’effectif total, seuls dix patients étaient des brûlés. Danielsen n’a quant à lui pas réussi à mettre en évidence de différence significative sur l’épithélialisation des sites donneurs.57 Cette absence de différence peut être expliquée par l’absence de renouvellement de l’application de PRP (une seule application contre plusieurs dans l’étude de Kakudo). Une étude chinoise de 2010 a mis en évidence un taux de guérison significativement plus important avec le traitement combiné (application de PRP et d’une matrice dermique acellulaire) comparé au traitement avec matrice dermique acellulaire seule sur des brûlures du 2ème degré profond (75 versus 62% à J14 et 88 versus 73% à J21).58 Cette étude portant sur 30 patients brûlés sur 10 à 48% retrouvait également un taux significativement plus bas d’infection au 7ème jour dans le groupe PRP. La méthodologie n’a pu être analysée du fait de la barrière de la langue. Une étude tchèque non contrôlée de 18 patients avec des brûlures des 2ème et 3ème degrés démontrait une réduction précoce des douleurs, de l’utilisation d’antalgiques et anti prurigineux, du temps d’hospitalisation et des coûts quand du PRP était combiné à l’excision greffe.39 Enfin, Andreone a obtenu une cicatrisation complète en sept à dix jours de brûlure chronique chez deux patients par application de PRP en spray et de microgreffes en pastilles sur du derme artificiel posé au préalable, alors que la greffe de peau mince initiale avait été un échec.59 Notons, comme précédemment, l’absence de groupe contrôle. En ce qui concerne la corrélation entre concentration en facteurs de croissance et taux de plaquettes, les études divergent.4,60,61 Le sexe, l’âge, la surface brûlée, la présence d’un sepsis pourraient influencer la concentration en facteurs de croissance du PRP, avec une variabilité inter individus importante.34,61 Certains auteurs se sont affranchis de ce risque en préparant leur PRP avec des animaux autres que ceux brûlés.46,47,49,52,62 Les facteurs de croissance seraient présents en concentration comparable chez le brûlé et chez le sujet sain, malgré la réaction systémique induite par la brûlure.4 Cette question a d’autant plus d’importance que Marck et d’autres auteurs ont montré que le taux plaquettaire des brûlés atteint son niveau le plus bas à J3 puis un pic vers J14 avant le retour à des taux normaux.44,63-65 Cette modification du taux de plaquettes chez le brûlé a donc un effet direct sur la concentration plaquettaire du PRP, en fonction du jour de prélèvement. Marck ne retrouve pas de différence significative entre le ratio de plaquettes dans le PRP/sang total des patients brûlés et celui chez les patients sains (4,7 versus 4,2 avec p :0,78) ni de concentration en facteurs de croissance.4 Par contre une étude ayant suivi six patients brûlés sur une surface moyenne de 15% pendant 1 mois retrouvait, grâce à des dosages de leurs marqueurs d’activation plaquettaire et de leur facteurs de croissance, que les plaquettes des sujets brûlés étaient peu activées mais qu’elles restaient néanmoins fonctionnelles.44 Les cicatrices de brûlures, qu’elles aient été greffées ou non, sont souvent hypertrophiques et pathologiques. Outre ses qualités en matière de cicatrisation, le PRP pourrait avoir de bonnes indications dans la prévention de ces cicatrices pathologiques, mais il pourrait tout autant être pourvoyeur de cicatrices hypertrophiques. L’absence de fibres élastiques dans le derme du site cicatrisé avec PRP (seulement des fibres de collagène) doit amener à s’interroger sur une éventuelle possible moins bonne cicatrisation, malgré une durée de cicatrisation plus courte.5 Peu d’études ont réalisé un suivi à long terme de cicatrices de brûlures traitées par PRP.53,54 Prochazka a étudié la qualité cicatricielle de brûlures du second degré profond excisées et greffées avec adjonction de PRP montrant de bons résultats, sans qu’il soit possible d’en tirer une conclusion car s’agissant d’une étude non comparative.39 Ruiz a présenté en 2018 le cas d’une patiente brûlée dont la qualité cicatricielle était nettement améliorée (selon l’échelle de Vancouver) sur 10 mois avec des applications répétées de PRP. Ce rapport d’un seul cas n’a pas été inclus à l’analyse.37 Il existe trop de disparités dans la réalisation des études, notamment liées à l’hétérogénéité des protocoles d’obtention, d’application du PRP et des techniques de greffe (épaisseur du prélèvement qui diffère, délai avant la greffe…). L’obtention du PRP repose sur la centrifugation d’un prélèvement sanguin standard anticoagulé, à la différence du PRF (« platelet rich fibrin ») qui n’utilise pas d’anticoagulant. Pour reproduire l’activation physiologique des plaquettes lors de l’agrégation, l’adjonction de chlorure de calcium ou de thrombine est nécessaire. Des études n’ont néanmoins pas ajouté d’activateur.48,49 Récemment, un nouveau système de classification a été proposé par Harrison et al, dans le but de systématiser les études faites sur le PRP.66 Malheureusement les études ne l’utilisent pas. Concernant les protocoles d’utilisation, peu d’études ont renouvelé l’application du PRP.5,35 Les études cliniques sont très peu nombreuses et les études animales utilisent des effectifs trop restreints. L’animal présente des caractéristiques anatomiques et physiologiques différentes de l’homme, ce qui limite l’extrapolation des résultats aux patients. Aucune étude n’a à ce jour étudié les effets du PRP en injection sous cutanée dans le traitement des brûlures chez l’homme. Deux études animales récentes ayant réussi à obtenir des résultats significatifs sur la réduction du temps de ré-épithélialisation et il semblerait que l’utilisation en injection sous cutanée ou intra dermique soit une des pistes de recherche à mettre en oeuvre dans le futur. Tout comme les précédentes revues de la littérature sur le sujet, cette revue ne permet pas de conclure.19,33-36 Néanmoins, à l’issue de cette revue il apparaît licite de proposer ce traitement à nos patients. Dans un premier temps il serait judicieux de limiter son utilisation à des brûlures peu étendues du 2ème degré profond ou du 3ème degré, nécessitant un traitement chirurgical par greffe de peau et présentant des facteurs de risque de mauvaise cicatrisation. L’injection sous cutanée dans le lit de la brûlure sous la greffe de peau semble être la meilleure méthode d’utilisation. En ce qui concerne les grands brûlés, le PRP est d’obtention plus rapide que les cultures de kératinocytes autologues (3 semaines) mais les volumes obtenus sont faibles et ne permettent pas une application sur de grandes surfaces. Ces greffes séquentielles de cellules cutanées cultivées dans des milieux enrichis avec du PRP méritent d’ailleurs leur place dans l’arsenal de traitement des brûlés.67 Dans l’avenir, de nouvelles questions viendront. Il sera intéressant de comparer le temps de cicatrisation d’un site de prélèvement de greffe avec application de feuillets de kératinocytes par rapport à l’application de PRP, le taux de prise de greffe sur une brûlure profonde excisée avec adjonction de PRP versus greffes en sandwich…
Conclusion
Chez l’animal, les résultats macroscopiques en termes d’épithélialisation sont positifs mais dans l’ensemble non significatifs. Les résultats microscopiques sont positifs et significatifs : augmentation d’un composant du collagène, réparation de la matrice extracellulaire, diminution des marqueurs de douleur neuropathique. Chez l’homme, malgré l’absence de différence significative du taux de plaquettes et de la concentration en facteurs de croissance entre les patients brûlés et les patients sains, aucune différence significative n’a pu être montrée sur l’épithélialisation, la réduction des douleurs, le prurit et le taux de complications. En revanche, la prise de greffe et les propriétés viscoélastiques semblent améliorées par le PRP. Même si cette revue ne permet pas de conclure au bénéfice clinique certain de l’utilisation du PRP sur les brûlés, elle encourage à se lancer dans l’écriture d’un protocole d’utilisation du PRP sur nos patients du centre Pierre Colson de l’hôpital Edouard Herriot à Lyon.
Acknowledgments
Conflit d’intérêt.Les auteurs déclarent ne pas avoir de liens d’intérêts.
References
- 1.Pietrzak W, Eppley B. Platelet rich plasma: biology and new technology. J Craniofac Surg. 2005;16:1043–1054. doi: 10.1097/01.scs.0000186454.07097.bf. [DOI] [PubMed] [Google Scholar]
- 2.Eppley B, Pietrzak W, Blanton M. Platelet-rich plasma: a review of biology and applications in plastic surgery. Plast Reconstr Surg. 2006;118:147e–159e. doi: 10.1097/01.prs.0000239606.92676.cf. [DOI] [PubMed] [Google Scholar]
- 3.Lubkowska A, Dolegowska B, Banfi G. Growth factor content in PRP and their applicability in medicine. J Biol Regul Homeost Agents. 2012;26 (2 Suppl 1):3S–22S. [PubMed] [Google Scholar]
- 4.Marck R, Gardien K, Vlig M. Growth factor quantification of platelet-rich plasma in burn patients compared to matched healthy volunteers. Int J Mol Sci. 2019;20:288. doi: 10.3390/ijms20020288. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Kakudo N, Kushida S, Minakata T. Platelet-rich plasma promotes epithelialization and angiogenesis in a split thickness skin graft donor site. Med Mol Morpho. 2011;44:233–236. doi: 10.1007/s00795-010-0532-1. [DOI] [PubMed] [Google Scholar]
- 6.Pierce G, Mustoe T, Altrock B. Role of platelet-derived growth factor in wound healing. J Cell Biochem. 1991;45:319–326. doi: 10.1002/jcb.240450403. [DOI] [PubMed] [Google Scholar]
- 7.Eppley B, Woodell J, Higgins J. Platelet quantification and growth factor analysis from platelet-rich plasma: implications for wound healing. Plast Reconstr Surg. 2004;114:1502–1508. doi: 10.1097/01.prs.0000138251.07040.51. [DOI] [PubMed] [Google Scholar]
- 8.Knighton D, Ciresi K, Fiegel V. Stimulation of repair in chronic, nonhealing, cutaneous ulcers using platelet-derived wound healing formula. Surg Gynecol Obstet. 1990;170:56–60. [PubMed] [Google Scholar]
- 9.Ferrari M, Zia S, Valbonesi M. A new technique for hemodilution, preparation of autologous platelet-rich plasma and intraoperative blood salvage in cardiac surgery. Int J Artif Organs. 1987;10:47–50. [PubMed] [Google Scholar]
- 10.Marx R, Carlson E, Eichstaedt R. latelet-rich plasma: growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;85:638–646. doi: 10.1016/s1079-2104(98)90029-4. [DOI] [PubMed] [Google Scholar]
- 11.El-Sharkawy H, Kantarci A, Deady J. Platelet-rich plasma: growth factors and pro- and anti-inflammatory properties. J Periodontol. 2007;78:661–669. doi: 10.1902/jop.2007.060302. [DOI] [PubMed] [Google Scholar]
- 12.Petrungaro P. Using platelet-rich plasma to accelerate soft tissue maturation in esthetic periodontal surgery. Compend Contin Educ Dent. 2001;22:729–732. [PubMed] [Google Scholar]
- 13.de Obarrio J, Araúz-Dutari J, Chamberlain T. The use of autologous growth factors in periodontal surgical therapy: platelet gel biotechnology - case reports. Int J Periodontics Restorative Dent. 2000;20:486–497. [PubMed] [Google Scholar]
- 14.Moro G, Casini V, Bastieri A. Use of platelet-rich plasma in major maxillary sinus augmentation. Minerva Stomatol. 2003;52:267–271. [PubMed] [Google Scholar]
- 15.Cervelli V, Gentile P, Scioli M. Application of plateletrich plasma in plastic surgery: clinical and in vitro evaluation. Tissue Eng Part C Methods. 2009;15:625–634. doi: 10.1089/ten.TEC.2008.0518. [DOI] [PubMed] [Google Scholar]
- 16.Cervelli V, Palla L, Pascali M. Autologous platelet-rich plasma mixed with purified fat graft in aesthetic plastic surgery. Aesthetic Plast Surg. 2009;33:716–721. doi: 10.1007/s00266-009-9386-0. [DOI] [PubMed] [Google Scholar]
- 17.Man D, Plosker H, Winland-Brown J. The use of autologous platelet-rich plasma (platelet gel) and autologous platelet-poor plasma (fibrin glue) in cosmetic surgery. Plast Reconstr Surg. 2001;107:229–237. doi: 10.1097/00006534-200101000-00037. [DOI] [PubMed] [Google Scholar]
- 18.Stuart J, Morgan R, Kenney J. Single-donor fibrin glue for hand burns. Ann Plast Surg. 1990;24:524–527. doi: 10.1097/00000637-199006000-00009. [DOI] [PubMed] [Google Scholar]
- 19.Merchán W, Chasoy M, Alfonso C. Platelet-rich plasma, a powerful tool in dermatology. J Tissue Eng Regen Med. 2019;13:892–901. doi: 10.1002/term.2832. [DOI] [PubMed] [Google Scholar]
- 20.Ashraf A, Younis M, Shaimaa D. The histopathological evidence of improved split thickness skin graft outcomes on using the autologous platelet-rich plasma: a prospective controlled clinical study. The Egyptian Journal of Medical Sciences. 2016;37:1013–1025. [Google Scholar]
- 21.Cialdai F, Colciago A, Pantalone D. Effect of unloading condition on the healing process and effectiveness of platelet rich plasma as a countermeasure: study on in vivo and in vitro wound healing models. Int J Mol Sci. 2020;21:407. doi: 10.3390/ijms21020407. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.De Angelis B, D’Autilio M, Orlandi F. Wound healing: in vitro and in vivo evaluation of a bio-functionalized scaffold based on hyaluronic acid and platelet-rich plasma in chronic ulcers. J Clin Med. 2019;8:1486. doi: 10.3390/jcm8091486. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Mehrannia M, Vaezi M, Yousefshahi F. Platelet rich plasma for treatment of nonhealing diabetic foot ulcers: a case report. Can J Diabetes. 2014;38:5–8. doi: 10.1016/j.jcjd.2013.08.271. [DOI] [PubMed] [Google Scholar]
- 24.Oztan M, Arslan F, Oztan S. Effects of topical application of platelet-rich plasma on esophageal stricture and oxidative stress after caustic burn in rats: is autologous treatment possible? J Pediatr Surg. 2019;54:1397–1404. doi: 10.1016/j.jpedsurg.2018.07.018. [DOI] [PubMed] [Google Scholar]
- 25.Gentile P, De Angelis B, Pasin M. Adipose-derived stromal vascular fraction cells and platelet-rich plasma: basic and clinical evaluation for cell-based therapies in patients with scars on the face. J Craniofac Surg. 2014;25:267–272. doi: 10.1097/01.scs.0000436746.21031.ba. [DOI] [PubMed] [Google Scholar]
- 26.Oztan M, Oztan S, Duzenli N. The effect of platelet-rich plasma on motility changes in experimental caustic esophageal burn. Esophagus. 2018;15:198–204. doi: 10.1007/s10388-018-0613-0. [DOI] [PubMed] [Google Scholar]
- 27.Kshersagar J, Kshirsagar R, Desai S. Decellularized amnion scaffold with activated PRP: a new paradigm dressing material for burn wound healing. Cell Tissue Bank. 2018;19:423–436. doi: 10.1007/s10561-018-9688-z. [DOI] [PubMed] [Google Scholar]
- 28.Mahmoudian-Sani MR, Rafeei F, Amini R. The effect of mesenchymal stem cells combined with platelet-rich plasma on skin wound healing. J Cosmet Dermatol. 2018;17:650–659. doi: 10.1111/jocd.12512. [DOI] [PubMed] [Google Scholar]
- 29.Hosni Ahmed H, Rashed L, Mahfouz S. Can mesenchymal stem cells pretreated with platelet-rich plasma modulate tissue remodeling in a rat with burned skin? Biochem Cell Biol. 2017;95:537–548. doi: 10.1139/bcb-2016-0224. [DOI] [PubMed] [Google Scholar]
- 30.Yao D, Hao D, Zhao F. Effects of platelet-rich plasma combined with polylactic acid/polycaprolactone on healing of pig deep soft tissue defect caused by fragment injury. Zhonghua Shao Shang Za Zhi. 2019;35:31–39. doi: 10.3760/cma.j.issn.1009-2587.2019.01.007. [DOI] [PubMed] [Google Scholar]
- 31.Lei X, Xu P, Zhang P. Effects of human adipose-derived mesenchymal stem cells and platelet-rich plasma on healing of wounds with full-thickness skin defects in mice. Zhonghua Shao Shang Za Zhi. 2018;34:887–894. doi: 10.3760/cma.j.issn.1009-2587.2018.12.013. [DOI] [PubMed] [Google Scholar]
- 32.Yeung C, Hsieh P, Wei L. Efficacy of lyophilised plateletrich plasma powder on healing rate in patients with deep second degree burn injury: a prospective double-blind randomized clinical trial. Ann Plast Surg. 2018;80 (2S Suppl 1):S66–S69. doi: 10.1097/SAP.0000000000001328. [DOI] [PubMed] [Google Scholar]
- 33.Pallua N, Wolter T, Markowicz M. Platelet-rich plasma in burns. Burns. 2010;36:4–8. doi: 10.1016/j.burns.2009.05.002. [DOI] [PubMed] [Google Scholar]
- 34.Marck R, Middelkoop E, Breederveld R. Considerations on the use of platelet-rich plasma, specifically for burn treatment. J Burn Care Res. 2014;35:219–227. doi: 10.1097/BCR.0b013e31829b334e. [DOI] [PubMed] [Google Scholar]
- 35.Picard F, Hersant B, Bosc R. Should we use platelet-rich plasma as an adjunct therapy to treat « acute wounds, » « burns, » and « laser therapies »: a review and a proposal of a quality criteria checklist for further studies. Wound Repair Regen. 2015;23:163–170. doi: 10.1111/wrr.12266. [DOI] [PubMed] [Google Scholar]
- 36.Zheng W, Zhao D, Zhao Y. Effectiveness of platelet rich plasma in burn wound healing: a systematic review and metaanalysis. J Dermatol Treat. 2020;21:1–7. doi: 10.1080/09546634.2020.1729949. [DOI] [PubMed] [Google Scholar]
- 37.Ruiz A, Cuestas D, Garcıa P. Early intervention in scar management and cutaneous burns with autologous platelet-rich plasma. J Cosmet Dermatol. 2018;17:1194–1199. doi: 10.1111/jocd.12554. [DOI] [PubMed] [Google Scholar]
- 38.Teodoreanu R, Popescu S, Lascăr I. Therapeutic protocol using growth factors in electrocution wounds-case reports and review of the literature. Romanian J Morphol Embryol. 20147;55:473–482. [PubMed] [Google Scholar]
- 39.Prochazka V, Klosova H, Stetinsky J. Addition of platelet concentrate to dermo-epidermal skin graft in deep burn trauma reduces scarring and need for revision surgeries. Biomed Pap Med Fac Univ Palacky Olomouc Czechoslov. 2014;158:242–258. doi: 10.5507/bp.2013.070. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Henderson J, Cupp C, Ross E. The effects of autologous platelet gel on wound healing. Ear Nose Throat J. 2003;82:598–602. [PubMed] [Google Scholar]
- 41.Hao T, Zhu J, Hu W. Autogenous platelet-rich plasma gel with acellular xenogeneic dermal matrix for treatment of deep II degree burns. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2010;24:647–649. [PubMed] [Google Scholar]
- 42.Yang S, Xiao C. Advances in the research of effects of autologous platelet-rich plasma on the treatment of burn wounds. Zhonghua Shao Shang Za Zhi. 2018;34:910–913. doi: 10.3760/cma.j.issn.1009-2587.2018.12.017. [DOI] [PubMed] [Google Scholar]
- 43.Curinga G, Scherer S, Rusciani A. Comments on « Platelet-rich plasma in burns ». Burns. 36:944–950. doi: 10.1016/j.burns.2009.08.018. [DOI] [PubMed] [Google Scholar]
- 44.Marck R, van der Bijl I, Korsten H. Activation, function and content of platelets in burn patients. Platelets. 2019;30:396–402. doi: 10.1080/09537104.2018.1448379. [DOI] [PubMed] [Google Scholar]
- 45.Maciel F, De Rossi R, Módolo T. Scanning electron microscopy and microbiological evaluation of equine burn wound repair after platelet-rich plasma gel treatment. Burns. 2012;38:10558–1065. doi: 10.1016/j.burns.2012.02.029. [DOI] [PubMed] [Google Scholar]
- 46.Ozcelik U, Ekici Y, Bircan H. Effect of topical plateletrich plasma on burn healing after partial-thickness burn injury. Med Sci Monit Int Med J Exp Clin Res. 2016;22:1903–1909. doi: 10.12659/MSM.895395. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Venter N, Marques R, Santos J. Use of platelet-rich plasma in deep second- and third-degree burns. Burns. 2016;42:807–814. doi: 10.1016/j.burns.2016.01.002. [DOI] [PubMed] [Google Scholar]
- 48.Singer A, Toussaint J, Chung W. The effects of platelet rich plasma on healing of full thickness burns in swine. Burns. 2018;44:1543–1550. doi: 10.1016/j.burns.2018.04.021. [DOI] [PubMed] [Google Scholar]
- 49.Orhan E, Sapmaz-Metin M, Tarladaçalışır-Topçu Y. The effect of platelet-rich plasma in inactive form on the burn zone of stasis in rats. J Plast Surg Hand Surg. 2019;53:301–308. doi: 10.1080/2000656X.2019.1614454. [DOI] [PubMed] [Google Scholar]
- 50.Uraloğlu M, Ural A, Efe G. The effect of platelet-rich plasma on the zone of stasis and apoptosis in an experimental burn model. Plast Surg (Oakv) 2019;27:173–181. doi: 10.1177/2292550318800498. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Sun Y, Cao Y, Zhao R. The role of autologous PRP on deep partial-thickness burn wound healing in bama pigs. J Burn Care Res. 2020;41:657–662. doi: 10.1093/jbcr/iraa012. [DOI] [PubMed] [Google Scholar]
- 52.Huang S, Wu S, Lee S. Platelet-rich plasma injection in burn scar areas alleviates neuropathic scar pain. Int J Med S. 2018;15:238–247. doi: 10.7150/ijms.22563. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Klosová H, Stětinský J, Bryjová I. Objective evaluation of the effect of autologous platelet concentrate on post-operative scarring in deep burns. Burns. 2013;39:1263–1276. doi: 10.1016/j.burns.2013.01.020. [DOI] [PubMed] [Google Scholar]
- 54.Marck R, Gardien K, Stekelenburg C. The application of platelet-rich plasma in the treatment of deep dermal burns: a randomized, double-blind, intra-patient controlled study. Wound Repair and Regeneration. 2016;24:712–720. doi: 10.1111/wrr.12443. [DOI] [PubMed] [Google Scholar]
- 55.Gupta S, Goil P, Thakurani S. Autologous platelet rich plasma as a preparative for resurfacing burn wounds with split thickness skin grafts. World J Plast Surg. 2020;9:29–32. doi: 10.29252/wjps.9.1.29. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Fang Z, Yang X, Wu G. The use of autologous plateletrich plasma gel increases wound healing and reduces scar development in split-thickness skin graft donor sites. J Plast Surg Hand Surg. 2019;53:356–360. doi: 10.1080/2000656X.2019.1635489. [DOI] [PubMed] [Google Scholar]
- 57.Danielsen P, Jørgensen B, Karlsmark T. Effect of topical autologous platelet-rich fibrin versus no intervention on epithelialization of donor sites and meshed split-thickness skin autografts: a randomized clinical trial. Plast Reconstr Surg. 2008;122:1431–1440. doi: 10.1097/PRS.0b013e318188202c. [DOI] [PubMed] [Google Scholar]
- 58.Hao T, Zhu J, Hu W. Autogenous platelet-rich plasma gel with acellular xenogeneic dermal matrix for treatment of deep II degree burns. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi Zhongguo Xiufu Chongjian Waike Zazhi. 2010;24:647–649. [PubMed] [Google Scholar]
- 59.Andreone A, den Hollander D. A retrospective study on the use of dermis micrografts in platelet-rich fibrin for the resurfacing of massive and chronic full-thickness burns. Stem Cells Int. 2019;2019:86360–86379. doi: 10.1155/2019/8636079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Taniguchi Y, Yoshioka T, Sugaya H. Growth factor levels in leukocyte-poor platelet-rich plasma and correlations with donor age, gender, and platelets in the Japanese population. J Exp. 2019;6:4. doi: 10.1186/s40634-019-0175-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Xiong G, Lingampalli N, Koltsov J. Men and women differ in the biochemical composition of platelet-rich plasma. Am J Sports Med. 2018;46:409–419. doi: 10.1177/0363546517740845. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Sonker A, Dubey A, Bhatnagar A. Platelet growth factors from allogeneic platelet-rich plasma for clinical improvement in split-thickness skin graft. Asian J Transfus Sci. 2015;9:155–158. doi: 10.4103/0973-6247.162712. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Marck R, Montagne H, Tuinebreijer W. Time course of thrombocytes in burn patients and its predictive value for outcome. Burns. 2013;19:714–722. doi: 10.1016/j.burns.2013.01.015. [DOI] [PubMed] [Google Scholar]
- 64.Warner P, Fields A, Braun L. Thrombocytopenia in the pediatric burn patient. J Burn Care. 2011;31:410–414. doi: 10.1097/BCR.0b013e318217f91b. [DOI] [PubMed] [Google Scholar]
- 65.George A, Bang R, Lari A. Acute thrombocytopenic crisis following burns complicated by staphylococcal septicaemia. Burns. 2001;27:84–88. doi: 10.1016/s0305-4179(00)00065-6. [DOI] [PubMed] [Google Scholar]
- 66.Harrison P. Subcommittee on platelet physiology: The use of platelets in regenerative medicine and proposal for a new classification system: guidance from the SSC of the ISTH. J Thromb Haemost. 2018;16:1895–1900. doi: 10.1111/jth.14223. [DOI] [PubMed] [Google Scholar]
- 67.Sabeh G, Sabeh M, Ishak S. Nouveau procédé: les greffes séquentielles de cellules cutanées guérissent-elles les brûlures de troisième degré? étude comparative à propos de 517 patients. Ann Burns Fire Disasters. 2018;31:213–222. [PMC free article] [PubMed] [Google Scholar]