Summary
Les bactériémies nosocomiales (BN) constituent une des infections les plus sévères chez les brûlés en réanimation. Leur pronostic est aggravé par l’émergence et la dissémination des bactéries multirésistantes (BMR). Notre étude rétrospective avait pour objectif de déterminer les caractéristiques clinico-bactériologiques des BN survenues chez les patients hospitalisés dans le service de réanimation des brûlés du Centre de Traumatologie et des Grands Brûlés en Tunisie, durant une période de 3 ans (2016-2018). Nous avons relevé 261 bactériémies chez 216 patients, soit une prévalence de 25,7% et une densité d’incidence de 13,4‰ journées d’hospitalisation. La grande majorité (88,9%) des BN survenaient pendant les 2 premières semaines d’hospitalisation. Le taux de BN liées au cathéter était de 11,1%. P. æruginosa (20,2%) et A. baumannii (16,8%) étaient les 2 espèces les plus fréquemment isolées quand S. aureus ne représentait que 7,5% des bactéries en causes. Les taux de résistances étaient élevés avec 71% des P. æruginosa résistant à la ceftazidime, 64% des S. aureus étant des SARM, 69,5% de résistance aux C3G parmi les entérobactéries. La colimycine restait le seul antibiotique régulièrement actif (98%) sur A. baumannii. Le taux global de BMR était de 44%, représentées essentiellement par A. baumannii, E-BLSE et P. æruginosa. La mortalité attribuable aux BN était de 25%, avec un taux de BMR nettement plus élevé dans les BN fatales comparativement à celui dans les BN avec évolution favorable (p= 0,000019).
Keywords: bactériémie nosocomiale, brûlés, antibiorésistance, mortalité
Abstract
Nosocomial bacteremia (NB) is one of the most severe infections in burns in intensive care units. Their prognosis is worsened with the emergence and spread of multidrug resistant bacteria (MDR). Our retrospective study aimed to investigate clinical and bacteriological characteristics of NB occurring in patients hospitalized in the Trauma and Burn Center’s Burn Unit (TBC-BU) in Tunisia, during a 3-year period (2016-2018). We found 261 NB in 216 patients, for a prevalence of 25.7% and an incidence density of 13.4‰ days of in-patient stay. The vast majority (88.9%) of NB occurred during the first 2 weeks of hospitalization. The catheterrelated bacteremia rate was 11.1%. P. æruginosa (20.2%) and A. baumannii (16.8%) were the 2 species most frequently isolated when S. aureus represented only 7.5% of isolates. Resistance rates were high, with 71% of P. æruginosa resistant to ceftazidime, 64% of S. aureus being MRSA, 69,5% of resistance to 3rd generation cephalosporins among Enterobacteriaceae, and colimycin remaining the only regularly active antibiotic (98%) on A. baumannii. The MDR rate was 44%, represented mainly by A. baumannii, ESBL-E and P. æruginosa. The mortality rate due to NB was 25%, with a significantly higher rate of MDR in fatal NB compared to that in NB with favorable outcome (p = 0,000019).
Introduction
Les infections nosocomiales (IN) posent un véritable problème de santé publique, alourdissant la prise en charge des patients hospitalisés, et générant de lourdes dépenses pour les établissements hospitaliers.1 Les principaux facteurs de risque d’acquisition d’une IN sont l’usage de procédures invasives, l’utilisation inappropriée d’antibiotiques et le statut immunitaire du patient.2 Chez le brûlé, l’IN représente une cause majeure de mortalité et de morbidité.3 Cette grande susceptibilité aux infections s’explique principalement par la perte du revêtement cutané, première ligne de défense immunitaire, et les désordres immunitaires systémiques induits par la brûlure.4 Les bactériémies nosocomiales (BN) représentent l’une des principales IN chez le brûlé.5 Les germes qui en sont responsables ont très souvent une résistance élevée aux antibiotiques qui place souvent le clinicien devant une impasse thérapeutique. Une bonne connaissance des espèces bactériennes isolées dans les hémocultures, de leur profil de sensibilité et de leur(s) mécanisme(s) de résistance oriente la prescription d’une antibiothérapie probabiliste et permet de mettre en place un programme de prévention de ces infections. Ceci permettrait l’amélioration du pronostic global des patients. Les objectifs de notre travail étaient d’étudier les caractéristiques cliniques des BN chez les grands brûlés, d’étudier leur profil bactériologique et la résistance aux antibiotiques des germes isolés et d’estimer le taux de mortalité attribuable à ces BN.
Méthodes
Il s’agit d’une étude rétrospective réalisée sur une période de 3 ans allant du 1er janvier 2016 au 31 décembre 2018, menée dans le service de réanimation des brûlés du Centre de Traumatologie et des Grands Brûlés. Ce service comporte 8 lits de réanimation et 12 lits en post-réanimation répartis en 10 chambres individuelles et 5 chambres doubles. Notre étude a comporté deux volets, clinique et bactériologique. La définition adoptée de la BN (et donc la sélection des patients) était celle du CDC d’Atlanta, à savoir l’isolement dans une hémoculture d’une bactérie pathogène, chez un patient hospitalisé depuis plus de 2 jours, non porteur d’une telle infection à son admission.6 L’étude des dossiers médicaux a permis de retenir l’essentiel des informations démographiques et cliniques. L’identification des bactéries a été effectuée par les méthodes conventionnelles. L’antibiogramme a été réalisé par la méthode de diffusion en milieu gélosé, selon les recommandations du Comité de l’Antibiogramme de la Société Française de Microbiologie (CA-SFM). Dans cette étude, les souches de sensibilité intermédiaire ont été considérées comme résistantes. Pour les souches d’entérobactéries résistantes à l’ertapénème sur l’antibiogramme standard, les concentrations minimales inhibitrices (CMI) des trois carbapénèmes (imipénème, ertapénème et méropénème) et de la tigécycline ont été déterminées par les bandelettes Etests ® (bioMérieux SA, Marcy l’étoile, France). Pour les souches multirésistantes (BMR) d’entérobactéries, de Pseudomonas spp. et d’Acinetobacter baumannii, la CMI de la colimycine a été déterminée par microdilution en milieu liquide (UMIC, Biocentric, Bandol, France). Pour les souches de staphylocoques résistants à la méticilline, les CMI des glycopeptides ont été déterminées par microdilution en milieu liquide (UMIC, Biocentric, Bandol, France). Nous avons étudié les BMR suivantes : entérobactéries sécrétrices de β-lactamase à spectre étendu (E-BLSE), P. æruginosa et A. baumannii résistants à au moins trois familles d’antibiotiques parmi bêta-lactamines, aminosides, fluoroquinolones et colimycine, S. aureus résistant à la méticilline (SARM), E. fæcium résistant à la vancomycine (ERV) et entérobactéries productrices de carbapénémase (EPC), ces deux dernières faisant partie des Bactéries Hautement Résistantes émergentes (BHRe). L’antibiothérapie a été considérée comme appropriée lorsqu’au moins une des molécules administrées était active in vitro sur la souche responsable de la bactériémie.7 La mortalité a été considérée comme attribuable quand la bactériémie en était la principale cause, en l’absence d’autres facteurs associés pouvant contribuer au décès.8 Les données ont été saisies et exploitées par le logiciel Excel. Le test de corrélation des rangs de Spearman (rs) a été utilisé pour l’étude de l’évolution annuelle des taux de BMR. La comparaison des pourcentages sur deux séries indépendantes a été effectuée par le test du chi-deux de Pearson. Le seuil de signification (p) a été fixé à 0,05 pour tous les tests statistiques.
Résultats
Description des patients infectés. Durant la période d’étude, 216 patients sur les 1016 hospitalisés dans le service de réanimation des brûlés du CTGB ont développé une BN, soit une prévalence de 21,3%. La moyenne d’âge de nos patients était de 35 ± 14 ans [16- 82]. Le sex-ratio était de 1,8/1 avec une prédominance masculine (140/76). Le principal mode d’admission était le transfert d’un autre hôpital (71,3%). Le délai moyen entre la survenue de la brûlure et l’admission dans notre service des patients transférés était de 56,6 ± 120,6 heures [1 heure- 30 jours], médiane 21,5 heures, écart interquartile (EIQ) de 43 heures. Le 2ème mode d’admission était par le biais des urgences (28,7%). La Surface Cutanée Brûlée (SCB) moyenne était de 38,9 ± 17,3% [6-93] et 64,8% des patients avaient une SCB >30%.
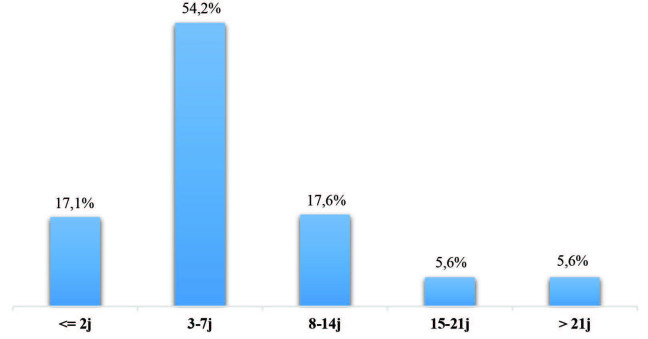
Description des épisodes bactériémiques. Durant la période d’étude, 261 BN ont été enregistrées chez 216 patients (25 patients ont subi 2 épisodes bactériémiques et dix 3 épisodes), soit une prévalence de 25,7 BN/ 100 patients hospitalisés, et une densité d’incidence de 13,4 BN/ 1 000 journées d’hospitalisation (JH). Les BN étaient monomicrobiennes dans 69% des cas (n=180) et polymicrobiennes dans 31% des cas (n=81 épisodes). Le délai moyen de survenue de la 1ère BN était de 8,2 ± 15,8 jours [1-200], médiane 5, EIQ 5. Dans 88,9% des cas, la BN est survenue dans les deux premières semaines d’hospitalisation, contre 5,6% après deux semaines et 5,6% après trois semaines (Fig.1). Ce délai était inférieur à 2 jours pour 18 patients (8,3%) qui avaient été transférés d’un autre hôpital. La porte d’entrée des BN a été microbiologiquement identifiée dans 24,1% des cas (63/261). La plus fréquente était un cathéter central (11,1%), suivie de la porte d’entrée cutanée (9,9%). Les portes d’entrée respiratoire et urinaire ne représentaient que 2,3% et 0,8%, respectivement.
Fig. 1. Répartition des bactériémies nosocomiales selon leur délai de survenue.
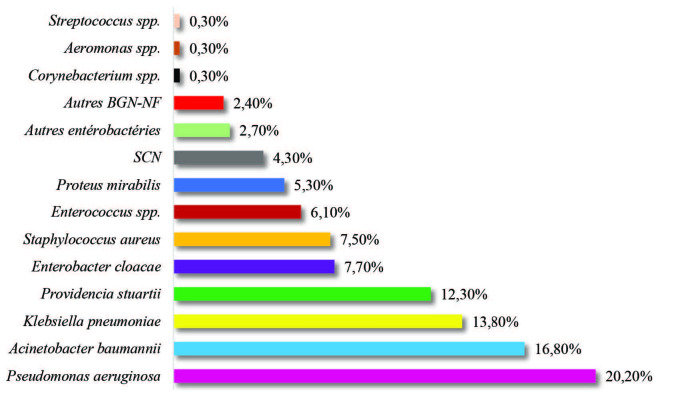
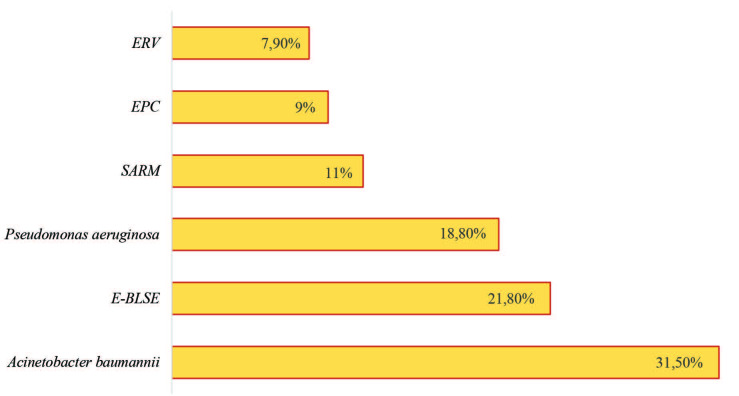
Profil bactériologique des BN (Fig. 2) et résistance aux antibiotiques. Durant la période d’étude, 375 souches bactériennes non répétitives ont été colligées. Les principales espèces bactériennes isolées étaient P. æruginosa (20,2%), A. baumannii (16,8%), K. pneumoniæ (13,8%), P. stuartii (12,3%), E. cloacæ (7,7%) et S. aureus (7,5%). Concernant P. æruginosa, 87% des souches étaient résistantes à la ticarcilline (TIC), 71% à la ceftazidime (CAZ) et 84% à l’imipénème (IPM). La résistance aux aminosides était de 81,6% pour l’amikacine (AMK) et 84,2% pour la gentamicine (GEN). Le taux de résistance à la ciprofloxacine (CIP) était de 51,4%. Aucune résistance à la colimycine (CLS) n’a été détectée. Le taux de P. æruginosa multirésistant était de 40,8%. Les souches d’A. baumannii avaient des taux de résistance très élevés à TIC (94%), à l’association ticarcilline-acide clavulanique (TCC- 92%), à CAZ (84%), à IPM (90%), à GEN (92%), à la tobramycine (TOB- 85%), à AMK (87%) et à CIP (89%). En revanche, le taux de résistance à la CLS n’était que de 2%. Le taux des isolats d’A. baumannii multirésistant était de 82,5%. L’étude de la sensibilité des entérobactéries aux bêta-lactamines a montré que 69,5% des souches étaient résistantes aux céphalosporines de 3ème génération (C3G). La production d’une BLSE a concerné 22,9% des souches. Neuf pour cent des souches étaient résistantes à IPM. Les résistances à GEN, AMK et TOB étaient de 78,5%, 30,3% et 73,5%, respectivement. La résistance aux fluoroquinolones était de 41,9%. Les souches de S.aureus résistantes à la méticilline (SARM) ont représenté 64% du total des souches de S. aureus. Une résistance aux aminosides a été retrouvée dans 68% des cas : elle était de phénotype KTG dans 57,9% des cas. Quant à CIP, la résistance était de 46,4%. Aucune résistance au linézolide (LZD), ni à la tigécycline (TGC), ni aux glycopeptides n’a été observée. Le taux global des BMR était de 44% (165/375). Elles étaient dominées par A. baumannii (31,5%), suivi par les E-BLSE (21,8%), P. æruginosa (18,8%), SARM (11%), les EPC (9%) et les ERV (7,9%) (Fig.3). Le taux des BMR responsables de BN n’avait pas de tendance significative à la hausse au cours du temps (rs=0,5 ; p=1).
Fig. 2. Répartition des souches responsables de bactériémies nosocomiales selon l’espèce bactérienne.
Fig. 3. Profil bactériologique des bactéries multi-résistantes (BMR) responsables de bactériémies nosocomiales.
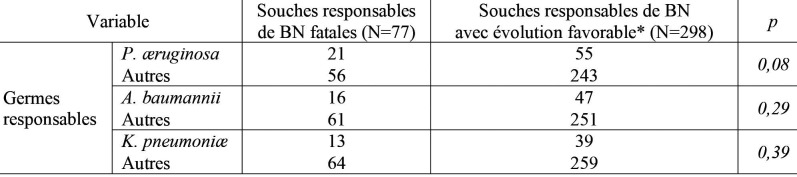
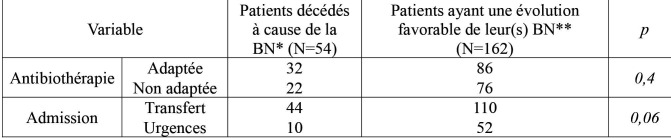
Antibiothérapie et évolution. L’antibiothérapie de 1ère intention était appropriée dans 54,6% des cas (118/216). Les antibiotiques les plus prescrits dans ce cadre étaient les bêta-lactamines (n=196), en particulier les carbapénèmes (n=98), suivies des glycopeptides (n=102), de la colimycine (n=100) et des aminosides (n=98). La mortalité globale était de 46,3% (100/216) et la mortalité attribuable aux était de 25% (54/216). Les BN fatales étaient polymicrobiennes dans 39% des cas, avec un total de 77 souches. Les principales espèces isolées au cours des BN fatales étaient P. æruginosa (27,3%), A. baumannii (20,8%) et K. pneumoniæ (16,9%). aux Mais, il n’y avait pas de différence statistiquement significative entre les taux de ces espèces parmi les souches responsables de BN fatales par rapport à celles responsables de BN avec évolution favorable (Tableau I). Parmi les 54 BN fatales, 46 étaient dues à au moins une souche de BMR (85%). Ce taux était nettement plus élevé que le taux de BMR dans les BN avec évolution favorable (53,1%) (p=0,000019) (Tableau II). Parmi les 54 patients décédés de BN, 22 avaient reçu une antibiothérapie non adaptée (41%). Ce taux n’était pas plus élevé que celui retrouvé chez les patients ayant une évolution favorable de leur(s) BN. Il n’y avait pas de différence statistiquement significative des taux des patients transférés parmi les patients décédés par la BN par rapport à ceux ayant une évolution favorable de leur(s) BN (p=0,06) (Tableau III).
Tableau I. Comparaison des taux de P. æruginosa, d’A. baumannii et de K. pneumoniæ dans les bactériémies nosocomiales fatales versus dans les bactériémies nosocomiales avec évolution favorable.
Tableau II. Comparaison des taux de bactéries multi-résistantes (BMR) dans les bactériémies nosocomiales fatales versus dans les bactériémies nosocomiales avec évolution favorable.
Tableau III. Comparaison des taux des patients transférés et des taux d’antibiothérapie adaptée dans les bactériémies nosocomiales fatales versus dans les bactériémies nosocomiales avec évolution favorable.
Discussion
Les BN constituent une des infections les plus sévères chez les brûlés en réanimation. Leur pronostic est aggravé par l’émergence et la dissémination des BMR.1-3 Notre étude avait l’avantage d’étudier les BN, cause majeure de morbi-mortalité chez le grand brûlé, sur les plans clinique et bactériologique. Ce travail reste limité par son caractère rétrospectif et l’absence d’un groupe témoin de patients non bactériémiques, rendant difficile l’identification des facteurs pronostics de ces bactériémies. Dans notre étude, la prévalence des BN était de 25,7% et leur densité d’incidence était de 13,4/1000 JH. Nos résultats sont nettement inférieurs à ceux retrouvé dans une étude multicentrique chinoise, où la prévalence des BN était de 67,8% et dans une étude turque réalisée dans un service de réanimation des brûlés où le taux d’incidence des BN était de 32,1/1000JH.8,9 Dans notre étude, 16% des patients avaient eu plusieurs épisodes de BN ce qui est inférieur au taux retrouvé en Chine en 2014 (53,7%).8 Le principal mode d’admission était le transfert d’un autre hôpital (71,3%). Le service de réanimation des brûlés du CTGB est un service à vacation nationale et de ce fait, il draine tous les patients du pays. Le délai moyen entre la survenue de la brûlure et l’admission dans notre service des patients transférés était de 56,6 heures [1 heure- 30 jours] avec une médiane de 21,5 heures. Parmi les 154 patients transférés, 18 patients (11,7%) ont manifesté leur bactériémie en moins de 48 heures après leur admission. El Danaf a montré que le retard de prise en charge adéquate en milieu de réanimation augmente le risque de mortalité chez le grand brûlé, notamment par choc septique.10 La SCB moyenne était de 38,9% et 64,8% de nos patients avaient une SCB >30%. En effet, le risque de BN augmente avec l’importance de la SCB.11 Le délai moyen de survenue de la 1ère BN était de 8,2 jours, ce qui correspond aux données de la littérature (entre 5 et 14 jours).9,10,12-14 La porte d’entrée des BN a été microbiologiquement identifiée dans seulement 24,1% des cas. Chez le grand brûlé, la bactériémie pourrait survenir sans qu’aucune porte d’entrée ne soit cliniquement décelable : soit par inoculation directe des bactéries dans la circulation sanguine suite à la destruction du revêtement cutané par la brûlure, soit par translocation bactérienne suite à une hypoperfusion intestinale observée souvent au cours des états de choc.15,16 La porte d’entrée la plus souvent objectivée était un cathéter central avec un taux de bactériémies liées aux cathéters (BLC) de 11,1%. Ce résultat est similaire à celui retrouvé par King et al (12%) qui ont montré que le risque de BLC augmente avec la durée du cathétérisme.17 Les principales espèces bactériennes rencontrées dans notre série étaient P. æruginosa (20,2%) et A. baumannii (16,8%). Cette même distribution a été retrouvée dans une série irakienne.5 Le tissu dévitalisé et l’environnement humide des brûlures (pansements, solutions antiseptiques …) offrent des conditions idéales pour le développement du bacille pyocyanique.18 A. baumannii, quant à lui, peut être rencontré dans divers sites de l’environnement du patient y compris les draps, les rideaux et les meubles.19 Il peut également se propager dans l’air sur de courtes distances, par les squames des patients colonisés et par les gouttelettes d’eau.20 Cependant le mode le plus commun reste la main du personnel soignant. Le renforcement du lavage des mains ainsi que le bio nettoyage deviennent une nécessité dans notre service. L’étude de la sensibilité aux antibiotiques dans notre étude a monté des résistances élevées aux antibiotiques habituellement prescrits. La résistance à la CAZ a concerné 71% des souches de P. æruginosa. Des taux aussi élevés ont été retrouvés au Brésil (70%) et en Inde (95%).21,22 Dans une étude faite dans notre service en 2011, ce taux était de 34%.3 Ainsi, le taux de P. æruginosa résistant à CAZ a presque doublé en 7 ans. Richard et al ont montré que la prescription de CAZ à des doses suboptimales favoriserait l’émergence de la résistance à cet antibiotique chez le pyocianique.23 La résistance à IPM touchait 84% des souches de P. æruginosa isolées dans notre étude. Ce taux a également doublé par rapport au taux retrouvé dans notre service en 2011 (37,1%) et il est de loin supérieur aux résultats retrouvés dans plusieurs études de différents pays, qui varient de 26 à 50%.3,24-30 Les données nationales du Laboratoire d’Antibio-Résistance en Tunisie (LART) de 2017 rapportent un taux de 33,9% en réanimation.31 Dans notre étude le taux de P. æruginosa multirésistant était de 40,8%. Ce résultat est similaire à celui retrouvé dans une série irakienne (39,6%), mais de loin inférieur à celui retrouvé dans une étude indienne (76,8%).4,32 Aux États-Unis, dans une série publiée en 2010, seules 15% des souches de P. æruginosa étaient des BMR.28 La disparité des taux de BMR entre les études pourrait s’expliquer par l’hétérogénéité de la définition de BMR d’une étude à une autre. Dans notre étude, seule CLS restait active sur les souches de P. æruginosa multirésistant. En effet, en cas de multirésistance chez ce germe, CLS demeure une molécule efficace avec des taux de résistance très faibles, voire nuls dans plusieurs études.29,30 Concernant A. baumannii, les souches isolées étaient résistantes à presque tous les antibiotiques testés, à l’exception de la CLS qui était active dans 98% des cas. La résistance à CAZ était de 84%. Selon plusieurs études faites en Maroc, en Inde et en Afrique du Sud, cette résistance varie de 71 à 99%.24,25,27 Concernant IPM, la résistance touchait 90% des isolats. Le même résultat (89,3%) avait été trouvé dans notre service en 2011.3 Une étude marocaine de 2017 a trouvé 84% de résistance d’A. baumannii à IPM.25 Selon les données de LART 2017, cette résistance atteint 57,3% des souches d’A. baumannii en milieu de réanimation.31 Dans notre série, une seule souche d’A. baumannii était résistante à la CLS (2%). Tandis que CLS reste un antibiotique de dernier recours pour traiter les infections à A. baumannii multirésistant, la résistance à la CLS a été signalée dans le monde entier.33 Concernant les entérobactéries, la résistance aux C3G était de 69,5%, taux proche de celui observé au Cameroun (65,4%), supérieur à ceux observés en Iran (26%) et au Bresil (58%).21,26,34 La résistance à IPM concernait 9,1% de nos souches d’entérobactéries. Dans une étude moléculaire réalisée sur 42 souches d’EPC isolées dans notre service en 2017, le gène blaNDM(59%) prédominait sur le blaOXA-48 (33%), 7% des souches coexprimant ces deux gènes.35 Concernant S. aureus, la résistance à la méticilline était de 64%, supérieure aux données nationales qui rapportent en 2017 un taux de SARM de 43,2% en réanimation.31 Ce taux a augmenté par rapport à celui retrouvé dans le même service en 2011 (56,1%).3 Son réservoir est essentiellement humain, il est constitué par les patients infectés ou colonisés au niveau de la peau, du périnée, du rhinopharynx et des narines. La transmission est essentiellement manuportée, souvent par l’intermédiaire du personnel soignant.36
Dans notre série, toutes les souches de S. aureus étaient sensibles aux glycopeptides. De nouveaux antibiotiques anti-staphylococciques tel que la daptomycine, le linézolide, la tigécycline ainsi que la ceftaroline, nouvelle céphalosporine de 5ème génération active sur le SARM, sont venus enrichir l’arsenal thérapeutique dans les infections à SARM.37 Ces molécules représentent une alternative en cas de résistance avérée aux glycopeptides et contribuent à prévenir le développement des souches résistantes ou de sensibilité diminuée aux glycopeptides, en réduisant l’utilisation de ces molécules. La proportion de BMR est un bon indicateur de la qualité de soin dans la structure hospitalière. Dans notre étude, le taux global de BMR était de 44%, avec une prédominance d’A. baumannii (31,5%), suivi des E-BLSE (21,8%), de P. æruginosa (18,8%) et de SARM (11%). Ces valeurs sont comparables à celles retrouvées dans un service de réanimation de brûlés en Corée du Sud en 2017.38 Dans notre étude, le taux de BMR dans les BN fatales était nettement plus élevé que celui observé dans les BN avec évolution favorable (p=0,000019). En effet, le sepsis dû à des souches de BMR est la principale cause de décès chez le brûlé.39 Dans notre étude, l’antibiothérapie de 1ère intention était appropriée dans 54,6% des cas. L’antibiothérapie probabiliste, lorsqu’elle est appropriée, améliore le pronostic des bactériémies. Ceci a été confirmé dans deux études Gradel et Leibovici, qui ont trouvé des taux de mortalité respectivement de 22% et 20% chez les patients qui ont reçu d’emblée un traitement antibiotique approprié contre 31% et 34% chez ceux qui ne l’ont pas reçu.40,41 Mais, dans notre série, le taux d’antibiothérapie non adaptée chez les patients décédés de leur BN n’était pas plus élevé que celui retrouvé chez les patients ayant une évolution favorable de leur(s) BN. La mortalité attribuable aux BN était de 25%. Les BN sont connues comme étant une cause majeure de décès chez le grand brûlé.42 Ce taux étant très variable d’une étude à l’autre, probablement à cause de l’hétérogénéité des populations étudiées (âge, type de service, pays), de la méthodologie de l’étude, du type de germe et de sa résistance aux antibiotiques.42,43
Conclusion
Au total, la prévalence des BN (25,7%) ainsi que leur densité d’incidence (13,4‰ JH) dans le service de réanimation des brûlés restent élevées. Le taux global de BMR était de 44%, représentées essentiellement par A. baumannii, E-BLSE et P. æruginosa. La mortalité attribuable aux BN était de 25%, avec un taux de BMR nettement plus élevé dans les BN fatales comparativement à celui dans les BN avec évolution favorable. Ceci doit nous inciter à concentrer plus d’effort sur la prévention qui est le seul moyen pour lutter contre les IN. Elle repose essentiellement sur une réhabilitation du service selon les normes actuelles en matière de lutte contre les IN, une accélération des transferts avec un meilleur usage des antibiotiques et la prévention primaire contre les brûlures. De même, une bonne connaissance de la flore bactérienne et la collaboration entre les microbiologistes et les réanimateurs permettent de guider l’antibiothérapie et améliorer le pronostic global des malades.
References
- 1.Vosylius S, Sipylaite J, Ivaskevicius J. Intensive care unit acquired infection: a prevalence and impact on morbidity and mortality. Acta Anaesthesiol Scand. 2003;47:1132–1137. doi: 10.1034/j.1399-6576.2003.00230.x. [DOI] [PubMed] [Google Scholar]
- 2.Hedfi M, Khouni H, Massoudi Y. Epidemiology of nosocomial infections: about 70 cases. Tunis Med. 2016;94:401–106. [PubMed] [Google Scholar]
- 3.Thabet L, Zoghlami A, Boukadida J. Étude comparative de la résistance aux antibiotiques des principales bactéries isolées au service de Réanimation de brûlés durant deux périodes (2005- 2008, 2008-2011) et dans deux structures hospitalières (Hôpital Aziza Othmana, Centre de traumatologie et grands brûlés Ben Arous). Tunis Med. 2013;91:138–142. [PubMed] [Google Scholar]
- 4.Le Floch R, Naux E, Arnould JF. L’infection bactérienne chez le patient brûlé. Ann Burns Fire Disasters. 2015;28:94–104. [PMC free article] [PubMed] [Google Scholar]
- 5.Ressner R, Murray C, Griffith M. Outcomes of bacteremia in burn patients involved in combat operations overseas. J Am Coll Surg. 2008;206:439–444. doi: 10.1016/j.jamcollsurg.2007.09.017. [DOI] [PubMed] [Google Scholar]
- 6.Horan T, Andrus M, Dudeck M. CDC/NHSN surveillance definition of health care–associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control. 2008;36:309–332. doi: 10.1016/j.ajic.2008.03.002. [DOI] [PubMed] [Google Scholar]
- 7.McCampbell B, Wasif N, Rabbitts A. Diabetes and burns: retrospective cohort study. J Burn Care Rehabil. 2002;23:127–166. doi: 10.1097/00004630-200205000-00004. [DOI] [PubMed] [Google Scholar]
- 8.Tang CQ, Li JQ, Shou BM. Epidemiology and outcomes of bloodstream infections in 177 severe burn patients from an industrial disaster: a multicentre retrospective study. Clin Microbiol Infect. 2018;247:199-e1-7. doi: 10.1016/j.cmi.2017.06.009. [DOI] [PubMed] [Google Scholar]
- 9.Öncül O, Öksüz S, Acar A. Nosocomial infection characteristics in a burn intensive care unit: analysis of an elevenyear active surveillance. Burns. 2014;40:835–841. doi: 10.1016/j.burns.2013.11.003. [DOI] [PubMed] [Google Scholar]
- 10.El Danaf A. Burn variables influencing survival: a study of 144 patients. Burns. 1995;21:517–520. doi: 10.1016/0305-4179(95)00035-a. [DOI] [PubMed] [Google Scholar]
- 11.Sittig K, Deitch EA. Effect of bacteremia on mortality after thermal injury. Arch Surg. 1988;123:1367–1370. doi: 10.1001/archsurg.1988.01400350081012. [DOI] [PubMed] [Google Scholar]
- 12.Raz-Pasteur A, Hussein K, Finkelstein R. Blood stream infections (BSI) in severe burn patients - early and late BSI: a 9-year study. Burns. 2013;39:636–642. doi: 10.1016/j.burns.2012.09.015. [DOI] [PubMed] [Google Scholar]
- 13.Patel B, Paratz J, Mallet A. Characteristics of bloodstream infections in burn patients: an 11-year retrospective study. Burns. 2012;38:685–690. doi: 10.1016/j.burns.2011.12.018. [DOI] [PubMed] [Google Scholar]
- 14.Cremer R, Ainaud P, Le Bever H. Infections nosocomiales dans un service de brûlés. Résultats d’une enquête prospective d’un an. Ann Fr Anesth Reanim. 1996;15:599–607. doi: 10.1016/0750-7658(96)82125-3. [DOI] [PubMed] [Google Scholar]
- 15.Sheridan RL. Sepsis in pediatric burn patients. Pediatr Crit Care Med. 2005;6:S112–S119. doi: 10.1097/01.PCC.0000161577.27849.BE. [DOI] [PubMed] [Google Scholar]
- 16.Church D, Elsayed S, Reid O. Burn wound infections. Clin Microbiol Rev. 2006;19:403–434. doi: 10.1128/CMR.19.2.403-434.2006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.King B, Schulman CI, Pepe A. Timing of central venous catheter exchange and frequency of bacteremia in burn patients. J Burn Care Res. 2007;28:859–860. doi: 10.1097/BCR.0b013e318159a40b. [DOI] [PubMed] [Google Scholar]
- 18.Mahar P, Padiglione AA, Cleland H. Pseudomonas aeruginosa bacteraemia in burns patients: risk factors and outcomes. Burns. 2010;36:1228–1233. doi: 10.1016/j.burns.2010.05.009. [DOI] [PubMed] [Google Scholar]
- 19.Revathi G, Puri J, Jain BK. Bacteriology of burns. Burns. 1998;24:347–349. doi: 10.1016/s0305-4179(98)00009-6. [DOI] [PubMed] [Google Scholar]
- 20.Pandit D, Gore D, Saileshwar N. Laboratory data from the surveillance of a burns ward for the detection of hospital infection. Burns. 1993;19:52–55. doi: 10.1016/0305-4179(93)90101-d. [DOI] [PubMed] [Google Scholar]
- 21.Santucci S, Gobara S, Santos C. Infections in a burn intensive care unit: experience of seven years. J Hosp Infect. 2003;53:6–13. doi: 10.1053/jhin.2002.1340. [DOI] [PubMed] [Google Scholar]
- 22.Singh N, Rani M, Gupta K. Changing trends in antimicrobial susceptibility pattern of bacterial isolates in a burn unit. Burns. 2017;43:1083–1087. doi: 10.1016/j.burns.2017.01.016. [DOI] [PubMed] [Google Scholar]
- 23.Richard P, Le Floch R, Chamoux C. Pseudomonas aeruginosa outbreak in a burn unit: role of antimicrobials in the emergence of multiply resistant strains. J Infect Dis. 1994;170:377–383. doi: 10.1093/infdis/170.2.377. [DOI] [PubMed] [Google Scholar]
- 24.Bahemia I, Muganza A, Moore R. Microbiology and antibiotic resistance in severe burns patients: a 5 year review in an adult burns unit. Burns. 2015;41:1536–1542. doi: 10.1016/j.burns.2015.05.007. [DOI] [PubMed] [Google Scholar]
- 25.Moutaouakkil Y, Siah S, Bennana A. Réévaluation clinicobiologique de l’antibiothérapie probabiliste en réanimation des brûlés. Ann Burns Fire Disasters. 2018;31:35–41. [PMC free article] [PubMed] [Google Scholar]
- 26.Khorasani G, Salehifar E, Eslami G. Profile of microorganisms and antimicrobial resistance at a tertiary care referral burn centre in Iran: emergence of Citrobacter freundii as a common microorganism. Burns. 2008;34:947–952. doi: 10.1016/j.burns.2007.12.008. [DOI] [PubMed] [Google Scholar]
- 27.Singh N, Goyal R, Manchanda V. Changing trends in bacteriology of burns in the burns unit, Delhi, India. Burns. 2003;29:129–132. doi: 10.1016/s0305-4179(02)00249-8. [DOI] [PubMed] [Google Scholar]
- 28.Keen III E, Robinson B, Hospenthal D. Prevalence of multidrug-resistant organisms recovered at a military burn center. Burns. 2010;36:819–825. doi: 10.1016/j.burns.2009.10.013. [DOI] [PubMed] [Google Scholar]
- 29.Tam VH, Chang KT, Abdelraouf KT. Prevalence, resistance mechanisms, and susceptibility of multidrug-resistant bloodstream isolates of Pseudomonas aeruginosa. Antimicrob Agents Chemother. 2010;54:1160–1164. doi: 10.1128/AAC.01446-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Falagas ME, Kasiakou SK, Saravolatz LD. Colistin: the revival of polymyxins for the management of multidrug-resistant gramnegative bacterial infections. Clin Infect Dis. 2005;40:1333–1340. doi: 10.1086/429323. [DOI] [PubMed] [Google Scholar]
- 31.Réseau LART (L’Antibio-Résistance en Tunisie). Données 2017. Société tunisienne de pathologie infectieuse, 22/12/2019. 2019 :https://www.infectiologie.org.tn/resistance.php . [Google Scholar]
- 32.Bhatt p, Rahti K. Prevalence of multidrug resistant Pseudomonas æruginosa infection in burn patients at a tertiary care centre. Indian Journal of Burns. 2015;23:56–59. [Google Scholar]
- 33.Ahmed SS, Alp E, Hopman J. Global epidemiology on colistin resistant Acinetobacter baumannii. J Infect Dis Ther. 2016;4(4):1–5. [Google Scholar]
- 34.Ebongue C, Tsiazok M, Mefo’o JP. Evolution of antibiotic resistance of Enterobacteriaceae isolated at the Douala General Hospital from 2005 to 2012. Pan Afr Med J. 2015;20:227. doi: 10.11604/pamj.2015.20.227.4770. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Maamar B, Messadi AA, Thabet L. Profil moléculaire et résistance aux antibiotiques des entérobactéries productrices de carbapénèmases chez le brûlé. Ann Burns Fire Disasters. 2019;32(3):203–209. [PMC free article] [PubMed] [Google Scholar]
- 36.Anguelov A, Giraud K, Akpabie A. Facteurs prédictifs d’acquisition du Staphylococcus aureus résistant à la méticilline dans un service de soins de suite et de réadaptation. Med Mal Infect. 2010;40:677–682. doi: 10.1016/j.medmal.2010.03.005. [DOI] [PubMed] [Google Scholar]
- 37.Cesur S, Irmak H, Simşek H. Evaluation of antibiotic susceptibilities and VISA-VRSA rates among MRSA strains isolated from hospitalized patients in intensive care units of hospitals in seven provinces of Turkey. Mikrobiyol Bul. 2012;46:352–358. [PubMed] [Google Scholar]
- 38.Park JJ, Seo YB, Choi YK. Changes in the prevalence of causative pathogens isolated from severe burn patients from 2012 to 2017. Burns. 2020;46:695–701. doi: 10.1016/j.burns.2019.09.008. [DOI] [PubMed] [Google Scholar]
- 39.Williams F, Herndon D, Hawkins H. The leading causes of death after burn injury in a single pediatric burn center. Crit Care. 2009;13:R183. doi: 10.1186/cc8170. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Gradel KO, Jensen US, Schønheyder HC. Impact of appropriate empirical antibiotic treatment on recurrence and mortality in patients with bacteraemia: a population-based cohort study. BMC Infect Dis. 2017;17:122. doi: 10.1186/s12879-017-2233-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Leibovici L, Shraga I, Drucker M. The benefit of appropriate empirical antibiotic treatment in patients with bloodstream infection. J Intern Med. 1998;244:379–386. doi: 10.1046/j.1365-2796.1998.00379.x. [DOI] [PubMed] [Google Scholar]
- 42.Bearman G, Wenzel R. Bacteremias: a leading cause of death. Arch Med Res. 2005;36:646–659. doi: 10.1016/j.arcmed.2005.02.005. [DOI] [PubMed] [Google Scholar]
- 43.Laupland KB, Gregson DB, Vanderkooi OG. The changing burden of pediatric bloodstream infections in Calgary, Canada, 2000-2006. Pediatr Infect Dis J. 2009;28:114–117. doi: 10.1097/INF.0b013e318187ad5a. [DOI] [PubMed] [Google Scholar]