Al Director:
La irrupción de la pandemia COVID-19 ha ocasionado una desviación profunda de recursos económicos, sociales y sanitarios disponibles, que limitan el control, diagnóstico y pronóstico de otras entidades nosológicas1, 2, 3. De la misma forma, los programas de control y prevención de la tuberculosis (TB), han sufrido también el desvío de recursos hacia el control de la pandemia4, 5. La Organización Mundial de la Salud considera que un 21% de personas con enfermedad tuberculosa no fueron diagnosticadas en 2020, lo que ocasionaría un exceso de mortalidad de 500.000 personas sobre los objetivos propuestos por la propia organización en la estrategia «End TB»6, 7.
Sin embargo, las medidas de distanciamiento social y aislamiento respiratorio adoptadas con la irrupción de la pandemia, han causado un efecto beneficioso sobre la incidencia de otras enfermedades infecciosas de transmisión respiratoria de corto periodo de incubación como son la gripe, virus respiratorio sincitial y otras8, 9, 10, 11.
El impacto de las medidas de control frente a la COVID-19 sobre la TB, enfermedad de transmisión respiratoria de periodo de incubación más prolongado, no es lo suficientemente conocido. En el presente estudio, presentamos datos de la incidencia de TB en relación con la pandemia COVID-19 en Galicia, España, donde existe un programa reconocido y consolidado de prevención y control de la TB, que incluye la búsqueda activa de casos12.
Se recogieron de forma agrupada todos los casos de TB incluidos en el Registro Gallego de TB entre 2015 y 2020 con fecha de revisión a 7-mayo-2021. Se analizaron las siguientes variables: fecha de diagnóstico, edad, localización, características de la radiografía de tórax (cavitada-no cavitada), baciloscopia de esputo (bacilífero-no bacilífero), el origen de información de los casos (declaración del médico responsable del diagnóstico, o por búsqueda activa de registros de Microbiología, Anatomía Patológica, sida, Instituciones Penitenciarias o mortalidad) y el retraso diagnóstico desde el inicio de los síntomas. Los datos poblaciones se obtuvieron del registro del Instituto Nacional de Estadística. Se comparó la incidencia de TB del último semestre de 2020, una vez establecidas las medidas de aislamiento debidas a la pandemia de COVID-19, con la del mismo periodo de 2019 mediante prueba de comparación de proporciones. La comparación de días de retraso diagnóstico se realizó mediante la prueba de Mann-Whitney. Por otra parte, se analizó la tendencia por semestres desde el año 2015 mediante análisis de regresión de Poisson y posteriormente un análisis de regresión segmentada para detectar un posible punto de cambio significativo en la tendencia.
El estudio no precisa aprobación de Comité de Ética por tratarse de un análisis de datos agrupados, sin posibilidad de identificación de pacientes.
En el 2.° semestre de 2020 se registraron 172 casos de TB, frente a 262 en el mismo periodo de 2019, lo que corresponde a una incidencia semestral/100.000 habitantes de 6,4 vs. 9,7 (reducción del riesgo = 34,35%; IC95%:20,43-45,84). El origen de información de los casos fue por búsqueda activa en registros de Microbiología y otros en el 34,3% (59/172) de los casos del segundo semestre de 2020 vs. 29,0% (76/262) en 2019 (p = 0,29). La proporción de pacientes con formas de TB sugestivas de mayor retraso diagnóstico (pacientes bacilíferos o con cavitación en la Rx tórax) fue similar en ambos periodos: 29,1% de enfermos bacilíferos en el segundo semestre de 2020 vs. 28,2% en el segundo semestre de 2019 (p = 0,94); mientras que la proporción de pacientes con cavitación en la Rx de tórax fue 14,5% en el segundo semestre de 2020 vs. 17,2% en el mismo periodo de 2019 (p = 0,55). La mediana de retraso diagnóstico en el segundo semestre de 2020 fue 60,5 días (RIQ: 23,0-122,0) frente a 65 días (RIQ: 30,5-121,5) del mismo periodo de 2019 (p = 0,51).
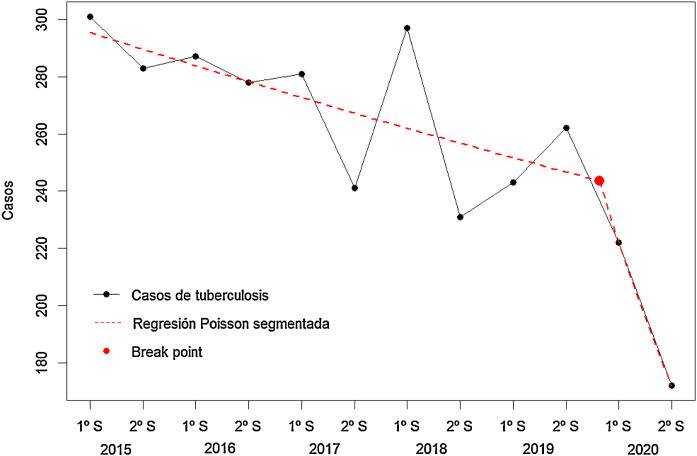
El análisis de tendencias por semestres objetivó un descenso del riesgo del periodo 2015-2020 de un 32% (IC95% 22%-42%) anual, más acusado que si consideramos solo el periodo 2015-2019 de un 20% (IC95% 7%-33%). El análisis de regresión segmentada de Poisson demuestra la existencia de un «break point» en la incidencia a partir del año 2020 con un valor de RR = 0,980 (IC95% 0,967-0,993) para la parte inicial de la recta de regresión (años 2015 a 2019), frente a un descenso más acusado de la recta relativo a los datos de 2020 (RR = 0,790; IC95% 0,635-0,945) (fig. 1 ).
Figura 1.
Análisis de tendencia por semestres de casos nuevos de tuberculosis en Galicia entre 2015 y 2020.
Se objetiva por tanto un descenso significativo en los casos registrados de TB, tras la adopción de medidas preventivas para la COVID-19. Se pueden considerar tres principales causas atribuibles, no necesariamente excluyentes. En primer lugar, puede existir una infradeclaración de casos. En segundo lugar, puede existir un retraso diagnóstico consecuencia del desvío de recursos sanitarios (laboratorios de Microbiología, Atención Primaria o los propios programas de TB), saturación de los servicios asistenciales que dificulten el acceso de los pacientes al sistema de salud, y/o reticencias de la población a acceder a hospitales o centros de salud por temor a exposición a SARS-CoV-213, 14.
Por último, puede existir un descenso real de los casos de TB en relación con la disminución de enfermedades de transmisión respiratoria con la adopción de medidas de confinamiento, distanciamiento social y uso de mascarillas15. Consideramos que esta es la explicación que más se adecúa a la realidad en nuestra comunidad autónoma. Aunque también en Galicia ha existido un desvío de recursos asignados al programa de control de TB, las Unidades de Tuberculosis han conservado su estructura y funciones básicas. Se ha mantenido la disponibilidad asistencial inmediata a enfermos, contactos, cribados y pacientes con sospecha diagnóstica de TB, además de continuar con la búsqueda activa de casos. La inexistencia de mayor proporción de enfermos con formas avanzadas de enfermedad (bacilíferos, Rx cavitadas) ni aumento en el retraso diagnóstico en el segundo semestre de 2020 refuerzan nuestra hipótesis de que nos hallamos ante un descenso real en la incidencia de enfermedad tuberculosa.
Aunque se ha estimado tradicionalmente que globalmente, solo un 50% de los casos incidentes de TB se manifiestan en los 2 primeros años del contagio, se ha sugerido recientemente que el periodo de incubación es menor en la mayor parte de los casos16. Todo ello también apoyaría la hipótesis de que nos encontremos ante un descenso real en los casos de TB, pese a los escasos meses transcurridos desde el inicio de las medidas de aislamiento en marzo de 2020. Por otra parte, existen ya estudios publicados en otros países que, aunque analizan menos el impacto de las medidas de control frente a COVID-19, describen también un descenso en la incidencia de TB17, 18.
La evolución en el tiempo de la pandemia, las medidas adoptadas para su control y un seguimiento a más largo plazo de las tasas de incidencia de TB, serán decisivos para confirmar si nos encontramos ante un descenso real de la incidencia de TB en relación con las medidas de aislamiento social. En cualquier caso, consideramos al igual que otros autores, que el descenso de casos de TB no debe en ningún caso relajar las medidas de control de la enfermedad o que incluso deban ser reforzadas19, 20.
En conclusión, las medidas de distanciamiento social y aislamiento respiratorio, incluyendo el uso generalizado de mascarillas, contribuyen de manera positiva al descenso de la incidencia de TB en nuestro medio.
Anexo A. Grupo de Trabajo del Programa de Prevención y Control de la Tuberculosis de Galicia
A. Castro-Paz (Complexo Hospitalario Universitario de Ourense); E. Cruz-Ferro (Programa gallego de tuberculosis. D.G. de Salud Pública); L. Ferreiro-Fernández (Hospital Clínico Universitario de Santiago); M. Otero Santiago (Hospital Universitario de A Coruña); A. Penas Truque (Hospital Lucus Augusti de Lugo); M.L. Pérez del Molino (Hospital Clínico Universitario de Santiago); A. Rodríguez-Canal (Complexo Hospitalario Universitario de Ourense); J.A. Taboada Rodríguez (D. G. de Salud Pública); P. Valiño López (Hospital Universitario de A Coruña); E. Vázquez García-Serrano (Hospital Arquitecto Marcide de Ferrol); R. Zubizarreta Alberdi (D.G. de Salud Pública).
Bibliografía
- 1.World Health Organization Pulse survey on continuity of essential health services during the Covid-19 pandemic. 2020 [consultado 5 Abr 2021]. Disponible en: https://www.who.int/publications/i/item/WHO-2019-nCoV-EHS_continuity-survey-2020.1. [Google Scholar]
- 2.Chmielewska B., Barratt I., Townsend R., Kalafat E., van der Meulen J., Gurol-Urganci I., et al. Effects of the COVID-19 pandemic on maternal and perinatal outcomes: a systematic review and meta-analysis. Lancet Glob Health. 2021;S2214–109X doi: 10.1016/S2214-109X(21)00079-6. 00079-6. doi: 10.1016/S2214-109X(21)00079-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Sarkar S., Khanna P., Singh A.K. Impact of COVID-19 in patients with concurrent co-infections: A systematic review and meta-analyses. J Med Virol. 2021;93:2385–2395. doi: 10.1002/jmv.26740. [DOI] [PubMed] [Google Scholar]
- 4.Migliori G.B., Thong P.M., Akkerman O., Alffenaar J.W., Álvarez-Navascués F., Assao-Neino M.M., et al. Worldwide Effects of Coronavirus Disease Pandemic on Tuberculosis Services January-April 2020. Emerg Infect Dis. 2020;26:2709–2712. doi: 10.3201/eid2611.203163. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Khan M.S., Rego S., Rajal J.B., Bond V., Fatima R.K., Isani A.K., et al. Mitigating the impact of COVID-19 on tuberculosis and HIV services: A cross-sectional survey of 669 health professionals in 64 low and middle-income countries. PLoS One. 2021;16:e0244936. doi: 10.1371/journal.pone.0244936. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.World Health Organization Impact of the COVID-19 pandemic on TB detection and mortality in. 2020 2021 [consultado 5 Abr 2021]. Disponible en: https://www.who.int/publications/m/item/impact-of-the-covid-19-pandemic-on-tb-detection-and-mortality-in-2020. [Google Scholar]
- 7.World Health Organization Global tuberculosis report; 2020 2020 [consultado 5 Abr 2021]. Disponible en: https://www.who.int/publications/i/item/9789240013131. [Google Scholar]
- 8.Lo S.H., Lin C.Y., Hung C.T., He J.J., Lu P.L. The impact of universal face masking and enhanced hand hygiene for COVID-19 disease prevention on the incidence of hospital-acquired infections in a Taiwanese hospital. Int J Infect Dis. 2021;104:15–18. doi: 10.1016/j.ijid.2020.12.072. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chen C.H., Lai C.C., Chao C.M., Tang H.J. Zero measles after COVID-19 pandemic in Taiwan. J Infect. 2021;82:414–451. doi: 10.1016/j.jinf.2020.10.021. [DOI] [PubMed] [Google Scholar]
- 10.Lai C.C., Chen S.Y., Yen M.Y., Lee P.I., Ko W.C., Hsueh P.R. The impact of COVID-19 preventative measures on airborne/droplet-transmitted infectious diseases in Taiwan. J Infect. 2021;82:e30–e31. doi: 10.1016/j.jinf.2020.11.029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Varela F.H., Scotta M.C., Polese-Bonatto M., Sartor I.T.S., Ferreira C.F., Fernandes I.R., et al. Absence of detection of RSV and influenza during the COVID-19 pandemic in a Brazilian cohort: Likely role of lower transmission in the community. J Glob Health. 2021;11:05007. doi: 10.7189/jogh.11.05007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Cruz-Ferro E., Ursúa-Díaz M.I., Taboada-Rodríguez J.A., Hervada-Vidal X., Anibarro L., Túñez V., et al. Epidemiology of tuberculosis in Galicia Spain, 16 years after the launch of the Galician tuberculosis programme. Int J Tuberc Lung Dis. 2014;18:134–140. doi: 10.5588/ijtld.13.0419. [DOI] [PubMed] [Google Scholar]
- 13.Comella-Del-Barrio P., de Souza-Galvão M.L., Prat-Aymerich C., Domínguez J. Impact of COVID-19 on Tuberculosis Control. Arch Bronconeumol. 2021;57:5–6. doi: 10.1016/j.arbres.2020.11.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Di Gennaro F., Gualano G., Timelli L., Vittozzi P., di Bari V., Libertone R., et al. Increase in tuberculosis diagnostic delay during first wave of the COVID-19 Pandemic: Data from an italian infectious disease referral hospital. Antibiotics (Basel). 2021;10:272. doi: 10.3390/antibiotics10030272. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chaabna K., Doraiswamy S., Mamtani R., Cheema S. Facemask use in community settings to prevent respiratory infection transmission: A rapid review and meta-analysis. Int J Infect Dis. 2021;104:198–206. doi: 10.1016/j.ijid.2020.09.1434. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Behr M.A., Edelstein P.H., Ramakrishnan L. Revisiting the timetable of tuberculosis. BMJ. 2018;362:k2738. doi: 10.1136/bmj.k2738. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Deutsch-Feldman M., Pratt R.H., Price S.F., Tsang C.A., Self J.L. Tuberculosis - United States, 2020. MMWR Morb Mortal Wkly Rep. 2021;70:409–414. doi: 10.15585/mmwr.mm7012a1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Chen H., Zhang K. Insight into the impact of the COVID-19 epidemic on tuberculosis burden in China. Eur Respir J. 2020;56:2002710. doi: 10.1183/13993003.02710-2020. doi: 10.1183/13993003.02710-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.McQuaid C.F., McCreesh N., Read J.M., Sumner T., White R.G., Harris R.C., et al. The potential impact of COVID-19-related disruption on tuberculosis burden. Eur Respir J. 2020;56:2001718. doi: 10.1183/13993003.01718-2020. doi: 10.1183/13993003.01718-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cronin A.M., Railey S., Fortune D., Wegener D.H., Davis J.B. Notes from the Field: Effects of the COVID-19 Response on Tuberculosis Prevention and Control Efforts - United States March-April 2020. MMWR Morb Mortal Wkly Rep. 2020;69:971–972. doi: 10.15585/mmwr.mm6929a4. [DOI] [PMC free article] [PubMed] [Google Scholar]