Abstract
目的
基于选择性细胞滞留(selective cell retention,SCR)技术中的细胞与细胞外基质黏附理论,拟设计一种简化多肽表面修饰脱钙骨基质(demineralized bone matrix,DBM),以期能同时促进骨再生与血管生成。
方法
选择层粘连蛋白(laminin,LN)α4 链核心区域功能肽(LNα4)、环状 RGD(cyclic RGDfK,cRGD)和带胶原结构域肽(collagen-binding domain,CBD),固相合成 CBD-LNα4-cRGD 多肽,表面修饰于 DBM,构建 DBM/CBD-LNα4-cRGD(以下简称 DBM/LN)支架材料。观测 DBM/LN 形态特征、CBD-LNα4-cRGD 表面修饰 DBM 的稳定性以及 CBD-LNα4-cRGD 表面修饰对小鼠血管内皮祖细胞(endothelial progenitor cells,EPCs)黏附、增殖以及管腔形成的影响,Western blot 验证其影响 EPCs 血管生成的分子机制。然后,取 24 只 10 周龄雄性 C57 小鼠制备 2 mm 长股骨缺损模型,分别采用经 SCR 技术处理的 DBM/LN(DBM/LN 组 ,n=12)和 DBM(DBM 组,n=12)修复骨缺损。术后 8 周,行影像学检查、血管造影、组织学及免疫荧光染色[CD31、内皮黏蛋白(endomucin,Emcn)、Ki67]观察,评估 DBM/LN 促进血管生成和骨再生能力。
结果
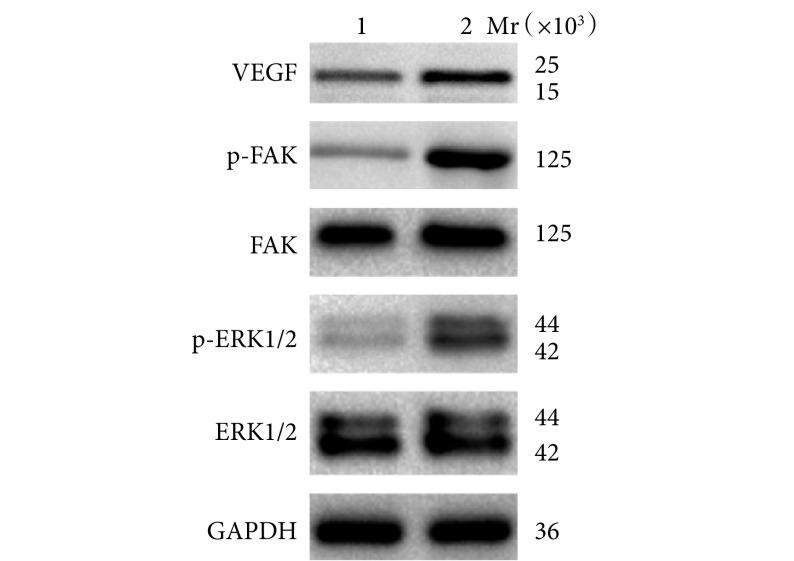
材料相关检测显示,与 DBM 相比,DBM/LN 表面更粗糙,但孔径差异无统计学意义(t=0.218,P=0.835);经 SCR 技术处理后,荧光强度提示 DBM/LN 支架稳定有效;与 DBM 相比,CBD-LNα4-cRGD 表面修饰后,DBM/LN 能黏附更多的 EPCs (P<0.05),且增殖速度增加、管腔形成能力增强。Western blot 检测示 DBM/LN 中 EPCs 表达 VEGF、p-FAK 和 p-ERK1/2 水平显著高于 DBM(P<0.05)。动物实验观测显示,与 DBM 组相比,DBM/LN 组骨缺损处血管生成和骨再生能力更强,血管体积和血管表面积差异均有统计学意义(P<0.05),CD31hiEmcnhi细胞数量显著增加(P<0.05)。
结论
DBM/LN 支架材料能促进 EPCs 黏附、H 型血管生成,实现小鼠骨缺损修复中血管生成和骨再生的有效耦联。
Keywords: 层粘连蛋白α4链, 血管内皮祖细胞, 骨再生, H型血管, 脱钙骨基质, 小鼠
Abstract
Objective
Based on the cell-extracellular matrix adhesion theory in selective cell retention (SCR) technology, demineralized bone matrix (DBM) modified by simplified polypeptide surface was designed to promote both bone regeneration and angiogenesis.
Methods
Functional peptide of α4 chains of laminin protein (LNα4), cyclic RGDfK (cRGD), and collagen-binding domain (CBD) peptides were selected. CBD-LNα4-cRGD peptide was synthesized in solid phase and modified on DBM to construct DBM/CBD-LNα4-cRGD scaffold (DBM/LN). Firstly, scanning electron microscope and laser scanning confocal microscope were used to examine the characteristics and stability of the modified scaffold. Then, the adhesion, proliferation, and tube formation properties of CBD-LNα4-cRGD peptide on endothelial progenitor cells (EPCs) were detected, respectively. Western blot method was used to verify the molecular mechanism affecting EPCs. Finally, 24 10-week-old male C57 mice were used to establish a 2-mm-length defect of femoral bone model. DBM/LN and DBM scaffolds after SCR treatment were used to repair bone defects in DBM/LN group (n=12) and DBM group (n=12), respectively. At 8 weeks after operation, the angiogenesis and bone regeneration ability of DBM/LN scaffolds were evaluated by X-ray film, Micro-CT, angiography, histology, and immunofluorescence staining [CD31, endomucin (Emcn), Ki67].
Results
Material related tests showed that the surface of DBM/LN scaffold was rougher than DBM scaffold, but the pore diameter did not change significantly (t=0.218, P=0.835). After SCR treatment, DBM/LN scaffold was still stable and effective. Compared with DBM scaffold, DBM/LN scaffold could adhere to more EPCs after the surface modification of CBD-LNα4-cRGD (P<0.05), and the proliferation rate and tube formation ability increased. Western blot analysis showed that the relative expressions of VEGF, phosphorylated FAK (p-FAK), and phosphorylated ERK1/2 (p-ERK1/2) proteins were higher in DBM/LN than in DBM (P<0.05). In the femoral bone defect model of mice, it was found that mice implanted with DBM/LN scaffold had stronger angiogenesis and bone regeneration capacity (P<0.05), and the number of CD31hiEmcnhi cells increased significantly (P<0.05).
Conclusion
DBM/LN scaffold can promote the adhesion of EPCs. Importantly, it can significantly promote the generation of H-type vessels and realize the effective coupling between angiogenesis and bone regeneration in bone defect repair.
Keywords: Laminin α4 chains, endothelial progenitor cells, bone regeneration, H-type vessels, demineralized bone matrix, mouse
节段性骨缺损常发生在创伤、骨感染和骨肿瘤截骨术后,是临床骨科难题之一。自体骨移植修复是临床修复骨缺损的“金标准”,但存在自体骨量不足等明显局限性,获取足量的高活性骨修复材料是修复此类缺损的关键[1-2]。理想的骨修复材料应具有快速血管化能力和强大的骨诱导生物活性。选择性细胞滞留(selective cell retention,SCR)技术是近年来国外学者报道的骨髓富集技术之一,可在支架材料中快速构建一个包含 BMSCs、血管内皮祖细胞(endothelial progenitor cells,EPCs)和各类细胞因子的微环境,达到高效、实用的临床效果[3]。该技术实际上是一种原位组织工程技术,滞留的细胞及因子越多,为支架提供的骨诱导微环境越好,越利于骨缺损修复。因此,对支架材料表面进行有效修饰,以期促进 SCR 技术处理时细胞和细胞因子滞留,成为当前骨再生领域的重要研究方向[4]。
骨缺损部位严重缺氧,骨再生过程中需要血管运输营养物质及代谢产物,所以血管生成十分重要[5]。前期我们对支架材料的研发聚焦于促进 MSCs 的黏附、迁移、增殖和分化,而对 EPCs 的募集、增殖及分化研究不够重视,导致很多支架材料在实际修复骨缺损中效果不佳。层粘连蛋白(laminin,LN)是一种基底膜蛋白,对维持和促进内皮细胞血管生成十分重要[6],能够促进内皮细胞的黏附、铺展与增殖[7]。但是 LN 由于相对分子质量大、蛋白质四级结构复杂、体外合成不稳定,尚无相关的简化功能肽在骨组织工程领域应用。LNα4 链是促进血管生成的关键部分,与肿瘤增殖、迁移等多种疾病的发生发展密切相关[8]。本课题组长期致力于骨缺损再生研究,本次研究拟将前期研究合成的 LNα4 链核心区域功能肽,与环状 RGD(cyclic RGDfK,cRGD)和带胶原结构域肽(collagen-binding domain,CBD)固相合成连接,然后表面修饰于脱钙骨基质(demineralized bone matrix,DBM),构建 DBM/CBD-LNα4-cRGD(以下简称 DBM/LN)支架材料,并行 SCR 技术处理,通过体外细胞实验和动物模型实验,验证该新型材料促进骨及血管生成的作用,以期为解决骨再生过程中血管化不足的难题提供参考。报告如下。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
10 周龄雄性 C57 小鼠 26 只,体质量 25~28 g,由北京华阜康生物科技股份有限公司提供。
DBM(北京大清生物技术股份有限公司);细胞计数试剂盒 8(cell counting kit 8,CCK-8;Dojindo 公司,日本);RPIM1640 培养基、Matrigel 基质胶(Corning 公司,美国);内皮黏蛋白(endomucin,Emcn)、CD31(Santa Cruz 公司,美国);Ki67(R&D 公司,美国);裂解缓冲液(Roche 公司,德国);VEGF、FAK、p-FAK、ERK1/2、p-ERK1/2 及 GAPDH 抗体(Abcam 公司,英国)。
Quanta 200 环境扫描电镜(FEI 公司,荷兰);荧光显微镜(Olympus 公司,日本);MaxQ HP 481 轨道振荡器(Thermo Fisher 公司,美国);LSM780 激光扫描共聚焦显微镜(Carl Zeiss 公司,德国);Image J 软件(美国国立卫生研究院)。
1.2. DBM/LN 制备及观测
1.2.1. DBM/LN 制备
采用固相合成法合成 CBD-LNα4-cRGD 多肽和 FITC 荧光标记的 CBD-LNα4-cRGD 多肽,其氨基酸序列为 TKKTLRTIND-AKYHEISIIYH-cRGDfK 和 TKKTLRTINDAK(-FITC)YHEISIIYH-cRGDfK;以质谱仪进行相对分子质量测定,以高效液相色谱仪鉴定纯度均>95%;合成与鉴定均由上海强耀生物科技有限公司完成。
首先,将 CBD-LNα4-cRGD 多肽以及 FITC 荧光标记的 CBD-LNα4-cRGD 多肽分别溶于含 2% 牛血清白蛋白的 PBS 溶液中,工作浓度为 100 μmol/L。将大小为 1.0 cm×1.0 cm×0.5 cm 的无菌异种来源 DBM 置入 CBD-LNα4-cRGD 溶液中,4℃ 浸没修饰 6 h 后 PBS 漂洗,氮气干燥。最终获得无荧光标记以及 FITC 荧光标记的 DBM/LN。
1.2.2. 支架材料形态特征观察
将单纯 DBM、DBM/LN 制作成 0.5 cm×0.5 cm×0.3 cm 大小,分别置于环境扫描电镜样品扫描仓。扫描条件:低真空模式、加速电压 25 kV、放大扫描倍数 100 倍。获得图像后,每个样品取 10 个孔,测量每个孔横向最小和最大直径,取其均值作为孔径。两种支架材料各取 10 个样本进行观测。
1.2.3. CBD-LNα4-cRGD 表面修饰的稳定性检测
严格避光条件下,取 DBM 以及 FITC 荧光标记的 DBM/LN,分别置于共聚焦培养皿中。扫描条件:激发波长 488 nm,接收波长 525 nm,荧光单通道模式。采用激光扫描共聚焦显微镜对样品进行三维扫描并重建清晰图像。然后,将样品置入干细胞富集器内;于 30℃ 条件下,加入含 10% 牛血清白蛋白的 PBS 缓冲液 50 mL,以高负荷强度模拟 SCR 技术操作 12 次;放入带滤网离心管中,以 200×g 离心 3 min。再次以相同扫描条件对样品进行三维扫描重建,对比模拟 SCR 技术处理前后样品荧光强度变化,以判断 CBD-LNα4-cRGD 修饰 DBM 的稳定性。实验重复 4 次。
1.2.4. CBD-LNα4-cRGD 表面修饰对 EPCs 黏附能力的影响
① 离心细胞黏附实验:以 Hoechst-33342 染料标记 EPCs(Z7030031;BioChain 公司,美国)后,调整细胞密度为 5×106个/mL,接种于 6 孔板中,每孔 2.5 mL。将大小为 1.00 cm×1.00 cm×0.05 cm 的 DBM/LN 及 DBM 以医用胶固定于盖玻片上,分别浸没于 6 孔板中,置入 37℃ 细胞培养箱中培养 5 min。随机取 3 块盖玻片,在荧光显微镜下捕获荧光图像。另取 3 块盖玻片反转置于带滤网的离心管内,以 50×g 离心 5 min 后取出,荧光显微镜下再次捕获荧光图像。利用 Image J 软件对离心前后图像进行细胞计数,计算细胞密度(个/ cm2)。实验重复 4 次。
② 振荡细胞黏附实验:将 EPCs 密度调整为 5×106个/mL,接种于 6 孔板中,每孔 2.5 mL。取 6 个大小为 1.00 cm×1.00 cm×0.05 cm 的 DBM/LN,浸没于 6 孔板中,置入 37℃ 细胞培养箱中 5 min。随机取 3 个样品置于含 10 mL 基础培养基(含 10% FBS 的 RPIM1640 培养基)的 50 mL 离心管中,将离心管垂直固定在轨道振荡器,以 150 r/min 振动 2 min,除去未贴附细胞。将上述支架材料转移至含 500 μL 基础培养基的 48 孔板,置于 37℃ 细胞培养箱中培养 4 h;每孔加入 50 μL CCK-8 试剂,继续培养 3 h。将试剂移入 96 孔板中,使用酶标仪获取波长 450 nm 处的吸光度(A)值,以代表支架材料中的细胞数。
1.2.5. 激光扫描共聚焦显微镜观察 EPCs 增殖
取大小为 0.5 cm×0.5 cm×0.5 cm 的 DBM、DBM/LN,分别置于干细胞富集器。调整 EPCs 密度为 1×105个/mL 后,吸取 10 mL 置入干细胞富集器,同 1.2.3 方法模拟 SCR 技术的富集过程,进行 4 个循环。取出富集 EPCs 的支架材料,置入 48 孔板,加入 500 μL 含10% FBS 的 RPIM1640 培养基后,置于 37℃ 细胞培养箱中培养。10 d 后取出支架材料常规漂洗固定 30 min,PBS 缓冲液漂洗 3 次;置于 24 孔板内,以 0.5% Triton X-100 浸泡 10 min,PBS 缓冲液漂洗;以 3% 牛血清白蛋白溶液封闭 2 h;将罗丹明标记的鬼笔环肽工作液(25 mg/mL)以每孔 1.5 mL 浸没支架材料,4℃ 避光孵育过夜。PBS 缓冲液漂洗 3 次,DAPI 工作液染色 5 min,PBS 缓冲液漂洗 3 次,激光扫描共聚焦显微镜下观察。
1.2.6. CBD-LNα4-cRGD 对 EPCs 管腔形成的影响
将 CBD-LNα4-cRGD 加入 RPIM 1640 培养基中,终浓度为 200 nmol/L,用此培养基体外培养 EPCs,培养 4 h 后收集细胞,调整细胞密度为 1.2×105个/mL。冰上放置 24 孔板,加入 Matrigel 基质胶(289 μL/孔),37℃ 孵育 60 min;取 EPCs 细胞悬液加至基质胶(300 μL/孔),37℃ 孵育 4 h 后,倒置显微镜观察 EPCs 管腔形成,Image J 软件测量管腔长度。以不含 CBD-LNα4-cRGD 培养基培养的 EPCs 作为空白对照。
1.2.7. Western blot 检测
采用间接共培养方式,将 EPCs 以 1×105个/mL 密度接种于 6 孔板中,待细胞达 70% 融合时放入 Transwell 小室,DBM/LN 组上室内放入 DBM/LN,DBM 组放入 DBM,每组6 个样品。继续培养 12 h,使用含 1% 蛋白酶抑制剂和磷酸酶抑制剂的冷冻裂解缓冲液裂解 EPCs。用 SDS-PAGE 凝胶电泳法分离蛋白,转移到聚偏二氟乙烯膜。加入一抗 VEGF、p-FAK、FAK、p-ERK1/2、ERK1/2、GAPDH 抗体,4℃ 摇床缓慢摇动过夜;加入对应一抗来源的辣根过氧化物标记二抗,37℃ 摇床缓慢摇动 120 min。凝胶成像仪中曝光、收集图像,使用 Image J 软件计算目的蛋白相对表达量。p-FAK 及p-ERK1/2 蛋白相对表达量为与 FAK 和FAK1/2 的比值。
1.3. 动物实验
1.3.1. 实验分组及方法
取大小为 5 mm×2 mm×2 mm 的 DBM/LN 和 DBM,分别放置于干细胞富集器内。取 10 周龄雄性 C57 小鼠 2 只,无菌条件下取小鼠股骨和胫骨,用注射器冲出全部骨髓,红细胞裂解液裂解红细胞后,得到骨髓有核细胞,采用磁珠分选 CD31+ 细胞,调整密度为 1×105个/mL。吸取 10 mL 细胞悬液加入干细胞富集器,用 50 mL 含 10% 牛血清白蛋白的 PBS 缓冲液,以高负荷强度模拟 SCR 技术富集过程,循环 4 次。将富集细胞后的支架放入带滤网离心管中,以 200×g 离心 3 min,备用。
取 10 周龄雄性 C57 小鼠 24 只,腹腔注射 0.5% 戊巴比妥钠 0.2 mL,麻醉成功后暴露右后肢股骨,在股骨中段植入 1 块微型钢板,两端分别拧入 2 枚螺钉固定,电钻制作 2 mm 节段性骨缺损模型。将股骨缺损模型随机分为 DBM/LN 组(n=12)及 DBM 组(n=12),将上述制备的 DBM/LN 和 DBM 分别放入股骨缺损处。术后 8 周取材进行以下观测。
1.3.2. 观测指标
① 影像学观察:两组小鼠骨缺损部位行 X 线片和 Micro-CT 三维重建检查。
② 血管造影观察[9]:两组小鼠分别腹腔注射 0.5 mL 1% 戊巴比妥钠处死后,打开胸腔,将头皮针插入左心室建立流入道,右心耳建立流出道。从左心室注射 5 mL 肝素(100 U/mL)、3 mL 10% 甲醛和 3 mL 造影剂,4℃ 过夜后截取小鼠右侧股骨,置于 4% 多聚甲醛固定 3 d,加入 pH7.2 的 EDTA 溶液脱钙 21 d。采用 Micro-CT 扫描,计算血管体积和血管表面积,每组取 6 个样本。
③ 免疫荧光染色及组织学观察:取多聚甲醛固定、脱钙后的股骨样本切片(片厚 5 μm),取部分切片分别与一抗小鼠 CD31、Emcn、Ki67 抗体孵育,4℃ 过夜;37℃,荧光偶联二抗孵育 1 h。激光扫描共聚焦显微镜采集图像,以 Image J 软件对图像进行定量分析,分别计数 CD31hiEmcnhi细胞以及 Ki67 和 Emcn 双染阳性细胞并计算密度(个/mm2)。每组取 6 个样本。取部分切片行 HE 染色,光镜下观察新骨生成情况。
1.4. 统计学方法
采用 SPSS17.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
2.1. 支架材料观测
2.1.1. 支架材料形态特征
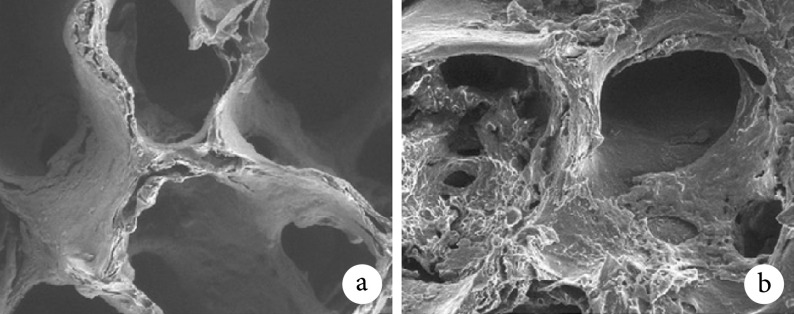
环境扫描电镜观察示,与 DBM 相比,DBM/LN 表面粗糙度增加(图 1)。DBM 及 DBM/LN 孔径分别为(433.123±21.024)、(436.256±21.172)μm,差异无统计学意义(t=0.218,P=0.835)。
图 1.
Representative micrographs of scaffolds by environmental scanning electron microscopy (×100)
环境扫描电镜观察支架材料形态(×100)
a. DBM;b. DBM/LN
a. DBM; b. DBM/LN
2.1.2. CBD-LNα4-cRGD 表面修饰的稳定性检测
激光扫描共聚焦显微镜观察示,模拟 SCR 技术处理前后 DBM/LN 均具有较强荧光,提示 DBM/LN 支架稳定有效;而 DBM 未检测到荧光(图 2)。
图 2.
Observation of scaffolds by laser scanning confocal microscope (×200)
激光扫描共聚焦显微镜观察支架材料(×200)
左:模拟 SCR 技术处理前 右:模拟 SCR 技术处理后 a. DBM;b. DBM/LN
Left: Before SCR treatment Right: After SCR treatment a. DBM; b. DBM/LN
2.1.3. CBD-LNα4-cRGD 表面修饰对 EPCs 黏附能力的影响
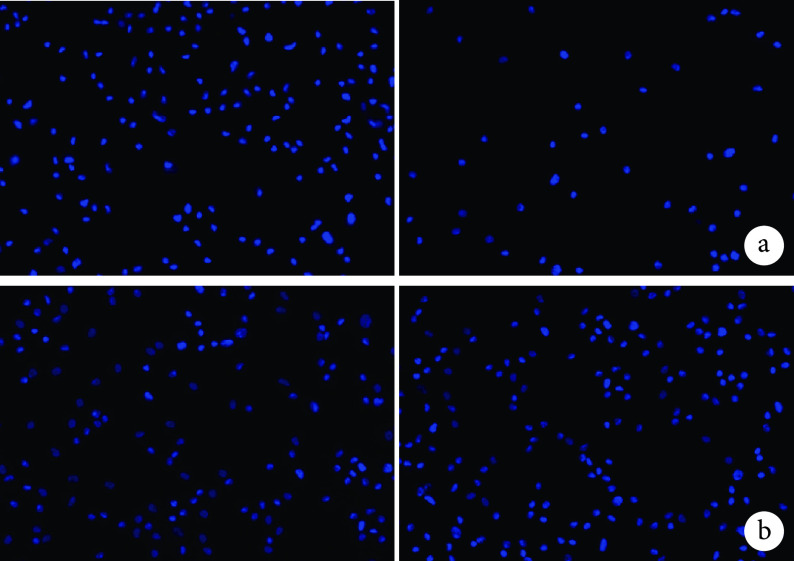
① 离心细胞黏附实验:离心前,DBM 组及 DBM/LN 组盖玻片上的 EPCs 密度分别为(6.421±0.323)、(6.367±0.208)×104个/cm2,差异无统计学意义(t=0.243,P=0.820);离心后分别为(1.867±0.252)、(5.267±0.404)×104个/cm2,DBM/LN 组 EPCs 密度明显高于 DBM 组,差异有统计学意义(t=12.368,P=0.000)。见图 3。
图 3.
The cell density before and after centrifugation observed by fluorescence microscope (×100)
荧光显微镜观察离心前后支架上细胞密度(×100)左:离心前 右:离心后 a. DBM;b. DBM/LN
Left: Before centrifugationRight: After centrifugation a. DBM; b. DBM/LN
② 振荡细胞黏附实验:振荡前,DBM 组及 DBM/LN 组 A 值分别为 1.583±0.073、1.573±0.097,差异无统计学意义(t=0.143,P=0.893);振荡后分别为 0.548±0.059、0.875±0.042,DBM/LN 组明显高于 DBM 组,差异有统计学意义(t=7.821,P=0.001)。
2.1.4. 激光扫描共聚焦显微镜观察 EPCs 增殖
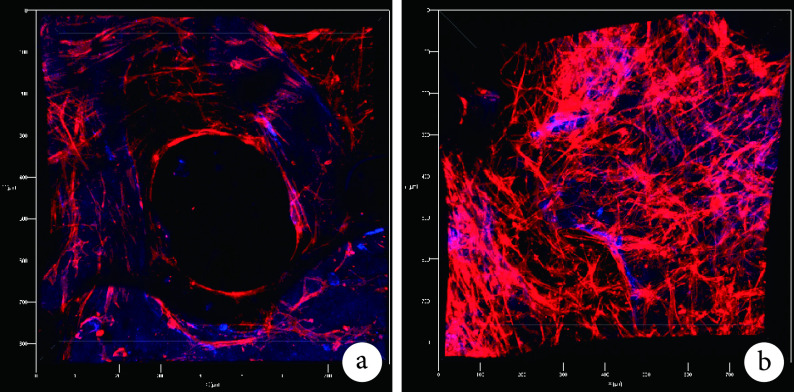
激光扫描共聚焦显微镜观察见,DBM/LN 与 DBM 相比有更多的 EPCs,细胞的延展性和增殖能力更强。见图 4。
图 4.
Proliferation of EPCs on different scaffolds by laser scanning confocal microscope (×100)
激光扫描共聚焦显微镜观察支架材料上 EPCs 增殖情况(×100)
a. DBM;b. DBM/LN
a. DBM; b. DBM/LN
2.1.5. CBD-LNα4-cRGD 对 EPCs 管腔形成的影响
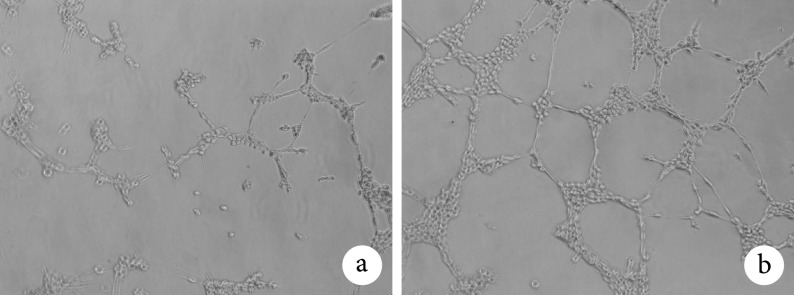
与空白对照 EPCs 相比,加入 CBD-LNα4-cRGD 能明显促进 EPCs 的管腔形成;前者管腔长度为(483.6±85.1) μm,后者为(1311.3±136.3) μm,差异有统计学意义(t=8.924,P=0.000)。见图 5。
图 5.
The effect of CBD-LNα4-cRGD on the tube formation of EPCs observed by inverted microscope (×200)
倒置显微镜观察 CBD-LNα4-cRGD 对 EPCs 管腔形成的影响(×200)
a. 含 CBD-LNα4-cRGD 的 RPIM1640 培养基培养的 EPCs;b. RPIM1640 培养基培养的 EPCs
a. EPCs cultured in RPIM1640 medium containing CBD-LNα4-cRGD; b. EPCs cultured in RPIM 1640 medium
2.1.6. Western blot 检测
DBM/LN 组 EPCs 中 VEGF、p-FAK、p-ERK1/2 蛋白相对表达量分别为 0.955±0.028、0.621±0.056、0.721±0.044,较 DBM 组的 0.611±0.074、0.316±0.022、0.440±0.089 明显增加,差异均有统计学意义(t=7.531,P=0.002;t=8.780,P=0.001;t=4.902,P=0.008)。见图 6。
图 6.
The relative expressions of target proteins in the two groups detected by Western blot
Western blot 检测两组目的蛋白相对表达量
Mr:相对分子质量 1: DBM 2:DBM/LN
Mr: Relative molecular mass1: DBM 2: DBM/LN
2.2. 动物实验观测
2.2.1. 影像学观察
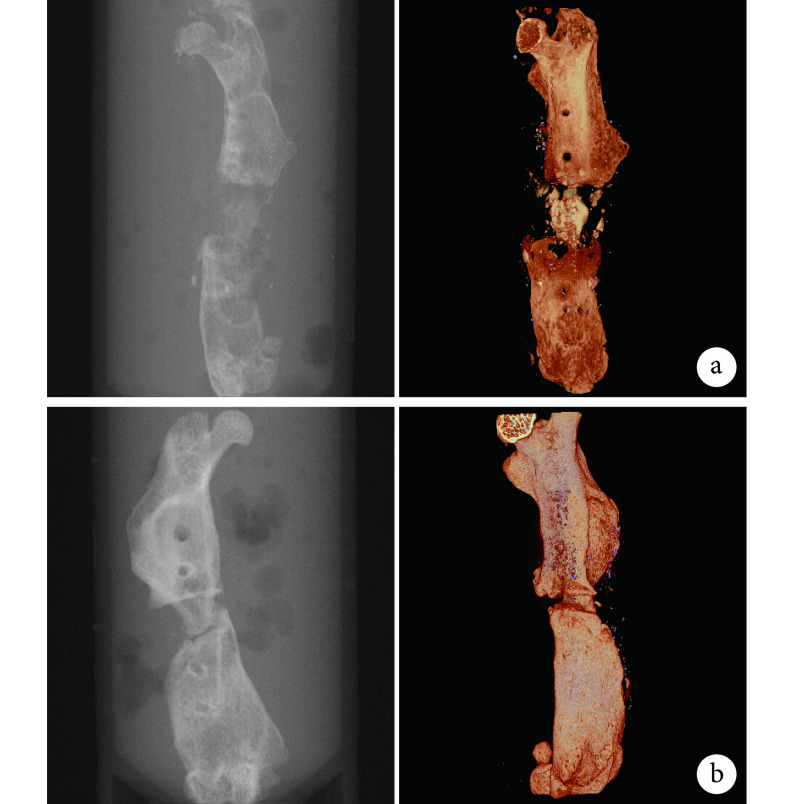
术后 8 周,X 线片和 Micro-CT 三维重建显示两组均有新骨形成,但 DBM/LN 组新骨形成更多。见图 7。
图 7.
Imaging observation of bone defect site at 8 weeks after operation
术后 8 周骨缺损部位影像学观察
左:X 线片 右:Micro-CT 三维重建 a. DBM 组;b. DBM/LN 组
Left: X-ray film Right: Micro-CT three-dimensional reconstruction a. DBM group; b. DBM/LN group
2.2.2. 血管造影观察
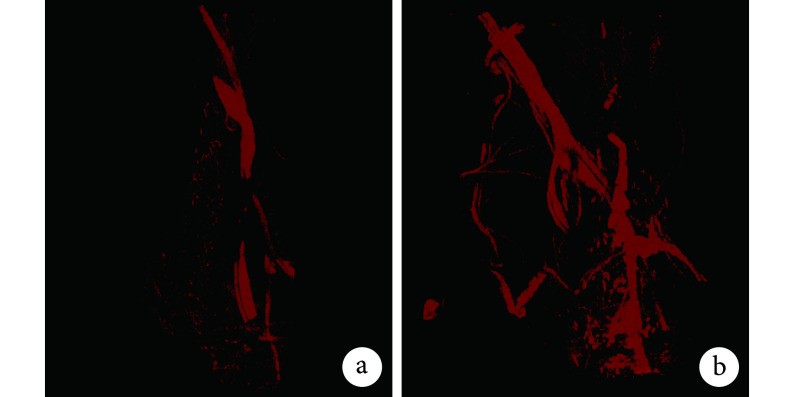
术后 8 周,Micro-CT 血管造影观察发现,与 DBM 组相比,DBM/LN 组支架血管更丰富(图 8)。DBM/LN 组血管体积和血管表面积分别为(0.233±0.027)mm3、(15.237±1.153)mm2,较 DBM 组的(0.153±0.025)mm3、(8.615±0.917)mm2明显增大,差异均有统计学意义(t=3.766,P=0.020;t=7.786,P=0.002)。
图 8.
Angiographic analysis of Micro-CT
Micro-CT 血管造影观察
a. DBM 组;b. DBM/LN 组
a. DBM group; b. DBM/LN group
2.2.3. 免疫荧光染色观察
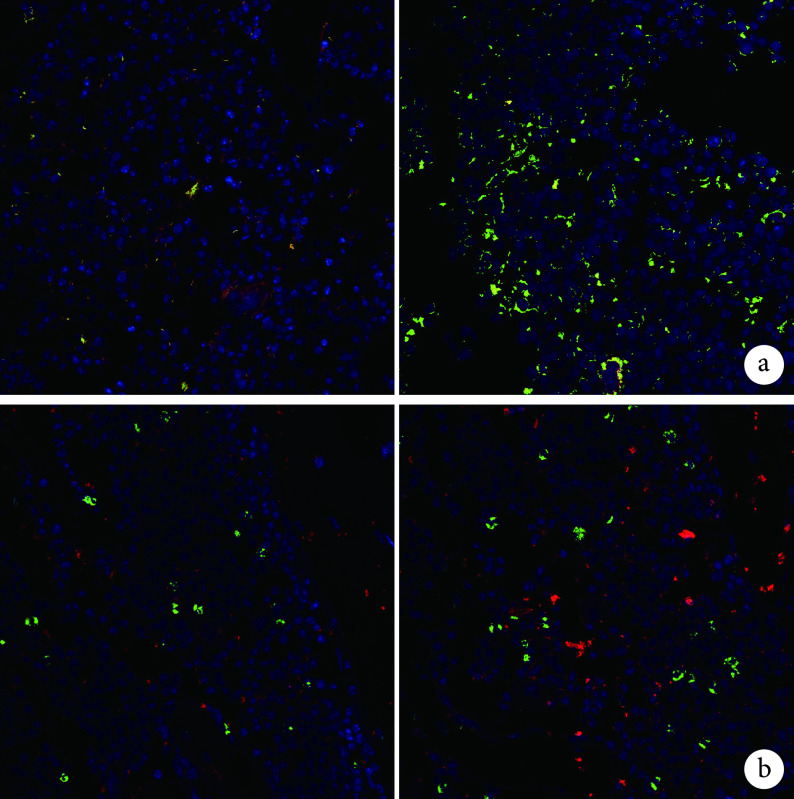
术后 8 周,DBM/LN 组中 CD31hiEmcnhi细胞密度为(10.033±1.320)个/mm2,较 DBM 组的(2.733±0.404)个/mm2明显增加,差异有统计学意义(t=9.159,P=0.001)。DBM/LN 组中 Ki67 和 Emcn 双染阳性细胞密度为(7.679±1.114)个/mm2,较 DBM 组(4.517±0.819)个/mm2明显增加,差异有统计学意义(t=3.961,P=0.017)。见图 9。
图 9.
Immunofluorescence staining of bone defect site (×400)Left: DBM group Right: DBM/LN group a. Immunofluorescence staining images of CD31 (red) and Emcn (green); b. Immunofluorescence staining images of Emcn (green) and Ki67 (red)
骨缺损区免疫荧光染色观察(×400)
左:DBM 组 右:DBM/LN 组 a. CD31(红色)和 Emcn(绿色)免疫荧光染色;b. Ki67(红色)和 Emcn(绿色)免疫荧光染色
2.2.4. 组织学观察
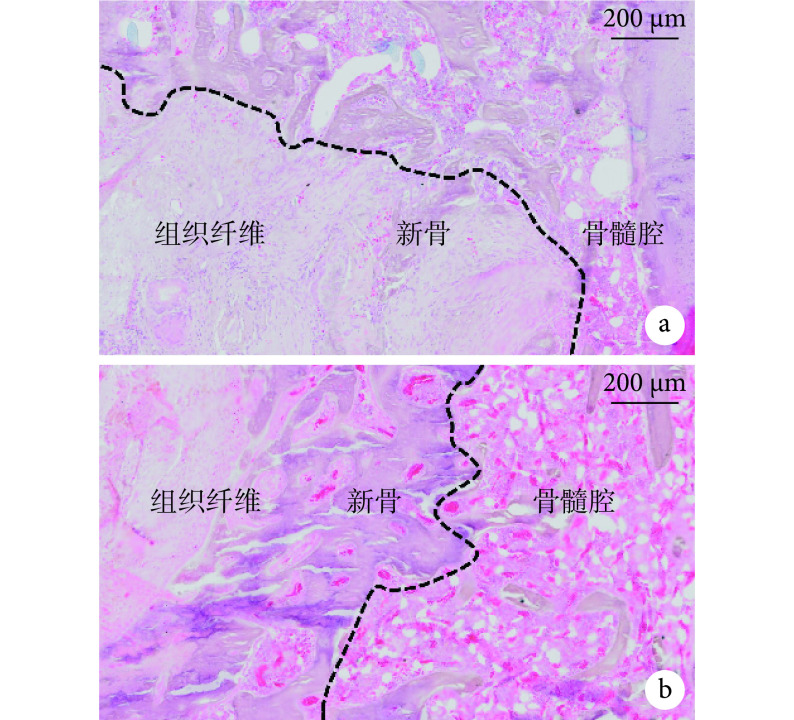
HE 染色示,DBM/LN 组新骨生成显著多于 DBM 组。见图 10。
图 10.
HE staining of bone defect site (×200)
骨缺损区 HE 染色观察(×200)
a. DBM 组;b. DBM/LN 组
a. DBM group; b. DBM/LN group
3. 讨论
目前,骨修复支架材料临床转化受到限制,主要原因是体内血管化不足和成骨相关前体细胞成骨分化活性弱。因此,相关研究的热点是赋予支架材料血管化和骨诱导的特性,例如改变生物材料的特性,使用特定生长因子来刺激血管发育、成熟以及成骨前体细胞的成骨分化。骨诱导和血管化对促进骨组织再生和重建都有重要作用,但由于机制不同,单用一种生物活性生长因子很难同时实现这两种生物学功能[10-11]。而 SCR 技术是利用细胞黏附性的差异,实现对目标细胞的滞留。因此,基于 EPCs 和 MSCs 共同表面整合素受体,我们在 DBM 支架材料上增加额定配体的思路应运而生。
细胞外基质蛋白能够显著促进细胞黏附,在生物材料表面修饰中有着广泛的应用。LN 是细胞外基质中一种可溶性大分子糖蛋白,通过整合素和蛋白聚糖介导,调节细胞黏附,在细胞生长和分化中起着至关重要的作用[12]。研究报道,LN 修饰的钛合金材料提高了 EPCs 的黏附、铺展、增殖及迁移能力[7],同时还能促进 BMSCs 的黏附和分化[13]。由于 LN 是大分子量的蛋白,体外合成不仅难以保持四级空间结构,而且稳定性差、易降解,所以需要寻找其核心功能域,以期能保留其核心的黏附迁移能力。LNα4 链是构成 LN-8(α4β1γ1)和 LN-9(α4β2γ1)的一个组分,主要存在于脑、肌肉、骨腔等组织的血管内皮、外周神经的束膜以及发育中肌纤维周围的基底膜,是唯一在新生与成熟血管内皮基底膜中均表达的 α 亚基[14-15]。LNα4 与其受体 αvβ3 整合素共同分布在血管内皮基底膜中且紧密连接,在内皮细胞的黏附、增殖和迁移过程中起重要作用[16]。许多整合素分子均能影响血管生成(如 αvβ3、α5β1、α2β1、α1β1 等),其中以 αvβ3 尤为重要[17]。αvβ3 整合素可同时黏附基质金属蛋白酶和细胞外基质,并促进内皮细胞分泌和诱导基质金属蛋白酶激活,后者可降解细胞外基质成分,并使 VEGF 从细胞外基质中释放出来,促进内皮细胞增殖、迁移和分化[18]。LNα4 缺失会引起机体血管生成受损,而 αvβ3 整合素的抗体则能特异性抑制由于 LNα4 过表达而引起的人真皮微血管内皮细胞的伸展与迁移[6]。由此可见,LNα4 与整合素 αvβ3 的相互作用是影响血管生成过程的重要因素。同时在 MSCs 的表面也存在大量整合素 αvβ3。因此,我们将 LNα4 中核心功能结构肽与 cRGD 和 CBD 固相合成,得到 CBD-LNα4-cRGD 多肽,表面修饰于 DBM 支架。
血管生成在骨缺损修复中占据重要作用,充分的血供能够为骨再生提供充足营养。前期文献报道,H 型血管特征标志为 CD31hiEmcnhi,与骨再生具有密切关系[19]。本研究离心细胞黏附实验和振荡细胞黏附实验结果显示,DBM/LN 支架材料表现出更高的滞留 EPCs 能力。经罗丹明标记的鬼笔环肽工作液染色发现,与单纯 DBM 相比,DBM/LN 中 EPCs 更多,细胞的延展性和增殖能力更强。小鼠骨缺损模型中,血管造影和免疫荧光染色观察提示,DBM/LN 组基于 LNα4 链功能肽修饰的 DBM 支架材料上 CD31hiEmcnhi细胞密度达 DBM 组 2 倍以上,且增殖能力显著增强。CD31hiEmcnhi血管亚型具有特定的分子、形态特征和位置,成骨祖细胞偏向定植于 CD31hiEmcnhi血管周围,因为该部位富含成骨祖细胞生存和增殖所需的生长因子[19]。Western blot 检测结果显示 DBM/LN 支架处理 EPCs 后,VEGF、p-FAK 和 p-ERK1/2 蛋白表达水平显著高于 DBM。上述实验结果提示 LNα4 链功能肽能促进内皮细胞黏附、增殖和管腔形成,可能是通过激活 FAK 活性,触发整合素下游的酪氨酸磷酸化级联反应所致。
骨修复过程中血管不仅是营养物质扩散、细胞增殖和新骨组织生长的营养传递器官,同时在调节细胞和骨再生信号分子方面也起着关键作用。我们前期研究显示, LNα4 链功能肽能促进 MSCs 在支架材料上的黏附、增殖,并且促进其成骨分化[4]。本次研究制备的 DBM/LN 携带 cRGD,使 DBM 修饰界面含有多个整合素配体,可分别与 MSCs 和 EPCs 上高表达的整合素亚型相结合,既能提高支架与细胞特异性黏附,又兼顾骨再生和血管生成[20]。
综上述,DBM/LN 支架材料能促进 EPCs 的黏附,最重要的是能显著促进 H 型血管的生成,实现骨缺损修复中血管生成和骨再生的有效耦联,为骨缺损修复的治疗提供了新的策略。
作者贡献:罗飞、董世武、许建中负责科研设计;汤勇负责实验实施、数据收集整理及统计分析、文章撰写;罗科宇、陈玥琦、高小亮、谭玖林、代其杰参与实验实施。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。基金项目经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:研究方案经陆军军医大学西南医院医学/动物实验伦理委员会批准。实验动物生产许可证号:SCXK(京)2019-0010,实验动物使用许可证号:SYXK(渝)2017-0011。
Funding Statement
国家自然科学基金面上项目(81472059、81974336)
National Natural Science Foundation of China (81472059, 81974336)
Contributor Information
世武 董 (Shiwu DONG), Email: dongshiwu@163.com.
飞 罗 (Fei LUO), Email: luofeispine@126.com.
References
- 1.García-Gareta E, Coathup MJ, Blunn GW Osteoinduction of bone grafting materials for bone repair and regeneration. Bone. 2015;81:112–121. doi: 10.1016/j.bone.2015.07.007. [DOI] [PubMed] [Google Scholar]
- 2.Sen MK, Miclau T. Autologous iliac crest bone graft: should it still be the gold standard for treating nonunions? Injury, 2007, 38 Suppl 1: S75-S80.
- 3.Hou T, Li Z, Luo F, et al A composite demineralized bone matrix—self assembling peptide scaffold for enhancing cell and growth factor activity in bone marrow. Biomaterials. 2014;35(22):5689–5699. doi: 10.1016/j.biomaterials.2014.03.079. [DOI] [PubMed] [Google Scholar]
- 4.Luo K, Gao X, Gao Y, et al Multiple integrin ligands provide a highly adhesive and osteoinductive surface that improves selective cell retention technology. Acta Biomater. 2019;85:106–116. doi: 10.1016/j.actbio.2018.12.018. [DOI] [PubMed] [Google Scholar]
- 5.Yang M, Li CJ, Xiao Y, et al Ophiopogonin D promotes bone regeneration by stimulating CD31 hi EMCN hi vessel formation. Cell Prolif. 2020;53(4):e12784. doi: 10.1111/cpr.12784. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Yousif LF, Di Russo J, Sorokin L Laminin isoforms in endothelial and perivascular basement membranes. Cell Adh Migr. 2013;7(1):101–110. doi: 10.4161/cam.22680. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kikkawa Y, Sugawara Y, Harashima N, et al Identification of laminin α5 short arm peptides active for endothelial cell attachment and tube formation. J Pept Sci. 2017;23(7-8):666–673. doi: 10.1002/psc.2987. [DOI] [PubMed] [Google Scholar]
- 8.Segarra M, Aburto MR, Cop F, et al Endothelial Dab1 signaling orchestrates neuro-glia-vessel communication in the central nervous system. Science. 2018;361(6404):eaao2861. doi: 10.1126/science.aao2861. [DOI] [PubMed] [Google Scholar]
- 9.Dou C, Ding N, Luo F, et al Graphene-based microRNA transfection blocks preosteoclast fusion to increase bone formation and vascularization. Adv Sci (Weinh) 2018;5(2):1700578. doi: 10.1002/advs.201700578. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Xu WL, Ong HS, Zhu Y, et al In situ release of VEGF enhances osteogenesis in 3D porous scaffolds engineered with osterix-modified adipose-derived stem cells . Tissue Eng Part A. 2017;23(9-10):445–457. doi: 10.1089/ten.tea.2016.0315. [DOI] [PubMed] [Google Scholar]
- 11.Yu WL, Sun TW, Qi C, et al Enhanced osteogenesis and angiogenesis by mesoporous hydroxyapatite microspheres-derived simvastatin sustained release system for superior bone regeneration. Sci Rep. 2017;7:44129. doi: 10.1038/srep44129. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Peng KY, Liu YH, Li YW, et al Extracellular matrix protein laminin enhances mesenchymal stem cell (MSC) paracrine function through αvβ3/CD61 integrin to reduce cardiomyocyte apoptosis. J Cell Mol Med. 2017;21(8):1572–1583. doi: 10.1111/jcmm.13087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Yeo IS, Min SK, Kang HK, et al Identification of a bioactive core sequence from human laminin and its applicability to tissue engineering. Biomaterials. 2015;73:96–109. doi: 10.1016/j.biomaterials.2015.09.004. [DOI] [PubMed] [Google Scholar]
- 14.Ljung K, Grönlund A, Felldin U, et al Human fetal cardiac mesenchymal stromal cells differentiate in vivointo endothelial cells and contribute to vasculogenesis in immunocompetent mice . Stem Cells Dev. 2019;28(5):310–318. doi: 10.1089/scd.2018.0198. [DOI] [PubMed] [Google Scholar]
- 15.Shan N, Zhang X, Xiao X, et al The role of laminin α4 in human umbilical vein endothelial cells and pathological mechanism of preeclampsia. Reprod Sci. 2015;22(8):969–979. doi: 10.1177/1933719115570913. [DOI] [PubMed] [Google Scholar]
- 16.Ishikawa T, Wondimu Z, Oikawa Y, et al Monoclonal antibodies to human laminin α4 chain globular domain inhibit tumor cell adhesion and migration on laminins 411 and 421, and binding of α6β1 integrin and MCAM to α4-laminins. Matrix Biol. 2014;36:5–14. doi: 10.1016/j.matbio.2014.03.003. [DOI] [PubMed] [Google Scholar]
- 17.Schmohl KA, Mueller AM, Dohmann M, et al Integrin αvβ3-mediated effects of thyroid hormones on mesenchymal stem cells in tumor angiogenesis. Thyroid. 2019;29(12):1843–1857. doi: 10.1089/thy.2019.0413. [DOI] [PubMed] [Google Scholar]
- 18.Bazzazi H, Zhang Y, Jafarnejad M, et al Computational modeling of synergistic interaction between αVβ3 integrin and VEGFR2 in endothelial cells: Implications for the mechanism of action of angiogenesis-modulating integrin-binding peptides. J Theor Biol. 2018;455:212–221. doi: 10.1016/j.jtbi.2018.06.029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Kusumbe AP, Ramasamy SK, Adams RH Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone. Nature. 2014;507(7492):323–328. doi: 10.1038/nature13145. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Verstappen J, Jin J, Kocer G, et al RGD-functionalized supported lipid bilayers modulate pre-osteoblast adherence and promote osteogenic differentiation. J Biomed Mater Res A. 2020;108(4):923–937. doi: 10.1002/jbm.a.36870. [DOI] [PubMed] [Google Scholar]