Abstract
目的
综述脂肪来源干细胞(adipose-derived stem cells,ADSCs)在皮肤瘢痕防治领域的研究进展。
方法
广泛查阅相关文献,对 ADSCs 预防、治疗皮肤瘢痕形成的体外实验、动物实验及临床研究效果、可能机制以及优化 ADSCs 效果的生物材料进行综述。
结果
体外、体内实验及临床研究提示 ADSCs 参与皮肤创伤愈合全过程,可能通过减轻炎症反应、促进血管新生,调控 p38/MAPK、过氧化物酶体增殖物激活受体 γ 或 TGF-β1/Smads 等通路抑制(肌)成纤维细胞活性,减少胶原沉积,从而预防、治疗皮肤瘢痕。生物工程材料,如猪脂肪源基质水凝胶、猪小肠黏膜下层细胞外基质以及人工合成的聚羟基丁酸酯-羟基戊酸盐支架,均有可能进一步提高 ADSCs 防治皮肤瘢痕形成的效能。
结论
ADSCs 在皮肤瘢痕防治研究中取得了显著进展,但临床应用途径仍待进一步研究。
Keywords: 脂肪来源干细胞, 皮肤瘢痕, 预防, 治疗, 研究进展
Abstract
Objective
To review the research progress of adipose-derived stem cells (ADSCs) in skin scar prevention and treatment.
Methods
The related literature was extensively reviewed and analyzed. The recent in vitroand in vivo experiments and clinical studies on the role of ADSCs in skin scar prevention and treatment, and the possible mechanisms and biomaterials to optimize the effect of ADSCs were summarized.
Results
As demonstrated by in vitro andin vivo experiments and clinical studies, ADSCs participate in the whole process of skin wound healing and may prevent and treat skin scars by reducing inflammation, promoting angiogenesis, or inhibiting (muscle) fibroblasts activity to reduce collagen deposition through the p38/mitogen-activated protein kinase, peroxisome proliferator activated receptor γ, transforming growth factor β1/Smads pathways. Moreover, bioengineered materials such as hydrogel from acellular porcine adipose tissue, porcine small-intestine submucosa, and poly (3-hydroxybutyrate-co-hydroxyvalerate) scaffold may further enhance the efficacy of ADSCs in preventing and treating skin scars.
Conclusion
Remarkable progress has been made in the application of ADSCs in skin scar prevention and treatment. While, further studies are still needed to explore the application methods of ADSCs in the clinic.
Keywords: Adipose-derived stem cells, skin scar, prevent, treatment, research progress
瘢痕组织是人体深度皮肤创伤修复的必然结果,与烧伤、外伤、手术切口、感染、慢性溃疡、异物、遗传及免疫功能等多种因素有关[1-2]。临床上,皮肤瘢痕可分为增生性瘢痕、瘢痕疙瘩、浅表性瘢痕、萎缩性瘢痕、挛缩性瘢痕、凹陷性瘢痕等[3],主要表现为皮肤局部外形和功能受损,可伴有局部皮肤瘙痒和/或顽固性疼痛。部分患者甚至因皮肤瘢痕而承受较大心理压力[4-5],生活质量显著下降。目前皮肤瘢痕发生机制尚不明确,治疗复杂且困难,是临床亟待解决的难题。探讨皮肤瘢痕发生的生理病理机制及可能的治疗靶点,对临床皮肤瘢痕诊治有重要意义。
脂肪来源干细胞(adipose-derived stem cells,ADSCs)是一种来源丰富的 MSCs,可通过微创方法从皮下脂肪组织中获得。由于 ADSCs 具有跨胚层多向分化潜能[6],同时具有自分泌及旁分泌功能,以及含量丰富、取材方便、创伤小、不涉及伦理问题等优点,已成为目前皮肤瘢痕防治领域的研究热点[7]。近年来有研究显示,脂肪系细胞具有抗纤维化作用。ADSCs 及成熟脂肪细胞均可通过旁分泌多种细胞生长因子来介导炎症反应及调控成纤维细胞(fibroblasts,Fb)增殖活化[8-9],对皮肤纤维化和难治性瘢痕有一定治疗作用[5, 10-11],但具体作用机制尚未完全阐明。本文将主要阐述 ADSCs 在皮肤瘢痕防治领域中的最新研究成果及其可能作用机制。
1. ADSCs 在皮肤瘢痕防治领域的相关研究
脂肪组织是皮肤固有结构之一,也是人体最大的内分泌器官,近年来其功能越来越受到研究者关注。研究提示,创伤愈合不良是瘢痕形成的重要原因,而脂肪系细胞能通过多种途径参与皮肤创伤愈合。当发生皮肤创伤时,脂肪细胞可通过肌动蛋白、肌球蛋白收缩“蠕动”到伤口周围[12],参与 Fb 招募及创伤修复[13]。另有研究提示,脂肪系细胞具有直接抗纤维化作用。ADSCs 及成熟脂肪细胞均可旁分泌多种细胞因子介导炎症调控及抗纤维化形成[8-9]。同时,皮内脂肪细胞进行性减少是多种皮肤纤维化疾病共同病理现象[8, 14];但在皮肤纤维化疾病中,脂肪细胞减少是启始原因还是伴随结果,目前尚无定论。这些研究成果提示 ADSCs 可能在皮肤纤维化及瘢痕形成中扮演重要角色,有望成为临床瘢痕防治的靶点。
1.1. ADSCs 在皮肤瘢痕防治领域的体外实验
肌 Fb 常被认为是 Fb 激活后的效应细胞,在伤口愈合和瘢痕形成中具有重要作用[15]:激活的肌 Fb 增殖活化,大量合成和分泌细胞外基质(extracellular matrix,ECM),其中 Ⅰ 型和 Ⅲ 型胶原含量尤其丰富,这两类胶原蛋白具有收缩能力,并且与平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达密切相关。而活化的(肌)Fb 关键特征之一也是表达 α-SMA。Spiekman 等[16]报道,TGF-β1 可促进 Fb 向肌 Fb 转化,但 ADSCs 分泌的细胞因子可以抑制肌 Fb 表型表达。在 ADSCs 影响下,(肌)Fb 增殖、活化,ECM 合成及细胞收缩力均受到一定程度抑制。类似地,Wang 等[17]用 ADSCs 条件培养基(conditioned medium from ADSCs,ADSCs-CM)培养从人瘢痕疙瘩中分离出的 Fb,发现 ADSC-CM 能抑制 Fb 增殖,下调 ECM 相关基因和蛋白的表达;并且实验组血管内皮标志物 CD31+ 和 CD34+ 较对照组分别减少 55% 和 57%。2019 年 Chai 等[18]也报道,ADSCs-CM 可降低Ⅰ型、Ⅲ型胶原蛋白及 α-SMA 的表达,与 ADSCs-CM 共培养的瘢痕组织中胶原排列更薄、更整齐。上述体外实验结果提示,ADSCs 可能通过旁分泌途径下调纤维化相关因子表达,改善瘢痕组织中胶原排列;但离体实验环境单一,ADSCs 在体内能否起到预防甚至逆转皮肤瘢痕形成的作用,还有待研究证实。
1.2. ADSCs 在皮肤瘢痕防治领域的动物实验
由于 ADSCs 在皮肤瘢痕防治领域的巨大潜力,已有多项动物实验就其防治瘢痕的效果及安全性进行了研究。见表 1。
表 1.
Animal experiments of ADSCs in skin scar prevention and treatment
ADSCs 在皮肤瘢痕防治领域的动物实验
| 作者
Author |
发表年份
Publication year |
动物模型
Animal model |
样本量
n |
实验组处理
Experimental group treatment |
对照组处理
Control group treatment |
术后随访
时间 Follow-up time |
结果
Result |
|||
| 注:SIS:小肠黏膜下层;PHBV:聚羟基丁酸酯-羟基戊酸盐
Note: SIS: small-intestine submucosa; PHBV: poly (3-hydroxybutyrate-co-hydroxyvalerate) | ||||||||||
| Lee 等[19] | 2011 | 裸鼠全层皮肤创伤模型 | ① 4/② 4/③ 4 | ① 胶原凝胶搭载 1×
106个人 ADSCs; ② 胶原凝胶搭载人真皮 Fb |
③ 单用胶原凝胶 | 28 d | 与对照组相比,实验组 ① 和 ② 表皮厚度均增加(仅基于 HE 染色) | |||
| Yun 等[20] | 2012 | 猪背部全层皮肤创伤模型 | 2(每只猪背部左右各 18 个皮肤创伤模型) | 术后 50 d 皮下注射 1×106个人 ADSCs,共注射 3 次,每次间隔 10 d | 术后 50 d 皮下注射等量 PBS,共注射 3 次,每次间隔 10 d | 100 d | 局部注射 ADSCs 可以减小瘢痕面积,改善瘢痕颜色和柔韧性;ADSCs 通过增加基质金属蛋白酶分子表达,降低肥大细胞活性,抑制 TGF-β1对 Fb 的作用,促进瘢痕重塑 | |||
| Castiglione
等[21] |
2013 | 大鼠纤维性海绵体炎(TGF-β1 诱导) | 9/9 | 局部注射含 1×
106个人 ADSCs 的 PBS |
局部注射等量 PBS | 5 周 | 实验组 Ⅲ 型胶原和弹性蛋白沉积减少,且勃起功能改善 | |||
| Lam 等[22] | 2013 | 小鼠背部全层皮肤创伤模型 | ① 3/② 3/③ 3(小鼠背部双侧造模) | ① SIS 搭载 1×106个小鼠 ADSCs | ② 单独应用 SIS;③ 单独注射 1×106个 ADSCs | 14 d | 单独注射 ADSCs 不能存活;与单独应用 SIS 相比,SIS 搭载 ADSCs 可减少纤维化面积 | |||
| Uysal 等[23] | 2014 | 大鼠背部全层皮肤创伤模型 | 20/20(每只大鼠背部造 4 个皮肤创伤模型) | 局部注射含 1×107个大鼠 ADSCs 的 PBS | 局部仅注射 PBS 或 PBS 注射后补片植皮 | 56 d | 与对照组相比,局部注射 ADSCs 使伤口愈合速度加快,表皮厚度增加,但瘢痕面积比 PBS 对照组大 | |||
| Zhang 等[24] | 2015 | 兔耳全层皮肤创伤模型 | ① 4/② 4/③ 4(每只兔左右耳各 3 个创伤模型) | ① 右耳术后 14 d
局部注射 4×106 个兔 ADSCs |
② 右耳术后 14 d 局部注射等量 ADSCs-CM 或 ③ 不做处理。①②③ 组左耳均注射等量 DMEM 培养基 | 35 d | 局部注射 ADSCs 或 ADSCs-CM 可通过降低 α-SMA 和Ⅰ型胶原基因表达,改善胶原沉积,减少兔耳增生性瘢痕形成 | |||
| Zonari 等[11] | 2015 | 大鼠背部全层皮肤创伤模型 | ① 4/② 4/③ 4(每只大鼠背部 2 个创伤模型) | ① PHBV 支架搭载 1×106 个大鼠 ADSCs | ② 单用 PHBV 支架③ 不处理 | 28 d | 实验组 α-SMA、TGF-β1 降低,TGF-β3 升高,能促进伤口愈合,减少瘢痕形成 | |||
| Franck 等[25] | 2019 | 大鼠腹部全层皮肤烧伤模型 | 11/12(每只大鼠腹部 484 mm2方形烧伤面积) | 皮温降至 35℃ 时,每只大鼠烧伤部位注射 3.4×106个大鼠 ADSCs/4 mL PBS;伤后第 4 天,同法注射等量 ADSCs | 皮温降至 35℃ 时,每只大鼠烧伤部位注射 4 mL PBS;伤后第 4 天,同法注射等量 PBS | 14 d | 与对照组相比,局部注射 ADSCs 能降低受伤皮肤区域淋巴管数量,且烧伤区域皮肤愈合形成的瘢痕面积更小 | |||
1.2.1. ADSCs 预防皮肤瘢痕形成的动物实验
研究显示,在裸鼠[19]、小鼠[22]、大鼠[11, 23]背部全层皮肤缺损模型及大鼠纤维性海绵体炎模型[21]中,于皮肤创伤初期局部注射 ADSCs 可以加速伤口愈合,但伤口愈合后皮肤纤维化面积及瘢痕形成的严重程度,各研究报道结果存在差异。大部分研究结果显示,局部注射 ADSCs 后,胶原蛋白、弹性蛋白沉积减少,皮肤纤维化面积缩小,表皮厚度增加,皮肤瘢痕情况明显优于对照组,且促纤维化因子 α-SMA 和 TGF-β1 表达降低,促血管生成的 VEGF 表达升高[11, 21-22]。创面缺血缺氧在皮肤创面修复及瘢痕形成中发挥重要作用,可能原因在于创面微血管分布造成组织低氧,激活 TGF-β1/Smads 通路,促进下游胶原蛋白沉积[26]。而 ADSCs 能创造血管生成的有利微环境,且 ADSCs 本身也可以促进血管生成,这些都有助于组织从缺血缺氧状态中恢复,加速创面愈合,减少皮肤瘢痕形成[27-28]。2019 年 Franck 等[25]通过大鼠腹部烧伤模型发现,伤后及时注射 ADSCs 能降低受伤皮肤区域淋巴管数量,且 14 d 后烧伤区域皮肤愈合形成的瘢痕面积更小。2014 年 Uysal 等[23]报道,局部注射 ADSCs 后,皮肤伤口愈合速度加快,表皮厚度增加,但皮肤瘢痕面积比对照组更大。综上,目前大部分研究结果倾向于 ADSCs 可以通过加速创面愈合来预防真皮瘢痕形成。
1.2.2. ADSCs 治疗皮肤瘢痕的动物实验
除了预防皮肤创伤后瘢痕形成,近年也有文献报道 ADSCs 可用于治疗已形成的皮肤瘢痕。Yun 等[20]构建了猪背部全层皮肤创伤模型,实验组于术后 50 d 皮下注射 1×106 个人 ADSCs,共注射 3 次,每次间隔 10 d,对照组在同时间点注射等量 PBS 溶液,注射后每 10 天检测 1 次,直至术后 100 d。结果发现局部注射 ADSCs 可以减小瘢痕面积,改善瘢痕颜色和柔韧性;ADSCs 注射可提高 ECM 分解酶——基质金属蛋白酶分子表达,促进 ECM 降解;并且 ADSCs 能降低肥大细胞活性,抑制 TGF-β1 对 Fb 的作用,促进瘢痕重塑。类似地,Zhang 等[24]构建兔耳全层皮肤创伤模型,实验组于术后 14 d 局部注射 4×106 个兔 ADSCs,对照组同时间点注射等量 ADSCs-CM 或 DMEM 培养基或不处理,术后 35 d 发现 ADSCs 组和 ADSCs-CM 组可通过降低 α-SMA 和Ⅰ型胶原基因表达,改善胶原沉积,减少兔耳增生性瘢痕形成。以上研究提示,ADSCs 可在皮肤瘢痕治疗中发挥作用,甚至有逆转皮肤瘢痕的潜力,但目前相关动物研究较少,且缺乏大样本临床研究,故尚不能得出 ADSCs 可以治疗皮肤瘢痕的结论。
1.3. ADSCs 在皮肤瘢痕防治领域的临床研究
目前,陆续有文献报道 ADSCs 可促进皮肤创面愈合,改善皮肤瘢痕形成。在两项非随机对照试验中,ADSCs 被用于治疗 10 例慢性顽固性放射性溃疡患者[29]和 29 例软组织缺损患者[30]。研究发现,ADSCs 可以促进伤口愈合[29]和改善脂肪移植效果[30],并且发现 ADSCs 可促进血管生成,重塑 ECM,从而减少深层组织纤维化和真皮瘢痕形成。2016 年,一项纳入 22 名受试者的临床研究[31]发现,激光治疗后,局部应用 ADSCs-CM 可以提高痤疮瘢痕组和嫩肤组的受试者满意度,增加皮肤弹性、水份,降低粗糙度和黑色素指数;且组织学分析显示,ADSCs-CM 使真皮胶原蛋白、弹性蛋白密度增加,排列更整齐。但这些临床研究样本量少,缺乏空白对照,瘢痕评估方法未统一,尚不能得出 ADSCs 能有效治疗瘢痕的结论,还需更多前瞻性研究来探索 ADSCs 对皮肤纤维化及瘢痕形成的影响。
2. ADSCs 防治瘢痕的可能机制
皮肤创伤愈合包括炎症反应期、增生期和成熟期。文献报道,ADSCs 参与了皮肤创伤愈合的全过程,但不同愈合阶段作用机制不同。以下对各阶段 ADSCs 防治瘢痕的可能机制进行总结(图 1)。
图 1.
The mechanism of ADSCs in different stages of skin wound healing
ADSCs 在皮肤创伤愈合不同阶段的作用机制
a. 炎症反应期;b. 增生期;c. 成熟期
a. Inflammation period; b. Proliferation period; c. Mature period
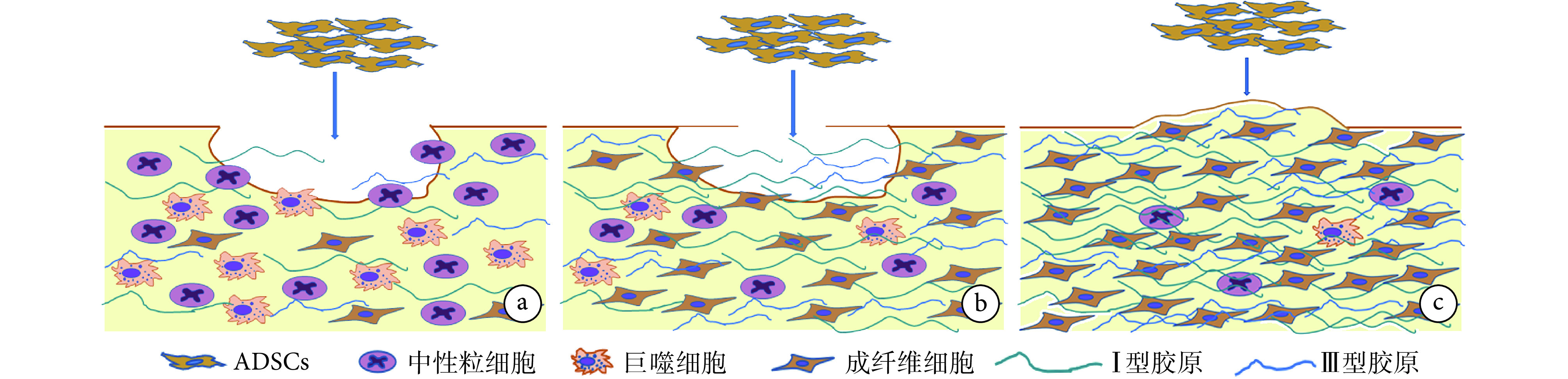
2.1. ADSCs 在皮肤创伤愈合炎症反应期的作用机制
皮肤创伤形成后数小时内便出现炎症反应,中性粒细胞、巨噬细胞等先后迁移至创伤区域,通过自分泌、旁分泌等途径分泌炎症介质,如 IL、TNF 及其他细胞因子和生长因子来共同促进创伤愈合[32]。既往研究提示,ADSCs 能减少伤口愈合过程中的炎症反应[33]。Horton 等[34]研究发现,ADSCs 通过促进 IL-4、IL-10 等抗炎因子表达,抑制 IL-1、IL-6、IL-8、TNF-α 等促炎因子分泌来减轻炎症反应。类似的,董瑶等[35]研究提示,创面注射 ADSCs 可促进组织中抗炎因子 IL-10 表达,抑制促炎因子 IL-1、IL-6 表达,从而缩短炎症反应期。此外,Manning 等[36]运用小鼠模型,发现 ADSCs 和 ADSCs-CM 一方面通过下调白三烯 B4 来减轻炎症反应,另一方面通过抑制 NF-κB 信号通路来减少促炎因子 IL-1β、IL-6、TNF-α 的释放。
2.2. ADSCs 在皮肤创伤愈合增生期的作用机制
在增生期,ADSCs 通过旁分泌的多种生物活性物质,如 bFGF、肝细胞生长因子、PDGF、VEGF 等来调控周围细胞的生长及其功能,从而减少瘢痕形成[37-38]。既往研究报道,ADSCs 分泌的 bFGF 能诱导并促进内皮细胞、Fb 分裂,有利于血管新生和创面愈合,从而减少瘢痕形成[39]。此外,Nie 等[40]发现,ADSCs 一方面可直接分泌肝细胞生长因子和 VEGF 等血管生成因子,促进伤口血管生成,有利于肉芽组织形成,加速皮肤创面愈合;另一方面,还可直接分化为血管内皮细胞和上皮细胞,增强血管结构,并促进创伤皮肤上皮化形成。
2.3. ADSCs 在皮肤创伤愈合成熟期的作用机制
2.3.1. p38/MAPK 通路
p38/MAPK 通路与炎症和纤维化密切相关,是目前瘢痕领域研究的热点通路。Li 等[41]、Chai 等[18]通过体外实验发现,ADSCs-CM 可降低 Ⅰ 型、Ⅲ 型胶原蛋白及 α-SMA 表达,与 ADSCs-CM 共培养的瘢痕组织中胶原排列更薄、更整齐。小鼠实验显示 ADSCs-CM 处理组伤口愈合加快,胶原沉积减少;并且增生性瘢痕来源的 Fb 经 ADSCs-CM 处理后,其磷酸化 p38(phosphorylated p38,p-p38)蛋白水平呈浓度依赖性下调。应用 p-p38 抑制剂 SB203580 后,进一步降低了 p-p38 表达,组织中 Ⅰ 型、Ⅲ 型胶原蛋白和 α-SMA 表达也明显降低,胶原纤维更薄,排列更有序。相反,应用 p-p38 激动剂 Anisomycin 后,纤维化相关蛋白表达增多,胶原结构变厚,排列更紊乱。以上研究提示 p38/MAPK 通路可能是 ADSCs-CM 减少瘢痕形成的重要途径。
2.3.2. 过氧化物酶体增殖物激活受体 γ(peroxisome proliferator activated receptor γ,PPAR-γ)通路
PPAR 是一类配体激活的核转录因子超家族成员,其中 PPAR-γ 最初在脂肪组织中被识别,在介导脂滴储存、脂肪合成及胰岛素稳态中有重要作用[42]。近年来,PPAR-γ 作为细胞内抗炎和抗纤维化因子,在生理性和病理性 ECM 重塑中的作用越来越受重视。在皮肤来源 Fb 中,PPAR-γ 在蛋白和 mRNA 水平上均有表达,PPAR-γ 受体可通过磷酸酶与张力蛋白同源物负向调节肌 Fb 活性及胶原生成[43];阻断 Fb 中 PPAR-γ 可导致小鼠更易在博来霉素诱导下发生皮肤纤维化。研究证实 PPAR-γ 是 TGF-β1 有力的内源性拮抗剂,可拮抗 TGF-β1 介导的皮肤(肌)Fb 中 ECM 合成增多效应,具有体外抗纤维化的作用[44]。综上,以 PPAR-γ 为靶点的抗纤维化机制为皮肤瘢痕防治拓宽了思路。
2.3.3. TGF-β1/Smads 通路
研究报道 TGF-β1/Smads 通路参与各种纤维化过程的发生、发展[45-47],近年来,其在皮肤瘢痕防治领域的作用也越来越受到关注。TGF-β1/Smads 通路中,TGF-β1 作为纤维化的启动因子,可上调其下游的 Smad3 表达,二者协同激活 Fb,促使其异常增殖,并转分化为其效应细胞肌 Fb,从而大量合成、分泌 ECM 沉积于创伤皮肤周围[48]。研究显示[49],ADSCs 可下调增生性瘢痕组织中 TGF-β1、Smad2/3 蛋白表达,上调抑制因子 Smad7 蛋白表达,抑制 TGF-β1/Smads 通路的异常激活,从而抑制皮肤增生性瘢痕过度纤维化。但该研究中,ADSCs 与增生性瘢痕来源 Fb 共培养最长时间仅为 7 d,短期内可观察到 ADSCs 通过 TGF-β1/Smads 通路抑制 Fb 活性,ADSCs 能否长期保持该作用有待后续研究证实。
2.4. ADSCs 外泌体防治瘢痕的作用机制
1987 年,Johnstone 等[50]最早从网织红细胞上清液中发现一种直径为 30~120 nm 的囊泡样结构,将其命名为外泌体。外泌体富含蛋白质、mRNA、miRNA 和其他物质,与其来源细胞有类似的生理功能[51],在细胞内以出芽方式形成,可由细胞主动或被动分泌。外泌体进入靶细胞后经过降解和再表达来调控靶细胞的基因表达[52]。Li 等[53]研究发现,ADSCs 外泌体携带生物学信号,具有干细胞功能。卢颖洁[54]通过小鼠背部皮肤切割损伤模型发现,ADSCs 外泌体能促进血管新生,加速皮肤创面愈合。类似的,王江文等[55]研究发现,ADSCs 外泌体通过促进血管新生以及 Fb 增殖、迁移和胶原合成来促进糖尿病小鼠创面愈合。此外,李全[56]的研究也发现,ADSCs 外泌体可调控创面的炎症反应,减少炎症介质产生,提高裸鼠全层皮肤缺损愈合速度,减少瘢痕形成。其减少瘢痕形成的可能机制为:ADSCs 外泌体上调创面组织 Fb 胶原基因的表达来加速创面愈合,减少瘢痕形成;此外还发现 ADSCs 外泌体可抑制 TGF-β1/Smads 通路,阻止了创面组织中 Fb 向肌 Fb 转分化。综上,近年研究提示 ADSCs 主要通过旁分泌途径发挥生理功能,其外泌体成为当前研究热点,已有较多研究探讨其在皮肤创伤愈合中的作用机制,但在皮肤纤维化及皮肤瘢痕防治领域,鲜有 ADSCs 外泌体的报道。ADSCs 外泌体在皮肤瘢痕防治中的作用亟待深入研究,有望成为揭示 ADSCs 瘢痕防治作用机制的突破点。
3. 优化 ADSCs 防治瘢痕效果的生物材料
传统的干细胞治疗方式包括全身应用和局部注射。全身应用是将干细胞注射到动物体内,依赖于干细胞自动归巢至病变部位;局部注射则是将干细胞直接植入创面。全身应用的细胞自动归巢定植率较低;而局部注射由于局部缺血缺氧及炎症微环境,细胞存活率和增殖率也较低。因此,提高干细胞自动归巢定植率、存活率及增殖率是目前干细胞治疗的主要突破点。
随着生物医学工程的发展,各类支架材料为干细胞治疗提供了新的策略。支架材料可分为生物天然材料及合成材料两大类。在生物天然材料方面,Tan 等[57]研发了一种猪脂肪源基质水凝胶(hydrogel from acellular porcine adipose tissue,HAPA),并报道 HAPA 诱导的 ADSCs 成脂分化过程可促进 Fb 迁移,HAPA 搭载 ADSCs 可显著提高小鼠全层皮肤缺损创面愈合速度,形成的皮肤组织结构更完整,含有更多皮内脂肪细胞及皮肤附属器[58]。此外,Lam 等[22]对比了 ADSCs 复合 SIS 和单独应用 SIS 或单独注射 1×106个 ADSCs 修复创面的效果,发现单独注射的 ADSCs 不能存活;与单独应用 SIS 相比,ADSCs 复合 SIS 可显著减小纤维化面积。在合成材料方面,Zonari 等[11]将脂肪细胞种植在 PHBV 支架中,ADSCs 复合 PHBV 组术后 28 d 检测到促纤维化因子 α-SMA 和 TGF-β1 表达降低,抑制纤维化因子 TGF-β3 表达升高,提示该支架材料搭载种子细胞能促进伤口愈合,减少瘢痕形成。综上,生物医学工程支架材料可能进一步优化 ADSCs 防治皮肤瘢痕的效果,具有较大临床应用潜力。
4. 总结与展望
ADSCs 的体内、体外实验均提示其具有促进皮肤创面愈合及预防、治疗皮肤瘢痕的作用,可能机制主要包括减轻炎症反应、促进血管新生以及通过 p38/MAPK、PPAR-γ、TGF-β1/Smads 通路等来调控 Fb 生物学行为。临床研究也提示 ADSCs 可减少深层组织纤维化和真皮瘢痕形成,有望成为皮肤缺损修复和瘢痕防治的新策略。但目前各项研究中瘢痕评估方法不同,检测时间点不同,并且缺乏大样本随机对照临床试验,ADSCs 防治皮肤瘢痕的疗效及具体作用机制尚需更多研究来证实。
近年来,随着生物工程技术的发展,新型复合支架材料越来越多应用于皮肤缺损修复。但 ADSCs 复合新型支架材料在皮肤瘢痕防治领域的研究尚较少,同时 ADSCs 植入创面的途径、存活率、预防及治疗瘢痕效果以及副作用等均有待进一步深入研究。
作者贡献:贺涛负责文章内容构思、观点形成、撰写文稿;杨济桥、徐莉、刘鹏程负责文献查阅、下载、整理;谭秋雯、吕青负责综述审阅、观点补充。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。经费支持没有影响文章观点。
Funding Statement
四川省科技厅应用基础研究项目(2019YJ0052)
Contributor Information
青 吕 (Qing LÜ), Email: lvqingwestchina@163.com.
秋雯 谭 (Qiuwen TAN), Email: hxtanqiuwen@163.com.
References
- 1.Zhao JC, Zhang BR, Shi K, et al Lower energy radial shock wave therapy improves characteristics of hypertrophic scar in a rabbit ear model. Exp Ther Med. 2018;15(1):933–939. doi: 10.3892/etm.2017.5441. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Chen SH, Chou PY, Chen ZY, et al Electrospun water-borne polyurethane nanofibrous membrane as a barrier for preventing postoperative peritendinous adhesion. Int J Mol Sci. 2019;20(7):1625. doi: 10.3390/ijms20071625. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Zhang X, Lan D, Ning S, et al Botulinum toxin type A prevents the phenotypic transformation of fibroblasts induced by TGF-β1 via the PTEN/PI3K/Akt signaling pathway. Int J Mol Med. 2019;44(2):661–671. doi: 10.3892/ijmm.2019.4226. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Chen XE, Liu J, Bin Jameel AA, et al Combined effects of long-pulsed neodymium-yttrium-aluminum-garnet laser, diprospan and 5-fluorouracil in the treatment of keloid scars. Exp Ther Med. 2017;13(6):3607–3612. doi: 10.3892/etm.2017.4438. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Spiekman M, van Dongen JA, Willemsen JC, et al The power of fat and its adipose-derived stromal cells: emerging concepts for fibrotic scar treatment. J Tissue Eng Regen Med. 2017;11(11):3220–3235. doi: 10.1002/term.2213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Ai G, Meng M, Wang L, et al microRNA-196a promotes osteogenic differentiation and inhibit adipogenic differentiation of adipose stem cells via regulating β-catenin pathway. Am J Transl Res. 2019;11(5):3081–3091. [PMC free article] [PubMed] [Google Scholar]
- 7.Harris WM, Zhang P, Plastini M, et al Evaluation of function and recovery of adipose-derived stem cells after exposure to paclitaxel. Cytotherapy. 2017;19(2):211–221. doi: 10.1016/j.jcyt.2016.10.010. [DOI] [PubMed] [Google Scholar]
- 8.Marangoni RG, Lu TT The roles of dermal white adipose tissue loss in scleroderma skin fibrosis. Curr Opin Rheumatol. 2017;29(6):585–590. doi: 10.1097/BOR.0000000000000437. [DOI] [PubMed] [Google Scholar]
- 9.Yu J, Wang MY, Tai HC, et al Cell sheet composed of adipose-derived stem cells demonstrates enhanced skin wound healing with reduced scar formation. Acta Biomater. 2018;77:191–200. doi: 10.1016/j.actbio.2018.07.022. [DOI] [PubMed] [Google Scholar]
- 10.Borovikova AA, Ziegler ME, Banyard DA, et al Adipose-derived tissue in the treatment of dermal fibrosis: Antifibrotic effects of adipose-derived stem cells. Ann Plast Surg. 2018;80(3):297–307. doi: 10.1097/SAP.0000000000001278. [DOI] [PubMed] [Google Scholar]
- 11.Zonari A, Martins TM, Paula AC, et al Polyhydroxybutyrate-co-hydroxyvalerate structures loaded with adipose stem cells promote skin healing with reduced scarring. Acta Biomater. 2015;17:170–181. doi: 10.1016/j.actbio.2015.01.043. [DOI] [PubMed] [Google Scholar]
- 12.Franz A, Wood W, Martin P Fat body cells are motile and actively migrate to wounds to drive repair and prevent infection. Dev Cell. 2018;44(4):460–470. doi: 10.1016/j.devcel.2018.01.026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Schmidt BA, Horsley V Intradermal adipocytes mediate fibroblast recruitment during skin wound healing. Development. 2013;140(7):1517–1527. doi: 10.1242/dev.087593. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Kruglikov IL, Scherer PE Dermal adipocytes: from irrelevance to metabolic targets? Trends Endocrinol Metab. 2016;27(1):1–10. doi: 10.1016/j.tem.2015.11.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Ng M, Thakkar D, Southam L, et al A Genome-wide association study of dupuytren disease reveals 17 additional variants implicated in fibrosis. Am J Hum Genet. 2017;101(3):417–427. doi: 10.1016/j.ajhg.2017.08.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Spiekman M, Przybyt E, Plantinga JA, et al Adipose tissue-derived stromal cells inhibit TGF-β1-induced differentiation of human dermal fibroblasts and keloid scar-derived fibroblasts in a paracrine fashion. Plast Reconstr Surg. 2014;134(4):699–712. doi: 10.1097/PRS.0000000000000504. [DOI] [PubMed] [Google Scholar]
- 17.Wang XX, Ma Y, Gao Z, et al. Human adipose-derived stem cells inhibit bioactivity of keloid fibroblasts. Stem Cell Res Ther, 2018, 9(1): 40. doi: 10.1186/s13287-018-0786-4.
- 18.Chai CY, Song J, Tan Z, et al Adipose tissue-derived stem cells inhibit hypertrophic scar (HS) fibrosis via p38/MAPK pathway. J Cell Biochem. 2019;120(3):4057–4064. doi: 10.1002/jcb.27689. [DOI] [PubMed] [Google Scholar]
- 19.Lee SH, Lee JH, Cho KH Effects of human adipose-derived stem cells on cutaneous wound healing in nude mice. Ann Dermatol. 2011;23(2):150–155. doi: 10.5021/ad.2011.23.2.150. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Yun IS, Jeon YR, Lee WJ, et al Effect of human adipose derived stem cells on scar formation and remodeling in a pig model: a pilot study. Dermatol Surg. 2012;38(10):1678–1688. doi: 10.1111/j.1524-4725.2012.02495.x. [DOI] [PubMed] [Google Scholar]
- 21.Castiglione F, Hedlund P, Van der Aa F, et al Intratunical injection of human adipose tissue-derived stem cells prevents fibrosis and is associated with improved erectile function in a rat model of Peyronie’s disease. Eur Urol. 2013;63(3):551–560. doi: 10.1016/j.eururo.2012.09.034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Lam MT, Nauta A, Meyer NP, et al Effective delivery of stem cells using an extracellular matrix patch results in increased cell survival and proliferation and reduced scarring in skin wound healing. Tissue Eng Part A. 2013;19(5-6):738–747. doi: 10.1089/ten.tea.2012.0480. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Uysal CA, Tobita M, Hyakusoku H, et al The effect of bone-marrow-derived stem cells and adipose-derived stem cells on wound contraction and epithelization. Adv Wound Care (New Rochelle) 2014;3(6):405–413. doi: 10.1089/wound.2014.0539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Zhang Q, Liu LN, Yong Q, et al. Intralesional injection of adipose-derived stem cells reduces hypertrophic scarring in a rabbit ear model. Stem Cell Res Ther, 2015, 6(1): 145. doi: 10.1186/s13287-015-0133-y.
- 25.Franck CL, Senegaglia AC, Leite LMB, et al. Influence of adipose tissue-derived stem cells on the burn wound healing process. Stem Cells Int, 2019, 2019: 2340725. doi: 10.1155/2019/2340725.eCollection2019.
- 26.Bellini E, Grieco MP, Raposio E The science behind autologous fat grafting. Ann Med Surg (Lond) 2017;24:65–73. doi: 10.1016/j.amsu.2017.11.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Hong KY, Yim S, Kim HJ, et al The fate of the adipose-derived stromal cells during angiogenesis and adipogenesis after cell-assisted lipotransfer. Plast Reconstr Surg. 2018;141(2):365–375. doi: 10.1097/PRS.0000000000004021. [DOI] [PubMed] [Google Scholar]
- 28.Wu SH, Shirado T, Mashiko T, et al Therapeutic effects of human adipose-derived products on impaired wound healing in irradiated tissue. Plast Reconstr Surg. 2018;142(2):383–391. doi: 10.1097/PRS.0000000000004609. [DOI] [PubMed] [Google Scholar]
- 29.Akita S, Yoshimoto H, Ohtsuru A, et al Autologous adipose-derived regenerative cells are effective for chronic intractable radiation injuries. Radiat Prot Dosimetry. 2012;151(4):656–660. doi: 10.1093/rpd/ncs176. [DOI] [PubMed] [Google Scholar]
- 30.Tiryaki T, Findikli N, Tiryaki D Staged stem cell-enriched tissue (SET) injections for soft tissue augmentation in hostile recipient areas: a preliminary report. Aesthetic Plast Surg. 2011;35(6):965–971. doi: 10.1007/s00266-011-9716-x. [DOI] [PubMed] [Google Scholar]
- 31.Zhou BR, Zhang T, Bin Jameel AA, et al The efficacy of conditioned media of adipose-derived stem cells combined with ablative carbon dioxide fractional resurfacing for atrophic acne scars and skin rejuvenation. J Cosmet Laser Ther. 2016;18(3):138–148. doi: 10.3109/14764172.2015.1114638. [DOI] [PubMed] [Google Scholar]
- 32.Rehman J, Traktuev D, Li J, et al Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells. Circulation. 2004;109(10):1292–1298. doi: 10.1161/01.CIR.0000121425.42966.F1. [DOI] [PubMed] [Google Scholar]
- 33.Atalay S, Coruh A, Deniz K Stromal vascular fraction improves deep partial thickness burn wound healing. Burns. 2014;40(7):1375–1383. doi: 10.1016/j.burns.2014.01.023. [DOI] [PubMed] [Google Scholar]
- 34.Horton JA, Hudak KE, Chung EJ, et al Mesenchymal stem cells inhibit cutaneous radiation-induced fibrosis by suppressing chronic inflammation. Stem Cells. 2013;31(10):2231–2241. doi: 10.1002/stem.1483. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.董瑶, 董飞君, 李幼华 脂肪干细胞调节创面炎症反应并促进创面愈合. 医学研究杂志. 2012;41(3):100–103. doi: 10.3969/j.issn.1673-548X.2012.03.030. [DOI] [Google Scholar]
- 36.Manning CN, Martel C, Sakiyama-Elbert SE, et al. Adipose-derived mesenchymal stromal cells modulate tendon fibroblast responses to macrophage-induced inflammation in vitro. Stem Cell Res Ther, 2015, 6(1): 74. doi: 10.1186/s13287-015-0059-4.
- 37.Zhang W, Bai X, Zhao B, et al Cell-free therapy based on adipose tissue stem cell-derived exosomes promotes wound healing via the PI3K/Akt signaling pathway. Exp Cell Res. 2018;370(2):333–342. doi: 10.1016/j.yexcr.2018.06.035. [DOI] [PubMed] [Google Scholar]
- 38.Bajek A, Gurtowska N, Olkowska J, et al Adipose-derived stem cells as a tool in cell-based therapies. Arch Immunol Ther Exp (Warsz) 2016;64(6):443–454. doi: 10.1007/s00005-016-0394-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Park J, Lee JH, Yoon BS, et al. Additive effect of bFGF and selenium on expansion and paracrine action of human amniotic fluid-derived mesenchymal stem cells. Stem Cell Res Ther, 2018, 9(1): 293. doi: 10.1186/s13287-018-1058-z.
- 40.Nie C, Yang D, Xu J, et al Locally administered adipose-derived stem cells accelerate wound healing through differentiation and vasculogenesis. Cell Transplant. 2011;20(2):205–216. doi: 10.3727/096368910X520065. [DOI] [PubMed] [Google Scholar]
- 41.Li Y, Zhang W, Gao J, et al. Adipose tissue-derived stem cells suppress hypertrophic scar fibrosis via the p38/MAPK signaling pathway. Stem Cell Res Ther, 2016, 7(1): 102. doi: 10.1186/s13287-016-0356-6.
- 42.Mirza AZ, Althagafi II, Shamshad H Role of PPAR receptor in different diseases and their ligands: Physiological importance and clinical implications. Eur J Med Chem. 2019;166:502–513. doi: 10.1016/j.ejmech.2019.01.067. [DOI] [PubMed] [Google Scholar]
- 43.Ho YY, Lagares D, Tager AM, et al Fibrosis—a lethal component of systemic sclerosis. Nat Rev Rheumatol. 2014;10(7):390–402. doi: 10.1038/nrrheum.2014.53. [DOI] [PubMed] [Google Scholar]
- 44.Vallée A, Lecarpentier Y, Guillevin R, et al Interactions between TGF-β1, canonical WNT/β-catenin pathway and PPAR γ in radiation-induced fibrosis. Oncotarget. 2017;8(52):90579–90604. doi: 10.18632/oncotarget.21234. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Zhang LT, Peng XB, Fang XQ, et al Human umbilical cord mesenchymal stem cells inhibit proliferation of hepatic stellate cells in vitro . Int J Mol Med. 2018;41(5):2545–2552. doi: 10.3892/ijmm.2018.3500. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Han Y, Lu JS, Xu Y, et al Rutin ameliorates renal fibrosis and proteinuria in 5/6-nephrectomized rats by anti-oxidation and inhibiting activation of TGFβ1-smad signaling. Int J Clin Exp Pathol. 2015;8(5):4725–4734. [PMC free article] [PubMed] [Google Scholar]
- 47.Zhang Y, Zhao H, Li H, et al. Protective effects of amarogentin against carbon tetrachloride-induced liver fibrosis in mice. Molecules, 2017, 22(5): 754. doi: 10.3390/molecules22050754.
- 48.Ikushima H, Miyazono K TGF-β signal transduction spreading to a wider field: a broad variety of mechanisms for context-dependent effects of TGF-β. Cell Tissue Res. 2012;347(1):37–49. doi: 10.1007/s00441-011-1179-5. [DOI] [PubMed] [Google Scholar]
- 49.许言文. 脂肪干细胞旁分泌作用基于 TGF-β1/Smads 通路对增生性瘢痕影响的实验研究. 乌鲁木齐: 新疆医科大学, 2016.
- 50.Johnstone RM, Adam M, Hammond JR, et al Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). J Biol Chem. 1987;262(19):9412–9420. [PubMed] [Google Scholar]
- 51.Wang L, Hu L, Zhou X, et al. Exosomes secreted by human adipose mesenchymal stem cells promote scarless cutaneous repair by regulating extracellular matrix remodelling. Sci Rep, 2017, 7(1): 13321. doi: 10.1038/s41598-017-12919-x.
- 52.张静 干细胞外泌体生物学功能及临床应用前景. 中国美容医学杂志. 2017;26(4):136–140. [Google Scholar]
- 53.Li P, Kaslan M, Lee SH, et al Progress in exosome isolation techniques. Theranostics. 2017;7(3):789–804. doi: 10.7150/thno.18133. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.卢颖洁. 人脂肪干细胞来源的外泌体通过 miR-486-5p 介导促进皮肤创面愈合的机制研究. 南昌: 南昌大学, 2020.
- 55.王江文, 易阳艳, 朱元正, 等 脂肪干细胞来源外泌体促进糖尿病小鼠创面愈合的实验研究. 中国修复重建外科杂志. 2020;34(1):124–131. [Google Scholar]
- 56.李全. ADSC-exo 对肉芽组织成纤维细胞增殖影响及修复裸鼠皮肤缺损的研究. 天津: 天津医科大学, 2019.
- 57.Tan QW, Zhang Y, Luo JC, et al Hydrogel derived from decellularized porcine adipose tissue as a promising biomaterial for soft tissue augmentation. J Biomed Mater Res A. 2017;105(6):1756–1764. doi: 10.1002/jbm.a.36025. [DOI] [PubMed] [Google Scholar]
- 58.Tan QW, Tang SL, Zhang Y, et al Hydrogel from acellular porcine adipose tissue accelerates wound healing by inducing intradermal adipocyte regeneration. J Invest Dermatol. 2019;139(2):455–463. doi: 10.1016/j.jid.2018.08.013. [DOI] [PubMed] [Google Scholar]


