Abstract
目的
探讨基于膝关节 CT 及下肢全长 X 线片设计的股骨远端截骨导板在人工全膝关节置换术(total knee arthroplasty,TKA)中应用的可行性及准确性。
方法
以 2016 年 7 月—2017 年 2 月拟行初次 TKA 的 20 例膝关节重度骨关节炎患者作为研究对象。男 9 例,女 11 例;年龄 53~84 岁,平均 69.4 岁。体质量指数 22.1~31.0 kg/m2,平均 24.8 kg/m2。术前膝关节活动度(range of motion,ROM)为(103.0±19.4)°、疼痛视觉模拟评分(VAS)为(5.4±1.3)分、美国特种外科医院(HSS)评分为(58.1±11.3)分。术前基于下肢全长正侧位 X 线片及膝关节 CT 构建膝关节三维模型,设计并制作股骨远端截骨导板,模拟手术确定股骨远端截骨厚度。比较术前设计以及术中实际股骨远端内、外侧髁截骨厚度。记录术中失血量、术后引流量及计算隐性失血量;术后 3 个月行膝关节 ROM、VAS 评分、HSS 评分评估临床疗效;通过比较术前及术后 1 周的股骨外翻角(femoral mechanical-anatomical angle,FMAA)、股骨远端解剖外侧角(anatomical lateral distal femoral angle,aLDFA)、股骨机械轴与胫骨机械轴夹角(mechanical femoral tibial angle,mFTA)、股骨远端屈曲角(distal femoral flexion angle,DFFA)、股骨假体屈曲角(femoral prosthesis flexion angle,FPFA)、股骨假体外侧角(anatomical lateral femoral component angle,aLFC)、前翼与股骨前方皮质线夹角(α 角),评估股骨远端假体冠状面及矢状面位置。
结果
于股骨远端截骨导板辅助下 TKA 均顺利完成;术前设计股骨远端内、外侧髁截骨厚度与术中实际截骨厚度差异均无统计学意义(P>0.05)。患者均获随访 3 个月。术后切口均Ⅰ期愈合,未出现关节周围感染、下肢深静脉血栓形成等并发症。除 1 例患者未行氨甲环酸治疗外,其余 19 例患者术中失血量为 30 ~150 mL,平均 73.2 mL;术后引流量为 20~500 mL,平均 154.5 mL;隐性失血量为 169.2~1 400.0 mL,平均 643.8 mL。术后 3 个月 ROM 为(111.5±11.5)°,与术前比较差异无统计学意义(t=–1.962,P=0.065);VAS 评分为(2.4±0.9)分、HSS 评分为(88.2±7.5)分,与术前比较差异均有统计学意义(t=7.248,P=0.000;t=–11.442,P=0.000)。X 线片复查示术后 mFTA 与术前测量比较差异有统计学意义(P<0.05);aLDFA、FMAA、DFFA 与术前测量比较差异无统计学意义(P>0.05);FPFA、aLFC、α 角与术前规划比较差异均无统计学意义(P>0.05)。
结论
基于膝关节 CT 及下肢全长 X 线片制备的股骨远端截骨导板辅助 TKA 能实现精确截骨,改善下肢冠状面和矢状面力线,减少手术失血量,早期疗效满意。
Keywords: 个体化截骨导板, 下肢全长 X 线片, CT, 股骨截骨, 人工全膝关节置换术
Abstract
Objective
To discuss the feasibility and accuracy of distal femoral patient-specific cutting guide in total knee arthroplasty (TKA) based on knee CT and full-length X-ray film of lower extremities.
Methods
Between July 2016 and February 2017, 20 patients with severe knee joint osteoarthritis planned to undergo primary TKA were selected as the research object. There were 9 males and 11 females; aged 53-84 years, with an average of 69.4 years. The body mass index was 22.1-31.0 kg/m2, with an average of 24.8 kg/m2. The preoperative range of motion (ROM) of the knee joint was (103.0±19.4)°, the pain visual analogue scale (VAS) score was 5.4±1.3, and the American Hospital of Special Surgery (HSS) score was 58.1±11.3. Before operation, a three-dimensional model of the knee joint was constructed based on the full-length X-ray film of lower extremities and CT of the knee joint. The distal femoral patient-specific cutting guide was designed and fabricated, and the thickness of the distal femoral osteotomy was determined by digital simulation. The thickness of the internal and external condyle of the distal femur osteotomy before operation and the actual thickness of the intraoperative osteotomy were compared. The intraoperative blood loss, postoperative drainage loss, and hidden blood loss were recorded. The ROM of knee joint, VAS score, and HSS score at 3 months after operation were recorded to evaluate effectiveness. The position of the coronal and sagittal plane of the distal femoral prosthesis were assessed by comparing the femoral mechanical-anatomical angle (FMAA), anatomical lateral distal femoral angle (aLDFA), mechanical femoral tibial angle (mFTA), distal femoral flexion angle (DFFA), femoral prosthesis flexion angle (FPFA), anatomical lateral femoral component angle (aLFC), and the angle of the femoral component and femoral shaft (α angle) between pre- and post-operation.
Results
TKA was successfully completed with the aid of the distal femoral patient-specific cutting guide. There was no significant difference between the thickness of the internal and lateral condyle of the distal femur osteotomy before operation and the actual thickness of the intraoperative osteotomy (P>0.05). All patients were followed up 3 months. All incisions healed by first intention, and there was no complications such as periarticular infection and deep vein thrombosis. Except for 1 patient who was not treated with tranexamic acid, the intraoperative blood loss of the rest 19 patients ranged from 30 to 150 mL, with an average of 73.2 mL; the postoperative drainage loss ranged from 20 to 500 mL, with an average of 154.5 mL; and the hidden blood loss ranged from 169.2 to 1 400.0 mL, with an average of 643.8 mL. At 3 months after operation, the ROM of the knee was (111.5±11.5)°, and there was no significant difference when compared with the preoperative one (t=–1.962,P=0.065). The VAS score was 2.4±0.9 and HSS score was 88.2±7.5, showing significant differences when compared with the preoperative ones (t=7.248, P=0.000; t=–11.442,P=0.000). Compared with the preoperative measurements, there was a significant difference in mFTA (P<0.05), and there was no significant difference in aLDFA, FMAA, or DFFA; compared with the preoperative plan, there was no significant difference in FPFA, aLFC, or α angle (P>0.05).
Conclusion
The use of distal femoral patient-specific cutting guide based on knee CT and full-length X-ray film of lower extremity can achieve precise osteotomy, improve coronal and sagittal limb alignment, reduce intraoperative blood loss, and obtain satisfactory short-term effectiveness.
Keywords: Patient-specific cutting guide, full-length X-ray film of lower extremity, CT, femoral osteotomy, total knee arthroplasty
精确截骨、正确放置假体以及良好软组织平衡是人工全膝关节置换术(total knee arthroplasty,TKA)获得良好疗效的关键[1],与术后假体生存率、患者满意度有着密切联系[2]。研究表明,TKA 术中采用传统髓内定位后下肢机械轴的准确率仅为 68.2%[3],引起偏差的主要原因是股骨远端截骨不够精确[4]。为此,近年来临床逐渐使用个体化截骨导板以提高截骨准确性。
目前用于设计个体化截骨导板的图像采集方式尚无统一标准[5-6],多数研究通过下肢全长 CT 确定下肢力线进而设计个体化截骨导板,也有基于下肢全长 MRI 设计个体化截骨导板。其中,MRI 相较于 CT 对软骨的显示更好,重建的模型更接近真实解剖,设计制作的截骨导板也可直接贴合于关节表面,理论上定位更准确。但是,基于 CT 和 MRI 图像制备的两种截骨导板在辅助 TKA 精确度方面各有不同[7-8],MRI 易受空间误差影响出现三维模型几何相容性下降,进而导致截骨导板制备精确度下降,术中贴合度降低,且患者所承受的经济压力也较 CT 明显增大。但下肢全长 CT 扫描范围广,耗费时间较长,患者所受辐射量较大。为此,我们提出联合膝关节 CT 与下肢全长 X 线片设计股骨远端截骨导板,膝关节 CT 扫描范围明显小于下肢全长 CT,缩短了辐射暴露时间。2016 年 7 月—2017 年 2 月,我们将采用该方法制备的股骨远端截骨导板用于 20 例重度骨关节炎患者初次 TKA 中。现总结患者临床资料,探讨该截骨导板的可行性以及优势。报告如下。
1. 临床资料
1.1. 一般资料
本组男 9 例,女 11 例;年龄 53~84 岁,平均 69.4 岁。体质量指数 22.1~31.0 kg/m2,平均 24.8 kg/m2。左侧 10 例,右侧 10 例。患者主要临床症状为膝关节疼痛和/或合并下肢内翻畸形、屈曲挛缩。其中,膝关节内翻畸形 19 例,内翻角度为 6°~23°,平均 11.7°;屈曲挛缩畸形 14 例,屈曲挛缩角度–30°~–5°,平均–8.8°。术前膝关节活动度(range of motion,ROM)为(103.0±19.4)°、疼痛视觉模拟评分(VAS)为(5.4±1.3)分、美国特种外科医院(HSS)评分为(58.1±11.3)分。患者均经保守治疗无效或效果不佳。
1.2. 股骨远端截骨导板的制备
术前摄下肢全长正侧位 X 线片;采用 64 排多层螺旋(Siemens 公司,德国)行膝关节 CT 扫描,扫描范围:股骨远端关节面以上 12 cm,胫骨平台关节面以下 10 cm,扫描条件:层厚 1 mm,矩阵 512×512,电压 120 kV,电流 200~280 mAs。将 X 线片以及 CT 图像以 DICOM 格式导入 Mimics 16.0 软件(Materialize 公司,比利时)进行图像初步处理,再用 Geomagic studio 2013(Geomagic 公司,美国)及 Unigraphics NX 9.0(Siemens 公司,德国)软件进行测量及设计。
设计原理:股骨远端三维模型中股骨远端解剖轴恒定,参考股骨机械轴与解剖轴在正、侧位 X 线片上的夹角,根据画法几何中的平行投影法,即可确定膝关节三维模型中股骨机械轴和解剖轴。截骨面设计原则:冠状面截骨线垂直于股骨机械轴,矢状面垂直于股骨解剖轴(图 1a)。
图 1.
Preparation of the distal femoral patient-specific cutting guides
股骨远端截骨导板制备
a. 确定股骨远端截骨面(A 为股骨机械轴,B 为股骨解剖轴);b. 股骨远端旋转定位;c. 股骨远端截骨导板设计;d. 股骨远端截骨导板 3D 打印实体
a. Determining the distal femoral osteotomy surface (A for the femoral mechanical axis, B for the femoral anatomical axis); b. Distal femoral external rotation positioning; c. Design of distal femoral patient-specific cutting guide; d. Solid distal femoral patient-specific cutting guide by three-dimensional printing

术前规划:于术前下肢全长正位 X 线片测量股骨外翻角(femoral mechanical-anatomical angle,FMAA)、股骨远端解剖外侧角(anatomical lateral distal femoral angle,aLDFA)、股骨机械轴与胫骨机械轴夹角(mechanical femoral tibial angle,mFTA),于下肢全长侧位 X 线片测量股骨远端屈曲角(distal femoral flexion angle,DFFA);在 Unigraphics NX 9.0 软件中对股骨假体屈曲角(femoral prosthesis flexion angle,FPFA)、股骨假体外侧角(anatomical lateral femoral component angle,aLFC)、前翼与股骨前方皮质线夹角(α 角)进行规划设计;股骨远端内、外侧髁截骨厚度参照股骨远端假体厚度进行规划设计,记录术前计划角度及截骨厚度。
股骨远端旋转定位依据 CT 三维测量股骨远端外科通髁轴与股骨后髁连线的夹角,即股骨后髁角(图 1b)。选取股骨前方无软骨的皮质区域为前方支撑,与股骨远端外科通髁轴在同一平面的股骨内外侧髁边缘骨赘为外旋定位参考点及内外侧支撑。为实现与传统截骨器械通配使用,远端截骨面的定位钉参考 LINK 公司股骨远端截骨器的定位孔进行设计(图 1c)。同时基于假体三维模型设计股骨远端截骨厚度、假体型号,并施行数字模拟截骨。截骨导板模型设计后,采用 3D 打印机(EOS 公司,德国)以尼龙粉末打印[9-10](图 1d)。术前 1 d 将截骨导板进行高温高压蒸汽灭菌(132~134℃,0.22 MPa,8 min)备用。整个设计及制备需 3~4 d。
1.3. 手术方法
本组手术均由同一组医生完成;采用 GEMINI® MK-Ⅱ旋转活动平台表面膝关节置换假体(LINK 公司,德国);除 1 例有心脏支架植入史患者外,其余患者均在术中及术后常规使用氨甲环酸。全麻下,患者取仰卧位,大腿根部捆扎气压止血带(35.4 kPa)。取膝关节前正中切口,髌旁内侧入路。采用传统器械行胫骨髓外定位,截骨面垂直于胫骨机械轴,后倾角度 6°~10°。股骨截骨:充分显露股骨前方皮质区域,将制备的截骨导板紧密贴合股骨前方皮质区以及内、外侧髁骨赘边缘,先后植入外旋定位钉及前髁固定钉,保证植钉足够深度后取出外旋定位钉,完成股骨远端截骨;再将外旋定位钉植入截骨导板钉孔,验证外旋定位,全程无需开髓腔。见图 2。胫骨截骨后根据术前预计假体型号放置试模及垫片,复位并活动膝关节,确认关节稳定性及活动度满意后取出试模及垫片。截骨面均匀铺垫骨水泥,安装膝关节假体及垫片,待骨水泥凝固后再次检查膝关节稳定性及活动范围,测量力线良好。放置负压引流管,逐层缝合切口。
图 2.
Operation diagram of the distal femoral patient-specific cutting guide intraoperatively
术中股骨远端截骨导板操作示意图
a、b. 导板安置;c. 外旋定位验证;d. 截骨后骨面
a, b. Patient-specific cutting guide placement; c. External rotation verification; d. Bone surface after cutting

1.4. 术后处理
术后常规使用低分子肝素抗凝及抗生素预防感染;膝关节持续冰敷 72 h,24 h 后拔除引流管。麻醉恢复后即开始踝泵锻炼股四头肌肌力;术后第 2 天膝关节 X 线片复查明确假体位置良好后,在助行器辅助下下地行走,期间指导患者康复锻炼。
1.5. 疗效评价指标
① 比较术前设计股骨远端内、外侧髁截骨厚度以及术中实际截骨厚度。
② 术后 1 周复查下肢全长正侧位 X 线片。于正位片测量 FMAA、aLDFA、mFTA,与术前测量比较评估冠状面力线;于侧位片测量 DFFA、FPFA、aLFC、α 角,分别与术前测量(DFFA)以及术前规划(FPFA、aLFC、α 角)比较,评估股骨远端假体矢状面位置及力线。
③ 记录术中失血量及术后引流量,基于术后第 3 天血红蛋白计算隐性失血量。术后 3 个月行膝关节 ROM、VAS 评分、HSS 评分,评估手术疗效。
1.6. 统计学方法
采用 SPSS 统计软件进行分析。数据以均数±标准差表示,手术前后比较采用配对 t 检验;检验水准取双侧 α=0.05。
2. 结果
本组手术均顺利完成。术前设计股骨远端内、外侧髁截骨厚度分别为(8.8±0.9)、(8.7±1.6)mm,与术中实际截骨厚度(8.4±1.2)、(8.6±1.9)mm 比较,差异均无统计学意义(t=1.433,P=0.168;t=0.307,P=0.762)。
患者均获随访 3 个月。术后切口均Ⅰ期愈合,未出现关节周围感染、下肢深静脉血栓形成等并发症。1 例未使用氨甲环酸者术中失血量为 100 mL、术后引流量为 25 mL、隐性失血量为 806.3 mL。其余 19 例患者术中失血量为 30 ~150 mL,平均 73.2 mL;术后引流量为 20 ~500 mL,平均 154.5 mL;隐性失血量为 169.2~1 400.0 mL,平均 643.8 mL。术后 3 个月 ROM 为(111.5±11.5)°,与术前比较差异无统计学意义(t=–1.962,P=0.065);VAS 评分为(2.4±0.9)分、HSS 评分为(88.2±7.5)分,与术前比较差异均有统计学意义(t=7.248,P=0.000;t=–11.442,P=0.000)。见图3。
图 3.
A 67-year-old female patient with severe osteoarthritis of the right knee
患者,女,67 岁,右膝关节重度骨关节炎
a. 术前下肢全长正侧位 X 线片;b. 术前患侧膝关节正侧位 X 线片;c. 术后 1 周下肢全长正侧位 X 线片;d. 术后 3 个月膝关节正侧位 X 线片;e. 术后 3 个月膝关节功能像
a. Full-length X-ray films of lower extremities in anteroposterior and lateral views before operation; b. Anteroposterior and lateral X-ray films of the knee before operation; c. Full-length X-ray films of lower extremities in anteroposterior and lateral views at 1 week after operation; d. Anteroposterior and lateral X-ray films of the knee at3 months after operation; e. Knee function at 3 months after operation

X 线片冠状面评估:术后 FMAA、aLDFA 与术前测量比较,差异均无统计学意义(P>0.05);mFTA 与术前测量比较差异有统计学意义(P<0.05)。矢状面评估:DFFA 与术前测量比较差异无统计学意义(P>0.05);FPFA、aLFC、α 角与术前规划比较,差异均无统计学意义(P>0.05)。见表 1。
表 1.
Comparison of related indexes of distal femoral prosthesis position and limb alignment before and after operation (n=20,
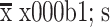 , °)
, °)
手术前后股骨远端假体位置及力线相关指标比较(n=20,
 ,°)
,°)
| 时间
Time |
aLDFA | FMAA | mFTA | DFFA | FPFA | aLFC | α 角
α angle |
| 术前
Preoperative |
83.3±1.5 | 6.8±2.2 | 11.7±4.8 | 1.9±1.9 | 3.1±2.7 | 88.9±1.9 | 4.7±2.1 |
| 术后
Postoperative |
83.3±2.5 | 7.1±2.0 | 1.2±1.1 | 1.5±3.0 | 3.4±4.3 | 88.6±3.0 | 5.0±3.3 |
| 统计值
Statistic |
t=0.000
P=1.000 |
t=−2.042
P=0.055 |
t=9.533
P=0.000 |
t=0.570
P=0.575 |
t=−0.365
P=0.719 |
t=0.590
P=0.562 |
t=−0.443
P=0.663 |
3. 讨论
3.1. 截骨导板准确性分析
吴昊等[11]报道相对于传统截骨方法,精确截骨术后关节功能恢复更好,且下肢力线改善明显,特别是对于存在较严重膝关节畸形和功能障碍的患者,二次截骨发生率也有所降低。本研究基于膝关节 CT 及下肢全长 X 线片图像制备股骨远端截骨导板,术前设计与术中实际截骨厚度比较差异无统计学意义,与基于 MRI 制作的个体化截骨导板截骨厚度差值[(1.3±1.2)mm]相近[12],提示制备的股骨远端截骨导板截骨精确度较高,与王志为等[13]的研究结论相似。
目前,对于个体化截骨导板纠正下肢冠状面力线效果的研究明显多于其他层面力线。研究表明,相较于传统 TKA,个体化截骨导板能更好地恢复下肢冠状面力线[14-15],但也有报道两者无明显差异[16-17]。本研究结果显示术后 mFTA 与术前测量比较差异有统计学意义,且与刘帅等[18]结合全下肢 MRI 与 CT 图像制备个体化截骨导板得出的 mFTA(1.7±1.3)° 结果相近。而 FMAA、aLDFA 与术前测量比较差异无统计学意义,说明下肢力线恢复至术前生理状态。因此,我们认为基于膝关节 CT 及下肢全长 X 线片制备的股骨远端截骨导板,也能有效改善下肢冠状面力线。
目前,对于个体化截骨导板对股骨远端矢状面力线的纠正作用仍存在争论[19-21]。Kim 等[22]通过对 3 048 例膝关节假体寿命分析,发现在矢状面将股骨假体置于相对于股骨远端解剖轴屈曲 0°~3° 时,假体生存率相对较高。但相关文献报道只有 25% 患者的股骨假体能达到矢状面屈曲 0°~3° 范围[10]。传统 TKA 中股骨远端矢状面力线调整以髓腔开口点为支撑,或扩大髓腔开口,手动上翘或下压活动髓内定位杆尾端调整截面屈曲角度,但常因缺乏参照而发生股骨远端前方皮质切迹或前方悬突。研究表明,髓腔开口点偏前或偏后 5 mm 都可能导致股骨远端假体安置在过伸或过屈位–2.2°~8.7°[23],进而出现一系列如假体周围骨折、假体无菌性松动、髌骨弹响、伸屈膝受限等并发症。而且随着髓腔开口扩大,以及股骨髓腔杆的插入使髓腔内压力升高,不仅增加了脂肪栓塞发生概率,也增加了术中失血量[23-24]。
对此,本研究在术前规划时相对于股骨远端解剖轴屈曲 0°~3° 范围内对 FPFA 进行调整,结果显示术后 FPFA 与术前规划比较差异无统计学意义;术后 DFFA 与术前测量比较差异也无统计学意义,与精确髓内定位时的 1.9° 相近[25]。为分析股骨假体矢状面安置角度与假体中远期磨损的相关性,戴繁林等[26]进行了一项相关分析,结果显示 α 角与假体使用寿命成负相关,即 TKA 术后矢状面上 α 角越大,假体使用寿命越短。本研究中 α 角为(5.0±3.3)°,与戴繁林等报道的 (17.16±4.04)° 相比明显减小,说明术前将 FPFA 在相对于股骨远端解剖轴屈曲 0°~3° 范围内进行规划调整,术后 DFFA 更精确,且能获得更理想的 α 角。Leo 等[27]提出采用基于下肢全长 CT 制备的个体化截骨导板辅助 TKA 时,aLFC 为(86.2±2.2)° 时假体位置最佳,本研究术后测量 aLFC 为(88.6±3.0)°,与 Leo 等[27]提出的标准相近。因此,采用基于膝关节 CT 及下肢全长 X 线片制备的股骨远端截骨导板辅助 TKA,也能获得较好的股骨远端假体矢状面位置及力线。
3.2. 截骨导板辅助 TKA 疗效分析
传统 TKA 术中失血量主要为股骨髓腔内失血,隐性失血量为关节间隙、组织间隙以及关节腔积血等。个体化截骨导板术前规划采取的是股骨远端髓外定位,术中全程无需打开髓腔。Voleti 等[28]使用个体化截骨导板辅助 TKA,术中失血量平均为 371 mL。Gong 等[29]使用个体化截骨导板辅助 TKA,术中失血量平均为 68 mL,术后引流量平均为 194 mL。本组术中失血量平均为 73.2 mL,术后引流量平均为 154.5 mL,隐形失血量平均为 643.8 mL,与大多数采用个体化截骨导板辅助 TKA 研究结论相同,可显著减少术中失血量。
此外,本研究结果还显示术后 3 个月膝关节 ROM 与术前相比差异无统计学意义,但患者疼痛评分及功能评分较术前明显改善,与余进伟等[30]的研究结论相同,提示本研究制备的股骨远端截骨导板辅助 TKA 能获得较好早期疗效。
3.3. 基于膝关节 CT 及下肢全长 X 线片设计股骨远端截骨导板的体会
3.3.1. 模型构建
Mimics 16.0 软件中股骨远端三维模型构建是在 CT 二维图像上先设定阈值、再形成“蒙板(mask)”,而软件自带的部分图像功能只能分割阈值相差明显的部位。首先,膝关节骨关节炎患者的膝关节 CT 图像依靠软件自动分割会出现边缘缺损,尤其是扫描电流参数不固定时,骨赘边缘显示差异明显,扫描电流越大、骨赘显示越清晰,但患者辐射量增加[31];扫描电流过小,骨赘显示越差,常需手动修补。但当利用软件自定义设置分割阈值时,若阈值过大,“蒙板”边缘越不完整,对于骨赘的划分就越差,使用软件中的“Calculate 3D”功能重建的模型不完整;若阈值过小,“蒙板”的边缘越毛糙,对于边缘的识别度降低,造成重建后模型边缘毛糙,出现多余的“钉突”。其次,在手动编辑“蒙板”时,常需同时处理冠状面、矢状面及横断面 3 个层面,不同人对于骨赘在 3 个层面的显示图像辨识不同,因此重建的三维模型形态也不同。本研究膝关节 CT 扫描参数为层厚 1 mm、矩阵 512×512、电压 120 kV、电流 200~280 mAs,在三维模型构建中能较好地显示膝关节边缘骨赘情况,有利于准确重建膝关节骨模型。
3.3.2. 定位参考点选择
目前个体化截骨导板制备所需的图像采集方式和术前截骨规划的方法并无统一标准[5-6]。CT 扫描虽然在软骨显示及重建模型精确度方面不及 MRI,且不能将关节面作为参考,但基于 CT 图像重建的模型表面更光滑平整,作为定位参考比 MRI 更准确[32]。也有研究基于 CT 图像进行膝关节模型构建,但截骨仍以软骨下骨为参考,术中需将关节面软骨及边缘骨赘咬除以用于截骨导板的安置[13, 33]。但咬除关节面软骨时无法控制显露的软骨下骨与术前规划形态相同或相似,人为误差较大。本研究中选取股骨前方皮质区及内外侧髁边缘骨赘作为参考定位点,通过术中观察证实股骨前方皮质区参考价值最大,个体化截骨导板在此处的贴合度直接影响整个截骨界面的定位,也直接影响截骨力线。但只参考股骨前方皮质不能获得股骨远端的稳定性,需增加股骨内外侧髁边缘骨赘作为固定参考,既能提供足够稳定性,也能作为股骨外科通髁轴的参考界面,术中可以更直观地查看旋转力线。
综上述,基于膝关节 CT 及下肢全长 X 线片制备股骨远端截骨导板辅助 TKA 能实现精确截骨,并能获得精确的下肢冠状面和矢状面力线,减少手术失血量,术后早期膝关节功能明显改善。
作者贡献:吴碧、冯均伟负责实验设计及实施,起草文章,并负责数据收集整理及统计分析;王跃负责项目策划及总体设计和实施;郝鹏参与实验实施及对文章的知识性内容作批评性审阅。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突;基金项目经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:研究方案经四川省医学科学院·四川省人民医院医学伦理委员会批准[伦审(研)2020 年第 420 号]。
Funding Statement
四川省卫生和计划生育委员会2015年科技基金项目(150189)
References
- 1.Klein GR, Parvizi J, Rapuri VR, et al The effect of tibial polyethylene insert design on range of motion: evaluation of in vivo knee kinematics by a computerized navigation system during total knee arthroplasty. J Arthroplasty. 2004;19(8):986–991. [PubMed] [Google Scholar]
- 2.Sikorski JM Alignment in total knee replacement. J Bone Joint Surg (Br) 2008;90(9):1121–1127. doi: 10.1302/0301-620X.90B9.20793. [DOI] [PubMed] [Google Scholar]
- 3.Mason JB, Fehring TK, Estok R, et al Meta-analysis of alignment outcomes in computer-assisted total knee arthroplasty surgery. J Arthroplasty. 2007;22(8):1097–1106. doi: 10.1016/j.arth.2007.08.001. [DOI] [PubMed] [Google Scholar]
- 4.王波, 胡海涛, 潘健, 等 膝关节骨性关节炎全膝关节置换术后下肢力线与早期临床效果关系的研究. 中国骨与关节损伤杂志. 2015;30(10):1044–1048. doi: 10.7531/j.issn.1672-9935.2015.10.012. [DOI] [Google Scholar]
- 5.Schotanus MGM, Boonen B, van der Weegen W, et al No difference in mid-term survival and clinical outcome between patient-specific and conventional instrumented total knee arthroplasty: a randomized controlled trial. Knee Surg Sports Traumatol Arthrosc. 2019;27(5):1463–1468. doi: 10.1007/s00167-018-4968-5. [DOI] [PubMed] [Google Scholar]
- 6.Martijn S, Elke T, Marion H, et al Favourable alignment outcomes with MRI-based patient-specific instruments in total knee arthroplasty. Knee Surgery Sports Traumatology Arthroscopy. 2018;26(9) doi: 10.1007/s00167-017-4637-0. [DOI] [PubMed] [Google Scholar]
- 7.Wu XD, Xiang BY, Schotanus M, et al CT- versus MRI-based patient-specific instrumentation for total knee arthroplasty: A systematic review and meta-analysis. Surgeon. 2017;15(6):336–348. doi: 10.1016/j.surge.2017.06.002. [DOI] [PubMed] [Google Scholar]
- 8.An VV, Sivakumar BS, Phan K, et al Accuracy of MRI-based vs. CT-based patient-specific instrumentation in total knee arthroplasty: A meta-analysis . J Orthop Sci. 2017;22(1):116–120. doi: 10.1016/j.jos.2016.10.007. [DOI] [PubMed] [Google Scholar]
- 9.邱冰, 张明娇, 唐本森, 等 基于 3D 打印个性化手术导航模板辅助下的人工全膝关节置换. 中国组织工程研究. 2015;(48):7731–7735. doi: 10.3969/j.issn.2095-4344.2015.48.004. [DOI] [Google Scholar]
- 10.Gromov K, Korchi M, Thomsen MG, et al What is the optimal alignment of the tibial and femoral components in knee arthroplasty? Acta Orthop. 2014;85(5):480–487. doi: 10.3109/17453674.2014.940573. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.吴昊, 查振刚, 熊高鑫, 等 全膝关节置换术中精确截骨的疗效观察. 暨南大学学报 (自然科学与医学版) 2010;31(2):178–181, 185. [Google Scholar]
- 12.Fitzgerald SJ, Trousdale RT Why knees fail in 2011: patient, surgeon, or device? Orthopedics. 2011;34(9):e513–515. doi: 10.3928/01477447-20110714-45. [DOI] [PubMed] [Google Scholar]
- 13.王志为, 温亮, 于洋, 等 个性化截骨工具辅助下运动学对线全膝关节置换的早期临床结果. 中华外科杂志. 2020;58(6):457–463. [Google Scholar]
- 14.Daniilidis K, Tibesku CO Frontal plane alignment after total knee arthroplasty using patient-specific instruments. Int Orthop. 2013;37(1):45–50. doi: 10.1007/s00264-012-1732-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Heyse TJ, Tibesku CO Improved tibial component rotation in TKA using patient-specific instrumentation. Arch Orthop Trauma Surg. 2015;135(5):697–701. doi: 10.1007/s00402-015-2157-2. [DOI] [PubMed] [Google Scholar]
- 16.Boonen B, Schotanus MG, Kerens B, et al Intra-operative results and radiological outcome of conventional and patient-specific surgery in total knee arthroplasty: a multicentre, randomised controlled trial. Knee Surg Sports Traumatol Arthrosc. 2013;21(10):2206–2212. doi: 10.1007/s00167-013-2620-y. [DOI] [PubMed] [Google Scholar]
- 17.Chareancholvanich K, Narkbunnam R, Pornrattanamaneewong C A prospective randomised controlled study of patient-specific cutting guides compared with conventional instrumentation in total knee replacement. Bone Joint J. 2013;95-B(3):354–359. doi: 10.1302/0301-620X.95B3.29903. [DOI] [PubMed] [Google Scholar]
- 18.刘帅, 姚庆强, 田书畅, 等 3D 打印截骨槽导板与定位钉导板在全膝关节置换术中的对比研究. 中国骨与关节杂志. 2017;6(5):334–339. doi: 10.3969/j.issn.2095-252X.2017.05.003. [DOI] [Google Scholar]
- 19.Roh YW, Kim TW, Lee S, et al Is TKA using patient-specific instruments comparable to conventional TKA? A randomized controlled study of one system. Clin Orthop Relat Res. 2013;471(12):3988–3995. doi: 10.1007/s11999-013-3206-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Kotela A, Lorkowski J, Kucharzewski M, et al Corrigendum to “patient-specific CT-based instrumentation versus conventional instrumentation in total knee arthroplasty: a prospective randomized controlled study on clinical outcomes and in-hospital data”. Biomed Res Int. 2018;2018:6723963. doi: 10.1155/2018/6723963. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Kotela A, Lorkowski J, Kucharzewski M, et al Patient- specific CT-based instrumentation versus conventional instrumentation in total knee arthroplasty: a prospective randomized controlled study on clinical outcomes and in-hospital data. Biomed Res Int. 2015;2015:165908. doi: 10.1155/2015/165908. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Kim YH, Park JW, Kim JS, et al The relationship between the survival of total knee arthroplasty and postoperative coronal, sagittal and rotational alignment of knee prosthesis. Int Orthop. 2014;38(2):379–385. doi: 10.1007/s00264-013-2097-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Church JS, Scadden JE, Gupta RR, et al Embolic phenomena during computer-assisted and conventional total knee replacement. J Bone Joint Surg (Br) 2007;89(4):481–485. doi: 10.1302/0301-620X.89B4.18470. [DOI] [PubMed] [Google Scholar]
- 24.Heyse TJ, Haas SB, Drinkwater D, et al Intraarticular fibrinogen does not reduce blood loss in TKA: a randomized clinical trial. Clin Orthop Relat Res. 2014;472(1):272–276. doi: 10.1007/s11999-013-3036-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Mihalko WM, Boyle J, Clark LD, et al The variability of intramedullary alignment of the femoral component during total knee arthroplasty. J Arthroplasty. 2005;20(1):25–28. doi: 10.1016/j.arth.2004.10.011. [DOI] [PubMed] [Google Scholar]
- 26.戴繁林, 胡立新, 王小武, 等 全膝关节置换术中股骨假体矢状面置入角度与假体中远期磨损的相关性研究. 中国骨与关节损伤杂志. 2019;34(8):796–799. doi: 10.7531/j.issn.1672-9935.2019.08.004. [DOI] [Google Scholar]
- 27.Leo P, Martin M, Georg B, et al Patient-specific instrumentation improved three-dimensional accuracy in total knee arthroplasty: a comparative radiographic analysis of 1257 total knee arthroplasties. J Orthop Surg Res. 2019;14(10):437. doi: 10.1186/s13018-019-1465-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Voleti PB, Hamula MJ, Baldwin KD, et al Current data do not support routine use of patient-specific instrumentation in total knee arthroplasty. J Arthroplasty. 2014;29(9):1709–1712. doi: 10.1016/j.arth.2014.01.039. [DOI] [PubMed] [Google Scholar]
- 29.Gong S, Xu W, Wang R, et al Patient-specific instrumentation improved axial alignment of the femoral component, operative time and perioperative blood loss after total knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. 2019;27(4):1083–1095. doi: 10.1007/s00167-018-5256-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.余进伟, 郭甲瑞, 陈旭, 等 3D 打印模板辅助关节置换治疗膝骨关节炎的前瞻性研究. 实用骨科杂志. 2018;24(9):782–785, 836. [Google Scholar]
- 31.王向东, 韩萍, 赵虎, 等 腕关节多层螺旋 CT 扫描参数、图像质量和辐射剂量的关系. 解剖学报. 2010;41(6):905–908. doi: 10.3969/j.issn.0529-1356.2010.06.026. [DOI] [Google Scholar]
- 32.White D, Chelule KL, Seedhom BB Accuracy of MRI vs CT imaging with particular reference to patient specific templates for total knee replacement surgery . Int J Med Robot. 2008;4(3):224–231. doi: 10.1002/rcs.201. [DOI] [PubMed] [Google Scholar]
- 33.Ensini A, Timoncini A, Cenni F, et al Intra- and post-operative accuracy assessments of two different patient-specific instrumentation systems for total knee replacement. Knee Surg Sports Traumatol Arthrosc. 2014;22(3):621–629. doi: 10.1007/s00167-013-2667-9. [DOI] [PubMed] [Google Scholar]


