Abstract
目的
探究 miR-27a 过表达的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)来源外泌体 exo(miR-27a)能否促进骨再生并改善糖皮质激素(glucocorticoids,GC)诱导的股骨头坏死(osteonecrosis of femoral head,ONFH)(GC-ONFH)。
方法
构建 exo(miR-27a),并通过透射电镜、纳米颗粒跟踪分析、Western blot 和实时荧光定量 PCR(real-time fluorescent quantitative PCR,qRT-PCR)进行鉴定。采用 qRT-PCR 评估 exo(miR-27a)递送 miR-27a 至成骨细胞 MC3T3-E1 的效果,ALP 染色、茜素红染色及 qRT-PCR 评估其对 MC3T3-E1 细胞成骨的影响。行双荧光素酶报告基因检测验证 miR-27a 靶向 Dickkopf WNT 信号通路抑制剂 2(Dickkopf WNT signaling pathway inhibitor 2,DKK2)是否为潜在机制,并在 MC3T3-E1 细胞内通过 qRT-PCR、Western blot 及茜素红染色进一步验证该机制。最后,通过 SD 大鼠的 GC-ONFH 模型验证 exo(miR-27a)对 ONFH 的保护作用。
结果
透射电镜、纳米颗粒跟踪分析、Western blot 和 qRT-PCR 检测示 exo(miR-27a)构建成功。exo(miR-27a)可将 miR-27a 有效递送至 MC3T3-E1 细胞并提高其成骨能力。双荧光素酶报告基因检测示 miR-27a 通过直接靶向 DDK2 促进成骨。动物实验 Micro-CT 及 HE 染色结果显示,尾静脉注射 exo(miR-27a)改善了 SD 大鼠 GC-ONFH 模型的骨坏死情况。
结论
exo(miR-27a)可以促进骨再生,并在一定程度上改善 GC-ONFH。
Keywords: miR-27a, 外泌体, 成骨, 股骨头坏死, 人脐静脉内皮细胞, 基因靶向治疗
Abstract
Objective
To investigate whether exosomes derived from miR-27a-overexpressing human umbilical vein endothelial cells (HUVECs)—exo (miR-27a) can promote bone regeneration and improve glucocorticoids (GC) induced osteonecrosis of femoral head (ONFH) (GC-ONFH).
Methods
The exo (miR-27a) were intended to be constructed and identified by transmission electron microscopy, nanoparticle tracking analysis, Western blot, and real-time fluorescent quantitative PCR (qRT-PCR). qRT-PCR was used to evaluate the effect of exo (miR-27a) in delivering miR-27a to osteoblasts (MC3T3-E1 cells). Alkaline phosphatase staining, alizarin red staining, and qRT-PCR were used to evaluate its effect on MC3T3-E1 cells osteogenesis. Dual-luciferase reporter (DLRTM) assay was used to verify whether miR-27a targeting Dickkopf WNT signaling pathway inhibitor 2 (DKK2) was a potential mechanism, and the mechanism was further verified by qRT-PCR, Western blot, and alizarin red staining in MC3T3-E1 cells. Finally, the protective effect of exo (miR-27a) on ONFH was verified by the GC-ONFH model in Sprague Dawley (SD) rats.
Results
Transmission electron microscopy, nanoparticle tracking analysis, Western blot, and qRT-PCR detection showed that exo (miR-27a) was successfully constructed. exo (miR-27a) could effectively deliver miR-27a to MC3T3-E1 cells and enhance their osteogenic capacity. The detection of DLRTM showed that miR-27a promoted bone formation by directly targeting DDK2. Micro-CT and HE staining results of animal experiments showed that tail vein injection of exo (miR-27a) improved the osteonecrosis of SD rat GC-ONFH model.
Conclusion
exo (miR-27a) can promote bone regeneration and protect against GC-ONFH to some extent.
Keywords: MiR-27a, exosomes, osteogenesis, osteonecrosis of femoral head, human umbilical vein endothelial cells, gene targeted therapy
股骨头坏死(osteonecrosis of femoral head,ONFH)是一种常见的骨科难治病,作为一种破坏性和进行性疾病,常导致股骨头塌陷,约 70% 患者最终需要行髋关节置换术,给患者带来沉重的经济负担和身心损害[1-4]。糖皮质激素(glucocorticoids,GC)引起的 ONFH(GC-ONFH)是最常见的非创伤性骨坏死类型之一[5-6]。根据既往研究,GC-ONFH 的发病机制可以归纳为血运重建困难和成骨活性减弱[7-9]。因此,增强血管生成或促进成骨是预防及早期治疗 GC-ONFH 的关键[10-11]。
外泌体作为基因传递的天然纳米载体,已在很多临床研究中表现出积极治疗作用,例如炎症缓解、组织修复和再生调节[12-13]。近年,外泌体在骨组织修复和再生领域得到了广泛关注[14-16],其依靠出色的生物相容性和靶向性,逐渐成为骨组织工程中热门的基因治疗载体[17-20]。据报道血管内皮细胞来源外泌体具有良好的骨靶向性[21],有望应用于 GC-ONFH 的基因疗法。
miRNA 是一种内源性非编码小 RNA,近年来大量研究表明部分 miRNA 在成骨分化过程中至关重要,如 miR-181a/b-1 通过介导 PTEN/PI3K/AKT 通路促进骨再生,miR-130a 对 MSCs 的成骨成脂分化平衡发挥重要作用,miR-335-5p 在小鼠体内实验中可以促进骨形成[22-24]。此外,据报道 miR-27a 正调节 MSCs 的成骨分化,过表达 miR-27a 显著增强其 ALP 活性和钙沉积水平,miR-27a 在体内外均显示出强大的成骨能力[25-26]。然而,miRNA 在体内容易被降解,这在一定程度上限制了其在骨组织工程中的应用,因此寻找 miRNA 的保护性载体一直是组织工程研究重要方向[27-28]。将血管内皮细胞来源外泌体用作 miR-27a 的运输载体,可能是保护其避免被免疫系统降解并靶向骨组织,从而发挥促进骨再生的一种可行策略。
目前,有关 miR-27a 结合血管内皮细胞来源外泌体在 GC-ONFH 中的研究尚未见报道。因此,本研究通过构建 miR-27a 过表达的血管内皮细胞来源外泌体,验证其体内外成骨能力,最终在大鼠 GC-ONFH 模型中验证其保护作用,旨在为治疗性 miRNA 搭载外泌体的再生疗法奠定理论基础。
1. 材料与方法
1.1. 实验动物及主要材料、仪器
清洁级 2 月龄雄性 SD 大鼠 18 只,体质量约 250 g,购自西安交通大学实验动物中心。
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs;北京鼎国昌盛生物技术有限责任公司);miR-27a-3p mimics(人工合成的 miR-27a-3p 模拟物)、miR-27a-3p inhibitor(人工合成的 miR-27a-3p 抑制剂)、miR-27a-3p NC(miR-27a-3p 模拟物的阴性对照)(上海吉玛制药技术有限公司);MC3T3-E1 细胞、双荧光素酶报告基因试剂盒、Dickkopf WNT 信号通路抑制剂 2(Dickkopf WNT signaling pathway inhibitor 2,DKK2)过表达慢病毒(上海吉凯基因科技有限公司);实时荧光定量 PCR(real-time fluorescent quantitative PCR,qRT-PCR)引物(北京擎科生物科技有限公司);HUVECs 专用培养基(ScienCell 生物技术公司,美国);α-MEM 培养基、FBS、青霉素-链霉素双抗(Thermo Fisher Scientific 公司,美国);jetPRIME 转染试剂盒(Polyplus-transfection®SA 公司,法国);细胞计数试剂盒 8(cell counting kit 8,CCK-8)、ALP 染色试剂盒、茜素红染色试剂盒、苏木素伊红染色试剂盒(上海碧云天生物技术有限公司);DKK2 抗体、β-actin 抗体(Abcam 公司,美国);多聚甲醛、EDTA-脱钙液、十六烷基吡啶氯化钠、β-甘油磷酸钠、抗坏血酸磷酸、地塞米松(Sigma 公司,日本)。酶标仪(北京天根生化科技有限公司);超速离心机(Beckman 公司,德国);HT-7700 透射电镜(Hitachi 公司,日本);N30E 粒径分析仪(厦门福流生物科技有限公司)。
1.2. HUVECs 的转染及相关观测
1.2.1. 细胞培养
将冻存于液氮中的 HUVECs 于 39℃ 水浴中快速解冻,并以 1 000×g 离心 5 min;弃上清,用 HUVECs 专用培养基重悬细胞沉淀,接种于 T25 培养瓶中,37℃、5%CO2 恒温培养箱培养。当细胞生长至约 80% 融合时,加入胰蛋白酶-EDTA 消化后按 1∶3 比例传代培养,依据生长情况进行换液。
1.2.2. 细胞转染及分组
取第 3 代 HUVECs 以 2.5×105 个/mL 密度接种于 6 孔板,培养 12 h 后分别加入含 miR-27a NC(miR-27a NC 组)或 miR-27a mimics(miR-27a mimics 组)的转染混合物(依照 jetPRIME 转染试剂盒说明书配置)进行转染,继续培养 24 h 后更换为新鲜培养基。
1.2.3. 观测指标
① 光镜观察:转染 36 h 后光镜下观察两组细胞形态变化。② qRT-PCR 检测转染效率:转染后 48 h 收集两组细胞,以 Trizol 提取细胞总 RNA,将其逆转录成 cDNA,采用 qRT-PCR 试剂盒检测 miR-27a 基因表达,以 U6 作为内参基因,以 2–ΔΔCt 法对数据进行分析,得出各组 miR-27a 的 mRNA 相对表达量。引物序列见表 1。③ CCK-8 法检测细胞活力:转染 24、72 h 后,按照 CCK-8 试剂盒说明书方法,检测 miR-27a NC 组、miR-27a mimics 组细胞活力,以吸光度(A)值表示;以培养 24、72 h 未转染的 HUVECs 作为对照组。
表 1.
Primer sequences for qRT-PCR
qRT-PCR 引物序列
| 基因
Gene |
引物序列(5'→3')
Primer sequence (5'→3') |
| COL1A1 | 上游 GCTCCTCTTAGGGGCCACT |
| Forward | |
| 下游 ATTGGGGACCCTTAGGCCAT | |
| Reverse | |
| RUNX2 | 上游 GCCGGGAATGATGAGAACTA |
| Forward | |
| 下游 GGTGAAACTCTTGCCTCGTC | |
| Reverse | |
| OCN | 上游 GCCATCACCCTGTCTCCTAA |
| Forward | |
| 下游 GCTGTGGAGAAGACACACGA | |
| Reverse | |
| GAPDH | 上游 CATCCCAGAGCTGAACG |
| Forward | |
| 下游 CTGGTCCTCAGTGTAGCC | |
| Reverse | |
| miR-27a | 上游 CGGCGGTTTCACAGTGGCTAAG |
| Forward | |
| 下游 CCAGTGCAGGGTCCGAGGTAT | |
| Reverse | |
| U6 | 上游 CGCTTCGGCAGCACATATAC |
| Forward | |
| 下游 AAATATGGAACGCTTCACGA | |
| Reverse | |
| DKK2 | 上游 CTGATGCGGGTCAAGGATTCA |
| Forward | |
| 下游 CTCCCCTCCTAGAGAGGACTT | |
| Reverse |
1.3. HUVECs 外泌体的提取及鉴定
1.3.1. 外泌体的提取
采用超速离心法提取 miR-27a NC 组和 miR-27a mimics 组的外泌体并对应分为 exo(NC)组和 exo(miR-27a)组。具体方法:分别取 miR-27a NC 组和 miR-27a mimics 组转染 48 h 后的上清,以 300×g 离心 10 min 去除残留细胞;取上清,以 2 000×g 离心 10 min 去除细胞碎片;取上清,以 10 000×g 离心 30 min 去除大的囊泡和某些细胞器;取上清,以 10 000×g 离心 90 min 提取外泌体;弃上清,用 PBS 清洗外泌体沉淀去除杂蛋白,再以 10 000×g 离心 90 min 提取纯化的外泌体。
1.3.2. 外泌体的鉴定
① 透射电镜观察:取 exo(miR-27a)组外泌体,透射电镜观察外泌体形态。② 纳米颗粒跟踪分析:取 exo(miR-27a)组外泌体,采用纳米颗粒跟踪分析法分析外泌体的粒径分布。③ Western blot 检测:取 exo(NC)组和 exo(miR-27a)组外泌体,用 RIPA 裂解液提取各组总蛋白,BCA 试剂盒检测蛋白浓度,依照蛋白浓度调整蛋白上样量,行 SDS-PAGE 电泳,100 V 下湿转,5% 脱脂奶粉封闭过夜,孵育相应蛋白一抗和二抗,包括外泌体阳性蛋白标志物[外泌体膜蛋白(CD9)和外泌体内蛋白(Alix)]和内质网特异性蛋白标志物(Calnexin),采用 ECL 化学发光法进行成像。以单纯 HUVECs 为对照。④ qRT-PCR 检测:分别取 exo(NC)组和 exo(miR-27a)组外泌体,同 1.2.3 方法检测 miR-27a mRNA 相对表达量。引物序列见表 1。
1.4. 过表达 miR-27a 的 HUVECs 外泌体对 MC3T3-E1 细胞成骨分化的影响
1.4.1. 细胞培养及实验分组
同 HUVECs 方法复苏 MC3T3-E1 细胞,采用 α-MEM 完全培养基(含 10%FBS 及 1% 青霉素-链霉素)进行复苏及传代培养,依据细胞生长状况进行换液。取复苏后第 3 代 MC3T3-E1 细胞,分别与外泌体 exo(NC)和 exo(miR-27a)共培养(外泌体浓度为 5 μg/mL),设为 EXO(NC)组和 EXO(miR-27a)组,以单纯 MC3T3-E1 细胞为空白对照组。
1.4.2. 观测指标
① ALP 染色和茜素红染色:取各组 MC3T3-E1 细胞,更换为成骨诱导培养基(含 10 mmol/L β-甘油磷酸钠、0.05 mmol/L 抗坏血酸磷酸、100 nmol/L 地塞米松的 α-MEM 完全培养基)培养,诱导 7 d 行 ALP 染色,拍照后采用 Image J 软件检测 ALP 染色阳性面积百分比;诱导 14 d 行茜素红染色,将矿化结节溶于 100 mmol/L 十六烷基吡啶氯化钠中 30 min,测定 562 nm 波长下 A 值。② qRT-PCR 检测:首先,取 EXO(NC)组和 EXO(miR-27a)组 MC3T3-E1 细胞,同 1.2.3 方法检测 miR-27a mRNA 相对表达量,以验证 miR-27a 过表达的 HUVECs 外泌体是否将 miR-27a 成功递送至 MC3T3-E1 细胞中。然后,取 EXO(NC)组、EXO(miR-27a)组和空白对照组 MC3T3-E1 细胞,同法检测成骨相关基因骨钙素(osteocalcin,OCN)、Ⅰ型胶原 alpha 1 链(collagen type Ⅰalpha 1 chain,COL1A1)、RUNX 家族转录因子 2(RUNX family transcription factor 2,RUNX2)mRNA 相对表达量,以 GADPH 为内参基因。引物序列见表 1。
1.5. 验证 miR-27a 是否通过靶向 DKK2 促进成骨分化
1.5.1. 双荧光素酶报告基因实验及靶细胞内验证实验
实验分 6 组:NC(空质粒)+miR-27a mimics 组、NC+miR-27a NC 组、WT(野生型)+miR-27a mimics 组、WT+miR-27a NC 组、MUT(突变型)+miR-27a mimics 组、MUT+miR-27a NC 组。2 个 NC 组用于验证本实验体系是否正常,WT 和 MUT 组用于验证 miR-27a-3p 是否直接靶向 DKK2 的 3’UTR 区域。按照双荧光素酶报告基因检测试剂盒说明书进行实验,记录各组相对荧光强度。
在靶细胞内进一步验证 miR-27a 是否可以靶向 DDK2 并降低其表达水平。取 MC3T3-E1 细胞,分别用 miR-27a mimics、miR-27a inhibitor 及 miR-27a NC 转染,转染方法同 1.2.2;转染后 72 h 分别采用 qRT-PCR 和 Western blot 法检测 DKK2 的 mRNA 和蛋白表达水平。
1.5.2. 验证 miR-27a 靶向 DKK2 对 MC3T3-E1 细胞矿化水平的影响
构建过表达 DKK2 的 MC3T3-E1 细胞系:制备浓度为 5×104 个/mL 的 MC3T3-E1 细胞悬液并接种于 6 孔板中,培养 12 h 后更换含 5 µg/mL 聚凝胺的新鲜培养基,加入适量 DKK2 过表达慢病毒,保证感染复数为 100(依据慢病毒公司技术指导的推荐量);培养 12 h 后更换为普通培养基,继续培养 72 h 并密切观察细胞状态和荧光强度,细胞长满后(约 90%)进行传代培养,并用 10 µg/mL 嘌呤霉素筛选出稳定表达 DDK2 的 MC3T3-E1 细胞系。向过表达 DKK2 的 MC3T3-E1 细胞以及正常 MC3T3-E1 细胞分别转染 miR-27a mimics 和 miR-27a NC,故实验分成 4 组:DKK2(−)+miR-27a NC 组(阴性对照组)、DKK2(+)+miR-27a NC 组(DKK2 过表达组)、DKK2(−)+miR-27a mimics 组(miR-27a 过表达组)、DKK2(+)+miR-27a mimics 组(挽救组)。成骨诱导培养 14 d 同 1.4.2 方法行茜素红染色,酶标仪测定 562 nm 波长下 A 值。
1.6. 过表达 miR-27a 的 HUVECs 外泌体对大鼠 GC-ONFH 的影响
1.6.1. 实验分组及方法
取适应性喂养 1 周的 SD 大鼠 18 只,随机分为正常对照组、模型组和干预组,每组 6 只。取模型组和干预组动物,按照文献[29]方法制备大鼠 GC-ONFH 模型,正常对照组大鼠不造模。干预组于 GC 注射第 1 天同时开始每天尾静脉注射过表达 miR-27a 的 HUVECs 外泌体 (100 μg/只)。模型组造模过程中不作特殊处理。造模过程中每只大鼠每天肌肉注射 10 万 U 青霉素以防止感染发生,如动物死亡及时予以补充。
1.6.2. Micro-CT 观测
造模后 4 周取大鼠双侧股骨头,4% 多聚甲醛固定 24 h。取一侧股骨头行 Micro-CT 扫描,使用 Mimics Medical 21.0 软件生成每组代表性样品的横截面和矢状面。测量相对骨体积(bone volume/tissue volume,BV/TV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁数目(trabecular number,Tb.N)和骨小梁分离度(trabecular thickness,Tb.Sp)。
1.6.3. HE 染色观察
取另一侧股骨头,用 10%EDTA 脱钙 4 周(期间每 3 天更换 1 次脱钙液)。石蜡包埋、切片(片厚 5 μm)、二甲苯梯度脱蜡、梯度乙醇水化、蒸馏水冲洗,常规行 HE 染色并观察股骨头组织形态。
1.7. 统计学方法
采用 GraphPad Prism8 统计软件进行分析。数据以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用 SNK 检验;两组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
2.1. HUVECs 的转染及相关观测
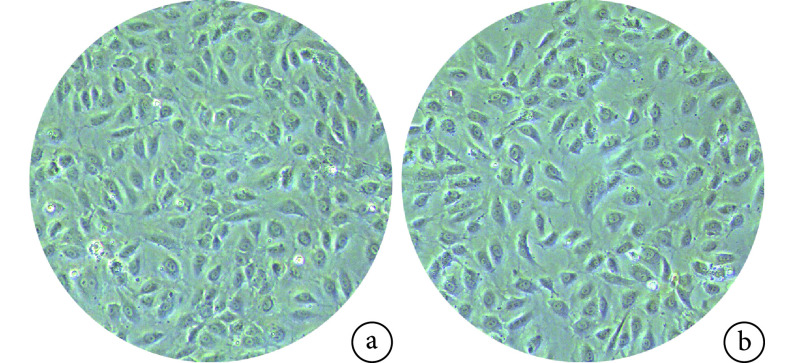
光镜观察示,miR-27a NC 组与 miR-27a mimics 组的 HUVECs 形态一致,均呈铺路状鹅卵石样且形态饱满清晰(图 1)。qRT-PCR 检测示,miR-27a mimics 组 miR-27a mRNA 相对表达量为 254.037±19.576,显著高于 miR-27a NC 组的 1.004±0.017,差异有统计学意义(t=22.390,P=0.002)。CCK-8 检测示,miR-27a NC 组、miR-27a mimics 组及对照组转染 24 h 时 A 值分别为 0.611±0.035、0.618±0.030、0.613±0.015,72 h 时分别为 1.953±0.240、1.994±0.186、1.913±0.130;3 组细胞活力随培养时间延长均显著增加,3 组间比较差异无统计学意义(P>0.05)。说明成功构建 miR-27a 过表达的 HUVECs。
图 1.
Cell morphology observation at 36 hours after transfection (×100)
转染后 36 h 细胞形态观察(×100)
a. miR-27a NC 组;b. miR-27a mimics 组
a. miR-27a NC group; b. miR-27a mimics group
2.2. HUVECs 外泌体的提取及鉴定
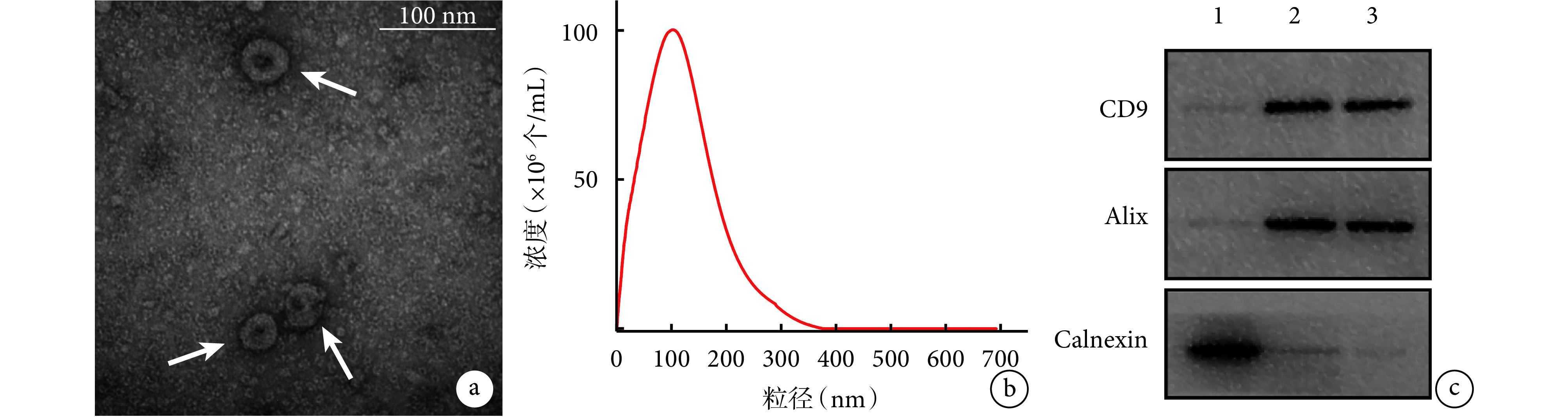
透射电镜观察示,exo(miR-27a)组外泌体呈盘状或杯状(图 2a),与文献报道[12]一致。纳米颗粒跟踪分析表明,exo(miR-27a)组 90.62% 外泌体粒径分布在 30~150 nm 范围(图 2b),与其他研究中外泌体粒径参数[13]相似。Western blot 检测示,exo(NC)组和 exo(miR-27a)组 CD9 和 Alix 蛋白表达均呈阳性,几乎未见 Calnexin 蛋白表达;单纯 HUVECs 则相反(图 2c)。上述检测结果说明外泌体提取成功。
图 2.
Exosome identification
外泌体鉴定
a. exo(miR-27a)组透射电镜观察(×50 k) 箭头示外泌体;b. exo(miR-27a)组纳米颗粒跟踪分析;c. Western blot 检测 1:单纯 HUVECs 2:exo(NC)组 3:exo(miR-27a)组
a. Transmission electron microscopy observation (×50 k) Arrow indicated exosome; b. Nanoparticle tracking analysis; c. Western blot assay 1: HUVECs 2: exo (NC) group 3: exo (miR-27a) group
qRT-PCR 检测示,exo(miR-27a)组外泌体中 miR-27a mRNA 相对表达量为 26.560±1.498,显著高于 exo(NC)组的 1.004±0.113,差异有统计学意义(t=29.470,P=0.001)。表明 miR-27a 过表达的 HUVECs 外泌体成功获取。
2.3. 过表达 miR-27a 的 HUVECs 外泌体对 MC3T3-E1 细胞成骨分化的影响
2.3.1. ALP 染色和茜素红染色
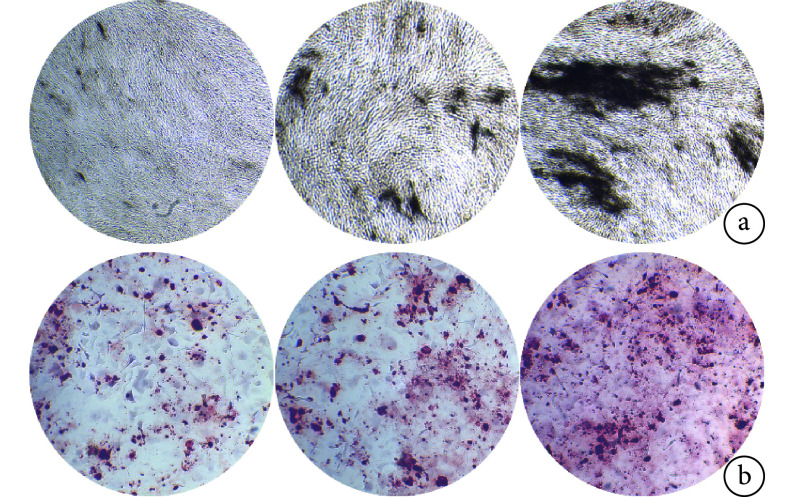
EXO(NC)组、EXO(miR-27a)组和空白对照组 ALP 染色阳性面积百分比分别为 17.903%±1.343%、33.199%±2.305%,5.911%±1.639%,A 值分别为 4.051±0.255、8.729±0.432、1.789±0.221,EXO(NC)组和 EXO(miR-27a)组显著高于空白对照组,EXO(miR-27a)组显著高于 EXO(NC)组,差异均有统计学意义(P<0.05)。见图 3。
图 3.
ALP staining and alizarin red staining observations in each group (×40)
各组 ALP 染色和茜素红染色观察(×40)
从左至右依次为空白对照组、EXO(NC)组、EXO(miR-27a)组 a. ALP 染色;b. 茜素红染色
From left to right for blank control group, EXO (NC) group, EXO (miR-27a) group, respectively a. ALP staining; b. Alizarin red staining
2.3.2. qRT-PCR 检测
EXO(miR-27a)组 MC3T3-E1 细胞中 miR-27a mRNA 相对表达量显著高于 EXO(NC)组,差异有统计学意义(t=70.090,P=0.000)。表明 miR-27a 过表达的 HUVECs 外泌体将 miR-27a 成功递送至 MC3T3-E1 细胞中。见图 4a。
图 4.
qRT-PCR detection of related gene expression
qRT-PCR 检测相关基因表达
a. miR-27a;b. COL1A1;c. OCN;d. RUNX2
a. miR-27a; b. COL1A1; c. OCN; d. RUNX2
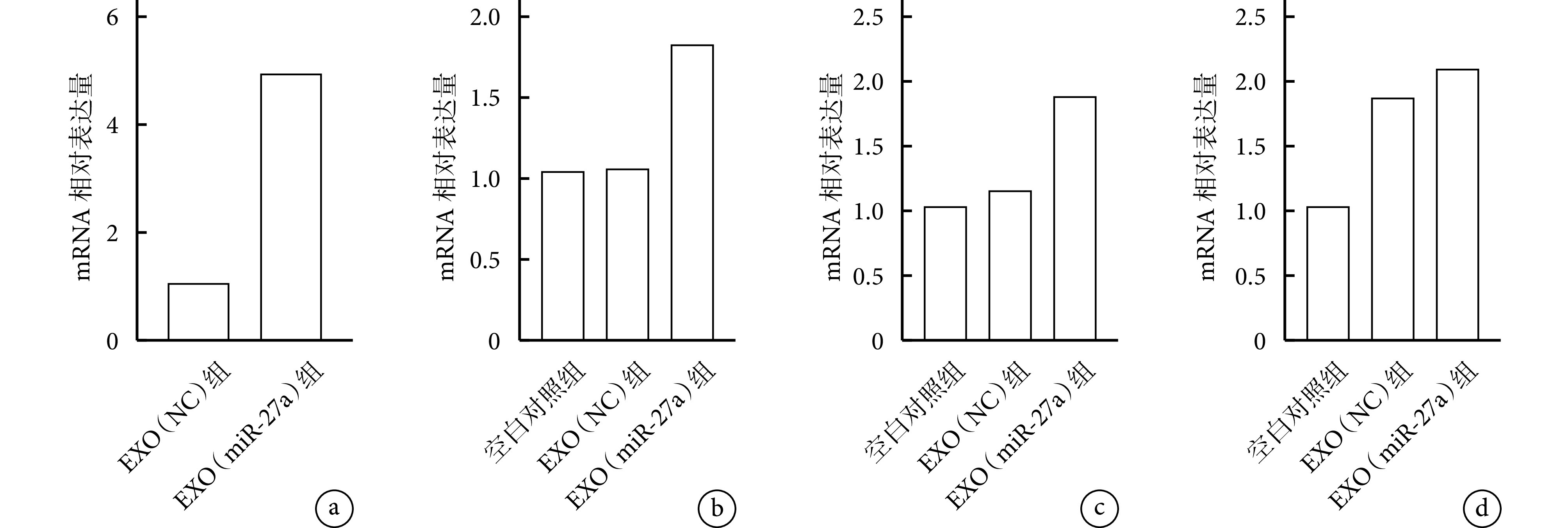
成骨相关基因表达检测示,EXO(miR-27a)组 OCN 和 COL1A1 mRNA 相对表达量显著高于 EXO(NC)组和空白对照组,差异有统计学意义(P<0.05),EXO(NC)组和空白对照组间差异无统计学意义(P>0.05);EXO(miR-27a)组和 EXO(NC)组 RUNX2 mRNA 相对表达量显著高于空白对照组,差异有统计学意义(P<0.05),EXO(miR-27a)组和 EXO(NC)组间差异无统计学意义(P>0.05)。见图 4b~d。
2.4. miR-27a 是否通过靶向 DKK2 促进成骨分化
2.4.1. 双荧光素酶报告基因实验及靶细胞内验证实验
双荧光素酶报告基因实验结果显示,WT+miR-27a NC 组、WT+miR-27a mimics 组、MUT+miR-27a NC 组、MUT+miR-27a mimics 组的相对荧光强度分别为 98.111±2.239、57.715±2.594、100.288±2.621、106.527±3.029。提示 miR-27a mimics 可以抑制包含野生型 DKK2 3’UTR 的荧光素酶活性,但对包含突变型 DKK2 3’UTR 的荧光素酶活性无影响,表明 miR-27a 可以直接靶向 DDK2 基因的 3’UTR 区域发挥抑制作用。见图 5。
图 5.
Sequence design of DLRTM assay
双荧光素酶基因报告实验序列设计
蓝色示野生型序列,红色示突变型对应序列
Blue for wild-type sequences, red for mutant sequences
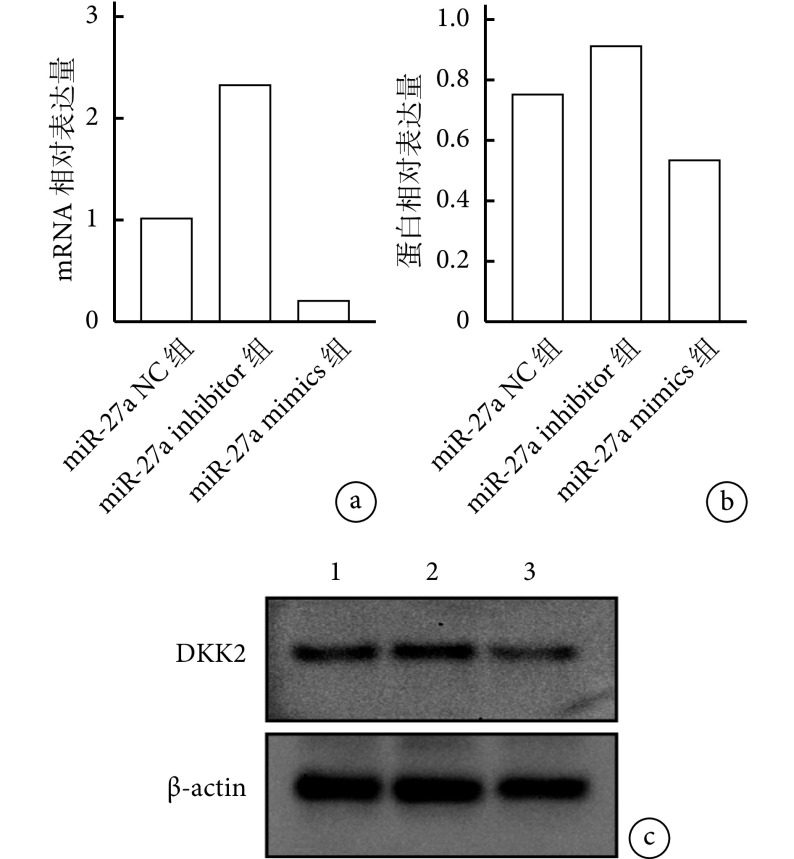
靶细胞内验证实验显示,与 miR-27a NC 组比较,miR-27a inhibitor 组 DKK2 的 mRNA 和蛋白相对表达量显著升高,miR-27a mimics 组显著降低,差异均有统计学意义(P<0.05)。见图 6。表明 miR-27a 在 MC3T3-E1 细胞内可以靶向 DDK2 并降低其表达水平。
图 6.
Intracellular validation experiments on target cells
靶细胞内验证实验
a. 各组 DKK2 mRNA 相对表达量;b. 各组 DKK2 蛋白相对表达量;c. Western blot 电泳图1:miR-27a NC 组 2:miR-27a inhibitor 组 3:miR-27a mimics 组
a. Relative expression of DKK2 mRNA in each group; b. Relative expression level of DKK2 protein in each group; c. Western blot electropherogram 1: miR-27a NC group 2: miR-27a inhibitor group 3: miR-27a mimics group
2.4.2. miR-27a 靶向 DKK2 对 MC3T3-E1 细胞矿化水平的影响
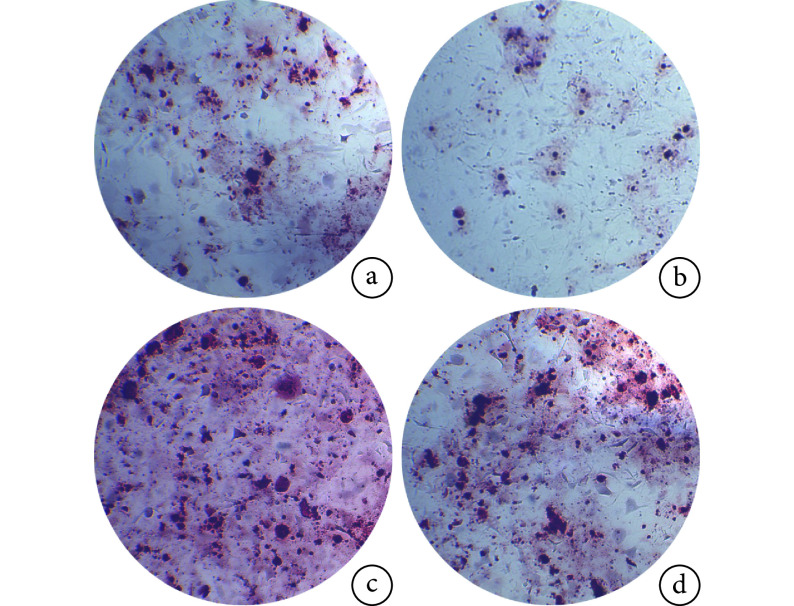
茜素红染色示,DKK2 过表达组矿化结节数显著降低,miR-27a mimics 组矿化结节数显著增加,而两者对矿化水平的影响可在一定程度上相互抵消。见图 7。阴性对照组、DKK2 过表达组、miR-27a 过表达组、挽救组 A 值分别为 2.892±0.157、0.693±0.08、8.679±0.409、2.925±0.081,除阴性对照组和挽救组比较差异无统计学意义(P>0.05)外,其余各组间比较差异均有统计学意义(P<0.05)。
图 7.
Alizarin red staining to observe the miR-27a targeting DKK2 affected the mineralization level of MC3T3-E1 cells (×40)a. Negative control group; b. DKK2 overexpression group; c. MiR-27a overexpression group; d. Rescue group
茜素红染色观察 miR-27a 靶向 DKK2 影响 MC3T3-E1 细胞的矿化水平(×40)
a. 阴性对照组;b. DKK2 过表达组; c. miR-27a 过表达组;d. 挽救组
2.5. 过表达 miR-27a 的 HUVECs 外泌体对大鼠 GC-ONFH 的影响
2.5.1. Micro-CT 观测
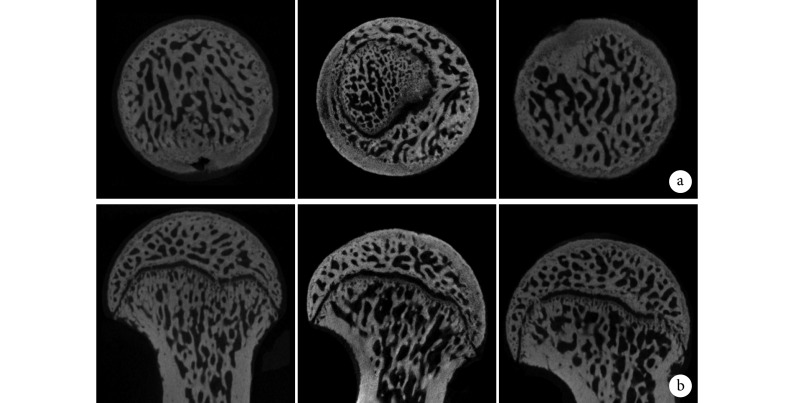
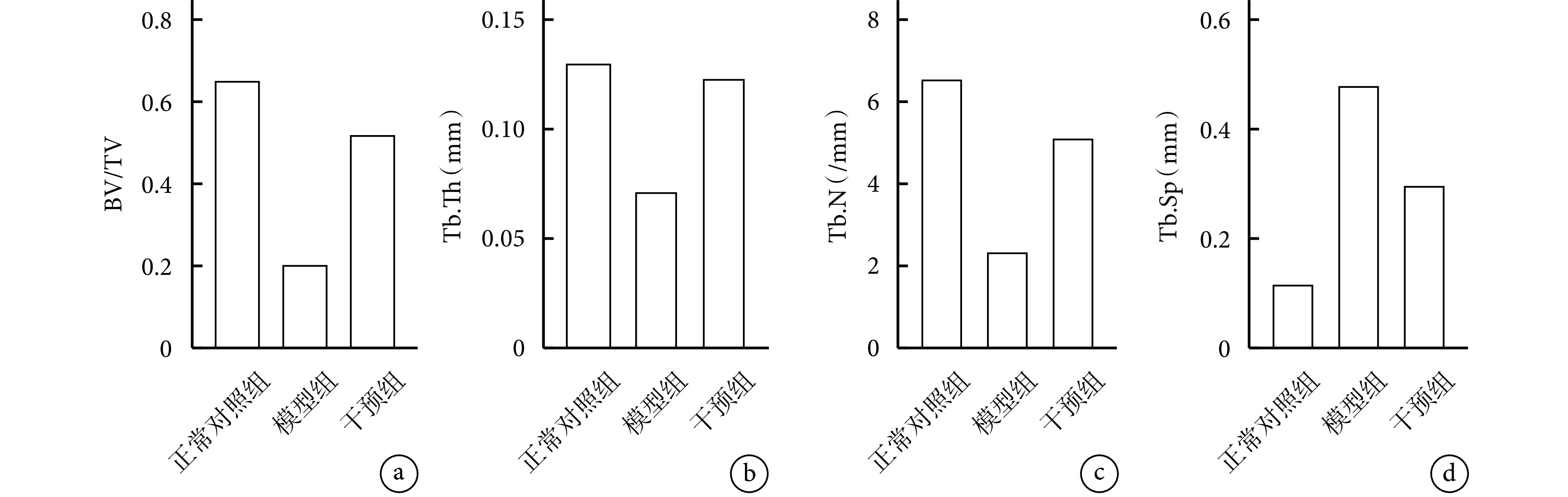
Micro-CT 观察示,与正常对照组比较,模型组在股骨头软骨下区域观察到更多骨质损失和囊性变,骨小梁变得稀疏且结构松散紊乱;而干预组上述情况均得到改善,但仍未达到正常对照组水平。见图 8。定量分析示,模型组 BV/TV、Tb.Th、Tb.N 显著低于正常对照组和干预组,Tb.Sp 显著高于正常对照组和干预组,差异均有统计学意义(P<0.05)。见图 9。
图 8.
Micro-CT observation of femoral head microstructure in each group of rats
Micro-CT 观察各组大鼠股骨头微结构
从左至右依次为正常对照组、模型组、干预组 a. 横截面;b. 矢状面
From left to right for normal control group, model group, intervention group, respectively a. Cross-section; b. Sagittal plane
图 9.
Micro-CT quantitative detection of the bone tissue parameters of femoral head in each group of rats
Micro-CT 定量检测各组大鼠股骨头骨组织参数
a. BV/TV;b. Tb.Th;c. Tb.N;d. Tb.Sp
a. BV/TV; b. Tb.Th; c. Tb.N; d. Tb.Sp
2.5.2. HE 染色观察
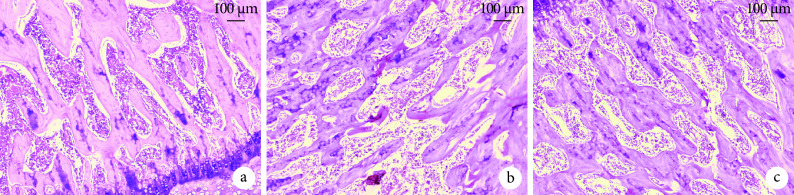
与正常对照组比较,模型组观察到明显骨坏死现象,表现为骨小梁结构紊乱,骨小梁周围存在许多成纤维细胞,空骨陷窝增多,骨髓腔内充满大量脂肪空泡,髓质造血细胞退化或坏死明显。而干预组骨坏死程度较轻微,骨小梁虽然有僵化稀疏表现,但结构较完整,空骨陷窝形成较少,髓腔内脂肪空泡较少,造血系细胞轻度退化或坏死,但仍未达到正常对照组水平。见图 10。
图 10.
HE staining to observe the histomorphology of the femoral head in each group of rats (×100)
HE 染色观察各组大鼠股骨头组织形态(×100)
a. 正常对照组;b. 模型组;c. 干预组
a. Normal control group; b. Model group; c. Intervention group
3. 讨论
生物材料结合细胞疗法是再生医学的热门研究方向[30-31],但部分生物材料的潜在毒性和慢性炎症问题仍然存在[32],而细胞疗法与肿瘤和栓塞形成密切相关[33],目前解决这些问题仍面临巨大挑战。因此适当做减法可能是另一个可行思路。外泌体作为天然纳米级生物材料兼具优良生物活性,成为重点研究对象[34],在再生医学中的治疗作用已被广泛验证。如与诱导多能干细胞相比,其衍生的外泌体能更安全、有效地用于心肌梗死修复,人脐带 MSCs 来源外泌体可通过激活自噬防止顺铂诱导的肾毒性,MSCs 来源外泌体可通过抑制肺血管重塑改善肺动脉高压,以及巨噬细胞来源外泌体能促进神经再生等[35-38]。在骨再生领域外泌体同样有重要作用,例如在转染 miR-26a 的人 CD34+ 造血干细胞中提取的外泌体可促进 MSCs 成骨分化,携带 miR-122-5p 的 BMSCs 来源外泌体能促进 ONFH 中成骨细胞增殖,人前列腺癌细胞 PC-3 来源外泌体通过下调 miR-214 和阻断 NF-κB 信号通路抑制破骨细胞成熟,HIF-1α 可增强 MSCs 衍生外泌体对 Jagged1 介导的骨组织血管再生等[39-42]。这些研究显示,运用改性外泌体促进骨再生可能是保护 GC-ONFH 的可行策略[43]。因此本研究选择将促进骨再生的 miR-27a 加载于内皮细胞来源外泌体,以应用于早期 GC-ONFH 的保护研究。
将治疗性 microRNA 加载于外泌体主要包括源细胞的基因修饰和外泌体的直接加载(如混合、电穿孔或超声干预)[44],由于后者效率不稳定,因此源细胞的基因修饰是主流选择[45]。本研究通过 miR-27a mimics 修饰 HUVECs,最终获得 miR-27a 过表达的外泌体;而 qRT-PCR 结果显示,外泌体将 miR-27a 成功递送至 MC3T3-E1 细胞中,表明将治疗性 miR-27a 加载到外泌体并递送至靶细胞的策略可行。据报道,在不同目的细胞中 miR-27a 可通过不同靶点来促进成骨分化,如肌细胞增强因子 2C(Mef2c)、Sp7 转录因子、分泌型卷曲相关蛋白 1(SFRP1)、WNT 信号通路 APC 调节剂和 PRDM16 等[26]。此外,miR-27a 通过靶向过氧化物酶体增殖物激活受体 γ(PPARγ)和 BMP 拮抗剂(GREM1)调节 MSCs 的成骨和成脂分化平衡,从而在类固醇诱导的 ONFH 大鼠模型中起治疗作用[25]。本实验表明,miR-27a 可以在体外促进成骨细胞前体细胞 MC3T3-E1 的成骨分化,过表达的 miR-27a 显著增强 ALP 活性和钙沉积以及成骨相关基因(RUNX2、COL1A1 和 OCN)的表达,这与其他报道一致。此外,本研究双荧光素酶报道显示 DKK2 为 miR-27a 的靶标;挽救实验显示,过表达 DKK2 可有效抵消(挽救)miR- 27a mimics 的促成骨作用,即 miR-27a 通过直接靶向 DKK2 来促进成骨。已知 Wnt 信号通路是骨骼形成的重要调节途径,而 DKK2 是 Wnt 通路的天然拮抗剂[26, 46]。因此本研究结果表明,富含 miR-27a 的外泌体可以将 miR-27a 递送至 MC3T3-E1 细胞,从而解除 DKK2 对 Wnt 通路的抑制作用来促进成骨。
很多研究表明血管生成促进成骨进程,而该过程中血管内皮细胞与成骨细胞的通讯至关重要[47-48],外泌体又是细胞间通讯的重要方式,因此可以推测血管内皮细胞来源外泌体在成骨过程中扮演了重要角色。故本实验选择 HUVECs 来源外泌体作为促成骨 miRNA 的载体,希望能达到更好的促成骨效果。体外实验的 ALP 染色和茜素红染色显示,尽管单纯 HUVECs 来源外泌体没有 miR-27a 过表达的 HUVECs 外泌体效果显著,但其在一定程度上也能促进 MC3T3-E1 细胞成骨,基本达到实验预期。此外,有研究表明血管内皮细胞来源外泌体是高度生物相容性的骨靶向纳米颗粒[21, 49],本研究的动物实验结果也与之相符。通过尾静脉注射外泌体的方式进行干预,HE 染色和 Micro-CT 检测显示 miR-27a 过表达的 HUVECs 来源外泌体缓解了大鼠 GC-ONFH 坏死程度,表现出一定保护作用。说明 miR-27a 过表达的 HUVECs 来源外泌体成功到达股骨头损伤部位,展示出其可靶向骨损伤部位的良好应用前景。
综上述,将 miR-27a 加载于血管内皮细胞来源外泌体显示出良好的促成骨活性,并能一定程度缓解 GC-ONFH 进展,为外泌体的骨修复再生研究提供了一定参考。但仍有一些问题,如明确治疗机制、进一步提高骨靶向性能的方案、miRNA 的选择以及加载方式优化等,有待进一步研究明确。
作者贡献:张根生、刘瑞宇、党晓谦负责实验设计、实施及文章撰写;刘继超、焦海斌负责数据收集整理、统计分析;焦海斌、党晓谦负责对文章的知识性内容作批评性审阅。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。课题经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:研究方案经西安交通大学实验动物中心伦理委员会批准(XJTULAC2019-1284)。实验动物使用许可证号:SYXK(陕)-2020-005。
Funding Statement
陕西省重点研发项目(2019SF-168)
References
- 1.Microsurgery Department of the Orthopedics Branch of the Chinese Medical Doctor Association Chinese guideline for the diagnosis and treatment of osteonecrosis of the femoral head in adults. Orthop Surg. 2017;9(1):3–12. doi: 10.1111/os.12302. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Zhao D, Zhang F, Wang B, et al Guidelines for clinical diagnosis and treatment of osteonecrosis of the femoral head in adults (2019 version) J Orthop Translat. 2020;21:100–110. doi: 10.1016/j.jot.2019.12.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Kubo T, Ueshima K, Saito M, et al Clinical and basic research on steroid-induced osteonecrosis of the femoral head in Japan. J Orthop Sci. 2016;21(4):407–413. doi: 10.1016/j.jos.2016.03.008. [DOI] [PubMed] [Google Scholar]
- 4.Zhang QY, Li ZR, Gao FQ, et al Pericollapse stage of osteonecrosis of the femoral head: A Last chance for joint preservation. Chin Med J (Engl) 2018;131(21):2589–2598. doi: 10.4103/0366-6999.244111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Liu LH, Zhang QY, Sun W, et al Corticosteroid-induced osteonecrosis of the femoral head: Detection, diagnosis, and treatment in earlier stages. Chin Med J (Engl) 2017;130(21):2601–2607. doi: 10.4103/0366-6999.217094. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Hardy RS, Zhou H, Seibel MJ, et al Glucocorticoids and bone: Consequences of endogenous and exogenous excess and replacement therapy. Endocr Rev. 2018;39(5):519–548. doi: 10.1210/er.2018-00097. [DOI] [PubMed] [Google Scholar]
- 7.Weinstein RS, Hogan EA, Borrelli MJ, et al The pathophysiological sequence of glucocorticoid-induced osteonecrosis of the femoral head in male mice. Endocrinology. 2017;158(11):3817–3831. doi: 10.1210/en.2017-00662. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Wang A, Ren M, Wang J The pathogenesis of steroid-induced osteonecrosis of the femoral head: A systematic review of the literature. Gene. 2018;671:103–109. doi: 10.1016/j.gene.2018.05.091. [DOI] [PubMed] [Google Scholar]
- 9.Fang SH, Chen L, Chen HH, et al MiR-15b ameliorates SONFH by targeting Smad7 and inhibiting osteogenic differentiation of BMSCs. Eur Rev Med Pharmacol Sci. 2019;23(22):9761–9771. doi: 10.26355/eurrev_201911_19539. [DOI] [PubMed] [Google Scholar]
- 10.刘立华, 孙伟, 王云亭, 等 头颈部开窗减压治疗 L1 型激素性股骨头坏死: 单中心前瞻性临床研究. 中国组织工程研究. 2021;25(6):906–911. doi: 10.3969/j.issn.2095-4344.2396. [DOI] [Google Scholar]
- 11.中国医师协会骨科医师分会骨循环与骨坏死专业委员会, 中华医学会骨科分会骨显微修复学组, 国际骨循环学会中国区 中国成人股骨头坏死临床诊疗指南 (2020) 中华骨科杂志. 2020;40(20):1365–1376. doi: 10.3760/cma.j.cn121113-20200306-00133. [DOI] [Google Scholar]
- 12.Barile L, Vassalli G Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 2017;174:63–78. doi: 10.1016/j.pharmthera.2017.02.020. [DOI] [PubMed] [Google Scholar]
- 13.Liao W, Du Y, Zhang C, et al Exosomes: The next generation of endogenous nanomaterials for advanced drug delivery and therapy. Acta Biomater. 2019;86:1–14. doi: 10.1016/j.actbio.2018.12.045. [DOI] [PubMed] [Google Scholar]
- 14.Qin Y, Sun R, Wu C, et al Exosome: A novel approach to stimulate bone regeneration through regulation of osteogenesis and angiogenesis. Int J Mol Sci. 2016;17(5):712. doi: 10.3390/ijms17050712. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Masaoutis C, Theocharis S The role of exosomes in bone remodeling: implications for bone physiology and disease. Dis Markers. 2019;2019:9417914. doi: 10.1155/2019/9417914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Behera J, Tyagi N Exosomes: mediators of bone diseases, protection, and therapeutics potential. Oncoscience. 2018;5(5-6):181–195. doi: 10.18632/oncoscience.421. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Qi X, Zhang J, Yuan H, et al Exosomes secreted by human-induced pluripotent stem cell-derived mesenchymal stem cells repair critical-sized bone defects through enhanced angiogenesis and osteogenesis in osteoporotic rats. Int J Biol Sci. 2016;12(7):836–849. doi: 10.7150/ijbs.14809. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Zhao P, Xiao L, Peng J, et al Exosomes derived from bone marrow mesenchymal stem cells improve osteoporosis through promoting osteoblast proliferation via MAPK pathway. Eur Rev Med Pharmacol Sci. 2018;22(12):3962–3970. doi: 10.26355/eurrev_201806_15280. [DOI] [PubMed] [Google Scholar]
- 19.Zhang J, Liu X, Li H, et al Exosomes/tricalcium phosphate combination scaffolds can enhance bone regeneration by activating the PI3K/Akt signaling pathway. Stem Cell Res Ther. 2016;7(1):136. doi: 10.1186/s13287-016-0391-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Lu J, Wang QY, Sheng JG Exosomes in the repair of bone defects: next-generation therapeutic tools for the treatment of nonunion. Biomed Res Int. 2019;2019:1983131. doi: 10.1155/2019/1983131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Song H, Li X, Zhao Z, et al Reversal of osteoporotic activity by endothelial cell-secreted bone targeting and biocompatible exosomes. Nano Lett. 2019;19(5):3040–3048. doi: 10.1021/acs.nanolett.9b00287. [DOI] [PubMed] [Google Scholar]
- 22.Zheng H, Liu J, Tycksen E, et al MicroRNA-181a/b-1 over-expression enhances osteogenesis by modulating PTEN/PI3K/AKT signaling and mitochondrial metabolism. Bone. 2019;123:92–102. doi: 10.1016/j.bone.2019.03.020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Lin Z, He H, Wang M, et al MicroRNA-130a controls bone marrow mesenchymal stem cell differentiation towards the osteoblastic and adipogenic fate. Cell Prolif. 2019;52(6):e12688. doi: 10.1111/cpr.12688. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Zhang L, Tang Y, Zhu X, et al Overexpression of MiR-335-5p promotes bone formation and regeneration in mice. J Bone Miner Res. 2017;32(12):2466–2475. doi: 10.1002/jbmr.3230. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Gu C, Xu Y, Zhang S, et al miR-27a attenuates adipogenesis and promotes osteogenesis in steroid-induced rat BMSCs by targeting PPARγ and GREM1. Sci Rep. 2016;6:38491. doi: 10.1038/srep38491. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Wu X, Gu Q, Chen X, et al MiR-27a targets DKK2 and SFRP1 to promote reosseointegration in the regenerative treatment of peri-implantitis. J Bone Miner Res. 2019;34(1):123–134. doi: 10.1002/jbmr.3575. [DOI] [PubMed] [Google Scholar]
- 27.Sriram M, Sainitya R, Kalyanaraman V, et al Biomaterials mediated microRNA delivery for bone tissue engineering. Int J Biol Macromol. 2015;74:404–412. doi: 10.1016/j.ijbiomac.2014.12.034. [DOI] [PubMed] [Google Scholar]
- 28.Arriaga MA, Ding MH, Gutierrez AS, et al The application of microRNAs in biomaterial scaffold-based therapies for bone tissue engineering. Biotechnology Journal. 2019;14(10):e1900084. doi: 10.1002/biot.201900084. [DOI] [PubMed] [Google Scholar]
- 29.黎牧帆, 张二洋, 吕雷锋, 等 维生素 E 对大鼠早期激素性股骨头缺血性坏死的作用及机制研究. 中国修复重建外科杂志. 2018;32(11):1421–1428. [Google Scholar]
- 30.Velmurugan BK, Bharathi Priya L, Poornima P, et al Biomaterial aided differentiation and maturation of induced pluripotent stem cells. J Cell Physiol. 2019;234(6):8443–8454. doi: 10.1002/jcp.27769. [DOI] [PubMed] [Google Scholar]
- 31.Bakhshandeh B, Zarrintaj P, Oftadeh MO, et al Tissue engineering; strategies, tissues, and biomaterials. Biotechnol Genet Eng Rev. 2017;33(2):144–172. doi: 10.1080/02648725.2018.1430464. [DOI] [PubMed] [Google Scholar]
- 32.Jewell CM, Collier JH Biomaterial interactions with the immune system. Biomater Sci. 2019;7(3):713–714. doi: 10.1039/C8BM90063A. [DOI] [PubMed] [Google Scholar]
- 33.Sato Y, Bando H, Di Piazza M, et al Tumorigenicity assessment of cell therapy products: The need for global consensus and points to consider. Cytotherapy. 2019;21(11):1095–1111. doi: 10.1016/j.jcyt.2019.10.001. [DOI] [PubMed] [Google Scholar]
- 34.Colao IL, Corteling R, Bracewell D, et al Manufacturing exosomes: A promising therapeutic platform. Trends Mol Med. 2018;24(3):242–256. doi: 10.1016/j.molmed.2018.01.006. [DOI] [PubMed] [Google Scholar]
- 35.Adamiak M, Cheng G, Bobis-Wozowicz S, et al Induced pluripotent stem cell (iPSC)-derived extracellular vesicles are safer and more effective for cardiac repair than iPSCs. Circ Res. 2018;122(2):296–309. doi: 10.1161/CIRCRESAHA.117.311769. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Wang B, Jia H, Zhang B, et al Pre-incubation with hucMSC-exosomes prevents cisplatin-induced nephrotoxicity by activating autophagy. Stem Cell Res Ther. 2017;8(1):75. doi: 10.1186/s13287-016-0463-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Zhang S, Liu X, Ge L L, et al Mesenchymal stromal cell-derived exosomes improve pulmonary hypertension through inhibition of pulmonary vascular remodeling. Respir Res. 2020;21(1):71. doi: 10.1186/s12931-020-1331-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Qing L, Chen H, Tang J, et al Exosomes and their microRNA cargo: New players in peripheral nerve regeneration. Neurorehabil Neural Repair. 2018;32(9):765–776. doi: 10.1177/1545968318798955. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Zuo R, Kong L, Wang M, et al Exosomes derived from human CD34 stem cells transfected with miR-26a prevent glucocorticoid-induced osteonecrosis of the femoral head by promoting angiogenesis and osteogenesis. Stem Cell Res Ther. 2019;10(1):321. doi: 10.1186/s13287-019-1426-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Qin Y, Wang L, Gao Z, et al Bone marrow stromal/stem cell-derived extracellular vesicles regulate osteoblast activity and differentiation in vitro and promote bone regeneration in vivo . Sci Rep. 2016;6:21961. doi: 10.1038/srep21961. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Duan Y, Tan Z, Yang M, et al PC-3-derived exosomes inhibit osteoclast differentiation by downregulating miR-214 and blocking NF-B signaling pathway. Biomed Res Int. 2019;2019:8650846. doi: 10.1155/2019/8650846.b. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Gonzalez-King H, García NA, Ontoria-Oviedo I, et al Hypoxia inducible factor-1α potentiates jagged 1-mediated angiogenesis by mesenchymal stem cell-derived exosomes. Stem Cells. 2017;35(7):1747–1759. doi: 10.1002/stem.2618. [DOI] [PubMed] [Google Scholar]
- 43.Liao W, Ning Y, Xu HJ, et al BMSC-derived exosomes carrying microRNA-122-5p promote proliferation of osteoblasts in osteonecrosis of the femoral head. Clin Sci (Lond) 2019;133(18):1955–1975. doi: 10.1042/CS20181064. [DOI] [PubMed] [Google Scholar]
- 44.Familtseva A, Jeremic N, Tyagi SC Exosomes: cell-created drug delivery systems. Mol Cell Biochem. 2019;459(1-2):1–6. doi: 10.1007/s11010-019-03545-4. [DOI] [PubMed] [Google Scholar]
- 45.Burnouf T, Agrahari V, Agrahari V Extracellular vesicles as nanomedicine: Hopes and hurdles in clinical translation. Int J Nanomedicine. 2019;14:8847–8859. doi: 10.2147/IJN.S225453. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Zhou B, Peng K, Wang G, et al miR-483-3p promotes the osteogenesis of human osteoblasts by targeting Dikkopf 2 (DKK2) and the Wnt signaling pathway. Int J Mol Med. 2020;46(4):1571–1581. doi: 10.3892/ijmm.2020.4694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Watson EC, Adams RH Biology of bone: The vasculature of the skeletal system. Cold Spring Harb Perspect Med. 2018;8(7):a031559. doi: 10.1101/cshperspect.a031559. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Sivaraj KK, Adams RH Blood vessel formation and function in bone. Development. 2016;143(15):2706–2715. doi: 10.1242/dev.136861. [DOI] [PubMed] [Google Scholar]
- 49.Pegtel DM, Gould SJ Exosomes. Annu Rev Biochem. 2019;88:487–514. doi: 10.1146/annurev-biochem-013118-111902. [DOI] [PubMed] [Google Scholar]