Abstract
目的
探讨脂肪干细胞来源外泌体(adipose-derived stem cell released exosomes,ADSC-Exos)对糖尿病小鼠创面愈合的影响。
方法
取患者自愿捐赠脂肪组织,采用酶消化法分离培养 ADSCs,并于第 3 代细胞上清液提取 Exos(ADSC-Exos);透射电镜观察 ADSC-Exos 形态,Western blot 检测膜表面标志性蛋白 Alix、CD63,纳米颗粒跟踪分析仪检测粒径分布。取患者自愿捐赠皮肤组织,采用酶消化法分离培养成纤维细胞。将 PKH26 标记的 ADSC-Exos 与第 5 代成纤维细胞培养,共聚焦荧光显微镜观察其能否进入细胞,采用细胞计数试剂盒 8(cell counting kit 8, CCK-8)及划痕法观察 ADSC-Exos 对成纤维细胞增殖及迁移的影响。取 24 只 8 周龄 Balb/c 雄性小鼠制备糖尿病模型后,背部制备直径 8 mm 全层皮肤缺损创面,实验组(n=12)及对照组(n=12)创面真皮层分别注射 0.2 mL ADSC-Exos 及 PBS。第 1、4、7、11、16、21 天大体观察创面愈合情况,计算创面愈合率;第 7、14、21 天取材,行组织学(HE 及 Masson)及 CD31 免疫组织化学染色,观察创面结构、胶原纤维及新生血管情况。
结果
ADSC-Exos 为边缘清晰、大小分布均匀的膜性囊泡;粒径为 40~200 nm,平均 102.1 nm;膜表面标志性蛋白 Alix、CD63 均呈阳性。ADSC-Exos 与成纤维细胞复合培养观察示,ADSC-Exos 可进入成纤维细胞胞内,并能促进成纤维细胞增殖及迁移。动物实验显示,实验组小鼠背部创面愈合明显快于对照组,各时间点创面愈合率差异均有统计学意义(P<0.05)。与对照组比较,实验组创面结构愈合更好,愈合前期新生微血管更多,愈合后期胶原纤维沉积更多;其中,第 7、14、21 天创面缺损长度,第 7、14 天微血管数量,第 14、21 天胶原纤维沉积百分比,组间差异均有统计学意义(P<0.05)。
结论
ADSC-Exos 通过促进创面血管新生以及成纤维细胞增殖、迁移和胶原合成来促进糖尿病小鼠创面愈合。
Keywords: 脂肪干细胞, 外泌体, 成纤维细胞, 血管新生, 创面愈合, 小鼠
Abstract
Objective
To investigate the effects of adipose-derived stem cell released exosomes (ADSC-Exos) on wound healing in diabetic mice.
Methods
The ADSCs were isolated from the adipose tissue donated by the patients and cultured by enzymatic digestion. The supernatant of the 3rd generation ADSCs was used to extract Exos (ADSC-Exos). The morphology of ADSC-Exos was observed by transmission electron microscopy. The membrane-labeled proteins (Alix and CD63) were detected by Western blot, and the particle size distribution was detected by nanoparticle tracking analyzer. The fibroblasts were isolated from the skin tissue donated by the patients and cultured by enzymatic digestion. The 5th generation fibroblasts were cultured with PKH26-labeled ADSC-Exos, and observed by confocal fluorescence microscopy. The effects of ADSC-Exos on proliferation and migration of fibroblasts were observed with cell counting kit 8 (CCK-8) and scratch method. Twenty-four 8-week-old Balb/c male mice were used to prepare a diabetic model. A full-thickness skin defect of 8 mm in diameter was prepared on the back. And 0.2 mL of ADSC-Exos and PBS were injected into the dermis of the experimental group (n=12) and the control group (n=12), respectively. On the 1st, 4th, 7th, 11th, 16th, and 21st days, the wound healing was observed and the wound healing rate was calculated. On the 7th, 14th, and 21st days, the histology (HE and Masson) and CD31 immunohistochemical staining were performed to observe the wound structure, collagen fibers, and neovascularization.
Results
ADSC-Exos were the membranous vesicles with clear edges and uniform size; the particle size was 40-200 nm with an average of 102.1 nm; the membrane-labeled proteins (Alix and CD63) were positive. The composite culture observation showed that ADSC-Exos could enter the fibroblasts and promote the proliferation and migration of fibroblasts. Animal experiments showed that the wound healing of the experimental group was significantly faster than that of the control group, and the wound healing rate was significantly different at each time point (P<0.05). Compared with the control group, the wound healing of the experimental group was better. There were more microvessels in the early healing stage, and more deposited collagen fibers in the late healing stage. There were significant differences in the length of wound on the 7th, 14th, and 21st days, the number of microvessels on the 7th and 14th days, and the rate of deposited collagen fibers on the 14th and 21st days between the two groups (P<0.05).
Conclusion
ADSC-Exos can promote the wound healing in diabetic mice by promoting angiogenesis and proliferation and migration of fibroblasts and collagen synthesis.
Keywords: Adipose-derived stem cells, exosomes, fibroblasts, angiogenesis, wound healing, mouse
据世界卫生组织(WHO)统计,全球有近 4.22 亿名糖尿病患者,预计 2035 年将增加到 5.92 亿[1]。糖尿病创面愈合迟缓是糖尿病并发症之一[2],虽然治疗方法较多,但是效果不理想,探讨新的促进糖尿病创面愈合方法成为研究热点[3]。
外泌体(exosomes, Exos)是一种大小为 30~150 nm 的膜性囊泡[4],能参与细胞间通讯,并在组织修复和再生、疾病诊断方面发挥重要作用[5]。研究表明,人脐带间充质干细胞来源的 Exos 可以促进相关细胞增殖及迁移、增强血管生成、再上皮化和调节免疫应答,进而促进皮肤再生以及糖尿病创面愈合[6-8]。脂肪干细胞(adipose-derived stem cells,ADSCs)也是一种 MSCs,因具有获取方便、对供区损伤小、储存量大等优势,常用于组织再生和修复[9],ADSCs 移植后可促进血管新生[10]。最近,有研究证实了 ADSC-Exos 在创面愈合中的作用[11]。本课题组前期研究也发现 ADSC-Exos 能促进人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs) 增殖、迁移及管样分化,植入裸鼠体内后还能促血管新生[12]。结合上述研究结果,我们分析 ADSC-Exos 可能促进糖尿病小鼠创面愈合,为此进行了进一步研究,为临床应用 Exos 治疗慢性糖尿病创面奠定实验基础。报告如下。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
健康 8 周龄 Balb/c 雄性小鼠 24 只,体质量(30±5)g,由南昌大学实验动物中心提供。实验用游离脂肪组织由南昌大学第二附属医院整形美容科行吸脂术的女性患者自愿捐赠,患者年龄 25~36 岁。实验用皮肤组织由南昌大学第二附属医院整形美容科行上睑下垂矫正术的女性患者自愿捐赠,患者年龄 24~30 岁。
DMEM 培养基、FBS、0.25% 胰蛋白酶-0.02%EDTA、分散酶 Ⅱ(GIBCO 公司,美国);细胞计数试剂盒 8(cell counting kit 8,CCK-8;同仁公司,日本)。超高速离心机(Beckman 公司,美国);倒置相差显微镜(Olympus 公司,日本);流式细胞仪(BD 公司,美国);透射电镜(ZEISS 公司,德国);纳米颗粒跟踪分析仪(Malvern 公司,英国);CO2 培养箱、多功能酶标仪(Thermo 公司,美国);共聚焦荧光显微镜(Leica 公司,德国)。
1.2. ADSCs 分离培养及鉴定
取 12 mL 脂肪组织,PBS 液反复冲洗,用 12 mL 0.2%Ⅰ 型胶原酶消化至糊状;4℃、以 300×g 离心 5 min,弃上清;用培养基将沉淀重悬后接种至培养瓶内,置于 37℃、5%CO2 孵箱中培养。2 d 后首次换液,以后隔天换液 1 次,当细胞融合至 80% 时传代。
取第 3 代细胞于倒置相差显微镜下观察,细胞呈均一长梭形,细胞生长密集后呈漩涡状排列。流式细胞术鉴定细胞表面标志性抗原,CD49d、CD90、CD105 呈阳性表达,CD34、CD45、CD106 呈阴性表达。上述结果提示培养细胞为 ADSCs。
1.3. ADSC-Exos 分离培养及鉴定
取第 3 代 ADSCs,更换为去除 Exos 的完全培养基培养,48 h 后收集上清培养液,参照本课题组前期研究采用的密度梯度离心法分离 ADSC-Exos[12]。具体步骤:4℃、以 300×g 离心 10 min,取上清;3 000×g 离心 20 min,取上清;10 000×g 离心 30 min,取上清;10 000×g 离心 60 min,PBS 重悬收集沉淀;100 000×g 离心 60 min,PBS 重悬收集沉淀,用 0.22 μm 滤头过滤后获得 ADSC-Exos,置于–80℃ 保存备用。
采用透射电镜观察 ADSC-Exos 形态;Western blot 检测 ADSC-Exos 膜表面标志性蛋白 Alix、CD63;纳米颗粒跟踪分析仪检测 ADSC-Exos 粒径分布。
1.4. 成纤维细胞分离培养
将皮肤组织置于含 1% 抗生素的无菌 PBS 中洗涤,修剪脂肪和皮下组织后切成片,置于 4 mg/mL 分散酶 Ⅱ 过夜以分离表皮和真皮。将真皮切成小块,置于 0.1%Ⅰ型胶原酶、37℃ 消化 4 h,以分离成纤维细胞,经过滤、300×g 离心 10 min 及重悬后,置于 DMEM 培养基中,于 37℃、5%CO2 培养箱中培养,每 2~3 天更换培养基,传代培养。
1.5. ADSC-Exos 与成纤维细胞复合培养观察
1.5.1. ADSC-Exos 被成纤维细胞摄取分析
取 100 μL 浓度为 100 μg/mL 的 ADSC-Exos 重悬于 1 mL PBS,加入 4 μL PKH26 荧光染料溶液,37℃ 孵育 20 min,以 100 000×g 离心 70 min,弃上清液,将 ADSC-Exos 重悬于 10 mL PBS 中;4℃、以 100 000×g 离心 70 min,去除多余染料,弃上清;将 ADSC-Exos 重悬于 100 μL PBS 中备用。
取第 5 代成纤维细胞重悬于无血清培养基中,置于 37℃、5%CO2 培养箱中,待细胞贴壁后加入上述 PKH26 荧光标记的 ADSC-Exos,孵育 12 h 后采用 PBS 洗涤细胞 2 次,4% 多聚甲醛固定、DAPI 染色。共聚焦荧光显微镜下观察 PKH26 荧光标记的 ADSC-Exos(呈红色)是否进入成纤维细胞。
1.5.2. ADSC-Exos 对成纤维细胞增殖及迁移影响
① 采用 CCK-8 法检测 ADSC-Exos 对成纤维细胞增殖的影响。将第 3 代成纤维细胞以 2×103个/孔接种于 96 孔板,每孔加入无血清培养基 90 μL。将细胞均分成实验组和对照组,实验组添加 10 μL 浓度为 100 ng/mL 的 ADSC-Exos,对照组加入等量 PBS;培养 1、2、3、4、5 d 每组取 5 孔,每孔加入 10 μL CCK-8 溶液,继续孵育 4 h 后,采用多功能酶标仪检测 450 nm 波长下吸光度(A)值。实验重复 5 次。
② 采用划痕法检测 ADSC-Exos 对成纤维细胞迁移的影响。取第 3 代成纤维细胞以 7×104个/孔接种于 6 孔板中,每孔加入一定量培养基培养,待细胞汇集达 95% 以上时,弃去培养基,以无血清培养基饥饿培养 12~16 h 后,以丝裂霉素 C 处理 30 min,PBS 洗涤 2 次。采用 10 μL 移液器吸头直尺比照划痕,PBS 洗涤脱落细胞,10 倍镜下拍照;再将细胞分成对照组和实验组,实验组加入 0.5 mL 浓度为 100 ng/mL 的 ADSC-Exos,对照组加入等量 PBS,用无血清培养基培养 24 h 后拍照。采用 Photoshop CS6 软件测量细胞迁移距离,按照以下公式计算 24 h 迁移率:(0 h 划痕宽度-24 h 划痕宽度)/0 h 划痕宽度×100%。实验重复 3 次。
1.6. 动物实验观察
1.6.1. 糖尿病小鼠创面模型制备及分组
24 只小鼠于 12 h 光照/黑暗循环、室温 25℃ 条件下饲养。为了诱导糖尿病,在饮食调节 1 周后,给予高蔗糖和高脂肪饮食 10 周,然后在第 10、11 周时腹膜内注射链脲佐菌素(65 mg/kg)。每周监测小鼠空腹血糖和体质量水平,随机血糖>16.7 mmol/L 定义为糖尿病小鼠诱导成功。本实验 24 只小鼠均造模成功。
将 24 只糖尿病小鼠随机分成实验组及对照组,每组 12 只。两组小鼠腹腔注射 10% 水合氯醛(0.04 mL/10 g)麻醉后背部剃毛,采用定制的直径 8 mm 空心柱状旋转铁片制备圆形全层皮肤创面;然后用内径 12 mm 环状塑料环固定创面,5-0 不可吸收丝线间断缝合,使创面在塑料环内环正中央。创面制备后,实验组将 0.2 mL ADSC-Exos 溶液于 6 个方向均匀注射于创面边缘真皮层;对照组同法注射等量 PBS。凡士林纱布覆盖创面,医用纱布缠绕伤口处固定。见图 1。
图 1.
Schematic diagram of preparation of wound model of diabetic mice
糖尿病小鼠创面模型制备示意图
a. 背部创面;b. 塑料环固定创面;c. 注射层次示意图
a. The wound at the back; b. The wound was fixed with plastic ring; c. Injection level diagram

1.6.2. 观测指标
① 创面愈合观测:第 1、4、7、11、16、21 天大体观察创面愈合情况,创面照相后以 Image J 软件测量其面积,按以下公式计算创面愈合率:(初始创面面积−单位时间点创面面积)/初始创面面积×100%。
② 组织学及免疫组织化学染色观察:第 7、14、21 天每组各取 4 只小鼠,颈椎脱臼处死后切取创面组织,经 4% 多聚甲醛固定、乙醇梯度脱水、石蜡包埋,制备 4 μm 厚切片。取第 7、14、21 天切片行 HE 染色,第 14、21 天切片行 Masson 染色。于 HE 染色图片测量创面缺损长度;Masson 染色切片观察胶原纤维情况,400 倍镜下每张切片随机取 6 个视野,采用 Image Pro Plus 6.0 软件测定胶原纤维沉积百分比。
取第 7、14 天切片行 CD31 免疫组织化学染色,DAPI 复染,镜下观察两组创面血管新生情况,CD31 阳性染色呈棕色。400 倍镜下每张切片随机取 6 个视野,计数每个视野中微血管数,取均值。
1.7. 统计学方法
采用 Graphpad Prism 8 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
2.1. ADSC-Exos 鉴定
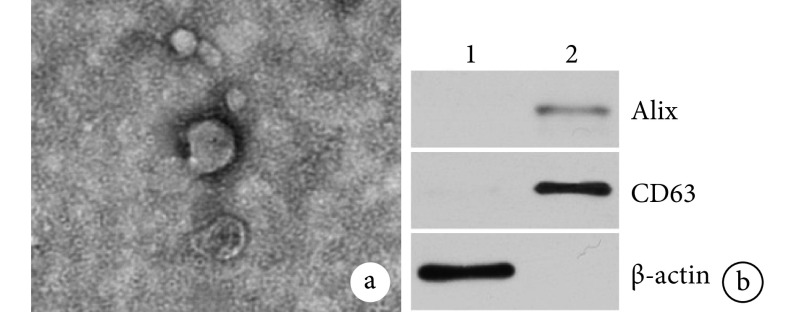
透射电镜下 ADSC-Exos 为边缘清晰、圆形、大小分布均匀的膜性囊泡(图 2a)。纳米颗粒跟踪分析仪检测 ADSC-Exos 粒径为 40~200 nm,平均 102.1 nm。Western blot 检测 ADSC-Exos 膜表面标志性蛋白 Alix、CD63 表达均呈阳性(图 2b)。
图 2.
Identification and observation of ADSC-Exos
ADSC-Exos 鉴定观察
a. 透射电镜观察(×50 k);b. Western blot 检测 ADSC-Exos 膜表面标志性蛋白 1:ADSCs2:ADSC-Exos
a. Transmission electron microscopy observation (×50 k); b. The membrane-labeled proteins of ADSC-Exos were detected by Western blot 1: ADSCs 2: ADSC-Exos
2.2. ADSC-Exos 与成纤维细胞复合培养观察
2.2.1. ADSC-Exos 被成纤维细胞摄取分析
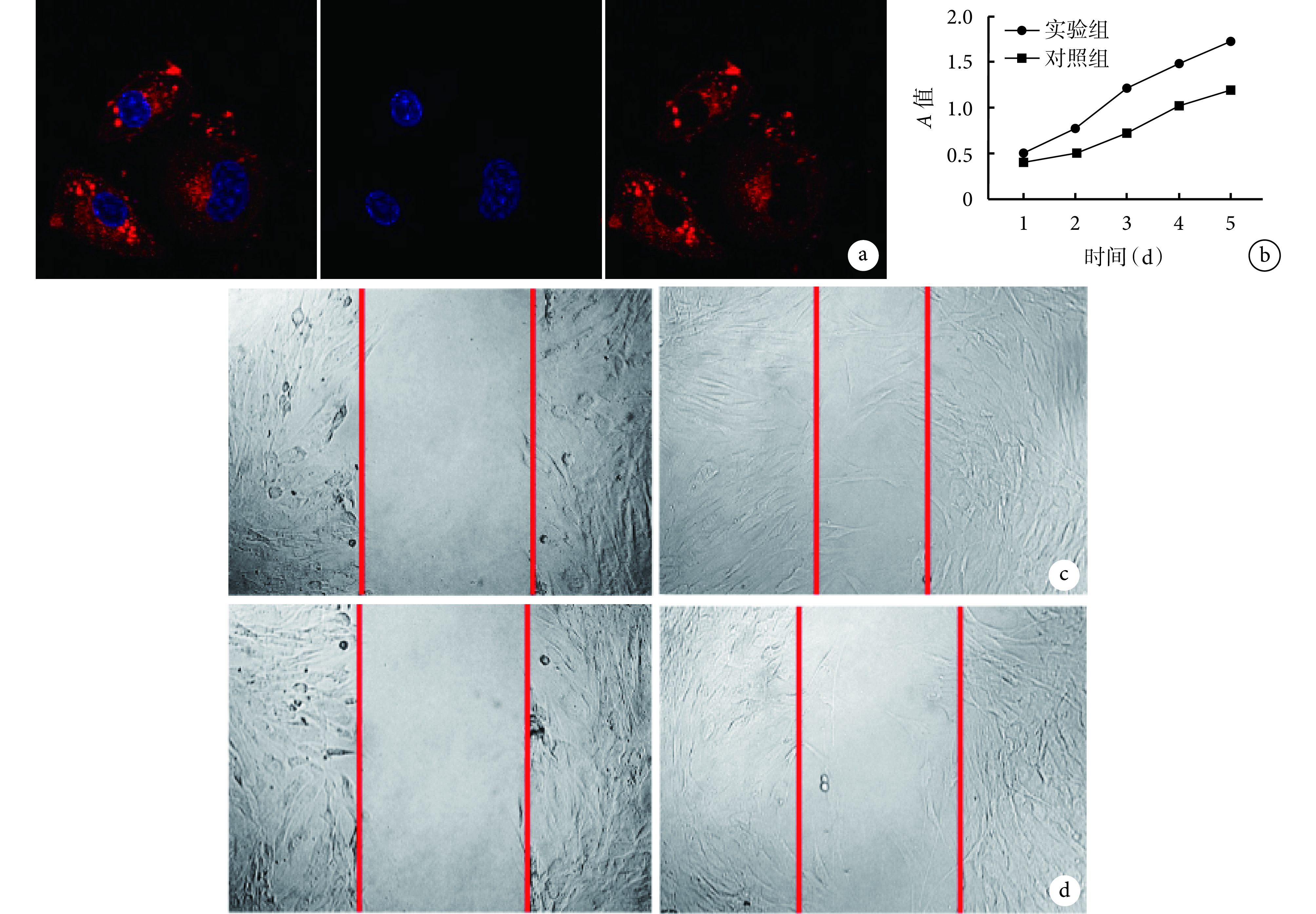
共聚焦荧光显微镜下可见 ADSC-Exos 被成纤维细胞摄取并分布于细胞核周围,表明 ADSC-Exos 可进入成纤维细胞内(图 3a)。
图 3.
Observation after ADSC-Exos and fibroblasts co-cultured
ADSC-Exos 与成纤维细胞复合培养观察
a. 共聚焦荧光显微镜观察 ADSC-Exos 进入成纤维细胞情况(×630) 从左至右分别为 DAPI、PKH26 及二者重叠;b. 两组 CCK-8 法检测成纤维细胞体外增殖;c. 实验组细胞迁移观察 左侧为 0 h、右侧为 24 h;d. 对照组细胞迁移观察 左侧为 0 h、右侧为 24 h
a. Confocal fluorescence microscopy observation of ADSC-Exos into fibroblasts (×630) From left to right for DAPI, PKH26, and merge, respectively; b. Cell proliferation of the two groups by CCK-8; c. Cell migration observation of experimental group Left for 0 hour and right for 24 hours; d. Cell migration observation of control group Left for 0 hour and right for 24 hours
2.2.2. ADSC-Exos 对成纤维细胞增殖及迁移的影响
CCK-8 法检测示,培养 1、2、3、4、5 d,实验组 A 值均明显高于对照组,差异有统计学意义(t=9.899,P=0.001;t=18.250,P=0.001;t=21.850,P=0.001;t=17.090,P=0.001;t=20.330,P=0.001)。见图 3b。细胞划痕迁移分析显示,实验组 24 h 迁移率为 80.0%±0.2%,明显高于对照组的 40.0%±0.1%,差异有统计学意义(t=4.534,P=0.001)。见图 3c、d。
2.3. 动物实验观察
2.3.1. 创面愈合观测
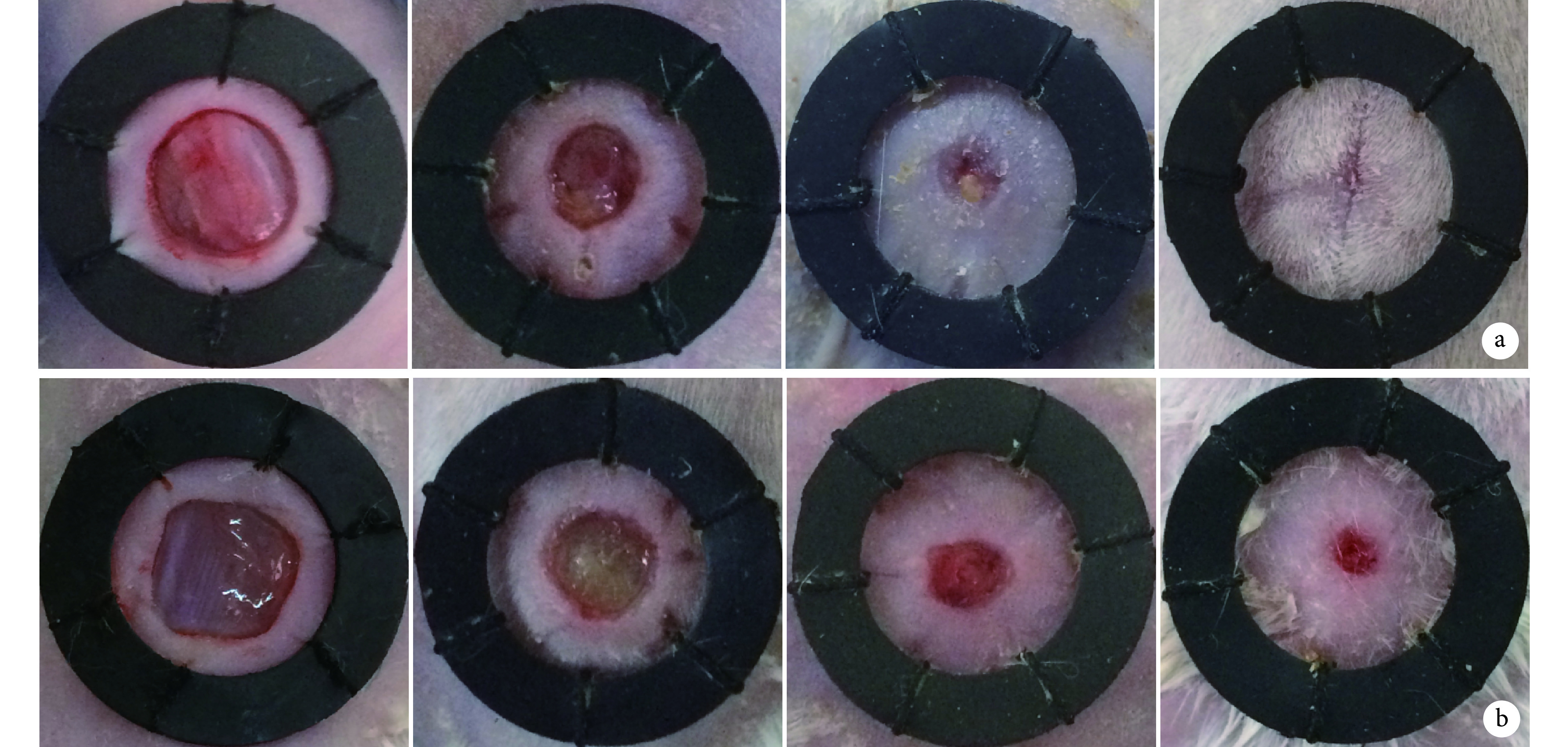
大体观察显示,实验组小鼠背部创面愈合明显快于对照组;实验组小鼠创面在第 21 天基本完全愈合,对照组仍有少量创面未愈合(图 4a、b)。实验组第 1、4、7、11、16、21 天创面愈合率分别为 2.068%±0.091%、15.283%±0.422%、37.453%±1.020%、61.240%±0.738%、80.285%±0.703%、98.033%±0.713%,对照组分别为 0.860%±0.147%、7.708%±0.323%、26.205%±0.955%、50.378%±0.484%、68.228%±0.878%、81.135%±0.795%,各时间点两组间差异均有统计学意义(t=14.000,P=0.001;t=28.530,P=0.001;t=16.100,P=0.001;t=24.620,P=0.001;t=21.440,P=0.001;t=31.660,P=0.001)。
图 4.
Wound healing observation of two groups
两组创面愈合大体观察
从左至右分别为第 1、7、16、21 天 a. 实验组;b. 对照组
From left to right for the 1st, 7th, 16th, and 21st days, respectively a. Experimental group; b. Control group
2.3.2. 组织学观察
① HE 染色:各时间点实验组创面新上皮长度比对照组短,第 21 天时实验组创面缺损长度基本接近于 0,对照组仍有一定缺损。见图 5。第 7、14、21 天实验组创面缺损长度分别为(0.39±0.04)、(0.12±0.02)、(0.01±0.01)cm,对照组分别为(0.49±0.06)、(0.22±0.03)、(0.10±0.01)cm,差异均有统计学意义(t=2.774,P=0.032;t=5.547,P=0.001;t=12.730,P=0.001)。
图 5.
HE staining of the two groups at each time point (×40)
两组各时间点 HE 染色观察(×40)
从左至右分别为第 7、14、21 天 a. 实验组;b. 对照组
From left to right for the 7th, 14th, and 21st days, respectively a. Experimental group; b. Control group

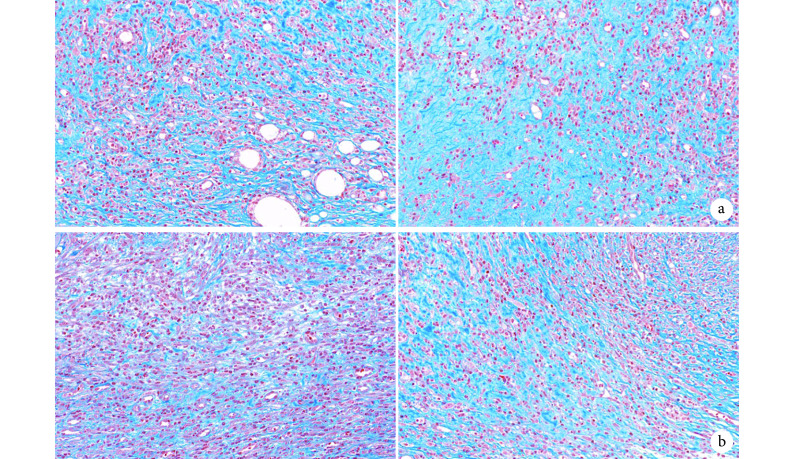
② Masson 染色:镜下观察创面床中胶原纤维广泛沉积且排列整齐,各时间点实验组胶原沉积和胶原纤维均多于对照组。见图 6。第 14、21 天实验组胶原纤维沉积百分比分别为 50.23%±1.03%、80.10%±2.05%,对照组分别为 30.50%±1.20%、51.51%±0.36%,差异均有统计学意义(t=24.950,P=0.001;t=28.430, P=0.001)。
图 6.
Masson staining of the two groups at each time point (×400)
两组各时间点 Masson 染色观察(×400)
从左至右分别为第 14、21 天 a. 实验组;b. 对照组
From left to right for the 14th and 21st days, respectively a. Experimental group; b. Control group
2.3.3. CD31 免疫组织化学染色
镜下观察示,第 7 天实验组新生血管多于对照组,并且呈平行排列;第 14 天实验组中观察到更典型的圆形或椭圆形微血管,且数量多于对照组。见图 7。
图 7.
CD31 immunohistochemical staining of the two groups at each time point (×400)
两组各时间点 CD31 免疫组织化学染色观察(×400)
从左至右分别为第 7、14 天 a. 实验组;b. 对照组
From left to right for the 7th and 14th days, respectively a. Experimental group; b. Control group
定量分析显示第 7、14 天实验组微血管数量分别为(59.51±2.02)、(57.62±3.14)个/视野,明显高于对照组的(21.32±1.23)、(36.65±2.34)个/视野,差异均有统计学意义(t=32.300,P=0.001;t=10.710, P=0.001)。
3. 讨论
慢性皮肤创面临床常见,可由多种原因导致,如糖尿病、老化、应激等[13],其中成纤维细胞是慢性创面愈合的主要靶细胞和效应细胞[14]。干细胞治疗已被证明在慢性创面愈合上发挥重要作用,其中治疗效果比较好的干细胞为 ADSCs[15]。但是由于干细胞在体内易致瘤、易诱导畸形、栓塞等[16],其移植治疗尚存在争议,为此需要寻找一种风险较低的治疗方法[17]。越来越多研究发现,ADSCs 能分泌许多蛋白质、细胞因子以及细胞外囊泡,这些细胞外囊泡具有与 ADSCs 相似的作用[18]。其中,人 ADSCs 能够刺激皮肤成纤维细胞增殖和迁移,是由于其分泌的一种细胞外囊泡——Exos[19]。因此,我们推测 ADSC-Exos 能促进糖尿病创面的愈合。
血管新生是创面愈合和组织修复的关键步骤[14]。研究发现,人脐带间充质干细胞来源 Exos 能促进内皮细胞增殖和迁移,从而促进血管生成,这可能是一个重要的皮肤伤口愈合机制[7]。本研究结果也提示 ADSC-Exos 能够在创面愈合前中期促进糖尿病创面血管新生。结合本课题组前期研究发现的 ADSC-Exos 可以进入 HUVECs 细胞质,并促进 HUVECs 增殖、迁移及管样分化[12],表明 ADSC-Exos 具有促进内皮细胞增殖、迁移和分化,从而促进创面血管新生的作用。
成纤维细胞增殖和迁移也是创面愈合的重要步骤[14]。近期研究发现,在糖尿病大鼠模型中,富血小板血浆来源 Exos 可促进成纤维细胞增殖、迁移以及创面皮肤再上皮化[20]。Geiger 等[21]研究发现人纤维细胞来源 Exos 含有多种生物活性的微小 RNA 和蛋白质,能加速成纤维细胞及上皮细胞增殖、迁移,促进创面愈合。本研究体外细胞实验结果显示,成纤维细胞能内化 ADSC-Exos,而且进入成纤维细胞内的 ADSC-Exos 能促进成纤维细胞增殖和迁移,但 ADSC-Exos 携带的何种信号分子在成纤维细胞内发挥作用有待深入研究。另外,动物实验中实验组创面愈合更快,说明与皮肤愈合密切相关的成纤维细胞在其中发挥重要作用,进一步验证了体外细胞实验中 ADSC-Exos 对成纤维细胞的作用。
在创面愈合后期,创面胶原沉积量对创面愈合质量有显著影响。Zhao 等[22]报道在大鼠创面模型中,高浓度人羊膜上皮细胞来源 Exos 通过刺激基质金属蛋白酶 1 的表达来调控细胞外基质沉积,从而促进创面愈合。本研究中,我们采用 Masson 染色观察创面愈合后期胶原沉积量,发现 ADSC-Exos 能促进胶原沉积。但是有学者提出在创面愈合后期胶原过量沉积会导致瘢痕增生,从而不利于创面愈合[19]。因此 ADSC-Exos 促进胶原沉积能否促进创面愈合,还需要继续探讨。
综上述,ADSC-Exos 可通过促进创面血管新生及优化成纤维细胞特性来促进糖尿病大鼠创面愈合。但 Exos 中的微小 RNA 及蛋白成分复杂[23],具体哪些微小 RNA 及蛋白能促进血管新生及优化成纤维细胞特性以及其具体机制,将在后续研究中进一步明确。
作者贡献:王江文负责文章撰写;朱元正负责数据收集整理及统计分析;张静负责体外细胞实验;胡玄负责动物饲养;聂佳莹、王朝慧负责动物实验;吴舒负责临床标本收集;易阳艳负责科研设计。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:研究方案经南昌大学第二附属医院医学/动物实验伦理委员会批准,批准号:研临审[2018]第(023)号。实验动物生产许可证号:SCXK(湘)2016-0002,实验动物使用许可证号:SYXK(赣)2015-0001。
Funding Statement
国家自然科学基金资助项目(81660326);江西省自然科学基金资助项目(20171ACB20037、20192BAB205056)
References
- 1.Krug EG Trends in diabetes: sounding the alarm. Lancet. 2016;387(10027):1485–1486. doi: 10.1016/S0140-6736(16)30163-5. [DOI] [PubMed] [Google Scholar]
- 2.Greenhalgh DG Wound healing and diabetes mellitus. Clin Plast Surg. 2003;30(1):37–45. doi: 10.1016/S0094-1298(02)00066-4. [DOI] [PubMed] [Google Scholar]
- 3.Hyldig K, Riis S, Pennisi CP, et al Implications of extracellular matrix production by adipose tissue-derived stem cells for development of wound healing therapies. Int J Mol Sci. 2017;18(6):E1167. doi: 10.3390/ijms18061167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Kourembanas S Exosomes: vehicles of intercellular signaling, biomarkers, and vectors of cell therapy. Annu Rev Physiol. 2015;77:13–27. doi: 10.1146/annurev-physiol-021014-071641. [DOI] [PubMed] [Google Scholar]
- 5.Rani S, Ryan AE, Griffin MD, et al Mesenchymal stem cell-derived extracellular vesicles: toward cell-free therapeutic applications. Mol Ther. 2015;23(5):812–823. doi: 10.1038/mt.2015.44. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zhang B, Wang M, Gong A, et al HucMSC-Exosome mediated-Wnt4 signaling is required for cutaneous wound healing. Stem Cells. 2015;33(7):2158–2168. doi: 10.1002/stem.1771. [DOI] [PubMed] [Google Scholar]
- 7.Zhang B, Wu X, Zhang X, et al Human umbilical cord mesenchymal stem cell exosomes enhance angiogenesis through the Wnt4/β-catenin pathway. Stem Cells Transl Med. 2015;4(5):513–522. doi: 10.5966/sctm.2014-0267. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Zhang J, Guan J, Niu X, et al Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis. J Transl Med. 2015;13:49. doi: 10.1186/s12967-015-0417-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Rao RR, Stegemann JP Cell-based approaches to the engineering of vascularized bone tissue. Cytotherapy. 2013;15(11):1309–1322. doi: 10.1016/j.jcyt.2013.06.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Rohringer S, Hofbauer P, Schneider KH, et al Mechanisms of vasculogenesis in 3D fibrin matrices mediated by the interaction of adipose-derived stem cells and endothelial cells. Angiogenesis. 2014;17(4):921–933. doi: 10.1007/s10456-014-9439-0. [DOI] [PubMed] [Google Scholar]
- 11.Than UTT, Guanzon D, Leavesley D, et al Association of extracellular membrane vesicles with cutaneous wound healing. Int J Mol Sci. 2017;18(5):E956. doi: 10.3390/ijms18050956. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.张静, 易阳艳, 阳水发, 等 脂肪干细胞来源外泌体对人脐静脉血管内皮细胞增殖、迁移及管样分化的影响. 中国修复重建外科杂志. 2018;32(10):1351–1357. doi: 10.7507/1002-1892.201804016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Hamed S, Bennett CL, Demiot C, et al Erythropoietin, a novel repurposed drug: an innovative treatment for wound healing in patients with diabetes mellitus. Wound Repair Regen. 2014;22(1):23–33. doi: 10.1111/wrr.12135. [DOI] [PubMed] [Google Scholar]
- 14.Martin P Wound healing—aiming for perfect skin regeneration. Science. 1997;276(5309):75–81. doi: 10.1126/science.276.5309.75. [DOI] [PubMed] [Google Scholar]
- 15.Gadelkarim M, Abushouk AI, Ghanem E, et al Adipose-derived stem cells: effectiveness and advances in delivery in diabetic wound healing. Biomed Pharmacother. 2018;107:625–633. doi: 10.1016/j.biopha.2018.08.013. [DOI] [PubMed] [Google Scholar]
- 16.Trounson A, McDonald C Stem cell therapies in clinical trials: progress and challenges. Cell Stem Cell. 2015;17(1):11–22. doi: 10.1016/j.stem.2015.06.007. [DOI] [PubMed] [Google Scholar]
- 17.Gyöngyösi M, Wojakowski W, Lemarchand P, et al Meta-analysis of cell-based CaRdiac stUdiEs (ACCRUE) in patients with acute myocardial infarction based on individual patient data. Circ Res. 2015;116(8):1346–1360. doi: 10.1161/CIRCRESAHA.116.304346. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Taverna S, Pucci M, Alessandro R Extracellular vesicles: small bricks for tissue repair/regeneration. Ann Transl Med. 2017;5(4):83. doi: 10.21037/atm.2017.01.53. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Hu L, Wang J, Zhou X, et al Exosomes derived from human adipose mensenchymal stem cells accelerates cutaneous wound healing via optimizing the characteristics of fibroblasts. Sci Rep. 2016;6:32993. doi: 10.1038/srep32993. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Guo SC, Tao SC, Yin WJ, et al Exosomes derived from platelet-rich plasma promote the re-epithelization of chronic cutaneous wounds via activation of YAP in a diabetic rat model. Theranostics. 2017;7(1):81–96. doi: 10.7150/thno.16803. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Geiger A, Walker A, Nissen E Human fibrocyte-derived exosomes accelerate wound healing in genetically diabetic mice. Biochem Biophys Res Commun. 2015;467(2):303–309. doi: 10.1016/j.bbrc.2015.09.166. [DOI] [PubMed] [Google Scholar]
- 22.Zhao B, Zhang Y, Han S, et al Exosomes derived from human amniotic epithelial cells accelerate wound healing and inhibit scar formation. J Mol Histol. 2017;48(2):121–132. doi: 10.1007/s10735-017-9711-x. [DOI] [PubMed] [Google Scholar]
- 23.Liang X, Zhang L, Wang S, et al Exosomes secreted by mesenchymal stem cells promote endothelial cell angiogenesis by transferring miR-125a. J Cell Sci. 2016;129(11):2182–2189. doi: 10.1242/jcs.170373. [DOI] [PubMed] [Google Scholar]