Abstract
目的
探讨负载 IL-4 和 BMP-2 的氧化石墨烯(graphene oxide,GO)-羧甲基壳聚糖(carboxymethyl chitosan,CMC)凝胶诱导巨噬细胞 M2 型分化及对 BMSCs 成骨分化的影响。
方法
取 CMC、GO 制备混合溶液后,分别添加 PBS、IL-4、BMP-2 或 IL-4+BMP-2,在交联剂作用下制备单纯或负载不同因子的 GO-CMC 凝胶支架;取单纯 GO-CMC 凝胶表征观测,包括大体、扫描电镜及傅里叶变换红外吸收光谱仪(Fourier transform infrared spectroscopy,FTIR)检测,以单纯 CMC 凝胶作为对照;取负载不同因子的 GO-CMC 凝胶行体外缓释实验。取 4~5 周龄 SPF 级 SD 雌性大鼠分离培养巨噬细胞,分别与单纯以及负载不同因子的 GO-CMC 凝胶培养,24 h 后行 CD206 免疫荧光检测巨噬细胞分化情况;取第 3 代大鼠 BMSCs 分别与单纯以及负载不同因子的 GO-CMC 凝胶成骨诱导培养,10 d 后行 ALP 染色观测早期成骨,21 d 行茜素红染色观测晚期成骨。
结果
大体观察 GO-CMC 凝胶呈棕色、半透明状;扫描电镜观察示,GO-CMC 凝胶孔径及孔壁厚度与单纯 CMC 凝胶相似,但内壁粗糙度增加;FTIR 检测显示 CMC 发生聚合形成凝胶。体外缓释实验示 3 种负载不同因子的 GO-CMC 凝胶缓释性能相似,均呈线性缓慢释放因子。CD206 免疫荧光检测示 GO-CMC 凝胶可诱导巨噬细胞 M2 型分化,ALP 及茜素红染色示 GO-CMC 凝胶可诱导 BMSCs 成骨分化;其中负载 IL-4+BMP-2 的 GO-CMC 凝胶作用最显著(P<0.05)。
结论
负载 IL-4 和 BMP-2 的 GO-CMC 凝胶可诱导巨噬细胞 M2 型分化,增强 BMSCs 成骨分化能力,为后期骨缺损修复及骨免疫调节研究提供了新的策略。
Keywords: 氧化石墨烯, 羧甲基壳聚糖, IL-4, BMP-2, 巨噬细胞, BMSCs, 大鼠
Abstract
Objective
To investigate the effect of graphene oxide (GO)-carboxymethyl chitosan (CMC) hydrogel loaded with interleukin 4 (IL-4) and bone morphogenetic protein 2 (BMP-2) on macrophages M2 type differentiation and osteogenic differentiation of bone marrow mesenchymal stem cells (BMSCs).
Methods
GO solution was mixed with CMC, then the phosphate buffered saline (PBS), IL-4, BMP-2, or IL-4+BMP-2 were added to prepare different GO-CMC hydrogel scaffolds with or without different cytokines under crosslinking agents. The characteristics of pure GO-CMC hydrogel were characterized by gross observation, scanning electron microscope (SEM), and Fourier transform infrared spectroscopy (FTIR), and the CMC hydrogel was used as control. The sustained release of GO-CMC hydrogels with different cytokines was also tested. Macrophages were isolated and cultured from female Sprague Dawley rats aged 4-5 weeks, and then cultured with GO-CMC hydrogels with and without different cytokines, respectively. CD206 immunofluorescence staining was used to detect the differentiation of macrophages after 24 hours. The 3rd generation of rats BMSCs were cultured with GO-CMC hydrogels with and without different cytokines respectively for osteogenic induction. The early osteogenesis was observed by alkaline phosphatase (ALP) staining after 10 days, and the late osteogenesis was observed by alizarin red staining after 21 days.
Results
Generally, GO-CMC hydrogel was brown and translucent. SEM showed that the pore diameter and wall thickness of GO-CMC hydrogel were similar to that of CMC hydrogel, but the inner wall roughness increased. FTIR test showed that CMC polymerized to form hydrogel. In vitro, the sustained release experiments showed that the properties of GO-CMC hydrogels loaded with different cytokines were similar. CD206 immunofluorescence detection showed that GO-CMC hydrogels could induce macrophages differentiation into M2-type. ALP and alizarin red staining showed that GO-CMC hydrogels could induce BMSCs osteogenic differentiation, in which GO-CMC hydrogel loaded with IL-4+BMP-2 showed the most significant effect (P<0.05).
Conclusion
The GO-CMC hydrogel loaded with IL-4 and BMP-2 can induce macrophages differentiation into M2-type and enhance the ability of BMSCs with osteogenic differentiation in vitro, which provide a new strategy for bone defect repair and immune regulation.
Keywords: Graphene oxide, carboxymethyl chitosan, interleukin 4, bone morphogenetic protein 2, macrophages, bone marrow mesenchymal stem cells, rat
肿瘤、创伤、先天性疾病等原因导致的大范围或节段性骨缺损修复一直是临床难题,采用具有骨诱导性生物材料构建类似自体骨修复骨缺损的方法显示了广阔的应用前景。目前体外生物材料诱导骨形成的研究中,未考虑宿主固有炎症反应,导致体内与体外研究结果不一致[1]。当生物材料植入体内时,首先在其表面黏附的细胞不是骨相关细胞,而是参与宿主免疫反应的免疫细胞,包括淋巴细胞、树突状细胞、单核细胞、巨噬细胞等,其中巨噬细胞为主要参与者,在骨损伤早期和晚期骨重建中发挥着重要作用。巨噬细胞具有高度可塑性,可以分为经典活化的 M1 型和选择活化的 M2 型,分别发挥促炎作用和抗炎作用。近年来,M2 型巨噬细胞及其亚型作为治疗型巨噬细胞备受重视,不仅具有强大的抗炎作用,还具有促进细胞迁移增殖、细胞成熟、细胞外基质形成和血管形成[2-3],调节干细胞以及成骨细胞、破骨细胞的功能活性等[4]重要作用,成为骨修复重建和骨免疫调节的研究热点。IL-4 是免疫系统中重要的免疫细胞因子,能够诱导巨噬细胞向 M2 型分化,在骨修复炎症反应阶段减轻局部炎症,促进骨修复。然而,IL-4 半衰期非常短,在机体内的有效时间仅有 2~10 min,很容易被机体清除,阻碍了 IL-4 的体内研究[5-6]。
羧甲基壳聚糖(carboxymethyl chitosan,CMC)是壳聚糖的衍生物,具有良好的水溶性以及天然生物相容性、降解性、抗菌等特性,可在交联剂作用下形成凝胶,广泛用作制备骨、软骨、皮肤软组织等的生物材料[7-8]。然而,单纯 CMC 凝胶机械性能差,不能满足组织生长环境的力学要求。近年来,氧化石墨烯(graphene oxide,GO)越来越受到关注,其在细胞黏附、增殖以及载药、生物传感等方面有着广阔应用前景,成为生物领域研究的热点[9-11]。有研究发现 CMC 与 GO 混合成胶后,CMC 机械强度明显提高[12]。同时在载药方面,GO 可以在不破坏蛋白分子结构条件下修饰结合所需负载的蛋白,并在其释放过程中表现出持续缓释作用,在减少用量的同时持续保持负载蛋白活性[13]。
因此,本研究通过 GO 负载 IL-4 和 BMP-2,制备具有缓释功能的 GO-CMC 凝胶支架,探讨该支架能否诱导巨噬细胞 M2 型分化以及通过释放 IL-4 和 BMP-2 增强 BMSCs 成骨分化能力。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
4~5 周龄 SPF 级 SD 雌性大鼠 4 只,体质量 200~220 g,购于成都达硕生物科技有限公司。
IL-4、BMP-2(R&D 公司,美国);L-DMEM、H-DMEM、FBS(GIBCO 公司,美国);1640 培养基(HyClone 公司,美国);CMC(羧甲基化≥80%;大连美仑生物技术有限公司);GO 粉末(南京先丰纳米材料有限公司);CD68 抗体、CD206 抗体(Abcam 公司,美国);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC]、N-羟基丁二酰亚胺(N-hydroxy succinimide,NHS)(Sigma 公司,美国);BCIP/NBT ALP 显色试剂盒(上海碧云天生物技术有限公司);AKP 测试盒(南京建成有限公司)。
倒置荧光显微镜、扫描电镜(Zeiss 公司,德国);傅立叶变换红外光谱仪(Fourier transform infrared spectroscopy,FTIR;热电公司,美国)。
1.2. 凝胶制备与表征
1.2.1. 凝胶制备
将 CMC 置于 PBS 配置成 2%(W/V)溶液,然后加入 GO 溶液,使 GO 浓度为 0.01 %(W/V),GO 溶液在混合前加入交联剂(0.1 mol/LEDC 及 0.025 mol/L NHS)活化 15 min。分别加入 PBS、IL-4(1 μg/mL)、BMP-2(2 μg/mL)以及 IL-4(1 μg/mL)+BMP-2(2 μg/mL),摇晃 2 h 使其与 CMC 溶液充分混合。加入交联剂,混合均匀后移至 96 孔板中静置 30 min,待其充分成胶后分别得到单纯 GO-CMC 凝胶以及负载 IL-4、BMP-2 及 IL-4+BMP-2 的 GO-CMC 凝胶,切割成厚度约 2 mm 的样品备用。另直接于 CMC 溶液中加入交联剂制备单纯 CMC 凝胶。将制备的凝胶置于 PBS 溶液中浸泡 72 h,每 24 小时换液 1 次,去除多余交联剂及其副产物。
1.2.2. GO-CMC 凝胶表征观测
① 大体观察:观察单纯 CMC 凝胶和单纯 GO-CMC 凝胶的形状、颜色。
② 扫描电镜观察:将单纯 CMC 凝胶和单纯 GO-CMC 凝胶置于–20℃ 冰箱中 2 h,然后转移至–80℃ 冰箱过夜并冻干,切片、喷金处理后,扫描电镜观察样品微观结构。
③ FTIR 检测:将单纯 CMC 凝胶和单纯 GO-CMC 凝胶冻干后研磨成粉末,溴化钾压片后,采用 FTIR 对样品进行分析。
④ 缓释性能:将负载不同因子的 GO-CMC 凝胶样品切片,片厚 2 mm、直径 17.8 mm,置于 4 mL EP 管中,加入 3 mL PBS 溶液(pH7.0),置于摇床(37℃、80 r/min)。分别于 1、3、5、7、14、28、42、56 d 吸取 PBS 溶液(–20℃ 保存),同时添加 3 mL 新的 PBS 溶液。待各时间点收集完成后,ELISA 检测 PBS 溶液中 IL-4、BMP-2 含量,绘制缓释曲线,计算各时间点缓释率。
1.3. GO-CMC 凝胶诱导巨噬细胞 M2 型分化
1.3.1. 大鼠巨噬细胞分离培养
取 4 只 SD 大鼠断颈处死,每只腹腔注射 10 mL 预冷 H-DMEM,静置 5~7 min。在剑突下最薄弱处作 2 mm 长切口打开腹腔,用无菌巴氏吸管从切口进入腹腔吸取淡黄色液体,置于离心管中,以半径 12 cm、1 000 r/min 离心 10 min;弃上清,加入含 10%FBS 的 H-DMEM 培养基重悬,调整细胞密度为 1.5×106个/mL,接种于放置细胞爬片的 6 孔板中,于 37℃、5%CO2 培养箱中培养 2 h 后更换培养基,去除未贴壁细胞及其他细胞,剩下贴壁细胞即为巨噬细胞,用于后续实验。
1.3.2. 诱导分化培养及观测
将巨噬细胞接种至有 24 孔爬片的 Transwell 孔板下室中,调整细胞密度为 2×105个/孔,2 h 后首次换液,去除未贴壁细胞;取制备的单纯 GO-CMC 凝胶(对照组)以及负载 IL-4、BMP-2、IL-4+BMP-2 的 GO-CMC 凝胶(分别为 IL-4 组、BMP-2 组、IL-4+BMP-2 组),分别置于 Transwell 孔板上室中;同时设置空白对照(无材料和因子)和阳性对照(仅有 IL-4)。培养 24 h 后取出细胞爬片行 CD206 免疫荧光检测,荧光显微镜下观察蓝色荧光(DAPI)和红色荧光(罗丹明)双染者即为 M2 型阳性细胞,200 倍镜下随机取 5 个视野计算阳性率。
1.4. GO-CMC 凝胶诱导 BMSCs 成骨分化
1.4.1. 诱导培养及分组
取前期研究分离培养的第 3 代 BMSCs 接种至 24 孔 Transwell 孔板下室中,调整细胞密度为 2×104个/孔,待细胞融合至 60%~70% 时,更换为成骨诱导培养基;同时取单纯 GO-CMC 凝胶(对照组)以及负载 IL-4、BMP-2、IL-4+BMP-2 的 GO-CMC 凝胶(分别为 IL-4 组、BMP-2 组、IL-4+BMP-2 组),分别置于 Transwell 孔板上室中,每隔 2 d 换液 1 次。以单纯 BMSCs 成骨诱导培养作为空白组。
1.4.2. 观测指标
① 早期成骨观测:诱导培养 10 d 各组取 3 孔细胞,参照 BCIP/NBT ALP 显色试剂盒说明书染色,光镜下观察细胞染色情况。参照 AKP 测试盒操作说明书检测 ALP 蛋白、总蛋白含量,并计算 ALP 蛋白/总蛋白比值。② 晚期成骨观测:诱导培养 21 d 后各组取 3 孔细胞行茜素红染色,光镜下观察钙结节染色情况。然后用 10% 氯化十六烷基吡啶溶解,采用全自动酶标仪于 562 nm 波长处读取吸光度(A)值。
1.5. 统计学方法
采用 GraphPad8.0 统计软件进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用 SNK 检验;检验水准α=0.05。
2. 结果
2.1. 凝胶表征观测
2.1.1. 大体观察
单纯 CMC 凝胶呈淡黄色,半透明状,含水量高,折光性强;单纯 GO-CMC 凝胶呈棕色,半透明状,含水量高,折光性强。见图 1。
图 1.
General observation
大体观察
a. CMC 凝胶;b. GO-CMC 凝胶
a. CMC hydrogel; b. GO-CMC hydrogel
2.1.2. 扫描电镜观察
单纯 CMC 凝胶为疏松多孔结构,孔壁较薄且光滑;孔径较大,达(311.5±17.0)nm。单纯 GO-CMC 凝胶孔径及孔壁厚度与单纯 CMC 凝胶相比无明显变化,但内壁粗糙度增加、表面积增大,同时可以观察到孔壁上附着的 GO。见图 2。
图 2.
SEM observation
扫描电镜观察
a. CMC 凝胶(×35);b. GO-CMC 凝胶(×35);c. GO-CMC 凝胶孔壁附着的 GO(×2 000)
a. CMC hydrogel (×35); b. GO-CMC hydrogel (×35); c. GO attached to the wall of GO-CMC hydrogel (×2 000)

2.1.3. FTIR 检测
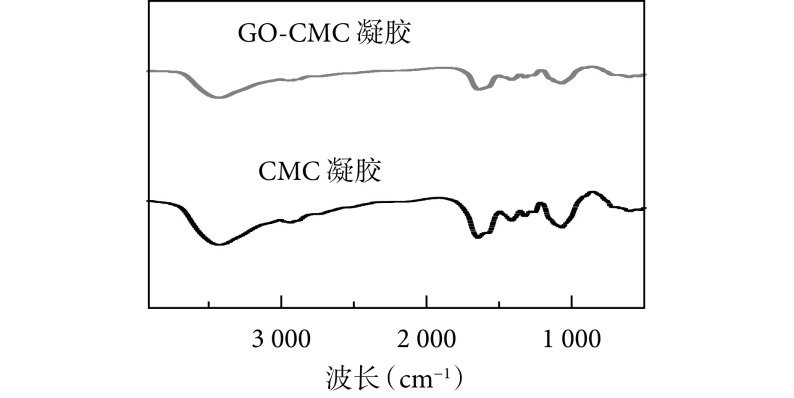
单纯 CMC 凝胶和单纯 GO-CMC 凝胶的红外光谱中可见 1 648 cm–1和 1 590 cm–1波长处分别出现波峰变化,说明在化学交联剂作用下发生了化学键的结合(CMC 自身形成、CMC 与 GO 之间形成),形成了典型的酰胺键(-NHCO-)Ⅰ和Ⅱ,表明 CMC 发生聚合形成凝胶。见图 3。
图 3.
FTIR analysis of hydrogel
凝胶 FTIR 检测
2.1.4. 负载因子凝胶的缓释性能观测
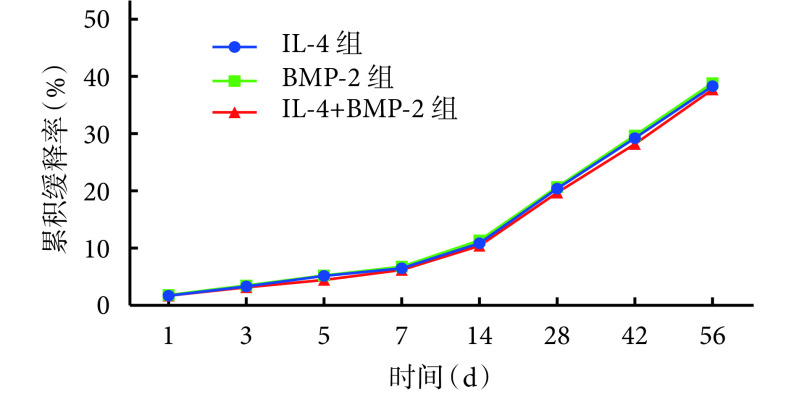
缓释曲线提示各样品均呈线性缓慢释放因子,56 d 后缓释率均未达 40%,未出现突释现象。3 种负载不同因子的 GO-CMC 凝胶缓释性能相似,其中负载 IL-4 的 GO-CMC 凝胶最大缓释率为 38.3%,负载 BMP-2 的 GO-CMC 凝胶为 38.8%,负载 IL-4+BMP-2 的 GO-CMC 凝胶(IL-4 和 BMP-2 均值)为 37.2%。见图 4。
图 4.
The sustained release curves of GO-CMC hydrogels loaded with different cytokines
负载不同因子的 GO-CMC 凝胶缓释曲线
2.2. GO-CMC 凝胶诱导巨噬细胞 M2 型分化
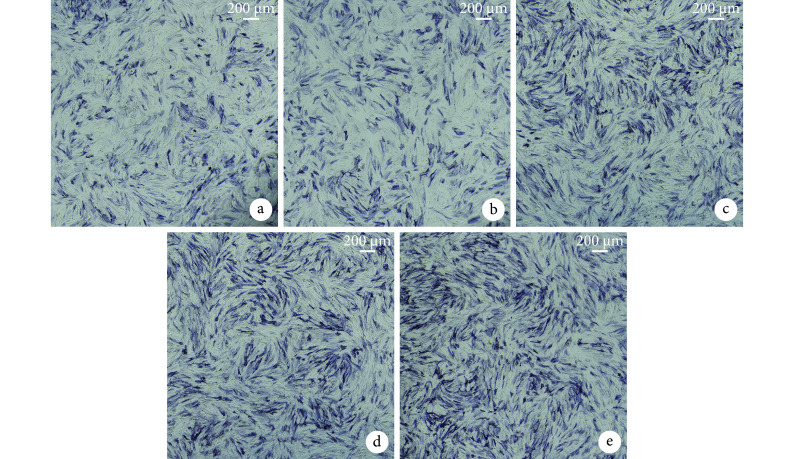
培养 24 h 后,IL-4 组、IL-4+BMP-2 组中可见大量 M2 型阳性细胞,阳性率分别为 88.67%±1.28%、89.20%±0.62%,组间差异无统计学意义(P>0.05);对照组以及 BMP-2 组仅可见少量 M2 型阳性细胞,阳性率分别为 6.07%±0.57%、6.27%±0.91%,组间差异亦无统计学意义(P>0.05);而 IL-4 组、IL-4+BMP-2 组与对照组、BMP-2 组间差异有统计学意义(P<0.05)。见图 5。
图 5.
CD206 immunofluorescence staining of each group
各组 CD206 免疫荧光染色观察
从左至右分别为光镜(×100)下以及荧光显微镜(×100)下 DAPI 染色、罗丹明染色及二者重叠a. IL-4 组;b. BMP-2 组;c. IL-4+BMP-2 组;d. 对照组
From left to right for light microscope (×100) observation and DAPI staining, rhodamine staining, and the merge under fluorescence microscope (×100) a. IL-4 group; b. BMP-2 group; c. IL-4+BMP-2 group; d. Control group

2.3. GO-CMC 凝胶诱导 BMSCs 成骨分化
2.3.1. 早期成骨观测
成骨诱导培养 10 d 后,各组均可见蓝紫色片状沉积,其中 IL-4+BMP-2 组颜色最深、片状沉积最大,其次分别为 BMP-2 组、IL-4 组、对照组及空白组。见图 6。
图 6.
ALP staining observation of each group after osteogenic induction cultured for 10 days (×100)
成骨诱导培养 10 d 各组 ALP 染色观察(×100)
a. 空白组;b. 对照组;c. IL-4 组;d. BMP-2 组;e. IL-4+BMP-2 组
a. Blank group; b. Control group; c. IL-4 group; d. BMP-2 group; e. IL-4+BMP-2 group
半定量检测显示,空白组、对照组、IL-4 组、BMP-2 组、IL-4+BMP-2 组 ALP 蛋白/总蛋白比值分别为 1.43±0.11、1.42±0.02、1.58±0.03、1.72±0.02、1.96±0.08。IL-4+BMP-2 组及 BMP-2 组 ALP 蛋白/ 总蛋白比值明显高于 IL-4 组、对照组及空白组,IL-4+BMP-2 组高于 BMP-2 组,IL-4 组高于对照组及空白组,差异均有统计学意义(P<0.05);对照组及空白组间差异无统计学意义(P>0.05)。
2.3.2. 晚期成骨观测
各组均可见橘红色钙化结节、成团聚集,其中 BMP-2 组以及 IL-4+BMP-2 组钙化结节更多、橘红色片状更大。见图 7。
图 7.
Alizarin red staining observation of each group after osteogenic induction cultured for 21 days (×100)
成骨诱导培养 21 d 各组茜素红染色观察(×100)
a. 空白组;b. 对照组;c. IL-4 组;d. BMP-2 组;e. IL-4+BMP-2 组
a. Blank group; b. Control group; c. IL-4 group; d. BMP-2 group; e. IL-4+BMP-2 group
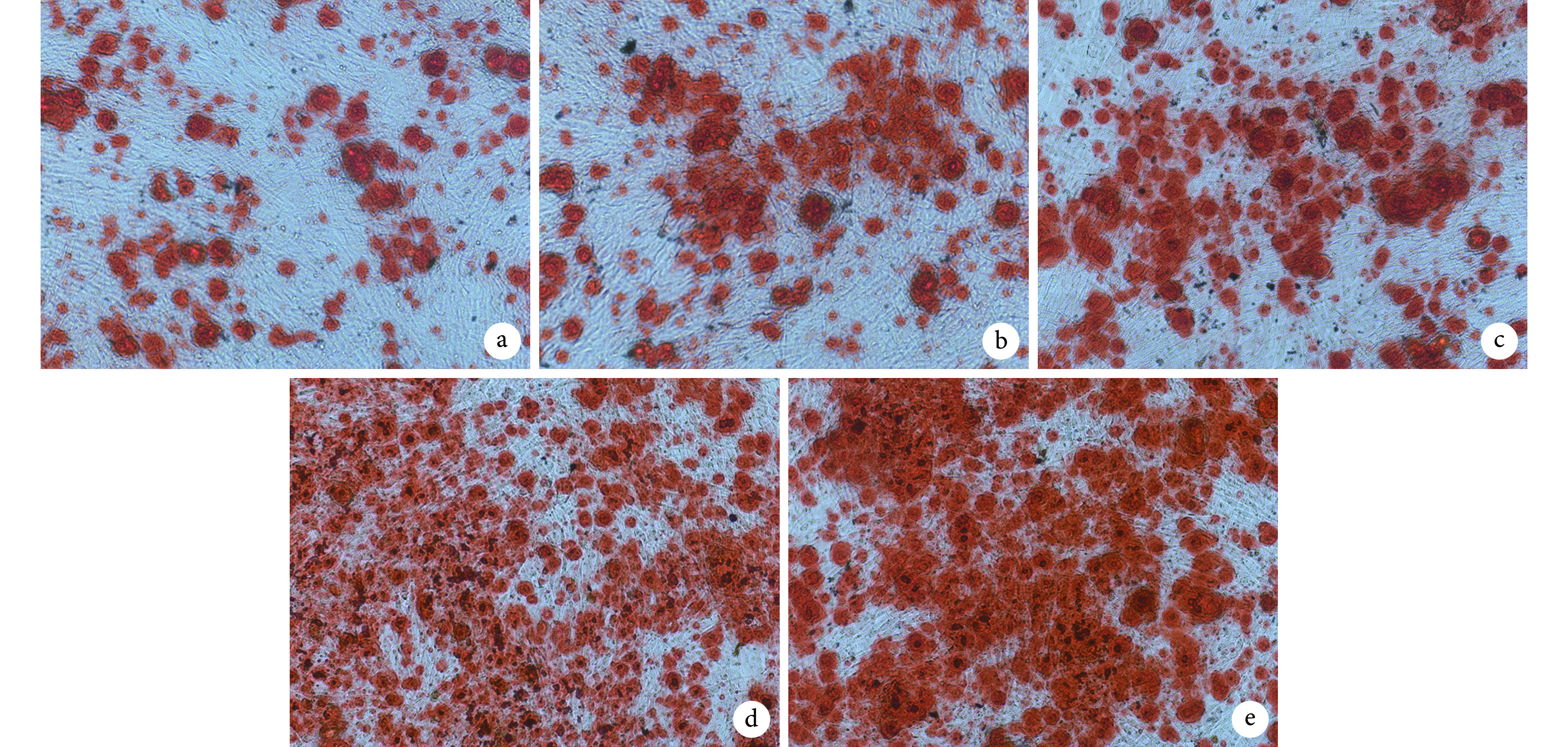
半定量检测显示,IL-4+BMP-2 组、BMP-2 组、IL-4 组、对照组及空白组A值分别为 0.377±0.009、0.327±0.007、0.255±0.006、0.228±0.015、0.214±0.009。IL-4+BMP-2 组及 BMP-2 组明显高于 IL-4 组、对照组及空白组,IL-4+BMP-2 组高于 BMP-2 组,IL-4 组高于对照组及空白组,差异均有统计学意义(P<0.05);对照组及空白组间差异无统计学意义(P>0.05)。
3. 讨论
本研究通过 GO 负载 IL-4 和 BMP-2 两种生物活性因子与 CMC 溶液混合,成功制备 GO-CMC 凝胶支架,其不仅能诱导巨噬细胞向 M2 型分化,同时缓释的 IL-4 和 BMP-2 均可以在体外增强 BMSCs 成骨分化能力。近年来,骨诱导材料的免疫调节越来越受到重视,被认为是组织再生的重要影响因素[14-16]。CMC 作为天然多糖类,不仅具有良好的生物相容性及降解性,还具有抗菌特性,这些特性使其在生物材料工程领域得到广泛应用[17]。GO 由于表面含有大量羟基、羧基等功能基团,被修饰后能作为载体,负载多种生物蛋白分子,在保持其生物活性同时表现出缓慢释放的特性[18]。表征观察显示该凝胶支架具有疏松多孔结构,孔径在 300 nm 左右,有利于营养物质的交换及代谢产物的排出,同时其内壁粗糙,增加了细胞及蛋白分子的黏附面积;FTIR 检测提示在 1 648 cm−1和 1 590 cm−1波长处分别形成了典型的酰胺键(-NHCO-)的波峰变化,表明 GO 和 CMC 或者其自身发生了交联,产生了新的化学键,形成了稳定的凝胶结构。
骨骼系统与免疫系统形成了一个新的研究方向,称为“骨免疫学”。例如,免疫细胞产生的细胞因子(如 TGF-β 和 IL-4)在分化早期可诱导成骨细胞迁移、增殖或分泌骨细胞外基质,而 IL-1β 和 TNF-α 可抑制成骨细胞分化[19]。基于此,本研究应用 IL-4 诱导巨噬细胞向 M2 型分化,从而达到促进 BMSCs 增殖和成骨分化的目的。Zheng 等[20]比较了不同剂量 IL-4 诱导巨噬细胞分化的效果,以期提供一种精确的主动免疫调节机制,从而达到增强成骨和成血管目的。研究发现当单次 IL-4 用量为 10 ng 时,巨噬细胞分化为 M1 型与 M2 型比例最适合,促进成骨和成血管作用也最强。本研究选择 IL-4 浓度为 1 μg/mL,单个凝胶支架单次缓释剂量与 Zheng 等[20]实验剂量相似。BMP-2 作为成骨诱导因子的研究很多,不同文献报道的使用剂量各不相 同[21-22],由于 GO 负载因子后呈现缓慢释放趋势,因此本研究采用 BMP-2 的使用剂量为 2 μg/mL,与 Lee 等[12]实验研究剂量一致。研究表明,GO 负载 BMP-2 缓慢释放的特性不仅可以持续释放因子作用于目的细胞,避免突释所带来的不良效果,同时也可减少用量,进而减少副作用并降低成本[1]。
本研究 GO-CMC 凝胶诱导巨噬细胞 M2 型分化检测结果显示,负载 IL-4 的凝胶支架组(IL-4、IL-4+BMP-2 组)均成功诱导巨噬细胞 M2 型分化,表明凝胶支架在与巨噬细胞共培养中释放一定量 IL-4,能诱导巨噬细胞向 M2 型分化,为组织修复提供有力的细胞微环境,为后续体内实验奠定了基础。有研究证实巨噬细胞可以通过分泌多种因子,如 BMP-2、TNF-α、抑瘤素等,调控骨形成[23-25]。因此,下一步需要对 IL-4 诱导巨噬细胞 M2 型分化和 BMSCs 的共培养体系进行实验研究,探索其增强 BMSCs 成骨分化形成的机制。
目前,M0、M1、M2 型巨噬细胞对 BMSCs 成骨分化的影响仍存在争议[26]。研究发现尽管 M1 型巨噬细胞在成骨早期和中期显著促进共培养的 MSCs 成骨分化,但未观察到其对 MSCs 矿化作用的增强[23]。与此相反,M2 型巨噬细胞增强了共培养的 MSCs 矿化,并且这种作用和巨噬细胞与 MSCs 的比例成正相关。此外,BMP-2 和抑瘤素参与不同亚型巨噬细胞和 MSCs 之间的相互作用,从而刺激后者的成骨分化。另有研究发现,M0 型巨噬细胞增强细胞的成骨能力,但与 M1 型和 M2 型巨噬细胞相比,细胞形成片层的能力受损[27]。相比之下,M2 型巨噬细胞不仅能促进培养细胞的成骨分化潜能,还表现出形成稳健细胞片层的能力。
通过对 BMSCs 成骨诱导研究,我们发现 IL-4+BMP-2 组 ALP 染色最深、片状沉积最大,半定量检测结果提示其早期成骨蛋白含量最高;而茜素红染色同样表明负载两种因子的凝胶诱导 BMSCs 成骨分化作用明显强于单一因子或不含因子凝胶,提示 IL-4 的参与提高了 BMSCs 的成骨分化能力,而具体机制目前尚不清楚,已成为研究热点[1,28-30]。
综上述,本研究通过 GO 负载 IL-4 和 BMP-2,与 CMC 构建复合凝胶支架,体外实验表明该支架不仅可以诱导巨噬细胞 M2 型分化,并且释放的两种因子均能增强 BMSCs 成骨分化能力,为体内实验奠定了良好基础,同时为骨缺损修复及骨免疫调节提供了新的策略。但目前对于巨噬细胞调控 BMSCs 成骨分化的机制仍不明确,两者相互关系仍需进一步探索,对于骨诱导生物材料精确的免疫调控也需进一步研究。
作者贡献:邹敏负责实验设计及实施、数据收集整理及统计分析、文章撰写;孙嘉辰负责实验设计及实施、统计分析、文章撰写;项舟审核实验内容,对文章的知识性内容作批评性审阅。
利益冲突:所有作者声明在课题研究和文章撰写过程中不存在利益冲突。经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:研究方案经四川大学华西医院实验动物伦理委员会批准(2020072A)。
Funding Statement
国家自然科学基金资助项目(31870961)
References
- 1.Chen Z, Wu C, Gu W, et al Osteogenic differentiation of bone marrow MSCs by β-tricalcium phosphate stimulating macrophages via BMP2 signaling pathway. Biomaterials. 2014;35(5):1507–1518. doi: 10.1016/j.biomaterials.2013.11.014. [DOI] [PubMed] [Google Scholar]
- 2.Ferrante CJ, Pinhal-Enfield G, Elson G, et al The adenosine-dependent angiogenic switch of macrophages to an M2-like phenotype is independent of interleukin-4 receptor alpha (IL-4 Ralpha) signaling. Inflammation. 2013;36(4):921–931. doi: 10.1007/s10753-013-9621-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Chen P, Piao X, Bonaldo P Role of macrophages in Wallerian degeneration and axonal regeneration after peripheral nerve injury. Acta Neuropathol. 2015;130(5):605–618. doi: 10.1007/s00401-015-1482-4. [DOI] [PubMed] [Google Scholar]
- 4.Pajarinen J, Lin T, Gibon E, et al Mesenchymal stem cell-macrophage crosstalk and bone healing. Biomaterials. 2019;196:80–89. doi: 10.1016/j.biomaterials.2017.12.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Travis J Method of cancer treatment. Science. 1992;258(5):1732–1733. [Google Scholar]
- 6.Upadhyaya L, Singh J, Agarwal V, et al The implications of recent advances in carboxymethyl chitosan based targeted drug delivery and tissue engineering applications. J Control Release. 2014;186:54–87. doi: 10.1016/j.jconrel.2014.04.043. [DOI] [PubMed] [Google Scholar]
- 7.Slavchov RI, Novev JK Surface tension of concentrated electrolyte solution. J Colloid Interface Sci. 2012;387(1):234–243. doi: 10.1016/j.jcis.2012.07.020. [DOI] [PubMed] [Google Scholar]
- 8.Liu X, Miller AL 2nd, Park S, et al Functionalized carbon nanotube and graphene oxide embedded electrically conductive hydrogel synergistically stimulates nerve cell differentiation. ACS Appl Mater Interfaces. 2017;9(17):14677–14690. doi: 10.1021/acsami.7b02072. [DOI] [PubMed] [Google Scholar]
- 9.Jing X, Mi HY, Napiwocki BN, et al Mussel-inspired electroactive chitosan/graphene oxide composite hydrogel with rapid self-healing and recovery behavior for tissue engineering. Carbon. 2017;125:557–570. doi: 10.1016/j.carbon.2017.09.071. [DOI] [Google Scholar]
- 10.Park J, Kim B, Han J, et al Graphene oxide flakes as a cellular adhesive: prevention of reactive oxygen species mediated death of implanted cells for cardiac repair. ACS Nano. 2015;9(5):4987–4999. doi: 10.1021/nn507149w. [DOI] [PubMed] [Google Scholar]
- 11.Sun X, Liu Z, Welsher K, et al Nano-graphene oxide for cellular imaging and drug delivery. Nano Res. 2008;1(3):203–212. doi: 10.1007/s12274-008-8021-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Lee SS, Huang BJ, Kaltz SR, et al Bone regeneration with low dose BMP-2 amplified by biomimetic supramolecular nanofibers within collagen scaffolds. Biomaterials. 2013;34(2):452–459. doi: 10.1016/j.biomaterials.2012.10.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zhang W, Zhao F, Huang D, et al Strontium-substituted submicrometer bioactive glasses modulate macrophage responses for improved bone regeneration. ACS Appl Mater Interfaces. 2016;8(45):30747–30758. doi: 10.1021/acsami.6b10378. [DOI] [PubMed] [Google Scholar]
- 14.Zhang Q, Hubenak J, Iyyanki T, et al Engineering vascularized soft tissue flaps in an animal model using human adipose-derived stem cells and VEGF+PLGA/PEG microspheres on a collagen-chitosan scaffold with a flow-through vascular pedicle. Biomaterials. 2015;73:198–213. doi: 10.1016/j.biomaterials.2015.09.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Reeves AR, Spiller KL, Freytes DO, et al Controlled release of cytokines using silk-biomaterials for macrophage polarization. Biomaterials. 2015;73:272–283. doi: 10.1016/j.biomaterials.2015.09.027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Ahmed S, Ikram S Chitosan & its derivatives: a review in recent innovations. IJPSR. 2015;6(1):14–30. [Google Scholar]
- 17.Wang K, Ruan J, Song H, et al Biocompatibility of graphene oxide. Nanoscale Res Lett. 2011;6(1):8. doi: 10.1007/s11671-010-9751-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Ruan J, Wang XS, Yu Z, et al Enhanced physiochemical and mechanical performance of chitosan-grafted graphene oxide for superior osteoinductivity. Adv Funct Mater. 2016;26(7):1085–1097. doi: 10.1002/adfm.201504141. [DOI] [Google Scholar]
- 19.Mori G, D’Amelio P, Faccio R, et al The interplay between the bone and the immune system. Clin Dev Immunol. 2013;2013:720504. doi: 10.1155/2013/720504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Zheng ZW, Chen YH, Wu DY, et al Development of an accurate and proactive immunomodulatory strategy to improve bone substitute material-mediated osteogenesis and angiogenesis. Theranostics. 2018;8(19):5482–5500. doi: 10.7150/thno.28315. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Madl CM, Mehta M, Duda GN, et al Presentation of BMP-2 mimicking peptides in 3D hydrogels directs cell fate commitment in osteoblasts and mesenchymal stem cells. Biomacromolecules. 2014;15(2):445–455. doi: 10.1021/bm401726u. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Sun J, Zhang Y, Li B, et al Controlled release of BMP-2 from a collagen-mimetic peptide-modified silk fibroin-nanohydroxyapatite scaffold for bone regeneration. J Mater Chem B. 2017;5(44):8770–8779. doi: 10.1039/C7TB02043K. [DOI] [PubMed] [Google Scholar]
- 23.Champagne CM, Takebe J, Offenbacher S, et al Macrophage cell lines produce osteoinductive signals tha include bone morphogenetic protein-2. Bone. 2002;30(1):26–31. doi: 10.1016/S8756-3282(01)00638-X. [DOI] [PubMed] [Google Scholar]
- 24.Guihard P, Danger Y, Brounais B, et al Induction of osteogenesis in mesenchymal stem cells by activated monocytes/macrophages depends on oncostatin M signaling. Stem Cells. 2012;30(4):762–772. doi: 10.1002/stem.1040. [DOI] [PubMed] [Google Scholar]
- 25.Gibon E, Lu L, Goodman SB Aging, inflammation, stem cells, and bone healing. Stem Cell Res Ther. 2016;7:44. doi: 10.1186/s13287-016-0300-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Zhang Y, Böse T, Unger RE, et al Macrophage type modulates osteogenic differentiation of adipose tissue MSCs. Cell Tissue Res. 2017;369(2):273–286. doi: 10.1007/s00441-017-2598-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.He XT, Li X, Yin Y, et al The effects of conditioned media generated by polarized macrophages on the cellular behaviours of bone marrow mesenchymal stem cells. J Cell Mol Med. 2018;22(2):1302–1315. doi: 10.1111/jcmm.13431. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.He XT, Li X, Xia Y, et al Building capacity for macrophage modulation and stem cell recruitment in high-stiffness hydrogels for complex periodontal regeneration: experimental studies in vitro and in rats . Acta Biomater. 2019;88:162–180. doi: 10.1016/j.actbio.2019.02.004. [DOI] [PubMed] [Google Scholar]
- 29.Lin T, Pajarinen J, Nabeshima A, et al Establishment of NF-κB sensing and interleukin-4 secreting mesenchymal stromal cells as an “on-demand” drug delivery system to modulate inflammation. Cytotherapy. 2017;19(9):1025–1034. doi: 10.1016/j.jcyt.2017.06.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Shu Y, Yu Y, Zhang S, et al The immunomodulatory role of sulfated chitosan in BMP-2-mediated bone regeneration. Biomater Sci. 2018;6(9):2496–2507. doi: 10.1039/C8BM00701B. [DOI] [PubMed] [Google Scholar]