Abstract
目的
研究人羊膜间充质干细胞外泌体(human amniotic mesenchymal stem cell exosome,hAMSC-Exo)中的微小 RNA-135a(microRNA-135a,miR-135a)对成纤维细胞迁移的作用。
方法
用外泌体分离试剂盒提取 hAMSC-Exo 并进行鉴定,划痕实验检测 hAMSC-Exo 对成纤维细胞迁移的作用。实时荧光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR)检测过表达 miR-135a 后 hAMSC-Exo 中 miR-135a 基因相对表达量,划痕实验检测过表达和敲减 miR-135a 后 hAMSC-Exo 对成纤维细胞迁移的作用,Western blot 检测过表达和敲减 miR-135a 后 hAMSC-Exo 成纤维细胞迁移相关蛋白[大分子肿瘤抑制因子 2(large tumor suppressor 2,LATS2)、E-钙黏着蛋白(E-cadherin)、N-cadherin、α 平滑肌肌动蛋白(α smooth muscle actin,α-SMA)]的相对表达量;均以 293T 细胞外泌体及 hAMSC-Exo 作为对照。
结果
成功获得 hAMSC-Exo;划痕实验检测示,hAMSC 组促进成纤维细胞迁移能力最强,GW4869(外泌体抑制剂)处理 hAMSC 组促进成纤维细胞迁移能力减弱。qRT-PCR 检测示过表达 miR-135a 后,hAMSC-Exo 中 miR-135a 基因相对表达量明显增加。划痕实验检测示,过表达 miR-135a 后,hAMSC-Exo 促进成纤维细胞迁移能力增强;而敲减 miR-135a 后,hAMSC-Exo 促进成纤维细胞迁移能力减弱。Western blot 检测成纤维细胞迁移相关蛋白显示,与 293T 细胞外泌体组比较,各 hAMSC-Exo 处理组均下调 E-cadherin、N-cadherin 和 LATS2 表达,上调 α-SMA 表达;其中过表达 miR-135a 后,hAMSC-Exo 能力增强,敲减 miR-135a 后,hAMSC-Exo 能力较过表达 miR-135a 组下降。
结论
hAMSC-Exo 中的 miR-135a 可促进成纤维细胞迁移,抑制 E-cadherin、N-cadherin 和 LATS2 表达,促进 α-SMA 表达。
Keywords: 人羊膜间充质干细胞, 外泌体, miR-135a, 成纤维细胞
Abstract
Objective
To investigate the effect of microRNA-135a (miR-135a) in human amnion mesenchymal stem cell exosome (hAMSC-Exo) on the migration of fibroblasts.
Methods
The hAMSC-Exo was extracted with exosomes separation kit and identified, the effect of hAMSC-Exo on fibroblasts migration was detected by scratch test. Real-time fluorescence quantitative PCR (qRT-PCR) was used to detect the relative expression of miR-135a gene in hAMSC-Exo after overexpression of miR-135a. Scratch test was used to detect the effect of hAMSC-Exo on the migration of fibroblasts after overexpression and knockdown of miR-135a. Western blot was used to detect the migration related proteins of fibroblasts [large tumor suppressor 2 (LATS2), E-cadherin, N-cadherin, and α smooth muscle actin (α-SMA)] after overexpression and knockdown of miR-135a. The 293T cell exosomes and hAMSC-Exo were used as control.
Results
hAMSC-Exos were extracted successfully. Scratch test results showed that hAMSC group had the strongest ability to promote fibroblasts migration, and GW4869 (exosome inhibitor) treatment group had reduced ability to promote fibroblasts migration. qRT-PCR test showed that the relative expression of miR-135a gene in hAMSC-Exo increased significantly after over expression of miR-135a. Scratch test results showed that after over expression of miR-135a, hAMSC-Exo enhanced the migration ability of fibroblasts, while after knockdown of miR-135a, hAMSC-Exo weakened the migration ability of fibroblasts. Western blot results showed that the expressions of E-cadherin, N-cadherin, LATS2 were down regulated and α-SMA was up regulated in each hAMSC-Exo treatment group when compared with 293T cell exosomes group; after over expression of miR-135a, hAMSC-Exo decreased the expressions of E-cadherin, N-cadherin, LATS2 and increased the expression of α-SMA; while after knockdown of miR-135a, the ability of hAMSC-Exo was weakened.
Conclusion
miR-135a in hAMSC-Exo can promote fibroblasts’ migration, inhibit the expressions of E-cadherin, N-cadherin, LATS2, and promote the expression of α-SMA.
Keywords: Human amniotic mesenchymal stem cell, exosome, microRNA-135a, fibroblasts
创面愈合是一个复杂过程,需要多个步骤协调,主要分为炎性反应、上皮化和创面收缩、胶原沉积和重塑[1]。虽然创面愈合研究已取得一定进展,但在临床应用中仍存在诸多问题。已有研究证明,MSCs 可通过分泌细胞因子等促进血管内皮细胞生成,还可通过抗氧化凋亡等多种机制加快创面血管生成,促进难愈性创面愈合[2-4]。多种干细胞培养上清中含有丰富的相关外泌体[5-7]。外泌体通过与细胞融合,把干细胞内的 RNA、蛋白质等生物活性成分传递到周围细胞内发挥作用。微小 RNA(micro RNA,miRNA)是外泌体 RNA 中的主要成分,在研究外泌体功能和机制时受到广泛关注[8]。人羊膜间充质干细胞外泌体(human amnion mesenchymal stem cell exosome,hAMSC-Exo)可以促进创面愈合。有研究表明,miR-135a 可以促进乳腺癌细胞的迁移能力[9],但目前还没有关于其对成纤维细胞作用的报道。因此,本文通过研究 hAMSC-Exo miR-135a 对成纤维细胞的作用,初步探讨 hAMSC 在创面修复中的作用机制。
1. 材料与方法
1.1. 主要细胞、试剂及仪器
BJ 人皮肤成纤维细胞(上海生物化学与细胞生物学研究所);hAMSC 由遵义医学院细胞工程实验室提供。miR-135a mimic、miR-135a inhibitor(上海吉码基因技术有限公司);DMEM 培养基、FBS(GIBCO 公司,美国);Lipofectamine 2000、Trizol、外泌体分离试剂盒(Invitrogen 公司,美国);逆转录试剂盒、荧光定量 PCR 试剂盒[宝生物工程(大连)有限公司];BCA 蛋白浓度测定试剂盒,Western blot 试剂盒(上海碧云天生物技术有限公司);抗大分子肿瘤抑制因子 2(large tumor suppressor 2,LATS2)抗体、抗 E-钙黏着蛋白(E-cadherin)抗体、抗 N-cadherin 抗体、抗 α 平滑肌肌动蛋白(α smooth muscle actin,α-SMA)抗体、抗 CD9 抗体、抗 CD63 抗体和抗 CD81 抗体(Abcam 公司,英国);中性鞘磷脂酶抑制剂(GW4869;上海源叶生物科技有限公司)。纳米颗粒跟踪分析仪(Fritsch 公司,德国);透射电镜(Zeiss 公司,德国)。
1.2. hAMSC-Exos 相关观测
1.2.1. hAMSC-Exos 提取
取 FBS 以 100 000×g 离心 8 h,去除 FBS 中外泌体,取 hAMSC 和 293T 细胞,用含 10%FBS 的 DMEM 培养基于 37℃、5%CO2 培养箱培养。将 hAMSC 以 1×106 个/瓶接种至培养瓶培养,至长满 80% 培养瓶时收集 hAMSC 培养上清,300×g 离心 10 min;收集上清液,以 0.22 μm 过滤器过滤去除细胞碎片。取 hAMSC 培养上清,加入总体积 0.5 倍的外泌体提取试剂,用吸管吹打混匀;4℃ 孵育过夜,10 000×g 离心 1 h;弃上清,管底沉淀即为 hAMSC-Exos,用 30 μL 1×PBS 溶液稀释。BCA 测定外泌体浓度,保存于−80℃ 冰箱,备用。同法提取 293T 细胞外泌体。
1.2.2. hAMSC-Exos 鉴定
透射电镜观察 hAMSC-Exos 形态;Western blot 检测其外泌体表面标志 CD9、CD63 和 CD81 表达,以微管蛋白(α-tubulin)作为参考蛋白,以 hAMSC 作为对照;纳米颗粒跟踪分析仪检测其粒径分布。
1.2.3. hAMSC-Exos 促成纤维细胞迁移检测
用记号笔在 6 孔板背后划横线,将 BJ 人皮肤成纤维细胞以 1×106个/皿接种于 35 mm 培养皿中,在无血清 DMEM 培养基中饥饿 12 h。用枪头比着直尺,尽量垂直于背后的横线划痕。PBS 洗细胞 3 次,实验分为 3 组:A 组用 293T 细胞外泌体 25 μg/mL 刺激 BJ 人皮肤成纤维细胞;B 组用 hAMSC-Exo 25 μg/mL 刺激 BJ 人皮肤成纤维细胞;C 组取 1×106 个/mL hAMSC 接种于细胞培养瓶,加入 10 μmol/L GW4869 后 48 h 提取 hAMSC-Exo,以 25 μg/mL 作用于 BJ 人皮肤成纤维细胞。然后于 37℃、5%CO2 培养箱中培养细胞,分别于 0、24 h 时测量并记录空白区,采用 Image Pro Plus 6.0 软件按以下公式计算细胞迁移率:(0 h 空白区-24 h 空白区)/0 h 空白区×100%。
1.3. miR-135a 对成纤维细胞迁移影响的观测
1.3.1. miR-135a 的过表达和敲减
取 hAMSC 按 1×106 个/孔密度接种于 6 孔板,用含 10%FBS 的 DMEM 培养基培养。次日待细胞密度约为 80% 时,按照试剂盒说明书方法,用 Lipofectamin2000 转染试剂将 miR-135a mimic 或 miR-135a inhibitor 转染 hAMSC。采用超速离心法提取相应细胞上清的外泌体,即可获得过表达以及敲减 miR-135a 的 hAMSC-Exo。
1.3.2. 实时荧光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR)检测
取 293T 细胞外泌体、hAMSC-Exo 和过表达 miR-135a 的 hAMSC-Exo,分别设为 A1、B1、C1 组,使用逆转录试剂盒合成 cDNA,采用 SYBR 绿色 qPCR 法检测各组 miR-135a 基因表达。反应条件:初始变性 95℃、5 min;95℃、10 s,60℃、30 s,45 个循环。用 2−ΔΔCT 法定量分析 miRNA 和 mRNA 的表达水平,分别以 miR-16-5p 和 GAPDH 作为 miRNA 和 mRNA 的内部参照,检测 miR-135a 基因相对表达量。所有反应均设 3 个复孔。
1.3.3. hAMSC-Exos 中 miR-135a 促成纤维细胞迁移检测
同 1.2.3 方法采用细胞划痕实验检测 hAMSC-Exos 中 miR-135a 促成纤维细胞迁移的能力。实验分为 4 组:A2 组将 25 μg/mL 293T 细胞外泌体作用于 BJ 人皮肤成纤维细胞;B2 组将 25 μg/mL hAMSC-Exo 作用于 BJ 人皮肤成纤维细胞;C2 组用过表达 miR-135a 的 hAMSC 提取 hAMSC-Exo,以 25 μg/mL 作用于 BJ 人皮肤成纤维细胞;D2 组用敲减 miR-135a 的 hAMSC 提取 hAMSC-Exo,以 25 μg/mL 作用于 BJ 人皮肤成纤维细胞。分别于 0、24 h 时测量并记录空白区,计算并比较各组细胞迁移率。
1.3.4. Western blot 检测
同 1.3.3 方法分组,分别设为 A3、B3、C3、D3 组,24 h 后提取各组 BJ 人皮肤成纤维细胞总蛋白,采用常规 Western blot 法检测各组 LATS2、E-cadherin、N-cadherin、α-SMA 表达情况,并用 Image lab 软件分析各蛋白相对表达量。
1.4. 统计学方法
采用 Graphpad Prism 7 统计软件进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用 LSD 检验;检验水准 α=0.05。
2. 结果
2.1. hAMSC-Exo 相关观测
2.1.1. 形态观察及鉴定
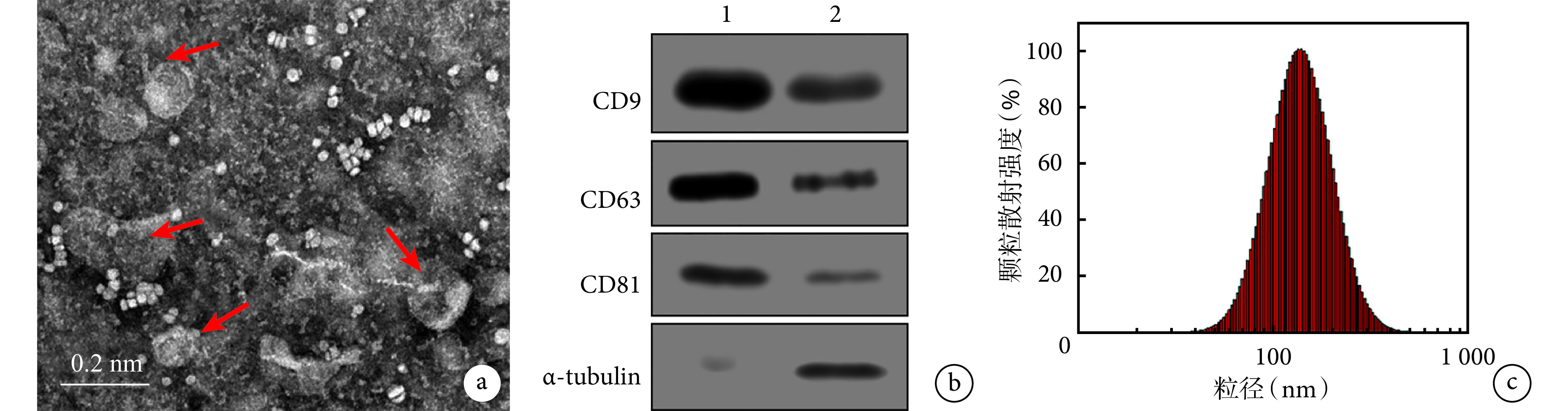
透射电镜观察示,hAMSC-Exo 呈圆形、椭圆形或茶托状,粒径为 30~150 nm。Western blot 检测示,hAMSC-Exo 可见外泌体表面标志 CD9、CD63 和 CD81 呈阳性表达。纳米颗粒跟踪分析仪检测示,90% hAMSC-Exo 粒径分布于 30~150 nm 之间,平均粒径为 103 nm。见图 1。
图 1.
Morphological observation and identification of hAMSC-Exo
hAMSC-Exo 形态观察及鉴定
a. 透射电镜观察(×50 k);b. Western blot 检测 1:hAMSC-Exo 2:hAMSC;c. 纳米颗粒跟踪分析仪检测粒径分布
a. Transmission electron microscope observation (×50 k); b. Western blot analysis 1: hAMSC-Exo 2: hAMSC; c. Particle size distribution detected by Nanoparticle tracking analyzer
2.1.2. hAMSC-Exos 促成纤维细胞迁移检测
细胞迁移 24 h 时,A、B、C 组细胞迁移率分别为 48.87%±3.29%、84.59%±3.18%、62.55%±4.46%,B、C 组显著高于 A 组,B 组高于 C 组,差异均有统计学意义(P<0.05)。见图 2。
图 2.
Scratch test to detect the effect of hAMSC-Exo on the migration of BJ fibroblasts
划痕实验检测 hAMSC-Exo 对 BJ 人皮肤成纤维细胞迁移的影响
上排为 0 h,下排为 24 h a. A 组;b. B 组;c. C 组
The upper row for 0 hour and the lower row for 24 hours a. Group A; b. Group B; c. Group C
2.2. miR-135a 对成纤维细胞迁移影响的观测
2.2.1. qRT-PCR 检测
A1、B1、C1 组 miR-135a 基因相对表达量分别为 1.03±0.46、4.05±0.61、16.15±0.36,B1、C1 组显著高于 A1 组,C1 组显著高于 B1 组,差异均有统计学意义(P<0.05)。
2.2.2. hAMSC-Exos 中 miR-135a 促成纤维细胞迁移检测
细胞迁移 24 h 时,A2、B2、C2、D2 组细胞迁移率分别为 36.35%±3.02%、64.84%±1.09%、90.50%±6.13%、52.56%±1.92%,B2、C2、D2 组显著高于 A2 组,B2、C2 组显著高于 D2 组,C2 组显著高于 B2 组,差异均有统计学意义(P<0.05)。见图 3。
图 3.
Scratch test to detect the effect of miR-135a in hAMSC-Exo on the migration of BJ fibroblasts
划痕实验检测 hAMSC-Exo 中 miR-135a 对 BJ 人皮肤成纤维细胞迁移的影响
上排为 0 h,下排为 24 h a. A2 组;b. B2 组;c. C2 组;d. D2 组
The upper row for 0 hour and the lower row for 24 hours a. Group A2; b. Group B2; c. Group C2; d. Group D2

2.2.3. Western blot 检测
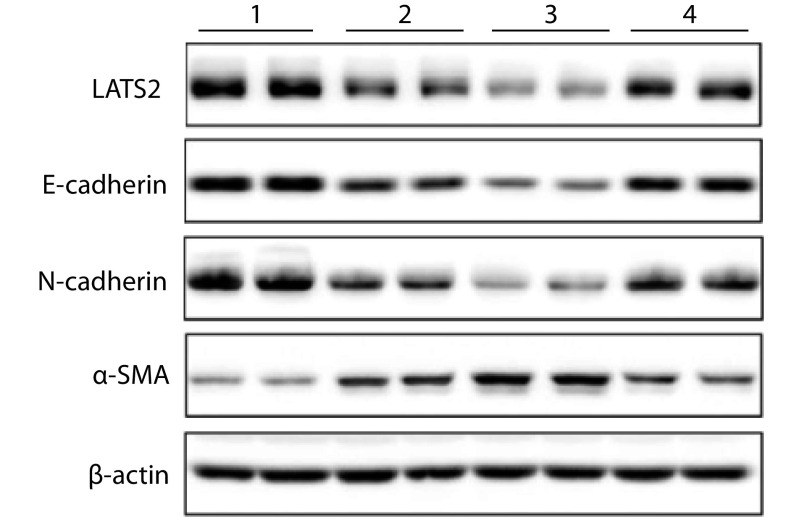
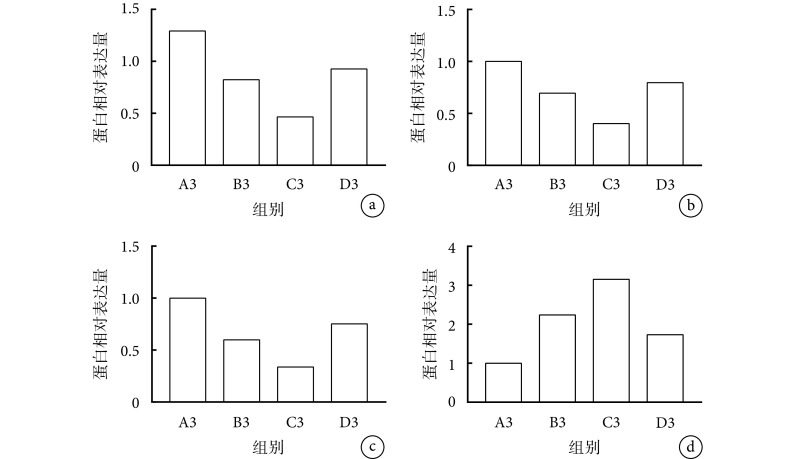
各组外泌体作用于 BJ 人皮肤成纤维细胞 24 h 后,与 A3 组相比,B3、C3、D3 组显著下调成纤维细胞迁移相关蛋白 E-cadherin、N-cadherin 和 LATS2 的表达水平,上调 α-SMA 的表达水平,其中 C3 组的下调或上调作用最为明显;D3 组敲减 miR-135a 后,下调或上调上述蛋白的能力减弱。各组间各蛋白相对表达量比较差异均有统计学意义(P<0.05)。见图 4、5。
图 4.
The effect of miR-135a on the expressions of migration related proteins in fibroblasts detected by Western blot
Western blot 检测各组外泌体中 miR-135a 对 BJ 人皮肤成纤维细胞迁移相关蛋白表达的影响
1:A3 组 2:B3 组 3:C3 组 4:D3 组
1: Group A3 2: Group B3 3: Group C3 4: Group D3
图 5.
The relative expressions of migration related proteins in various fibroblasts detected by Western blot
Western blot 检测各组成纤维细胞迁移相关蛋白相对表达量
a. LATS2;b. E-cadherin;c. N-cadherin;d. α-SMA
a. LATS2; b. E-cadherin; c. N-cadherin; d. α-SMA
3. 讨论
hAMSC 从人羊膜组织中获得,是目前常用的干细胞治疗种子细胞。干细胞通过旁分泌发挥创面修复作用,通过释放生物活性因子调节细胞增殖和迁移功能。外泌体是由细胞分泌的一类重要旁分泌因子,目前研究发现它们在组织修复和再生中起着主导作用[10]。外泌体也被认为是细胞间通讯介质,细胞通过外泌体发挥分泌和转移功能蛋白及 miRNA[11]的作用。研究发现 MSCs 的外泌体可以促进创面修复[5-6]。然而hAMSC-Exo 介导创面修复和愈合的分子机制仍不清楚。
疏松结缔组织中含有大量成纤维细胞,会产生弹性纤维、胶原纤维和网状纤维,在创面愈合中扮演重要角色。研究发现,成纤维细胞可以通过分泌细胞外基质促进肉芽组织形成,成纤维细胞内的微丝和微管可以形成骨架,作为创面修复的纤维支架结构[12]。因此,成纤维细胞的增殖和迁移是创面愈合的关键。GW4869 是一种中性鞘磷脂酶 2 抑制剂,可以抑制鞘磷脂分解成神经酰胺,而神经酰胺能够促进多囊小体的腔内小囊泡形成,驱动外泌体的产生。因此,GW4869 可以抑制中性鞘磷脂酶 2 的活性,损害外泌体囊泡出芽,从而抑制外泌体形成。本研究从细胞划痕实验可以看出,hAMSC 可以促进成纤维细胞迁移,加入外泌体抑制剂 GW4869 后,其促进成纤维细胞迁移的能力明显降低,表明 hAMSC-Exo 在成纤维细胞迁移中扮演重要角色。因此,我们需要进一步探索 hAMSC-Exo 在成纤维细胞迁移中的作用机制。
miRNA 是一类短链非编码 RNA,1 个 miRNA 分子可以调控多个靶基因表达,1 个靶基因也可以被多个 miRNA 分子调控。其中一些 miRNA 在创面愈合和纤维化疾病进展中起重要作用[13]。研究发现,miR-203 和 miR-210 分别通过促进角质形成细胞迁移和增殖来促进创面愈合,而 miR-200 家族则通过抑制角质形成细胞迁移来延迟创面愈合[14-16]。而 miR-135a 可以促进肝癌细胞的迁移[17],但其在成纤维细胞迁移中的作用尚不清楚。
本研究采用划痕实验检测过表达和敲减 miR-135a 后 hAMSC-Exo 对成纤维细胞迁移的影响,结果发现与未修饰的 hAMSC-Exo 相比,过表达 miR-135a 后 hAMSC-Exo 促进成纤维细胞迁移的能力最强,敲减 miR-135a 后,hAMSC-Exo 促进成纤维细胞迁移的能力减弱。说明 hAMSC-Exo 中的 miR-135a 可以促进成纤维细胞增殖和迁移。
E-cadherin、N-cadherin、α-SMA 和 LATS2 是常见的成纤维细胞迁移相关蛋白。Cadherin 家族是 Ca2+依赖的细胞黏附素家族,介导细胞之间相互聚集的黏附分子在 Ca2+辅助下抵抗蛋白酶的水解作用。本实验选择的 E-cadherin 和 N-cadherin,对细胞在生长发育过程中的选择性聚集有重要作用[18]。LATS2 过表达可以抑制细胞增殖、迁移和侵袭。α-SMA 是创面愈合纤维化过程中的重要因子。本实验中 Western blot 检测结果示,与未修饰的 hAMSC-Exo 相比,过表达 miR-135a 后 hAMSC-Exo 可以明显抑制成纤维细胞 E-cadherin、N-cadherin 和 LATS2 表达,促进 α-SMA 表达;敲减 miR-135a 后,hAMSC-Exo 抑制成纤维细胞 E-cadherin、N-cadherin 和 LATS2 表达以及促进 α-SMA 表达能力均减弱。说明 hAMSC-Exo 中的 miR-135a 可以抑制 E-cadherin、 N-cadherin 和 LATS2 表达,促进 a-SMA 表达。
综上述,hAMSC-Exo 可以促进成纤维细胞迁移;miR-135a 在 hAMSC-Exo 促进成纤维细胞迁移过程中发挥关键作用,可以下调 E-cadherin、N-cadherin 和 LATS2 表达和上调 α-SMA 表达。hAMSC-Exo 中 miR-135a 的作用靶点及其在创面愈合中的作用机制有待进一步研究。
作者贡献:陈涛负责文章撰写;陈涛、高绍莹负责实验设计及实施、数据收集整理及统计分析;郝艺、张菲菲、唐修俊负责实验实施;魏在荣、王达利、祁建平对文章的知识性内容作批评性审阅。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。课题经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
Funding Statement
贵州省科技计划项目(黔科合 SY 字[2012]3084 号);国家自然科学基金资助项目(81560315、81560313);贵州省遵义市汇川区科技项目([2015]25)
References
- 1.Powers JG, Higham C, Broussard K, et al Wound healing and treating wounds: Chronic wound care and management. J Am Acad Dermatol. 2016;74(4):607–625. doi: 10.1016/j.jaad.2015.08.070. [DOI] [PubMed] [Google Scholar]
- 2.Schertl P, Volk J, Perduns R, et al Impaired angiogenic differentiation of dental pulp stem cells during exposure to the resinous monomer triethylene glycol dimethacrylate. Dent Mater. 2019;35(1):144–155. doi: 10.1016/j.dental.2018.11.006. [DOI] [PubMed] [Google Scholar]
- 3.Shojaee A, Parham A, Ejeian F, et al Equine adipose mesenchymal stem cells (eq-ASCs) appear to have higher potential for migration and musculoskeletal differentiation. Res Vet Sci. 2019;125:235–243. doi: 10.1016/j.rvsc.2019.06.015. [DOI] [PubMed] [Google Scholar]
- 4.熊佳超, 宋建星 脂肪来源干细胞治疗难愈性创面的研究进展. 中国修复重建外科杂志. 2018;32(4):457–461. [Google Scholar]
- 5.尹刚, 刘蔡钺, 林耀发, 等 脂肪干细胞来源外泌体对周围神经损伤后再生作用的实验研究. 中国修复重建外科杂志. 2018;32(12):1592–1596. doi: 10.7507/1002-1892.201707051. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Melzer C, Rehn V, Yang Y, et al Taxol-loaded MSC-derived exosomes provide a therapeutic vhicle to target metastatic breast cancer and other carcinoma cells. Cancers (Basel) 2019;11(6):pii: E798. doi: 10.3390/cancers11060798. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Zhang X, Liu J, Yu B, et al Effects of mesenchymal stem cells and their exosomes on the healing of large and refractory macular holes. Graefes Arch Clin Exp Ophthalmol. 2018;256(11):2041–2052. doi: 10.1007/s00417-018-4097-3. [DOI] [PubMed] [Google Scholar]
- 8.Yang L, Niu F, Yao H, et al Exosomal miR-9 released from HIV tat stimulated astrocytes mediates microglial migration. J Neuroimmune Pharmacol. 2018;13(3):330–344. doi: 10.1007/s11481-018-9779-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chen Y, Zhang J, Wang H, et al miRNA-135a promotes breast cancer cell migration and invasion by targeting HOXA10. BMC Cancer. 2012;12:111. doi: 10.1186/1471-2407-12-111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Hiwatashi N, Bing R, Kraja I, et al Stem cell-mediated paracrine signaling alters fibroplasia in human vocal fold fibroblasts in vitro . Ann Otol Rhinol Laryngol. 2017;126(8):581–588. doi: 10.1177/0003489417716186. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Yao Z, Qiao Y, Li X, et al Exosomes exploit the virus entry machinery and pathway to transmit alpha interferon-induced antiviral activity. J Virol. 2018;92(24):pii: 1578–1518. doi: 10.1128/JVI.01578-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Hormozi M, Baharvand P Achillea biebersteinni Afan may inhibit scar formation: In vitro study . Mol Genet Genomic Med. 2019;7(5):e640. doi: 10.1002/mgg3.640. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Dangwal S, Stratmann B, Bang C, et al Impairment of wound healing in patients with type 2 diabetes mellitus influences circulating microRNA patterns via inflammatory cytokines. Arterioscler Thromb Vasc Biol. 2015;35(6):1480–1488. doi: 10.1161/ATVBAHA.114.305048. [DOI] [PubMed] [Google Scholar]
- 14.Liu SC, Chuang SM, Hsu CJ, et al CTGF increases vascular endothelial growth factor-dependent angiogenesis in human synovial fibroblasts by increasing miR-210 expression. Cell Death Dis. 2014;5:e1485. doi: 10.1038/cddis.2014.453. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Shi K, Qiu X, Zheng W, et al MiR-203 regulates keloid fibroblast proliferation, invasion, and extracellular matrix expression by targeting EGR1 and FGF2. Biomed Pharmacother. 2018;108:1282–1288. doi: 10.1016/j.biopha.2018.09.152. [DOI] [PubMed] [Google Scholar]
- 16.Aunin E, Broadley D, Ahmed MI, et al Exploring a role for regulatory miRNAs in wound healing during ageing: involvement of miR-200c in wound repair. Sci Rep. 2017;7(1):3257. doi: 10.1038/s41598-017-03331-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Zeng YB, Liang XH, Zhang GX, et al miRNA-135a promotes hepatocellular carcinoma cell migration and invasion by targeting forkhead box O1. Cancer Cell Int. 2016;16:63. doi: 10.1186/s12935-016-0328-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Mohamedi Y, Fontanil T, Cobo T, et al Antitumor potential of fibulin-5 in breast cancer cells depends on its RGD cell adhesion motif. Cell Physiol Biochem. 2019;53(1):87–100. doi: 10.33594/000000123. [DOI] [PubMed] [Google Scholar]