Abstract
Antecedentes/contexto
Existe una tendencia en los pacientes hospitalizados por COVID-19 a desarrollar síntomas persistentes y a presentar una disminución en su calidad de vida tras el ingreso hospitalario.
Métodos
Estudio de cohorte prospectivo de pacientes con COVID-19 con ingreso hospitalario entre el 1 de marzo al 30 de abril de 2020. El objetivo primario fue comparar la calidad de vida relacionada con la salud y la presencia de síntomas persistentes seis meses después del ingreso, comparando los pacientes que requirieron ingreso en UCI con los que no lo precisaron.
Resultados
De los 242 pacientes hospitalizados durante el período de estudio, 44 (18,2%) necesitaron ingreso en UCI. Cuarenta (16,5%) pacientes fallecieron durante el ingreso hospitalario. Doscientos dos (83,5%) pacientes fueron dados de alta del hospital. A los seis meses, 183 (75,6%) pacientes completaron los cuestionarios (32 pacientes UCI y 151 pacientes no UCI). Noventa y seis (52,4%) refirieron disminución de la calidad de vida y 143 (78,1%) describieron síntomas persistentes. Un número mayor de pacientes de UCI mostraron un empeoramiento de su calidad de vida (71,9 vs. 43,7%, p = 0,004). No hubo diferencias en la proporción de pacientes con síntomas persistentes entre los pacientes con UCI y sin UCI (87,5 vs. 76,2%, p = 0,159). Los pacientes de UCI mostraron con mayor frecuencia disnea de esfuerzo (78,1 vs. 47,7%, p = 0,02), disnea de pequeños esfuerzos (37,5 vs. 4,6%, p < 0,001) y astenia (56,3 vs. 29,1%, p = 0,003).
Conclusiones
Los supervivientes de COVID-19 que necesitaron hospitalización presentaron síntomas persistentes y un deterioro de su calidad de vida. Los pacientes de UCI refirieron una mayor disminución de su calidad de vida, en comparación con los pacientes que no precisaron UCI.
Palabras clave: COVID-19, SARS-CoV-2, Pacientes críticos, Dificultad respiratoria aguda (SDRA), Calidad de vida relacionada con la salud, Estado funcional
Abstract
Background
Hospitalized COVID-19 patients are prone to develop persistent symptoms and to show reduced quality of life following hospital admission.
Methods
Prospective cohort study of COVID-19 patients admitted to a hospital from March 1 to April 30, 2020. The primary outcome was to compare health related quality of life and persistent symptoms six months after hospital admission, of COVID-19 patients who required ICU admission with those who did not.
Results
Among the 242 patients hospitalized during the defined period of time, 44 (18.2%) needed ICU admission. Forty (16.5%) patients died during hospital admission. Two hundred and two (83.5%) patients were discharged alive from the hospital. At six months, 183 (75.6%) patients completed the questionnaires (32 ICU patients and 151 non ICU patients). Ninety-six (52.4%) reported decreased quality of life and 143 (78.1%) described persistent symptoms. More ICU patients showed worsening of their quality of life (71.9 vs. 43.7%, P = 0.004). There were no differences in the proportion of patients with persistent symptoms between ICU and non ICU patients (87.5 vs. 76.2%, P = 0.159). ICU patients showed more frequently dyspnea on exertion (78.1 vs. 47.7%, P = 0.02), dyspnea on light exertion (37.5 vs. 4.6%, P < 0.001), and asthenia (56.3 vs. 29.1, P = 0.003).
Conclusions
Survivors of COVID-19 needing hospitalization had persistent symptoms and a decline in the quality of life. ICU patients referred a large decrease of their quality of life compared with non ICU patients.
Keywords: COVID-19, SARS-CoV-2, Critically ill patients, Acute respiratory distress (ARDS), Health-related quality of life, Functional status
Introducción
La COVID-19, infección causada por el virus del síndrome respiratorio agudo severo 2 (SARS-CoV-2), es una enfermedad recientemente conocida que se ha extendido rápidamente por todo el mundo1, 2, 3, 4. El espectro clínico de COVID-19 varía desde casos leves hasta casos muy graves. Aunque la mayoría de los pacientes presentan fiebre, tos, mialgias o fatiga con evolución favorable, algunos pacientes desarrollan disnea e hipoxemia, requiriendo ingreso hospitalario y/o en Unidad de Cuidados Intensivos (UCI). Estudios anteriores han descrito el modo de transmisión, la epidemiología general, la presentación clínica, los posibles tratamientos y los resultados a corto plazo como la mortalidad. Sin embargo, los resultados a largo plazo de los pacientes hospitalizados apenas se han comunicado. Estos pacientes son propensos a desarrollar síntomas persistentes, presentando una reducción de la calidad de vida relacionada con la salud (CVRS) que impacta en su capacidad de autocuidado y de realizar las actividades habituales en los meses posteriores al ingreso hospitalario, especialmente aquellos que ingresaron en UCI. La CVRS se reconoce como un componente importante de los resultados después de la hospitalización, especialmente después del ingreso en cuidados intensivos, y se recomienda que se evalúe de forma sistemática. El objetivo de este estudio fue comparar la CVRS y los síntomas persistentes seis meses después de la hospitalización de pacientes con COVID-19, comparando los que requirieron ingreso en UCI con los que no lo precisaron.
Métodos
Se realizó un estudio de cohortes observacional prospectivo en el Hospital Clínico Universitario de Santiago de Compostela, aprobado por el Comité de Ética de Galicia (CEImG, código 2020-188). Se obtuvo el consentimiento informado de todos los participantes por teléfono. Se incluyeron todos los pacientes adultos ingresados en el hospital entre el 1 de marzo y el 30 de abril de 2020 con infección confirmada por SARS-CoV-2 mediante resultado positivo de la prueba de reacción en cadena de la polimerasa (PCR) de una muestra nasofaríngea. Los resultados clínicos fueron monitorizados hasta el 1 de noviembre de 2020, la fecha del último seguimiento.
Se recogieron edad, sexo, antecedentes personales, tratamientos domiciliarios, valores de laboratorio al ingreso, tratamientos hospitalarios, necesidad de ingreso en la UCI, tratamientos en la UCI, los resultados del ingreso hospitalario, así como los resultados a los seis meses del ingreso.
Todos los supervivientes se incluyeron para evaluar la CVRS, el estado funcional y los síntomas persistentes mediante una entrevista estructurada seis meses después de la hospitalización. Estas encuestas fueron realizadas por investigadores capacitados. La CVRS se evaluó mediante el cuestionario de cinco dominios y tres niveles de la EuroQol Group Association (EQ-5D-3L), que consta de dos secciones: apartado descriptivo y escala visual analógica. El apartado descriptivo mide cinco elementos de la salud, que incluyen: movilidad, autocuidado, actividades habituales, dolor/malestar y ansiedad/depresión y evalúa cada elemento en tres niveles: sin problemas, algunos problemas o problemas graves. Los apartados se transforman a una puntuación (índice EQ-5D), con un rango continuo de -0,59 a 1,00, donde 1,00 indica «salud plena» y 0 representa la «muerte». La escala visual analógica (EQ-VAS) representa 0 = peor salud imaginable y 100 = mejor salud imaginable5, 6, 7. También se interrogó sobre síntomas persistentes potencialmente correlacionados con COVID-19 (disnea de esfuerzo, disnea de pequeños esfuerzos, astenia, apatía, mialgia, artralgia, dolor torácico, anosmia, tos, trastornos del sueño, caída del cabello, pérdida de memoria, alteraciones visuales). Además, se pidió a los pacientes que evaluaran su calidad de vida uno a tres meses antes del ingreso por COVID-19.
El objetivo primario fue comparar la CVRS y la presencia de síntomas persistentes tras seis meses de la hospitalización, entre los pacientes con COVID-19 que requirieron ingreso en la UCI y los que ingresaron en planta.
El objetivo secundario fue determinar los factores asociados con una mala CVRS y una disminución de la capacidad funcional en los pacientes con COVID-19, seis meses después de ser admitidos en el hospital.
Análisis estadístico
Todos los análisis se realizaron mediante R (versión 4.0.2; R Foundation for Statistical Computing) e IBM SPSS (versión 26; SPSS, Inc, Armonk, NY, EE. UU.). Las variables cuantitativas se expresaron como mediana (rango intercuartílico [IQR]) o media (desviación estándar [DE]) y las variables categóricas como número (%). Las medias de las variables continuas se compararon mediante pruebas t no pareadas o pareadas cuando los datos estaban distribuidos normalmente; de lo contrario, se utilizó la U de Mann-Whitney o el test de Wilcoxon. Las proporciones de las variables categóricas se compararon mediante el test de χ2 de Pearson o el test exacto de Fisher, según correspondiese; se utilizó la prueba de McNemar para comparar proporciones con datos emparejados.
Se utilizaron análisis de regresión logística multivariable para determinar los factores antes y durante la hospitalización asociados con un empeoramiento de la calidad de vida en los seis meses posteriores. Los factores significativos identificados en el análisis univariante y las variables clínicamente relevantes se consideraron para su inclusión en los modelos multivariados. Todos los test se realizaron en dos direcciones con un nivel de significación de p < 0,05.
Resultados
De los 242 pacientes incluidos durante el período del estudio, 44 (18,2%) necesitaron ingreso en UCI. No hubo diferencias entre los pacientes que requirieron o no ingreso en UCI en relación con características demográficas, antecedentes médicos o tratamientos domiciliarios (tabla 1 ). En la tabla 1 se muestra la evolución clínica y los tratamientos durante la estancia hospitalaria. Los pacientes de UCI recibieron corticosteroides y tocilizumab con más frecuencia que los pacientes que no ingresaron en la UCI. Entre los 44 pacientes de UCI, la media (DE) de APACHE II fue de 13,09 (4,52), 21 (70,5%) pacientes necesitaron ventilación mecánica y ocho (21,1%) necesitaron traqueostomía. Cuarenta (16,5%) pacientes fallecieron (10 fallecieron en UCI y 30 en planta).
Tabla 1.
Características demográficas, clínicas y tratamientos administrados durante el ingreso hospitalario (No = 242)
| Características | ||||
|---|---|---|---|---|
| Demográficas | Todos los pacientes hospitalizados No = 242 |
Pacientes UCI No = 44 |
Pacientes no UCI No = 198 |
Valor p |
| Edad, mediana (DE) | 65,94 (14,08) | 66,07 (11,17) | 65,91 (14,68) | 0,987 |
| Edad, No. (%) | ||||
| < 50 | 32 (13,2) | 5 (11,4) | 27 (13,6) | 0,710 |
| 50-70 | 113 (46,7) | 23 (52,3) | 90 (45,5) | |
| > 70 | 97 (40,1) | 16 (36,4) | 81 (40,9) | |
| Sexo masculino, No. (%) | 144 (59,5) | 19 (43,2) | 79 (39,9) | 0,688 |
| Enfermedades coexistentes, No. (%) | ||||
| Hipertensión | 107 (44,2) | 22 (50,0) | 85 (42,9) | 0,393 |
| Hiperlipidemia | 90 (37,2) | 13 (29,5) | 77 (38,9) | 0,246 |
| Obesidad (BMI ≥ 30 kg/m2) | 70 (28,9) | 13 (29,5) | 57 (28,8) | 0,920 |
| Diabetes | 52 (21,6) | 12 (27,3) | 40 (20,3) | 0,310 |
| Enfermedad pulmonar crónica | 44 (18,2) | 6 (13,6) | 38 (19,2) | 0,387 |
| Enfermedad cardiaca crónica | 32 (13,2) | 7 (15,9) | 25 (12,6) | 0,561 |
| Tratamientos domiciliarios, No. (%) | ||||
| IECA | 26 (10,7) | 8 (18,2) | 18 (9,1) | 0,103 |
| Anticoagulantes | 21 (8,7) | 4 (9,1) | 17 (8,6) | 0,999 |
| Antiagregantes plaquetarios | 29 (12,0) | 2 (4,5) | 27 (13,6) | 0,093 |
| Estatinas | 90 (37,2) | 13 (29,5) | 77 (38,9) | 0,246 |
| Parámetros de laboratorio, mediana (IQR) | ||||
| Linfocitos/μL | 800,00 (560,00-1.250,00) | 510,00 (380,00-800,00) | 940,00 (630,00-1.360,00) | < 0,001 |
| Lactato deshidrogenasa, U/L | 344,00 (250,50-493,50) | 419,00 (298,75-748,50) | 322,00 (241,00-427,50) | < 0,001 |
| Dímero D, ng/mL | 719,50 (445,50-1.261,75) | 996,50 (603,75-1.509,00) | 653,50 (413,50-1.148,75) | 0,004 |
| Proteína C reactiva, mg/L | 7,00 (3,08-13,00) | 13,00 (6,70-16,99) | 6,28 (2,74-11,00) | < 0,001 |
| Procalcitonina, ng/mL | 0,11 (0,07-0,20) | 0,13 (0,10-0,66) | 0,10 (0,06-0,18) | 0,007 |
| Ferritina sérica, μg/L | 548,00 (320,00-1.161,00) | 1.179,50 (504,00-920,00) | 505,00 (258,50-937,50) | < 0,001 |
| Tratamientos médicos hospitalarios, No. (%) | ||||
| Lopinavir-ritonavir | 206 (85,5) | 41 (95,3) | 165 (83,3) | 0,043 |
| Hidroxicloroquina | 232 (96,3) | 41 (95,3) | 191 (96,5) | 0,664 |
| Azitromicina | 218 (90,8) | 39 (92,9) | 179 (90,4) | 0,774 |
| Tocilizumab | 31 (12,8) | 22 (50,0) | 9 (4,5) | < 0,001 |
| Corticosteroides | 91 (37,6) | 40 (90,9) | 51 (25,8) | < 0,001 |
| Características durante la hospitalización | ||||
| Exitus durante estancia en UCI, No. (%) | 10 (4,1) | 10 (22,7) | ||
| Exitus durante hospitalización, No. (%) | 30 (12,4) | 11 (25,0) | 29 (14,6) | 0,094 |
| Estancia hospitalaria, días mediana (IQR) | 10,00 (7,00-17,00) | 28,00 (18,00-43,00) | 9,00 (7,00-12,75) | < 0,001 |
| Ventilación invasiva, No. (%) | 31 (12,8) | 31 (70,5) | ||
| Traqueotomizados, No. (%) | 8 (3,3) | 8 (21,1) | ||
| Duración de la VM, días, mediana (IQR) | 8,50 (0,00-18,00) | 8,50 (0,00-18,00) | ||
| Estancia en UCI, días, mediana (IQR) | 13,00 (7,25-30,50) | 13,00 (7,25-30,50) | ||
| APACHE II, media (DE) | 13,09 (4,52) | 13,09 (4,52) | ||
| Características, No. (%) | ||||
| Reingresos | 19 (8,3) | 6 (13,6) | 13 (7,0) | 0,217 |
| Fallecidos tras alta hospitalaria | 5 (2,1) | 1 (2,3) | 4 (2,0) | 0,999 |
| Fallecidos a los 6 meses | 45 (18,6) | 12 (27,3) | 33 (16,7) | 0,089 |
Datos están representados como número (porcentaje), mediana (rango intercuartílico) o media (desviación estándar).
IECA: inhibidor de la enzima convertidora de la angiotensina; BMI: índice de masa corporal; APACHE II: Acute Physiology and Chronic Health disease Classification System II; IQR: rango intercuartílico; DE: desviación estándar.
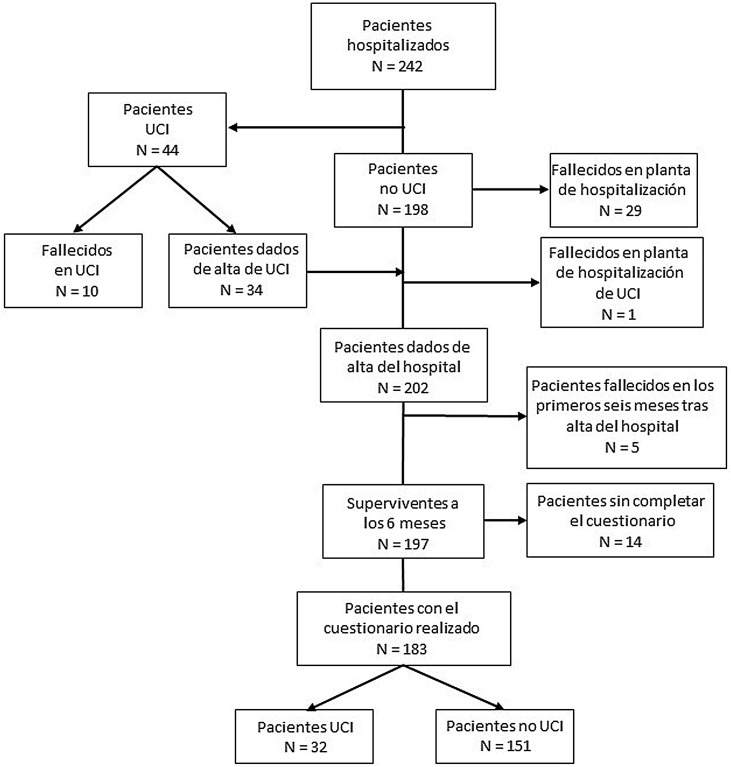
Doscientos dos pacientes sobrevivieron al ingreso hospitalario. A los seis meses, 183 pacientes completaron los cuestionarios de calidad de vida (32 que necesitaron ingreso en UCI y 151 que no). En la figura 1 se muestra un diagrama de flujo de la población de estudio.
Figura 1.
Flujo de pacientes del estudio.
Los resultados de la calidad de vida (5Q-3D-3L) en la entrevista a los seis meses se detallan en la tabla 2 y la tabla 3 . Noventa y seis (52,4%) pacientes refirieron empeoramiento en al menos una de las cinco dimensiones estudiadas en el EQ-5D-3L y 44 (24%) pacientes refirieron empeoramiento en dos o más dimensiones. Los problemas notificados con mayor frecuencia fueron ansiedad/depresión (37,7%) y dolor/malestar (35%). Las mujeres refirieron más problemas en las actividades habituales (25 vs. 12,1%, p = 0,024), dolor/malestar (45,2 vs. 26,3%, p = 0,007) y ansiedad/depresión (53,6 vs. 24,2%, p < 0,001) que los hombres. La necesidad de ventilación mecánica durante el ingreso hospitalario se asoció con un empeoramiento de la movilidad (63,6 vs. 17,4%; p < 0,001), realización de actividades habituales (40,9 vs. 14,9%, p = 0,006), dolor/malestar (59,1 vs. 31,7%, p = 0,011) y ansiedad/depresión (68,2 vs. 33,5%, p = 0,002). La edad, la duración de la estancia hospitalaria y la necesidad de ingreso en la UCI se asociaron con un empeoramiento en las cinco dimensiones estudiadas.
Tabla 2.
Calidad de vida y estado funcional de los pacientes estudiados (No = 183)
|
Calidad de vida (EQ-5D-3L) Características: |
Antes de la COVID-19 No = 183 |
6 meses tras COVID-19 No = 183 |
Valor p |
Antes de la COVID-19 |
6 meses tras COVID-19 |
||||
|---|---|---|---|---|---|---|---|---|---|
| Pacientes UCI No = 32 |
Pacientes No UCI No = 151 |
Valor p | Pacientes UCI No = 32 |
Pacientes No UCI No = 151 |
Valor p | ||||
| Movilidad | |||||||||
| Sin problemas | 169 (92,3) | 141 (77,0) | < 0,001 | 31 (96,9) | 138 (91,4) | 0,470 | 13 (40,6) | 128 (84,8) | < 0,001 |
| Algunos problemas/Incapacidad para caminar | 14 (7,7) | 42 (17,4) | 1 (3,1) | 13 (8,6) | 19 (59,4) | 23 (15,2) | |||
| Cuidado personal | |||||||||
| Sin problemas | 177 (96,7) | 170 (92,9) | 0,016 | 32 (100,0) | 145 (96,0) | 0,592 | 27 (84,4) | 143 (94,7) | 0,054 |
| Algunos problemas/Incapacidad para lavarse o vestirse | 6 (3,3) | 13 (7,1) | 0 (0,0) | 6 (4,0) | 5 (15,6) | 8 (5,3) | |||
| Actividades habituales | |||||||||
| Sin problemas | 176 (96,2) | 150 (82,0) | < 0,001 | 32 (100,0) | 144 (95,4) | 0,608 | 20 (62,5) | 130 (86,1) | 0,002 |
| Algunos problemas/Incapacidad para realizar | 7 (3,8) | 33 (18,0) | 0 (0,0) | 7 (4,6) | 12 (37,5) | 21 (13,9) | |||
| Dolor o disconfort | |||||||||
| No dolor o disconfort | 165 (90,2) | 119 (65,0) | < 0,001 | 31 (9,9) | 134 (88,7) | 0,206 | 15 (46,9) | 104 (68,9) | 0,018 |
| Algo o extremo dolor o disconfort | 18 (9,8) | 64 (35,0) | 1 (3,1) | 17 (11,3) | 17 (53,1) | 47 (31,1) | |||
| Ansiedad o depresión | |||||||||
| No ansiedad o depresión | 171 (93,4) | 114 (62,3) | < 0,001 | 32 (100,0) | 139 (92,1) | 0,130 | 12 (37,5) | 102 (67,5) | 0,001 |
| Moderada o extremadamente ansioso o depresivo | 12(6,6) | 69 (37,7) | 0 (0,0) | 12 (7,9) | 20 (62,5) | 49 (32,5) | |||
| Índice EQ-5D | 0,9474 (0,1306) | 0,8074 (0,2173) | < 0,001 | 0,9859 (0,0554) | 0,9392 (0,1402) | 0,059 | 0,6724 (0,2504) | 0,8360 (0,1991) | < 0,001 |
| EQ-VAS (0-100) | 85,81 (14,74) | 72,51 (18,85) | < 0,001 | 87,81 (10,08) |
85,38 (15,55) | 0,887 | 60,13 (14,70) |
75,09 (18,65) |
< 0,001 |
Los datos están representados como n (%) o media (DE). La calidad de vida fue valorada con la EuroQol, cinco dimensiones, cuestionario de tres niveles (EQ-5D-3L), el índice EQ-5D y la EQ-VAS (0-100). Valores en negrita son estadísticamente significativos.
Tabla 3.
Porcentaje de pacientes que describieron algún problema en las cinco dimensiones de la EQ-5D-3L
| Movilidad |
Cuidado personal |
Actividades habituales |
Dolor o disconfort |
Ansiedad o depresión |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Problemas o incapaz | p | Problemas o incapaz | p | Problemas o incapaz | p | Algo o extremo | p | Moderado o extremo | p | ||
| Sexo: | Hombre | 19 (19,2) | 0,189 | 7 (7,1) | 0,985 | 12 (12,1) | 0,024 | 26 (26,3) | 0,007 | 24 (24,2) | < 0,001 |
| Mujer | 23 (27,4) | 6 (7,1) | 21 (25,0) | 38 (45,2) |
45 (53,6) |
||||||
| UCI | UCI | 19 (59,4) | < 0,001 | 5 (15,6) | 0,039 | 12 (37,5) | 0,002 | 17 (53,1) | 0,018 | 20 (62,5) | 0,001 |
| No UCI | 23 (15,2) | 8 (5,3) | 21 (37,5) | 47 (31,1) |
49 (32,5) |
||||||
| Comorbilidad | No | 16 (21,9) | 0,787 | 3 (4,1) | 0,199 | 12 (16,4) | 0,648 | 24 (32,9) | 0,628 | 28 (38,4) | 0,882 |
| Sí | 26 (23,6) | 10 (9,1) | 21 (19,1) | 40 (36,4) |
41 (37,3) | ||||||
| Obesidad | No | 31 (23,3) | 0,851 | 9 (6,8) | 0,753 | 26 (19,5) | 0,384 | 45 (33,8) | 0,599 | 50 (37,6) | 0,960 |
| Sí | 11 (22,0) | 4 (8,0) | 7 (14,0) | 19 (38,0) |
19 (38,0) | ||||||
| Hipertensión | No | 26 (24,5) | 0,552 | 6 (5,7) | 0,372 | 20 (18,9) | 0,730 | 35 (33,0) | 0,516 | 41 (38,7) | 0,750 |
| Sí | 16 (20,8) | 7 (9,1) | 13 (16,9) | 29 (37,7) |
28 (36,4) | ||||||
| Diabetes | No | 33 (21,9) | 0,388 | 10 (6,6) | 0,467 | 26 (17,2) | 0,480 | 50 (33,1) | 0,201 | 59 (39,1) | 0,476 |
| Sí | 9 (29,0) | 3 (9,7) | 7 (22,6) | 14 (45,2) |
10 (32,3) | ||||||
| Enfermedad cardiaca | No | 39 (23,4) | 0,676 | 11 (6,6) | 0,317 | 30 (18,0) | 0,999 | 58 (34,7) |
0,824 | 63 (37,7) | 0,986 |
| Sí | 3 (18,8) | 2 (12,5) | 3 (18,8) | 6 (37,5) | 6 (37,5) |
||||||
| Enfermedad pulmonar | No | 37 (23,7) | 0,553 | 10 (6,4) | 0,412 | 28 (17,9) | 0,999 | 54 (34,6) |
0,808 | 59 (37,8) | 0,938 |
| Sí | 5 (18,5) | 3 (11,1) | 5 (18,5) | 10 (37,0) |
10 (37,0) | ||||||
| Ventilación mecánica | No | 28 (17,4) | < 0,001 | 9 (5,6) | 0,054 | 24 (14,9) | 0,006 | 51 (31,7) |
0,011 | 54 (33,5) | 0,002 |
| Sí | 14 (63,6) | 4 (18,2) | 9 (40,9) | 13 (59,1) |
15 (68,2) | ||||||
| Edad, media (DE) | 67,19 (11,05) | 0,023 | 70,31 (9,94) |
0,026 | 68,24 (11,15) | 0,009 | 64,25 (12,81) |
0,436 | 63,22 (13,60) | 0,698 | |
| Estancia hospitalaria, mediana (IR) | 18,0 (8,0-36,75) |
< 0,001 | 20,0 (12,5-68,0) |
0,001 | 17,0 (11,0-37,5) |
< 0,001 | 12,0 (8,0-20,0) |
0,003 | 12,0 (8,0-20,0) |
0,005 | |
Datos están representados como número (porcentaje [%]), mediana (rango intercuartílico [IQR]), o media (desviación estándar [DE]).
UCI: Unidad de Cuidados Intensivos. Valores en negrita son estadísticamente significativos.
Los pacientes de UCI tuvieron una calidad de vida (índice EQ-5D y puntuación EQ-VAS) significativamente menor que los pacientes que no precisaron UCI (tabla 2). Más pacientes de UCI mostraron empeoramiento en al menos una de las cinco dimensiones estudiadas (71,9 vs. 43,7%, p = 0,004), o en dos o más dimensiones (59,4 vs. 16,6%, p < 0,001) (Tabla 4, Tabla 5 ).
Tabla 4.
Síntomas persistentes seis meses tras COVID-19 en los pacientes a estudio (n = 183)
| Síntomas persistentes a los 6 meses tras COVID-19 | Pacientes No = 183 |
Pacientes UCI No = 32 |
Pacientes no UCI No = 151 |
Valor p |
|---|---|---|---|---|
| Pacientes con algún síntoma | 143 (78,1) | 28 (87,5) | 115 (76,2) | 0,159 |
| Un síntoma | 27 (18,9) | 4 (14,3) | 23 (20,0) | 0,680 |
| Dos síntomas | 29 (20,3) | 5 (17,9) | 24 (20,9) | |
| Tres o más síntomas | 87 (60,8) | 19 (67,9) | 68 (59,1) | |
| Disnea de gran esfuerzo | 97 (53,0) | 25 (78,1) | 72 (47,7) | 0,002 |
| Disnea de ligero esfuerzo | 19 (10,4) | 12 (37,5) | 7 (4,6) | < 0,001 |
| Astenia | 62 (33,9) | 18 (56,3) | 44 (29,1) | 0,003 |
| Apatía | 33 (18,0) | 6 (18,8) | 27 (17,9) | 0,908 |
| Mialgias | 54 (29,5) | 11 (34,4) | 43 (28,5) | 0,506 |
| Artralgias | 55 (30,1) | 10 (31,3) | 45 (29,8) | 0,871 |
| Dolor de pecho | 15 (8,2) | 0 (0,0) | 15 (9,9) | 0,077 |
| Anosmia | 19 (10,4) | 3 (9,4) | 16 (10,6) | 0,999 |
| Tos | 23 (12,7) | 4 (12,9) | 19 (12,7) | 0,999 |
| Trastorno del sueño | 56 (30,6) | 6 (18,8) | 50 (33,1) | 0,109 |
| Caída de pelo | 56 (30,6) | 10 (31,3) | 46 (30,5) | 0,930 |
| Pérdida de memoria | 48 (26,2) | 7 (21,9) | 41 (27,2) | 0,538 |
| Alteraciones visuales | 10 (5,5) | 1 (3,1) | 9 (6,0) | 0,999 |
Datos están representados como número (porcentaje). Valores en negrita son estadísticamente significativos.
Tabla 5.
Análisis de regresión logística multivariable relacionado con las cinco dimensiones de la escala EQ-5D-3L, y factores que influyen
| Dimensiones de la EQ-5D-3L | β | se (β) | Valor p | OR | IC 95% (OR) | |
|---|---|---|---|---|---|---|
| Movilidad (algo de problemas/imposibilidad) | Sexo masculino | 0,366 | 0,411 | 0,373 | 1.442 | 0.644-3.228 |
| Edad | 0,038 | 0,019 | 0,041 | 1.039 | 1.001-1.077 | |
| Duración estancia hospitalaria | 0,051 | 0,021 | 0,015 | 1.053 | 1.009-1.097 | |
| Comorbilidad | -0,361 | 0,442 | 0,413 | 0,697 | 0,293-1.656 | |
| Necesidad de ingreso en UCI | 1.015 | 0,618 | 0,100 | 2.760 | 0,822-9.262 |
|
| Cuidado personal (algo de problema/imposibilidad) | Sexo masculino | -0,049 | 0,695 | 0,944 | 0,952 | 0,244-3.714 |
| Edad | 0,047 | 0,032 | 0,137 | 1.048 | 0,985-1.114 | |
| Duración estancia hospitalaria | 0,111 | 0,037 | 0,003 | 1.117 | 1.038-1.201 | |
| Comorbilidad | 0,104 | 0,803 | 0,897 | 1.109 | 0,229-5.357 | |
| Necesidad de ingreso en UCI | -2.949 | 1,840 | 0,109 | 0,052 | 0,001-1.930 |
|
| Actividades habituales (algo de problema/ imposibilidad) | Sexo masculino | 0,960 | 0,454 | 0,034 | 2.613 | 1.074-6.355 |
| Edad | 0,040 | 0,020 | 0,048 | 1.040 | 10.004-1.082 | |
| Duración estancia hospitalaria | 0,074 | 0,023 | 0,001 | 1.077 | 1.029-1.125 | |
| Comorbilidad | -0,176 | 0,475 | 0,711 | 0,839 | 0,330-2.126 | |
| Necesidad de ingreso en UCI | -0,702 | 0,806 | 0,384 | 0,496 | 0,102-2.406 |
|
| Dolor/disconfort (algo o extremo) | Sexo masculino | 0,885 | 0,335 | 0,008 | 2.424 | 1.257-4.670 |
| Edad | 0,005 | 0,014 | 0,730 | 1.005 | 0.978-1.031 | |
| Duración de estancia hospitalaria | 0,041 | 0,018 | 0,021 | 1.042 | 1.006-1.079 | |
| Comorbilidad | 0,116 | 0,354 | 0,743 | 1.123 | 0,560-2.249 | |
| Necesidad de ingreso en UCI | -0,144 | 0,591 | 0,808 | 0,866 | 0,271-2.759 |
|
| Ansiedad/Depresión (moderado o extremo) | Sexo masculino | 1.320 | 0,339 | 0,000 | 3.744 | 1.925-7.280 |
| Edad | -0,004 | 0,014 | 0,770 | 0,996 | 0,969-1.022 | |
| Duración de estancia hospitalaria | 0,029 | 0,018 | 0,098 | 1.030 | 0,994-1.065 | |
| Comorbilidad | 0,040 | 0,357 | 0,911 | 1.040 | 0,517-2.093 | |
| Necesidad de ingreso en UCI | 0,549 | 0,586 | 0,349 | 1.731 | 0,548-5.464 | |
Calidad de vida fue medida usando la escala EuroQol, cinco dimensiones, cuestionario de tres niveles (EQ-5D-3), el EQ-5D index y la EQ-VAS (0-100).
Valores en negrita son estadísticamente significativos.
Discusión
En este estudio de cohortes de pacientes que precisaron hospitalización por COVID-19 observamos una disminución en su calidad de vida a los seis meses de seguimiento. Se evidenció una mayor caída en la calidad de vida entre los que precisaron ingreso en UCI. Se encontraron con frecuencia síntomas persistentes como disnea de esfuerzo, astenia, mialgias, caída del cabello y trastornos del sueño.
Nuestros hallazgos son similares a los existentes en estudios de seguimiento a largo plazo de supervivientes de síndrome de distrés respiratorio agudo (SDRA) debido a otras etiologías, como influenza A (H1N1)8, u otras enfermedades por coronavirus9, 10, 11, 12, 13.
Tras el síndrome respiratorio agudo severo (SARS) en 2002, y el síndrome respiratorio de Oriente Medio (MERS) en 2012, los problemas observados a largo plazo fueron la reducción de la CVRS, problemas respiratorios, debilidad muscular, fatiga, dolor y depresión10, 11, 12, 13, 14, 15.
Una gran preocupación entre la población general son los posibles síntomas de COVID-19 a largo plazo. Recientemente se ha descrito un nuevo término, «long COVID»16, para describir la enfermedad en personas que se han recuperado de COVID-19, pero aún presentan efectos a largo plazo de la infección o han tenido los síntomas habituales mucho más tiempo de lo esperado. Tenforde et al.17, en una encuesta telefónica multiestatal de adultos con COVID-19 sintomáticos no hospitalizados, mostró que el 35% de los pacientes no habían regresado a su estado de salud habitual cuando fueron entrevistados dos a tres semanas después de la infección, presentando una enfermedad prolongada y síntomas persistentes. La fatiga (71%), la tos (61%) y el dolor de cabeza (61%) fueron los síntomas recogidos con mayor frecuencia. En otro estudio con un seguimiento de 60 días, Carfi et al.18 informó que el 87% de los pacientes dados de alta del hospital tras COVID-19 todavía experimentaban al menos un síntoma 60 días después del inicio de la enfermedad. La fatiga (53%), la disnea (43%) y el dolor articular (27%) fueron los síntomas más frecuentes.
El período de seguimiento de los pacientes con COVID-19 en estos dos estudios fue de 14 a 21 días y 60 días. En nuestra investigación se seleccionó período de seguimiento más largo. Además de la persistencia de los síntomas, se estudió la CVRS de los pacientes hospitalizados por COVID-19. Encontramos que estos pacientes tenían una CVRS reducida y los pacientes que requerían UCI informaron una calidad significativamente menor, en comparación con los pacientes que fueron hospitalizados en plantas de hospitalización general. Existen posibles factores de riesgo en los pacientes de UCI que afectan negativamente la calidad de vida, como la edad, las comorbilidades, la ventilación mecánica prolongada, la estancia en UCI o en el hospital, la disminución de la movilidad, el delirio o la depresión, la desnutrición y el uso de relajantes musculares o corticoides. Los corticosteroides, que han demostrado contribuir a reducir la mortalidad en la respuesta inflamatoria en pacientes con COVID-1919, 20, se han utilizado en nuestros pacientes en UCI (91%), más que en aquellos que no requirieron ingreso en UCI (26%). Estudios previos han demostrado que los corticosteroides inducen miopatía, atrofia muscular y debilidad un año después de la hospitalización21, 22, y esto puede resultar en una reducción significativa de la calidad de vida en los supervivientes de la UCI. Se desconoce el efecto acumulativo de dichos factores sobre la CVRS y podría ser el objetivo de futuras investigaciones. Nuestro estudio respalda los hallazgos de otros estudios que informan de malos resultados funcionales a largo plazo en pacientes críticamente enfermos23, 24; sin embargo, hemos encontrado pocos estudios en la literatura que comparen la CVRS de los pacientes después de estar en una UCI o en una planta de hospitalización por la misma enfermedad13, 25. Batawi et al.13 estudiaron la CVRS de los supervivientes de MERS que requirieron hospitalización y observaron que, un año después del diagnóstico, los pacientes que necesitaron ingreso en la UCI presentaron una menor CVRS que los pacientes que no la necesitaron. Tøien K et al.25 mostraron que los pacientes traumatizados ingresados ??en la UCI por más de 24 h tenían puntuaciones más bajas en su CVRS, en comparación con los pacientes que no lo precisaban. Sin embargo, en el estudio de Feemster et al.26 no se encontraron estas diferencias al comparar la CVRS en tres grupos de pacientes: no hospitalizados, hospitalizados e ingresados ??en UCI, y observaron que la hospitalización se asoció con un mayor riesgo de deterioro de la CVRS después del alta sin encontrar diferencias entre los pacientes UCI y no UCI.
Limitaciones del estudio
El presente estudio tiene varias limitaciones. Primero, es un estudio de un solo centro con un número limitado de pacientes. Es posible que los resultados no reflejen la experiencia o los resultados de los pacientes con COVID-19 en otras regiones o países. En segundo lugar, se pidió a los pacientes seis meses después de ser hospitalizados que evaluaran su calidad de vida uno a tres meses antes de la COVID-19, y no sabemos si estos datos pueden estar influenciados por la situación clínica en el momento de la encuesta. Sin embargo, se realizó una evaluación de la CVRS y se encontró una asociación significativa con EQ- VAS y en el índice EQ-5D. En tercer lugar, se evaluó la CVRS y la persistencia de síntomas a los seis meses de la hospitalización, porque suponemos que los problemas de salud al ingreso se estabilizaron a los seis meses y la mortalidad más allá de esta fecha puede ser causada por otros factores. Sería importante evaluar estos datos al año y a los cinco años de la hospitalización, ya que varios autores demostraron alteraciones en la CVRS después de ese tiempo22, 27. Un estudio de cohorte multicéntrico más amplio de pacientes con COVID-19 de España y otros países ayudaría a definir mejor la calidad de vida y los síntomas persistentes en los meses o años posteriores al ingreso hospitalario.
Conclusiones
En este estudio de cohorte prospectivo de pacientes hospitalizados con COVID-19, una gran proporción de pacientes presentaba síntomas persistentes y una calidad de vida reducida a los seis meses. Los pacientes de UCI presentaron una mayor disminución de su calidad de vida, en comparación con los pacientes que no precisaron UCI. Los síntomas persistentes fueron frecuentes, tanto en los pacientes ingresados en la UCI como en los ingresados en planta. Nuestros datos sugieren que se necesitan intervenciones para mejorar la CVRS después de la COVID-19, incluido el seguimiento telefónico, los programas de rehabilitación después del alta hospitalaria o las consultas sobre el dolor.
Código de ensayo clínico
El Comité de Ética de Galicia, España, (código núm. 2020-188).
Financiación
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores muestran su agradecimiento a los médicos y enfermeras de los hospitales participantes.
Bibliografía
- 1.Zhu N., Zhang D., Wang W., Li X., Yang B., Song J., et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020;382:727–733. doi: 10.1056/NEJMoa2001017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Wu C., Chen X., Cai Y., Xia J., Zhou X., Xu S., et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan China. JAMA Intern Med. 2020;180:934–943. doi: 10.1001/jamainternmed.2020.0994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Grasselli G., Zangrillo A., Zanella A., Antonelli M., Cabrini L., Castelli A., et al. Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region Italy. JAMA. 2020;323:1574–1581. doi: 10.1001/jama.2020.5394. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Taboada M., Rama P., Pita-Romero R., Moreno E., Leal S., Varela M., et al. Critically ill COVID-19 patients attended by anesthesiologists in northwestern Spain: a multicenter prospective observational study. Rev Esp Anestesiol Reanim. 2021;68:10–20. doi: 10.1016/j.redar.2020.08.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.EuroQol Group EuroQol--a new facility for the measurement of health-related quality of life. Health Policy. 1990;16:199–208. doi: 10.1016/0168-8510(90)90421-9. [DOI] [PubMed] [Google Scholar]
- 6.Rabin R., de Charro F. EQ-5D: a measure of health status from the EuroQol Group. Ann Med. 2001;33:337–343. doi: 10.3109/07853890109002087. [DOI] [PubMed] [Google Scholar]
- 7.Klok F.A., Boon G.J.A.M., Barco S., Endres M., Miranda Geelhoed J.J., Knauss S., et al. The Post-COVID-19 Functional Status scale: a tool to measure functional status over time after COVID-19. Eur Respir J. 2020;56 doi: 10.1183/13993003.01494-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Luyt C.E., Combes A., Becquemin M.H., Beigelman-Aubry C., Hatem S., Brun A.L., et al. Long-term outcomes of pandemic 2009 influenza A(H1N1)-associated severe ARDS. Chest. 2012;142:583–592. doi: 10.1378/chest.11-2196. [DOI] [PubMed] [Google Scholar]
- 9.Ahmed H., Patel K., Greenwood D.C., Halpin S., Lewthwaite P., Salawu A., et al. Long-term clinical outcomes in survivors of severe acute respiratory syndrome and Middle East respiratory syndrome coronavirus outbreaks after hospitalisation or ICU admission: A systematic review and meta-analysis. J Rehabil Med. 2020;52:jrm00063. doi: 10.2340/16501977-2694. [DOI] [PubMed] [Google Scholar]
- 10.Tansey C.M., Louie M., Loeb M., Gold W.L., Muller M.P., de Jager J.A., et al. One-year outcomes and health care utilization in survivors of severe acute respiratory syndrome. Arch Intern Med. 2007;167:1312–1320. doi: 10.1001/archinte.167.12.1312. [DOI] [PubMed] [Google Scholar]
- 11.Hui D.S., Wong K.T., Ko F.W., Tam L.S., Chan D.P., Woo J., et al. The 1-year impact of severe acute respiratory syndrome on pulmonary function, exercise capacity, and quality of life in a cohort of survivors. Chest. 2005;128:2247–2261. doi: 10.1378/chest.128.4.2247. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Hui D.S., Joynt G.M., Wong K.T., Gomersall C.D., Li T.S., Antonio G., et al. Impact of severe acute respiratory syndrome (SARS) on pulmonary function, functional capacity and quality of life in a cohort of survivors. Thorax. 2005;60:401–409. doi: 10.1136/thx.2004.030205. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Batawi S., Tarazan N., Al-Raddadi R., Al Qasim E., Sindi A., Al Johni S., et al. Quality of life reported by survivors after hospitalization for Middle East respiratory syndrome (MERS) Health Qual Life Outcomes. 2019;17:101. doi: 10.1186/s12955-019-1165-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Lee S.H., Shin H.S., Park H.Y., Kim J.L., Lee J.J., Lee H., et al. Depression as a mediator of chronic fatigue and posttraumatic stress symptoms in middle east respiratory syndrome survivors. Psychiatry Investig. 2019;16:59–64. doi: 10.30773/pi.2018.10.22.3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Lam M., Wing Y., Yu M., Leung C.M., Ma R.C.W., Kong A.P.S., et al. Mental morbidities and chronic fatigue in severe acute respiratory syndrome survivors: Long-term follow-up. Arch Intern Med. 2009;169:2142–2147. doi: 10.1001/archinternmed.2009.384. [DOI] [PubMed] [Google Scholar]
- 16.Mahase E. Covid-19: What do we know about «long covid»? BMJ. 2020;370:m2815. doi: 10.1136/bmj.m2815. [DOI] [PubMed] [Google Scholar]
- 17.Tenforde M.W., Kim S.S., Lindsell C.J., Billig Rose E., Shapiro N.I., Files D.C., et al. Symptom Duration and Risk Factors for Delayed Return to Usual Health Among Outpatients with COVID-19 in a Multistate Health Care Systems Network — United States, March–June 2020. MMWR Morb Mortal Wkly Rep. 2020;69:993–998. doi: 10.15585/mmwr.mm6930e1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Carfì A., Bernabei R., Landi F., Gemelli Against COVID-19 Post-Acute Care Study Group Persistent Symptoms in Patients After Acute COVID-19. JAMA. 2020;324:603–605. doi: 10.1001/jama.2020.12603. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Sterne J.A.C., Murthy S., Diaz J.V., Slutsky A.S., Villar J., et al. WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group Association Between Administration of Systemic Corticosteroids and Mortality Among Critically Ill Patients With COVID-19: A Meta-analysis. JAMA. 2020;324:1330–1341. doi: 10.1001/jama.2020.17023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.The RECOVERY Collaborative Group Dexamethasone in hospitalized patients with Covid-19—preliminary report. N Engl J Med. 2021;384:693–704. doi: 10.1001/jama.2010.1553. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Iwashyna T.J., Ely E.W., Smith D.M., Langa K.M. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA. 2010;304:1787–1794. doi: 10.1001/jama.2010.1553. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Herridge M.S., Cheung A.M., Tansey C.M., Matte-Martyn A., Diaz-Granados N., Al-Saidi F., et al. Canadian Critical Care Trials Group; One-year outcomes in survivors of the acute respiratory distress syndrome. N Engl J Med. 2003;348:683–693. doi: 10.1056/NEJMoa022450. [DOI] [PubMed] [Google Scholar]
- 23.Yende S., Austin S., Rhodes A., Finfer S., Opal S., Thompson T., et al. Long-Term Quality of Life Among Survivors of Severe Sepsis: Analyses of Two International Trials. Crit Care Med. 2016;44:1461–1467. doi: 10.1097/CCM.0000000000001658. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Iwashyna T.J., Ely E.W., Smith D.M., Langa K.M. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA. 2010;304:1787–1794. doi: 10.1001/jama.2010.1553. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Tøien K., Bredal I.S., Skogstad L., Myhren H., Ekeberg O., et al. Health related quality of life in trauma patients Data from a one-year follow up study compared with the general population. Scand J Trauma Resusc Emerg Med. 2011;19:22. doi: 10.1186/1757-7241-19-22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Feemster L.C., Cooke C.R., Rubenfeld G.D., Hough C.L., Ehlenbach W.J., Au D.H., et al. The influence of hospitalization or intensive care unit admission on declines in health-related quality of life. Ann Am Thorac Soc. 2015;12:35–45. doi: 10.1513/AnnalsATS.201404-172OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Herridge M.S., Tansey C.M., Matté A., Tomlinson G., Diaz-Granados N., Cooper A., et al. Functional disability 5 years after acute respiratory distress syndrome Canadian Critical Care Trials Group. N Engl J Med. 2011;364:1293–1304. doi: 10.1056/NEJMoa1011802. [DOI] [PubMed] [Google Scholar]