Abstract
药物相关性颌骨坏死(MRONJ)近年来发病率不断增高,目前认为其机制可能为骨重建抑制学说、血管生成抑制学说、口腔微生物感染学说、免疫抑制学说、细胞毒性、颌骨微裂纹形成及单核苷酸多态性等,但基于单机制进行防治效果均不理想。药物治疗前规范的口腔检查及相关疾病预处理,药物治疗期间定期口腔随访对MRONJ的预防具有重要意义。在MRONJ治疗过程中,准确判断其分期,根据指南进行标准化治疗的同时,也需考虑患者具体情况,进行个性化调整。本文将国内外最新相关研究及指南和四川大学华西口腔医院口腔颌面外科近年来对MRONJ诊治经验相结合,对其发病机制及防治策略展开阐述和讨论,供同行参考。
Keywords: 药物相关性颌骨坏死, 机制, 预防, 诊断, 治疗
Abstract
The morbidity rate of medication-related osteonecrosis of the jaws (MRONJ) increased rapidly in recent years. Thusfar, the mechanism of MRONJ has no consensus. The possible mechanisms may include bone remodeling inhibition theory, angiogenesis inhibition theory, oral microorganism infection theory, immunosuppression theory, cytotoxicity-targeted oral epithelial cells, microcrack formation of maxillary or mandibular bone, and single nucleotide polymorphism. However, the efficacy of prevention and treatment based on a single mechanism is not ideal. Routine oral examination before MRONJ-related drug treatment, treatment of related dental diseases, and regular oral follow-up during drug treatment are of great significance for the prevention of MRONJ. During the treatment of MRONJ, the stage of MRONJ must be determined accurately, treatment must be standardized in accordance with the guidelines, and personalized adjustments must be made considering the specific conditions of patients. This review aimed to combine the latest research and guidelines for MRONJ and the experiences on the treatment of MRONJ in the Maxillofacial Surgery Department of West China Hospital of Stomatology, Sichuan University, and discuss the strategies to improve the clinical process.
Keywords: medication-related osteonecrosis of the jaws, mechanism, prevention, diagnosis, treatment
双膦酸盐类药物(bisphosphonates,BPs)因具有强大的抗骨吸收作用,临床上广泛应用于骨质疏松、恶性肿瘤骨转移等疾病的防治[1]。然而在BPs的长期使用中,可能发生颌骨坏死并发症,其临床表现为颌面部死骨暴露及经久不愈的瘘管等。2007年,美国颌面外科医师协会(American Association of Oral and Maxillofacial Surgeons,AAOMS)正式将此类病症定义为双膦酸盐相关性颌骨坏死(bisphosphonate related osteonecrosis of the jaws,BRONJ)[2]。近年来,学者们发现除了BPs,迪诺塞麦等其他抗骨吸收药物以及肿瘤治疗中抗血管生成的靶向药物也会引起类似的颌骨坏死,故AAOMS将BRONJ更名为药物相关性颌骨坏死(medication-related osteonecrosis of the jaws,MRONJ)[3],临床上该类患者显著增加[4]。MRONJ一旦发生将会对患者的生活质量产生严重影响,带来巨大的痛苦(图1),但目前尚无有效治疗手段[5]。因此,探究MRONJ的发病机制及防治方法成为临床亟待解决的关键问题。本文旨在将国际文献报道与四川大学华西口腔医院相关基础和临床研究相结合,从该病的发病机制、预防原则、临床诊断分期及治疗等方面作一系统论述,以供同行参考。
图 1. MRONJ的临床表现.

Fig 1 Clinical manifestation of MRONJ
左:张口受限、局部软组织肿胀溢脓;右:死骨形成。
1. MRONJ的发病机制
关于MRONJ发病机制的多种假说包括:骨重建抑制学说、血管生成抑制学说、口腔微生物感染学说、免疫抑制学说、细胞毒性、颌骨微裂纹形成及单核苷酸多态性(single nucleotide polymorphisms,SNPs)等。但针对单一机制进行防治疗效均不理想,因此目前尚无某一种机制能够得到公认。
1.1. 骨重建抑制学说
颌骨,尤其是牙槽骨,在人的一生不断进行吸收和重建,新陈代谢十分活跃。破骨细胞来源于巨噬细胞系,由多个单核巨噬细胞融合而成,是骨吸收的主要功能细胞。颌骨的吸收重建主要依赖于破骨细胞吸收功能与成骨细胞骨基质形成功能的平衡,被一系列精妙的机制所调控。BPs具有高度的骨亲和性,可以进入破骨细胞内部,抑制胆固醇生成过程中的法尼基焦磷酸(farnesyl diphosphate,FPP)合成酶作用,促进破骨细胞凋亡,亦可以下调破骨细胞前体细胞核因子-κB受体活化因子(receptor activator of nuclear factor κB,RANK)的表达,抑制破骨前体细胞迁徙及向破骨细胞分化的过程。除此之外,BPs处理过的破骨细胞缺乏边缘褶皱,导致其对骨面的黏附能力下降,从而影响吸收功能[6]。另外,BPs可通过抑制破骨细胞V型质子泵,抑制其功能[7]。BPs影响酶的活性也被认为是一种可能的机制,Fleisch[8]指出多数BPs可抑制酪氨酸磷酸酯酶的活性。然而,另有相关研究[9]发现,长期使用阿仑膦酸盐(alendronate,ALN)的患者体内破骨细胞数量反而增加,但其形态具有异型性。该现象在小鼠动物模型上也得到了验证,但其在MRONJ发病过程中的具体作用尚待研究[10]。BPs通过调控破骨细胞引发MRONJ的机制得到了广泛研究,但尚无基于该机制的成熟防治方法用于临床。
早在1965年,Hattner等[11]就观察到在破骨细胞骨吸收的部位会有成骨细胞聚集并开始成骨,从而第一次提出了骨重建过程中耦合(coupling)的概念。颌骨重建依赖于多个细胞组成的基本多细胞单位(basic multicellular unit,BMU),在BMU中,各个细胞相互调控,构成稳定的微环境,从而保证重建顺利完成。Shimizu等[12]研究发现ALN可以通过调控破骨细胞膜结合因子EphrinB1表达,进而影响成骨细胞的活性,最终干扰骨耦合平衡。因此,对于MRONJ发病机制的研究似乎不应该仅局限于破骨细胞,相关药物对BMU内骨耦合平衡的影响是未来可能的研究方向。
1.2. 血管生成抑制学说
有研究[13]–[14]证实BPs可以抑制多种肿瘤中血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达。因此,BPs可能通过抑制颌骨内血管生成,导致颌骨处于局部缺血状态,最终发展成为颌骨坏死,这也是另一种主流假说[15]。MRONJ诱因常为拔牙等牙科有创治疗,临床表现为拔牙窝软组织延迟愈合及颌骨缺血坏死,而血管生成在创伤后软硬组织再生过程中起着至关重要的作用。有研究[16]证实,静脉输注的BPs能沉积在拔牙创周围的软硬组织内,影响新生血管的生成及长入。有研究[17]–[18]证实BPs可以显著抑制血管内皮细胞(vascular endothelial cell,VEC)的增殖及迁徙,促进细胞凋亡,从而诱发MRONJ。一些针对VEGF及其相关通路的药物,如贝伐单抗、舒尼替尼、雷帕霉素等,也被报道可能诱发颌骨坏死,这也在一定程度上支持该学说。但是该学说尚无法解释核因子-κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)单抗类药物诱发MRONJ的原理。有相关研究[13]–[14]通过香叶基香叶醇进行干预,虽然可以不完全拮抗BPs对VEC的抑制作用,但对MRONJ的防治作用却并不理想。
1.3. 口腔微生物感染学说
口腔内为有菌环境,而MRONJ患者常存在溢脓等感染症状,全身及局部抗感染治疗常被应用于MRONJ的保守治疗中。因此,微生物感染也被认为是MRONJ发病机制之一[19]。在对MRONJ病灶微生物检测的相关研究[20]–[21]中,放线菌报道最多,其检出率达到39%~100%。也有研究报道其他菌属,如厚壁菌、链球菌在病灶中占有主导地位。MRONJ病灶中的放线菌主要存在于黏膜下及坏死骨当中。但动物实验却发现使用BPs干预后,口腔菌群并无显著变化,且与颌骨坏死率无关[22]。那么,微生物定植导致骨坏死或是骨坏死部位有利于微生物定植,其中因果关系值得商榷。
1.4. 免疫抑制学说
近年来,免疫抑制学说成为了MRONJ机制研究的新方向。一方面,BPs可以直接调控免疫细胞导致骨坏死:BPs可以调控树突状细胞及巨噬细胞分化及功能,同时改变巨噬细胞M1/M2比例[23]–[24];MRONJ患者病灶区γδT细胞浸润明显增加,动物实验[25]证实敲除γδT细胞可以降低骨坏死概率;BPs也可以抑制中性粒细胞功能。另一方面,BPs及其他抗骨吸收药物可以通过破骨细胞对自然杀伤细胞(natural killer cell,NK)及T细胞进行调节,间接抑制免疫能力[26]–[27]。BPs使用者常合并有其他基础疾病,可能接受激素或化学药物治疗,导致其免疫功能紊乱,从而诱发MRONJ。
1.5. 其他
拔牙手术是MRONJ常见诱因之一,术后常出现拔牙创经久不愈,最终导致颌骨坏死的情况。导致拔牙创不愈的原因可能为BPs对黏膜的毒性作用。前期研究[16],[28]已经证实BPs可以抑制口腔角质细胞及成纤维细胞的增殖和迁徙能力,并诱导其凋亡。
长期使用BPs可能导致颌骨产生微裂纹,为微生物定植提供通道。动物实验[29]证实,MRONJ组颌骨与感染性骨髓炎及放射性骨髓炎组相比,其微裂纹出现率显著增加。
MRONJ具有个体差异性,因此基因因素,特别是SNPs也可能是MRONJ发病机制之一。前期研究[30]–[34]证实CYP2C8(rs1934951)、PPARG(rs1152003)、VEGF(rs3025039、rs699947、rs2010963)等位点与MRONJ发病率有关。最新系统评价证实,CYP2C8(rs1934951)、VEGF(rs3025039)与MRONJ发病相关,其他位点的合并结果为阴性[30]。最终结论还需要更多高质量、多中心临床试验研究证实。
总的来说,目前关于MRONJ发病机制假说较多,但根据各个假说进行防治效果均不理想,因此,多因素联合致病可能成为未来机制研究和临床防治的方向。
2. MRONJ的预防
2.1. 使用相关药物前的口腔诊疗原则
患者常因骨质疏松或恶性肿瘤等原因在相关专科医师指导下使用BPs或其他MRONJ相关药物。在此治疗之前,完善而详细的口腔检查应成为常规。所有涉及颌骨的侵袭性治疗,包括但不仅限于牙拔除术、根尖手术及囊肿刮治,均建议在药物治疗开始之前完成。同时,全面口腔洁治有利于保持健康的牙周状态,龋病治疗及根管治疗可以阻断感染沿根管向颌骨侵袭途径,以上也建议在药物治疗之前完成。
2.2. 药物使用期间的口腔维护及处理原则
在使用MRONJ相关药物后,患者需要在口腔医师指导下建立良好的口腔卫生习惯,并进行定期(每6~12月)的口腔随访,在口腔疾病的早期进行处理,预防病变进一步发展从而诱发MRONJ的产生。
总体来说MRONJ发病率并不算高,口服BPs患者的发病率仅为0.001%~0.05%[35];基于治疗骨质疏松目的,接受BPs或地诺单抗等抗骨吸收药物静脉输注的患者MRONJ发病率稍高(0.017%~0.35%)[36];相比而言,因肿瘤治疗接受静脉BPs药物治疗患者,MRONJ发病率显著升高(2.8%~4.3%)[37]。牙拔除术是MRONJ的主要诱因,有60%~70%的MRONJ患者在发病前接受了拔牙手术[38]。有报道[35],[39]证实,有MRONJ相关药物治疗病史的患者接受拔牙手术后,发病率为5.9%,使用自体血小板衍生物可降低发病率。因此,尽管绝大部分MRONJ患者发病的主要诱因为拔牙手术,但使用相关药物的患者接受拔牙手术后发生MRONJ的概率并不高,而不进行拔牙手术亦可能因为局部感染诱发MRONJ,因此,BPs及其他MRONJ相关药物使用史并不是拔牙手术的绝对禁忌证。在进行拔牙手术之前,充分的医患沟通非常重要,患者需要了解手术获益、MRONJ发生风险及后续治疗,并做出选择。同时,在拔牙手术前,可征求患者内科主诊医生建议,是否可暂时停用BPs类药物,以利于MRONJ的预防。其策略建议如下[3]:1)口服BPs<4年,临床危险因素较低:手术不需更改或延迟;2)口服BPs<4年,同时伴有全身基础疾病(如使用类固醇激素、糖尿病等),如果全身情况允许,牙科手术前3~6个月中断BPs,术后随访至少8+周或至少黏膜愈合;3)口服BPs>4年或静脉用药期间,伴或不伴有全身基础疾病,至少停药3~6个月后才考虑可能拔牙,同时必须与患者充分沟通停药及发生严重口腔并发症之间的收益比。但总体来说,由于BPs类药物与骨骼结合紧密,终末半衰期可达10年,因此,短期停药的效果可能欠佳。不同于BPs药物,地诺单抗等抗骨吸收药物不会沉积在骨骼上,因此,该类药物停用6个月后骨吸收抑制作用会明显减弱,可能对预防MRONJ具有较大意义。
在临床工作中,C-端肽(C-terminal telopeptide,CTX)可被应用于判断BPs或其他抗骨吸收药物使用者罹患MRONJ的风险中来。BPs类药物可以抑制CTX水平,增加MRONJ风险,停用药物后CTX水平会随着时间而回升[40]。在目前的临床实践中,早空腹CTX水平是临床医生判断MRONJ发生可能性的有利工具[41],也可以帮助判断停药时间长短及停药效果,但需注意结合其他指标进行综合考量。同时,术前规范预防性使用抗生素,术中采用微创理念拔牙保护骨组织,采用软组织瓣严密覆盖创面,术后规范护理保持口腔卫生,均有利于MRONJ预防。
除拔牙手术以外,患者还可能需要接受其他涉及颌骨的侵袭性操作,例如种植前植骨术、种植手术及牙周-根尖手术等。对于种植相关手术而言,其目的并不是为了消除颌骨局部感染,而是为了提升患者生活质量,又基于该类手术是MRONJ重要诱因,因此手术医生应在术前评估中慎重考虑。尤其是因肿瘤治疗而接受相关药物治疗的患者,因其药物用量大,MRONJ发病率相对高,现有研究结论并不推荐其接受种植手术。牙周-根尖手术目的是为了消除颌骨局部感染,在充分评估风险和与患者沟通前提下,MRONJ风险人群可以接受该类手术[42]。
3. MRONJ的诊断及临床分期
MRONJ的临床诊断需同时具备以下3个标准[3]:1)曾经或者当前正接受抗骨吸收或者抗血管生成药物的治疗;2)颌面部区域的骨质暴露,或者经口内或者口外瘘管可以探查到骨质,并且这种现象持续8周以上;3)颌骨区域无放射性治疗史且不存在明显的肿瘤及肿瘤转移性疾病。
在临床上,常需要将MRONJ与其他类型的颌骨坏死进行鉴别,如化脓性骨髓炎及放射性骨髓炎。从病因学、放射学特点、组织病理学特点等方面都可以进行鉴别,而其中最重要的鉴别方式是病因(既往史),MRONJ患者均有明确的相关药物服用史,这需要颌面外科医师在接诊时仔细询问既往史及药物服用史。
在MRONJ的诊断过程中,需要影像学检查手段的辅助,以判断病变程度及范围。目前可选择的影像学检查方式包括根尖片、全景片、锥形束CT(cone beam computed tomography,CBCT)或螺旋CT,甚至MRI和闪烁扫描/正电子发射型计算机断层显像(positron emission computed tomography,PET)(表1)。根尖片及全景片在判断早期病变方面敏感度不佳,综合放射剂量、显像效果及检查价格考虑,CBCT对硬组织的成像清晰、射线剂量低、操作简便、费用较低,这些优势令其成为MRONJ诊治过程中影像学检查的首选。对于接受低剂量药物治疗但无临床症状的患者,口腔检查即可,无需拍片;对于接受高剂量药物治疗但无临床症状时,可以通过根尖片或全景片检查早期牙齿病变,必要时加拍CBCT;而对于0~Ⅲ期的患者,CBCT均为检查的首选,必要时辅助MRI、骨扫描或PET,以更全面地评估所涉及的骨和软组织[43]。
表 1. MRONJ的影像学检查特点及使用建议.
Tab 1 Imaging characteristics of MRONJ and application suggestion
| 检查方式 | 使用建议 |
| 根尖片 | 可初步辅助判断,典型特征包括硬膜增厚、牙槽骨骨小梁密度增加、牙周膜间隙增宽等,但是使用较少 |
| 全景片 | 相对根尖片,可纳入判断的结构更多,表现为骨小梁密度增加、拔牙窝不完全愈合、骨片形成、下颌神经管或上颌窦底骨皮质增厚等,可以作为影像学检查选择之一 |
| 螺旋CT及CBCT | 典型病变包括弥漫性骨硬化、骨溶解区形成、骨皮质糜烂、骨膜增生、瘘管形成及拔牙牙槽窝不完全愈合。一般来说,该影像学显示区域大于临床暴露区域。在观察骨质改变上,螺旋CT及CBCT效果相当,但CBCT的辐射相对小得多 |
| MRI | 在观察骨质改变上,与CT相当,在评估骨坏死早期骨髓变化以及围绕骨坏死区域的软组织变化方面占优势,在临床症状出现之前可出现骨髓信号强度的降低 |
| 闪烁扫描和PET | 有早期核素浓集,死骨形成后会有核素摄取下降的特点,对于检测早期疾病具有高灵敏度 |
在当前临床工作中,结合患者的临床专科检查及影像学检查结果,AAOMS将接受了BPs、抗骨吸收或抗血管生成等药物的患者分为了5期,包括危险期、0、Ⅰ、Ⅱ、Ⅲ期,其中危险期及0期患者仅接受了相关治疗,但并未出现骨坏死,该分期主要是为MRONJ的预防和治疗提供指导(表2)[3]。
表 2. MRONJ的临床分期.
Tab 2 Clinical stages of MRONJ
| 临床分期 | 临床特点 | 治疗建议 |
| 危险期 | 无任何主观症状,无骨坏死表现 | 无需治疗,口腔卫生宣教 |
| 0 | 无骨坏死或骨暴露,有非特异性临床症状,可能发生进一步病变 | 全身系统治疗,包括止痛药和抗生素的使用 |
| Ⅰ | 有骨暴露或骨坏死,无临床症状,无感染征兆 | 抗菌含漱液,临床定期随访,向患者交代病情 |
| Ⅱ | 骨暴露或骨坏死,伴局灶感染 | 抗菌含漱液含漱,全身抗生素治疗,控制疼痛,游离死骨表浅清创,减少软组织刺激 |
| Ⅲ | 骨暴露或骨坏死,伴疼痛感染,同时具有以下一个或多个表现:病理性骨折,口外瘘道,病灶超出牙槽骨范围的颌骨 | 抗生素类含漱液,全身抗生素治疗,控制疼痛,选择性局部清创或手术切除 |
4. MRONJ的临床治疗
对于危险期和0期的患者,治疗策略以预防为主,可以结合MRONJ发病风险与全身疾病的治疗需求,建议其主诊医生采取最合适的药物和用量,得到药物疗效的最优化及MRONJ风险最低化。在口腔方面,加强卫生宣教,定期口腔洁治,可以进行非侵袭性的治疗操作,维持患者口腔处于良好的状态。0期患者可能出现自发疼痛,但患区周围牙及颌骨均未查及明显病变,全身系统性药物治疗,包括抗生素及止痛药的使用,可以帮助缓解症状,基于MRONJ机制研究中微生物感染理论及国内外治疗经验,青霉素、阿莫西林(含或不含克拉维酸钾)以及甲硝唑为常用有效药物[44]。该类患者必须进行定期的随访,内容包括口腔专科检查及影像学检查。
对于Ⅰ期患者,推荐保守的治疗策略。如果患者没有自觉症状,选择手术可能导致病变区域的扩大。对于暴露的死骨,应用漱口水进行含漱,局部冲洗,必要时进行全身系统性药物治疗,预防感染。部分患者死骨可自行分离后脱落,病变痊愈(图2)。如患者病情出现进展,出现感染不适症状,则可考虑手术治疗。
图 2. MRONJ患者随访期间死骨自行脱落后痊愈.
Fig 2 The MRONJ patients recovered after the sequestrum abscission during follow-up
左:死骨脱落后口内情况;中:死骨;右:死骨脱落前CBCT矢状位影像。
死骨形成伴感染后,病变则进展为Ⅱ~Ⅲ期,患者因感染导致局部疼痛、肿胀、溢脓或瘘管形成、口腔异味等临床症状,严重影响其生活质量。保守治疗可在一定程度上缓解患者的症状,但病情极易反复,因此,对于Ⅱ~Ⅲ期患者,可选择手术治疗。在MRONJ手术治疗过程中术者需要遵循以下原则:1)手术治疗前必须进行严格的术前影像学检查以明确边界;2)术中彻底清除所有受累的骨质,包括患区的牙齿;3)清理所有尖锐的骨缘和骨刺;4)术中病灶区尽量使用健康软组织做无张力地覆盖和封闭;5)根据微生物药物敏感性实验,在术后选择使用相应的抗生素,直至出现软组织的愈合;6)在术后软组织愈合之前,避免使用任何口腔义齿和假体。
Ⅱ期患者因病变较为局限,一般可采取门诊手术治疗,在局部麻醉下刮除病变坏死的牙槽骨,以减少对周围软组织的刺激,促进病变的愈合。在此过程中,包括血小板浓缩物、臭氧化油制剂及激光辅助治疗等辅助治疗手段可能起到一定的疗效。
Ⅲ期患者由于病变范围广,常伴随有多个症状,门诊手术困难,故常采取住院全麻下进行手术治疗。部分患者手术前死骨与正常颌骨之间有明显界限,行死骨摘除术后,患者创口常可在短期内愈合,疗效较佳(图3)。因此,在MRONJ的常规诊疗中,基于患者可以耐受的前提,均建议患者保守治疗,定期随访直至死骨完全分离。然而,部分患者颌骨病变较大,持续性地刺激周围组织,导致反复出现疼痛、肿胀及溢脓,对患者的生活质量产生极大的影响,患者不能耐受。对于该类患者,在征求本人意愿前提下,充分交代手术风险及二次手术可能性,可选择在死骨未完全分离的情况下进行病变扩大性切除。因死骨没有明显边界,手术时在保证去除死骨的前提下,对周围的颌骨进行了扩大性的打磨,但术后在术区周围仍容易出现薄片状死骨分离,需要二次手术刮除(图4)。
图 3. 死骨分离后进行手术,术后1月,黏膜基本愈合.
Fig 3 Sequestrectomy performed after sequestrum separation, mucosal healing was observed one month after operation
A:左下颌磨牙区骨暴露;B:全景片显示死骨已经分离;C:术中翻瓣去除死骨;D:创面填塞碘仿纱条后缝合;E:术后10 d拆线去除碘仿纱条,见肉芽组织覆盖骨面;F:术后1月见黏膜愈合。
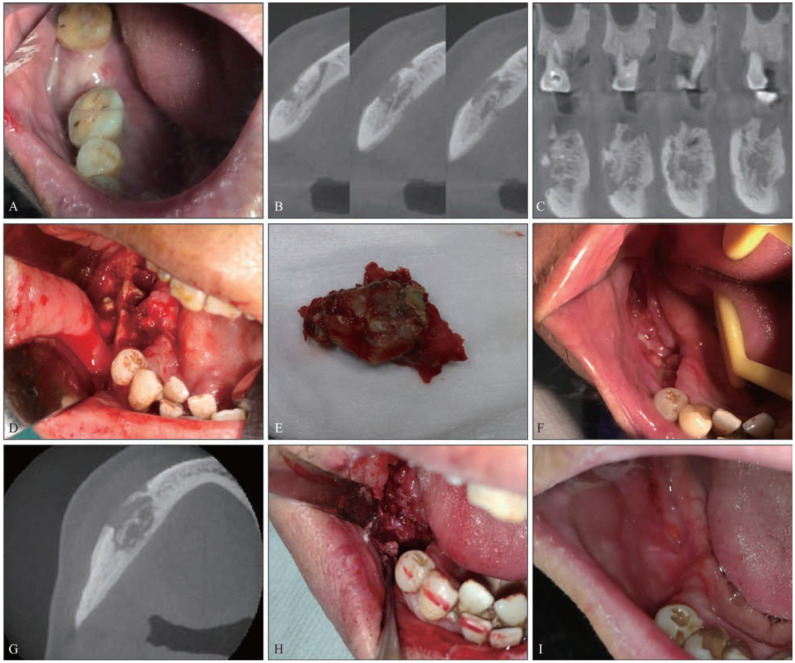
图 4. 死骨未完全分离患者进行多次手术后愈合.
Fig 4 The patient with incomplete separation sequestrum healed after several surgeries
A:MRONJ术前口内图片;B:术前CBCT横截面;C:术前CBCT冠状位;D:第一次手术术中图片;E:死骨;F:术后1个月图片,仍有肉芽;G:术后1个月CBCT横截面,示死骨形成;H:第二次门诊手术刮除;I:第二次术后1月复查,已愈合。
近年来,四川大学华西口腔医院颌面外科收治了百余例MRONJ患者,在上述原则指导下进行了诊治。通过病例回顾分析发现,手术前出现死骨分离的患者手术疗效较好,常无需二次手术。而死骨未分离则进行颌骨部分扩大切除手术者,常需要进行二次甚至多次手术,但大部分患者最终仍可达到局部愈合。基于上述病案笔者设想,在MRONJ Ⅱ、Ⅲ期患者发病早期进行死骨扩大切除,加速死骨分离,待其二次分离后,进行计划内的二次手术,以减少患者保守治疗时间,减少患者痛苦。但该设想尚需要大样本量临床研究证实。
目前关于MRONJ的治疗策略是有争议的,对于非手术还是手术作为首选治疗方法尚未达成共识。有学者[3],[45]认为,MRONJ具有一定的自限性,保守治疗可以缓解MRONJ症状,待死骨分离后进行手术,以期待达到更佳的手术效果。然而,保守治疗过程中患者的生活质量可能会受到影响,甚至在治疗过程中会出现疾病的进展,因此,亦有学者[46]主张早期进行手术,以期待达到疾病的早期痊愈,但疾病早期手术边界不易确定,手术边界的颌骨容易继续坏死。传统方法可以基于病变范围进行扩大切除,直至边界可见正常骨质;近年来,自体荧光(autofluorescence)及四环素荧光(tetracycline fluorescence)指引手术被应用在MRONJ病变切除术中,其疗效尚不能肯定[47]。
除了保守及手术治疗,一些辅助疗法也常被运用在临床中,包括高压氧舱、臭氧化油治疗、激光照射及激光手术等。高压氧舱可以解除BPs对破骨细胞功能抑制,促进血管生成,以及起到抗厌氧菌的作用。但其对于存在肿瘤病灶或转移灶患者、幽闭恐惧症患者及患有耳部疾病者禁用[48]。臭氧是氧气的一种同素异形体,医用臭氧是由氧气合成的。臭氧具有抗菌和促进伤口愈合的特性,其原理为通过刺激内源性抗氧化系统,阻断黄嘌呤/黄嘌呤氧化酶途径产生活性氧,改善局部血流,促进软硬组织愈合。一些临床及临床前研究[49]已经评估了空气产生的臭氧治疗MRONJ的作用,因为臭氧被认为可以通过清理骨坏死病变来诱导组织修复,从而促进黏膜愈合。将其用于手术后的辅助治疗,也取得了不错的效果。低强度激光照射增加骨无机基质和有丝分裂成骨指数,促进矿化;刺激淋巴和毛细血管生长,拔牙术前3 d+术后2周抗生素/术后4周激光(1 064 nm,1.25 W,15 Hz)。高强度激光可以直接去除死骨。
5. 结语
随着BPs及其他MRONJ相关药物在临床上的广泛应用,MRONJ发病率呈上升趋势。目前对于MRONJ发病机制研究尚未明确,需要进一步研究证实。在进行相关药物治疗前的口腔检查及治疗对预防MRONJ具有重要意义。采用非手术还是手术治疗MRONJ尚存在争议,但死骨分离患者手术效果较佳。在治疗过程中,部分辅助治疗手段结合保守及手术治疗可能取得较好疗效。怎样促进MRONJ死骨分离,是未来临床治疗的研究发展方向。
专家简介
潘剑,教授,博士研究生导师,医学博士,四川大学华西口腔医院口腔外科主任。国际牙医师学院委员(FICD)、中华口腔医学会牙及牙槽外科专委会副主任委员,口腔颌面外科专委会委员,四川省卫生健康委员会学术和技术带头人,四川省口腔医学会牙及牙槽外科专委会主任委员,口腔颌面外科专委会副主任委员,口腔全科专委会及口腔装备委员会常委,四川省医学会口腔专委会委员,四川省抗癌协会头颈肿瘤专委会委员。担任《华西口腔医学杂志》和《国际口腔医学杂志》常务编委,《中国口腔颌面外科杂志》编委。主持国家自然基金和省部级基金12项,发表学术论文80余篇,参编专著16部。从事口腔颌面外科临床、科研、教学与管理工作20余年。

Funding Statement
[基金项目] 四川省科技计划项目(2020YFS0182);四川大学华西口腔医院临床研究项目(LCYJ2019-1)
Supported by: Science and Technology Program of Sichuan Province (2020YFS0182); Clinical Research Program of West China Hospital of Stomatology, Sichuan University (LCYJ2019-1).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Russell RG. Bisphosphonates: the first 40 years[J] Bone. 2011;49(1):2–19. doi: 10.1016/j.bone.2011.04.022. [DOI] [PubMed] [Google Scholar]
- 2.Advisory Task Force on Bisphosphonate-Related Ostenonecrosis of the Jaws, American Association of Oral and Maxillofacial Surgeons. American Association of Oral and Maxillofacial Surgeons position paper on bisphosphonate-related osteonecrosis of the jaws[J] J Oral Maxillofac Surg. 2007;65(3):369–376. doi: 10.1016/j.joms.2006.11.003. [DOI] [PubMed] [Google Scholar]
- 3.Ruggiero SL, Dodson TB, Fantasia J, et al. American Association of Oral and Maxillofacial Surgeons position paper on medication-related osteonecrosis of the jaw-2014 update[J] J Oral Maxillofac Surg. 2014;72(10):1938–1956. doi: 10.1016/j.joms.2014.04.031. [DOI] [PubMed] [Google Scholar]
- 4.Wang Q, Liu J, Qi S, et al. Clinical analysis of medication related osteonecrosis of the jaws: a growing severe complication in China[J] J Dent Sci. 2018;13(3):190–197. doi: 10.1016/j.jds.2017.12.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.潘 剑, 王 杞章, 刘 济远. 双膦酸盐相关性颌骨坏死[J] 华西口腔医学杂志. 2017;35(1):29–36. doi: 10.7518/hxkq.2017.01.004. [DOI] [PMC free article] [PubMed] [Google Scholar]; Pan J, Wang QZ, Liu JY. Research progress on bisphosphonate-related osteonecrosis of the jaws[J] West China J Stomatol. 2017;35(1):29–36. doi: 10.7518/hxkq.2017.01.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Rogers MJ, Gordon S, Benford HL, et al. Cellular and molecular mechanisms of action of bisphosphonates[J] Cancer. 2000;88(12 Suppl):2961–2978. doi: 10.1002/1097-0142(20000615)88:12+<2961::aid-cncr12>3.3.co;2-c. [DOI] [PubMed] [Google Scholar]
- 7.David P, Nguyen H, Barbier A, et al. The bisphosphonate tiludronate is a potent inhibitor of the osteoclast vacuolar H(+)-ATPase[J] J Bone Miner Res. 1996;11(10):1498–1507. doi: 10.1002/jbmr.5650111017. [DOI] [PubMed] [Google Scholar]
- 8.Fleisch H. Bisphosphonates: mechanisms of action[J] Endocr Rev. 1998;19(1):80–100. doi: 10.1210/edrv.19.1.0325. [DOI] [PubMed] [Google Scholar]
- 9.Weinstein RS, Roberson PK, Manolagas SC. Giant osteoclast formation and long-term oral bisphosphonate therapy[J] N Engl J Med. 2009;360(1):53–62. doi: 10.1056/NEJMoa0802633. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Córdova LA, Guilbaud F, Amiaud J, et al. Severe compromise of preosteoblasts in a surgical mouse model of bisphosphonate-associated osteonecrosis of the jaw[J] J Craniomaxillofac Surg. 2016;44(9):1387–1394. doi: 10.1016/j.jcms.2016.07.015. [DOI] [PubMed] [Google Scholar]
- 11.Hattner R, Epker BN, Frost HM. Suggested sequential mode of control of changes in cell behaviour in adult bone remodelling[J] Nature. 1965;206(983):489–490. doi: 10.1038/206489a0. [DOI] [PubMed] [Google Scholar]
- 12.Shimizu E, Tamasi J, Partridge NC. Alendronate affects osteoblast functions by crosstalk through EphrinB1-EphB[J] J Dent Res. 2012;91(3):268–274. doi: 10.1177/0022034511432170. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Ziebart T, Koch F, Klein MO, et al. Geranylgeraniol-a new potential therapeutic approach to bisphosphonate associated osteonecrosis of the jaw[J] Oral Oncol. 2011;47(3):195–201. doi: 10.1016/j.oraloncology.2010.12.003. [DOI] [PubMed] [Google Scholar]
- 14.Pabst AM, Krüger M, Ziebart T, et al. Isoprenoid geranylgeraniol: the influence on cell characteristics of endothelial progenitor cells after bisphosphonate therapy in vitro[J] Clin Oral Investig. 2015;19(7):1625–1633. doi: 10.1007/s00784-014-1394-z. [DOI] [PubMed] [Google Scholar]
- 15.Pabst AM, Krüger M, Blatt S, et al. Angiogenesis in the development of medication-related osteonecrosis of the jaws: an overview[J] Dent J (Basel) 2016;5(1):2. doi: 10.3390/dj5010002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Pabst AM, Krüger M, Sagheb K, et al. The influence of geranylgeraniol on microvessel sprouting after bisphosphonate substitution in an in vitro 3D-angiogenesis assay[J] Clin Oral Investig. 2017;21(3):771–778. doi: 10.1007/s00784-016-1842-z. [DOI] [PubMed] [Google Scholar]
- 17.Lang M, Zhou Z, Shi L, et al. Influence of zoledronic acid on proliferation, migration, and apoptosis of vascular endothelial cells[J] Br J Oral Maxillofac Surg. 2016;54(8):889–893. doi: 10.1016/j.bjoms.2016.05.030. [DOI] [PubMed] [Google Scholar]
- 18.Wang Q, Liu J, Guo T, et al. Epidermal growth factor reverses the inhibitory effects of the bisphosphonate, zoledronic acid, on human oral keratinocytes and human vascular endothelial cells in vitro via the epidermal growth factor receptor (EGFR)/Akt/phosphoinositide 3-kinase (PI3K) signaling pathway[J] Med Sci Monit. 2019;25:700–710. doi: 10.12659/MSM.911579. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Zirk M, Wenzel C, Buller J, et al. Microbial diversity in infections of patients with medication-related osteonecrosis of the jaw[J] Clin Oral Investig. 2019;23(5):2143–2151. doi: 10.1007/s00784-018-2655-z. [DOI] [PubMed] [Google Scholar]
- 20.Hinson AM, Smith CW, Siegel ER, et al. Is bisphosphonate-related osteonecrosis of the jaw an infection? A histological and microbiological ten-year summary[J] Int J Dent. 2014;2014:452737. doi: 10.1155/2014/452737. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Russmueller G, Seemann R, Weiss K, et al. The association of medication-related osteonecrosis of the jaw with Actinomyces spp. infection[J] Sci Rep. 2016;6:31604. doi: 10.1038/srep31604. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Silveira FM, Etges A, Correa MB, et al. Microscopic evaluation of the effect of oral microbiota on the development of bisphosphonate-related osteonecrosis of the jaws in rats[J] J Oral Maxillofac Res. 2016;7(4):e3. doi: 10.5037/jomr.2016.7403. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Wolf AM, Rumpold H, Tilg H, et al. The effect of zoledronic acid on the function and differentiation of myeloid cells[J] Haematologica. 2006;91(9):1165–1171. [PubMed] [Google Scholar]
- 24.Zhang Q, Atsuta I, Liu S, et al. Il-17-mediated M1/M2 macrophage alteration contributes to pathogenesis of bisphosphonate-related osteonecrosis of the jaws[J] Clin Cancer Res. 2013;19(12):3176–3188. doi: 10.1158/1078-0432.CCR-13-0042. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Movila A, Mawardi H, Nishimura K, et al. Possible pathogenic engagement of soluble Semaphorin 4D produced by γδT cells in medication-related osteonecrosis of the jaw (MRONJ)[J] Biochem Biophys Res Commun. 2016;480(1):42–47. doi: 10.1016/j.bbrc.2016.10.012. [DOI] [PubMed] [Google Scholar]
- 26.Tseng HC, Kanayama K, Kaur K, et al. Bisphosphonate-induced differential modulation of immune cell function in gingiva and bone marrow in vivo: role in osteoclast-mediated NK cell activation[J] Oncotarget. 2015;6(24):20002–20025. doi: 10.18632/oncotarget.4755. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Grassi F, Manferdini C, Cattini L, et al. T cell suppression by osteoclasts in vitro[J] J Cell Physiol. 2011;226(4):982–990. doi: 10.1002/jcp.22411. [DOI] [PubMed] [Google Scholar]
- 28.Jung J, Park JS, Righesso L, et al. Effects of an oral bisphosphonate and three intravenous bisphosphonates on several cell types in vitro[J] Clin Oral Investig. 2018;22(7):2527–2534. doi: 10.1007/s00784-018-2349-6. [DOI] [PubMed] [Google Scholar]
- 29.Hoefert S, Schmitz I, Tannapfel A, et al. Importance of microcracks in etiology of bisphosphonate-related osteonecrosis of the jaw: a possible pathogenetic model of symptomatic and non-symptomatic osteonecrosis of the jaw based on scanning electron microscopy findings[J] Clin Oral Investig. 2010;14(3):271–284. doi: 10.1007/s00784-009-0300-6. [DOI] [PubMed] [Google Scholar]
- 30.Guo Z, Cui W, Que L, et al. Pharmacogenetics of medication-related osteonecrosis of the jaw: a systematic review and meta-analysis[J] Int J Oral Maxillofac Surg. 2020;49(3):298–309. doi: 10.1016/j.ijom.2019.07.016. [DOI] [PubMed] [Google Scholar]
- 31.Sarasquete ME, García-Sanz R, Marín L, et al. Bisphosphonate-related osteonecrosis of the jaw is associated with polymorphisms of the cytochrome P450 CYP2C8 in multiple myeloma: a genome-wide single nucleotide polymorphism analysis[J] Blood. 2008;112(7):2709–2712. doi: 10.1182/blood-2008-04-147884. [DOI] [PubMed] [Google Scholar]
- 32.Arduino PG, Menegatti E, Scoletta M, et al. Vascular endothelial growth factor genetic polymorphisms and haplotypes in female patients with bisphosphonate-related osteonecrosis of the jaws[J] J Oral Pathol Med. 2011;40(6):510–515. doi: 10.1111/j.1600-0714.2010.01004.x. [DOI] [PubMed] [Google Scholar]
- 33.Di Martino MT, Arbitrio M, Guzzi PH, et al. A peroxisome proliferator-activated receptor gamma (PPARG) polymorphism is associated with zoledronic acid-related osteonecrosis of the jaw in multiple myeloma patients: analysis by DMET microarray profiling[J] Br J Haematol. 2011;154(4):529–533. doi: 10.1111/j.1365-2141.2011.08622.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Choi H, Lee JH, Kim HJ, et al. Genetic association between VEGF polymorphisms and BRONJ in the Korean population[J] Oral Dis. 2015;21(7):866–871. doi: 10.1111/odi.12355. [DOI] [PubMed] [Google Scholar]
- 35.Beth-Tasdogan NH, Mayer B, Hussein H, et al. Interventions for managing medication-related osteonecrosis of the jaw[J] Cochrane Database Syst Rev. 2017;10(10):CD012432. doi: 10.1002/14651858.CD012432.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Scottish Dental Clinical Effectiveness Programme. Oral health management of patients at risk of medication-related osteonecrosis of the jaw[J] Br Dent J. 2017;222(12):930. doi: 10.1038/sj.bdj.2017.539. [DOI] [PubMed] [Google Scholar]
- 37.Drudge-Coates L, Van den Wyngaert T, Schiødt M, et al. Preventing, identifying, and managing medication-related osteonecrosis of the jaw: a practical guide for nurses and other allied healthcare professionals[J] Support Care Cancer. 2020;28(9):4019–4029. doi: 10.1007/s00520-020-05440-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Fliefel R, Tröltzsch M, Kühnisch J, et al. Treatment strategies and outcomes of bisphosphonate-related osteonecrosis of the jaw (BRONJ) with characterization of patients: a systematic review[J] Int J Oral Maxillofac Surg. 2015;44(5):568–585. doi: 10.1016/j.ijom.2015.01.026. [DOI] [PubMed] [Google Scholar]
- 39.王 杞章, 刘 济远, 潘 剑. 药物性颌骨坏死的研究进展[J] 华西口腔医学杂志. 2018;36(5):568–572. doi: 10.7518/hxkq.2018.05.019. [DOI] [PMC free article] [PubMed] [Google Scholar]; Wang QZ, Liu JY, Pan J. Progress on medication-related osteonecrosis of the jaw[J] West China J Stomatol. 2018;36(5):568–572. doi: 10.7518/hxkq.2018.05.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Dodson TB. CTX and its role in managing patients exposed to oral bisphosphonates [J] J Oral Maxillofac Surg. 2010;68(2):487–489. doi: 10.1016/j.joms.2009.07.088. [DOI] [PubMed] [Google Scholar]
- 41.Marx RE, Cillo JE, Jr, Ulloa JJ. Oral bisphosphonate-induced osteonecrosis: risk factors, prediction of risk using serum CTX testing, prevention, and treatment[J] J Oral Maxillofac Surg. 2007;65(12):2397–2410. doi: 10.1016/j.joms.2007.08.003. [DOI] [PubMed] [Google Scholar]
- 42.Di Fede O, Panzarella V, Mauceri R, et al. The dental management of patients at risk of medication-related osteonecrosis of the jaw: new paradigm of primary prevention[J] Biomed Res Int. 2018;2018:2684924. doi: 10.1155/2018/2684924. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Khan AA, Morrison A, Hanley DA, et al. Diagnosis and management of osteonecrosis of the jaw: a systematic review and international consensus[J] J Bone Miner Res. 2015;30(1):3–23. doi: 10.1002/jbmr.2405. [DOI] [PubMed] [Google Scholar]
- 44.Bermúdez-Bejarano EB, Serrera-Figallo MÁ, Gutiérrez-Corrales A, et al. Prophylaxis and antibiotic therapy in management protocols of patients treated with oral and intravenous bisphosphonates[J] J Clin Exp Dent. 2017;9(1):e141–e149. doi: 10.4317/jced.53372. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Yoneda T, Hagino H, Sugimoto T, et al. Bisphosphonate-related osteonecrosis of the jaw: position paper from the Allied Task Force Committee of Japanese Society for Bone and Mineral Research, Japan Osteoporosis Society, Japanese Society of Periodontology, Japanese Society for Oral and Maxillofacial Radiology, and Japanese Society of Oral and Maxillofacial Surgeons[J] J Bone Miner Metab. 2010;28(4):365–383. doi: 10.1007/s00774-010-0162-7. [DOI] [PubMed] [Google Scholar]
- 46.Lerman MA, Xie W, Treister NS, et al. Conservative management of bisphosphonate-related osteonecrosis of the jaws: staging and treatment outcomes[J] Oral Oncol. 2013;49(9):977–983. doi: 10.1016/j.oraloncology.2013.05.012. [DOI] [PubMed] [Google Scholar]
- 47.Beth-Tasdogan NH, Mayer B, Hussein H, et al. Interventions for managing medication-related osteonecrosis of the jaw[J] Cochrane Database Syst Rev. 2017;10(10):CD012432. doi: 10.1002/14651858.CD012432.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Peleg M, Lopez EA. The treatment of osteoradionecrosis of the mandible: the case for hyperbaric oxygen and bone graft reconstruction[J] J Oral Maxillofac Surg. 2006;64(6):956–960. doi: 10.1016/j.joms.2006.02.017. [DOI] [PubMed] [Google Scholar]
- 49.Bocci V. Ozone as Janus: this controversial gas can be either toxic or medically useful[J] Mediators Inflamm. 2004;13(1):3–11. doi: 10.1080/0962935062000197083. [DOI] [PMC free article] [PubMed] [Google Scholar]