Abstract
目的
比较低龄儿童龋患者和健康者唾液生化指标的差异及其与龋病状态的关联,建立龋病诊断模型。
方法
选取4~6岁儿童共120名,分为2组:低龄儿童龋患者(C组)和健康儿童(H组)各60名,采集唾液样本,比较pH、总蛋白以及离子浓度的差异,分析唾液生化指标与龋病状态的相关性,并建立龋病诊断模型。
结果
C组NO3−浓度显著低于H组,而Cl−、Br−、NH4+、Mg2+浓度显著高于H组(P<0.05);唾液NO3−浓度与患龋状态呈负相关,Br−、Cl−、NH4+浓度与患龋状态呈正相关(P<0.05)。利用唾液生化参数建立的龋病风险评估模型区分C组和H组的准确率可达85%以上。
结论
唾液pH、总蛋白和离子浓度有助于诊断和评估低龄儿童龋。
Keywords: 低龄儿童龋, 唾液, 生化指标, 关联性, 诊断模型
Abstract
Objective
This study aimed to compare the salivary biochemical indices between caries-free individuals and those with early childhood caries (ECC), and construct a saliva-based caries diagnostic model by analyzing the correlation between salivary biochemical indices and caries severity.
Methods
A total of 120 children aged 4-6 years were selected and divided into two groups: individuals with ECC (C group, n=60) and healthy children (H group, n=60). Salivary samples were collected to compare the pH, total protein, and ion concentrations between the two groups. The correlation between the salivary biochemical indices and caries severity was examined, and an ECC diagnostic model was established.
Results
The NO3− concentration significantly decreased in the C group, whereas the Cl−, Br−, NH4+, and Mg2+ concentrations significantly increased in the C group (P<0.05). In addition, the salivary caries severity had a significantly negative correlation with the NO3− concentration but had a positive correlation with Br−, Cl−, and NH4+ concentrations (P<0.05). The ECC diagnostic model based on salivary biochemical indices could yield satisfactory results in terms of distinguishing the C and H groups with over 85% accuracy.
Conclusion
Salivary biochemical indices can contribute to the diagnosis and risk assessment of ECC.
Keywords: early childhood caries, saliva, biochemical indices, correlation, diagnosis model
低龄儿童龋(early childhood caries,ECC)是指小于71个月的儿童,任何一颗乳牙上出现1个或1个以上的龋(无论是否成为龋洞)、失(因龋所失)、补牙面[1]。ECC发病率高,根据我国第四次全国口腔卫生流行病学调查[2],5岁儿童龋病患病率为71.9%,其进展迅速且累及广泛。乳牙龋损严重时造成咀嚼功能降低,影响儿童的营养摄入,并对颌面部以及全身的生长发育造成影响[3]。乳前牙的龋齿不仅影响美观、儿童的正确发音,还给儿童心理造成一定的影响[4]。
唾液可以通过清除食物残渣,利用碳酸氢和磷酸盐缓冲液中和酸,维持牙齿矿物质的过饱和以降低釉质溶解速度以及参与获得性生物膜的形成保护牙齿[5];但其温度、湿度、酸碱度以及口内特殊的解剖结构、物理化学性质等也能为致龋微生物群的生长繁殖创造有利的环境[6]。
传统的龋病诊断方法包括视诊、探诊结合照射咬合翼片,而射线照相术、透照、电阻抗技术设备以及基于荧光的方法可以辅助龋齿检测[7]。此外,现已建立了多个龋齿评分标准,包括基于视诊标准评分的国际龋齿检测评估系统-Ⅱ,基于激光的激光荧光龋齿诊断系统和基于光热辐射测量和调制发光的Canary龋齿检测系统[8]。可是,这些检测和评估方法操作繁琐,都需要患儿一定程度的椅旁配合,使龋病的诊断工作耗时费力。而本研究建立的龋病诊断和风险评估模型,基于唾液生化指标的检测,无需儿童的椅旁配合,操作简单易行;唾液样本的收集过程简便无损害,可以定期监测和评估龋病风险,能更方便、有效地区分龋病;通过检测口腔唾液微环境,可能更接近龋病发生进展过程的探讨,为ECC的预防和治疗提供依据。
1. 材料和方法
1.1. 采集对象的选择
2018年8—11月对青岛市5所幼儿园儿童进行口腔检查,纳入标准:4~6岁儿童,其父母或其他监护人能提供知情同意,并且能够配合取样。排除标准:全身性或先天性疾病、发育畸形以及身体其他部位存在细菌或严重感染的儿童,在3个月内使用抗生素、氟化物和微生态调节剂以及口腔活动矫治器的儿童。
参考以往相关研究[9]–[10],最终筛选出性别和年龄匹配的120名4~6岁儿童,分为低龄儿童龋病组[C组:龋失补牙(the number of decayed, missing and filled teeth,dmft)指数>3]和健康儿童组(H组:dmft指数=0),每组各60名(其中男女人数的比例为1∶1)。整个试验过程的细节和随后的数据发表均经青岛大学医学伦理委员会批准,并征得儿童监护人同意。
1.2. 样本采集方法
口腔检查:由3名儿童口腔专科医生按照世界卫生组织推荐的《口腔健康调查基本办法》进行检查[11],用dmft指数评估乳牙患龋状态。检查前经过培训,并且检查者间标准一致性检验结果良好(Kappa值>0.80)。检查器械经过严格高温高压消毒灭菌,检查者使用探针和口镜在自然光下检查乳牙患龋情况。
唾液收集:唾液样本的收集在同一时间段(上午9∶00—10∶00)。儿童取样的当天早晨不刷牙,收集前至少90 min未饮水或进食。采样时,儿童双手掌放在大腿上,头部稍微向下,略微向前弯曲,嘱其持续5 min把自然、未受刺激的唾液缓慢吐入50 mL无菌离心管中,进行编号并转移至4 °C保存箱直到收集结束,放置−80 °C冰箱保存。
1.3. 唾液样本分析
唾液样本自然解冻后在室温下以10 000 r·min−1的转速离心5 min,选取上清液,取2 mL唾液样本进行检测。
用电子pH计直接测定唾液pH值,首先用pH7缓冲液进行校准,检测下一个样品前将电极浸入蒸馏水,电极浸润部分用滤纸擦拭干净,并用pH7缓冲液校正再进行检测。
利用酶标仪测定唾液总蛋白浓度,在595 nm处测定样本的吸光度以得出唾液总蛋白浓度。
对于唾液离子浓度的测定,根据离子色谱仪的操作过程[12]测得峰面积和峰高度,首先配制淋洗液,然后检验标准品和样品并进行数据处理,分别计算得出Na+、K+、Cl−、PO43−、Ca2+、NO3−、NO2−、SO42−、F−、Br−、NH4+、Mg2+的浓度。
以上的所有检测均重复3次。
1.4. 数据分析
所有的统计分析采用R软件包(Version 3.6.1)进行。两组间的生化指标以平均数±标准差呈现,采用Wilcoxon rank sum检验比较两组数值的差异,Person相关系数评价生化指标与dmft指数的相关性,以P<0.05表示差异具有统计学意义。
根据低龄儿童龋患者和口腔健康儿童唾液生化参数的差异,利用随机森林(random forest,RF)算法基于全部唾液生化指标以及筛选出的5个具有显著差异的潜在生化标记物,分别建立龋病诊断和风险评估模型。根据软件包中的“rfcv”函数确定变量的特征重要性;将数据集随机分为训练集(90%)和测试集(10%),对RF模型进行训练,采用10倍交叉验证方法对结果进行评估,通过受试者工作特征曲线下面积(area under the receiver operating characteristic curve,AUC)描述和量化模型的分类能力。
2. 结果
2.1. 2组唾液pH、总蛋白、离子浓度的比较
C组和H组间唾液生化参数的比较分析见表1。由表1可见,C组唾液样本的NO3−浓度显著低于H组,Cl−、Br−、NH4+、Mg2+浓度显著高于H组(P<0.05);而其余生化指标,较之H组,如总蛋白、K+、PO43−、Na+、F−、SO42−、Ca2+浓度,在C组增高,pH、NO2−浓度在C组降低,但两组间的差异无统计学意义(P>0.05)。
表 1. 2组唾液生化指标的比较.
Tab 1 Comparison of salivary biochemical indices between 2 groups
| 唾液参数 | C组 | H组 | P值 |
| NO3−/(mg·L−1) | 10.90±13.18 | 32.93±66.46 | *** |
| Cl−/(mg·L−1) | 599.52±173.05 | 471.25±100.80 | *** |
| NH4+/(mg·L−1) | 197.34±67.21 | 159.34±56.82 | * |
| Mg2+/(mg·L−1) | 3.51±1.98 | 3.01±2.24 | * |
| Br−/(mg·L−1) | 2.26±1.47 | 1.29±0.75 | *** |
| NO2−/(mg·L−1) | 2.44±3.12 | 3.48±4.75 | NS |
| 总蛋白/(mg·L−1) | 1 173.89±325.35 | 1 116.75±332.62 | NS |
| K+/(mg·L−1) | 785.73±246.77 | 731.54±188.63 | NS |
| PO43−/(mg·L−1) | 468.48±166.66 | 421.10±126.18 | NS |
| Na+/(mg·L−1) | 100.61±64.77 | 76.86±29.57 | NS |
| F−/(mg·L−1) | 32.19±18.05 | 28.59±14.73 | NS |
| SO42−/(mg·L−1) | 21.96±9.49 | 18.17±5.92 | NS |
| Ca2+/(mg·L−1) | 14.40±6.55 | 10.92±6.37 | NS |
| pH | 6.85±0.20 | 6.85±0.23 | NS |
注:*为0.01<P<0.05;**为0.001<P<0.01;***为P<0.001;NS为差异无统计学意义。
2.2. 唾液生化参数与dmft指数的相关性
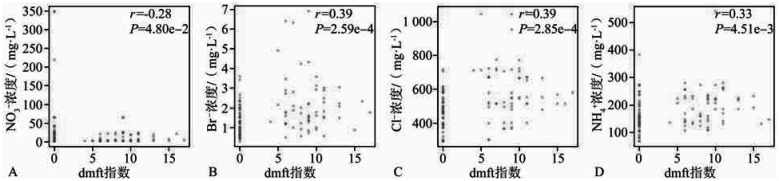
随着dmft指数的增加,NO3−的浓度显著降低(r=−0.28,P<0.05;图1A),Br−、Cl−、NH4+的浓度明显增加(r=0.39、0.39、0.33,P<0.05;图1B、C、D)。
图 1. 口腔唾液生化参数与dmft指数的关联性.
Fig 1 Correlation between salivary biochemical indices and dmft index
A:NO3−浓度与dmft指数呈负相关;B:Br−浓度与dmft指数呈正相关;C:Cl−浓度与dmft指数呈正相关;D:NH4+浓度与dmft指数呈正相关。
2.3. 基于唾液生化参数建立ECC的诊断模型
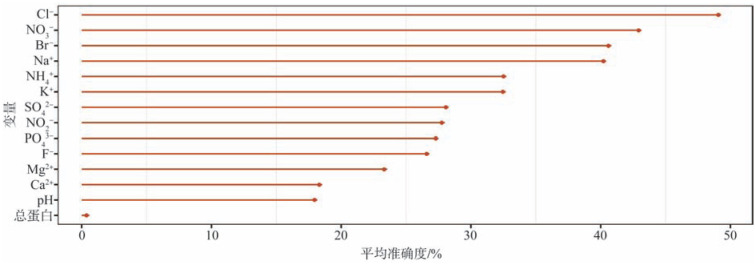
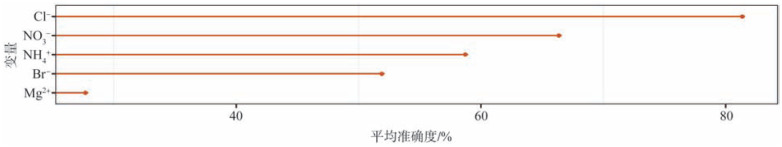
不同变量的重要性略有差别,在全部变量中,Cl−、NO3−、Br−、Na+、NH4+是对模型的建立具有较高贡献的变量(图2);而将筛选出的5个潜在龋病标记物对模型的重要性按照降序排列为:Cl−、NO3−、NH4+、Br−、Mg2+(图3)。基于全部唾液生化参数信息建立的龋病风险评估模型(AUC=86.78%,图4)与5个筛选变量建立的模型区分ECC和健康的性能基本相同(AUC=86.75%、图5),都要高于85%,提示生化指标在鉴别低龄儿童龋的准确性和有效性方面具有较好的分辨率。
图 2. 基于全部生化参数建立的模型变量的重要性分布.
Fig 2 Importance of variables in the model based on all biochemical parameters
所有生化指标按其对模型精度的重要性由高到低排列,线条长度表示所有指标对基于其建立模型的平均重要性。
图 3. 基于5个筛选参数建立的模型变量的重要性分布.
Fig 3 Importance of five variables in the model based on selected parameters
筛选出的5个生化指标按其对模型精度的重要性由高到低排列,线条长度表示这5个筛选指标对基于其建立模型的贡献。
图 4. 基于全部唾液生化参数建立的ECC风险评估模型的性能图.
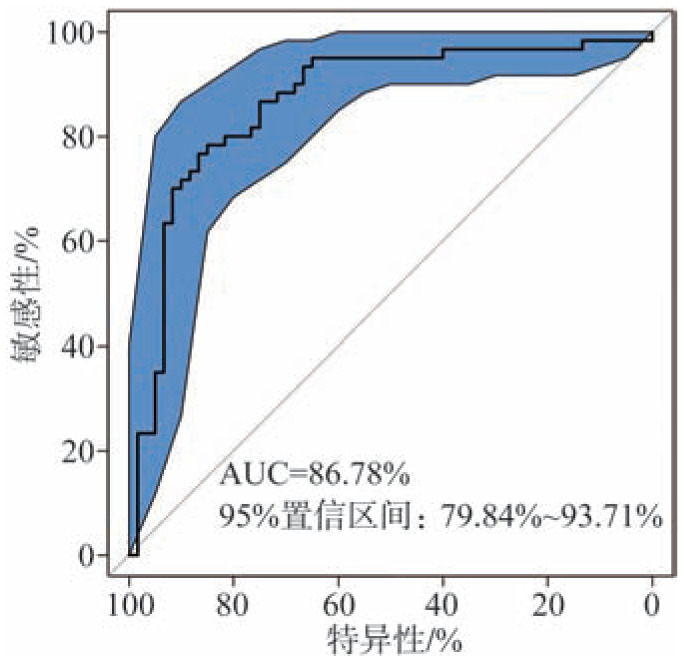
Fig 4 Performance of ECC risk assessment model based on all salivary biochemical parameters
基于全部生化指标的诊断模型的ROC曲线,通过曲线下面积(AUC=86.78%)测量诊断模型区分低龄儿童龋患者组和健康组的准确性,95%置信区间为79.84%~93.71%。AUC值越接近1,提示模型的诊断性能越好。
图 5. 基于5个筛选参数建立的ECC风险评估模型的性能图.
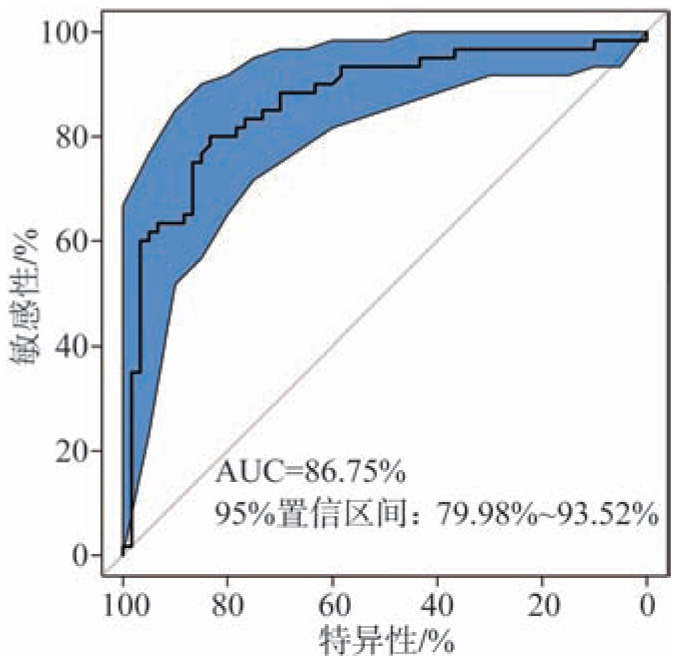
Fig 5 Performance of ECC risk assessment model based on five selected parameters
基于5个筛选参数的诊断模型的ROC曲线,通过曲线下面积(AUC=86.75%)测量诊断模型区分低龄儿童龋患者组和健康组的准确性,95%置信区间为79.98%~93.52%。AUC值越接近1,提示模型的诊断性能越好。
3. 讨论
唾液作为体内一种独特的体液,包含至少99%的水,其余主要为电解质和蛋白成分。虽然电解质和蛋白只占唾液的一小部分,但对维持口腔健康和牙体完整具有重要作用。唾液的无机成分主要来自血液,它们的含量不是恒定的,常常以离子的形式存在。唾液中这些电解质的电解生物利用度在龋病中起着关键作用,通过碳酸氢盐、磷酸盐、尿素、两性蛋白和酶实现缓冲和清除食物残渣的作用[13]。Na+和K+等阳离子参与跨细胞膜的主动转运,而阴离子Cl−可以激活α-淀粉酶,F−具有抗龋作用[14]。
首先,本研究的效力为80%,在95%置信区间和5%的误差范围内,至少需要100名参与者[15],所以最终选取了性别和年龄匹配的120名4~6岁儿童进行样本采集。通过比较ECC患者和健康儿童唾液生化指标的差异,发现C组的唾液NO3−浓度显著低于H组,并且与dmft指数呈负相关,其他研究[16]–[17]也得出了类似结果。饮食中摄入的硝酸盐通过主动运输被集中到唾液腺,其浓度是血浆的10倍[18],硝酸盐还原菌在厌氧环境下通过呼吸作用将NO3−还原为NO2−[19],在龋病进展过程中,随着厌氧菌和兼性厌氧数量的增加,更多的NO3−转化为NO2−,所以与健康儿童相比,ECC患者唾液中的NO3−浓度显著减少。然而,C组儿童唾液中的NO2−浓度并没有显著增加,这是由于亚硝酸盐不稳定,常作为中间产物,在酸的存在下易被分解为一氧化氮[20]。此外与H组相比,C组的pH值略有降低,而差异没有统计学意义(P>0.05);有研究[10]表明,患龋儿童唾液pH值显著降低,当碳水化合物作用时,产酸细菌通过糖酵解作用降低酸碱度,导致龋齿表面脱矿[21]。这可能是由于选取的儿童饮食习惯以及取唾液样本时间的差异造成的,而龋病是一种多因素疾病,微生物、饮食和食物都可能影响唾液的缓冲能力导致pH值改变。
其次,C组Cl−、Br−、NH4+、Mg2+浓度显著高于H组,其中Cl−、Br−、NH4+浓度与dmft指数正相关。保持牙齿的完整性是唾液的功能之一,牙齿暴露在唾液环境中,其表面形成的唾液蛋白膜起到屏障作用,减少牙齿表面的脱矿[22]。釉质主要由无机物组成,包括羟磷灰石晶体,少量氟磷灰石以及钠、钾、镁、氯等元素。一旦龋病发生,随着口腔内H+水平的升高,牙齿矿物质脱矿溶解,溶解的Ca2+、Na+、K+、Mg2+、Cl−和PO43−从牙齿结构扩散到牙齿周围的唾液中[23]。因此,与健康儿童相比,ECC患者唾液中上述离子增高,其中Cl−、Mg2+具有显著差异。离子浓度越高,说明牙齿中矿物成分的溶解程度越高。
本研究发现,两组的总蛋白含量无显著差异,在C组中略有增高,与既往研究[24]的结果相似,然而也有研究[10]发现,患龋儿童唾液中总蛋白含量显著高于健康儿童。总蛋白含量在患龋儿童唾液中增加,可能是因为抑菌蛋白成分如溶菌酶、乳铁蛋白、唾液过氧化物酶等抗氧化剂的增加,但唾液中又有一些蛋白如黏附素和凝集素,是通过增加微生物的定植发挥有害作用的[25]。而Ca2+、PO43−浓度在C组较高,但无差异,与以往研究[26]不完全一致,其不同之处可能在于离子浓度的测量方法,以往用邻甲酚酞络合剂和自动磷钼酸盐/紫外分光光度法在半自动分析器仪比色测定。而在本研究中,唾液样品的离子浓度都是用离子色谱仪分析的,离子色谱操作简单、精确度高、分析速度快,在灵敏度、操作、成本等多方面都具有明显优势[27]。
最后,唾液的生化标记物对有机体至关重要,在很多疾病的预防和治疗中发挥着重要作用。作为模型中最重要的变量,Cl−在维持电中性方面起着重要作用,其浓度显著影响了上皮细胞液体的分泌或吸收速度[28]–[29]。Mg2+可以作为羟磷灰石矿物组分的取代基,也有助于Ca2+和K+通过细胞膜的运输[30],并且Mg2+通过减少细菌毒性因子导致的炎症反应,在预防牙周疾病和龋齿中发挥了重要作用。而铵盐可以中和酸,提高口腔环境的pH,由作为缓冲物质存在于唾液中的尿素被牙菌斑代谢后产生,并且可能由于口腔内的反馈调节,使患龋儿童口腔内NH4+浓度补偿性升高。
本研究基于唾液全部生化信息和筛选出的5个龋病相关离子,分别建立了ECC风险评估模型,区分ECC患者和口腔健康者的准确度可达85%以上。AUC值越接近1,提示模型的诊断性能越好。筛选出的5个参数的龋病评估模型与基于全部唾液参数的龋病评估模型性能相似,提示利用这5个离子参数就可以快速、准确区分ECC患者和健康人群,并且唾液生化参数对于ECC的诊断和风险评估具有应用潜能。因此,唾液中丰富的无机离子可能是口腔微生物的最终代谢产物,对建立准确而便捷的龋病诊断和风险评估具有重要意义。
本课题组在后续的研究中将通过追踪观察,研究唾液中这些理化参数的水平变化能否先于临床症状的表现,将其作为预测儿童患龋的有力指标,为这些儿童制定个性化的预防计划。并且,本研究强调了生化指标对于诊断ECC的可行性,那么这些参数指标能否普遍适用于不同年龄组的人群以及其他类型的口腔感染有待进一步研究。
Funding Statement
[基金项目] 国家自然科学基金面上项目(81670979)
Supported by: The National Natural Science Foundation of China (81670979).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Drury TF, Horowitz AM, Ismail AI, et al. Diagnosing and reporting early childhood caries for research purposes. A report of a workshop sponsored by the National Institute of Dental and Craniofacial Research, the Health Resources and Services Administration, and the Health Care Financing Administration[J] J Public Health Dent. 1999;59(3):192–197. doi: 10.1111/j.1752-7325.1999.tb03268.x. [DOI] [PubMed] [Google Scholar]
- 2.Du MQ, Li Z, Jiang H, et al. Dental caries status and its associated factors among 3- to 5-year-old children in China: a national survey[J] Chin J Dent Res. 2018;21(3):167–179. doi: 10.3290/j.cjdr.a41076. [DOI] [PubMed] [Google Scholar]
- 3.Pierce A, Singh S, Lee J, et al. The burden of early childhood caries in Canadian children and associated risk factors[J] Front Public Health. 2019;7:328. doi: 10.3389/fpubh.2019.00328. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Nadelman P, Bedran N, Magno MB, et al. Premature loss of primary anterior teeth and its consequences to primary dental arch and speech pattern: a systematic review and meta-analysis[J] Int J Paediatr Dent. 2020;30(6):687–712. doi: 10.1111/ipd.12644. [DOI] [PubMed] [Google Scholar]
- 5.Dawes C. Salivary flow patterns and the health of hard and soft oral tissues[J] J Am Dent Assoc. 2008;139(Suppl):18S–24S. doi: 10.14219/jada.archive.2008.0351. [DOI] [PubMed] [Google Scholar]
- 6.Hemadi AS, Huang R, Zhou Y, et al. Salivary proteins and microbiota as biomarkers for early childhood caries risk assessment[J] Int J Oral Sci. 2017;9(11):e1. doi: 10.1038/ijos.2017.35. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Gomez J. Detection and diagnosis of the early caries lesion[J] BMC Oral Health. 2015;15(Suppl 1):S3. doi: 10.1186/1472-6831-15-S1-S3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Abrams SH, Sivagurunathan KS, Silvertown JD, et al. Correlation with caries lesion depth of the canary system, DIAGNOdent and ICDAS Ⅱ[J] Open Dent J. 2017;11:679–689. doi: 10.2174/1874210601711010679. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Pyati SA, Naveen Kumar R, Kumar V, et al. Salivary flow rate, pH, buffering capacity, total protein, oxidative stress and antioxidant capacity in children with and without dental caries[J] J Clin Pediatr Dent. 2018;42(6):445–449. doi: 10.17796/1053-4625-42.6.7. [DOI] [PubMed] [Google Scholar]
- 10.Sekhri P, Sandhu M, Sachdev V, et al. Estimation of trace elements in mixed saliva of caries free and caries active children[J] J Clin Pediatr Dent. 2018;42(2):135–139. doi: 10.17796/1053-4628-42.2.9. [DOI] [PubMed] [Google Scholar]
- 11.World Health Organization. Oral health surveys:basic methods[M] 5th ed. Geneva: World Health Organization; 2013. pp. 35–55. [Google Scholar]
- 12.胡 炜, 杜 东娜, 王 敬楠. 离子色谱仪的操作过程[J] 国际感染病学(电子版) 2019;8(1):177–178. [Google Scholar]; Hu W, Du DN, Wang JN. Operation process of ion chromatograph[J] Inf Int (Electr Ed) 2019;8(1):177–178. [Google Scholar]
- 13.Humphrey SP, Williamson RT. A review of saliva: normal composition, flow, and function[J] J Prosthet Dent. 2001;85(2):162–169. doi: 10.1067/mpr.2001.113778. [DOI] [PubMed] [Google Scholar]
- 14.Denny P, Hagen FK, Hardt M, et al. The proteomes of human parotid and submandibular/sublingual gland salivas collected as the ductal secretions[J] J Proteome Res. 2008;7(5):1994–2006. doi: 10.1021/pr700764j. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Kim J, Seo BS. How to calculate sample size and why[J] Clin Orthop Surg. 2013;5(3):235–242. doi: 10.4055/cios.2013.5.3.235. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Hegde AM, Neekhra V, Shetty S. Evaluation of levels of nitric oxide in saliva of children with rampant caries and early childhood caries: a comparative study[J] J Clin Pediatr Dent. 2008;32(4):283–286. doi: 10.17796/jcpd.32.4.4010kl5262687528. [DOI] [PubMed] [Google Scholar]
- 17.Syed M, Sachdev V, Chopra R. Intercomparison of salivary nitric oxide as a biomarker of dental caries risk between caries-active and caries-free children[J] Eur Arch Paediatr Dent. 2016;17(4):239–243. doi: 10.1007/s40368-016-0234-z. [DOI] [PubMed] [Google Scholar]
- 18.Doel JJ, Hector MP, Amirtham CV, et al. Protective effect of salivary nitrate and microbial nitrate reductase activity against caries[J] Eur J Oral Sci. 2004;112(5):424–428. doi: 10.1111/j.1600-0722.2004.00153.x. [DOI] [PubMed] [Google Scholar]
- 19.Duncan C, Dougall H, Johnston P, et al. Chemical generation of nitric oxide in the mouth from the enterosalivary circulation of dietary nitrate[J] Nat Med. 1995;1(6):546–551. doi: 10.1038/nm0695-546. [DOI] [PubMed] [Google Scholar]
- 20.Sánchez GA, Miozza VA, Delgado A, et al. Total salivary nitrates and nitrites in oral health and periodontal disease[J] Nitric Oxide. 2014;36:31–35. doi: 10.1016/j.niox.2013.10.012. [DOI] [PubMed] [Google Scholar]
- 21.Hegde MN, Attavar SH, Shetty N, et al. Saliva as a biomarker for dental caries: a systematic review[J] J Conserv Dent. 2019;22(1):2–6. doi: 10.4103/JCD.JCD_531_18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Silletti E, Vingerhoeds MH, Norde W, et al. Complex formation in mixtures of lysozyme-stabilized emulsions and human saliva[J] J Colloid Interface Sci. 2007;313(2):485–493. doi: 10.1016/j.jcis.2007.05.030. [DOI] [PubMed] [Google Scholar]
- 23.LeGeros RZ. Calcium phosphates in oral biology and medicine[J] Monogr Oral Sci. 1991;15:1–201. [PubMed] [Google Scholar]
- 24.Bhalla S, Tandon S, Satyamoorthy K. Salivary proteins and early childhood caries: a gel electrophoretic analysis[J] Contemp Clin Dent. 2010;1(1):17–22. doi: 10.4103/0976-237X.62515. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Gao X, Jiang S, Koh D, et al. Salivary biomarkers for dental caries[J] Periodontol 2000. 2016;70(1):128–141. doi: 10.1111/prd.12100. [DOI] [PubMed] [Google Scholar]
- 26.Singh S, Sharma A, Sood PB, et al. Saliva as a prediction tool for dental caries: an in vivo study[J] J Oral Biol Craniofac Res. 2015;5(2):59–64. doi: 10.1016/j.jobcr.2015.05.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.闫 爱云, 雷 守成, 张 鲜桃. 离子色谱技术的进展[J] 疾病监测与控制. 2015;9(10):713–715. [Google Scholar]; Yan AY, Lei SC, Zhang XT. Progress of use on ion chrom atography[J] J Dis Monit Contr. 2015;9(10):713–715. [Google Scholar]
- 28.Bohn AA, de Morais HA. A quick reference on chloride[J] Vet Clin North Am Small Anim Pract. 2017;47(2):219–222. doi: 10.1016/j.cvsm.2016.10.008. [DOI] [PubMed] [Google Scholar]
- 29.Shekarabi M, Zhang J, Khanna AR, et al. WNK kinase signaling in ion homeostasis and human disease[J] Cell Metab. 2017;25(2):285–299. doi: 10.1016/j.cmet.2017.01.007. [DOI] [PubMed] [Google Scholar]
- 30.Gröber U, Schmidt J, Kisters K. Magnesium in prevention and therapy[J] Nutrients. 2015;7(9):8199–8226. doi: 10.3390/nu7095388. [DOI] [PMC free article] [PubMed] [Google Scholar]