Abstract
目的
探索并构建肾肿瘤行肾部分切除术的CT三维可视化术前评估系统及其应用价值。
方法
回顾性收集北京大学第一医院泌尿外科因肾肿瘤行肾部分切除术患者的临床资料做初步探究,同时收集我国16家临床中心因肾肿瘤行肾部分切除术患者的同质化标准数据,应用CT三维可视化系统(IPS系统,Yorktal)评估肿瘤解剖结构、血供等信息,通过归纳和总结构建评估系统,完成虚拟手术设计及术中辅助导航,指导临床手术。
结果
基于泌尿系增强CT建立三维可视化图像,评分系统纳入肿瘤最长径和体积、肿瘤侵入实质内体积占比、肿瘤侵入实质最大深度、肿瘤与肾实质接触面积、肿瘤肾实质接触面平整度、肿瘤所在肾脏分段位置、肾血管变异情况及肾周脂肪。肿瘤平均二维直径为(2.78±1.43) cm,平均三维最大径为(3.09±1.35) cm,术后病理平均大小(3.01±1.38) cm。三维重建肿瘤最大径与术中肾动脉阻断时间延长、术中出血量显著相关(r=0.502,P=0.020;r=0.403,P=0.046)。三维重建及病理肿瘤体积分别为(25.7±48.4) cm3、(33.0±36.4) cm3(P=0.229),三维重建肿瘤体积与术中出血量显著相关(r=0.660,P < 0.001),肿瘤侵入肾实质内体积占比与术中肾动脉阻断时间延长、术后并发症的发生显著相关(r=0.410,P=0.041;r=0.587,P=0.005)。肿瘤与肾实质接触面积及是否存在血管变异与围手术期指标及术后并发症未见相关性。完成术前评估的同时,重建后的三维影像可在Touch Viewer系统上进行缩放、旋转、组合显示、颜色调整、透明化、长度体积自动测量及模拟裁切等操作,满足术前虚拟手术规划及术中辅助导航的要求。
结论
三维图像可提供更加直观的解剖结构,清晰显示肿瘤解剖参数及血供、脂肪等信息,CT三维重建肾肿瘤评价系统可帮助预测肾部分切除术手术难度、围术期并发症等。重建的三维可视化图像导入指定程序或机器人操作系统即可完成虚拟手术及术中辅助导航,帮助手术医师更好地把握手术过程。评分系统所包含的指标及各项指标的分值权重需要通过多中心大样本的研究来证实及完善。
Keywords: 肾肿瘤; 肾切除术; 外科手术, 计算机辅助; 体层摄影术, X线计算机; 成像, 三维
Abstract
Objective
To construct a preoperative evaluation system for partial nephrectomy using CT three-dimensional visualization technology and to explore its practical value.
Methods
The clinical data of the patients who underwent partial nephrectomy for renal tumors in Department of Urology, Peking University First Hospital were collected retrospectively. At the same time, the homogenized standard data of patients who underwent partial nephrectomy for renal tumors were collected in 16 clinical centers in China. The CT three-dimensional visualization system was applied (IPS system, Yorktal) to evaluate tumor anatomy, blood supply, perirenal fat and other information. The parameters were summarized to build a three-dimensional nephrometry system, on the basis of which virtual surgery design and intraoperative navigation were completed.
Results
A three-dimensional visualization image was established based on the enhanced CT urography. The nephrometry system included the longest diameter and volume of the tumor, proportion volume of tumor invading the parenchyma, maximum depth of the tumor invading the parenchyma, contact surface area, flatness of the tumor surface, renal segment where the tumor was located, vascular variation, and perirenal fat. The average two-dimensional diameter of the tumor was (2.78±1.43) cm, the average three-dimensional maximum diameter was (3.09±1.35) cm, and the average postoperative pathological size was (3.01±1.38) cm. The maximum tumor diameter in the three-dimensional image was significantly related to the prolonged renal artery clamping time and intra-operative blood loss (r=0.502, P=0.020; r=0.403, P=0.046). The three-dimensional and pathological tumor volume were (25.7±48.4) cm3 and (33.0±36.4) cm3, respectively (P=0.229). The tumor volume was significantly related to the intraoperative blood loss (r=0.660, P < 0.001). The proportion volume of the tumor invading into renal parenchyma was significantly related to the prolongation of renal artery clamping and the occurrence of postoperative complications (r=0.410, P=0.041; r=0.587, P=0.005). The tumor contact surface area and the presence of vascular variation did not show correlation with the perioperative data and postoperative complications. While the preoperative evaluation was completed, the reconstructed three-dimensional image could be zoomed, rotated, combined display, color adjustment, transparency, and simulated cutting on the Touch Viewer system. The process generally consisted of showing or hiding the tissue, adjusting the transparency of the interested area, rotating and zooming the image to match the position of the surgical patient. Together, these functions met the requirements of preoperative virtual surgery plan and intraoperative auxiliary navigation.
Conclusion
Three-dimensional images can provide a more intuitive anatomical structure. The CT three-dimensional visua-lization system clearly displays tumor anatomical parameters, blood supply and perirenal fat. The three-dimensional nephrometry system for renal tumors can help predict the difficulty of partial nephrectomy and perioperative complications. Importing the reconstructed three-dimensional visualization image into the specified program or robot operating system can complete virtual surgery and intraoperative navigation, helping the surgeon to better grasp the surgical process. The indexes included in the nephrometry system and the score weights of each index need to be confirmed and perfected by multi-center study with large samples.
Keywords: Kidney neoplasms; Nephrectomy; Surgery, computer-assisted; Tomography, X-ray computed; Imaging, three-dimensiona
肾癌是肾最常见的恶性肿瘤,约占成人恶性肿瘤的2%~4%[1-2]。T1期肾癌首选治疗方法是肾部分切除术,这种手术方式能为患者带来良好的肿瘤学预后,并且保留患肾功能。随着微创技术的发展和成熟,腹腔镜及机器人手术越来越受到广大医师和患者的青睐,但由于肾部分切除术的复杂性,围手术期存在出血(1%~2%)或尿瘘(3%~5%)的风险较高[3],因此,术前详尽地了解肾肿瘤及相关结构的解剖信息至关重要,可以为手术规划提供重要依据。目前,已有多种评分系统纳入肾肿瘤的各种相关特征以预测手术的复杂性、围手术期并发症的风险,包括RENAL评分、PADUA和C指数等[4-6]。尽管有大量文献支持这些评分系统的临床价值,但各研究之间使用现有的评分系统来预测肾部分切除术的临床结局并不一致[7],一个主要原因在于这些评分系统基于二维CT图像[8],需要在三个空间轴(轴位、冠状位和矢状位)上查看二维图像,再通过复杂的认知还原肿瘤的实际情况。
三维可视化技术可以通过处理标准二维图像来创建三维虚拟模型,借助这些三维可视化图像,可以更精确地评估肿瘤位置、肿瘤特征以及肿瘤与血管和集合系统的关系,进而预计肾部分切除术的手术复杂性并指导术前规划。但CT三维重建在当前的临床实践中尚未常规使用[9]。为了在术前及术中更准确、直观地把握肾肿瘤、血供的解剖特点及毗邻关系,本研究提出CT三维可视化肾肿瘤术前评分系统,并报告如下。
1. 资料与方法
1.1. 临床资料
收集自2011年12月至2019年12月北京大学第一医院泌尿外科因肾肿瘤行肾部分切除术患者的临床资料,包括年龄、性别、体重指数(body mass index,BMI)、肿瘤位置、肿瘤大小、术前血肌酐及肾小球滤过率(glomerular filtration rate,GFR)、手术时间、肾动脉阻断时间、出血量、术后住院日、并发症、术后血肌酐及GFR等,肾动脉阻断时间超过30 min为阻断时间延长。收集全国16个中心行肾部分切除术患者的临床资料进一步验证完善本评分系统细则。具体纳入标准为:(1)因肾肿瘤行肾部分切除术;(2)接受泌尿系增强CT及CT三维重建检查。排除标准为:(1)无法完成肾部分切除术而行肾根治性切除者;(2)CT资料无法满足重建标准;(3)患者拒绝手术或拒绝资料收集;(4)存在心、肺、肝功能不全失代偿,有严重出血倾向的疾病或糖尿病血糖控制不稳定等麻醉和手术禁忌证。
1.2. CT三维可视化评分系统
CT三维可视化评分系统各指标均以北京大学泌尿外科研究所制定的《泌尿系疾病三维可视化技术流程规范》(附于文末)为基础,以确保同质化和一致性。为直观、便捷地展示各组织结构的特征及解剖关系,CT三维可视化图像中采用特定的颜色代表相应的组织器官,其中肾被渲染为紫色,肿瘤为橙色,集合系统为绿色,动脉为红色,静脉为蓝色,脂肪为黄色,骨为白色,未定义结构为粉色。
1.2.1. CT三维重建标准
CT原始数据要求为平扫+增强扫描,数据层厚0.625~1.500 mm。扫描全系列DICOM格式图像数据,具体要求包括:(1)推荐64排及以上CT扫描,包含平扫+增强(肾皮髓质期、肾实质期及排泄期)扫描;(2)患者取仰卧位,头足方向扫描,深吸气后屏住呼吸,扫描矩阵512×512,机架旋转速度0.50~0.75 s/圈,扫描条件120 kV、200~250 mA(建议采用管电流自动调制技术),扫描范围为膈肌至耻骨联合,对比剂采用碘造影剂(碘海醇,350 mg I/mL),以3 mL/s速率注射;(3)扫描层厚1.0 mm、层间距1.0 mm,普通层厚2.5 mm、层间距2.5 mm,薄层标准层厚0.6 mm、层间距0.6 mm;(4)肾皮髓质期延时时间为20~25 s,肾实质期延时时间为60~70 s,肾排泄期延时时间为3~5 min,必要时排泄期可延长更长时间。
1.2.2. CT三维重建指标
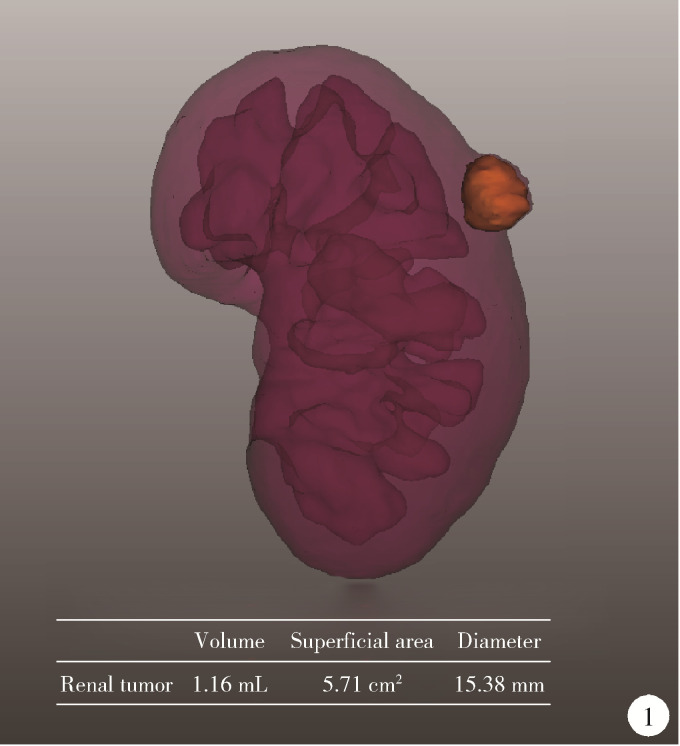
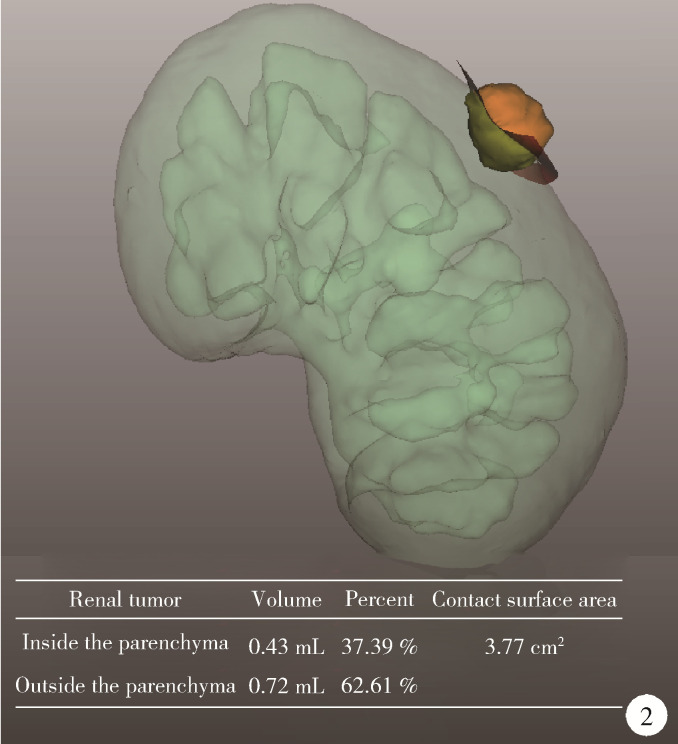
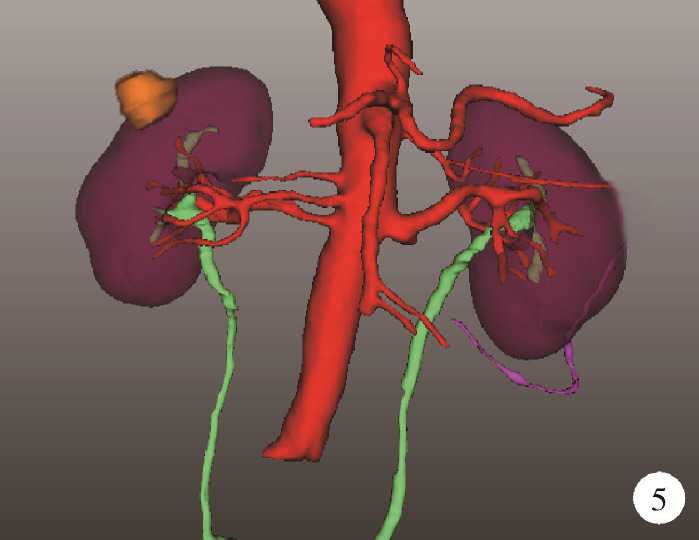
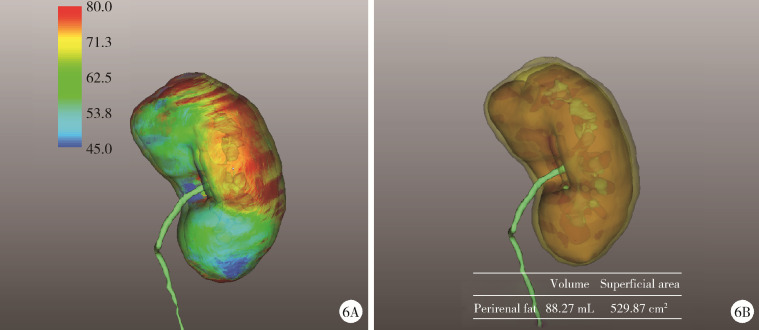
(1) 肿瘤最长径与体积(图 1):三维图像中肿瘤的最长径线以及肿瘤的几何体积;(2)肿瘤侵入肾实质内体积占比(图 2):以肾实质边缘为界作假想平面,该平面切割肿瘤后位于肾实质内的部分占肿瘤总体积的百分比,用于量化肿瘤内生外凸性质;(3)肿瘤与肾实质接触面积(图 2):利用三维可视化技术拟合肾肿瘤与肾实质接触平面并计算其面积,该面积直接反映肾部分切除术创面的大小;(4)肿瘤侵入实质最大深度(图 3):肾实质内肿瘤距肾实质边缘平面的最大垂直距离,用于评估肿瘤的浸润深度;(5)肿瘤肾实质接触面平整度:拟合肿瘤与肾实质接触的曲面的同时,以标准平滑曲面作为参考,提供肿瘤是否有异常隆起等相关信息,可警示切除肾肿瘤时肿瘤边界是否规则,避免切破肿瘤或对正常肾实质造成不必要的损伤,在完全切除肿瘤的同时尽可能多地保留肾实质;(6)肿瘤所在肾脏分段(图 4):分为上段、上前段、下前段、下段、后段,肿瘤所处位置决定手术入路、肿瘤切除及缝合的难易程度;(7)肾血管变异(图 5):限时阻断肾动脉或选择性阻断肾动脉是肾部分切除术的先决条件,肾动脉的变异以副肾动脉最为常见,术前识别变异的肾动脉可为术中完全阻断动脉提供保障;(8)肾周脂肪(图 6):测定肾周脂肪的体积和表面积,并根据CT值将肾周脂肪渲染为不同颜色,颜色越深提示脂肪黏性、硬度越大。
图 1.
肿瘤最长径与体积
Tumor diameter and volume Figure
图 2.
肿瘤侵入肾实质体积比与肿瘤接触面积
Volume proportion of tumor invading into renal parenchyma and contact surface area
图 3.
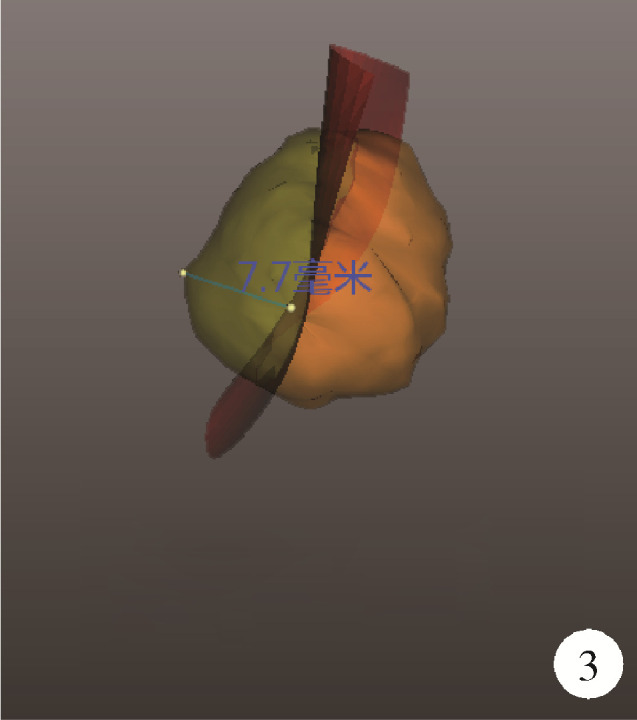
肿瘤侵入肾实质最大深度
Maximum depth of tumor invading into renal parenchyma
图 4.
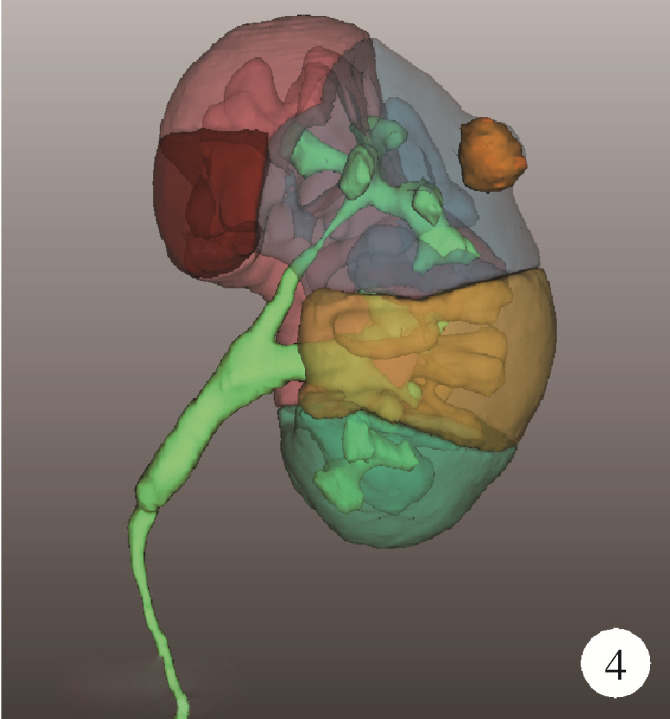
肾脏分段
Renal segment
图 5.
肾脏血管变异
Variation of renal vascular
图 6.
肾周脂肪参数
Perirenal fat parameters
6A, the perirenal fat was rendered in different colors according to the CT value; 6B, volume and superficial area of perirenal fat.
1.3. 统计学方法
符合正态分布的连续变量采用x±s表示,不符合正态分布的连续变量采用中位数(范围)表示,分类变量采用n(%)表示。采用配对样本t检验比较二维直径、三维图像肿瘤最大径及病理大小之间的差异,采用Pearson相关性分析处理连续变量的相关性问题,采用Spearman相关性分析处理包含分类变量的相关性问题。P < 0.05为差异有统计学意义。
2. 结果
本中心共58例患者在肾部分切除术前行泌尿系CT三维重建,并接受术中导航(图 7),包括男性34例,女性24例,平均年龄(54.4±10.2)岁,基本临床资料见表 1。所有患者均成功完成手术,无中转开腹,围手术期参数见表 2。肿瘤平均二维直径为(2.78±1.43) cm,平均三维最大径为(3.09±1.35) cm,术后病理平均大小(3.01±1.38) cm。相比于二维图像,三维重建所得肿瘤最大径更接近病理大小,但三维重建肿瘤最大径、二维CT肿瘤直径及病理肿瘤大小间差异无统计学意义(P二维-病理=0.187;P三维-病理=0.585;P三维-二维=0.130)。三维重建肿瘤最大径与术中肾动脉阻断时间延长、术中出血量显著相关(r=0.502,P=0.020;r=0.403,P=0.046)。三维重建及病理肿瘤体积大小分别为(25.7±48.4) cm3、(33.0±36.4) cm3(P=0.229),三维重建肿瘤体积与术中出血量显著相关(r=0.660,P < 0.001)。肿瘤侵入肾实质内体积占比与术中肾动脉阻断时间延长、术后并发症的发生显著相关(r=0.410,P=0.041;r=0.587,P=0.005)。肿瘤接触面积及是否存在血管变异与围手术期指标及术后并发症未见相关性。
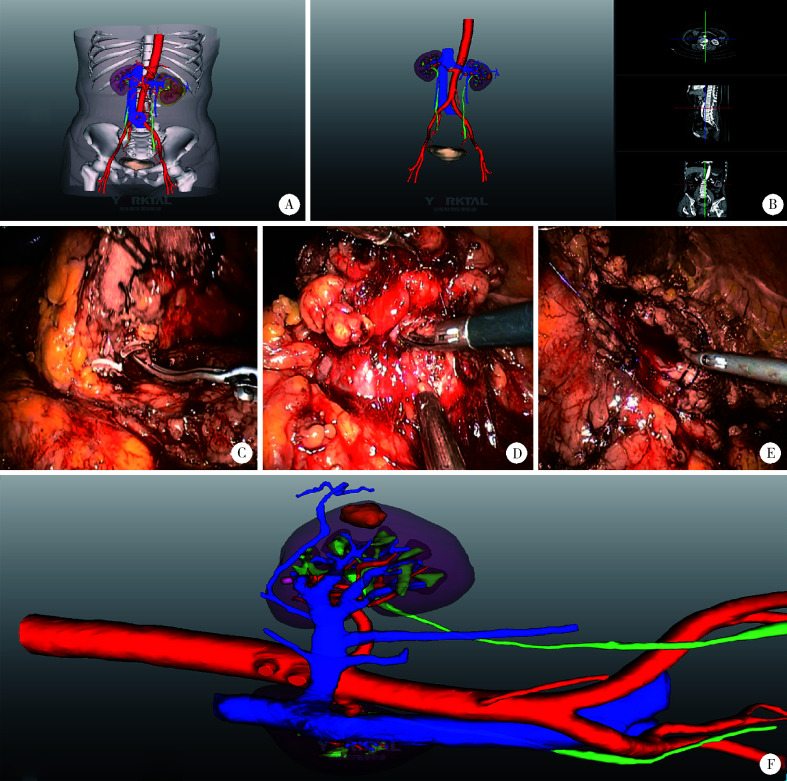
图 7.
三维重建术中导航操作流程示意图
Operation flow diagram of three-dimension reconstruction in the intraoperative navigation
A, three-dimension reconstruction result; B, show or hide organizations and adjust transparency; C, clamp the renal artery; D, expose the renal neoplasm; E, suture the renal parenchyma; F, rotate the image to the same position as the surgery.
表 1.
患者临床资料及CT三维重建数据
Clinical characteristics and tumor parameters in three-dimensional image
| Variables | Data |
| BMI, body mass index; eGFR, estimated glomerular filtration rate. | |
| Age/years, x±s | 54.4±10.2 |
| BMI/(kg/m2), x±s | 25.2±3.2 |
| Location, n (%) | |
| Left | 28 (48.3) |
| Right | 30 (51.7) |
| Diameter/cm, x±s | 2.78±1.43 |
| Volume/cm3, x±s | 33.0±36.4 |
| Preoperative creatinine/(μmol/L), x±s | 81.0±16.4 |
| Preoperative eGFR/(mL/min/1.73 m2), x±s | 87.4±16.4 |
| Maximum diameter in 3D image/cm, x±s | 3.09±1.35 |
| Volume in 3D image/cm3, x±s | 25.7±48.4 |
| Proportion of the tumor inside the parenchyma/%, M (range) | 38.9% (0.5%-100.0%) |
| Contact surface area/cm2, x±s | 10.8±7.4 |
| Vascular variation, n (%) | 7 (12.1) |
表 2.
肾部分切除术患者围手术期资料
Perioperative data of patients undergoing partial nephrectomy
| Variables | Data | |
| eGFR, estimated glomerular filtration rate. | ||
| Operation time/min, x±s | 127.6±50.5 | |
| Time of renal artery clamping/min, x±s | 28.5±12.3 | |
| Blood loss/mL, M (range) | 20 (0-2 800) | |
| Hospital stay/d, M (range) | 4.5 (3-18) | |
| Postoperative creatinine/(μmol/L), x±s | 82.3±27.7 | |
| Postoperative eGFR/[mL/(min·1.73 m2)], x±s | 70.8±27.6 | |
| Complications, n | 4 | |
3. 讨论
CT三维可视化技术可直观展现各组织间的空间解剖关系,自动测量靶组织相关参数,为精准化手术提供帮助,在骨科和口腔科的应用已较为成熟[10-11],而软组织因血供繁多、组织密度相近且空间结构复杂,较少见CT三维可视化技术应用的报道。随着影像技术的发展和图像精度的提高,CT三维可视化通过更加优化的算法,展示出更立体直观的影像,跨过了医师凭借自身经验对二维图像进行抽象的立体重建和三维认识的过程,逐渐成为传统影像学检查的新的呈现方式。因此,提出三维可视化下的肾肿瘤肾部分切除术术前评分系统是十分必要的。
现有的评分系统中肿瘤最长径是反映肿瘤最直观的参数之一。传统CT图像中定义肿瘤最长径的方法为任何平面(中轴位、矢状位、冠状位)中肿瘤的最大直径,测量方法局限于二维图像,肿瘤的实际情况仍需医师凭借自身经验判断。Porpiglia等[12]报道三维重建模型与传统CT在测量肿瘤最长径时无明显差异,且一致性检验结果近乎一致。因此,本评分系统采用了三维图像下的肿瘤最长径,标准参考TNM分期。另一方面,肿瘤体积是反映肿瘤负荷的另一指标,在三维技术下成为可测量参数,是对肿瘤最长径的重要补充。虽然肿瘤最长径和肿瘤体积可直观反映肿瘤负荷,但肿瘤位于肾实质外的部分无法为评估因肾部分切除术造成的肾体积缺损提供有效的参考,因此,本评分系统纳入了侵入肾实质肿瘤体积占肿瘤总体积百分比,将内生性生长的程度进行量化,直观展现肿瘤与肾实质关系的密切程度。肿瘤的大小和生长方式还可影响肿瘤侵入实质的深度。肿瘤浸润深度直接影响肾部分切除的深度,已被证实是影响肾部分切除术实施及术后并发症发生率的重要因素[13-14],测定该指标可帮助医师把握肾部分切除的深度。此外,CT三维可视化可清晰显示肿瘤所处位置,据此可决定手术入路、肿瘤切除及缝合的难易程度。
肿瘤与其周围未受累的肾实质的接触面积是影响肾切除和缝合的重要因素。Leslie等[15]报道肿瘤接触面积(contact surface area,CSA)是手术时间、术后并发症、住院日和术后肾功能的独立预测指标,且与目前的评分系统相比,CSA在预测围手术期事件时可能更准确。已报道的CSA估算方法包括肿瘤总表面积与肾内肿瘤体积百分比的乘积、2πrd(r为肿瘤半径、d为浸润深度)[16],这些基于数学模型的计算结果显示出CSA与围手术期参数及术后肾功能的相关性,证明了CSA在肾部分切除术中的预测价值,更准确的CSA评估方式还有待研究。Takagi等[17]报道了手动描绘结合自动计算CSA的方法,但该方法需花费大量时间精力。本研究推荐利用三维可视化技术智能拟合肾肿瘤与肾实质接触平面并计算其面积,为肾部分切除术创面大小提供参考,同时,另一接触面相关参数为肿瘤肾实质接触面平整度,可警示泌尿外科医师在切除肾肿瘤时肿瘤边界是否规则,若接触面局部有凸出的肿瘤,切除时则需格外小心,避免切破肿瘤或对正常肾实质造成不必要的损伤,在完全切除肿瘤的同时尽可能多地保留肾实质。
肾血管变异包括动、静脉血管走行或数量的变异,血管变异会影响手术的安全性,同时也会使手术并发症风险增加。腹腔镜下肾部分切除术的关键步骤即为处理脉管系统,因此,术前了解肾血管变异十分重要。副肾动脉是最常见的血管变异,大约会出现在1/3的患者,副肾动脉的存在可能会导致肾门阻断不完全,引起严重的术中出血、并发症发生或肿瘤切缘阳性。常见的静脉变异包括肾静脉过多、静脉过晚融合、主动脉后左肾静脉等,静脉变异对肾部分切除术的影响较小,但术前识别这些变异,可降低术中血管损伤的可能性。CT三维可视化在识别血管方面有特别的优势,通过旋转、缩放、透明化、组合显示等工具可以清晰显示肾及肿瘤的血供情况,个体化制定手术计划,有利于在适当的病例中辅助完成选择性肾动脉阻断肾部分切除术。
肾周脂肪的数量和性质可影响肾门解剖、术野暴露、肿瘤切除和肾脏缝合等重要手术操作,疏松的肾周脂肪可以轻松地完成游离与显露,而大量、致密的脂肪在一定程度上会影响肾部分切除术的进行。术前评估患者肾周脂肪的情况对手术有一定的帮助。尽管BMI被广泛用于反映个体的肥胖度,但目前研究表明BMI与肾部分切除术的围手术期参数之间没有相关性[18-19],因为BMI不能区分脂肪和肌肉的质量以及内脏脂肪和皮下脂肪。肾周脂肪厚度的定义为从肾包膜到肾周筋膜在肾静脉的延长线上的距离。Macleod等[20]比较了肾周脂肪、BMI、腹部肥胖对于机器人辅助肾部分切除术难度的预测价值,发现肾周脂肪的测量与术中失血量、手术时间的增加有关。除了肾周脂肪数量,脂肪的性质对肾部分切除术也有很大影响。梅奥粘连概率(Mayo adhesive probability,MAP)有助于预测黏性肾周脂肪的可能性,以评估肾部分切除术的困难程度。本评分系统纳入肾周脂肪的表面积、体积和CT值用于评价肾周脂肪的数量及性质,评估具有“黏性”的脂肪的数量,以预测肾部分切除术手术过程中游离肾脏和暴露肾血管的难度。
重建后的三维影像可在Touch Viewer系统上进行缩放、旋转、组合显示、颜色调整、透明化、长度和体积自动测量及模拟裁切等操作,满足术前虚拟手术规划及术中辅助导航的要求,流程一般为:(1)打开三维可视化结果;(2)设置显示或隐藏组织;(3)调整组织器官透明度;(4)旋转、缩放,调整图像与手术患者体位一致;(5)全屏显示,或导入手术机器人系统,进一步帮助手术医师把握手术过程及术中变化(图 7)。
本研究初步探究CT三维重建在肾部分切除术中的应用价值,分析三维图像下的相关参数对手术时间、肾动脉阻断时间、出血量、并发症等的预测价值,但仍有一定的不足。首先,受限于回顾性研究及样本量,我们仅分析了三维指标与围手术期参数的相关性,没有进一步分析因果关系。其次,对于存在相关性的指标,需进一步探究评价细则以更好地预测手术难度及并发症的风险,对于没有相关性的指标,原因可能是样本量不足所导致的偏倚;此外,仍有部分指标尚未实现定量评价,如血管变异,细化分型有助于进一步提高本评分系统的临床应用价值。最后,本文报告的结果为单中心经验,由于本中心为综合转诊医院,可能存在患者的选择偏倚,未来需通过多中心前瞻性研究进一步证实以推广。
综上,CT三维可视化可清晰显示肿瘤解剖参数及血供、脂肪等信息,综合这些信息构成肾肿瘤三维可视化评价系统可帮助预测肾部分切除术的手术难度、围术期并发症、术后肾功能等。重建的三维图像导入指定程序或机器人操作系统即可完成虚拟手术及术中辅助导航,帮助手术医师更好地把握手术过程。评分系统所包含的指标及各项指标的分值权重尚需根据多中心大样本的研究来证实及完善。
附:泌尿系疾病三维可视化技术流程规范
三维可视化作为数字医学技术的一种影像学工具,采用计算机图像处理技术将CT或MRI图像数据经过工作站处理,导入三维可视化成像软件系统对数据进行分割、融合、计算、渲染等操作,构建出立体的三维模型。该模型可对目标病灶、相关脏器和脉管系统的精确位置、空间解剖结构、形态及容积等信息进行多角度和全方位的描述和解释,可为临床医师提供直观的视觉体验和全量化信息,对术前准确诊断、个体化手术方案的规划和手术风险的预估具有很高价值。
经过数年的发展,三维可视化技术在保留肾单位手术、尿路重建手术、经皮肾镜碎石术以及活体肾移植中均有着广泛应用。北京大学泌尿外科研究所从2018年1月开始采用三维可视化技术评估手术患者,并深入应用到临床实践之中。
为更好地规范三维可视化技术在泌尿外科的应用,我们根据经验总结了三维可视化操作流程,并从三维可视化技术的数据输入、处理以及报告输出三个方面建立了三维可视化临床技术标准,供临床参考。
1. 三维可视化技术输入标准
1.1. CT扫描标准
(1) 推荐64排及以上CT扫描,包含平扫+增强(肾皮髓质期、肾实质期及排泄期)扫描。(2)患者取仰卧位,头足方向扫描,深吸气后屏住呼吸; 扫描矩阵512×512, 机架旋转速度0.5~0.75 s/圈,扫描条件120 kV、200~250 mA(建议采用管电流自动调制技术);扫描范围为膈肌至耻骨联合;对比剂采用碘造影剂(碘海醇,350 mg I/mL),以3 mL/s速率注射。(3)扫描层厚1.0 mm、层间距1.0 mm,普通层厚2.5 mm、层间距2.5 mm,薄层标准层厚0.6 mm、层间距0.6 mm。(4)肾皮髓质期延时时间为20~25 s,肾实质期延时时间为60~70 s,肾排泄期延时时间为3~5 min,必要时排泄期可延长更长时间。(5)保存DICOM数据格式,数据层厚0.625~1.500 mm。
1.2. MRI扫描标准
(1) 推荐1.5 T及以上MRI设备进行平扫+增强扫描,先行T1WI及T2WI平扫,后增强扫描。(2)检查前患者在检查床上反复训练,能良好屏气20 s以上,取仰卧位,头足方向扫描,视野为420 mm×300 mm,扫描层厚2.0~3.0 mm,层间距2.0~3.0 mm。(3)MRI平扫:①T1WI:横断位,T1WI采用屏气二维相扰梯度回波序列,双回波扰相回波序列(正相位:TR 190 ms,TE 4.4 ms;反相位:TR 190 ms);②脂肪抑制T2WI:横断位,T2WI呼吸触发脂肪抑制快速恢复自旋回波扫描(TR/TE:5 000/81 ms)。(4)MRI增强:薄层动态增强扫描,采用T1WI序列,如需包含全泌尿系,建议动态增强采用冠状位扫描;注射造影剂后三期扫描:动脉期12~40 s,静脉期40~75 s,延迟期85~110 s。(5)保存DICOM数据格式,数据层厚0.625~1.5 mm。
2. 三维可视化技术处理标准
2.1. 软件系统及功能要求
软件资质需取得国家食品药品监督管理总局等注册认证,且为便于下级医院使用,手术规划功能应支持Web操作浏览,支持移动多终端查阅。
2.1.1. 三维可视化重建模块
(1) 实体脏器:肾、肾上腺成像模块;(2)空腔脏器:输尿管、膀胱和血管三维成像模块。
2.1.2. 手术规划模块
可以自定义扩大占位病变轮廓边界,从而更好地设计R0切除方案。具备三维图像和二维图像的映射交互功能,方便交互查看二维和三维图形。
2.1.3. 软件系统性能指标
(1) 实体脏器体积测量:误差在±5%内;(2)血管成像:根据临床需求和影像质量情况,血管实现3~5级以上成像;(3)输尿管系统成像:根据临床需求和影像质量,扩张输尿管系统,实现2~3级以上成像;(4)肾切除手术规划测量:占位扩展半径0~20 mm,立体空间距离测量误差在±5%内,映射成像误差≤±5%;
2.2. 三维可视化技术人员要求
具有医学影像、临床医学专业背景的技术人员以及具备临床经验的医生在软件培训后均可进行三维可视化图像处理操作,或可根据实际情况委托专业第三方机构开展。
2.3. 三维可视化重建范围及标准
常规重建范围为目标病变(占位、囊肿、结石等)、腹腔及盆腔脏器(包括肾上腺、肾、输尿管、膀胱、胰腺、脾、十二指肠、空回肠与结直肠等)、相应脉管系统(主要为腹主动脉、下腔静脉、髂内和髂外动静脉及其分支等,特别注意应包括肾动静脉以及性腺动静脉,同时对于增大的淋巴结也应重建出来),另外也应包括相邻的皮肤、肌肉以及骨骼。值得注意的是,凡有变异血管,特别是影响手术规划的变异血管应纳入重建范围。此外,为更准确地完成重建,还应结合患者病史、相关检查、体征、CT报告等,特殊情况或者合并疾病需以个体化诊疗需求为准,单独考虑重建范围。
3. 影像报告标准
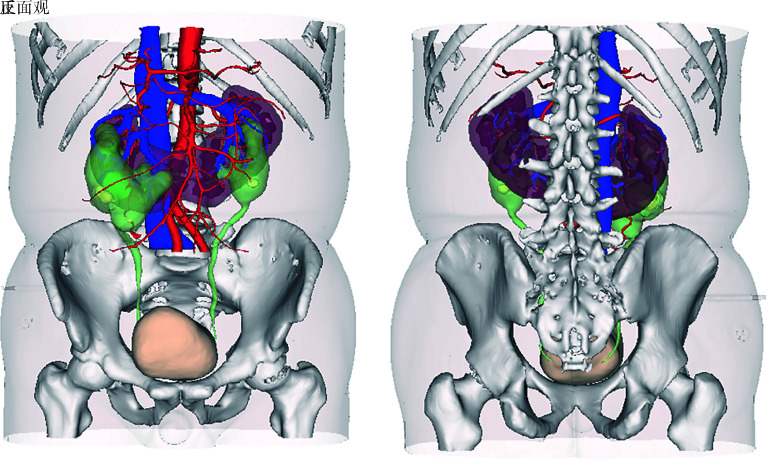
影像报告应包括:(1)医院、科室、患者等基本信息;(2)三维可视化模型正、反面整体视图(图 1);(3)各组织脏器、病变、结石等体积信息;(4)占位与周边组织器官以及血管的关系(图 2);(5)血管及输尿管如有变异需在报告中特别指出并提示(图 3);(6)对原始影像资料的评估分析;(7)条件允许的情况下应标记变异分型;(8)条件允许的情况下应提供模拟手术方案供参考。
图 1.
三重建模形整体视图(马蹄肾、双肾积水)
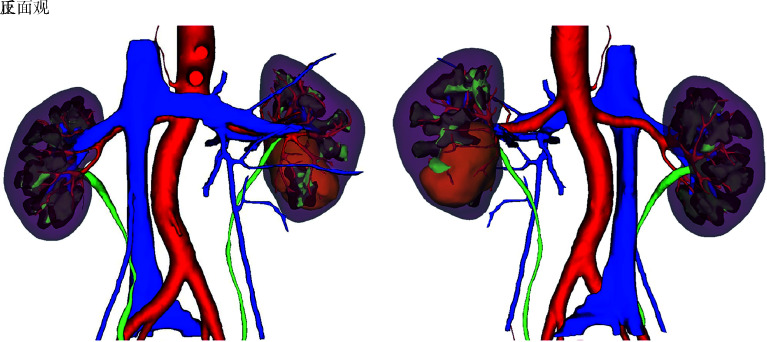
图 2.
占位与肾实质、肾盂、肾盏以及血管的关系(左肾肿瘤)
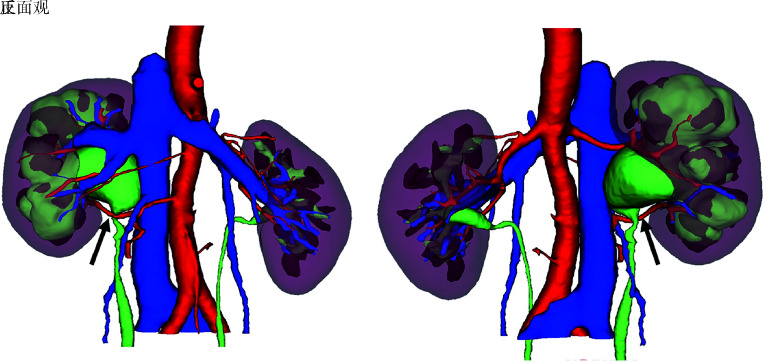
图 3.
肾实质、肾盂、肾盏及输尿管与动脉、静脉的关系(右肾积水,箭头示左肾下极异位动脉)
总之,泌尿外科和影像科医生可参考本规范,使三维可视化结果同质化,具有可比性和可信度,为建设标准化疾病大数据和样本库平台奠定基础,提高泌尿系疾病诊疗技术水平。
(2020-08-19 收稿)
(本文编辑: 赵波)
“泌尿系疾病三维可视化技术流程规范”参与研究和撰写者名单:北京大学第一医院泌尿外科,北京大学泌尿外科研究所,国家泌尿、男性生殖系肿瘤研究中心彭意吉、熊盛炜、唐琦、杨昆霖、谢家馨、李学松、周利群;北京大学第一医院影像科王鹤;贵阳市第二人民医院泌尿外科梅傲冰。
Contributor Information
唐 琦 (Qi TANG), Email: drtangq@163.com.
李 学松 (Xue-song LI), Email: pineneedle@sina.com.
References
- 1.Rossi SH, Klatte T, Usher-Smith J, et al. Epidemiology and screening for renal cancer. World J Urol. 2018;36(9):1341–1353. doi: 10.1007/s00345-018-2286-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Motzer RJ, Jonasch E, Agarwal N, et al. Kidney cancer, version 2. NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2017;15(6):804–834. doi: 10.6004/jnccn.2017.0100. [DOI] [PubMed] [Google Scholar]
- 3.Campbell S, Uzzo RG, Allaf ME, et al. Renal mass and localized renal cancer: AUA guideline. J Urol. 2017;198(3):520–529. doi: 10.1016/j.juro.2017.04.100. [DOI] [PubMed] [Google Scholar]
- 4.Ficarra V, Novara G, Secco S, et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery. Eur Urol. 2009;56(5):786–793. doi: 10.1016/j.eururo.2009.07.040. [DOI] [PubMed] [Google Scholar]
- 5.Kutikov A, Uzzo RG. The R.E.N.A.L. nephrometry score: A comprehensive standardized system for quantitating renal tumor size, location and depth. J Urol. 2009;182(3):844–853. doi: 10.1016/j.juro.2009.05.035. [DOI] [PubMed] [Google Scholar]
- 6.Simmons MN, Ching CB, Samplaski MK, et al. Kidney tumor location measurement using the C index method. J Urol. 2010;183(5):1708–1713. doi: 10.1016/j.juro.2010.01.005. [DOI] [PubMed] [Google Scholar]
- 7.Hew MN, Baseskioglu B, Barwari K, et al. Critical appraisal of the PADUA classification and assessment of the R.E.N.A.L. nephrometry score in patients undergoing partial nephrectomy. J Urol. 2011;186(1):42–46. doi: 10.1016/j.juro.2011.03.020. [DOI] [PubMed] [Google Scholar]
- 8.Wadle J, Hetjens S, Winter J, et al. Nephrometry scores: The effect of imaging on routine read-out and prediction of outcome of nephron-sparing surgery. Anticancer Res. 2018;38(5):3037–3041. doi: 10.21873/anticanres.12559. [DOI] [PubMed] [Google Scholar]
- 9.Porpiglia F, Amparore D, Checcucci E, et al. Current use of three-dimensional model technology in urology: A road map for personalised surgical planning. Eur Urol Focus. 2018;4(5):652–656. doi: 10.1016/j.euf.2018.09.012. [DOI] [PubMed] [Google Scholar]
- 10.Cartiaux O, Paul L, Francq BG, et al. Improved accuracy with 3D planning and patient-specific instruments during simulated pelvic bone tumor surgery. Ann Biomed Eng. 2014;42(1):205–213. doi: 10.1007/s10439-013-0890-7. [DOI] [PubMed] [Google Scholar]
- 11.Wu J, Li Y, Zhang Y. Use of intraoral scanning and 3-dimensional printing in the fabrication of a removable partial denture for a patient with limited mouth opening. J Am Dent Assoc. 2017;148(5):338–341. doi: 10.1016/j.adaj.2017.01.022. [DOI] [PubMed] [Google Scholar]
- 12.Porpiglia F, Amparore D, Checcucci E, et al. Three-dimensional virtual imaging of renal tumours: A new tool to improve the accuracy of nephrometry scores. BJU Int. 2019;124(6):945–954. doi: 10.1111/bju.14894. [DOI] [PubMed] [Google Scholar]
- 13.Tannus M, Goldman SM, Andreoni C. Practical and intuitive surgical approach renal ranking to predict outcomes in the management of renal tumors: A novel score tool. J Endourol. 2014;28(4):487–492. doi: 10.1089/end.2013.0148. [DOI] [PubMed] [Google Scholar]
- 14.Nisen H, Ruutu M, Glucker E, et al. Renal tumour invasion index as a novel anatomical classification predicting urological complications after partial nephrectomy. Scand J Urol. 2014;48(1):41–51. doi: 10.3109/21681805.2013.797491. [DOI] [PubMed] [Google Scholar]
- 15.Leslie S, Gill IS, de Castro AA, et al. Renal tumor contact surface area: A novel parameter for predicting complexity and outcomes of partial nephrectomy. Eur Urol. 2014;66(5):884–893. doi: 10.1016/j.eururo.2014.03.010. [DOI] [PubMed] [Google Scholar]
- 16.Hsieh PF, Wang YD, Huang CP, et al. A mathematical method to calculate tumor contact surface area: An effective parameter to predict renal function after partial nephrectomy. J Urol. 2016;196(1):33–40. doi: 10.1016/j.juro.2016.01.092. [DOI] [PubMed] [Google Scholar]
- 17.Takagi T, Yoshida K, Kondo T, et al. Association between tumor contact surface area and parenchymal volume change in robot-assisted laparoscopic partial nephrectomy carried out using the enucleation technique. Int J Urol. 2019;26(7):745–751. doi: 10.1111/iju.14004. [DOI] [PubMed] [Google Scholar]
- 18.Kiziloz H, Dorin R, Finnegan KT, et al. The impact of body mass index on perioperative outcomes in robot-assisted laparoscopic partial nephrectomy. J Endourol. 2013;27(8):1000–1007. doi: 10.1089/end.2012.0665. [DOI] [PubMed] [Google Scholar]
- 19.Gong EM, Orvieto MA, Lyon MB, et al. Analysis of impact of body mass index on outcomes of laparoscopic renal surgery. Urology. 2007;69(1):38–43. doi: 10.1016/j.urology.2006.09.020. [DOI] [PubMed] [Google Scholar]
- 20.Macleod LC, Hsi RS, Gore JL, et al. Perinephric fat thickness is an independent predictor of operative complexity during robot-assisted partial nephrectomy. J Endourol. 2014;28(5):587–591. doi: 10.1089/end.2013.0647. [DOI] [PubMed] [Google Scholar]