Abstract
Epilepsien stellen nach Demenzen und Schlaganfall die dritthäufigste neurologische Krankheitsgruppe bei älteren Menschen dar. Die Inzidenz der Epilepsien steigt im Alter, sodass aufgrund demografischer Entwicklungen in den kommenden Jahren mit einer weiteren Zunahme älterer Patienten mit Epilepsie zu rechnen ist. Die häufigsten Ursachen der Altersepilepsie stellen zerebrovaskuläre Erkrankungen und Demenzen dar. Anfälle bei älteren Menschen werden oft spät erkannt. Das Auftreten eines Status epilepticus ist bei älteren Patienten häufiger und mit erhöhter Morbidität und Letalität vergesellschaftet. Die medikamentöse Behandlung älterer Patienten wird durch Komorbiditäten und Polypharmazie erschwert, wobei Antiepileptika mit geringem Interaktionsprofil und guter Verträglichkeit zur Behandlung der Altersepilepsie gewählt werden sollten. Levetiracetam und Lamotrigin sind aufgrund geringer Interaktionen und guter Verträglichkeit Antiepileptika erster Wahl beim älteren Patienten.
Schlüsselwörter: Anfälle, Status epilepticus, Antiepileptika, Polypharmazie, Komorbiditäten
Abstract
Epilepsy is the third most frequent neurological disorder in aged patients after stroke and dementia. The incidence of epilepsy increases with age with the highest rates in patients ≥ 65 years old. Due to demographic changes the number of aged patients with epilepsy is expected to increase further in the coming years. The leading cause of new onset epilepsy in aged patients is cerebrovascular disease followed by dementia. The recognition of seizures in aged patients is often delayed. Status epilepticus occurs more frequently in aged patients and is associated with a high mortality and morbidity. Antiepileptic drug (AED) treatment of aged patients is complicated by comorbidities and polypharmacy and AEDs with a low interaction profile and high tolerability should be selected. Levetiracetam and lamotrigine are the AEDs of choice due to low interactions and good tolerability.
Keywords: Seizures, Status epilepticus, Antiepileptic drugs, Polypharmacy, Comorbidities
Lernziele
Nach der Lektüre dieses Beitrags
können Sie die häufigsten Ursachen der Altersepilepsie nennen.
erkennen Sie klinische Zeichen, die auf einen epileptischen Anfall bei älteren Patienten hindeuten können.
kennen Sie wichtige Differenzialdiagnosen der Epilepsie und deren Diagnostik.
können Sie grundlegende Überlegungen zur Wahl des geeigneten Antiepileptikums bei älteren Patienten anstellen.
Einleitung
Epilepsien sind die dritthäufigste neurologische Erkrankung
neurologische Erkrankung
beim älteren Menschen [1] und mit einer Vielzahl sozioökonomischer Probleme vergesellschaftet. Epilepsie ist definiert als das Auftreten von mindestens 2 unprovozierten Anfällen im Abstand > 24 h oder Auftreten eines unprovozierten Anfalls und Vorliegen von Befunden, die die Wahrscheinlichkeit eines weiteren Anfalls auf > 60 % erhöhen [2]. Die Prävalenz der Epilepsie nimmt im Alter zu und steigt auf 1–2 % bei über 85-Jährigen [3, 4]. „Altersepilepsie“ wird meist als das Auftreten einer Epilepsie bei Menschen ≥ 60 Jahre definiert [5, 6]. Aufgrund der demografischen Entwicklungen ist mit einem weiteren Anstieg von Epilepsien zu rechnen. Neben der Betreuung von immer älter werdenden Patienten mit Epilepsie stellt somit insbesondere die Neudiagnose Epilepsie beim alten Menschen den behandelnden Arzt, den Patienten, Familie und Pflegepersonal vor eine Reihe von Herausforderungen in Diagnostik, Therapie und Management.
Fallbeispiel
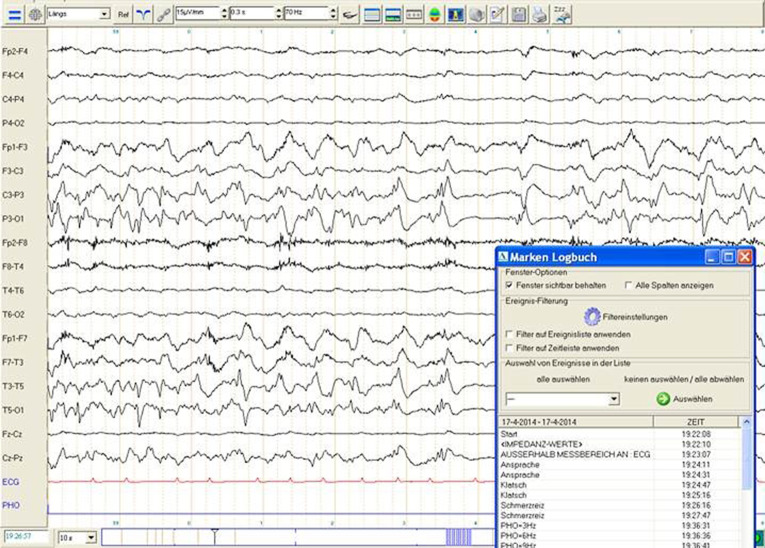
Eine 86-jährige Patientin wird aufgrund von Verwirrtheit mit der Rettung aus dem Seniorenheim in die Notfallambulanz transferiert. Hypertonie, Diabetes Typ 2 und Niereninsuffizienz sind vordiagnostiziert. Vor 2 Jahren hatte die Patientin einen linksseitigen ischämischen Mediainfarkt mit residualer Feinmotorikstörung und Wortfindungsstörungen. Am Aufnahmetag war die Patientin beim Frühstück unauffällig; eine halbe Stunde später fand sie die Pflegerin ohne Reaktion auf Ansprache, mit Blickwendung nach rechts und kauenden Mundbewegungen vor. Nach wenigen Minuten wurde die Patientin unruhig und befolgte keine Aufforderungen. Im Krankenhaus war sie wach, agitiert, ohne Paresen mit fehlender Sprachproduktion. In der Akut-CT des Schädels stellte sich ein linksseitiger temporaler ischämischer Defekt, ohne rezente Pathologie, dar. Das Akut-EEG (Elektroenzephalogramm) zeigte ein Statusmuster über links temporoparietal (Abb. 1). Durch die i.v.-Gabe von 2 mg Lorazepam und 1 g Levetiracetam konnte der Status durchbrochen werden. Die Patientin wurde zunehmend klarer, befolgte Aufforderungen, benannte Gegenstände korrekt und konnte nachsprechen. Die Diagnose eines Status aphasicus, ätiologisch residual („remote“) symptomatisch nach linksseitigem ischämischem Mediainfarkt, wurde gestellt und eine antiepileptische Therapie eingeleitet, worunter die Patientin anfallsfrei ist.
Ursachen epileptischer Anfälle bei älteren Patienten
Die steigende Inzidenz und Prävalenz von Epilepsie im Alter lassen sich durch den demografischen Wandel und mit der Zunahme der zugrunde liegenden Ätiologien der Altersepilepsie erklären.
Zerebrovaskuläre Erkrankungen und Altersepilepsie
Während bei jüngeren Patienten genetische Epilepsiesyndrome, Entwicklungsstörungen des Gehirns, Hippocampussklerose oder Hirntumoren die häufigsten identifizierbaren Ursachen sind, stehen bei alten Patienten Anfälle in Verbindung mit zerebrovaskulären Erkrankungen (ischämischer oder hämorrhagischer Schlaganfall
Schlaganfall
) an erster Stelle. Das Auftreten epileptischer Anfälle im Rahmen eines Schlaganfalls innerhalb von 7 Tagen (akut symptomatisch) oder mit zeitlicher Latenz nach stattgehabtem Schlaganfall (Remote oder residual symptomatisch) ist für beinahe die Hälfte aller Anfälle im Alter verantwortlich [8]. Bis zu 25 % aller Patienten erleiden nach einem Schlaganfall einen epileptischen Anfall [9]; das Risiko, eine Epilepsie zu entwickeln, beträgt 4 % nach einem Jahr und steigt nach 5 Jahren auf 8 % an [10]. Hämorrhagische Schlaganfälle und intrazerebrale Blutungen
intrazerebrale Blutungen
gehen mit einem noch höheren Risiko für epileptische Anfälle von 5–17 % einher [11]. Prädiktoren für das Auftreten epileptischer Anfälle nach ischämischem Schlaganfall sind ein kortikales Infarktareal, Infarkte im Versorgungsgebiet der A. cerebri media, eine arterioarterielle Ursache, schwere neurologische Ausfallsymptomatik (National Institutes of Health Stroke Scale [NIHSS] ≥ 11) und frühe Anfälle (< 24–48 h) [10]. Akut symptomatische Anfälle im Rahmen eines Schlaganfalls stellen häufig eine diagnostische Herausforderung in der Akutversorgung dar, da insbesondere eine postiktale Lähmung
postiktale Lähmung
(Todd-Parese) klinisch nicht von einer Parese im Rahmen einer frischen Ischämie unterschieden werden kann. Die Identifikation einer akuten Durchblutungsstörung
akuten Durchblutungsstörung
und deren umgehende Behandlung mithilfe der systemischen Lyse und/oder Thrombektomie im Falle des Verschlusses eines großen Gefäßes sind jedoch von größter Bedeutung und entscheidend für das Outcome.
Die Beziehung zwischen Epilepsie und zerebrovaskulären Erkrankungen ist nicht unidirektional. Das Risiko, einen Schlaganfall zu erleiden, ist bei Patienten mit spät beginnender Epilepsie erhöht („epilepsia praecursiva“
„epilepsia praecursiva“
, [12]), wobei dies z. T. durch gemeinsame Risikofaktoren erklärt werden kann. Eine populationsbasierte Kohortenstudie in Finnland, die 245 Patienten mit Anfallsbeginn in der Kindheit und unkompliziertem Verlauf für 45 Jahre nachverfolgte, stellte fest, dass auch unabhängig von vaskulären Risikofaktoren MR-tomographische vaskuläre Läsionen in der Gruppe der Epilepsiepatienten signifikant häufiger waren [13]. Die engmaschige Kontrolle und Behandlung vaskulärer Risikofaktoren ist somit insbesondere bei älteren Epilepsiepatienten von großer Bedeutung.
Merke
Zerebrovaskuläre Erkrankungen sind die häufigste zugrunde liegende Ursache der Altersepilepsie.
Patienten mit Epilepsie im Alter haben auch im Fall keiner zerebrovaskulären Ursache der Epilepsie ein erhöhtes Risiko, einen Schlaganfall zu erleiden; Risikofaktoren sollten somit engmaschig kontrolliert werden.
Cave
Eine akute zerebrale Ischämie als Ursache eines akut symptomatischen Anfalls muss, insbesondere bei Fortbestehen einer Parese nach Sistieren des epileptischen Anfalls, mithilfe der zerebralen MRT ausgeschlossen werden, um keine wichtige Behandlungsoption zu verpassen.
Demenz und Altersepilepsie
Eine zweite wichtige Ursache der Altersepilepsie stellen Demenzerkrankungen dar, die etwa 10–20 % der neu beginnenden Epilepsien zugrunde liegen [14]. Eine Fall-Kontroll-Studie in Großbritannien fand bei Patienten mit Demenz vom Alzheimer-Typ (DAT
DAT
) eine Inzidenzrate epileptischer Anfälle von 5,6/1000 Personenjahren und bei vaskulärer Demenz von 7,5/1000 Personenjahren. Im Vergleich hierzu lag die Inzidenzrate epileptischer Anfälle in der gleichaltrigen Kontrollgruppe ohne Demenz bei 0,8/1000 Personenjahren [15]. Die Prävalenz epileptischer Anfälle bei Patienten mit DAT beträgt etwa 5 % [16], und das Risiko, eine Epilepsie zu entwickeln, ist um das bis zu 10-Fache erhöht [17]. Die Beziehung zwischen Epilepsie und Demenz ist jedoch, noch mehr als beim Schlaganfall, bidirektional: Ältere Patienten mit neu diagnostizierter Epilepsie weisen bereits vor Therapiebeginn häufiger kognitive Defizite
kognitive Defizite
auf als gleichaltrige Kontrollpersonen [18] und haben ein 1,5-faches Risiko, innerhalb von 8 Jahren eine Demenz zu entwickeln [19]. Insbesondere bei Patienten mit Temporallappenepilepsie
Temporallappenepilepsie
(TLE) sind Gedächtnisprobleme ein häufig berichtetes Symptom, wobei bildgebende und neurophysiologische Studien gemeinsame Charakteristika von milder kognitiver Beeinträchtigung („mild cognitive impairment“, MCI) und Temporallappenepilepsie aufzeigen konnten [20]. Funktionelle Studien mithilfe der simultanen Elektroenzephalographie und des „functional magnetic resonance imaging“ (EEG-fMRI) fanden eine Abnahme der Konnektivität im „default mode network“ bei Patienten mit TLE [21], die auch bei Patienten mit MCI und DAT in ähnlicher Form beschrieben wurde [22] und negativ mit Kognition und Gedächtnisleistung assoziiert ist. Ein wesentlicher Faktor, der Epilepsie und Demenz verbindet, sind auch hier gemeinsame vaskuläre Risikofaktoren. Zudem wurden bei Patienten mit langjähriger Epilepsie signifikant häufiger Amyloidablagerungen
Amyloidablagerungen
im präfrontalen Kortex mithilfe der Amyloid-Positronen-Emissions-Tomographie nachgewiesen als bei gleichaltrigen Kontrollpersonen, was eine gemeinsame zugrunde liegende Pathophysiologie von Epilepsie und Demenz vermuten lässt [23]. Des Weiteren fand sich bei Patienten mit therapieresistenter TLE, die einem epilepsiechirurgischen Eingriff unterzogen wurden, in 94 % der Fälle (31/33 Patienten) hyperphosphoryliertes Tau-Protein
hyperphosphoryliertes Tau-Protein
in den Gewebsproben, wobei ein höheres Ausmaß der damit verbundenen Pathologie mit schlechterer kognitiver Leistung assoziiert war [24]. Es ist jedoch weiterhin Gegenstand intensiver Forschung, inwieweit gemeinsame zugrunde liegende Pathomechanismen die Entwicklung beider Erkrankungen bedingen, und welchen Einfluss Faktoren wie Anfallsfrequenz, Frequenz interiktaler epileptiformer Potenziale und Antiepileptikatherapie auf die Entwicklung kognitiver Defizite bei Epilepsiepatienten haben.
Merke
Patienten mit Demenz, insbesondere DAT und vaskulärer Demenz, weisen ein erhöhtes Risiko auf, eine Epilepsie zu entwickeln, jedoch ist auch das Risiko der Entwicklung kognitiver Defizite und Demenz bei Epilepsiepatienten erhöht.
Kognitive Einschränkungen sind insbesondere bei TLE häufig und oft der am stärksten die Lebensqualität einschränkende Faktor.
Herausforderungen in der Diagnostik
Anfälle bei alten Menschen werden häufig erst spät erkannt [25], und die Rate an initialen Fehldiagnosen ist hoch [14]. Ein Grund hierfür ist die Semiologie, die sich von jüngeren Erwachsenen unterscheidet. Im Alter treten Anfälle oft in Form fokal nicht bewusst erlebter Anfälle mit Arrest, ohne klassische Symptome wie Automatismen oder psychische Phänomene, auf [26, 27, 28], und bilateral tonisch klonische Anfälle sind im Vergleich zu jungen Erwachsenen (65 %) seltener (26 %) [27]. Auren werden seltener berichtet und manifestieren sich oft unspezifisch in Form von Schwindel [27]. Symptome wie Innehalten oder eine häufig prolongiert bestehende postiktale Desorientiertheit
postiktale Desorientiertheit
[28] können z. B. als Verwirrtheitszustand im Rahmen einer Demenz fehlinterpretiert werden. Patienten selbst können teils aufgrund kognitiver Einschränkungen im Rahmen der zugrunde liegenden Erkrankungen wie Schlaganfall oder Demenz keine detaillierte Aussage über Symptome im Rahmen des Anfalls treffen. Die Diagnosestellung kann in diesen Fällen insbesondere bei zudem fehlender Fremdanamnese herausfordernd sein. Da alte Menschen häufiger allein leben und z. B. aufgrund eingeschränkter Mobilität teils weniger an gesellschaftlichen Ereignissen teilnehmen können, stellt soziale Isolation
soziale Isolation
einen weiteren erschwerenden Faktor in der korrekten Diagnosestellung dar [14].
Die Diagnose Epilepsie stellt alte Menschen vor eine Vielzahl psychosozialer Herausforderungen, da diese zu weiteren Einschränkungen von Selbstständigkeit und Mobilität z. B. durch Fahruntauglichkeit oder Angst vor Stürzen im Rahmen von Anfällen beitragen kann. Das Risiko anfallsassoziierter Verletzungen
anfallsassoziierter Verletzungen
durch Stürze ist bei alten Menschen hoch [29, 30], wobei Frakturen zu Krankenhausaufenthalten, weiterer Immobilisierung, Isolation und Langzeitmorbidität führen können.
Wichtigste Differenzialdiagnosen
Eine der wichtigsten Differenzialdiagnosen epileptischer Anfälle beim alten Menschen stellen, wie auch bei jüngeren Patienten, Synkopen dar. Diese können meist durch gezielte Eigen- und Fremdanamnese mit speziellem Augenmerk auf Trigger-Faktoren (z. B. langes Stehen, körperliche Anstrengung, Hitze, Miktion etc.), Prodromalsymptomatik (ungerichteter Schwindel, Herzstolpern, Übelkeit etc.) und Dauer von epileptischen Anfällen differenziert werden. Neben Reflexsynkopen
Reflexsynkopen
, die die häufigste Ursache von Synkopen in jedem Lebensalter darstellen, muss bei alten Menschen aufgrund der häufig bestehenden kardialen Komorbiditäten eine kardiogene (arrhythmogene oder strukturelle) Genese ausgeschlossen werden. Insbesondere arrhythmogene Synkopen
arrhythmogene Synkopen
müssen aufgrund ihrer ungünstigen Prognose rasch erkannt und behandelt werden [31]. Die Durchführung eines Elektrokardiogramms (EKG) sowie, dem kardiovaskulären Risikoprofil entsprechend, die Anamnese (Palpitationen, Synkope bei körperlicher Anstrengung, Angina-pectoris-Symptomatik etc.) und Erhebung des klinischen Befunds, ergänzend eine Echokardiographie, sowie ggf. ein Langzeit-EKG sollten im Fall eines passageren Bewusstseinsverlustes erfolgen [31]. Synkopen, einhergehend mit motorischen Entäußerungen (konvulsive Synkopen
konvulsive Synkopen
), sind selten [32], können jedoch eine spezielle Herausforderung in der Differenzierung zu epileptischen Anfällen darstellen [33, 34]. Im Gegensatz zu bilateral tonisch klonischen Anfällen bestehen oft unspezifische Prodromi, gefolgt von einem Bewusstseinsverlust mit tonischer Extension der beidseitigen Arme und nachfolgend irregulären Zuckungen, die meist kürzer (20–30 s) andauern und mit rascher Reorientierung einhergehen. Die Fremdanamnese sollte insbesondere auf lateralisierende Zeichen
lateralisierende Zeichen
wie Herdblick, Kopfversion, einseitige motorische Entäußerungen und nachfolgende Verwirrtheit eingehen. Harnverlust kann auch bei konvulsiven Synkopen vorkommen, weist jedoch ebenso wie ein seitlicher Zungenbiss auf eine epileptische Genese hin. Laborchemisch zeigt sich nach epileptischen Anfällen meist ein Konzentrationsanstieg der Kreatinkinase
Kreatinkinase
(CK) als Folge der ausgeprägten motorischen Aktivität im Anfall.
Weitere wichtige Differenzialdiagosen epileptischer Anfälle stellen bei alten Menschen, aufgrund der klinischen Präsentationsform (Sprachstörung, Desorientiertheit, Areagibilität ohne motorische Phänomene) sowohl transitorisch ischämische Attacken, eine beginnende Demenz als auch ein Delir unterschiedlicher Ursache dar. Basislaboruntersuchungen
Basislaboruntersuchungen
mit Bestimmung von Blutzucker, Elektrolyten, Nieren- und Leberfunktionsparametern, einschließlich Ammoniak, bilden die Grundlage der Diagnostik. Elektrolytstörungen
Elektrolytstörungen
wie z. B. Hyponatriämien können sich insbesondere im Rahmen einer Diuretikatherapie oder antidepressiven Medikation mit selektiven Serotonin-Wiederaufnahmehemmern (SSRI) präsentieren. Hypoglykämien
Hypoglykämien
unter antidiabetischer Therapie sind bei älteren Patienten häufig und äußern sich in Form von fluktuierender Desorientiertheit oder Vigilanzschwankungen [35]. Auch Intoxikationen
Intoxikationen
sollten in der Akutdiagnostik ausgeschlossen werden. Eine akute Bildgebung ist in der Diagnostik unklarer Episoden mit Bewusstseinsbeeinträchtigung essenziell, um Pathologien mit fluktuierendem Verlauf wie z. B. Subduralhämatome unter oraler Antikoagulation etc. auszuschließen.
Die Elektroenzephalographie
Elektroenzephalographie
stellt in der Diagnostik epileptischer Anfälle, insbesondere innerhalb der ersten 48 h [36], zur Abgrenzung gegenüber Differenzialdiagnosen ein wichtiges diagnostisches Werkzeug dar. Allerdings gibt das erste EEG auch bei vorliegender epileptischer Genese nur in etwa einem Drittel der Fälle klare Hinweise in Form epileptiformer Potenziale. Unspezifische Veränderungen wie milde fokale Verlangsamungen oder diffuse Veränderungen sind bei älteren Patienten häufig und tragen nicht zur Klärung der Diagnose bei [14]. Bei ätiologisch unklarem Delir
Delir
ist die Durchführung eines EEG zum Ausschluss eines nichtkonvulsiven Status epilepticus (NCSE) indiziert.
Eine Bildgebung mithilfe der MRT nach Epilepsieprotokoll sollte auch bei älteren Patienten im Falle der Diagnose einer Epilepsie unklarer Ursache erfolgen. Der Ausschluss einer Autoimmunenzephalitis mithilfe der Liquordiagnostik
Liquordiagnostik
sollte entsprechend klinischer Präsentation und Bildgebungsbefund erwogen werden. Bei erstmaligem Auftreten von Anfällen im späten Erwachsenenalter, einhergehend mit kognitivem Abbau und Verhaltensauffälligkeiten, sowie Volumenvermehrung und Hyperintensität im Bereich der mesiotemporalen Strukturen (Amygdala, Hippocampus) in der zerebralen MRT sollte an dieses Krankheitsbild gedacht werden.
Merke
Epileptische Anfälle beim älteren Patienten präsentieren sich häufig in Form fokal nicht bewusst erlebter Anfälle mit kognitiver Symptomatik (Aphasie, Verwirrtheit) und Arrest ohne prominente motorische Phänomene, sodass die Diagnosestellung oft verzögert erfolgt.
Die Basisdiagnostik in der Abklärung unklarer passagerer Bewusstseinsstörungen umfasst neben der Labordiagnostik (einschl. Elektrolyten, Blutzucker, Nieren- und Leberfunktionsparametern) eine internistische Untersuchung (EKG, Blutdruck, ggf. Echokardiographie und Langzeit-EKG), eine Bildgebung des Schädels (akut mithilfe der CT, bei unklarer Befundlage und Verdacht auf epileptische Genese eine MRT nach Epilepsieprotokoll) und ein EEG.
Status epilepticus
Bei älteren Menschen manifestieren sich Anfälle häufiger in Form eines SE, der als das Fortbestehen eines epileptischen Anfalls für die Dauer > 5 min beim bilateral tonisch klonischen Anfall (konvulsiver SE) und > 10 min beim fokalen SE mit oder ohne Bewusstseinsbeeinträchtigung (NCSE
NCSE
) definiert ist [37]. Ein Status epilepticus tritt bei älteren Patienten häufiger ohne vorbestehende Epilepsie de novo auf und präsentiert sich oft in Form eines NCSE mit oder ohne Koma [38]. Die Inzidenz des SE beträgt bei Menschen ≥ 60 Jahre 79,9/100.000 Erwachsene pro Jahr, verglichen mit 18,8/100.000 Erwachsene pro Jahr bei < 60-Jährigen [39]. Morbidität und Mortalität des SE sind hoch und steigen altersabhängig von 4,1 % bei < 60-Jährigen auf 22,5 % bei Patienten ≥ 60 Jahren an [38, 39].
Merke
Der SE ist ein akuter neurologischer Notfall, der mit hoher Morbidität und Mortalität einhergeht und rasche medikamentöse Behandlung erfordert.
Herausforderungen in der Therapie
Die medikamentöse Behandlung der Epilepsie bei alten Patienten stellt den behandelnden Arzt vor eine Reihe von Herausforderungen, wobei folgende Aspekte vor der Einleitung einer Antiepileptikatherapie beim alten Menschen bedacht werden müssen: (1) Alte Menschen reagieren meist sensibler auf Medikamente, insbesondere zentral wirksame Substanzen, wobei unspezifische Nebenwirkungen
unspezifische Nebenwirkungen
wie Schwindel, Müdigkeit, Gangunsicherheit und Konzentrationsstörungen häufig sind. Diese können im Weiteren zu Problemen wie sozialer Isolation, Sturzneigung mit Immobilisierung und Medikamenten-Non-Compliance führen, sodass Antiepileptika beim alten Menschen insbesondere hinsichtlich ihrer Verträglichkeit ausgewählt werden sollten. (2) Eingeschränkte Nierenfunktion, reduzierter hepataler Metabolismus und Mangelernährung mit verminderter Eiweißbindung führen zu Veränderungen von Pharmakokinetik und Pharmakodynamik beim alten Patienten. Die therapeutische Breite von Medikamenten ist bei alten Menschen häufig reduziert, sodass es oft zu Überdosierung
Überdosierung
kommt. (3) Aufgrund von Komorbiditäten nehmen alte Patienten häufig eine Reihe unterschiedlicher Medikamente ein, sodass das Risiko von Medikamenteninteraktionen
Medikamenteninteraktionen
hoch ist. Hiervon sind insbesondere Medikamente betroffen, welche durch das Zytochrom-P450-Enzym-System der Leber verstoffwechselt werden (z. B. orale Antikoagulanzien, Antiarrhythmika, Antidepressiva etc.), da eine Vielzahl von Antiepileptika zu einer Induktion dieser Enzyme führt (Carbamazepin [CBZ], Phenytoin [PHT], Phenobarbital [PB], Oxcarbazepin [OXC], Eslicarbazepinacetat [ESL], Topiramat [TPM]) oder Inhibition (Valproinsäure, VPA). (4) Die Wirkung von Medikamenten auf Lipidstoffwechsel, Reizleitungssystem des Herzens, Knochenstoffwechsel und Kognition etc. ist bei älteren, multimorbiden Patienten von entscheidender Bedeutung. Unerwünschte Effekte im Rahmen der Anwendung können schwerwiegende Folgen haben, z. B. Frakturen durch Reduktion der Knochendichte bei erhöhtem Sturzrisiko.
Vor Therapiebeginn sollte neben einer Basislabordiagnostik zur Beurteilung von Nierenfunktion und Lebersyntheseleistung auch eine neuropsychologische Diagnostik
neuropsychologische Diagnostik
erfolgen, um evtl. negative kognitive Effekte durch die medikamentöse Therapie beurteilen zu können. Im Allgemeinen sollte bei alten Patienten die antiepileptische Medikation in niedriger Dosierung begonnen und langsam gesteigert werden, wobei niedrigere Zieldosen als bei jüngeren Patienten bereits Wirksamkeit zeigen und angestrebt werden sollten [40, 41]. Die Bestimmung von Medikamentenspiegeln, die insbesondere bei älteren Antiepileptika vielerorts verfügbar sind, kann helfen, die minimal wirksame Zieldosis für jeden Patienten zu identifizieren und im Fall einer Abnahme der Nieren- oder Leberfunktion eine Dosisanpassung vorzunehmen.
Merke
Antiepileptika sollten bei alten Menschen vordergründig hinsichtlich der Verträglichkeit ausgewählt werden, wobei Medikamente mit Interaktionsrisiko sowie negativen Auswirkungen auf Stoffwechselleistung oder Kognition vermieden werden sollten.
Das Credo ist auch in der Behandlung mit Antiepileptika beim alten Patienten „start low, go slow“, um die Verträglichkeit zu erhöhen, wobei auch geringere Zieldosen bereits eine ausreichende Wirksamkeit zeigen können.
Häufig verwendete Antiepileptika: Carbamazepin, Lamotrigin, Levetiracetam
Einen Überblick über die pharmakokinetischen und pharmakodynamischen Eigenschaften der gebräuchlichsten Antiepileptika bietet Tab. 1.
| Carbamazepin (CBZ) | Levetiracetam (LEV) | Lamotrigin (LTG) | |
|---|---|---|---|
| Wirkmechanismus | Schnelle Inaktivierung spannungsabhängiger Natriumkanäle | Bindet an das synaptische Vesikelprotein SV2A | Inaktivierung spannungsabhängiger Natriumkanäle |
| Bioverfügbarkeit | Nahezu 100 % | 100 % | 100 % |
| Maximale Plasmakonzentration (Cmax) | Bei Retardpräparat nach 12 h (4–24 h) | Nach 1,3 h | – |
| Proteinbindung (%) | 70–80 | < 10 | 55 |
| Verteilungsvolumen (l/kg) | 0,8–1,9 | 0,5–0,7 | 0,92–1,22 |
| Eliminations-HWZ | Nach Einzeldosis 36 h, durch Autoinduktion nach mehrfachen Gaben 16–24 h |
7 ± 1 h Bei älteren Patienten um 40 % verlängert: 10–11 h |
33 h (14–103 h) |
| Primäre Eliminationsroute |
In der Leber durch Oxidation zum aktiven Metaboliten Carbamazepin-10,11-epoxid metabolisiert, Autoinduktion von CYP3A4 → raschere Elimination nach 3 bis 4 Wochen Behandlungsdauer 70 % renal, 30 % Fäzes |
95 % unverändert renal | Glucuronidierung in der Leber zu inaktiven Metaboliten, Ausscheidung renal |
| Potenzielle Interaktionen | Starker Induktor von CYP3A4, zusätzlich Induktion von CYP1A2, CYP2C9, CYP2C19, UGT | LEV verringert Methotrexat-Clearance |
VPA hemmt Glucuronidierung von LTG → erhöhte LTG-Wirksamkeit CBZ, PHT, orale Kontrazeptiva (Ethinylestradiol-Levonorgestrel-Kombinationspräparate) Rifampicin, Lopinavir/Ritonavir → reduzierte LTG-Wirksamkeit |
| Notwendigkeit der Dosisanpassung | Keine Dosisanpassung bei älteren Patienten |
Bei älteren Patienten bis zu 40 % reduzierte Clearance Niereninsuffizienz: < 30 ml/min und 1,73 m2KOF 250–500 mg 2‑mal tgl. Bei Dialysepflichtigkeit 500–1000 mg einmal tgl. + 250–500 mg nach Dialyse |
Keine Dosisanpassung bei älteren Patienten 50 %ige Reduktion bei Leberfunktionsstörung der Child-Pugh-Klasse B 75 % ige Reduktion bei Leberfunktionsstörung der Child-Pugh-Klasse C |
| Initialdosis | 100–200 mg in 2 ED, Dosissteigerung um 100 mg/Woche | 500 mg TD in 2 ED, nach 1 Woche 1000 mg TD |
25 mg/Tag, Dosiserhöhung um 25 mg alle 2 Wochen Cave: bei Kombinationstherapie mit VPA Dosiserhöhung um 12,5 mg/Woche |
| Zieldosis | Max. 1200 mg | 1000–(3000 mg) | 100–200 mg |
| Besondere Nebenwirkungen |
Hyponatriämie, Leukopenie > Thrombopenie, Schwindel, Diplopie, Kopfschmerzen, Ataxie, Tremor, Übelkeit Allergische Reaktionen: HLA-B*1502 (+HLA-A*3101) stellt einen Risikofaktor für das Auftreten allergischer Reaktionen dar (in der Han-chinesischen oder thailändischen Bevölkerung) |
Reizbarkeit, Irritabilität, Konzentrationsstörungen | Allergische Reaktionen (Stevens-Johnson-Syndrom 1:1000) abhängig von der Geschwindigkeit der Aufdosierung |
CYP Zytochrom-P450-System, ED Einzeldosis, HLA humanes Leukozytenantigen, HWZ Halbwertszeit, PHT Phenytoin, TD Tagesdosis, UGT Uridin-5´-diphospho-glucuronosyltransferase, VPA Valproat
Zwei multizentrische randomisierte kontrollierte Studien zur Beurteilung der Wirksamkeit und Tolerabilität von CBZ und Lamotrigin
Lamotrigin
(LTG) bei Patienten ≥ 65 Jahren [42, 43] zeigten, dass LTG bei vergleichbarer Wirksamkeit hinsichtlich Verträglichkeit dem CBZ in retardierter und unretardierter Form überlegen war. In einer rezenteren randomisierten doppelblinden Parallelgruppenstudie (STEP-ONE) waren CBZ in retardierter Form, LTG und Levetiracetam
Levetiracetam
(LEV) hinsichtlich ihrer Wirksamkeit vergleichbar, LEV und LTG schnitten hinsichtlich der Verträglichkeit gegenüber CBZ retard jedoch besser ab [44]. Eine weitere groß angelegte unverblindete, randomisierte Studie, die die „Standardantiepileptika“ CBZ retard bei fokalen Epilepsiesyndromen oder VPA bei generalisierten Epilepsiesyndromen mit LEV verglich (KOMET-Studie), fand in der Post-hoc-Analyse älterer Patienten ≥ 60 Jahre, dass bei vergleichbarer Wirksamkeit die Rate an Therapieabbrüchen unter LEV im Vergleich zu CBZ retard niedriger war [45].
Aufgrund der Notwendigkeit einer langsamen Eindosierung von LTG und lediglich oraler Darreichungsform ist insbesondere im Fall des Auftretens bilateral tonisch klonischer Anfälle oder eines SE auch bei älteren Patienten LEV als Medikament erster Wahl dem LTG überlegen. Zudem kann LEV im Gegensatz zu LTG und CBZ i.v. verabreicht werden und ist somit in der Akutbehandlung epileptischer Anfälle die Substanz erster Wahl. Levetiracetam wird zu 66 % unverändert renal ausgeschieden; bei älteren Patienten liegt selbst bei regelrechter Nierenfunktion eine durchschnittlich 40 % erniedrigte Clearance vor, sodass eine Dosisanpassung notwendig ist [46]. Unter antiepileptischer Therapie mit LEV wurden dosisabhängige psychiatrische Nebenwirkungen
psychiatrische Nebenwirkungen
, insbesondere Aggressivität und Stimmungsschwankungen bis hin zu psychotischen Störungen, beobachtet [47, 48, 49], die signifikant häufiger bei Patienten mit vorbestehender psychiatrischer Komorbidität auftraten [47]. Eine randomisierte placebokontrollierte doppelblinde Studie untersuchte den Einfluss von LEV, 1000 mg, vs. Placebo auf Kognition und Stimmung bei älteren Menschen > 65 Jahre, wobei sich eine geringe Zunahme von Irritabilität und Fatigue, jedoch kein negativer Effekt auf Kognition und Gedächtnis zeigte [50]. Im klinischen Alltag kann jedoch das Auftreten psychiatrischer Nebenwirkungen (Verhaltensauffälligkeiten, Reizbarkeit und depressive Stimmung) bei alten Patienten insbesondere bei höheren Dosen von LEV zu beobachten sein.
Enzyminduzierende Antiepileptika
Enzyminduzierende Antiepileptika
wie CBZ, zu einem geringeren Teil auch OXC und PHT, weisen das Risiko von Interaktion mit z. B. oralen Antikoagulanzien, Antiarrhythmika, Antidepressiva und Antihypertensiva bei Langzeitbehandlung auf. Daneben steigt das Risiko metabolischer Nebenwirkungen
metabolischer Nebenwirkungen
. Vaskuläre Risikofaktoren wie Lipidwerte und Homocystein steigen häufig unter der Therapie mit CBZ an, zudem fand sich unter der Langzeittherapie mit CBZ, PHT und VPA, nicht jedoch unter LTG, eine Zunahme der Intima-Media-Dicke. In einer Post-hoc-Analyse der STEP-ONE-Studie wurde eine reduzierte lipidsenkende Wirkung von Statinen unter Therapie mit CBZ nachgewiesen [51]. Somit sollten diese Antiepileptika bei Patienten mit bereits erhöhtem vaskulären Risikoprofil vermieden werden. Des Weiteren weisen klassische Antiepileptika
klassische Antiepileptika
, die über eine Blockade der spannungsabhängigen Natriumkanäle wirken (CBZ, OXC, PHT), das Risiko von Arrhythmien durch Interaktion mit dem kardialen Reizleitungssystem auf, sodass deren Einsatz bei Patienten mit kardialer Vorschädigung kritisch hinterfragt werden sollte. Elektrolytstörungen, insbesondere Hyponatriämien, treten sowohl unter Therapie mit CBZ als auch OXC auf und können insbesondere bei älteren Patienten in Kombination mit anderen Medikamenten wie Diuretika oder SSRI zu klinisch manifesten metabolischen Entgleisungen mit Verwirrtheit, Vigilanzminderung oder Anfällen führen [35].
Eine weitere klinisch relevante potenzielle Nebenwirkung enzyminduzierender Antiepileptika stellt die Störung des Knochenstoffwechsels mit Reduktion der Knochendichte
Knochendichte
dar. Insbesondere bei alten Patienten mit erhöhtem Frakturrisiko im Rahmen anfallsassoziierter Stürze oder multifaktorieller Gangstörung ist dies von großer Bedeutung.
Merke
In der Behandlung älterer Patienten mit Epilepsie sind LEV und LTG dem CBZ retard bei vergleichbarer Wirksamkeit hinsichtlich der Verträglichkeit überlegen.
Enzyminduzierende Antiepileptika (CBZ, OXC, PHT) sollten aufgrund ihres Interaktionsrisikos, negativer Auswirkungen auf vaskuläre Risikofaktoren sowie Knochenstoffwechsel bei älteren Patienten vermieden werden.
„Neuere“ Antiepileptika: Lacosamid, Eslicarbazepinacetat, Perampanel und Brivaracetam
Die Entwicklung von Antiepileptika mit neuen Wirkmechanismen, geringerem Interaktionspotenzial und verbesserter Verträglichkeit hat in vergangenen Jahrzehnten zur Zulassung einer Reihe „neuer“ Antiepileptika geführt [52]. Die Datenlage zum Einsatz dieser Substanzen bei älteren Patienten ist i. Allg. gering, da Zulassungsstudien meist strenge Einschlusskriterien aufweisen und neben der Altersgrenze auch Komorbiditäten und Schwierigkeiten bei Rekrutierung und Einwilligungsfähigkeit den Einschluss dieser Patienten in randomisierte kontrollierte Studien limitieren.
Lacosamid
Lacosamid
(LCM) gehört zur Gruppe der Natriumkanalblocker; im Gegensatz zu CBZ, OXC und PHT verstärkt es die langsame Inaktivierung spannungsabhängiger Natriumkanäle. In einer Phase III-Non-Inferiority-Studie [53], die LCM mit CBZ retard bei Patienten ≥ 65 Jahren verglich, zeigten sich eine geringere Nebenwirkungsrate (LCM 35 % vs. CBZ retard 53 %), eine geringere Abbruchrate (LCM 21 % vs. CBZ retard 26 %) und bessere Wirksamkeit (Anfallsfreiheit LCM 73 % vs. CBZ-retard 60 %). Lacosamid wurde auch nach i.v.-Gabe aufgrund repetitiver Anfälle bei älteren Patienten ≥ 60 Jahren gut toleriert, wobei milde zentralnervöse Nebenwirkungen wie Müdigkeit, ungerichteter Schwindel und geringer Tremor berichtet wurden [54]. Aufgrund des seltenen Auftretens von atrioventrikulären (AV-)Überleitungsstörungen unter der Therapie mit LCM muss vor Therapiebeginn sowie nach Aufdosierung eine EKG-Untersuchung zum Ausschluss eines AV-Blocks
AV-Blocks
durchgeführt werden. Hinsichtlich Kognition und Einfluss auf die Knochendichte liegen keine ausreichenden Daten zur Therapie mit LCM bei älteren Patienten vor.
Eslicarbazepinacetat
Eslicarbazepinacetat
(ESL) ist eine „Tochtersubstanz“ von CBZ, die ihre Wirkung über die langsame Inaktivierung spannungsabhängiger Natriumkanäle entfaltet, jedoch im Gegensatz zu CBZ und OXC ein deutlich geringeres Interaktionsrisiko
Interaktionsrisiko
und nur eine geringe enzyminduzierende Wirkung aufweist. Eine multizentrische, nichtkontrollierte „Open-label“-Phase-III-Studie untersuchte Wirksamkeit und Verträglichkeit einer additiven Therapie mit ESL bei 72 Patienten ≥ 65 Jahren; in 65 % der Fälle traten Nebenwirkungen auf [55]. Ungerichteter Schwindel (12,5 %), Schläfrigkeit und Fatigue (8,3 %) sowie Hyponatriämien (8,3 %) wurden am häufigsten berichtet und führten bei 22 % der Patienten zum Therapieabbruch. Metabolische Störungen wie Dyslipidämien sind unter einer Therapie mit ESL geringer als unter CBZ-Anwendung, sodass ESL insbesondere aufgrund des niedrigeren Interaktionsrisikos Vorteile gegenüber der Muttersubstanz CBZ aufweist.
Brivaracetam
Brivaracetam
(BRV) ist eine dem LEV verwandte Substanz, die ebenso über das synaptische Vesikelprotein 2A wirkt, keine signifikante enzyminduzierende oder -inhibierende Wirkung aufweist und zum Großteil renal ausgeschieden wird. In einer Phase-IIb-Studie konnte eine Abnahme psychiatrischer Nebenwirkungen, die unter LEV bestanden, nach Umstellung auf BRV festgestellt werden [56], sodass diese Substanz evtl. bei psychiatrischen Nebenwirkungen unter LEV, jedoch guter Wirksamkeit als Alternative erwogen werden kann. Die Möglichkeit einer i.v.-Verabreichungsform ist insbesondere bei akuten Anfällen oder SE von großem Vorteil.
Perampanel
Perampanel
(PER) wirkt über eine nichtkompetitive Hemmung des glutamatergen α‑Amino-3-hydroxy-5-methyl-4-isooxazolpropionat(AMPA)-Rezeptors, die die Konzentration des primären exzitatorischen Neurotransmitters Glutamat im Zentralnervensystem reduziert. In eine multinationale, multizentrische Beobachtungsstudie zur Therapie mit PER wurden 135 Patienten ≥ 65 Jahren eingeschlossen [57], wobei sich eine Nebenwirkungsrate von 79 % zeigte. Ungerichteter Schwindel (24,7 %), Müdigkeit (16,5 %) und Verhaltensauffälligkeiten (16,5 %) waren die am häufigsten berichteten Nebenwirkungen, die in 6 % der Fälle zu einem Therapieabbruch führten. Die Einnahme der Medikation direkt vor dem Zubettgehen „an der Bettkante sitzend“, eine langsame Eindosierung mit Steigerung um 2 mg alle 4 Wochen sowie eine niedrige Zieldosis reduzieren Nebenwirkungen und steigern die Verträglichkeit. Ein Vorteil von PER ist die einmal tägliche Einnahme aufgrund einer langen Halbwertzeit
Halbwertzeit
von 105 h. Eine orale Lösung von PER ist seit Kurzem erhältlich, sodass die Verwendung auch bei Schluckstörung möglich ist.
Einen Überblick über die pharmakokinetischen und pharmakodynamischen Eigenschaften „neuer Antiepileptika“ bietet Tab. 2.
| Eslicarbazepinacetat (ESL) | Brivaracetam (BRV) | Lacosamid (LCM) | Perampanel (PER) | |
|---|---|---|---|---|
| Wirkmechanismus |
Langsame Inaktivierung spannungsabhängiger Natriumkanäle Inhibition spannungsabhängiger Kalziumkanäle (Cav3.2) |
Bindet an synaptisches Vesikelprotein (SV2A) |
Langsame Inaktivierung spannungsabhängiger Natriumkanäle Bindet an CRMP‑2 |
Selektiver nonkompetitiver AMPA-Rezeptor Antagonist (antiglutamaterg) |
| Bioverfügbarkeit (%) | Oral > 90 |
Oral ≈ 100 I.v. 100 |
Oral ≈ 100 I.v 100 |
Oral ≈ 100 |
| Maximale Plasmakonzentration (Cmax) | 2–3 h | 1 h (durch fettreiche Nahrung verzögert) | 0,5–4 h, unabhängig von Nahrungsaufnahm | – |
| Proteinbindung (%) |
30 46 % konzentrationsunabhängige Bindung an Blutzellen ↓ Bei älteren Patienten und Leberversagen, Niereninsuffizienz, Hypoalbuminämie |
≤ 20 Reduziert bei älteren Patienten und Hypoalbuminämie |
< 15 Reduziert bei älteren Patienten und Leberversagen, Niereninsuffizienz Hypoalbuminämie |
95 Reduziert bei älteren Patienten und Leberversagen, Niereninsuffizienz, Hypoalbuminämie |
| Verteilungsvolumen (l/kg) |
2,7 Erhöht bei älteren Patienten |
0,5 Hohe Membranpermeabilität aufgrund der Lipophilie Erhöht bei älteren Patienten und Leberfunktionsstörung |
0,5–0,8 Erhöht bei älteren Patienten, Leberfunktionsstörung und Hypoalbuminämie |
1,1 Erhöht bei älteren Patienten, Leberfunktionsstörung und Hypoalbuminämie |
| Eliminations-HWZ |
20–24 h Keine Autoinduktion |
6–11 h Gering erhöht bei älteren Patienten |
12–16 h Erhöht bei älteren Patienten mit 10- bis 35 %iger Zunahme der Plasmakonzentration > 65 Jahre |
105 h Effektive HWZ 48 h Erhöht bei Leberfunktionsstörung (mild 306 h, mäßig 295 h) |
| Primäre Eliminationsroute | Hydrolytische Metabolisierung zum aktiven Metaboliten Eslicarbazepin; Metaboliten 90 % renal ausgeschieden |
95 % renale Ausscheidung Metabolisierung durch Hydrolyse und Hydroxylierung, < 10 % unverändert renal |
95 % renale Ausscheidung, teilweise unverändert und teilweise nach O‑Methylierung | 30 % renal, 70 % hepataler Metabolismus durch CYP3A4 und CYP3A5 |
| Potenzielle Interaktionen |
Schwacher Induktor für CYP3A4 und UGT1A1 Inhibitor CYP2C19 |
Rifampicin senkt BRV-Serum-Spiegel um ca. 45 % BRV erhöht die Serumkonzentration von Carbamazepin-10, 11-epoxid |
Enzyminduktoren senken Serumspiegel um 15–20 % |
Enzyminduktoren reduzieren Serumspiegel bis zu 50 %: Clearance gesteigert durch PHT (1,7-fach), CBZ (2,7-fach), OXC (1,9-fach) PER erhöht OXC-Spiegel um 33 % Ketoconazol verlängert die HWZ um ≈ 15 % PER reduziert Levonorgestrel dosisabhängig (44 %) |
| Notwendigkeit der Dosisanpassung |
Keine altersabhängige Dosisanpassung notwendig Bei Niereninsuffizienz: Kreatinin-Clearance 30–60 ml/min Initialdosis 200 mg Kreatinin-Clearance < 30 ml/min Anwendung nicht empfohlen |
Keine altersabhängige Dosisreduktion notwendig Bei Leberfunktionsstörung Dosisreduktion, maximale TD 150 mg in 2 ED |
Keine altersabhängige Dosisreduktion notwendig Bei schwerer Niereninsuffizienz mit Kreatinin-Clearance < 30 ml/min maximale TD 250 mg Bei mäßiger Leberfunktionsstörung maximale TD 300 mg Bei schwerer Leberfunktionsstörung nicht empfohlen |
Keine Dosisreduktion bei älteren Patienten notwendig, jedoch bereits niedrigere Zieldosen wirksam Bei leichter bis mäßiger Leberfunktionsstörung maximale TD 8 mg Bei schwerer Leberfunktionsstörung nicht empfohlen |
| Initialdosis | 400 mg einmal tgl. (abends) | 50 mg/Tag in 2 ED | 100 mg in 2 ED | 2 mg einmal tgl., abends direkt vor dem Zubettgehen |
| Zieldosis | 1200 mg einmal tgl. | 200 mg/Tag in 2 ED | 400–(600) mg | 8–10 mg, bei älteren Patienten bereits 6 mg wirksam |
| Besondere Nebenwirkungen | Hyponatriämie, Verlängerung des PR-Intervalls, Gewichtszunahme, allergische Reaktionen: HLA-B*1502-Allel assoziiert mit erhöhtem Risiko eines Stevens-Johnson-Syndroms | Inappetenz, Reizbarkeit, Depression, Schwindel, Somnolenz |
Schwindel, Kopfschmerzen, Diplopie, Übelkeit Verlängerung des PQ-Intervalls |
Schwindel, Gangstörung, Müdigkeit, Reizbarkeit |
AMPA α-Amino-3-hydroxy-5-methyl-4-isooxazolpropionat, CBZ Carbamazepin, CRMP‑2 „collapsin response mediator protein 2“, CYP Zytochrom-P450-System, ED Einzeldosis, HLA humanes Leukozytenantigen, HWZ Halbwertszeit, OXC Oxcarbazepin, PHT Phenytoin, TD Tagesdosis, UGT Uridin-5´-diphospho-glucuronosyltransferase, VPA Valproat
Merke
Neue Antiepileptika (LCM, ESL, BRV, PER) weisen teilweise andere Wirkmechanismen sowie ein geringeres Interaktionsrisiko auf, was zu besserer Verträglichkeit auch bei älteren Patienten führen kann.
Die Datenlage zur Anwendung neuer Substanzen bei älteren Patienten, insbesondere im Hinblick auf Kognition, vaskuläre Risikofaktoren, Knochenstoffwechsel etc. ist noch begrenzt.
Lacosamid ist ein bereits langjährig erprobtes, gut und rasch wirksames Antiepileptikum, das auch bei älteren Patienten gute Wirksamkeit und Verträglichkeit aufweist. Eine EKG-Untersuchung vor der Therapieeinleitung und im Verlauf sollte zum Ausschluss eines AV-Blocks erfolgen.
Fazit für die Praxis
Epileptische Anfälle sind beim älteren Menschen häufig und stellen oft das Symptom einer akuten zerebralen Schädigung z. B. im Rahmen eines Schlaganfalls dar. Das rechtzeitige Erkennen und die rasche Abklärung hinsichtlich zugrunde liegender Ätiologie sind für Behandlung und Prognose entscheidend.
Zerebrovaskuläre Erkrankungen stellen die häufigste Ursache der Altersepilepsie dar, wobei neben der Anfallskontrolle eine gute Einstellung vaskulärer Risikofaktoren für das Therapieansprechen und Outcome von Bedeutung ist.
Durch die klinisch oft nicht eindeutige Präsentation epileptischer Anfälle mit häufigem Fehlen motorischer Entäußerungen ist die korrekte Diagnosestellung erschwert. Bei Verdacht auf epileptische Anfälle sollten die rasche Zuweisung zu einem Neurologen und weitere Abklärung erfolgen, um die Einleitung einer adäquaten Therapie nicht zu verzögern.
Die Diagnose der Epilepsie stellt für Patienten und Betreuungspersonen häufig eine große Herausforderung dar, und die adäquate Behandlung kann psychosoziale Probleme reduzieren.
Die medikamentöse Therapie richtet sich bei älteren Patienten vordergründig nach Verträglichkeit und geringem Interaktionsrisiko. Eine niedrige Anfangsdosis, langsames Aufdosieren und das Anstreben der niedrigsten wirksamen Zieldosis steigern die Verträglichkeit und Lebensqualität.
CME-Fragebogen
Welche der folgenden neurologischen Erkrankungen stellt die häufigste Ursache einer neu beginnenden Epilepsie im Alter dar?
Demenz vom Alzheimer-Typ
Idiopathisches Parkinson-Syndrom
Vaskuläre Demenz
Schädel-Hirn-Trauma
Schlaganfall
Ein 76-jähriger Patient wird aufgrund einer Bewusstseinsminderung, einhergehend mit Zuckungen des linken Arms und im Gesicht links, an die Notaufnahme transferiert. Bei dem Patienten ist eine Hypertonie vordiagnostiziert. Bei Eintreffen im Krankenhaus bestehen weiterhin Zuckungen des linken Arms und im Gesicht links, die nach Gabe von 2 mg Lorazepam sistieren. Nachfolgend ist der Patient somnolent, und es besteht eine Parese des linken Arms. Welche wichtige Ursache dieses erstmaligen fokalen Anfalls müssen Sie am dringlichsten ausschließen?
Hyponatriämie
Akuter rechtsseitiger Mediainfarkt
Intoxikation
Alkoholentzugsanfall
Demenz
Ein 81-jähriger Patient wird aufgrund einer plötzlich aufgetretenen Bewusstseinsminderung mit der Rettung in die Notaufnahme gebracht. In der Ambulanz kommt es zum Auftreten eines bilateral tonisch klonischen Anfalls mit Kopf- und Blickwendung nach rechts; nachfolgend ist er weiterhin bewusstlos, und es bestehen Zuckungen im Gesicht rechts fort. Welchen akut lebensbedrohlichen Notfall müssen Sie mithilfe des EEG ausschließen?
Katatoner Stupor
Nichtkonvulsiver Status epilepticus
Akut dekompensierte Demenz vom Alzheimer-Typ
Akinetische Krise bei M. Parkinson
Schlafapnoesyndrom
Eine 74-jährige Patientin stellt sich aufgrund 2‑maliger Episoden mit Bewusstseinsverlust in der Notaufnahme vor. Die Patientin schildert, Hitzegefühl und Herzrasen bemerkt und anschließend das Bewusstsein verloren zu haben. Sie sei, am Boden liegend, wieder zu sich gekommen, wobei sie sofort wusste, wo sie sich befand. Es bestand kein Zungenbiss oder Muskelkater. Eine Fremdanamnese liegt nicht vor. Klinisch präsentiert sich die Patientin ohne fokal neurologische Defizite. Blutdruck, Herzfrequenz und Temperatur sind unauffällig. Welche Ursache der 2‑maligen Bewusstseinsverluste müssen Sie in diesem Fall so schnell wie möglich ausschließen?
Psychogene nichtepileptische Anfälle
Kardiogene Synkopen
Elektrolytentgleisungen
Rezidivierende Transitorisch ischämische Attacken
Meningoenzephalitis
Welches der folgenden Symptome ist bei einem erstmals aufgetretenen epileptischen Anfall jenseits des 70. Lebensjahres am häufigsten?
Aura
Automatismen
Bilateral tonisch klonischer Anfall
Prolongierte Desorientiertheit
Motorische Phänomene
Ein 93-jähriger Patient wird aufgrund von Verwirrtheit in die Notaufnahme gebracht. Bei dem Patienten ist eine Niereninsuffizienz bekannt. Laut Tochter hätte der Patient aufgrund einer gastrointestinalen Infektion in den vergangenen Tagen kaum etwas getrunken. Klinisch besteht eine leichte Bewusstseinsbeeinträchtigung (Somnolenz), keine Paresen oder motorischen Entäußerungen; der Patient ist afebril. Welche der folgenden Untersuchungen zur Abklärung des Verwirrtheitszustandes leiten Sie als Erstes ein?
Magnetresonanztomographie des Schädels
Labordiagnostik, einschl. Nierenfunktionsparameter
Elektroenzephalographie
Neuropsychologische Testung
Liquoruntersuchung
Welches Antiepileptikum soll aufgrund der guten Wirksamkeit, Verträglichkeit, des geringen Nebenwirkungsprofils und der geringen Interaktionen als Medikament erster Wahl bei älteren Menschen zum Einsatz kommen (Evidenzklasse I)?
Carbamazepin
Perampanel
Levetiracetam
Lacosamid
Phenytoin
Welches der folgenden Antiepileptika hat die längste Eliminationshalbwertszeit?
Carbamazepin
Brivaracetam
Lacosamid
Levetiracetam
Perampanel
Warum sollte eine antiepileptische Therapie mit Carbamazepin bei älteren Menschen nur mit Vorsicht eingesetzt werden?
Als Enzyminduktor weist Carbamazepin eine Reihe von Wechselwirkungen mit anderen Medikamenten auf.
Carbamazepin ist ein nur schwach antiepileptisch wirksames Medikament.
Die Dosis von Carbamazepin muss bei älteren Menschen sehr hoch gewählt werden, um Wirksamkeit zu zeigen.
Carbamazepin ist kein geeignetes Medikament bei fokalen Epilepsiesyndromen.
Die Bestimmung des Medikamentenspiegels ist bei Carbamazepin nicht möglich, sodass eine Therapiekontrolle schwierig ist.
Welches ist das wichtigste Kriterium bei der Wahl eines geeigneten Antiepileptikums bei älteren Patienten?
Verfügbarkeit einer i.v.-Darreichungsform
Kurze Halbwertszeit
Möglichkeit der Bestimmung von Medikamentenspiegeln im Blut
Gute Verträglichkeit
Geringe therapeutische Breite
Funding
Open access funding provided by Paracelsus Medical University.
Einhaltung ethischer Richtlinien
Interessenkonflikt
Gemäß den Richtlinien des Springer Medizin Verlags werden Autoren und Wissenschaftliche Leitung im Rahmen der Manuskripterstellung und Manuskriptfreigabe aufgefordert, eine vollständige Erklärung zu ihren finanziellen und nichtfinanziellen Interessen abzugeben.
Autoren
E. Trinka: A. Finanzielle Interessen: bezahlter Berater/interner Schulungsreferent/Gehaltsempfänger o. Ä.: UCB, Eisai, BIAL, Medtronic, EVER Pharma, Biogen, Takeda, LivaNova, Newbridge, Sunovion, GW Pharmaceuticals, Marinus, Arvelle, Böhringer Ingelheim, GSK, Novartis, Sanofi, Sandoz. – B. Nichtfinanzielle Interessen: Prim. Univ.-Professor, FRCP, Vorstand der Universitätsklinik für Neurologie, neurologische Intensivmedizin und Neurorehabilitation der PMU | Mitgliedschaften: Österreichische Gesellschaft für Neurologie (Past-Präsident), Salzburger Ärztegesellschaft (Präsident), International League Against Epilepsy Europe (Chair).
A. Rohracher: A. Finanzielle Interessen: Forschungsstipendium für Epilepsie: Österreichische Gesellschaft. – Erstattung der Reisekosten, Referentenhonorare: Eisai. – B. Nichtfinanzielle Interessen: angestellte Neurologin, Universitätsklinik für Neurologie, Paracelsus Medizinische Privatuniversität Salzburg, Zentrum für kognitive Neurowissenschaften | Mitgliedschaften: Österreichische Gesellschaft für Neurologie (ÖGN), Österreichische Gesellschaft für Epileptologie (ÖGfE).
Wissenschaftliche Leitung
Die vollständige Erklärung zum Interessenkonflikt der Wissenschaftlichen Leitung finden Sie am Kurs der zertifizierten Fortbildung auf www.springermedizin.de/cme.
Der Verlag
erklärt, dass für die Publikation dieser CME-Fortbildung keine Sponsorengelder an den Verlag fließen.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Feigin VL, Abajobir AA, Abate KH, et al. Global, regional, and national burden of neurological disorders during 1990–2015: a systematic analysis for the global burden of disease study 2015. Lancet Neurol. 2017;16:877–897. doi: 10.1016/S1474-4422(17)30299-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Fisher RS, Acevedo C, Arzimanoglou A, et al. ILAE official report: a practical clinical definition of epilepsy. Epilepsia. 2014;55:475–482. doi: 10.1111/epi.12550. [DOI] [PubMed] [Google Scholar]
- 3.La de Court A, Breteler MM, Meinardi H, et al. Prevalence of epilepsy in the elderly: the Rotterdam Study. Epilepsia. 1996;37:141–147. doi: 10.1111/j.1528-1157.1996.tb00005.x. [DOI] [PubMed] [Google Scholar]
- 4.Huber DP, Griener R, Trinka E. Antiepileptic drug use in Austrian nursing home residents. Seizure. 2013;22:24–27. doi: 10.1016/j.seizure.2012.09.012. [DOI] [PubMed] [Google Scholar]
- 5.Josephson CB, Engbers JDT, Sajobi TT, et al. Towards a clinically informed, data-driven definition of elderly onset epilepsy. Epilepsia. 2016;57:298–305. doi: 10.1111/epi.13266. [DOI] [PubMed] [Google Scholar]
- 6.Sander JW, Hart YM, Johnson AL, et al. National general practice study of epilepsy: newly diagnosed epileptic seizures in a general population. Lancet. 1990;336:1267–1271. doi: 10.1016/0140-6736(90)92959-l. [DOI] [PubMed] [Google Scholar]
- 7.Rohracher A (2020) Status epilepticus: Herausforderungen in Diagnostik und Therapie; Zeitschriftenbeitrag, Neurologisch; 17. Jahrestagung der Österreichischen Gesellschaft für Neurologie, ÖGN-Abstractband 2020, 08.09.2020
- 8.Brodie MJ, Elder AT, Kwan P. Epilepsy in later life. Lancet Neurol. 2009;8:1019–1030. doi: 10.1016/S1474-4422(09)70240-6. [DOI] [PubMed] [Google Scholar]
- 9.Bentes C, Martins H, Peralta AR, et al. Post-stroke seizures are clinically underestimated. J Neurol. 2017;264:1978–1985. doi: 10.1007/s00415-017-8586-9. [DOI] [PubMed] [Google Scholar]
- 10.Galovic M, Döhler N, Keezer MR, et al. The SeLECT score is useful to predict post-stroke epilepsy. Lancet Neurol. 2018;17:395–396. doi: 10.1016/S1474-4422(18)30075-9. [DOI] [PubMed] [Google Scholar]
- 11.Rossi C, de Herdt V, Dequatre-Ponchelle N, et al. Incidence and predictors of late seizures in intracerebral hemorrhages. Stroke. 2013;44:1723–1725. doi: 10.1161/STROKEAHA.111.000232. [DOI] [PubMed] [Google Scholar]
- 12.Brigo F, Tezzon F, Nardone R. Late-onset seizures and risk of subsequent stroke: a systematic review. 2014. [DOI] [PubMed] [Google Scholar]
- 13.Sillanpää M, Anttinen A, Rinne JO, et al. Childhood-onset epilepsy five decades later. A prospective population-based cohort study. Epilepsia. 2015;56:1774–1783. doi: 10.1111/epi.13187. [DOI] [PubMed] [Google Scholar]
- 14.Stefan H. Epilepsy in the elderly: facts and challenges. Acta Neurol Scand. 2011;124:223–237. doi: 10.1111/j.1600-0404.2010.01464.x. [DOI] [PubMed] [Google Scholar]
- 15.Imfeld P, Bodmer M, Schuerch M, et al. Seizures in patients with Alzheimer’s disease or vascular dementia: a population-based nested case-control analysis. Epilepsia. 2013;54:700–707. doi: 10.1111/epi.12045. [DOI] [PubMed] [Google Scholar]
- 16.Cheng C-H, Liu C-J, Ou S-M, et al. Incidence and risk of seizures in Alzheimer’s disease: a nationwide population-based cohort study. Epilepsy Res. 2015;115:63–66. doi: 10.1016/j.eplepsyres.2015.05.009. [DOI] [PubMed] [Google Scholar]
- 17.Hommet C, Mondon K, Camus V, et al. Epilepsy and dementia in the elderly. Dement Geriatr Cogn Disord. 2008;25:293–300. doi: 10.1159/000119103. [DOI] [PubMed] [Google Scholar]
- 18.Witt J-A, Werhahn KJ, Krämer G, et al. Cognitive-behavioral screening in elderly patients with new-onset epilepsy before treatment. Acta Neurol Scand. 2014;130:172–177. doi: 10.1111/ane.12260. [DOI] [PubMed] [Google Scholar]
- 19.Breteler MM, de Groot RR, van Romunde LK, et al. Risk of dementia in patients with Parkinson’s disease, epilepsy, and severe head trauma: a register-based follow-up study. Am J Epidemiol. 1995;142:1300–1305. doi: 10.1093/oxfordjournals.aje.a117597. [DOI] [PubMed] [Google Scholar]
- 20.Höller Y, Trinka E. What do temporal lobe epilepsy and progressive mild cognitive impairment have in common? Front Syst Neurosci. 2014;8:58. doi: 10.3389/fnsys.2014.00058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Fahoum F, Zelmann R, Tyvaert L, et al. Epileptic discharges affect the default mode network—fMRI and Intracerebral EEG evidence. Plos One. 2013;8:e68038. doi: 10.1371/journal.pone.0068038. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Celone KA, Calhoun VD, Dickerson BC, et al. Alterations in memory networks in mild cognitive impairment and Alzheimer’s disease: an independent component analysis. J Neurosci. 2006;26:10222–10231. doi: 10.1523/JNEUROSCI.2250-06.2006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Joutsa J, Rinne JO, Hermann B, et al. Association between childhood-onset epilepsy and Amyloid burden 5 decades later. JAMA Neurol. 2017;74:583–590. doi: 10.1001/jamaneurol.2016.6091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Tai XY, Koepp M, Duncan JS, et al. Hyperphosphorylated tau in patients with refractory epilepsy correlates with cognitive decline: a study of temporal lobe resections. Brain. 2016;139:2441–2455. doi: 10.1093/brain/aww187. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Collins NS, Shapiro RA, Ramsay RE. Elders with epilepsy. Med Clin North Am. 2006;90:945–966. doi: 10.1016/j.mcna.2006.06.002. [DOI] [PubMed] [Google Scholar]
- 26.Tanaka A, Akamatsu N, Shouzaki T, et al. Clinical characteristics and treatment responses in new-onset epilepsy in the elderly. Seizure. 2013;22:772–775. doi: 10.1016/j.seizure.2013.06.005. [DOI] [PubMed] [Google Scholar]
- 27.Cloyd J, Hauser W, Towne A, et al. Epidemiological and medical aspects of epilepsy in the elderly. Epilepsy Res. 2006;68(Suppl 1):S39–S48. doi: 10.1016/j.eplepsyres.2005.07.016. [DOI] [PubMed] [Google Scholar]
- 28.Ramsay RE, Rowan AJ, Pryor FM. Special considerations in treating the elderly patient with epilepsy. Neurology. 2004;62:S24–S29. doi: 10.1212/wnl.62.5_suppl_2.s24. [DOI] [PubMed] [Google Scholar]
- 29.Sheth RD, Gidal BE, Hermann BP. Pathological fractures in epilepsy. Epilepsy Behav. 2006;9:601–605. doi: 10.1016/j.yebeh.2006.08.003. [DOI] [PubMed] [Google Scholar]
- 30.Lees A. Retrospective study of seizure-related injuries in older people: a 10-year observation. Epilepsy Behav. 2010;19:441–444. doi: 10.1016/j.yebeh.2010.08.021. [DOI] [PubMed] [Google Scholar]
- 31.Brignole M, Moya A, d Lange FJ, et al. 2018 ESC Guidelines for the diagnosis and management of syncope. Eur Heart J. 2018;39:18831948. doi: 10.1093/eurheartj/ehy037. [DOI] [PubMed] [Google Scholar]
- 32.Lin JT, Ziegler DK, Lai CW, et al. Convulsive syncope in blood donors. Ann Neurol. 1982;11:525–528. doi: 10.1002/ana.410110513. [DOI] [PubMed] [Google Scholar]
- 33.Ozkara C, Metin B, Kucukoglu S. Convulsive syncope: a condition to be differentiated from epilepsy. Epileptic Disord. 2009;11:315–319. doi: 10.1684/epd.2009.0281. [DOI] [PubMed] [Google Scholar]
- 34.Kanjwal K, Karabin B, Kanjwal Y, et al. Differentiation of convulsive syncope from epilepsy with an implantable loop recorder. Int J Med Sci. 2009;6:296–300. doi: 10.7150/ijms.6.296. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Nardone R, Brigo F, Trinka E. Acute symptomatic seizures caused by electrolyte disturbances. J Clin Neurol. 2016;12:21–33. doi: 10.3988/jcn.2016.12.1.21. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.King MA, Newton MR, Jackson GD, et al. Epileptology of the first-seizure presentation: a clinical, electroencephalographic, and magnetic resonance imaging study of 300 consecutive patients. Lancet. 1998;352:1007–1011. doi: 10.1016/S0140-6736(98)03543-0. [DOI] [PubMed] [Google Scholar]
- 37.Trinka E, Cock H, Hesdorffer D, et al. A definition and classification of status epilepticus—report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia. 2015;56:1515–1523. doi: 10.1111/epi.13121. [DOI] [PubMed] [Google Scholar]
- 38.Rohracher A, Reiter DP, Brigo F, et al. Status epilepticus in the elderly—A retrospective study on 120 patients. Epilepsy Res. 2016;127:317–323. doi: 10.1016/j.eplepsyres.2016.08.016. [DOI] [PubMed] [Google Scholar]
- 39.Leitinger M, Trinka E, Giovannini G, et al. Epidemiology of status epilepticus in adults: A population-based study on incidence, causes, and outcomes. Epilepsia. 2019;60:53–62. doi: 10.1111/epi.14607. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Trinka E. Epilepsy: comorbidity in the elderly. Acta Neurol Scand Suppl. 2003;180:33–36. doi: 10.1034/j.1600-0404.108.s180.5.x. [DOI] [PubMed] [Google Scholar]
- 41.Trinka E. Ideal characteristics of an antiepileptic drug: How do these impact treatment decisions for individual patients? Acta Neurol Scand. 2012;126:10–18. doi: 10.1111/ane.12015. [DOI] [PubMed] [Google Scholar]
- 42.Brodie MJ, Overstall PW, Giorgi L. Multicentre, double-blind, randomised comparison between lamotrigine and carbamazepine in elderly patients with newly diagnosed epilepsy. The UK Lamotrigine Elderly Study Group. Epilepsy Res. 1999;37:81–87. doi: 10.1016/s0920-1211(99)00039-x. [DOI] [PubMed] [Google Scholar]
- 43.Saetre E, Perucca E, Isojärvi J, et al. An international multicenter randomized double-blind controlled trial of lamotrigine and sustained-release carbamazepine in the treatment of newly diagnosed epilepsy in the elderly. Epilepsia. 2007;48:1292–1302. doi: 10.1111/j.1528-1167.2007.01128.x. [DOI] [PubMed] [Google Scholar]
- 44.Werhahn KJ, Trinka E, Dobesberger J, et al. A randomized, double-blind comparison of antiepileptic drug treatment in the elderly with new-onset focal epilepsy. Epilepsia. 2015;56:450–459. doi: 10.1111/epi.12926. [DOI] [PubMed] [Google Scholar]
- 45.Pohlmann-Eden B, Marson AG, Noack-Rink M, et al. Comparative effectiveness of levetiracetam, valproate and carbamazepine among elderly patients with newly diagnosed epilepsy: Subgroup analysis of the randomized, unblinded KOMET study. BMC Neurol. 2016;16:149. doi: 10.1186/s12883-016-0663-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Hirsch LJ, Arif H, Buchsbaum R, et al. Effect of age and comedication on levetiracetam pharmacokinetics and tolerability. Epilepsia. 2007;48:1351–1359. doi: 10.1111/j.1528-1167.2007.01043.x. [DOI] [PubMed] [Google Scholar]
- 47.Weintraub D, Buchsbaum R, Resor SR, Jr, et al. Psychiatric and behavioral side effects of the newer antiepileptic drugs in adults with epilepsy. Epilepsy Behav. 2007;10:105–110. doi: 10.1016/j.yebeh.2006.08.008. [DOI] [PubMed] [Google Scholar]
- 48.Chen Z, Lusicic A, O’Brien TJ, et al. Psychotic disorders induced by antiepileptic drugs in people with epilepsy. Brain. 2016;139:2668–2678. doi: 10.1093/brain/aww196. [DOI] [PubMed] [Google Scholar]
- 49.Helmstaedter C, Fritz NE, Kockelmann E, et al. Positive and negative psychotropic effects of levetiracetam. Epilepsy Behav. 2008;13:535–541. doi: 10.1016/j.yebeh.2008.05.012. [DOI] [PubMed] [Google Scholar]
- 50.Schoenberg MR, Rum RS, Osborn KE, et al. A randomized, double-blind, placebo-controlled crossover study of the effects of levetiracetam on cognition, mood, and balance in healthy older adults. Epilepsia. 2017;58:1566–1574. doi: 10.1111/epi.13849. [DOI] [PubMed] [Google Scholar]
- 51.Mintzer S, Trinka E, Kraemer G, et al. Impact of carbamazepine, lamotrigine, and levetiracetam on vascular risk markers and lipid-lowering agents in the elderly. Epilepsia. 2018;59:1899–1907. doi: 10.1111/epi.14554. [DOI] [PubMed] [Google Scholar]
- 52.Rohracher A, Kalss G, Kuchukhidze G, et al. New anti-seizure medication for elderly epilepsy patients—a critical narrative review. Expert Opin Pharmacother. 2020 doi: 10.1080/14656566.2020.1843636. [DOI] [PubMed] [Google Scholar]
- 53.Baulac M, Rosenow F, Toledo M, et al. Efficacy, safety, and tolerability of lacosamide monotherapy versus controlled-release carbamazepine in patients with newly diagnosed epilepsy: A phase 3, randomised, double-blind, non-inferiority trial. Lancet Neurol. 2017;16:43–54. doi: 10.1016/S1474-4422(16)30292-7. [DOI] [PubMed] [Google Scholar]
- 54.Rainesalo S, Mäkinen J, Raitanen J, et al. Clinical management of elderly patients with epilepsy; the use of lacosamide in a single center setting. Epilepsy Behav. 2017;75:86–89. doi: 10.1016/j.yebeh.2017.07.045. [DOI] [PubMed] [Google Scholar]
- 55.Costa R, Oliveira C, Lopes N, et al. Safety and efficacy of eslicarbazepine acetate treatment in elderly patients. Epilepsia. 2014;55:340. [Google Scholar]
- 56.Yates SL, Fakhoury T, Liang W, et al. An open-label, prospective, exploratory study of patients with epilepsy switching from levetiracetam to brivaracetam. Epilepsy Behav. 2015;52:165–168. doi: 10.1016/j.yebeh.2015.09.005. [DOI] [PubMed] [Google Scholar]
- 57.Rohracher A, Zimmermann G, Villanueva V, et al. Perampanel in routine clinical use across Europe: Pooled, multicenter, observational data. Epilepsia. 2018;59:1727–1739. doi: 10.1111/epi.14520. [DOI] [PubMed] [Google Scholar]