Abstract
Objective The aim of the present study was to quantify the urinary concentration of the C-terminal cross-linked telopeptide of type-II collagen (CTX-II) biomarker in patients who suffered an isolated ACL injury, and to compare the concentrations found in this population with a control group of patients with no metabolic changes in the knee that could lead to cartilage degeneration.
Methods A cross-sectional pilot study was performed in two groups: patients with ACL tears and a control group (each group with 10 male subjects, with an age range between 18 and 35 years, and body mass index below 30 kg/m 2 ). In both groups, urine concentrations of a biomarker related to the degradation of type-II collagen (CTX-II) was measured. For the group with ACL tears, a temporal relationship between the time after the injury and the amount of the biomarker was also examined.
Results There were significant differences in the concentrations of urinary CTX-II between the ACL group and the control group ( p = 0.009). No significant relationship was observed between the time after the injury and the quantity of the biomarker.
Conclusions Patients with ACL injury had higher concentrations of urinary CTX-II biomarker than those with no ACL injury ( p = 0.009). However, there was no correlation between the concentration of this biomarker and the elapsed time after the injury ( p > 0.05).
Keywords: osteoarthritis, biomarkers, anterior cruciate ligament injuries
Introduction
Anterior cruciate ligament (ACL) injury causes knee instability. Other intra-articular lesions commonly accompany ACL tears, especially those of the cartilage and menisci. The treatment of these lesions involves surgical reconstruction to reestablish the anatomy and biomechanics of the native ligament, mitigating symptoms and enabling the return to activities. 1
One of the main postoperative sequelae of ACL injury is not completely eliminated after ligament reconstruction: the onset of osteoarthritis (OA) of the knee. On average, the signs and symptoms appear 10 to 15 years following ligament reconstruction, with an incidence ranging from 0% to 86% of cases. 2 3 4 5 6
The diagnosis of OA is clinical. The imaging tests have low sensitivity and specificity to detect early changes and monitor the progression of the disease during a short-term follow-up. Visible radiographic changes occur on average two years after the onset of the disease. 1 6 The lack of a universal measurement standard with adequate sensitivity and specificity makes it difficult to measure the early degenerative processes after injury or ACL reconstruction, making a more accurate, short-term screening modality desirable. 4 The use of biomarkers enables an early, non-invasive measurement of the processes of cartilage degeneration. These biochemical markers of connective tissue are released into the systemic circulation, and can be measured in the blood, the urine or the synovial fluid. One of the main biomarkers for the diagnosis and prognosis of OA is C-terminal cross-linked telopeptide of type-II collagen (CTX-II). 7 8 9 10 11 This biomarker is released during the dynamic process of type-II collagen degeneration, and, consequently, it correlates with the destruction and formation of cartilage. 8 12 13 14 15 16 17 18 Mouritzen et al 19 showed that CTX-II has a specificity for OA of the knee. Rotational trauma and intra-articular bleeding associated with ACL tear are thought to cause an acute metabolic alteration of the cartilage and subchondral bone, resulting in the onset of the long-term degeneration of the articular cartilage. One of the biomarkers of this process is CTX-II. 8
In the literature, no study has evaluated the correlation of the CTX-II biomarker in a homogeneous sample with isolated ACL injury, what makes the study unique and innovative. The aim of the present study was to quantify the urinary concentration of the CTX-II biomarker in patients who suffered an isolated ACL injury and to compare the concentrations found in this population with those of a control group of patients with no knee injury. Our hypothesis was that the urine concentrations of CTX-II would be higher in patients with ACL rupture and, therefore, the biomarker would be useful as a prognostic indicator of the development of OA.
Methods
Study Design
The present study was evaluated and approved by the Ethics in Research Committee of the author's institution. The present was a cross-sectional, observational, single-center, pilot study comparing the presence of a type-II collagen degradation urinary biomarker in patients with ACL injury of the knee and healthy patients without knee injury (control group).
Between June 2017 and February 2018, 10 male subjects with a history of isolated ACL lesion (group 1–treatment) and 10 males with no history of knee ligament injury (group 2–control) were evaluated and included in the study.
The inclusion criteria were: male gender; age between 18 and 35 years; body mass index (BMI) lower than 30 kg/m 2 ; isolated ACL lesions or absence of knee injuries; and patients who did not practice sports, since some previous studies suggest an increase in the levels of CTX-II after the practice of sports in certain conditions. 20 21 The exclusion criteria were: female gender; presence of degenerative knee or other joint disease; systemic, autoimmune or infectious diseases; other knee ligament injuries; history of knee surgery; lesions of the meniscus or of the associated cartilage (bone bruises on the magnetic resonance imaging [MRI] scans were not considered cartilage lesions, and were included in the study); any previous ACL surgical treatment; and use of nonsteroidal anti-inflammatory drugs for at least 1 month before the evaluation. With these selection criteria, we tried to make our sample as homogeneous as possible and to obtain the lowest risk to present idiopathic OA or other pathologies such as osteoporosis.
The patients were selected from the outpatient care population with clinical and radiologic findings of the ACL tear. The anterior drawer, Lachman, and pivot-shift maneuvers were used during the physical examination, along with MRI diagnostic confirmation of ACL rupture for Group-1 subjects. These evaluations were performed just before the urine collection, excluding all pathologies that could interfere in the analysis (meniscal lesions, cartilage lesions, osteoarthritis). The maximum time postinjury was stablished as 2 years.
Urine Sample Collection
A single, clean-catch urine collection of all participants was performed, following the same aseptic protocol: after the genital region was topically sterilized, collection of either the first urination of the day or urination two hours after the previous urination (exactly as described in the CTX-II kit instruction manual), during the middle urination stream (neglecting the initial and final phases), using a sterile flask was completed. These urine samples were kept in a refrigerated environment for a maximum duration of 12 hours before centrifugation and frozen at -20°C for the period (1 week to 7 months) prior to the analysis. In the ACL group, the urine samples were obtained in the patients' first visit to the office before any treatment.
Urinalysis and Presence of CTX-II
The urine samples were thawed simultaneously at room temperature for thirty minutes prior to the quantitative measurement of CTX-II. An enzyme-linked immunosorbent assay (ELISA, Elabscience, Houston, TX, US) was performed on each sample. This ELISA kit used the ELISA-sandwich principle for sample analyses. Using this methodology, the supplied ELISA plate is precoated with an antibody specific for human CTX-II. The collected samples (urine) were poured into the wells of the ELISA plate and homogenized with the specific antibody, forming a conjugate (antigen–antibody complex).
Then, a biotinylated detection antibody specific for avidin-horseradish peroxidase (HRP) conjugate was added to the plate and incubated. The free components were removed during a wash. The substrate solution was added to each well, and only the wells containing human CTX-II/conjugate would appear blue. The enzyme-substrate reaction was terminated by the addition of a stop solution, and the color then became yellow. Immediately following this, the optical density (OD) was measured spectrophotometrically at a wavelength of 450 nm ± 2 nm (EZ Read 400 Biochrom spectrometer, Cambourne, Cambridge, UK). The value of the OD is proportional to the concentration of human CTX-II present in the sample. The calculation of the concentration of CTX-II in the samples was then performed by comparing the values calculated based on a standard curve.
The specifications of the ELISA test for the detection of the degradation of type-II collagen (CTX-II kit) according to the manufacturer were as follows: sensitivity: 0.10 ng/mL; detection range: 0.16 ng/mL to 10 ng/mL; reproducibility: coefficient of variation < 10%
All analyses were performed simultaneously in the same laboratory (at the Molecular Biology Division) on the same equipment. The results were evaluated and compared between groups.
Statistical Analysis
Summary statistics (mean, standard deviation, median, minimum, and maximum) were used to describe the characteristics of the patients and the biomarker concentrations within each group. The Mann-Whitney test was used to compare the groups in relation to the concentration of CTX-II. The Spearman correlation was used to evaluate the relationship between the time after the injury and the presence of urinary CTX-II. Values of p lower than 5% (0.05) were defined as statistically significant differences.
Results
The patients in the ACL group had a mean age of 20.8 years and a mean BMI of 25 kg/m 2 . The patients in control group had a mean age of 28.2 years and a mean BMI of 24.5 kg/m 2 . The individuals in the ACL group were younger than those of the control group ( p < 0.001), and there was no significant difference between the groups in terms of BMI ( p > 0.05) ( Table 1 ).
Table 1. Descriptive characteristics evaluated according to each group and results of the comparative testing.
| Variable | Groups | Total | p -value | |
|---|---|---|---|---|
| Age (years) | Control ( n = 10) | Anterior cruciate ligament ( n = 10) | ( n = 20) | < 0.001 |
| Mean ± standard deviation | 28.2 ± 3.8 | 20.8 ± 2.6 | 24.5 ± 5 | |
| Median (minimum; maximum) | 28.5 (22; 35) | 20 (18; 25) | 24 (18; 35) | |
| Body mass index (Kg/m 2 ) | 0.853 | |||
| Mean ± standard deviation | 24.5 ± 3.4 | 25 ± 2.3 | 24.8 ± 2.8 | |
| Median (minimum; maximum) | 24.5 (18; 29) | 24 (22; 29) | 24 (18; 29) | |
| Time postinjury (months) | ||||
| Mean ± standard deviation | 6.8 ± 4.7 | 6.8 ± 4.7 | ||
| Median (minimum; maximum) | 5.5 (2; 18) | 5.5 (2; 18) |
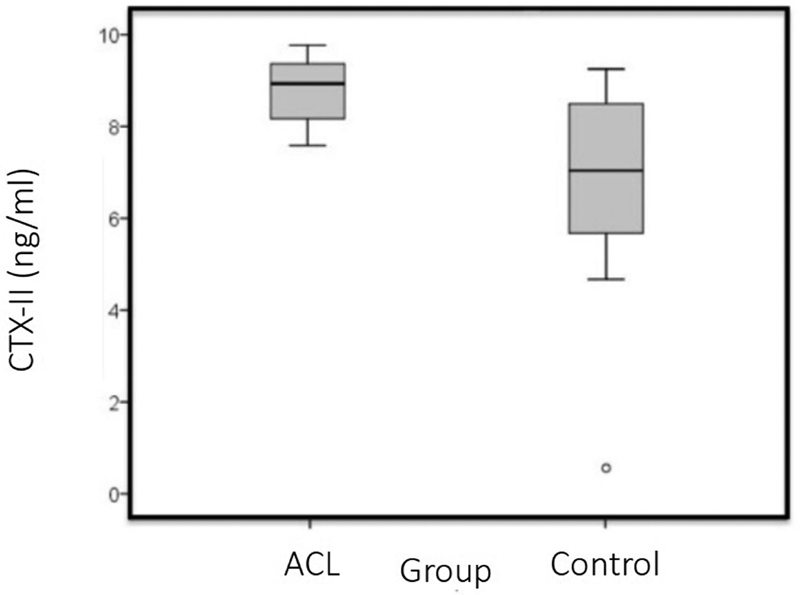
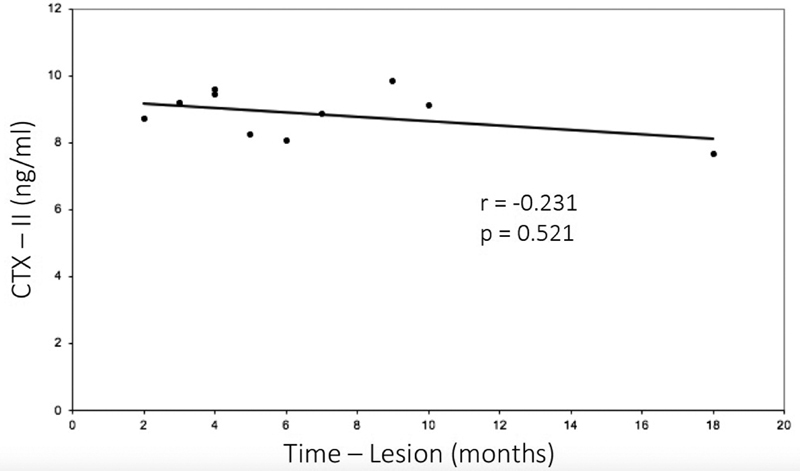
The mean concentration of CTX-II in the ACL group was of 8.9 ± 0.7 ng/mL (range: 7.7 ng/mL to 9.8 ng/mL), which was higher than that of the control group: 6.7 ± 2.6 mg/mL (range 0.7 ng/mL to 9.4 ng/mL; p = 0.009) ( Table 2 and Fig. 1 ). The time postinjury varied between 2 and 18 months, and there was no difference between the time post-injury and the CTX-II levels for the ACL group ( p = 0.521; r = -0.231) ( Fig. 2 and Table 1 ).
Table 2. Quantitative analysis of the CTX-II urine biomarker according to each group and results of the comparative testing.
| CTX-II Urine Concentration (ng/mL) | |||||||
|---|---|---|---|---|---|---|---|
| Groups | n | Mean | SD | Median | Minimum | Maximum | p -value |
| ACL (1) | 10 | 8.9 | 0.7 | 9 | 7.7 | 9.8 | |
| Control (2) | 10 | 6.7 | 2.6 | 7.2 | 0.7 | 9.4 | p = 0.009 |
| Total | 20 | 7.8 | 2.1 | 8.4 | 0.7 | 9.8 | |
Abbreviations: ACL, anterior cruciate ligament; CTX-II, C-terminal cross-linked telopeptide of type-II collagen; SD, standard deviation.
Fig. 1.
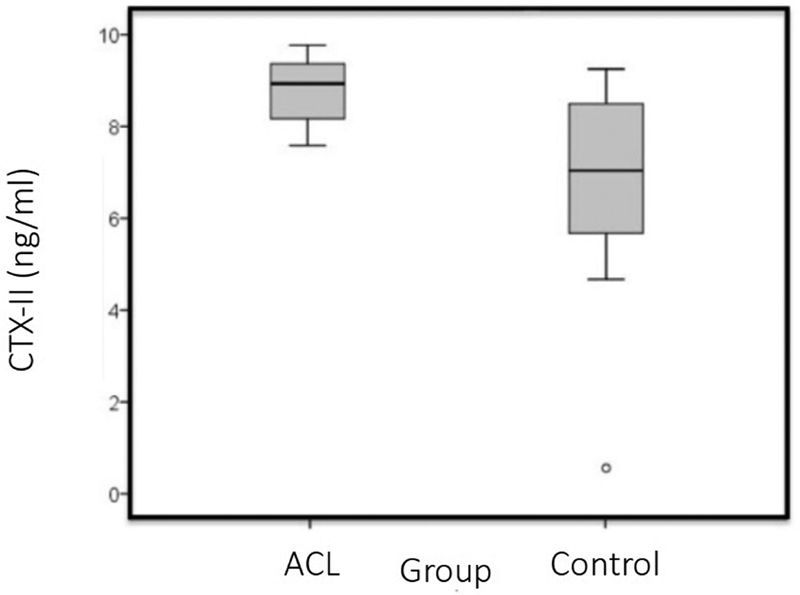
Mean value of the C-terminal cross-linked telopeptide of type-II collagen (CTX-II): anterior cruciate ligament (ACL) group versus control group. The mean value of the CTX-II in the ACL group was of 8.9 ± 0.7 ng/mL (range: 7.7 ng/mL to 9.8 ng/mL), which was higher than that of the control group: 6.7 ± 2.6 ng/mL (range 0.7 ng/mL to 9.4 ng/mL) ( p = 0.009).
Fig. 2.
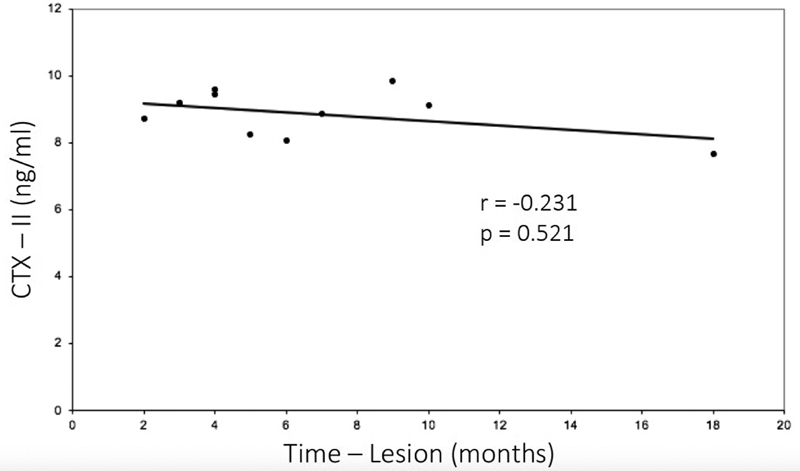
Relationship between time postinjury and CTX-II concentration. There was no difference between the time postinjury and the CTX-II concentration in the ACL group ( p = 0.521; r = -0.231).
Discussion
Our hypothesis was supported by the results of this study. Subjects with ACL rupture had significantly higher concentrations of urinary CTX-II than the subjects without injury ( p = 0.009), regardless of the time postinjury. This finding supports the notion that metabolic changes in the articular cartilage occurring soon after the initial ACL rupture appear to predispose patients to degenerative knee pathology, as seen in other previous studies. 4 14 15 17 22 23 24 25
Interleukins (IL-6, IL-8) and matrix metalloproteases (MMP-3 and MMP-13) are some of the cytokines thought to be intimately related to the degradation of type-II collagen. 1 5 On average, OA becomes symptomatic and hinders the patients from performing activities 10 to 15 years after the initial traumatic event. 7 9 12 However, this degenerative process does not affect all patients with a history of ACL tear, as evidenced by the wide range of incidence in this population (0% to 86%). 2 3 4 5 6
Until now, there has not been a reliable, early prognostic marker for this process. As an established marker of type-II cartilage breakdown, CTX-II can be measured in the blood, the synovial fluid, and the urine because the molecule is not altered after renal filtration. The advantage of the urinary measurement is the ease of collection. Moreover, because it is considered a burden-of-disease type biomarker according to the burden of disease, investigative, prognostic, efficacy of intervention and diagnostic (BIPED) classification, 10 the correlation between the severity of the degenerative changes of the OA and the CTX-II biomarker concentrations support its use as a diagnostic and prognostic tool. 10 25 26 27
Because of the intrinsic characteristics of each method of biomarker quantification (manufacturer, as well as gender, age, BMI and articular joint of the studied patients) there are no uniform or reference values described in the literature, and even the units of measurement differ according to the kit used. 19 Several biomarkers of inflammation quantification such as the cartilage oligomeric matrix protein (COMP), aggrecan degradation products (ARGS) and even inflammatory cytokines have been associated with degenerative processes in the knee cartilage. 5 Despite this variability in the analysis of biomarkers, previous studies in the literature concluded that there is a quantitative increase in biomarkers after an ACL injury. 3 24 However, these studies did not control for isolated ACL injury, the stage of the disease, or use of the same biomarker.
Comparing with previous studies involving CTX-II and OA, Garnero et al 28 compared 67 patients with knee OA and 67 healthy subjects, and a found significant difference between both groups concerning the concentration of urinary CTX-II (mean value: 431 ng/mmol Creatinine and 345 ng/mmol Cr respectively). In another study comparing 17 healthy individuals and 329 patients with any kind of knee injury (ACL/ACL combined with another ligament or meniscus tear, or an isolated meniscus tear), Lohmander et al 18 found a significant difference in the serum CTX-II measurement (mean: 1.4 ng/mL and 9.5 ng/mL respectively). Saberi Hosnijeh et al, 29 in a large cohort study, evaluated 1,335 participants with and without OA and the relationship with several biomarkers, including CTX-II, and showed as result values of 2.4 ng/mmol Cr for the CTX-II in the group that developed OA, and of 2.27 ng/mmol Cr in the group without OA (a small but significant difference).
The present study measured only the preoperative urine CTX-II concentrations; therefore, our study is unique in its aim to identify an early prognostic OA biomarker. Two other studies quantified CTX-II following surgical ligament reconstruction. Larsson et al 26 found no difference in CTX-II biomarker concentrations in the serum, urine, and synovial fluid when comparing the values before and after surgery. Chmielewski et al 8 performed serial urine CTX-II measurements after surgery and found that the concentration decreased over time.
Nevertheless, to demonstrate the specificity of a biomarker and its prognostic power, the homogeneity of the sample is crucial. Furthermore, the markers must be measured accurately and reproducibly, with coefficients of variation lower than 10%. Because patient characteristics such as gender, age and BMI vary, it is necessary to minimize the variability between the compared groups, or to stratify the study according to the analyzed variable. The present study is unique in its methodology, because care was taken to evaluate only patients with isolated ACL injuries, establishing the specificity of this biomarker for post-ACL injury cartilage degeneration in a homogeneous group. According to Deshpande et al, 30 the risk of OA in male, non-obese patients, under 35 years of age is lower than 1%.
The temporal trend of the concentration of the CTX-II biomarker was also evaluated. However, no statistically significant trend was found ( p > 0.05). One of the inclusion criteria for the study was an injury sustained at a maximum of 2 years prior to enrollment, and the postinjury time ranged from 2 to 18 months. The absence of a temporal trend can be explained in two ways: the small sample population, and the possibility of type-II collagen degradation occurring after the trauma sooner than our analysis. These levels could remain chronically elevated, unless a new event occurs, including surgical treatment or some other non-surgical treatment. 26
Despite the fact that our inclusion criteria were designed to identify demographically similar patients, there was a significant difference between the mean ages of the groups. The control group had a higher average age (28.2 ± 3.8 years) than the ACL group (20.8 ± 2.6 years). If the result were the opposite, we might consider this an important bias, once CTX-II values are increased in older patients.
We acknowledge the limitations of the present study. This cross-sectional pilot study provided a statistical evaluation of biomarker concentration in both injured and control populations. Biomarker concentrations are known to change with time and stage of cartilage degeneration. In addition, biomarker concentrations are known to vary with interventions, both surgical and/or clinical. 8 26 Prospective studies tend to provide better information regarding the temporal trends of biomarker concentrations and their related pathological severity. Another limitation of the present study is the small sample size ( n = 20). While this limitation may reduce the robustness of the conclusions, the sample size provided ample power to provide statistically significant results. A study with a larger sample will ultimately provide more conclusive data and may better elucidate the changes in CTX-II concentrations over time. The final limitation is the exclusion of female patients, because the main objective of the selection criteria was to homogenize the sample. This analysis will be necessary in future studies with larger samples of patients of both genders.
Further studies may better elucidate how to inhibit the process of cartilage degeneration after an ACL injury or other joint conditions. Biomarker measurement may play an important role in achieving this goal, because they help in the early diagnosis of metabolic alterations both qualitatively and quantitatively, in terms of disease severity. Finally, they may be used in therapeutic studies to evaluate treatment efficacy.
Perspective
Previous studies have shown that inflammatory cytokine levels increase after ACL rupture, and that this phenomenon may be associated with OA. 2 3 4 17 24 Another way to show an alteration in cartilage metabolism after knee trauma is using biomarkers, such as COMP and CTX-II. 5 15 The importance of the present study is to show the increase in CTX-II concentrations after an ACL tear, and other studies are being conducted after these results. This also could be useful for other pathologies, such as meniscal or cartilaginous injuries and other ligament injuries. It may also be useful to test or compare surgical techniques, medications or interventions to prevent OA. C-terminal cross-linked C-telopeptide of type- II collagen, among other biomarkers, has the advantage of being measured in the urine; therefore, it is an easy and non-invasive way to show and follow cartilage formation and degradation.
Conclusion
Patients with ACL injury had higher concentrations of urinary CTX-II than those with no ACL injury ( p = 0.009). Nevertheless, there was no correlation between the concentration of this biomarker and the elapsed time postinjury ( p > 0.05).
Conflito de Interesses Os autores não têm conflito de interesses a declarar.
Trabalho desenvolvido no Departamento de Ortopedia e Traumatologia, Centro de Traumatologia do Esporte, Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brasil.
Work developed at the Orthopedics and Traumatology Department, Centro de Traumatologia do Esporte, Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brazil.
Suporte Financeiro
Não houve suporte financeiro de fontes públicas, comerciais, ou sem fins lucrativos.
Financial Support
There was no financial support from public, commercial, or non-profit sources.
Referências
- 1.Sanders T L, Maradit Kremers H, Bryan A J. Incidence of Anterior Cruciate Ligament Tears and Reconstruction: A 21-Year Population-Based Study. Am J Sports Med. 2016;44(06):1502–1507. doi: 10.1177/0363546516629944. [DOI] [PubMed] [Google Scholar]
- 2.Poole A R, Kobayashi M, Yasuda T. Type II collagen degradation and its regulation in articular cartilage in osteoarthritis. Ann Rheum Dis. 2002;61 02:ii78–ii81. doi: 10.1136/ard.61.suppl_2.ii78. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Lohmander L S, Atley L M, Pietka T A, Eyre D R. The release of crosslinked peptides from type II collagen into human synovial fluid is increased soon after joint injury and in osteoarthritis. Arthritis Rheum. 2003;48(11):3130–3139. doi: 10.1002/art.11326. [DOI] [PubMed] [Google Scholar]
- 4.Bigoni M, Sacerdote P, Turati M. Acute and late changes in intraarticular cytokine levels following anterior cruciate ligament injury. J Orthop Res. 2013;31(02):315–321. doi: 10.1002/jor.22208. [DOI] [PubMed] [Google Scholar]
- 5.Palmieri-Smith R M, Wojtys E M, Potter H G. Early Cartilage Changes After Anterior Cruciate Ligament Injury: Evaluation With Imaging and Serum Biomarkers-A Pilot Study. Arthroscopy. 2016;32(07):1309–1318. doi: 10.1016/j.arthro.2015.12.045. [DOI] [PubMed] [Google Scholar]
- 6.Wang X, Bennell K L, Wang Y. Tibiofemoral joint structural change from 2.5 to 4.5 years following ACL reconstruction with and without combined meniscal pathology. BMC Musculoskelet Disord. 2019;20(01):312. doi: 10.1186/s12891-019-2687-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cohen M, Amaro J T, Ejnisman B. Anterior cruciate ligament reconstruction after 10 to 15 years: association between meniscectomy and osteoarthrosis. Arthroscopy. 2007;23(06):629–634. doi: 10.1016/j.arthro.2007.03.094. [DOI] [PubMed] [Google Scholar]
- 8.Chmielewski T L, Trumble T N, Joseph A M. Urinary CTX-II concentrations are elevated and associated with knee pain and function in subjects with ACL reconstruction. Osteoarthritis Cartilage. 2012;20(11):1294–1301. doi: 10.1016/j.joca.2012.07.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Oiestad B E, Holm I, Aune A K. Knee function and prevalence of knee osteoarthritis after anterior cruciate ligament reconstruction: a prospective study with 10 to 15 years of follow-up. Am J Sports Med. 2010;38(11):2201–2210. doi: 10.1177/0363546510373876. [DOI] [PubMed] [Google Scholar]
- 10.Bauer D C, Hunter D J, Abramson S B. Classification of osteoarthritis biomarkers: a proposed approach. Osteoarthritis Cartilage. 2006;14(08):723–727. doi: 10.1016/j.joca.2006.04.001. [DOI] [PubMed] [Google Scholar]
- 11.Fosang A J, Stanton H, Little C B, Atley L M. Neoepitopes as biomarkers of cartilage catabolism. Inflamm Res. 2003;52(07):277–282. doi: 10.1007/s00011-003-1177-5. [DOI] [PubMed] [Google Scholar]
- 12.Øiestad B E, Engebretsen L, Storheim K, Risberg M A. Knee osteoarthritis after anterior cruciate ligament injury: a systematic review. Am J Sports Med. 2009;37(07):1434–1443. doi: 10.1177/0363546509338827. [DOI] [PubMed] [Google Scholar]
- 13.Mobasheri A, Henrotin Y. Biomarkers of (osteo)arthritis. Biomarkers. 2015;20(08):513–518. doi: 10.3109/1354750X.2016.1140930. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Cameron M, Buchgraber A, Passler H. The natural history of the anterior cruciate ligament-deficient knee. Changes in synovial fluid cytokine and keratan sulfate concentrations. Am J Sports Med. 1997;25(06):751–754. doi: 10.1177/036354659702500605. [DOI] [PubMed] [Google Scholar]
- 15.Harkey M S, Luc B A, Golightly Y M. Osteoarthritis-related biomarkers following anterior cruciate ligament injury and reconstruction: a systematic review. Osteoarthritis Cartilage. 2015;23(01):1–12. doi: 10.1016/j.joca.2014.09.004. [DOI] [PubMed] [Google Scholar]
- 16.Ajuied A, Wong F, Smith C. Anterior cruciate ligament injury and radiologic progression of knee osteoarthritis: a systematic review and meta-analysis. Am J Sports Med. 2014;42(09):2242–2252. doi: 10.1177/0363546513508376. [DOI] [PubMed] [Google Scholar]
- 17.Higuchi H, Shirakura K, Kimura M. Changes in biochemical parameters after anterior cruciate ligament injury. Int Orthop. 2006;30(01):43–47. doi: 10.1007/s00264-005-0023-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Lohmander L S, Englund P M, Dahl L L, Roos E M. The long-term consequence of anterior cruciate ligament and meniscus injuries: osteoarthritis. Am J Sports Med. 2007;35(10):1756–1769. doi: 10.1177/0363546507307396. [DOI] [PubMed] [Google Scholar]
- 19.Mouritzen U, Christgau S, Lehmann H J, Tankó L B, Christiansen C. Cartilage turnover assessed with a newly developed assay measuring collagen type II degradation products: influence of age, sex, menopause, hormone replacement therapy, and body mass index. Ann Rheum Dis. 2003;62(04):332–336. doi: 10.1136/ard.62.4.332. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Jorge P B, Sprey J W, Runco G M, Lima M V, Severino N R, Santili C. Diferença na degeneração articular de acordo com o tipo de esporte. Rev Bras Ortop. 2019;54(05):509–515. doi: 10.1016/j.rboe.2018.02.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Severino R M, Jorge P B, Martinelli M O, de Lima M V, Severino N R, Duarte Junior A. Análise dos níveis séricos do biomarcador CTX-II em atletas profissionais como fator preditivo de degradação articular. Rev Bras Ortop. 2015;50(03):331–335. doi: 10.1016/j.rboe.2015.04.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Wu W, Billinghurst R C, Pidoux I. Sites of collagenase cleavage and denaturation of type II collagen in aging and osteoarthritic articular cartilage and their relationship to the distribution of matrix metalloproteinase 1 and matrix metalloproteinase 13. Arthritis Rheum. 2002;46(08):2087–2094. doi: 10.1002/art.10428. [DOI] [PubMed] [Google Scholar]
- 23.Nelson F, Billinghurst R C, Pidoux I. Early post-traumatic osteoarthritis-like changes in human articular cartilage following rupture of the anterior cruciate ligament. Osteoarthritis Cartilage. 2006;14(02):114–119. doi: 10.1016/j.joca.2005.08.005. [DOI] [PubMed] [Google Scholar]
- 24.Irie K, Uchiyama E, Iwaso H. Intraarticular inflammatory cytokines in acute anterior cruciate ligament injured knee. Knee. 2003;10(01):93–96. doi: 10.1016/s0968-0160(02)00083-2. [DOI] [PubMed] [Google Scholar]
- 25.Davis H C, Spang J T, Loeser R F. Time between anterior cruciate ligament injury and reconstruction and cartilage metabolism six-months following reconstruction. Knee. 2018;25(02):296–305. doi: 10.1016/j.knee.2018.01.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Larsson S, Struglics A, Lohmander L S, Frobell R. Surgical reconstruction of ruptured anterior cruciate ligament prolongs trauma-induced increase of inflammatory cytokines in synovial fluid: an exploratory analysis in the KANON trial. Osteoarthritis Cartilage. 2017;25(09):1443–1451. doi: 10.1016/j.joca.2017.05.009. [DOI] [PubMed] [Google Scholar]
- 27.Kraus V B, Hargrove D E, Hunter D J, Renner J B, Jordan J M. Establishment of reference intervals for osteoarthritis-related soluble biomarkers: the FNIH/OARSI OA Biomarkers Consortium. Ann Rheum Dis. 2017;76(01):179–185. doi: 10.1136/annrheumdis-2016-209253. [DOI] [PubMed] [Google Scholar]
- 28.Garnero P, Piperno M, Gineyts E, Christgau S, Delmas P D, Vignon E. Cross sectional evaluation of biochemical markers of bone, cartilage, and synovial tissue metabolism in patients with knee osteoarthritis: relations with disease activity and joint damage. Ann Rheum Dis. 2001;60(06):619–626. doi: 10.1136/ard.60.6.619. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Saberi Hosnijeh F, Siebuhr A S, Uitterlinden A G. Association between biomarkers of tissue inflammation and progression of osteoarthritis: evidence from the Rotterdam study cohort. Arthritis Res Ther. 2016;18:81. doi: 10.1186/s13075-016-0976-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Deshpande B R, Katz J N, Solomon D H. Number of Persons With Symptomatic Knee Osteoarthritis in the US: Impact of Race and Ethnicity, Age, Sex, and Obesity. Arthritis Care Res (Hoboken) 2016;68(12):1743–1750. doi: 10.1002/acr.22897. [DOI] [PMC free article] [PubMed] [Google Scholar]