Abstract
Introducción y objetivos
Presentamos una serie de casos de 10 pacientes recibiendo manejo protocolizado para infección por SARS-CoV-2 que desarrollaron complicaciones gastrointestinales severas. El objetivo del estudio es contribuir a la discusión sobre las complicaciones gastrointestinales de la infección por SARS-CoV-2. Hasta el momento y tras una revisión de la literatura, se trata de la primera serie de casos detallada sobre este tema.
Materiales y métodos
Se realizó una búsqueda retrospectiva y filtrada de todos los pacientes ingresados en nuestro hospital por infección por SARS-CoV-2 que desarrollaron complicaciones gastrointestinales severas. Se obtuvieron del expediente clínico todos los datos relevantes al manejo intrahospitalario antes y después de la cirugía.
Resultados
De 905 pacientes ingresados a la fecha del 26 de agosto de 2020 en nuestro hospital por infección por SARS-CoV-2, 10 pacientes desarrollaron complicaciones gastrointestinales severas. Siete de ellos fueron hombres. Se presentaron 4 perforaciones del yeyuno proximal, 3 perforaciones del colon ascendente, una perforación concomitante del colon sigmoides e íleon terminal, una necrosis intestinal masiva y una defunción prequirúrgica. Se realizaron 3 colectomías derechas, 4 resecciones intestinales, un procedimiento de Hartmann con resección intestinal y una reparación primaria de intestino delgado. La mortalidad del grupo estudiado fue del 50%.
Conclusión
Las perforaciones intestinales espontáneas y la isquemia mesentérica aguda están surgiendo como complicaciones severas y que ponen en riesgo la vida de pacientes hospitalizados por SARS-CoV-2. Se requiere más evidencia para identificar factores de riesgo, establecer medidas preventivas y analizar los posibles efectos adversos de los protocolos de manejo actuales.
Palabras clave: COVID-19, Perforación intestinal, Isquemia mesentérica, Trombosis mesentérica
Abstract
Introduction and aims
A case series of ten patients that received protocolized care for SARS-CoV-2 infection and developed severe gastrointestinal complications, is presented. The aim of our study was to contribute to the ongoing discussion regarding gastrointestinal complications related to SARS-CoV-2 infection. After reviewing the current literature, ours appears to be the first detailed case series on the topic.
Materials and methods
A retrospective filtered search of all patients admitted to our hospital for SARS-CoV-2 infection, who developed severe gastrointestinal complications, was performed. All relevant data on hospital patient management, before and after surgery, were collected from the medical records.
Results
Of the 905 patients admitted to our hospital due to SARS-CoV-2 infection, as of August 26, 2020, ten of them developed severe gastrointestinal complications. Seven of those patients were men. There were four cases of perforation of the proximal jejunum, three cases of perforations of the ascending colon, one case of concomitant perforation of the sigmoid colon and terminal ileum, one case of massive intestinal necrosis, and one preoperative death. Three right colectomies, four intestinal resections, one Hartmann's procedure with bowel resection, and one primary repair of the small bowel were performed. The mortality rate of the patients analyzed was 50%.
Conclusion
Spontaneous bowel perforations and acute mesenteric ischemia are emerging as severe, life-threatening complications in hospitalized SARS-CoV-2 patients. More evidence is needed to identify risk factors, establish preventive measures, and analyze possible adverse effects of the current treatment protocols.
Keywords: COVID-19, Bowel perforation, Mesenteric ischemia, Mesenteric thrombosis
Introducción y objetivos
Hasta el 26 de agosto del 2020, el SARS-CoV-2 ha afectado 24.3 millones de pacientes a nivel mundial, con 829,663 defunciones reportadas de acuerdo a reportes de la Organización Mundial de la Salud. El número sigue creciendo en varios países y los mecanismos patológicos exactos de este nuevo virus y sus implicaciones sistémicas permanecen desconocidos, a pesar de la abundancia de investigación publicada desde el comienzo de la pandemia global.
Como se ha reportado extensamente, en hasta el 50% de los casos de infección por SARS-CoV-2 se pueden desarrollar síntomas gastrointestinales1, en ocasiones incluso antes de los síntomas respiratorios. El virus ha sido identificado en muestras fecales, y el mecanismo confirmado de entrada a las células gastrointestinales es el receptor de la enzima convertidora de la angiotensina 2 (ECA-2)2. Xiao et al. reportaron expresión abundante del receptor ECA-2 en células glandulares de epitelio gástrico, duodenal y rectal, por inmunofluorescencia3.
La infección por SARS-CoV-2 también ha demostrado causar coagulopatías, y se ha demostrado hipercoagulabilidad en los enfermos críticos por medio de tromboelastografía4. La trombosis secundaria a dicho estado de hipercoagulabilidad puede llevar a embolia pulmonar e isquemia intestinal, razón por la cual se está utilizando anticoagulación parenteral en el tratamiento de la enfermedad.
En México, a la fecha del 26 de agosto del 2020, se han reportado 573,888 casos confirmados de SARS-CoV-2, con 62,076 defunciones, y no se observan indicios de aplanamiento de la curva. El Hospital San José Tec de Monterrey es un hospital de especialidades avanzadas en Monterrey, una de las ciudades más grandes del país. El hospital ha sido designado como exclusivo para COVID, y desde mayo del 2020 se ha recibido y tratado a pacientes en sus 150 camas. De acuerdo con nuestra investigación, se han publicado pocos reportes respecto a isquemia intestinal o perforación en pacientes con infección por SARS-CoV-25, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18.
El objetivo de nuestro estudio fue presentar una serie de casos completa sobre el tema, con tantos detalles pre- y postoperatorios como fuera posible.
Materiales y métodos
Realizamos una búsqueda retrospectiva filtrada de todos los pacientes hospitalizados en el Hospital San José Tec de Monterrey desde que se estableció en mayo del 2020 como un centro de referencia para SARS-CoV-2, con los siguientes criterios de inclusión: 1) prueba PCR positiva por SARS-CoV-2; 2) pacientes hospitalizados bajo manejo protocolizado por neumonía COVID, y 3) el desarrollo de perforación intestinal espontánea o isquemia mesentérica aguda.
Obtuvimos las características demográficas, al igual que toda la información relevante preoperatoria, postoperatoria, quirúrgica y sobre admisión. Los datos relevantes sobre la admisión incluyeron la carga viral SARS-CoV-2 y marcadores séricos. La información relevante preoperatoria anterior al inicio de síntomas incluyó el intervalo de tiempo desde admisión, el intervalo de tiempo desde la primera dosis inmunomoduladora, la modalidad de oxígeno suplementario requerida, admisión a la unidad de cuidado intensivo (UCI), e inestabilidad hemodinámica. La información perioperatoria relevante incluyó hallazgos por imagen, procedimiento quirúrgico realizado, hallazgos quirúrgicos, y la presencia o ausencia de necrosis o perforación. Los datos postoperatorios relevantes incluyeron la tasa de mortalidad por todas las causas y el reporte patológico.
Las características de línea base fueron reportadas como frecuencias y porcentajes. Debido a los valores atípicos en los resultados de los marcadores proinflamatorios, se utilizaron mediana y rango. Para parámetros con distribución normal se utilizó la media aritmética. Los datos fueron presentados de manera descriptiva, con medidas de tendencia central calculadas para expresar las características de línea base. No se realizó análisis estadístico.
Todos los pacientes incluidos en el presente estudio firmaron el consentimiento informado, aceptando el manejo estandarizado hospitalario por infección por SARS-CoV-2, al igual que un consentimiento informado respecto a la utilización de sus archivos clínicos personales para propósitos de investigación. El estudio cumple con los estándares actuales bioéticos y fue aprobado por el comité de ética de nuestra institución. El presente análisis y los consentimientos informados firmados no constituyeron un protocolo de tratamiento experimental, sino un tratamiento empírico basado en datos sobre el tema emergentes de manera continua. No se incluyeron datos o imágenes que permitan la identificación de los pacientes.
Resultados
Todos los pacientes hospitalizados en nuestro centro durante el periodo del estudio cursaban con neumonía por SARS-CoV-2. De los 905 expedientes clínicos analizados, 10 pacientes cumplieron con los criterios de inclusión, con una incidencia del 1.1%. Todos los pacientes hospitalizados recibieron el mismo manejo estandarizado, el cual incluyó medidas de apoyo y terapia de oxígeno, desde cánula nasal hasta ventilación mecánica, conforme a necesidad, además del siguiente tratamiento estandarizado: 40 mg de metilprednisolona diarios o 6 mg de dexametasona diarios, 250 mg de azitromicina diarios, 600 mg de ceftarolina diarios, 200/50 mg de lopinvir/ritonavir dos veces al día, 400 mg de ribavirina dos veces al día, 40-60 mg de enoxaparina diarios. Los inmunomoduladores fueron utilizados de la siguiente manera: todos los pacientes comenzaron con 4 mg de baricitinib diarios, y si en cualquier momento un paciente tenía niveles de ferritina > 1,000 ng/ml e IL-6 > 80 pg/ml, se administraron dos dosis de 8 mg/kg de tocilizumab con espacio de 12 h y se suspendió el baricitinib.
La razón para el uso de cada uno de estos medicamentos estuvo basada en datos emergentes continuos disponibles conforme el avance de la pandemia. Específicamente, los esteroides han sido el tratamiento principal a nivel mundial; los antibióticos fueron usados para prevenir o tratar infecciones bacterianas adicionales; los antivirales e inmunomoduladores fueron usados dado que fueron tratamientos emergentes y prometedores durante el segundo cuarto del 2020; la heparina de bajo peso molecular fue utilizada como tromboprofilaxis. El remdesivir y la ivermectina no fueron utilizados. Las recomendaciones sobre el tratamiento médico por infección SARS-CoV-2 han estado cambiando continuamente, y los protocolos de tratamiento alrededor del mundo deben apegarse a las recomendaciones emergentes o establecer su propio protocolo experimental. El primer abordaje ha sido la norma en nuestra institución, el cual constituye un tratamiento empírico basado en datos actuales y emergentes de todo el mundo.
Se incluyó a 10 pacientes, de los cuales 7 eran hombres (70%), con una edad promedio de 61.6 años y un IMC de 29.2 kg/m2. Tres pacientes (30%) tenían diabetes mellitus, 4 pacientes tenían hipertensión arterial (40%) y 3 pacientes eran fumadores (30%). La tabla 1 muestra las características basales de la población.
Tabla 1.
Características de línea base
| Demográficos | (n = 10) |
|---|---|
| Edad, años (media) | 61.6 |
| Sexo, % hombres | 70% |
| IMC, kg/m2(media) | 29.2 |
| Comorbilidades | |
| Diabetes mellitus, frecuencia (%) | 3 (30%) |
| Hipertensión arterial, frecuencia (%) | 4 (40%) |
| Tabaquismo, frecuencia (%) | 3 (30%) |
| Variables preoperatorias | |
| Resultado CORADS (media) | 4.7/5 |
| Tiempo de admisión a inicio, días (media) | 10.6 |
| Admisión a UCI antes de inicio, frecuencia (%) | 9 (90%) |
| Uso de presores antes de inicio, frecuencia (%) | 5 (50%) |
| Ventilación mecánica antes de inicio, frecuencia (%) | 8 (80%) |
| # dosis de baricitinib (media) | 6.6 |
De los 10 pacientes estudiados, 9 (90%) estaban en la UCI al inicio de los síntomas, de los cuales 8 estaban con ventilación mecánica invasiva. Cinco de esos 9 pacientes críticos estaban hemodinámicamente inestables, recibiendo vasopresores. La tabla 2 muestra la carga viral y biomarcadores al momento de la admisión.
Tabla 2.
Biomarcadores de admisión
| Biomarcador | Mediana | Rango |
|---|---|---|
| Carga viral (copias/ml) | 3383 | (45.2 - 35060) |
| Leu (×103/ml) | 11.2 | (4.6 - 15.5) |
| LDH (U/L) | 376 | (190 - 684) |
| CRP (mg/l) | 17.6 | (3.42 - 45.10) |
| D-Dímero (ng/l) | 353 | (8 - 2117) |
| Procalcitonina (ng/ml) | 0.2 | (0.06 - 1.28) |
| Ferritina (ng/ml) | 1098 | (16.3 - 4011) |
| IL-6 (pg/ml) | 63.2 | (3.71 - 1624) |
| BNP (pg/ml) | 35.3 | (10 - 342) |
| Troponina (ng/l) | 16.6 | (1.5 - 383) |
| Neutrófilos (%) | 88.1 | (69.6 - 92.8) |
| Plaquetas (×103/ml) | 280 | (105 - 520) |
| Lactato (mmol/l) | 2.1 | (1 - 3.71) |
| Creatinina (mg/dl) | 0.8 | (0.6 - 6.6) |
| Fibrinógeno (mg/dl) | 438.5 | (65 - 643) |
BNP: péptido natriurético cerebral; CRP: proteína C reactiva; LDH: lactato deshidrogenasa; Leu: leucocitos.
Respecto al uso de inmunomoduladores, todos los pacientes recibieron baricitinib, al igual que esteroides concomitantes (dexametasona, metilprednisolona, etc.). No fueron necesarios ajustes a la dosis relacionados con linfopenia, ya que no se presentó en ninguno de los pacientes en nuestra serie de casos. La dosis de baricitinib no fue ajustada por función renal. Se utilizó tocilizumab en 2 (20%) pacientes.
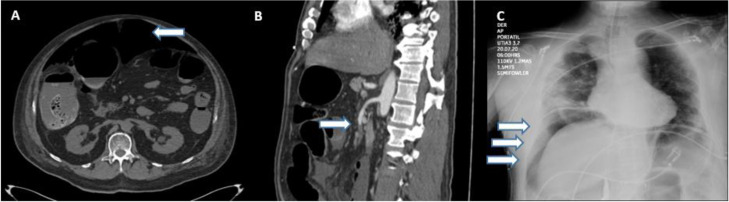
Ocho pacientes fueron diagnosticados por medio de TC abdominal, 6 de ellos presentaron signos de neumoperitoneo, lo cual fue indicio de perforación intestinal (fig. 1 A). Un paciente presentó trombosis de la arteria mesentérica superior (fig. 1B), sin aire libre o signos de perforación. El otro paciente presentó una fístula enterocutánea, conectando la piel con un sitio de yeyunostomía previa (14 años), de acuerdo a lo observado por medio de TC. Dos pacientes fueron diagnosticados por medio de radiografía torácica que reveló aire subdiafragmático consistente con perforación intestinal (fig. 1C). Uno de los pacientes antes mencionados (H, 74) murió 7 h después del diagnóstico, durante la resucitación preoperatoria e intentos de estabilización hemodinámica como preparación para cirugía de emergencia. En los demás pacientes se realizó laparotomía.
Figura 1.
A) TC que muestra neumoperitoneo (flecha). B) TC que muestra trombosis de arteria mesentérica superior (flecha). C) Radiografía torácica que muestra aire subdiafragmático (flechas).
Tres pacientes presentaron perforaciones ascendentes pequeñas en el colon ascendente y fueron manejados con colectomía derecha. Uno de ellos (H, 69) fue reintervenido debido a signos de choque hemodinámico; una laceración de vena cava inferior, resultado de una disección complicada del colon ascendente por flemón localizado durante la cirugía inicial, fue identificada y reparada, y el paciente murió 12 h después. Los otros 2 pacientes fueron dados de alta (H, 34; M, 54). A ninguno de los 3 pacientes mencionados anteriormente se le realizó anastomosis primaria, y ninguno tuvo signos de trombosis en la revisión histopatológica.
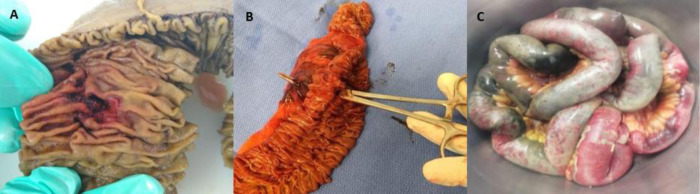
Cuatro pacientes presentaron pequeñas perforaciones en el intestino delgado proximal (yeyuno) (fig. 2 A), todas en la unión mesentérica. El primer paciente (H, 51) presentó un divertículo yeyunal perforado. El segundo paciente (M, 79) presentó 4 divertículos yeyunales. Ambos fueron manejados con resección del segmento afectado (fig. 2B) y anastomosis primaria de extremo a extremo. El análisis patológico del primer paciente reportó trombosis mesentérica de intestino delgado, y el otro análisis solamente reportó divertículos perforados con inflamación local. El primer paciente fue dado de alta y el segundo paciente murió 12 días después de la cirugía. El tercer paciente (H, 67) presentó perforación yeyunal de 2 mm a 10 cm de la unión duodenoyeyunal. La lesión fue manejada con reparación primaria y derivación gastroyeyunal y no se estudió ningún espécimen quirúrgico. El paciente murió 48 h después de la cirugía. El último paciente (H, 73) desarrolló una fístula enterocutánea, conectando un sitio de yeyunostomía previa con la piel abdominal, durante la hospitalización por SARS-CoV-2 bajo nuestro protocolo de tratamiento. Se le realizó resección intestinal y anastomosis primaria de extremo a extremo. El análisis patológico no reportó trombosis mesentérica y el paciente fue dado de alta después de una recuperación exitosa.
Figura 2.
A) Espécimen quirúrgico de resección de yeyuno que muestra perforación total. B) Intestino delgado reseccionado, mismo paciente, mostrando perforación total y hematoma en el mesenterio. C) Intestino delgado reseccionado; se pueden observar áreas irregulares de necrosis.
Un paciente (H, 55) presentó necrosis intestinal, afectando los 250 cm más distales del intestino delgado, lo cual requirió la resección de la porción afectada (fig. 2C), por medio de la creación de yeyunostomía terminal. Debido a la incertidumbre respecto a la viabilidad de su colon ascendente, se utilizó un aparato de presión negativa intraperitoneal (ABThera®, KCI, San Antonio, TX, EE.UU.), con planeación de cirugía de intervalo. El paciente fue reintervenido 48 h después, encontrando colon ascendente viable, se retiró el sistema ABThera y su pared abdominal fue cerrada. El análisis patológico reportó necrosis y trombosis e isquemia mesentérica. El paciente murió 28 días después de la cirugía.
Un paciente (M, 60) presentó perforación de colon sigmoide y perforación de íleon terminal, lo cual fue manejado con el procedimiento de Hartman y resección de intestino delgado concomitante, con anastomosis primaria de extremo a extremo. El análisis patológico reportó colon perforado, sin signos de trombosis y el paciente fue dado de alta tras su recuperación.
El intervalo de tiempo promedio entre ingreso e inicio de síntomas abdominales fue 10.6 días (rango de 7-16). La mortalidad general de pacientes internados debido a infección SARS-CoV-2 en nuestro hospital es del 10.05%. En nuestro grupo de estudio, 5 pacientes sobrevivieron, resultando en una tasa de mortalidad del 50% y un riesgo relativo de muerte de 4.97, en comparación con el resto de la población SARS-CoV-2 en nuestro hospital. Los detalles completos de cada uno de nuestros pacientes están en la tabla 3 .
Tabla 3.
Resultados
| Paciente | Carga viral | Días desde admisión | Hallazgos | Procedimiento | Anastomosis primaria | Reporte patológico | Resultado final |
|---|---|---|---|---|---|---|---|
| 1 | 35060 | 7 | Perforación de colon ascendente | Colectomía derecha | No | Colon perforado | Alta |
| 2 | 47.77 | 16 | Perforación de colon ascendente | Colectomía derecha | No | Necrosis transmural | Defunción |
| 3 | 1668 | 12 | Divertículo yeyunal perforado | Resección intestinal | Sí | Trombosis mesentérica | Alta |
| 4 | 395548 | 7 | Perforación yeyunal | Reparación intestinal | - | - | Defunción |
| 5 | 12515 | 7 | Necrosis de intestino delgado | Resección intestinal | No | Trombosis mesentérica | Defunción |
| 6 | 45.2 | 13 | - | - | - | - | Defunción |
| 7 | 2480 | 14 | Fístula enterocutánea con absceso | Resección intestinal | Sí | Peritonitis crónica | Alta |
| 8 | 3338 | 12 | Perforación sigmoide + perforación de íleo terminal | Procedimiento de Hartman + resección intestinal | Sí (intestino delgado) | Peritonitis crónica | Alta |
| 9 | 7531 | 10 | Divertículos yeyunales perforados (3) | Resección intestinal | Sí | Divertículos perforados | Defunción |
| 10 | 3428 | 8 | Perforación de colon ascendente | Colectomía derecha | No | Colon perforado | Alta |
| Paciente | # dosis de baricitinib | # dosis de tocilizumab | Dosis de vasopresinaa (U/min) | Dosis de norepinefrinaa (mcg/kg/min) | Peso | Dosis de HBPM (mg QD) |
|---|---|---|---|---|---|---|
| 1 | 3 | 0 | - | - | 90 | 60 |
| 2 | 3 | 0 | 0.06 | 0.8 | 91 | 80 |
| 3 | 8 | 0 | - | - | 100 | 60 |
| 4 | 0 | 0 | 0.04 | 0.4 | 85 | 60 |
| 5 | 3 | 0 | - | 0.06 | 89 | 80 |
| 6 | 7 | 0 | 0.06 | 0.5 | 84 | 60 |
| 7 | 6 | 0 | - | - | 91 | 80 |
| 8 | 7 | 2 | 0.04 | 0.05 | 99 | 80 |
| 9 | 10 | 0 | 0.04 | 0.11 | 62 | 40 |
| 10 | 8 | 2 | 0.04 | 0.08 | 94 | 60 |
Dosis inicial; continuamente evaluada para lograr presiones arteriales medias adecuadas.
Discusión
Con una incidencia del 1.1% y un riesgo relativo de muerte de 4.97, como se reporta en nuestro estudio, las complicaciones intestinales graves en pacientes hospitalizados por infección SARS-CoV-2 están emergiendo como un fenómeno de riesgo de muerte serio. De manera interesante, el desenlace en dichos pacientes suma el 5.49% de las muertes por SARS-CoV-2 en nuestro hospital. Los mecanismos propuestos de lesión viral al conducto gastrointestinal ya han sido discutidos. A la fecha, a nivel mundial se han publicado 8 reportes de caso único5, 6, 7, 8, 9, 10, 11, 12, 13. Norsa et al. también publicaron una serie de casos de 7 pacientes14, pero ofrece poca información sobre diagnóstico, hallazgos quirúrgicos y tratamiento previo. En una serie de casos presentada por Gao et al.15, describieron a 4 pacientes con abdomen agudo, quienes eran sospechosos de infección SARS-CoV-2, pero finalmente dieron negativo. Ignat et al.16 reportaron una serie de casos de 3 pacientes que desarrollaron isquemia intestinal, mientras estaban hospitalizados por infección SARS-CoV-2 en Francia. Sin embargo, no mencionan el intervalo de tiempo entre admisión y el desarrollo del abdomen agudo, o el manejo previo durante la hospitalización. Kaafarani et al.17 presentaron una serie de casos de 141 pacientes graves, describiendo complicaciones gastrointestinales relacionadas con infección SARS-CoV-2, de los cuales 5 pacientes (3.54%) presentaron isquemia intestinal. Finalmente, Bhayana et al.18 presentaron una serie de casos de orientación radiológica que incluyó detalles quirúrgicos y radiológicos de 4 pacientes SARS-CoV-2 con trombosis mesentérica. Toda la literatura publicada y detalles disponibles aparecen en la tabla 4 , excepto el estudio de Kaafarani et al. Su serie de casos fue excluida de la tabla debido a la falta de detalles individuales de los pacientes y de especificación de resultados de supervivencia. Hasta donde sabemos, la nuestra es la primera serie de casos completa sobre el tema.
Tabla 4.
Investigación textual de otros reportes de caso con implicación de isquemia intestinal, trombosis o perforación en pacientes hospitalizados por SARS-CoV-2
| Autor | n | Sexo | Edad | Herramienta diagnóstica | Imagen de aire libre | Trombosis (TC) | Cirugía | Sitio afectado | Necrosis presente | Perforación | Supervivencia |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Norsa | 1 | M | 62 | TC | No | Sí | Resección intestinal | Intestino delgado | Sí | No | No |
| Bhayana | 4 | - | - | TC | No | Sí | Resección intestinal | Intestino delgado | Sí | No | - |
| - | - | TC | No | Sí | Laparotomía | Intestino delgado | Sí | No | - | ||
| - | - | TC | No | Sí | Laparotomía | Intestino delgado | No | No | - | ||
| - | - | TC | No | Sí | Laparotomía | Colon/estómago | No | No | - | ||
| Farinaa | 1 | M | 70 | TC | No | Sí | No | Intestino delgado | - | - | No |
| Azouz | 1 | M | 56 | TC | No | No | Resección intestinal | Intestino delgado | Sí | - | - |
| Norsa | 7 | M | 85 | TC | Sí | ||||||
| F | 71 | Endoscopía | No se proporciona información por paciente | Sí | |||||||
| M | 69 | TC | No | ||||||||
| F | 79 | TC | Dos pacientes tenían edema de pared de colon marcada | Sí | |||||||
| M | 63 | TC | Cuatro pacientes tenían neumatosis intestinalis | No | |||||||
| M | 62 | TC | Un paciente tenía trombosis de vena cava inferior y vena mesentérica superior | No | |||||||
| F | 83 | TC | No proporcionaron información sobre cirugía o hallazgos quirúrgicos | No | |||||||
| Chan | 1 | M | 73 | TC | No | Sí | No | Colon sigmoide | - | - | No |
| De Nardi | 1 | M | 53 | TC | Sí | Sí (EP) | Colectomía derecha | Colon ascendente | No | Sí | Sí |
| Neto | 1 | F | 80 | TC | Sí | No | Sigmoidectomía | Colon sigmoide | No | Sí | No |
| Winnicka | 1 | M | 73 | Radiografía | Sí | - | No | - | - | - | Sí |
| Guardiola | 1 | M | 66 | TC | Sí | No | Colectomía derecha | Colon ascendente | No | Sí | - |
| Gaob | 4 | F | 71 | - | - | - | Resección intestinal | Intestino delgado | No | - | Sí |
| M | 41 | - | - | - | Resección intestinal | Intestino delgado | Sí | - | Sí | ||
| M | 52 | - | - | - | Reparación intestinal | Intestino delgado | No | Sí | Sí | ||
| M | 63 | - | - | - | Reparación intestinal | Intestino delgado | No | Sí | Sí | ||
| Bianco | 1 | M | 59 | TC | No | No | Resección intestinal | Intestino delgado | Sí | No | No |
EP: embolia pulmonar; F: femenino; M: masculino; TC: tomografía computarizada.
Farina et al. reportaron un caso sospechoso de COVID con PCR negativa.
Todos los pacientes reportados por Gao et al. fueron sospechosos inicialmente de tener COVID, pero finalmente probaron negativos.
Nuestra razón para utilizar baricitinib y tocilizumab para tratar neumonía por SARS-CoV-2 estuvo basada en la literatura que estaba disponible al momento de concebir nuestro protocolo de tratamiento, el cual fue en su totalidad observacional. No se realizaron cambios al protocolo durante el periodo del estudio. El primer ensayo prospectivo con tocilizumab (Estudio COVACTA fase III), el cual fue realizado por el Grupo Roche, se ha detenido debido a que el análisis intermedio mostró que no cumplía con sus puntos terminales pretendidos, de acuerdo a una publicación reciente en su sitio web. Sin embargo, esto ocurrió posteriormente a nuestra colección de datos.
Se han propuesto varias hipótesis para explicar por qué SARS-CoV-2 parece causar lesión gastrointestinal, como lo explican Pan et al. Primero, el virus puede sobrerregular la expresión de receptores ECA-2, lo cual permite una mayor penetración del virus a las células digestivas. De manera similar, puede dañar directa o indirectamente el sistema gastrointestinal por medio de respuesta inflamatoria. Además, dado que el intestino es un órgano grande del sistema inmunológico, puede alterar el llamado «eje intestino-pulmón» al causar cambios en la composición y función de la microbiota intestinal. Simultáneamente, un trastorno de coagulación es inducido por inflamación sistémica, y la hipoxia y la inmovilización también podrían participar. Se han reportado niveles elevados del factor de von Willebrand, el cual se produce en respuesta al daño de endotelio vascular, el cual expresa receptores ECA-219. Ambos mecanismos podrían contribuir a la trombosis mesentérica, lo cual puede llevar a isquemia intestinal. Finalmente, la isquemia mesentérica simplemente podría ser consecuencia de choque hemodinámico debido a neumonía por SARS-CoV-220, 21.
La isquemia mesentérica aguda secundaria a trombosis puede ser explicada por el estado de hipercoagulación ya atribuido a la infección por SARS-CoV-2, como se explicó previamente. Sin embargo, las perforaciones espontáneas, como las descritas en nuestros pacientes, plantean la pregunta de si el mecanismo es simplemente la lesión directa mediada por receptores de ECA-2 mencionada anteriormente, o si existen otros factores en juego, posiblemente incluyendo algún aspecto del manejo protocolizado recibido. De manera interesante, las perforaciones espontáneas parecen ocurrir predominantemente en el ceco o en el yeyuno proximal. Además, tanto Kaafarani et al. como Bhayana et al. notaron una decoloración irregular amarillenta en la serosa intestinal de las lesiones isquémicas, diferente del color usual morado o negro del intestino necrótico. Nosotros no observamos decoloración inusual en nuestros pacientes.
Las limitaciones de la presente serie de casos incluyen su naturaleza retrospectiva y la falta de grupo control, lo cual sirvió de motivación para un estudio de caso-control que se realiza actualmente. Una limitación importante del diseño del nuevo estudio caso-control será la imposibilidad de analizar el uso de medicamentos inmunosupresores y corticoesteroides como un factor de riesgo, dado que todos nuestros pacientes los reciben, por lo que tanto casos como controles tendrán la misma exposición. Sin embargo, será interesante comparar dichos pacientes con el resto de la población que no desarrolló complicaciones intestinales, comparando sus cargas virales y otros marcadores de gravedad de la enfermedad. La inclusión en el presente estudio del paciente con una fístula enterocutánea fue discutida plenamente entre los autores y decidimos no excluirla por dos razones. Primero, el paciente cumplía con todos los criterios de inclusión. Segundo, independientemente de la yeyunostomía previa, la cual fue cerrada con éxito 14 años antes, y considerando la recuperación sin incidentes del paciente desde entonces, creemos que es poco probable que la reapertura del sitio de la yeyunostomía habría ocurrido si el paciente no hubiera sido hospitalizado por neumonía SARS-CoV-2. Además, todas las fístulas enterocutáneas ocurren en el contexto de perforación intestinal o pérdida de integridad de la pared intestinal, lo cual es la razón por la que dicho paciente es mencionado en la sección de perforación de intestino delgado.
Dado que no se puede esperar una correlación o asociación de una serie de casos pequeña, no se pudieron sacar conclusiones definitivas. Sin embargo, los autores del presente artículo recomiendan el uso de anticoagulación profiláctica en cualquier régimen de tratamiento por infección SARS-CoV-2, al igual que la constante evaluación de pacientes hospitalizados por el desarrollo de síntomas abdominales. También se deben realizar estudios sobre el perfil de seguridad de medicamentos utilizados actualmente para tratar SARS-CoV-2, ya que medicamentos de base inmunológica como el tocilizumab y el baricitinib han sido asociados con un riesgo de perforación intestinal espontánea6, 22, 23, 24. El uso de corticoesteroides y su relación con perforación gastrointestinal ha sido discutida desde 198025, 26, y un estudio de cohorte más reciente de 2017 encontró que el uso de corticoesteroides incrementaba en gran medida la mortalidad (es decir, duplicaba) en el contexto de perforación intestinal27. Conforme la pandemia actual avance y se presenten más casos con complicaciones gastrointestinales, habrá mayor disponibilidad de estudios que puedan esclarecer el mecanismo de dicho fenómeno, determinar los factores de riesgo involucrados y establecer medidas preventivas. Por tal motivo, instamos a todos los autores contribuyentes a la discusión sobre este tema que proporcionen detalles completos de la admisión hospitalaria y el periodo perioperatorio, describiendo el protocolo de tratamiento completo para pacientes con infección SARS-CoV-2.
Financiación
No se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de intereses
Todos los autores declaran no tener conflictos de intereses.
Referencias
- 1.Pan L., Mu M., Yang P. Clinical characteristics of COVID-19 patients with digestive symptoms in Hubei China. Am J Gastroenterol. 2020;115:766–773. doi: 10.14309/ajg.0000000000000620. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kotfis K., Skonieczna-Żydecka K. COVID-19: gastrointestinal symptoms and potential sources of SARS-CoV-2 transmission. Anaesthesiol Intensive Ther. 2020;52:171–172. doi: 10.5114/ait.2020.93867. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Xiao F., Tang M., Zheng X. Evidence for gastrointestinal infection of SARS-CoV-2. Gastroenterology. 2020;158:1831–1833. doi: 10.1053/j.gastro.2020.02.055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Panigada M., Bottino N., Tagliabue P. Hypercoagulability of COVID-19 patients in Intensive Care Unit. A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost. 2020;18:1738–1742. doi: 10.1111/jth.14850. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Norsa L., Valle C., Morotti D. Intestinal ischemia in the COVID-19 era. Dig Liver Dis. 2020;52:1090–1091. doi: 10.1016/j.dld.2020.05.030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Guardiola P.G., Ares J.A., Tomás N.P. Perforación intestinal en paciente COVID-19 en tratamiento con tocilizumab y corticoides. A propósito de un caso. Cir Esp. 2020;99:156–157. doi: 10.1016/j.ciresp.2020.04.030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.De Nardi P., Parolini D.C., Ripa M. Bowel perforation in a Covid-19 patient: Case report. Int J Colorectal Dis. 2020 doi: 10.1007/s00384-020-03627-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Azouz E., Yang S., Monnier-Cholley L. Systemic arterial thrombosis and acute mesenteric ischemia in a patient with COVID-19. Intensive Care Med. 2020 doi: 10.1007/s00134-020-06079-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chan K.H., Lim S.L., Damati A. Coronavirus disease 2019 (COVID-19) and ischemic colitis: An under-recognized complication. Am J Emerg Med. 2020 doi: 10.1016/j.ajem.2020.05.072. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Neto I.J., Viana K.F., Silva M.B. Perforated acute abdomen in a patient with COVID-19: an atypical manifestation of the disease. J Coloproctology. 2020 doi: 10.1016/j.jcol.2020.05.011. [DOI] [Google Scholar]
- 11.Farina D., Rondi P., Botturi E. Gastrointestinal: Bowel ischemia in a suspected coronavirus disease (COVID-19) patient. J Gastroenterol Hepatol. 2020;36:41. doi: 10.1111/jgh.15094. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Winnicka L.M., Shenoy M.A. Gastrointestinal perforation in a COVID-19 patient. Infect Dis Clin Pract. 2020 [Google Scholar]
- 13.Bianco F., Ranieri A.J., Paterniti G. Acute intestinal ischemia in a patient with COVID-19. Tech Coloproctol. 2020 doi: 10.1007/s10151-020-02255-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Norsa L., Pietro B., Indriolo A. Poor outcome of intestinal ischemic manifestations of COVID 19. Gastroenterology. 2020;159:1595–1597. doi: 10.1053/j.gastro.2020.06.041. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Gao Y., Xi H., Chen L. Emergency surgery in suspected COVID-19 patients with acute abdomen. Ann Surg. 2020;272:e38–e39. doi: 10.1097/SLA.0000000000003961. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Ignat M., Philouze G., Aussenac-Belle L. Small bowel ischemia and SARS-CoV-2 infection: An underdiagnosed distinct clinical entity. Surgery. 2020;168:14–16. doi: 10.1016/j.surg.2020.04.035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Kaafarani H.M., Moheb M.E., Hwabejire J.O. Gastrointestinal complications in critically ill patients with COVID 19. Ann Surg. 2020 doi: 10.1097/SLA.0000000000004004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Bhayana R., Som A., Li M.D. Abdominal imaging findings in COVID-19: Preliminary observations. Radiology. 2020 doi: 10.1148/radiol.2020201908. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Escher R., Breakey N., Lämmle B. Severe COVID-19 infection associated with endothelial activation. Thromb Res. 2020;190:62. doi: 10.1016/j.thromres.2020.04.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Parry A.H., Wani A.H., Yaseen M. Acute mesenteric ischemia in severe coronavirus-19 (COVID-19): Possible mechanisms and diagnostic pathway. Acad Radiol. 2020;27:1190. doi: 10.1016/j.acra.2020.05.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Lodigiani C., Iapichino G., Carenzo L. Venous and arterial thromboembolic complications in COVID-19 patients admitted to an academic hospital in Milan, Italy. Thromb Res. 2020;191:9–14. doi: 10.1016/j.thromres.2020.04.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Harigai M. Growing evidence of the safety of JAK inhibitors in patients with rheumatoid arthritis. Rheumatology. 2019;58:i34–i42. doi: 10.1093/rheumatology/key287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Smolen J.S., Genovese M.C., Takeuchi T. Safety profile of baricitinib in patients with active rheumatoid arthritis with over 2 years median time in treatment. J Rheumatol. 2019;46:7–18. doi: 10.3899/jrheum.171361. [DOI] [PubMed] [Google Scholar]
- 24.Xie F., Yun H., Bernatsky S. Brief Report: Risk of gastrointestinal perforation among rheumatoid arthritis patients receiving tofacitinib tocilizumab, or other biologic treatments. Arthritis Rheumatol. 2016;68:2612–2617. doi: 10.1002/art.39761. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Arsura E.L. Corticosteroid-associated perforation of colonic diverticula. Arch Intern Med. 1990;150:1337–1338. doi: 10.1001/archinte.1990.00390180139026. [DOI] [PubMed] [Google Scholar]
- 26.Remine S.G., Mcilrath D.C. Bowel perforation in steroid-treated patients. Ann Surg. 1980;192:581–586. doi: 10.1097/00000658-198010000-00016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Broersen L.H., Horváth-Puhó E., Pereira A.M. Corticosteroid use and mortality risk in patients with perforated colonic diverticular disease: A population-based cohort study. BMJ Open Gastroenterol. 2017;4:e000136. doi: 10.1136/bmjgast-2017-000136. [DOI] [PMC free article] [PubMed] [Google Scholar]