Abstract
目的
旨在探讨褐藻素(Fx)对人前列腺癌PC-3细胞凋亡的影响及其作用机制。
方法
采用相应的试剂盒检测PC-3细胞活力和细胞凋亡。荧光探针染色检测PC-3细胞中的线粒体膜电位、线粒体形态和线粒体超氧化物。同时采用相应的试剂盒检测PC-3细胞中三磷酸腺苷、过氧化氢、丙二醛和超氧化物的含量以及总抗氧化能力。Western blot方法检测PC-3细胞中Bcl-2、Bax和细胞色素c蛋白的表达。采用相应的试剂盒检测PC-3细胞中caspase-9和caspase-3/7活性。
结果
Fx呈时间和剂量依赖性地抑制PC-3细胞活力,呈剂量依赖性地诱导PC-3细胞凋亡(P < 0.05)。经Fx处理后,PC-3细胞中的线粒体膜电位水平降低,线粒体碎片化,线粒体超氧化物水平升高(P < 0.05),且Fx的作用效果成剂量依赖性。Fx剂量依赖性地降低PC-3细胞中的三磷酸腺苷水平和总抗氧化能力,剂量依赖性地增加过氧化氢、丙二醛和超氧化物的含量(P < 0.05)。经Fx处理后,PC-3细胞中Bax和细胞质中细胞色素c的水平呈剂量依赖性增加,PC-3细胞中Bcl-2和线粒体中细胞色素c的水平呈剂量依赖性降低(P < 0.05)。
结论
Fx通过引发线粒体功能障碍导致氧化应激和激活线粒体介导的凋亡信号通路诱导PC-3细胞凋亡,提示Fx有望成为治疗前列腺癌的潜在药物。
Keywords: 褐藻素, 前列腺癌, 细胞凋亡, 线粒体, 氧化应激
Abstract
Objective
To investigate the apoptosis- inducing effect of fucoxanthin in human prostate cancer PC-3 cells and the underlying mechanism.
Methods
The viability and apoptosis of PC-3 cells treated with fucoxanthin were analyzed using commercial kits, and the mitochondrial membrane potential, mitochondrial morphology and mitochondrial superoxide were detected using fluorescence probe staining. The contents of ATP, H2O2, malondialdehyde (MDA), superoxide and the total antioxidant capacity of PC-3 cells were determined. The protein expressions of Bcl-2, Bax and cytochrome c were detected with Western blotting, and the activity of caspase-9 and caspase- 3/7 was detected using corresponding kits.
Results
Fucoxanthin significantly inhibited the viability of PC-3 cells in a time- and dose-dependent manner, and dose-dependently induced apoptosis of the cells (P < 0.05). Fucoxanthin-treated PC-3 cells showed significantly decreased mitochondrial membrane potential, mitochondrial fragmentation and increased superoxide level in the mitochondria (P < 0.05), and these effects of fucoxanthin were dose- dependent. Fucoxanthin dose-dependently decreased ATP level and the total antioxidant capacity of PC-3 cells, increased the contents of H2O2, MDA and superoxide (all P < 0.05), enhanced the protein expressions of Bax and cytochrome c in the cytoplasm, and lowered the protein expressions of Bcl-2 and cytochromes in the mitochondria (P < 0.05).
Conclusions
Fucoxanthin induces apoptosis of PC-3 cells by triggering mitochondrial dysfunction to cause oxidative stress and by activating mitochondria-mediated apoptotic signaling pathways, suggesting its potential in prostate cancer treatment.
Keywords: fucoxanthin, prostate cancer, apoptosis, mitochondria, oxidative stress
前列腺癌是西方国家男性发病率居于第1位、致死率居于第2位的恶性肿瘤,其发病率和年龄直接相关,年龄增大,前列腺癌的发病率显著升高[1]。根据文献报道,我国前列腺癌的发病率呈明显上升趋势,前列腺癌正严重危害我国中老年男性的身体健康[2]。手术治疗、内分泌治疗、化疗、放疗等是目前治疗前列腺癌的主要手段,然而目前治疗前列腺癌的药物均存在一定的副作用[3]。因此,寻找高效且无毒副作用的天然来源活性物质,研究开发其用于前列腺癌临床用药具有非常重要现实的意义。
海洋活性小分子褐藻素(Fx)是一种从褐藻中提取的天然类胡萝卜素,具有独特的结构(图 1A),包含共轭双键长链、共轭羰基、5,6-单环氧化物和乙酰基[4]。Fx具有广泛的药理活性,如抗炎、抗肥胖、抗糖尿病、抗血管生成和抗癌活性[5-8],且Fx安全性评估也未展现出Fx明显的毒副作用[9]。既往研究表明Fx对前列腺癌细胞的增殖有一定的抑制作用,但Fx抗前列腺癌的具体作用机制尚无相关报道[10-11]。本文采用PC-3细胞作为前列腺癌细胞模型,探讨Fx对PC-3细胞凋亡的影响及其作用机制,旨在为海洋活性小分子Fx开发应用于前列腺癌的临床药物提供实验数据支撑。
1.
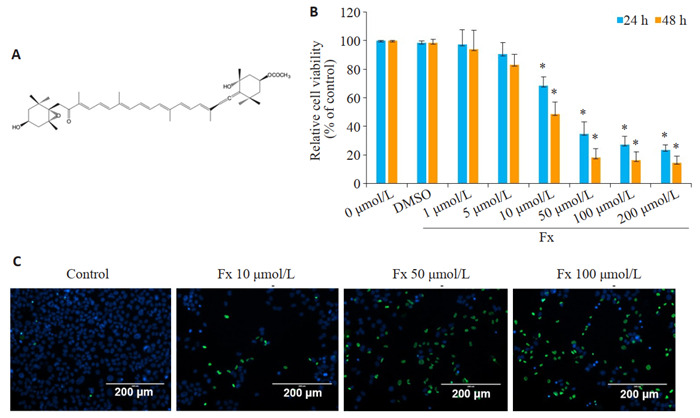
Fx抑制PC-3细胞的活力
Inhibitory effect of fucoxanthin (Fx) on viability of PC-3 cells. A: Chemical structure of Fx. B: Viability of PC-3 cells treated with different concentrations of Fx for 24 or 48 h detected by CCK-8 assay. C: Viability of PC-3 cells treated with different concentrations of Fx for 48 h detected by ReadyProbes® cell Viability Imaging Kit. Experiments were performed independently at least thrice with similar results. *P < 0.05 vs control group.
1. 材料和方法
1.1. 材料
1.1.1. 实验细胞
人雄激素非依赖型前列腺癌细胞株PC-3细胞购买于中山大学实验动物中心。PC-3细胞使用含10%胎牛血清的RPMI 1640培养基于37 ℃、5% CO2培养箱中培养,取对数生长期细胞用于实验[12-13]。
1.1.2. 试剂和抗体
RPMI 1640培养基、胎牛血清(Gibco);褐藻素、Caspase 9活性比色试剂盒(Merck Life Science);细胞线粒体分离试剂盒、三磷酸腺苷(ATP)检测试剂盒、Hoechst 33342染色液、过氧化氢检测试剂盒、总抗氧化能力检测试剂盒(ABTS法)、丙二醛(MDA)检测试剂盒、细胞增殖-毒性检测试剂盒(CCK-8试剂盒)、线粒体膜电位检测试剂盒、Bcl-2、Cytochrome c蛋白抗体(碧云天生物科技有限公司);线粒体超氧化物红色荧光探针试剂盒、Ready ProbesTM细胞活力成像试剂盒(ThermoFisher);Annexin V-FITC/PI双染试剂盒和TUNEL细胞凋亡检测试剂盒(上海翊圣生物科技有限公司);Caspase- Glo® 3/7检测试剂盒(Promega);GAPDH、Bax蛋白抗体、HRP标记的山羊抗兔IgG和HRP标记的山羊抗小鼠IgG(武汉博士德生物科技有限公司)。
1.2. 方法
1.2.1. 使用CCK-8试剂盒和Ready ProbesTM细胞活力成像试剂盒检测细胞活力
待PC-3细胞进行相应处理后,使用CCK-8试剂盒检测其细胞活力,经CCK-8溶液于37 ℃孵育1 h后,测量吸光度A450 nm,计算细胞活力。待PC-3细胞进行相应处理后,使用ReadyProbesTM细胞活力成像试剂盒(蓝/绿)检测其细胞活力,按照说明书操作后,使用Olympus IX71观察PC-3细胞。
1.2.2. 采用TUNEL法和Annexin V-FITC/PI双染法检测PC-3细胞凋亡
待PC-3细胞经爬片进行相应处理后,使用TUNEL细胞凋亡检测试剂盒检测其细胞凋亡,按照说明书操作后,在荧光显微镜下分析样本。根据TUNEL阳性细胞数与Hoechst 33342阳性细胞数的比值计算凋亡细胞的百分比,随机分析每张爬片的20个视野。待PC-3细胞进行相应处理后,使用Annexin V-FITC/PI双染试剂盒检测其细胞凋亡,按照说明书操作后,样品在1 h内用流式细胞仪进行定量检测。
1.2.3. 线粒体膜电位、线粒体形态和线粒体超氧化物的检测
待PC-3细胞进行相应处理后,分别使用JC-1探针、MitoTracker探针或MitoSOX探针检测其线粒体膜电位、线粒体形态或线粒体超氧化物。分别经1×JC-1染色工作液于37 ℃孵育20 min后1×JC-1缓冲液洗2次、经250 μmol/L MitoTracker工作液于37 ℃孵育30 min后PBS洗3次或经5 μmol/L MitoSOX工作液于37 ℃孵育10 min后PBS洗3次,随后使用Olympus IX71观察PC-3细胞。
1.2.4. ATP、H2O2、MDA和超氧化物含量及总抗氧化能力的检测
待PC-3细胞进行相应处理后,按照试剂盒说明书方法,使用ATP检测试剂盒、过氧化氢检测试剂盒、脂质氧化检测试剂盒、超氧化物检测试剂盒和总抗氧化能力检测试剂盒(ABTS法),分别检测PC-3细胞中的ATP水平、H2O2含量、MDA含量、超氧化物的含量和总抗氧化能力。
1.2.5. Western blot法检测蛋白表达水平
按照实验目的,利用细胞线粒体分离试剂盒提取线粒体和去除线粒体成分的细胞质蛋白,或利用RIPA裂解液提取细胞全蛋白。用SDS-PAGE凝胶电泳分离蛋白后将蛋白由凝胶转至NC膜上。使用5%脱脂奶粉于室温封闭1 h后,剪出所需蛋白条带用相应的一抗于4 ℃孵育过夜。次日采用相应的HRP标记二抗于室温孵育1 h,加入化学发光试剂,用X线胶片曝光,胶片经HP LaserJet Professional M1213nf MFP扫描后,Gelpro32软件分析蛋白条带的灰度值。
1.2.6. Caspase和Caspase-3/7活性的检测
待PC-3细胞进行相应处理后,使用Caspase 9活性比色试剂盒检测其Caspase 9活性,按照说明书操作后,测量吸光度A450 nm,计算Caspase 9活性。待PC-3细胞进行相应处理后,使用Caspase-Glo® 3/7检测试剂盒检测其Caspase-3/7活性,按照说明书操作后,用流式细胞仪检测Caspase-3/7活性。
1.3. 数据统计
采用SPSS 22.0软件对数据进行分析。数据以均数±标准差表示,数据的统计分析采用单因素方差分析,实验至少独立进行了3次,得到相似的结果。P < 0.05为差异具有统计学意义。
2. 结果
2.1. Fx对PC-3细胞活力的抑制作用
不同剂量的Fx处理24 h或48 h后,PC-3细胞活力受到抑制,并呈剂量和时间依赖性。CCK-8实验结果显示,不同剂量的Fx处理一定时间后,PC-3细胞活力受到抑制,且呈剂量依赖性。PC-3细胞在10、50、100 μmol/L的Fx处理24 h后,PC-3细胞存活率分别为68.36%、34.67%、27.34%。以上剂量的Fx处理48 h后,PC-3细胞存活率分别为48.67%、18.45%、16.43%。10 μmol/L以上剂量的Fx能有效抑制PC-3细胞的活力(P < 0.05,图 1B)。Ready Probes®细胞活力成像试剂盒(蓝/绿)检测在10、50、100 μmol/L的Fx处理48 h后PC-3细胞的活力,用绿色标记死细胞,用蓝色标记总细胞。结果显示,与对照组相比,在10、50、100 μmol/L的Fx处理48 h后,PC-3细胞活力明显降低,这与CCK-8实验结果一致(图 1C)
2.2. Fx诱导PC-3细胞凋亡
Hoechst 33342染色法检测PC-3细胞的形态变化,结果显示经Fx处理的PC-3细胞表现出凋亡相关的特征,如染色质压实和核碎裂,细胞核荧光比对照组更亮(图 2A)。流式细胞术检测结果显示,Fx处理48 h后的PC-3细胞凋亡率明显高于对照组(图 2B)。TUNEL染色结果也显示,Fx处理48 h后的PC-3细胞中,TUNEL阳性细胞数与Hoechst 33342阳性细胞总数的比值较对照组明显增大(P < 0.05,图 2C)。
2.
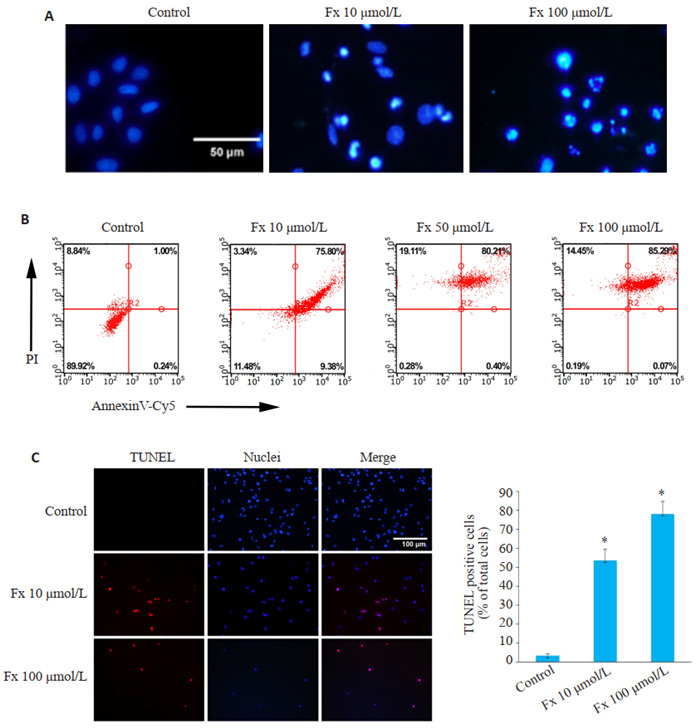
Fx诱导PC-3细胞凋亡
Fx induces apoptosis of PC-3 cells. A: Hoechst 33342 staining of the cells treated with different concentrations of Fx (Scale bar=50 μmol/L). B: Flow cytometry of PC-3 cells treated with different concentrations of Fx for 48 h. C: TUNEL staining of PC-3 cells showing the apoptotic cells (red indicates apoptotic cells and blue indicates nuclei. Scale bar=100 μmol/L). The number of TUNEL-positive cells was quantified. Experiments were performed independently at least thrice with similar results. *P < 0.05 vs control group.
2.3. Fx对PC-3细胞线粒体功能及形态的影响
使用线粒体膜电位检测试剂盒检测线粒体膜电位的变化,结果显示,对照组PC-3细胞展现出更多的红色荧光,且强度较高。经Fx处理后,PC-3细胞展现出更多的绿色荧光,且亮度成剂量依赖性升高(图 3A)。荧光探针标记线粒体形态结果显示,对照组PC-3细胞内线粒体网络相互连接,呈细长丝状状分布。经Fx处理的PC-3细胞线粒体网络变短,呈分散短棒状分布且碎片化(图 3B)。经Fx处理的PC-3细胞中ATP含量降低,且呈剂量依赖性(P < 0.05,图 3C)。
3.
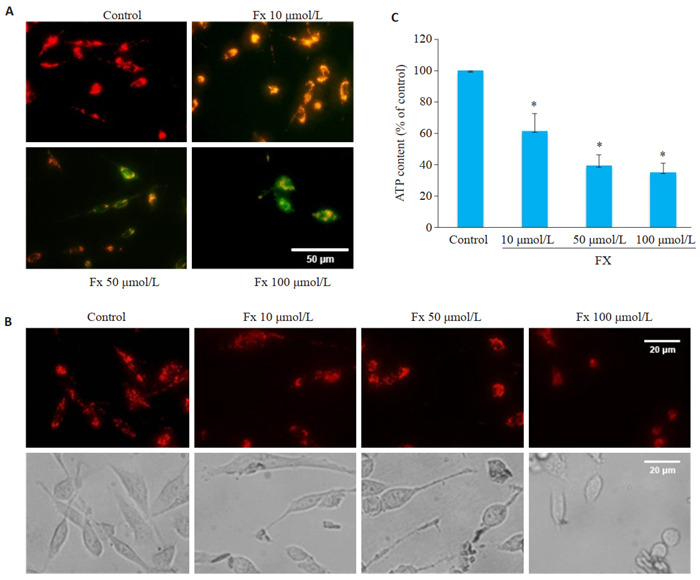
Fx对PC-3细胞线粒体功能的影响
Effects of Fx on mitochondrial function and morphology of PC-3 cells. A: Mitochondrial membrane potential of PC-3 cells treated with different concentrations of Fx for 24 h detected by a JC-1 fluorescent probe (red indicates JC-1 aggregate and green fluorescence indicates JC-1 monomer. Scale bar=50 μmol/L). B: Fluorescence images of mitochondria stained with Mitotracker in PC-3 cells treated with different concentrations of Fx for 24 h (Scale bar=20 μmol/L). C: ATP content in PC-3 cells treated with different concentrations of Fx for 24 h. *P < 0.05 vs control group.
2.4. Fx增加PC-3细胞的氧化应激水平
在10、50、100 μmol/L的Fx处理24 h后,PC-3细胞的H2O2、MDA和超氧化物水平均升高(P < 0.05,图 4A~C)。此外,Fx处理后PC-3细胞总抗氧化能力减弱(P < 0.05,图 4D)。MitoSOX染色结果显示,Fx处理后PC-3细胞展现的红色荧光强度明显强于对照组(图 4E)。
4.
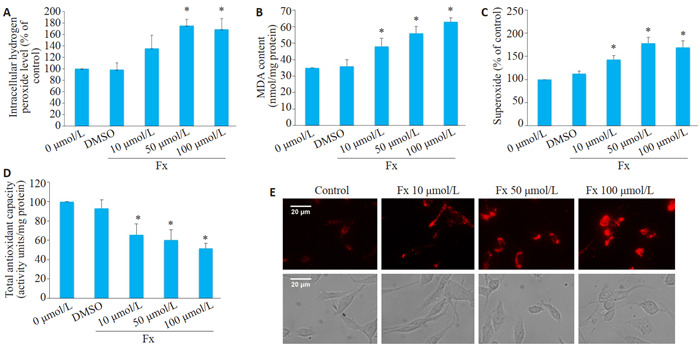
Fx增加PC-3细胞的氧化应激水平
Fx enhances oxidative stress level in PC-3 cells. A-D: H2O2, MDA, and superoxide levels and total antioxidant capacity, respectively, of PC-3 cells treated with 10, 50 and 100 μmol/L Fx for 24 h. E: Representative fluorescence images of MitoSOX in PC-3 cells treated with 10, 50 and 100 μmol/L Fx for 24 h (Scale bar=20 μmol/L). *P < 0.05 vs control group.
2.5. Fx激活线粒体介导的凋亡信号通路
Western blot结果表明Fx不仅下调了Bcl-2蛋白表达水平,还提高了Bax蛋白表达水平,导致Bcl-2/Bax比值降低(P < 0.05,图 5A)。Western blot检测PC-3细胞中细胞色素c从线粒体渗漏到细胞质的情况,与对照组PC-3细胞相比,Fx处理后显著抑制了线粒体中细胞色素c蛋白的表达,显著促进细胞质中细胞色素c蛋白的表达(P < 0.05,图 5B)。同时,比色法和荧光定量法结果显示Fx可增强PC-3细胞中caspase 9和caspase 3/7活性(P < 0.05,图 5C、D)。
5.
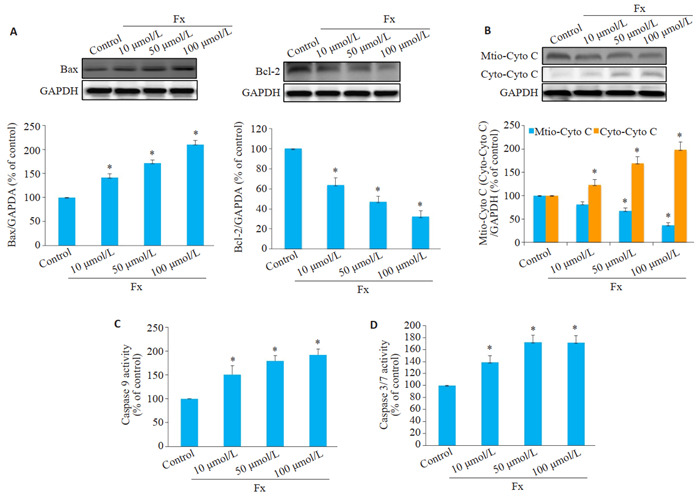
Fx激活线粒体介导的PC-3细胞凋亡
Fx activates mitochondria-mediated apoptosis in PC-3 cells treated with different concentrations of Fx for 24 h. A: Western blotting for Bax and Bcl-2 in PC-3 cells. B: Western blotting for cytochrome c (cyto c) in mitochondrial and cytosolic fractions. C: Caspase 9 activity detected using a colorimetric kit. D: Caspase 3/7 activity in PC-3 cells detected using caspase-Glo 3/7 assay kitcolorimetric kit. *P < 0.05 vs vcontrol group.
3. 讨论
近年来研究表明,海洋药物在肿瘤研究方面极受重视,其来源广泛,作为抗癌新药开发的潜力很大[14]。Fx对癌症的抵抗作用已在几种癌症模型中得到证实[15]。在人胃癌细胞系SGC7901、人膀胱癌细胞系T24、人非小细胞肺癌细胞系(A549和H1299)、人脑胶质瘤癌细胞系(U87和U251)和人宫颈癌SiHa细胞中,Fx能够通过增加Bax表达的同时降低Bcl-2表达来诱导细胞凋亡[16]。在拥有抗癌活性的同时,Fx还是安全的。已有研究表明,在ICR小鼠分别进行了一次性口服Fx 1000或2000 mg/kg和持续30 d,每天口服500或1000 mg/kg的毒性实验,未发现Fx致畸致死现象,且ICR小鼠肝、脾性腺组织的病理切片未见有异常[9]。因此,食用Fx是安全的,至少在实验动物模型中。在本研究中,CCK-8实验和死/活细胞染色结果显示,Fx处理后的PC-3细胞活力明显下降。流式细胞仪和TUNEL检测结果表明Fx可诱导PC-3细胞凋亡。结果表明Fx能够诱导PC-3细胞凋亡,随后继续探讨Fx诱导PC-3细胞凋亡的具体机制。
线粒体是参与细胞凋亡的主要细胞器之一,线粒体功能和能量代谢是肿瘤发生和进展的关键,它被认为是前列腺癌的新兴生物学指标,调节线粒体的功能可能是前列腺癌治疗的有效策略[17-18]。有研究表明,橘皮苷治疗能通过引发线粒体功能障碍诱导BFTC-905膀胱癌细胞凋亡,发挥抗肿瘤作用[19]。本研究实验结果显示,PC-3细胞经Fx处理后,线粒体膜电位水平和ATP含量降低,同时线粒体发生碎片化,与线粒体功能障碍发生在凋亡早期的观点一致[15]。结果表明Fx可通过引发线粒体功能障碍诱导PC-3细胞凋亡。
与除癌症以外的其他病理形式的氧化应激的有害作用相反,活性氧可以加速抗肿瘤发生信号传导,并通过氧化应激导致肿瘤细胞凋亡[20-22]。肿瘤细胞中的抗氧化剂可以清除过量的活性氧,从而引起对活性氧诱导的细胞凋亡的抗性[23]。诱导肿瘤细胞内活性氧过度产生也是很多化疗药物抗肿瘤的机制之一[24]。有研究报道阿苯达唑通过诱导活性氧生成选择性地抑制PC-3、DU145、LNCaP和AT2前列腺癌细胞株的增殖[25]。因此,通过氧化应激诱导肿瘤细胞凋亡是癌症治疗的重要策略。本实验研究结果结果显示,经Fx处理的PC-3细胞中,H2O2、MDA和超氧化物的含量升高,细胞总抗氧化能力减弱,线粒体超氧化物表达增加。结果表明Fx可通过引发PC-3细胞氧化应激诱导PC-3细胞凋亡。
Bcl-2蛋白家族在线粒体介导的凋亡信号通路中起关键作用,包括Bax为代表的促凋亡因子和以Bcl-2为代表的抗凋亡因子。Bax在线粒体诱导的细胞死亡中起核心作用。Bcl-2是一种重要的抗凋亡蛋白[26]。有研究表明,Bcl-2和Bax的比值可作为“凋亡开关”[27]。其比值的降低可增大线粒体外膜的各种通道通透性,导致细胞色素c蛋白释放到细胞质中,诱导caspase 9的激活[28-30]。Caspase 9可以激活caspase 3/7,caspase 3/7是线粒体介导的凋亡信号通路中的凋亡启动子,也是细胞凋亡的执行者[31]。有研究表明,白杨素诱导癌细胞凋亡通过Bcl-2家族的调节和激活caspase-3和9抑制肺癌细胞的生长[32]。本实验研究结果显示,Fx可提高PC-3细胞中Bax的表达水平并降低Bcl-2的表达水平,降低了Bcl-2和Bax比值,促进细胞色素c从线粒体向细胞质的释放,诱导caspase 9和caspase 3/7的激活。结果表明Fx可通过线粒体介导的凋亡信号通路诱导PC-3细胞凋亡。
综上所述,本研究结果显示Fx降低了PC-3细胞活力并诱导PC-3细胞凋亡。Fx诱导PC-3细胞线粒体功能障碍,包括线粒体膜电位降低、线粒体碎片化和ATP生成降低。Fx通过引发PC-3细胞线粒体功能障碍导致氧化应激,包括H2O2、MDA、超氧化物含量的增加、总抗氧化能力的降低和线粒体超氧化物表达的增加。Fx通过线粒体介导的凋亡途径诱导PC-3细胞凋亡,包括Bax的表达增加,Bcl-2的表达降低,细胞色素c从线粒体到细胞质释放的增加,caspase 9和caspase 3/7的激活。上述结果表明Fx可通过引发线粒体功能障碍导致氧化应激以及调节线粒体介导的凋亡信号通路诱导前列腺癌PC-3细胞凋亡,展现出体外抗前列腺癌作用。本研究为Fx抗前列腺癌作用机制提供新的思路,即通过引发线粒体功能障碍导致氧化应激从而诱导细胞凋亡。然而本研究存在一定局限性,例如未阐明Fx与线粒体相互作用的具体机制。在下一步的研究中,我们将使用动物模型开展Fx抗前列腺癌作用及机制的进一步探讨,为海洋来源天然活性物质Fx用于治疗前列腺癌临床用药提供更完善的实验数据支撑。
Biography
李国平,主治医师,硕士研究生,E-mail: lzuligp@163.com
Funding Statement
海南省自然科学基金(819MS105)
Contributor Information
李 国平 (Guoping LI), Email: lzuligp@163.com.
赵 映淑 (Yingshu ZHAO), Email: hnzhaoyshu@126.com.
References
- 1.孙 颖浩, 黄 健. 中国泌尿外科和男科疾病诊断治疗指南(2019版) 北京: 科学出版社; 2020. [孙颖浩, 黄健. 中国泌尿外科和男科疾病诊断治疗指南(2019版) [M]. 北京: 科学出版社, 2020.] [Google Scholar]
- 2.李 星, 曾 晓勇. 中国前列腺癌流行病学研究进展. 肿瘤防治研究. 2021;48(1):28. [李星, 曾晓勇. 中国前列腺癌流行病学研究进展[J]. 肿瘤防治研究, 2021, 48(1): 28.] [Google Scholar]
- 3.周 利群. 中国前列腺癌药物去势治疗专家共识解读. 中华泌尿外科杂志. 2017;38(z1):4–5. doi: 10.3760/j.issn.1000-6702.2017.z1.002. [周利群. 中国前列腺癌药物去势治疗专家共识解读[J]. 中华泌尿外科杂志, 2017, 38(z1): 4-5.] [DOI] [Google Scholar]
- 4.Yang GY, Jin L, Zheng DX, et al. Fucoxanthin alleviates oxidative stress through Akt/Sirt1/FoxO3α signaling to inhibit HG-induced renal fibrosis in GMCs. Mar Drugs. 2019;17(12):E702. doi: 10.3390/md17120702. [Yang GY, Jin L, Zheng DX, et al. Fucoxanthin alleviates oxidative stress through Akt/Sirt1/FoxO3α signaling to inhibit HG-induced renal fibrosis in GMCs[J]. Mar Drugs, 2019, 17(12): E702.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Karpiński TM, Adamczak A. Fucoxanthin-an antibacterial carotenoid. Antioxidants (Basel) 2019;8(8):E239. doi: 10.3390/antiox8080239. [Karpiński TM, Adamczak A. Fucoxanthin-an antibacterial carotenoid [J]. Antioxidants (Basel), 2019, 8(8): E239.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Koo SY, Hwang JH, Yang SH, et al. Anti-obesity effect of standardized extract of microalga Phaeodactylum tricornutum containing fucoxanthin. Mar Drugs. 2019;17(5):E311. doi: 10.3390/md17050311. [Koo SY, Hwang JH, Yang SH, et al. Anti-obesity effect of standardized extract of microalga Phaeodactylum tricornutum containing fucoxanthin[J]. Mar Drugs, 2019, 17(5): E311.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Muradian Kh, Vaiserman A, Min KJ, et al. Fucoxanthin and lipid metabolism: a minireview. Nutr Metab Cardiovasc Dis. 2015;25(10):891–7. doi: 10.1016/j.numecd.2015.05.010. [Muradian Kh, Vaiserman A, Min KJ, et al. Fucoxanthin and lipid metabolism: a minireview[J]. Nutr Metab Cardiovasc Dis, 2015, 25 (10): 891-7.] [DOI] [PubMed] [Google Scholar]
- 8.Gammone MA, D'Orazio N. Anti-obesity activity of the marine carotenoid fucoxanthin. Mar Drugs. 2015;13(4):2196–214. doi: 10.3390/md13042196. [Gammone MA, D'Orazio N. Anti-obesity activity of the marine carotenoid fucoxanthin[J]. Mar Drugs, 2015, 13(4): 2196-214.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chen SJ, Lee CJ, Lin TB, et al. Protective effects of fucoxanthin on ultraviolet B-induced corneal denervation and inflammatory pain in a rat model. Mar Drugs. 2019;17(3):E152. doi: 10.3390/md17030152. [Chen SJ, Lee CJ, Lin TB, et al. Protective effects of fucoxanthin on ultraviolet B-induced corneal denervation and inflammatory pain in a rat model[J]. Mar Drugs, 2019, 17(3): E152.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kotake-Nara E, Kushiro M, Zhang H, et al. Carotenoids affect proliferation of human prostate cancer cells. J Nutr. 2001;131(12):3303–6. doi: 10.1093/jn/131.12.3303. [Kotake-Nara E, Kushiro M, Zhang H, et al. Carotenoids affect proliferation of human prostate cancer cells[J]. J Nutr, 2001, 131 (12): 3303-6.] [DOI] [PubMed] [Google Scholar]
- 11.Kotake-Nara E, Asai A, Nagao A. Neoxanthin and fucoxanthin induce apoptosis in PC-3 human prostate cancer cells. Cancer Lett. 2005;220(1):75–84. doi: 10.1016/j.canlet.2004.07.048. [Kotake-Nara E, Asai A, Nagao A. Neoxanthin and fucoxanthin induce apoptosis in PC-3 human prostate cancer cells[J]. Cancer Lett, 2005, 220(1): 75-84.] [DOI] [PubMed] [Google Scholar]
- 12.Li K, Zheng QS, Chen XY, et al. Isobavachalcone induces ROS-mediated apoptosis via targeting thioredoxin reductase 1 in human prostate cancer PC-3 cells. http://www.ncbi.nlm.nih.gov/pubmed/30410640. Oxid Med Cell Longev. 2018;2018:1915828. doi: 10.1155/2018/1915828. [Li K, Zheng QS, Chen XY, et al. Isobavachalcone induces ROS-mediated apoptosis via targeting thioredoxin reductase 1 in human prostate cancer PC-3 cells[J]. Oxid Med Cell Longev, 2018, 2018: 1915828.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Yeo C, Han DS, Lee HJ, et al. Epigallocatechin-3-gallate suppresses vasculogenic mimicry through inhibiting the twist/VE-cadherin/ AKT pathway in human prostate cancer PC-3 cells. Int J Mol Sci. 2020;21(2):E439. doi: 10.3390/ijms21020439. [Yeo C, Han DS, Lee HJ, et al. Epigallocatechin-3-gallate suppresses vasculogenic mimicry through inhibiting the twist/VE-cadherin/ AKT pathway in human prostate cancer PC-3 cells[J]. Int J Mol Sci, 2020, 21(2): E439.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Khalifa SAM, Elias N, Farag MA, et al. Marine natural products: a source of novel anticancer drugs. Mar Drugs. 2019;17(9):E491. doi: 10.3390/md17090491. [Khalifa SAM, Elias N, Farag MA, et al. Marine natural products: a source of novel anticancer drugs[J]. Mar Drugs, 2019, 17(9): E491.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Satomi Y. Antitumor and cancer-preventative function of fuco-xanthin: a marine carotenoid. Anticancer Res. 2017;37(4):1557–62. doi: 10.21873/anticanres.11484. [Satomi Y. Antitumor and cancer-preventative function of fuco-xanthin: a marine carotenoid[J]. Anticancer Res, 2017, 37(4): 1557-62.] [DOI] [PubMed] [Google Scholar]
- 16.Bae M, Kim MB, Park YK, et al. Health benefits of fucoxanthin in the prevention of chronic diseases. http://www.sciencedirect.com/science/article/pii/S138819812030010X. Biochim Biophys Acta Mol Cell Biol Lipids. 2020;1865(11):158618. doi: 10.1016/j.bbalip.2020.158618. [Bae M, Kim MB, Park YK, et al. Health benefits of fucoxanthin in the prevention of chronic diseases[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2020, 1865(11): 158618.] [DOI] [PubMed] [Google Scholar]
- 17.Vayalil PK. Mitochondrial oncobioenergetics of prostate tumo-rigenesis. http://www.ingentaconnect.com/content/sp/ol/2019/00000018/00000005/art00001. Oncol Lett. 2019;18(5):4367–76. doi: 10.3892/ol.2019.10785. [Vayalil PK. Mitochondrial oncobioenergetics of prostate tumo-rigenesis[J]. Oncol Lett, 2019, 18(5): 4367-76.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Zong WX, Joshua DR, Eileen W. Mitochondria and cancer. Mol Cell. 2016;61(5):667–76. doi: 10.1016/j.molcel.2016.02.011. [Zong WX, Joshua DR, Eileen W. Mitochondria and cancer[J]. Mol Cell, 2016, 61(5): 667-76.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Lin JJ, Huang CC, Su YL, et al. Proteomics analysis of tangeretin-induced apoptosis through mitochondrial dysfunction in bladder cancer cells. Int J Mol Sci. 2019;20(5):E1017. doi: 10.3390/ijms20051017. [Lin JJ, Huang CC, Su YL, et al. Proteomics analysis of tangeretin-induced apoptosis through mitochondrial dysfunction in bladder cancer cells[J]. Int J Mol Sci, 2019, 20(5): E1017.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Liang WQ, Cui JX, Zhang KC, et al. Shikonin induces ROS-based mitochondria-mediated apoptosis in colon cancer. Oncotarget. 2017;8(65):109094–106. doi: 10.18632/oncotarget.22618. [Liang WQ, Cui JX, Zhang KC, et al. Shikonin induces ROS-based mitochondria-mediated apoptosis in colon cancer[J]. Oncotarget, 2017, 8(65): 109094-106.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Garza-Lombó C, Pappa A, Panayiotidis MI, et al. Redox homeo-stasis, oxidative stress and mitophagy. Mitochondrion. 2020;51:105–17. doi: 10.1016/j.mito.2020.01.002. [Garza-Lombó C, Pappa A, Panayiotidis MI, et al. Redox homeo-stasis, oxidative stress and mitophagy[J]. Mitochondrion, 2020, 51: 105-17.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Nogueira V, Hay N. Molecular pathways: reactive oxygen species homeostasis in cancer cells and implications for cancer therapy. Clin Cancer Res. 2013;19(16):4309–14. doi: 10.1158/1078-0432.CCR-12-1424. [Nogueira V, Hay N. Molecular pathways: reactive oxygen species homeostasis in cancer cells and implications for cancer therapy[J]. Clin Cancer Res, 2013, 19(16): 4309-14.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Hanikoglu A, Ozben H, Hanikoglu F, et al. Hybrid compounds & oxidative stress induced apoptosis in cancer therapy. Curr Med Chem. 2020;27(13):2118–32. doi: 10.2174/0929867325666180719145819. [Hanikoglu A, Ozben H, Hanikoglu F, et al. Hybrid compounds & oxidative stress induced apoptosis in cancer therapy[J]. Curr Med Chem, 2020, 27(13): 2118-32.] [DOI] [PubMed] [Google Scholar]
- 24.Yang H, Villani RM, Wang H, et al. The role of cellular reactive oxygen species in cancer chemotherapy. J Exp Clin Cancer Res. 2018;37(1):266. doi: 10.1186/s13046-018-0909-x. [Yang H, Villani RM, Wang H, et al. The role of cellular reactive oxygen species in cancer chemotherapy[J]. J Exp Clin Cancer Res, 2018, 37(1): 266.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Kim U, Shin C, Kim CY, et al. Albendazole exerts antiproliferative effects on prostate cancer cells by inducing reactive oxygen species generation. Oncol Lett. 2021;21(5):395. doi: 10.3892/ol.2021.12656. [Kim U, Shin C, Kim CY, et al. Albendazole exerts antiproliferative effects on prostate cancer cells by inducing reactive oxygen species generation[J]. Oncol Lett, 2021, 21(5): 395.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Moazami-Goudarzi M, Farshdousti-Hagh M, Hoseinpour-Feizi A, et al. The acute lymphoblastic leukemia prognostic scoring whether it is possible by BCL-2, BAX gene promoter genotyping. http://europepmc.org/articles/PMC4913713/ Caspian J Intern Med. 2016;7(2):105–13. [Moazami-Goudarzi M, Farshdousti-Hagh M, Hoseinpour-Feizi A, et al. The acute lymphoblastic leukemia prognostic scoring whether it is possible by BCL-2, BAX gene promoter genotyping[J]. Caspian J Intern Med, 2016, 7(2): 105-13.] [PMC free article] [PubMed] [Google Scholar]
- 27.Saini RK, Keum YS, Daglia M, et al. Dietary carotenoids in cancer chemoprevention and chemotherapy: a review of emerging evidence. Pharmacol Res. 2020;157:104830. doi: 10.1016/j.phrs.2020.104830. [Saini RK, Keum YS, Daglia M, et al. Dietary carotenoids in cancer chemoprevention and chemotherapy: a review of emerging evidence [J]. Pharmacol Res, 2020, 157: 104830.] [DOI] [PubMed] [Google Scholar]
- 28.姚 越, 张 冲, 韩 兵, et al. 紫草素通过抑制人睾丸癌1-10和精原细胞瘤TCAM-2糖酵解诱导细胞死亡. http://www.j-smu.com:81/CN/Y2020/V40/I09/1288. 南方医科大学学报. 2020;40(9):1288–94. doi: 10.12122/j.issn.1673-4254.2020.09.10. [姚越, 张冲, 韩兵, 等. 紫草素通过抑制人睾丸癌1-10和精原细胞瘤TCAM-2糖酵解诱导细胞死亡[J]. 南方医科大学学报, 2020, 40(9): 1288-94.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Yu GW, Luo HW, Zhang N, et al. Loss of p53 sensitizes cells to palmitic acid-induced apoptosis by reactive oxygen species accumulation. Int J Mol Sci. 2019;20(24):E6268. doi: 10.3390/ijms20246268. [Yu GW, Luo HW, Zhang N, et al. Loss of p53 sensitizes cells to palmitic acid-induced apoptosis by reactive oxygen species accumulation[J]. Int J Mol Sci, 2019, 20(24): E6268.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.黄 国敏, 王 玉佩, 孙 超, et al. 线粒体超微结构及其调控机制的研究进展. https://www.cnki.com.cn/Article/CJFDTOTAL-SHSW201912001.htm. 生物化学与生物物理进展. 2019;46(12):1141–9. [黄国敏, 王玉佩, 孙超, 等. 线粒体超微结构及其调控机制的研究进展[J]. 生物化学与生物物理进展, 2019, 46(12): 1141-9.] [Google Scholar]
- 31.Ola MS, Nawaz M, Ahsan H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis. http://europepmc.org/abstract/MED/21210296. Mol Cell Biochem. 2011;351(1/2):41–58. doi: 10.1007/s11010-010-0709-x. [Ola MS, Nawaz M, Ahsan H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J]. Mol Cell Biochem, 2011, 351(1/2): 41-58.] [DOI] [PubMed] [Google Scholar]
- 32.Samarghandian S, Nezhad MA, Mohammadi G. Role of caspases, Bax and Bcl-2 in chrysin-induced apoptosis in the A549 human lung adenocarcinoma epithelial cells. Anticancer Agents Med Chem. 2014;14(6):901–9. doi: 10.2174/1871520614666140209144042. [Samarghandian S, Nezhad MA, Mohammadi G. Role of caspases, Bax and Bcl-2 in chrysin-induced apoptosis in the A549 human lung adenocarcinoma epithelial cells[J]. Anticancer Agents Med Chem, 2014, 14(6): 901-9.] [DOI] [PubMed] [Google Scholar]


