Abréviations
- COVID-19
maladie à coronavirus 2019
- IgE
immunoglobulines E
- PA
paquet-année
- SARS CoV-2
severe actute respiratory syndrome coronavirus-2
Les vaccins à base de nanoparticules lipidiques contenant de l’ARNm (LNP) sont de nouvelles molécules utilisées par Pfizer-BioNTech et Moderna, pour lutter contre la maladie à coronavirus en 2019 (COVID-19). Ces vaccins ciblent la protéine « spike » du virus (« protéine spicule » ou « protéine S »). Cette protéine est située à la surface de l’enveloppe du severe acute respiratory syndrome-coronavirus-2 (SARS-CoV-2), et lui permet de se fixer à un récepteur cellulaire, l’enzyme de conversion de l’angiotensine 2 puis de pénétrer dans les cellules de l’organisme [1], [2].
Les essais cliniques et les vaccinations en cours montrent des niveaux de protection élevés et des effets indésirables de gravité variable. Cependant, certains types d’effets indésirables rapportés, notamment cutanés, restent encore mal définis. Dans l’essai clinique de phase III du vaccin Pfizer-BioNTechCOVID-19 [3] et dans le premier rapport de morbi-mortalité post-commercialisation du vaccin [4], les principales manifestations cutanées rapportées étaient de type anaphylactique (urticaire et l’exanthème érythémateux diffus) et des réactions allergiques non anaphylactiques (réaction au site d’injection, prurit et éruptions cutanées sans description sémiologique) [4], [5], [6].
Baden et al ont rapporté des réactions immédiates au site d’injection après la première dose de Pfizer-BioNTech. Récemment Jedlowski et al ont rapporté un exanthème morbilliforme après chaque dose d’injection du vaccin Pfizer-BioNTech [7]. Nous rapportons ici le premier cas à notre connaissance d’une réaction eczématiforme diffuse survenue 8 jours après la première injection du vaccin Pfizer-BioNTech, et récidivant 4 jours après l’administration de la seconde dose.
Observation
Il s’agit d’un homme de 80 ans, en bon état général, ayant comme antécédent une hypertension artérielle traitée par amlodipine depuis plusieurs années, un tabagisme à raison de 60 paquet-année (PA). Le patient n’avait aucun antécédent d’eczéma, d’atopie, ni d’allergie connue. Dans les 2 h suivant l’injection le patient a présenté une fébricule à 38 °C et des céphalées qui ont régressé après 72 h. Huit jours plus tard, le patient a présenté une éruption prurigineuse composée de macules et de plaques érythémato-squameuses mal limitées au niveau du tronc et des 4 membres (Fig. 1 ). La surface cutanée atteinte était estimée à 20 %. Il n’y avait pas d’atteinte muqueuse ni phanérienne. Le patient était apyrétique, et ne présentait aucun signe systémique. La prise en charge initiale avec antihistaminiques et une crème anti-mycosique n’a conduit à aucune amélioration. La numération formule sanguine n’a pas mis en évidence d’hyperéosinophilie, le bilan hépatique et rénal était normal, les immunoglobulines E (IgE) étaient augmentées à 287 UI/mL pour une normale inférieure à 100 UI/mL. Une biopsie au punch retrouvait une minime spongiose, une hyper-orthokératose focalement parakératosique. Le derme sous-jacent renfermait un infiltrat lymphocytaire périvasculaire et de rares polynucléaires éosinophiles. L’histologie était compatible avec un eczéma. Le patient a été traité par dermocorticoïdes pendant 15 jours (avec une évolution favorable).
Figure 1.
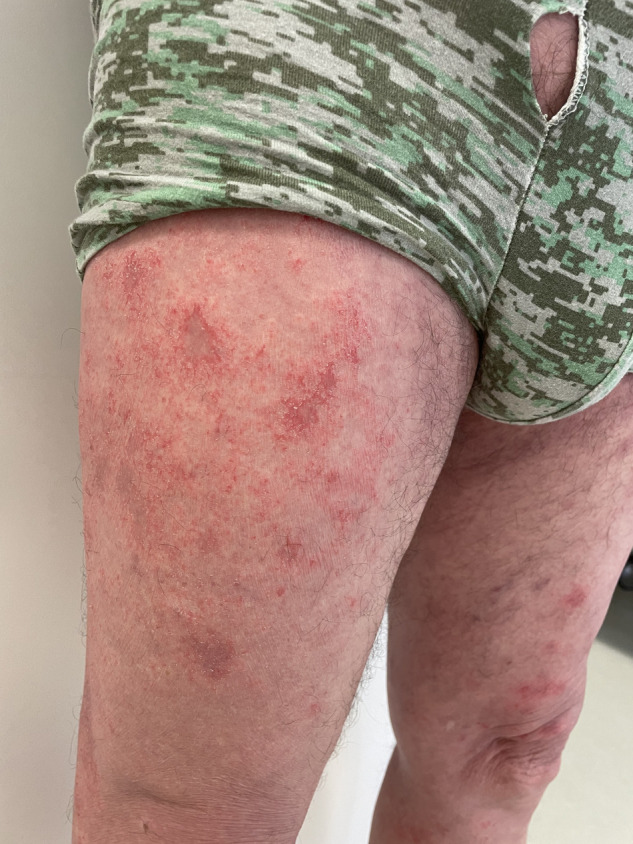
Éruption eczématiforme des membres inférieurs.
Le patient a présenté une récidive des lésions 4 jours après l’administration de la seconde dose de vaccin qui ont régressé après 2 semaines de traitement par dermocorticoïdes. Une déclaration au centre régional de pharmacovigilance et de pharmaco épidémiologie Centre Val-de Loire a été faite le 22 février 2021 et a été enregistrée sous le numéro 210767.
Les autres diagnostics évoqués chez ce patient étaient une dermatite atopique ou un eczéma de contact déclenchés ou aggravés par le vaccin devant le taux élevé des IgE mais le patient n’avait aucun antécédant personnel ou familial d’atopie, et il n’y a pas eu de modifications dans les habitudes d’hygiène ni de topiques appliqués sur la peau. Une toxidermie à un traitement systémique était éliminée devant l’absence de d’introduction de nouveau médicament. Le caractère aigu de l’éruption permet d’éliminer une pemphigoïde pré-bulleuse et une dermatite eczématiforme chronique du sujet âgé.
La relation de causalité entre l’éruption cutanée présentée par ce patient et le vaccin Pfizer-BioNtech a été évaluée « vraisemblable » (C3S1I3) en appliquant la méthode française d’imputabilité [8].
À notre connaissance une telle réaction n'a pas été rapportée auparavant. Compte tenu de l’intensification de la vaccination de masse, ces réactions sont susceptibles de susciter des inquiétudes chez les patients et le personnel soignant d’où l’intérêt de mieux préciser le cadre nosologique de ces effets indésirables.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Footnotes
Ce cas a été déclaré au Centre régional de pharmacovigilance et de pharmaco épidémiologie Centre-Val de Loire le 22 février 2021 et enregistré sous le numéro 210767.
Références
- 1.Jiang S., Hillyer C., Du L. Neutralizing antibodies against SARS-CoV-2 and other human coronaviruses. Trends Immunol. 2020;41:355–359. doi: 10.1016/j.it.2020.03.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Padron-Regalado E. Vaccines for SARS-CoV-2: lessons from other coronavirus strains. Infect Dis Ther. 2020;9:1–20. doi: 10.1007/s40121-020-00300-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Polack F.P., Thomas S.J., Kitchin N., Absalon J., Gurtman A., Lockhart S., et al. Safety and efficacy of the BNT162b2 mRNA Covid-Covid-19 Vaccine. N Engl J Med. 2020;383(27):2603–2615. doi: 10.1056/NEJMoa2034577. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.CDC COVID-19 Response Team; Food and Drug Administration Allergic reactions including anaphylaxis after receipt of the first dose of Pfizer-BioNTech COVID-19 vaccine - United States, December 14-23, 2020. MMWR Morb Mortal Wkly Rep. 2021;70(2):46–51. doi: 10.15585/mmwr.mm7002e1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Blumenthal K.G., Freeman E.E., Saff R.R., Robinson L.B., Wolfson A.R., Foreman R.K., et al. Delayed large local reactions to mRNA-1273 vaccine against SARS-CoV-2. N Engl J Med. 2021;384(13):1273–1277. doi: 10.1056/NEJMc2102131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Baden L.R., El Sahly H.M., Essink B., Kotloff K., Frey S., Novack R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med. 2021;384:403–416. doi: 10.1056/NEJMoa2035389. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Jedlowski P.M., Jedlowski M.F. Morbiliform rash after administration of Pfizer-BioNtech COVID-19 mRNA vaccine. Dermatol Online J. 2021;27(1) [13030/qt4xs486zg] [PubMed] [Google Scholar]
- 8.Moore N., Berdaï D., Blin P., Droz C. Pharmacovigilance - The next chapter. Therapie. 2019;74(6):557–567. doi: 10.1016/j.therap.2019.09.004. [DOI] [PubMed] [Google Scholar]


