Abstract
Objetivo
Comparar las características clínicas, los tratamientos y la evolución de los pacientes críticos con neumonía por COVID-19 atendidos en unidades de cuidados intensivos (UCI) tras un año de pandemia.
Metodología
Estudio multicéntrico, prospectivo, en el que se incluyó pacientes críticos COVID-19 en 9 UCI del noroeste de España. Se compararon las características clínicas, los tratamientos y la evolución de pacientes ingresados en UCI durante los meses de marzo-abril de 2020 (periodo 1) con pacientes ingresados en enero-febrero de 2021 (periodo 2).
Resultados
Se incluyeron 337 pacientes (98 en el periodo 1 y 239 en el periodo 2). En el periodo 2 menos pacientes requirieron ventilación mecánica invasiva (VMI) (65% vs 84%, p < 0,001), utilizándose con mayor frecuencia cánulas nasales de alto flujo (CNAF) (70% vs 7%, p < 0,001), ventilación mecánica no invasiva (VMNI) (40% vs 14%, p < 0,001), corticoides (100% vs 96%, p = 0,007) y posición de decúbito prono tanto en pacientes despiertos (42% vs 28%, p = 0,012) como en pacientes intubados (67% vs 54%, p = 0,034). Los días de VMI, de estancia en UCI y hospitalaria fueron inferiores en el periodo 2. La mortalidad fue similar en los dos periodos estudiados (16% vs 17%).
Conclusiones
Tras un año de pandemia, observamos que en los pacientes ingresados en UCI se ha utilizado con mayor frecuencia CNAF, VMNI, uso del decúbito prono y corticoides, disminuyendo los pacientes en VMI, así como los tiempos de estancia en UCI y de estancia hospitalaria. La mortalidad ha sido similar en los dos periodos a estudio.
Palabras clave: COVID-19, SARS-CoV-2, Pacientes críticos, Síndrome de distrés respiratorio agudo (SDRA), Decúbito prono, Corticoides
Abstract
Objective
To compare the clinical characteristics, treatments, and evolution of critical patients with COVID-19 pneumonia treated in intensive care units (ICU) after one year of pandemic.
Methodology
Multicenter, prospective study, which included critical COVID-19 patients in 9 ICUs in northwestern Spain. The clinical characteristics, treatments, and evolution of patients admitted to the ICU during the months of March-April 2020 (period 1) were compared with patients admitted in January-February 2021 (period 2).
Results
337 patients were included (98 in period 1 and 239 in period 2). In period 2, fewer patients required invasive mechanical ventilation (IMV) (65% vs. 84%, P < .001), using high-flow nasal cannulas (CNAF) more frequently (70% vs. 7%, P < .001), ventilation non-invasive mechanical (NIMV) (40% vs. 14%, P < .001), corticosteroids (100% vs. 96%, P = .007) and prone position in both awake (42% vs. 28%, P = .012), and intubated patients (67% vs. 54%, P = .034). The days of IMV, ICU stay and hospital stay were lower in period 2. Mortality was similar in the two periods studied (16% vs. 17%).
Conclusions
After one year of pandemic, we observed that in patients admitted to the ICU, CNAF, NIMV, use of the prone position, and corticosteroids have been used more frequently, reducing the number of patients in IMV, and the length of stay in the ICU and hospital stay. Mortality was similar in the two study periods.
Keywords: COVID-19, SARS-CoV-2, Critical patients, Acute respiratory distress syndrome (ARDS), Prone position, Corticosteroids
Introducción
Desde la aparición de la infección por el coronavirus SARS-CoV-2 en Wuhan, China, en diciembre de 2019, esta se ha extendido rápidamente a nivel mundial1, 2. El 31 de enero de 2020 España confirmó su primer paciente con enfermedad por coronavirus 2019 (COVID-19), y Galicia, región ubicada al noroeste del país, un mes después. Desde entonces se han documentado tres olas. La primera entre los meses de febrero a mayo de 2020, la segunda entre septiembre y noviembre de 2020, y la tercera entre enero y marzo de 2021.
En los últimos meses se han publicado diversos artículos relacionados con las características clínicas de los pacientes críticos COVID-19, los tratamientos utilizados, las complicaciones asociadas a la enfermedad, la evolución de estos pacientes en las unidades de cuidados intensivos (UCI) y sus factores pronósticos3, 4, 5, 6, 7, 8. La mayoría de estas publicaciones hacen referencia al primer semestre de la pandemia, en la que apenas se contaba con evidencia científica por lo novedoso de la infección. Un año después del primer caso documentado en España, diferentes ensayos clínicos y estudios observacionales han modificado los tratamientos que se emplean en estos pacientes, sobre todo en lo referente al uso de corticoides9, 10, antivirales11, 12, anticoagulantes13, antibióticos14 o inmunomoduladores15, así como los cuidados respiratorios: cánulas nasales de alto flujo (CNAF), ventilación mecánica no invasiva (VMNI), o la utilización de posición de decúbito prono, tanto en pacientes en ventilación espontánea como en ventilación mecánica invasiva (VMI)16, 17, 18, 19.
Existen en la actualidad pocos estudios donde se comparen las características clínicas, las diferencias en los tratamientos utilizados y en los resultados obtenidos (complicaciones, mortalidad) en pacientes críticos COVID-19 a lo largo del año de pandemia20, 21.
Por tanto, realizamos un estudio observacional, prospectivo, que incluyó a pacientes con infección COVID-19, que presentaban insuficiencia respiratoria grave, y que requirieron ingreso en UCI. Nuestro objetivo fue comparar las características clínicas, los tratamientos utilizados, las complicaciones y la evolución de los pacientes atendidos en UCI del noroeste de España en dos periodos: un primer periodo durante los meses de marzo y abril de 2020, coincidiendo con la primera ola de la pandemia, y un segundo periodo durante los meses de enero y febrero de 2021, coincidiendo con la tercera ola.
Métodos
En los meses de marzo y abril de 2020, y en enero y febrero de 2021, evaluamos prospectivamente los pacientes con insuficiencia respiratoria aguda por COVID-19, confirmada por un resultado positivo en una reacción en cadena de la polimerasa con transcriptasa inversa (RTPCR), ingresados en UCI de nueve hospitales localizados en el noroeste de España (Galicia): Complejo Hospitalario Universitario de Santiago (CHUS), de A Coruña (CHUAC), de Pontevedra (CHUP), de Ferrol (CHUF), de Ourense (CHUO), de Vigo (CHUVI), Hospital Universitario Lucus Augusti de Lugo (HULA), Hospital POVISA de Vigo y Hospital da Mariña en Lugo. Los pacientes admitidos en la UCI durante los meses de marzo-abril de 2020 se consideraron del periodo inicial de la pandemia (periodo 1), y los pacientes admitidos durante los meses de enero-febrero de 2021, del periodo final (periodo 2). El comité de ética de Galicia (código 2020-188) aprobó este estudio y, debido a sus características y al momento de pandemia, se eliminó la necesidad de consentimiento informado a los pacientes.
Se recogieron los siguientes datos de todos los pacientes al ingreso en UCI: edad, sexo, peso, altura, enfermedades concomitantes y tratamientos domiciliarios; además de la puntuación de la escala de evaluación de la fisiología aguda y salud crónica II (APACHE-II), la presión arterial parcial de oxígeno (PaO2), la fracción de oxígeno inspirado (FiO2), la relación PaO2/FiO2 y pruebas de laboratorio iniciales (hemograma, bioquímica sérica, ferritina sérica, procalcitonina, lactato deshidrogenasa, dímero D y proteína C reactiva). La evaluación adicional consistió en la presencia de infecciones coexistentes y el tiempo desde la aparición de los síntomas iniciales hasta el ingreso en el hospital y en la UCI.
Durante la estancia en UCI evaluamos las medicaciones utilizadas (vasopresores, antibióticos, antivirales, corticoides, anticoagulantes, bloqueantes neuromusculares, inmunosupresores, antiagregantes), el modo de apoyo respiratorio (VMI, VMNI, CNAF), el uso de terapia de reemplazo renal, el uso de decúbito prono en pacientes despiertos o intubados, la necesidad de traqueostomía para ventilación mecánica prolongada, las complicaciones (infección adquirida en UCI, complicaciones tromboembólicas, necesidad de reintubación, neumotórax, reingreso en UCI) y el resultado en UCI, que incluyó el número de pacientes que fallecieron, los que fueron dados de alta y los que aún permanecían en la UCI al finalizar el seguimiento el 21 de marzo de 2021.
Los autores diseñaron el ensayo, recopilaron los datos y realizaron el análisis. Todos los autores revisaron el manuscrito, dan fe de su exactitud y la integridad de los datos, y aprobaron la decisión de enviar el manuscrito para su publicación.
Análisis estadístico
Se realizó un análisis descriptivo de las características demográficas y clínicas de los pacientes tratados en los dos periodos a estudio. Las medidas descriptivas para las variables categóricas incluyeron valores absolutos y porcentajes; las variables cuantitativas se describen como medidas de tendencia central (media o mediana) y medidas de dispersión (desviación típica o amplitud intercuartílica).
Para comparar las distribuciones de frecuencia entre los dos periodos se utilizó el estadístico chi-cuadrado o la prueba exacta de Fisher. Se utilizó la prueba t de Student o la prueba de Mann-Whitney, según procediera, para comparar las variables continuas. Todos los test se realizaron con un planteamiento bilateral. Se consideraron significativos valores de p < 0,05.
Para explorar factores de riesgo asociados a mortalidad en los pacientes ingresados durante los dos periodos a estudio en la UCI se realizó un análisis de regresión logística univariable y multivariable, considerando variables asociadas a mortalidad descritas en previos estudios: edad, escala APACHE-II de gravedad, obesidad, PaO2/FiO2 al ingreso en UCI y necesidad de ventilación mecánica.
Resultados
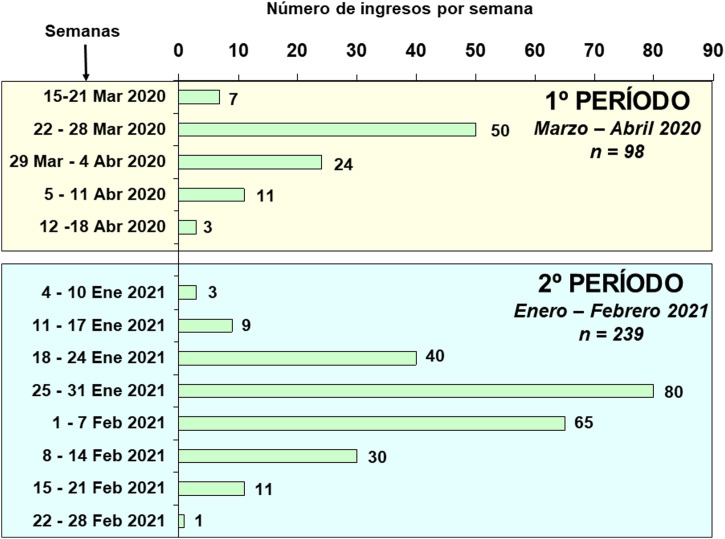
Un total de 337 pacientes con insuficiencia respiratoria aguda por COVID-19 fueron ingresados en las UCI de nueve hospitales del noroeste de España durante los dos periodos de estudio (fig. 1 ): 98 pacientes durante el periodo 1 (marzo-abril de 2020) y 239 pacientes durante el periodo 2 (enero-febrero de 2021). El porcentaje de pacientes hospitalizados que requirieron ingreso en una unidad de cuidados críticos varió entre el 10 y el 15% en los centros incluidos en el estudio. La tabla 1 muestra las características demográficas, las enfermedades coexistentes, los tratamientos médicos crónicos y los datos de laboratorio al ingreso en UCI de los pacientes ingresados en los dos periodos. La edad de los pacientes ingresados en el periodo 2 fue menor que la de los del periodo 1 (63,88 [11,53] vs 66,94 [9,78] años, p = 0,037). La hipertensión, la hiperlipidemia y la obesidad fueron las enfermedades coexistentes más frecuentes durante los dos periodos. En el periodo 2 la obesidad (IMC > 30) fue más frecuente que en el periodo 1 (52% vs 40%, p = 0,022).
Figura 1.
Número de pacientes ingresados por semana durante los dos periodos a estudio.
Tabla 1.
Datos demográficos, antecedentes personales y datos analíticos al ingreso en la UCI de los pacientes en los dos periodos a estudio
| Periodo 1 Marzo-abril 2020 n = 98 |
Periodo 2 Enero-febrero 2021 n = 239 |
p | |
|---|---|---|---|
| Edad, años | 66,94 (9,78) | 63,88 (11,53) | 0,037 |
| Sexo masculino, n (%) | 62 (63,3) | 161 (67,4) | 0,470 |
| Peso, kg | 83,50 (15,53) | 86,45 (19,73) | 0,337 |
| Altura, cm | 166,14 (7,88) | 166,84 (8,64) | 0,393 |
| IMC, kg/m2 | 30,34 (5,04) | 30,97 (6,09) | 0,583 |
| Comorbilidades, n (%) | |||
| Hipertensión | 56 (57,1) | 124 (51,9) | 0,379 |
| Hiperlipidemia | 45 (45,9) | 122 (51,0) | 0,393 |
| Diabetes | 22 (22,4) | 57 (23,8) | 0,783 |
| Asma | 7 (7,1) | 21 (8,8) | 0,620 |
| EPOC | 11 (11,2) | 17 (7,1) | 0,214 |
| Enfermedad cardiaca | 28 (28,6) | 35 (14,6) | 0,003 |
| Obesidad (IMC ≥ 30 kg m−2) | 39 (39,8) | 128 (53,6) | 0,022 |
| Cáncer | 7 (7,1) | 32 (13,4) | 0,104 |
| Tratamientos domiciliarios, n (%) | |||
| IECA | 29 (29,9) | 57 (23,9) | 0,258 |
| Anticoagulantes | 5 (5,2) | 18 (7,5) | 0,434 |
| Antiagregantes plaquetarios | 23 (23,7) | 39 (16,3) | 0,113 |
| Estatinas | 38 (38,8) | 108 (45,2) | 0,281 |
| Corticoides | 6 (6,1) | 27 (11,3) | 0,147 |
| Inmunosupresores | 5 (5,2) | 13 (5,5) | 0,910 |
| Broncodilatadores | 9 (9,2) | 28 (11,7) | 0,500 |
| Datos de laboratorio al ingreso, mediana (RI) | |||
| Leucocitos | 7.465 (5.577-11.602) | 8.170 (6.200-10.300) | 0,369 |
| Linfocitos | 600 (400-930) | 570 (400-800) | 0,305 |
| Lactato deshidrogenasa, U/l | 456 (363-633) | 454 (354-638) | 0,902 |
| Dímero D, ng/ml | 1.103 (737-2.121) | 889 (562-1.569) | 0,013 |
| Proteína C reactiva, mg/dl | 14,95 (10,28-34,75) | 10,00 (4,3-15,54) | < 0,001 |
| Procalcitonina, ng/ml | 0,14 (0,09-0,37) | 0,13 (0,07-0,30) | 0,093 |
| Ferritina sérica, μg/l | 927 (598-1.513) | 1.018 (533-1.665) | 0,958 |
| Creatinina, mg/dl | 0,86 (0,71-1,12) | 0,82 (0,66-1,05) | 0,265 |
| Urea, mg/dl | 43 (34-66) | 47 (38-65) | 0,165 |
EPOC: enfermedad pulmonar obstructiva crónica; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; UCI: unidad de cuidados intensivos.
Los valores se muestran como número (porcentaje) o mediana (amplitud intercuartílica).
La evolución clínica de los pacientes, los tratamientos y el manejo ventilatorio durante la estancia en UCI se resumen en la tabla 2 y las Figura 2, Figura 3 . Los pacientes ingresados en el periodo 2, a pesar de tener un menor APACHE-II (12 [12-20] vs 15 [12-20], p < 0,001), presentaban en el momento de ingreso en la UCI relaciones PaO2/FiO2 menores (105 [83-132] vs 128 [100-170], p < 0,001). El tiempo desde el inicio de los síntomas hasta el ingreso hospitalario fue similar durante los dos periodos; sin embargo, el tiempo desde el inicio de los síntomas hasta el ingreso en UCI fue menor en el periodo 2 (9 [7-11] vs 10 [7-12] días, p = 0,047).
Tabla 2.
Características clínicas y tratamientos administrados a los pacientes ingresados en la UCI durante los dos periodos a estudio
| Periodo 1 Marzo-abril 2020 n = 98 |
Periodo 2 Enero-febrero 2021 n = 239 |
p | |
|---|---|---|---|
| APACHE-II | 15,00 (12,00-20,0) | 12,00 (10,00-16,00) | < 0,001 |
| Tiempo desde inicio síntomas a ingreso hospitalario, días | 7,00 (5,00-10,00) | 7,00 (5,00-9,00) | 0,282 |
| Tiempo desde inicio síntomas a ingreso en UCI, días | 10,00 (7,00-12,00) | 9,00 (7,00-11,00) | 0,047 |
| PaO2/FiO2al ingreso en UCI, mg | 128,00 (99,75-170,00) | 105,00 (83,00-132,00) | < 0,001 |
| PaO2al ingreso en UCI, mg | 80,50 (66,50-97,00) | 72,00 (64,00-100,00) | 0,005 |
| FiO2al ingreso en UCI, % | 60,00 (50,00-100,00) | 70,00 (60,00-100,00) | 0,007 |
| Ingreso hospitalario y en UCI el mismo día | 25 (25,5) | 62 (25,9) | 0,935 |
| Estancia en UCI, días | 15,00 (10,00-24,00) | 12,00 (7,00-20,00) | 0,018 |
| Estancia en hospital, días | 29,00 (19,00-43,00) | 23,00 (15,00-36,00) | 0,001 |
| Coinfección al ingreso en UCI | 18 (18,4) | 26 (10,9) | 0,064 |
| Oxigenoterapia | |||
| Gafas nasales de alto flujo | 7 (7,1) | 166 (69,5) | < 0,001 |
| Ventilación mecánica no invasiva | 14 (14,3) | 81 (33,9) | < 0,001 |
| Ventilación mecánica invasiva (VMI) | 82 (83,7) | 155 (64,9) | < 0,001 |
| Tiempo desde ingreso en UCI hasta intubación orotraqueal, días | < 0,001 | ||
| < 24 h | 74 (90,2) | 96 (61,9) | |
| 24-48 h | 4 (4,9) | 26 (16,8) | |
| > 48 h | 4 (4,9) | 33 (21,3) | |
| Días de ventilación mecánica en el total de pacientes ingresados | 12,00 (6,00-18,00) | 7,00 (0,00-15,00) | < 0,001 |
| Días de ventilación mecánica en los pacientes intubados | 13,00 (9,00-19,25) | 11,00 (8,00-20,00) | 0,318 |
| Pacientes que necesitaron traqueostomía | 23 (23,5) | 43 (18,0) | 0,250 |
| Tiempo desde la VMI a la traqueotomía, días | 16,00 (11,75-18,00) | 15,00 (10,75-19,00) | 0,611 |
| Uso de decúbito prono en pacientes despiertos | 27 (27,6) | 101 (42,3) | 0,012 |
| Uso de decúbito prono en pacientes ventilados | 53 (54,1) | 107 (67,3) | 0,034 |
| Técnica de reemplazo renal | 6 (6,1) | 13 (5,5) | 0,812 |
| ICU Medical treatments, n (%) | |||
| Lopinavir-ritonavir | 92 (93,9) | 0 (0,0) | < 0,001 |
| Hidroxicloroquina | 97 (99,0) | 0 (0,0) | < 0,001 |
| Remdesivir | 1 (1,0) | 18 (7,5) | 0,019 |
| Interferón | 41 (41,8) | 0(0,0) | < 0,001 |
| Tocilizumab | 57 (58,2) | 68 (28,5) | < 0,001 |
| Corticosteroides | 94 (95,9) | 239 (100,0) | 0,007 |
| Antibióticos | 88 (89,9) | 218 (91,2) | 0,683 |
| Anticoagulantes dosis profilácticas | 16 (16,3) | 61 (25,5) | 0,068 |
| Anticoagulantes dosis intermedias (24 h) | 41 (41,8) | 104 (43,5) | 0,778 |
| Anticoagulantes dosis altas | 41 (41,8) | 74 (31,0) | 0,056 |
| Vasopresores | 64 (65,3) | 96 (40,2) | < 0,001 |
| Relajantes musculares (en pacientes con VMI) | 57 (69,5) | 137 (88,4) | < 0,001 |
APACHE-II: escala de evaluación de fisiología aguda y salud crónica II; FiO2: fracción de oxígeno inspirado; PaO2: presión arterial parcial de oxígeno; UCI: unidad de cuidados intensivos.
Los datos se expresan como número (porcentaje), mediana (amplitud intercuartílica).
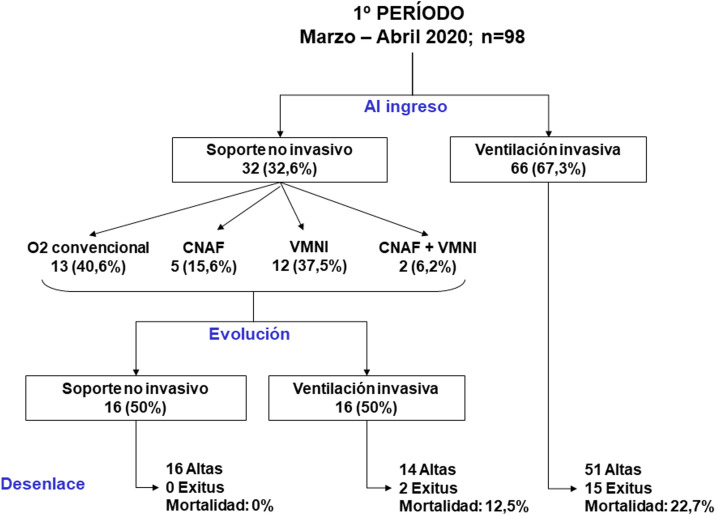
Figura 2.
Flujo de pacientes durante el primer periodo a estudio.
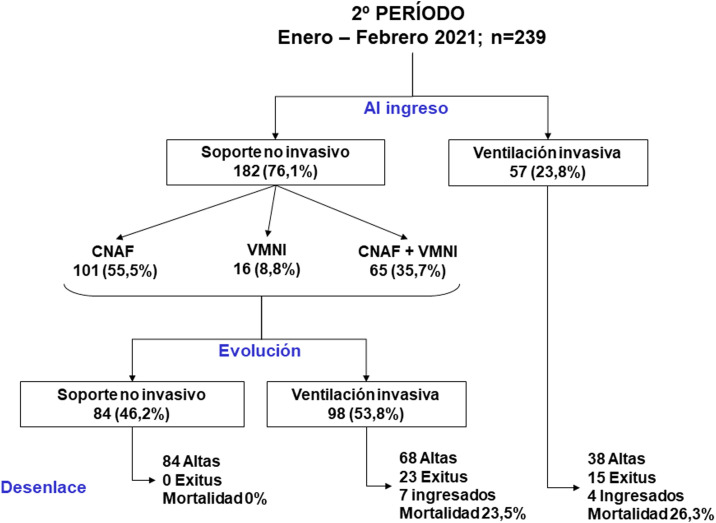
Figura 3.
Flujo de pacientes durante el segundo periodo a estudio.
En comparación con el periodo 1, en el periodo 2 un menor número de pacientes requirieron VMI (65% vs 84%, p < 0,001) (tabla 2). El 90% de los pacientes que requirieron VMI en el periodo 1 fueron intubados en las primeras 24 h tras su ingreso en la UCI, en comparación con el 63% en el periodo 2 (p < 0,001). El inicio de la VMI tras su ingreso en la UCI se realizó de una forma más tardía en el periodo 2 (tabla 2, p < 0,001). En relación a los días de VMI en los pacientes intubados, no se han observado diferencias entre los dos periodos (13 [9-19] días vs 11 [8-20] días, p = 0,318); sin embargo, los días de VMI en el total de pacientes ingresados en UCI ha sido considerablemente menor en el periodo 2 (7 [0-15] días vs 12 [6-18] días, p < 0,001).
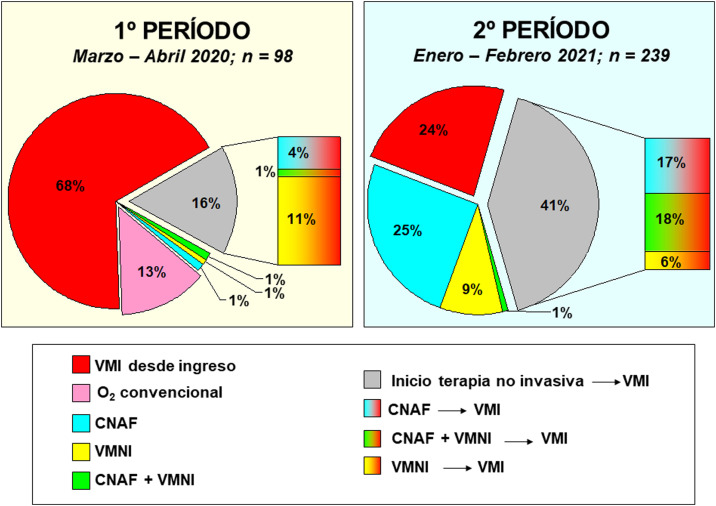
En el periodo 2 un mayor número de casos fueron manejados con CNAF (70% vs 7%, p < 0,001), VMNI (40% vs 14%, p < 0,001) y posición decúbito prono, tanto en pacientes despiertos (42% vs 28%, p = 0,012) como en pacientes intubados (67% vs 54%, p = 0,034) (tabla 2). El manejo ventilatorio de los pacientes al ingreso en la UCI y su evolución se describen en las Figura 2, Figura 3, Figura 4 .
Figura 4.
Modos ventilatorios utilizados en los dos periodos a estudio.
En la tabla 2 se muestran los fármacos utilizados. Algunos, como lopinavir-ritonavir, hidroxicloroquina o interferón, han dejado de emplearse en el período 2. Los corticoides han sido utilizados en el 100% de los pacientes en este segundo período.
En relación con la mortalidad de los pacientes ingresados en la UCI, no hemos encontrado diferencias entre los dos periodos a estudio (17% vs 16%, p = 0,756). Sin embargo, el tiempo de estancia en UCI (15 [10-24] vs 12 [7-20] días, p = 0,018) y el tiempo de estancia hospitalaria (23 [15-36] vs 29 [19-43] días, p = 0,001) ha sido menor en el periodo 2 (tabla 2).
Aunque hemos observado una tendencia a una menor frecuencia de complicaciones en los pacientes con neumonía por COVID ingresados en la UCI en el periodo 2, no hemos encontrado diferencias significativas en ninguna de las complicaciones estudiadas (neumotórax, reintubaciones, insuficiencia renal aguda con necesitad de terapia de reemplazo renal, tromboembolismo pulmonar u otros eventos trombóticos, infecciones nosocomiales, reingresos en UCI, necesidad de aminas o muerte) (Tabla 2, Tabla 3 ).
Tabla 3.
Complicaciones y resultado de los pacientes Covid-19 atendidos en las UCI de anestesia durante los dos periodos a estudio
| Periodo 1 Marzo-abril 2020 n = 98 |
Periodo 2 Enero-febrero 2021 n = 239 |
p | |
|---|---|---|---|
| Neumotórax | 8 (8,2) | 11 (4,6) | 0,198 |
| Reintubación | 12 (12,2) | 17 (7,1) | 0,127 |
| Lesión renal aguda con necesidad de TRR | 6 (6,1) | 13 (5,5) | 0,812 |
| Tromboembolismo pulmonar | 7 (7,1) | 13 (5,4) | 0,548 |
| Otros eventos trombóticos | 5 (5,1) | 4 (1,7) | 0,128 |
| Infección nosocomial en pacientes en ventilación mecánica | 51 (62,2) | 102 (65,8) | 0,580 |
| Infección nosocomial en el total de pacientes ingresados | 52 (53,1) | 113 (47,3) | 0,335 |
| Reingreso en UCI | 4 (4,1) | 7 (3,0) | 0,598 |
| Fallecimiento entre los pacientes que requirieron VM | 16 (19,5) | 38 (24,7) | 0,369 |
| Fallecimiento UCI | 17 (17,3) | 38 (16,0) | 0,756 |
| Fallecimiento intrahospital | 20 (20,4) | 40 (16,8) | 0,433 |
TRR: terapia de reemplazo renal; UCI: unidad de cuidados intensivos; VM: ventilación mecánica.
En el análisis de regresión logística multivariable, en el primer periodo a estudio la edad y el cociente PaO2/FiO2 se asociaron de forma significativa con la mortalidad intrahospitalaria. En el segundo periodo a estudio, una mayor edad de los pacientes y una mayor puntuación en la escala APACHE-II se relacionaron con un incremento de la mortalidad intrahospitalaria (Tabla S1, suplemento).
Discusión
En el presente estudio hemos investigado cómo han variado las características clínicas, los tratamientos recibidos y los resultados de los pacientes ingresados por distrés respiratorio por COVID-19 en nueve UCI del noroeste de España tras un año desde el inicio de la pandemia. Comparando un primer periodo de ingresos durante los meses de marzo y abril de 2020 con el último periodo durante los meses de enero y febrero de 2021, hemos observado en este segundo período un aumento del empleo de soporte ventilatorio no invasivo, una menor duración de la VMI de los pacientes que ingresan en UCI y una menor duración de la estancia de los pacientes, tanto en las unidades de críticos como en el hospital. Sin embargo, no encontramos diferencias en cuanto a la mortalidad.
En un estudio similar que comparaba los resultados de un menor número de pacientes críticos COVID-19 tratados en una UCI francesa en la primera y segunda ola de la pandemia no se encontraron diferencias en cuanto a mortalidad y tiempo de estancia en UCI20, aunque llama la atención que presentaban una tasa de mortalidad cercana al 50%, muy superior a la de nuestra población.
Durante la primera ola de la pandemia, coincidiendo con el primer periodo del presente estudio, los profesionales nos enfrentamos a una enfermedad de nueva aparición que provocó un número elevado de cuadros graves en un breve período de tiempo y que llevó a muchas UCI a la saturación. Además, existían dudas en cuanto a las formas de transmisión de la enfermedad, lo que condicionó el soporte respiratorio de los pacientes en favor de la VMI. La ausencia de tratamientos específicos llevó a que se empleasen o evitasen fármacos en base al conocimiento adquirido en epidemias de neumonías víricas graves precedentes22, 23. Todos estos factores condicionaron una elevada mortalidad y un elevado número de complicaciones en los pacientes atendidos en ese período inicial. El mayor conocimiento de la fisiopatología y la transmisión de la enfermedad, el desarrollo de ensayos clínicos que probaron el beneficio o la ausencia del mismo de algunas terapias24 y la experiencia ganada en el manejo de los pacientes podrían hacer pensar que la mortalidad de los pacientes ingresados en las UCI casi un año después podría ser menor. Sin embargo, en el presente estudio no encontramos diferencias en mortalidad en el segundo periodo en comparación con el primero de la pandemia. Varios factores podrían explicar estos resultados.
En primer lugar, en el noroeste de España, a diferencia de otras regiones, hubo una mayor sobrecarga asistencial durante el segundo periodo (tercera ola pandémica) en comparación con el primer periodo (primera ola) (fig. 1). Esta mayor incidencia de casos podría deberse al aumento de la variante británica del virus, que fue mayoritaria durante la tercera ola de la pandemia en nuestra región. La sobrecarga del sistema ha sido una de las claves en la mortalidad asociada al COVID-19. De hecho, la mortalidad de la primera ola de nuestras UCI de anestesia fue menor que la reportada en estudios publicados en esa misma época en otras áreas de nuestro país que sufrieron una mayor carga asistencial4, 8, 25.
En segundo lugar, los corticoides, que se han mostrado como efectivos en la reducción de la mortalidad de los pacientes graves con COVID-199, 26, ya se emplearon de forma mayoritaria en nuestra área durante el primer periodo de estudio, lo que pudo contribuir a una reducción de la mortalidad comparada con otras zonas durante esa etapa, y a un menor impacto positivo del tratamiento en nuestros pacientes al comparar los dos períodos estudiados.
En cuanto a las características clínicas de los pacientes ingresados, observamos, de igual forma que otros estudios, una edad menor en los pacientes del segundo período27, así como una menor comorbilidad cardiaca. Ambos factores, y un ingreso en UCI más precoz, pueden haber contribuido a la observación de una menor puntuación de la escala de gravedad APACHE-II, así como de algunos marcadores de gravedad de la infección (PCR y dímeros D), y a una menor necesidad de vasopresores, comparado con los pacientes ingresados hace un año. Sin embargo, la patología pulmonar, reflejada por el intercambio gaseoso al ingreso, fue más grave en los pacientes del segundo período.
Una de las mayores diferencias en el manejo de los pacientes ha sido en el empleo de terapias ventilatorias no invasivas, restringidas a pocos casos al inicio de la pandemia y mayoritario en el segundo período, aspecto que también se observa en otras series20, 27. La intubación precoz o no de estos pacientes sigue siendo una fuente de debate28, 29. El soporte no invasivo pretende reducir la necesidad de ventilación invasiva y sus complicaciones asociadas. En el primer periodo, la mayoría de los pacientes se manejaron con VMI precoz debido a la estructura de UCI abiertas y al riesgo de transmisión entre pacientes y a los profesionales. En el segundo periodo estudiado, con mayor evidencia de que las terapias no invasivas eran seguras, su empleo ha aumentado. No ha sido probada la reducción de la mortalidad con el empleo de estas terapias frente a la VMI precoz, pero sí parecen reducir la duración de la ventilación mecánica y la estancia en UCI30, lo que puede ser un elemento a tener muy en cuenta en situaciones de sobrecarga por una ola pandémica. De hecho, en nuestra serie, la duración de la VMI, la duración del ingreso en UCI y en el hospital han sido dos, tres y seis días menor, respectivamente, en el segundo período estudiado que en el primero.
Por contra, un hipotético retraso en la intubación puede asociarse a un peor pronóstico posterior, circunstancia que se ha observado en otros cuadros de insuficiencia respiratoria31. Sin embargo, esta asociación no se ha probado en pacientes con COVID-1932. En nuestra serie, la mayor demora entre el ingreso y la intubación no condicionó una duración mayor de la VMI en los pacientes que finalmente se intubaron, ni una mortalidad superior en ese subgrupo de pacientes frente a los que ya se intubaron al ingreso.
La colocación del paciente en decúbito prono para la ventilación reduce la mortalidad en el distrés grave33. Esta técnica ha sido usada de forma muy extensa desde el inicio de la pandemia, incluso en pacientes en ventilación espontánea16, 17. A pesar de que su efectividad es fuente de debate en pacientes no intubados34, ha sido más empleada en el segundo período, en un intento de reducir las necesidades de intubación.
Aparte de los corticoides, ningún otro fármaco ha demostrado un efecto de reducción de la mortalidad en los pacientes con COVID 19 graves. Muchos de los empleados de forma mayoritaria al inicio de la pandemia (hidroxicloroquina, lopinavir-ritonavir, interferón) se han dejado de emplear un año después, debido a la falta de evidencia para su empleo14, 15. Únicamente el remdesivir, antiviral que ha mostrado cierta efectividad en la mejora de escalas clínicas de los pacientes infectados11, 12, y el inmunomodulador tocilizumab, cuya efectividad está todavía en discusión35, 36, 37, se han empleado en este segundo período.
En cuanto al uso de anticoagulantes, en la serie descrita se han administrado de forma mayoritaria dosis de profilaxis intermedias en ambas períodos, lo que probablemente se justifica por el elevado porcentaje de pacientes obesos. A pesar de la fisiopatología protrombótica de la COVID y de que algún estudio sugiere un mejor resultado en los pacientes en los que se emplean dosis altas de tromboprofilaxis38, un estudio aleatorizado no encontró diferencias entre las dosis bajas e intermedias de profilaxis antitrombótica en un resultado compuesto de eventos trombóticos arteriales o venosos, necesidad de ECMO o muerte, en pacientes ingresados en UCI13, pero sí un aumento en la incidencia de trombocitopenia en el grupo tratado con dosis intermedias. En la actualidad no se recomienda la utilización de profilaxis a dosis elevadas39, salvo en poblaciones concretas, como pueden ser los obesos.
Observamos una tendencia no significativa a la reducción de complicaciones de los pacientes en el segundo período analizado, reintubaciones y reingresos desde planta; sin embargo, de forma análoga a otros estudios40, sigue destacando el elevado porcentaje de casos que presentan infección nosocomial, especialmente neumonía asociada a la ventilación mecánica en los pacientes con distrés grave por COVID 19.
El presente estudio tiene algunas limitaciones. Esta investigación solo incluyó a pacientes con distrés respiratorio por COVID-19 ingresados en 9 UCI ubicadas en el noroeste de España, por lo que los resultados podrían no reflejar la experiencia de otras UCI ubicadas en otras regiones de España u otros países. Otra limitación es que el diseño fue observacional, pero la intención del estudio fue analizar el cambio de actitud terapéutica y los resultados conforme ha aumentado el conocimiento de la COVID-19 tras un año de pandemia.
En conclusión, los pacientes ingresados por distrés respiratorio por COVID-19 en UCI del noroeste de España, tras un año desde el inicio de la pandemia, fueron más jóvenes, con un peor intercambio gaseoso y con menos patología extrapulmonar en comparación con los pacientes ingresados en la primera ola. Más pacientes recibieron soporte ventilatorio no invasivo y fueron colocados en posición de decúbito prono, tanto durante la VMI como durante la ventilación espontánea. Observamos una reducción en la duración de la VMI, en el tiempo de estancia en UCI y en el tiempo de estancia hospitalaria. Se ha generalizado el uso de corticoides y se han dejado de emplear tratamientos ensayados en las fases iniciales de la enfermedad y que posteriormente se probó que no eran efectivos. La mortalidad en el ingreso en las UCI no presentó una reducción significativa.
Financiación
No se recibió financiación para la realización de este estudio. Se brindó apoyo únicamente de fuentes institucionales y departamentales.
Autoría
Concepción del estudio: Pablo Rama, Yolanda Sanduende, Manuel Taboada.
Diseño del estudio: Pablo Rama, Yolanda Sanduende, Manuel Taboada.
Recopilación de datos: todos los autores.
Análisis de datos: Teresa Seoane-Pillado.
Redacción del manuscrito: todos los autores ayudaron a revisar el borrador del manuscrito.
Edición y aprobación del manuscrito: todos los autores.
Conflicto de intereses
Los autores declaran la ausencia de conflicto de intereses.
Agradecimientos
Los autores agradecen a los médicos, enfermeras, auxiliares, celadores y personal implicado en el tratamiento de los pacientes COVID-19 durante este año tan duro de pandemia.
Footnotes
Se puede consultar material adicional a este artículo en su versión electrónica disponible en doi:10.1016/j.eimc.2021.06.016.
Anexo A. Material adicional
Bibliografía
- 1.Guan W.J., Ni Z.Y., Hu Y., Liang W.H., Ou C.Q., He J.X., et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382:1708–1720. doi: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y., et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Grasselli G., Zangrillo A., Zanella A., Antonelli M., Cabrini L., Castelli A., et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy region, Italy. JAMA. 2020;323:1574–1581. doi: 10.1001/jama.2020.5394. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Barrasa H., Rello J., Tejada S., Martín A., Balziskueta G., Vinuesa C., et al. SARS-CoV-2 in Spanish intensive care units: Early experience with 15-day survival in Vitoria. Anaesth Crit Care Pain Med. 2020;39:553–561. doi: 10.1016/j.accpm.2020.04.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Zangrillo A., Beretta L., Scandroglio A.M., Monti G., Fominskiy E., Colombo S., et al. Characteristics, treatment, outcomes and cause of death of invasively ventilated patients with COVID-19 ARDS in Milan, Italy. Crit Care Resusc. 2020;22:200–211. doi: 10.1016/S1441-2772(23)00387-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Yu Y., Xu D., Fu S., Zhang J., Yang X., Xu L., et al. Patients with COVID-19 in 19 ICUs in Wuhan, China: A cross-sectional study. Crit Care. 2020;24:219. doi: 10.1186/s13054-020-02939-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Bhatraju P.K., Ghassemieh B.J., Nichols M., Kim R., Jerome K.R., Nalla A.K., et al. Covid-19 in critically ill patients in the Seattle region — Case series. N Engl J Med. 2020;382:2012–2022. doi: 10.1056/NEJMoa2004500. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ferrando C., Mellado-Artigas R., Gea A., Arruti E., Aldecoa C., Bordell A., et al. Patient characteristics, clinical course and factors associated to ICU mortality in critically ill patients infected with SARS-CoV-2 in Spain: A prospective, cohort, multicentre study. Rev Esp Anestesiol Reanim. 2020;67:425–437. doi: 10.1016/j.redar.2020.07.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Horby P., Lim W.S., Emberson J.R., Mafham M., Bell J.L., Linsell L., et al. RECOVERY Collaborative Group Dexamethasone in hospitalized patients with Covid-19. N Engl J Med. 2021;384:693–704. doi: 10.1056/NEJMoa2021436. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Rochwerg B., Siemieniuk R.A., Agoritsas T., Lamontagne F., Askie L., Lytvyn L., et al. A living WHO guideline on drugs for Covid-19. BMJ. 2020;370:m3379. doi: 10.1136/bmj.m3379. Update in: BMJ. 2021 Mar 31;372:n860. [DOI] [PubMed] [Google Scholar]
- 11.Goldman J.D., Lye D.C.B., Hui D.S., Marks K.M., Bruno R., Montejano R., et al. Remdesivir for 5 or 10 days in patients with severe Covid-19. N Engl J Med. 2020;383:1827–1837. doi: 10.1056/NEJMoa2015301. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Rochwerg B., Agarwal A., Zeng L., Leo Y.S., Appiah J.A., Agoritsas T., et al. Remdesivir for severe Covid-19: A clinical practice guideline. BMJ. 2020;370:m2924. doi: 10.1136/bmj.m2924. Erratum in: BMJ. 2020 Nov 23;371:m4542. [DOI] [PubMed] [Google Scholar]
- 13.Sadeghipour P., Talasaz A.H., Rashidi F., Sharif-Kashani B., Beigmohammadi M.T., Farrokhpour M., et al. INSPIRATION Investigators Effect of intermediate-dose vs standard-dose prophylactic anticoagulation on thrombotic events, extracorporeal membrane oxygenation treatment, or mortality among patients with COVID-19 admitted to the intensive care unit: The INSPIRATION randomized clinical trial. JAMA. 2021;325:1620–1630. doi: 10.1001/jama.2021.4152. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Furtado R.H.M., Berwanger O., Fonseca H.A., Corrêa T.D., Ferraz L.R., Lapa M.G., et al. Azithromycin in addition to standard of care versus standard of care alone in the treatment of patients admitted to the hospital with severe COVID-19 in Brazil (COALITION II): A randomised clinical trial. Lancet. 2020;396:959–967. doi: 10.1016/S0140-6736(20)31862-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Narain S., Stefanov D.G., Chau A.S., Weber A.G., Marder G., Kaplan B., et al. Comparative survival analysis of immunomodulatory therapy for coronavirus disease 2019 cytokine storm. Chest. 2021;159:933–948. doi: 10.1016/j.chest.2020.09.275. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Coppo A., Bellani G., Winterton D., di Pierro M., Soria A., Faverio P., et al. Feasibility and physiological effects of prone positioning in non-intubated patients with acute respiratory failure due to COVID-19 (PRON-COVID): A prospective cohort study. Lancet Respir Med. 2020;8:765–774. doi: 10.1016/S2213-2600(20)30268-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Taboada M., González M., Álvarez A., González I., García J., Eiras M., et al. Effectiveness of prone positioning in nonintubated intensive care unit patients with moderate to severe acute respiratory distress syndrome by coronavirus disease 2019. Anesth Analg. 2021;132:25–30. doi: 10.1213/ANE.0000000000005239. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Gleissman H., Forsgren A., Andersson E., Lindqvist E., Lipka Falck A., Cronhjort M., et al. Prone positioning in mechanically ventilated patients with severe acute respiratory distress syndrome and coronavirus disease 2019. Acta Anaesthesiol Scand. 2021;65:360–363. doi: 10.1111/aas.13741. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Taboada M., Baluja A., dos Santos L., González I., Veiras S., Caruezo V., et al. Effectiveness of dexmedetomidine combined with high flow nasal oxygen and long periods of awake prone positioning in moderate or severe COVID-19 pneumonia. J Clin Anesth. 2021;72:110261. doi: 10.1016/j.clinane.2021.110261. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Contou D., Fraissé M., Pajot O., Tirolien J.A., Mentec H., Plantefève G. Comparison between first and second wave among critically ill COVID-19 patients admitted to a French ICU: No prognostic improvement during the second wave? Crit Care. 2021;25:3. doi: 10.1186/s13054-020-03449-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Rodríguez-Núñez N., Gude F., Lama A., Rábade C., Varela A., Abelleira R., et al. Health indicators in hospitalized patients with SARS-CoV-2 pneumonia: A comparison between the first and second wave. Arch Bronconeumol. 2021 doi: 10.1016/j.arbres.2021.03.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Yao T.T., Qian J.D., Zhu W.Y., Wang Y., Wang G.Q. A systematic review of lopinavir therapy for SARS coronavirus and MERS coronavirus — A possible reference for coronavirus disease-19 treatment option. J Med Virol. 2020;92:556–563. doi: 10.1002/jmv.25729. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Yin Y., Wunderink R.G. MERS, SARS and other coronaviruses as causes of pneumonia. Respirology. 2018;23:130–137. doi: 10.1111/resp.13196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Siemieniuk R.A., Bartoszko J.J., Ge L., Zeraatkar D., Izcovich A., Kum E., et al. Drug treatments for Covid-19: Living systematic review and network meta-analysis. BMJ. 2020;370:m2980. doi: 10.1136/bmj.m2980. Update in: BMJ. 2020 Sep 11;370:m3536. Update in: BMJ. 2020 Dec 17;371:m4852. Update in: BMJ. 2021 Mar 31;372:n858. Erratum in: BMJ. 2021 Apr 13;373:n967. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Taboada M., Rama P., Pita-Romero R., Moreno E., Leal S., Varela M., et al. Critically ill COVID-19 patients attended by anesthesiologists in northwestern Spain: A multicenter prospective observational study. Rev Esp Anestesiol Reanim. 2021;68:10–20. doi: 10.1016/j.redar.2020.08.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Cano E.J., Fonseca Fuentes X., Corsini Campioli C., O’Horo J.C., Abu Saleh O., Odeyemi Y., et al. Impact of corticosteroids in coronavirus disease 2019 outcomes: Systematic review and meta-analysis. Chest. 2021;159:1019–1040. doi: 10.1016/j.chest.2020.10.054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Kurtz P., Bastos L.S.L., Dantas L.F., Zampieri F.G., Soares M., Hamacher S., et al. Evolving changes in mortality of 13,301 critically ill adult patients with COVID-19 over 8 months. Intensive Care Med. 2021;47:538–548. doi: 10.1007/s00134-021-06388-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Tobin M.J. Basing respiratory management of COVID-19 on physiological principles. Am J Respir Crit Care Med. 2020;201:1319–1320. doi: 10.1164/rccm.202004-1076ED. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Cabrini L., Ghislanzoni L., Severgnini P., Landoni G., Baiardo Redaelli M., Franchi F., et al. Early versus late tracheal intubation in COVID-19 patients: A pro-con debate also considering heart-lung interactions. Minerva Cardioangiol. 2020 doi: 10.23736/S0026-4725.20.05356-6. [DOI] [PubMed] [Google Scholar]
- 30.Mellado-Artigas R., Ferreyro B.L., Angriman F., Hernández-Sanz M., Arruti E., Torres A., et al. High-flow nasal oxygen in patients with COVID-19-associated acute respiratory failure. Crit Care. 2021;25:58. doi: 10.1186/s13054-021-03469-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Kangelaris K.N., Ware L.B., Wang C.Y., Janz D.R., Zhuo H., Matthay M.A., et al. Timing of intubation and clinical outcomes in adults with acute respiratory distress syndrome. Crit Care Med. 2016;44:120–129. doi: 10.1097/CCM.0000000000001359. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Hernandez-Romieu A.C., Adelman M.W., Hockstein M.A., Robichaux C.J., Edwards J.A., Fazio J.C., et al. Timing of intubation and mortality among critically ill coronavirus disease 2019 patients: A single-center cohort study. Crit Care Med. 2020;48:e1045–e1053. doi: 10.1097/CCM.0000000000004600. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Guérin C., Reignier J., Richard J.C., Beuret P., Gacouin A., Boulain T., et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013;368:2159–2168. doi: 10.1056/NEJMoa1214103. [DOI] [PubMed] [Google Scholar]
- 34.Ferrando C., Mellado-Artigas R., Gea A., Arruti E., Aldecoa C., Adalia R., et al. Awake prone positioning does not reduce the risk of intubation in COVID-19 treated with high-flow nasal oxygen therapy: A multicenter, adjusted cohort study. Crit Care. 2020;24:597. doi: 10.1186/s13054-020-03314-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Rosas I.O., Bräu N., Waters M., Go R.C., Hunter B.D., Bhagani S., et al. Tocilizumab in hospitalized patients with severe Covid-19 pneumonia. N Engl J Med. 2021 doi: 10.1056/NEJMoa2028700. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Salama C., Han J., Yau L., Reiss W.G., Kramer B., Neidhart J.D., et al. Tocilizumab in patients hospitalized with Covid-19 pneumonia. N Engl J Med. 2021;384:20–30. doi: 10.1056/NEJMoa2030340. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Gordon A.C., Mouncey P.R., Al-Beidh F., Rowan K.M., Nichol A.D., Arabi Y.M., et al. REMAP-CAP Investigators Interleukin-6 receptor antagonists in critically ill patients with Covid-19. N Engl J Med. 2021 doi: 10.1056/NEJMoa2100433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Jonmarker S., Hollenberg J., Dahlberg M., Stackelberg O., Litorell J., Everhov Å.H., et al. Dosing of thromboprophylaxis and mortality in critically ill COVID-19 patients. Crit Care. 2020;24:653. doi: 10.1186/s13054-020-03375-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Moreno G., Carbonell R., Bodí M., Rodríguez A. Systematic review of the prognostic utility of D-dimer, disseminated intravascular coagulation, and anticoagulant therapy in COVID-19 critically ill patients. Med Intensiva. 2021;45:42–55. doi: 10.1016/j.medin.2020.06.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Razazi K., Arrestier R., Haudebourg A.F., Benelli B., Carteaux G., Decousser J.W., et al. Risks of ventilator-associated pneumonia and invasive pulmonary aspergillosis in patients with viral acute respiratory distress syndrome related or not to Coronavirus 19 disease. Crit Care. 2020;24:699. doi: 10.1186/s13054-020-03417-0. Erratum in: Crit Care. 2021 Mar 22;25(1):118. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.